Identification of A Cold-active Lipase Producing Strain, Optimization of Fermentation Conditions and Analysis of Enzymatic Properties
-
摘要: 为筛选高产低温脂肪酶的菌株,并对产酶条件进行优化,同时为脂肪酶的工业化开发提供生产资料。从黑龙江省漠河县土壤样品中筛选出一株产低温脂肪酶菌株,通过形态学鉴定、生理生化实验及分子生物学鉴定,确定该菌株为普城沙雷氏菌(Serratia plymuthica)。通过单因素实验,探究温度、pH、装液量、接种量、碳源、氮源、金属离子、诱导剂等不同因素对菌株产酶的影响,通过Plackett-Burman实验,爬坡试验及响应曲面设计,优化橄榄油、蛋白胨、装液量等因素的添加量。结果表明:该菌株最优产酶条件为20 ℃、pH7.5、装液量42 mL、接种量0.5%、20 g/L麦芽糖、14 g/L蛋白胨、0.5 g/L的MgSO4·7H2O及46 mL/L橄榄油。此优化条件下,脂肪酶活为98.05 U/mL,是优化前的5.85倍。酶学性质结果表明,该脂肪酶最适温度为30 ℃,属于低温脂肪酶,最适反应pH为7,Mg2+明显可以促进酶活。有机溶剂中甲醇和乙醇明显抑制了酶活性,而正己烷明显可以促进酶活性。该结论可为微生物资源开发利用,工业生产低温脂肪酶提供一定的理论依据及方法指导。Abstract: To screen strains with high production of cold-active lipase and optimize enzyme production conditions, as well as to provide production information for the industrial development of lipase, a cold-active lipase producing strain was screened from soil samples in Mohe County, Heilongjiang Province, and identified as Serratia plymuthica by morphological identification, physiological and biochemical experiments and molecular biology. The effects of different factors such as temperature, pH, loading volume, inoculum, carbon source, nitrogen source, metal ion and inducer on the enzyme production of the strain were investigated by single-factor experiments, as well as the optimization of the addition of olive oil, peptone and loading volume by Plackett-Burman experiment, hill climbing test and response surface design. The results showed that the optimal enzyme production conditions were 20 ℃, pH7.5, loading volume 42 mL, inoculum 0.5%, 20 g/L maltose, 14 g/L peptone, 0.5 g/L MgSO4·7H2O and 46 mL/L olive oil. The lipase activity under this optimized condition was 98.05 U/mL, which was 5.85 times higher than that before optimization. The results of enzymatic properties showed that the optimum temperature of this lipase was 30 ℃, which was a low temperature lipase, and the optimum reaction pH was 7. Mg2+ could obviously promote the enzyme activity. The organic solvents methanol and ethanol obviously inhibited the enzyme activity, while n-hexane could obviously promote the enzyme activity. The conclusion can provide some theoretical basis and methodological guidance for the development and utilization of microbial resources and industrial production of low-temperature lipase.
-
脂肪酶(Lipase)是一类特殊的酯酶,能水解三酰甘油酯为脂肪酸、甘油二酯、单酸甘油酯及甘油[1],广泛应用于各个领域,如食品[2-3],医药[4-5],生活[6],能源[7]等。脂肪酶来源广泛,目前可以从一些油料种子[8],动物的胰脏[9]及微生物[10]中获取。相对于动植物所产生的脂肪酶,微生物产生的脂肪酶具有来源广泛、生产周期短、产量高、易提取、对外界环境要求低等特点,更易工业化生产。
近些年国内外关于产脂肪酶菌株发酵条件优化的研究报道层出不穷,如Behera等[11]通过CCD实验设计,得到了葡萄球菌(Staphylococcus)产脂肪酶的最佳的pH值、温度和搅拌速度,优化后的最大酶活为1.82 U/mL,柳萌等[12]通过单因素实验对灰霉菌(Botrytis cinerea)的培养基成分和发酵条件进行优化,筛选出其产胞外脂肪酶的最优发酵条件。Salgado等[13]从橄榄磨废水中分离出产孢外脂肪酶的菌株Magnusiomyces capitatus,并通过氧气利用率和氮浓度双因素的正交试验实现了脂肪酶产量的优化,并在培养基中添加了一定浓度的橄榄油,来提高脂肪酶的产量,最高可达3.96 U/mL。林仙菊等[14]从海鳗肠道内容物中筛选到洋葱伯克霍尔德菌(Burkholderia cepacia),采用单因素实验和均匀实验设计进行发酵条件优化,优化后的脂肪酶活力较之前提高了4.7倍。刘元利等[15]通过优化碳源、氮源、温度、盐度等条件,优化后产脂肪酶可达1326 U/mL。但大多数研究集中在中高温脂肪酶方面,对于低温脂肪酶的研究较少[16],普通脂肪酶的适合反应温度通常在30~50 ℃,但低温脂肪酶的最适反应温度为40 ℃以下[17],且其最大特点是在0 ℃下依旧具有一定的活性。
随着各个领域对脂肪酶的需求日益增加,开发低温脂肪酶,探寻最优发酵条件及工业化生产显得尤为重要。本研究拟从漠河土壤中分离出一株产低温脂肪酶活性较高的菌株,通过形态学及分子生物学鉴定,确定其分类地位,通过单因素实验,Plackett-Burman实验,爬坡试验及响应曲面设计,探究温度、pH、装液量、接种量、碳源、氮源、金属离子、诱导剂对脂肪酶酶活的影响,从而筛选出最优发酵条件,以达到高产优势菌株的目的。并对该菌株产的脂肪酶进行初步纯化,探究其酶学性质。对开发低温脂肪酶及工业化生产提供了理论依据。
1. 材料与方法
1.1 材料与仪器
土壤样品 采样地点位于黑龙江省漠河县洛古河村的林下土壤(53°21'21" N,121°37’15" E),观音山林下土壤(53°25'2" N,122°15’36" E)以及北极村林下土壤(53°25'2"N,122°15’36" E),在每个样地分别随机设置三个采样点,采样前除去地表枯落物,采集距地表5 cm左右的土壤,每份50 g置于密封袋中,编号记录并于保温箱中保存,于实验室进行后续处理;牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂15 g,蒸馏水1000 mL,pH7.4~7.6;脂肪酶筛选培养基:蛋白胨10 g,酵母提取物5 g,氯化钠5 g,氯化钙0.1 g,Tween-80 10 mL,蒸馏水1000 mL,琼脂15 g;LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1000 mL,pH7.4,固体LB培养基再加入15 g琼脂;液体发酵培养基:麦芽糖5 g,蛋白胨10 g,七水硫酸镁0.5 g,橄榄油20 mL,蒸馏水1000 mL;DNA试剂盒 上海生工生物工程有限公司;脂肪酶(LPS)活性检测试剂盒 苏州格锐思生物科技有限公司;牛肉膏、蛋白胨、胰蛋白胨、琼脂、酵母提取物、氯化钠、麦芽糖、蔗糖、葡萄糖、七水硫酸镁、硫酸亚铁等 分析纯,哈尔滨兆奎致远生物科技有限公司。
SE402F型电子天平 奥豪斯仪器有限公司;DL-CJ-2NDI型超净工作台 哈尔滨东联电子技术开发有限公司;T-100型PCR仪 BioRad;HC-3016R型低温超速冷冻离心机 安徽中科中佳仪器有限公司;SuPerMax 3100型酶标仪 上海闪普生物科技有限公司;ZQZY-B8型恒温振荡培养箱 上海知楚仪器有限公司。
1.2 实验方法
1.2.1 细菌菌株的分离与纯化
菌株分离采用平板稀释法[18],将5 g土样与45 mL无菌水混合后加入玻璃珠,160 r/min振荡30 min,制成浓度为10−1的菌悬液。之后用无菌水分别稀释成浓度梯度为10−2、10−3、10−4、10−5的菌悬液。分别取150 μL各浓度梯度菌悬液至牛肉膏蛋白胨培养基上,涂布均匀,标记后在恒温培养箱中16 ℃培养。3 d后,用接种环分别挑取不同的细菌菌落,采用划线法接种至细菌选择培养基上,以获得纯化的细菌菌落,16 ℃培养3 d,进行后续试验。
1.2.2 产脂肪酶菌株的初筛与复筛
将上述分离纯化得到的细菌菌株接种于LB培养基上活化,活化后点接于脂肪酶筛选培养基上,16 ℃培养。根据脂肪酶能够分解吐温80且产物能够与Ca2+ 结合而在菌落周围形成白色沉淀圈[19],初筛出能产脂肪酶的菌株。将初筛得到的细菌菌株以1%的接种量接种至发酵培养基,16 ℃,160 r/min条件下培养32 h,取发酵液,在12000 r/min、4 ℃离心10 min,取上清液为粗酶液,进行酶活力测定。筛选出活性最高的菌株进行后续实验。
1.2.3 脂肪酶活性的测定
依据苏州格锐思脂肪酶(LPS)活性试剂盒进行脂肪酶活性测定(对硝基苯酚法[20]),具体操作详见说明书。
1.2.4 菌株的鉴定及生理生化特性
形态学鉴定:观察产酶菌落形状、颜色、表面、边缘、隆起情况,并对菌株进行革兰氏染色以及相应的生理生化实验如V-P实验、甲基红(MR)实验、明胶水解实验、产H2S实验等[21]。
分子生物学鉴定:采用16S rDNA通用引物27F和1492R进行PCR扩增,将PCR产物送至上海生工生物工程有限公司进行测序,将测序结果在NCBI网站上进行BLAST比对,构建系统发育树。
1.2.5 产脂肪酶菌株发酵条件优化
1.2.5.1 单因素实验
以酶活为指标进行单因素实验测定,以液体发酵培养基,温度16 ℃,2%接种量,pH为7,装液量30 mL为基础。分别研究温度、pH、装液量、接种量、碳源、氮源、金属离子、诱导剂对脂肪酶酶活的影响。分别选取温度:10、15、20、25、30、35 ℃;pH:6.0、6.5、7.0、7.5、8.0、8.5;装液量10、20、30、40、50 mL的培养基倒入50 mL锥形瓶;接种量0.5%、1%、2%、3%、4%、5%;碳源:葡萄糖、蔗糖、麦芽糖、可溶性淀粉,确定最佳碳源后,配制添加量分别为0、5、10、15、20 g/L;氮源:蛋白胨、胰蛋白胨、牛肉膏、酵母粉,确定最佳氮源后,配制添加量分别为0、5、10、15、20 g/L;金属离子:Mg2+、Mn2+、Cu2+、Fe2+的硫酸盐,确定最佳金属离子后,配制添加量分别为0、0.5、1.0、1.5、2.0、2.5、3.0 g/L的发酵培养基;诱导剂:不添加诱导剂和分别添加橄榄油、葵花籽油、亚麻籽油。确定最佳诱导剂后,配制添加量分别为10、20、30、40、50 mL/L。
1.2.5.2 Plackett-Burman 试验
对八个单因素(温度、pH、装液量、接种量、碳源、氮源、金属离子、诱导剂)进行Plackett-Burman 设计,每个因素取高低两个水平,如表1。
表 1 Plackett-Burman试验设计Table 1. Plackett-Burman experimental design序号 因素 低水平 高水平 A 麦芽糖(g/L) 5 15 B 蛋白胨(g/L) 10 20 C Mg2+(g/L) 0 1 D 橄榄油(mL) 30 50 E 温度(℃) 15 25 F pH 7 8 G 装液量(mL) 10 30 H 接种量(%) 0.25 0.75 1.2.5.3 爬坡试验
根据上述单因素实验确定的单因素正负效应,在PB试验的基础上,依据显著性分析结果确定3个显著因素的最陡爬坡。
1.2.5.4 响应曲面试验优化
对PB试验结果进行显著性分析,选取显著性最高的三个因素(蛋白胨、装液量、橄榄油),以脂肪酶为响应值,设计Box-Behnken试验,如表2所示,得出菌株产脂肪酶的最优发酵条件。
表 2 Box-Behnken试验因素水平Table 2. Box-Behnken experimental factor level水平 因素 B:蛋白胨(g/L) G:橄榄油(mL) D:装液量(mL) −1 10 30 10 0 15 40 20 +1 20 50 30 1.2.6 脂肪酶的纯化
以实验所得最优发酵条件进行菌株发酵,将发酵液离心取上清得到粗酶液。在冰水浴及磁力搅拌条件下缓慢加入研磨好的硫酸铵粉末,按饱和度(10%~90%)依次添加,静止1 h后冷冻离心,得到第一个分级沉淀,以相同的方式吸取上清液加入硫酸铵,得到多个分级沉淀,将沉淀收集。沉淀置于pH7.5的磷酸缓冲液中溶解,利用透析袋脱盐至滤液中加入BaCl2没有沉淀析出为止。所得沉淀进行后续酶学性质研究。
1.2.7 酶学性质分析
1.2.7.1 温度对酶活的影响及酶的热稳定性
在磷酸缓冲液中加入纯化后酶液,在不同温度下(0、4、15、20、25、30、35、40 ℃)置于水浴锅中保温15 min,测定各温度下的酶活;同时在不同温度下(20、30、40、50、60 ℃)保存1 h,每10 min测定酶活。
1.2.7.2 pH对酶活的影响及酶对pH的耐受性
配制浓度为50 mmol/L的不同pH缓冲液:柠檬酸缓冲液(pH3.0~5.0)、磷酸盐缓冲液(pH6.0~8.0)、Tris-HCl缓冲液(pH9.0)、碳酸钠缓冲液(pH10.0~11.0),在缓冲液中加入纯化后的酶液,30 min后测定各pH下的酶活;同时将酶液与各缓冲液按1:3的比例混合后,在最适温度下保温4 h,每30 min测定酶活。
1.2.7.3 金属离子对酶活的影响
配制浓度10 mmol/L的含Mg2+、Ca2+、Cu2+、Fe2+、Zn2+、Mn2+的磷酸盐缓冲液,在缓冲液中加入纯化后的酶液,以不添加金属离子为对照,测定酶活。
1.2.7.4 有机溶剂对酶活的影响
在酶活测定体系中分别加入甲醇、乙醇、异丙醇、乙酸乙酯、正己烷、三氯乙烷等有机溶剂[22],有机溶剂体积分数为10%,对照组为不添加有机溶剂,最适温度处理1 h,测定酶活。
1.3 数据处理
实验数据均平行测定3次,采用Microsoft Excel 2017进行数据统计,采用SPSS.25进行单因素方差分析及显著性分析,采用Design-expert 8.0进行Plackett-Burman和Box-Behnken 响应面优化试验设计及分析验证,使用Origin 2021进行图像绘制。
2. 结果与分析
2.1 产脂肪酶菌株的初筛和复筛
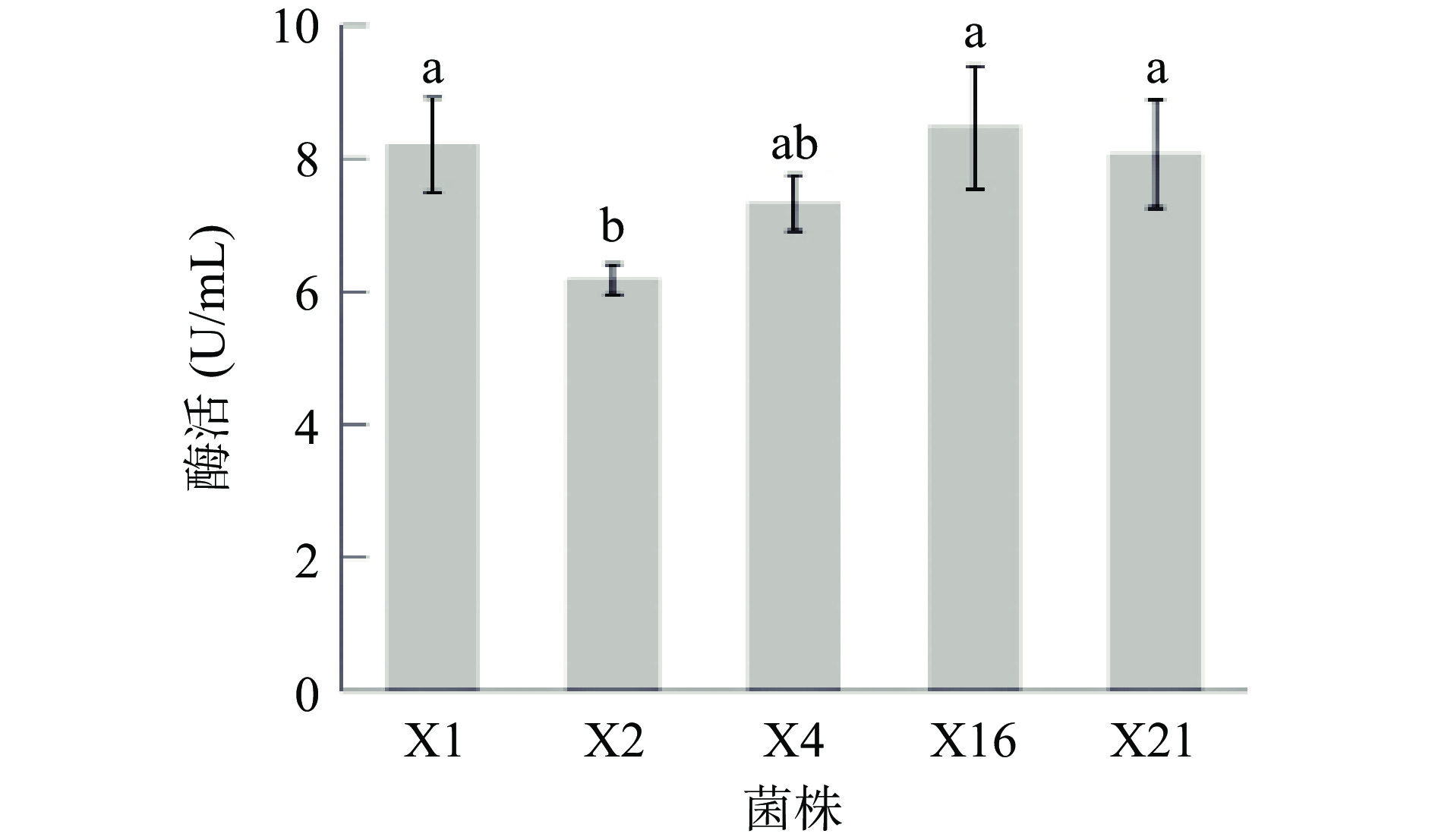
经过初筛,有5株菌株(X1、X2、X4、X16、X21)能够在筛选培养基上产生白色沉淀圈,表明这5株菌株均能产生脂肪酶。对初筛结果中的5株菌株进行复筛,提取粗酶液,通过测定酶活大小(图1),菌株X16酶活最高,为8.47 U/mL,因此选取X16进行后续实验。
2.2 菌株鉴定结果
2.2.1 菌株形态学鉴定
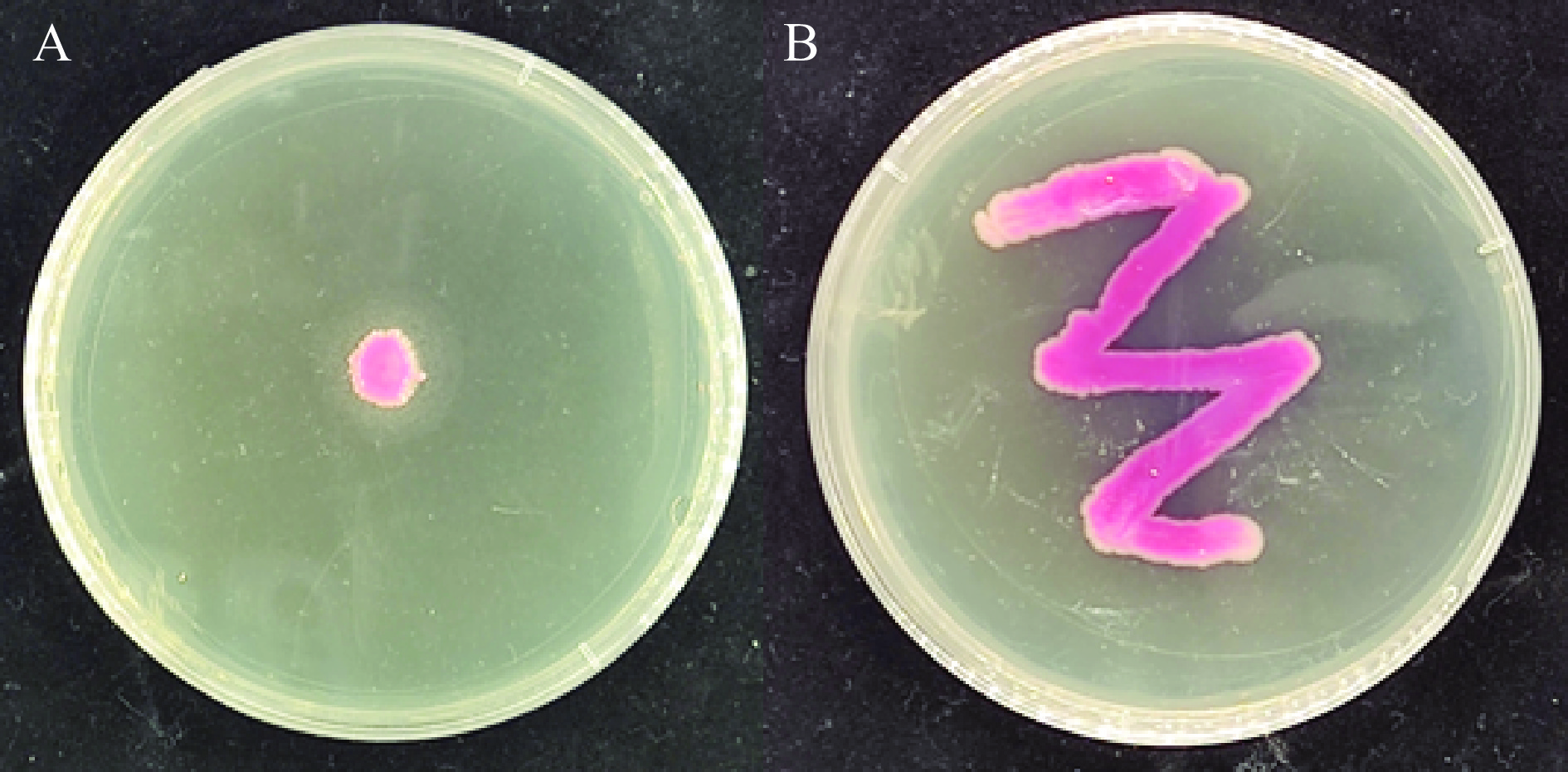
由图2A可以看出菌株X16在筛选培养基上产生的白色沉淀圈,由图2B可知,X16菌株呈粉红色,边缘光滑整齐,表面呈凸起状,表面湿润。
2.2.2 菌株生理生化特性
菌株X16生理生化结果显示(表3),该菌株为革兰氏阴性菌,可分解葡萄糖、蔗糖、麦芽糖,不产气,VP实验为阳性,MR实验阴性,可产生蛋白酶与脂肪酶。
表 3 菌株X16生理生化鉴定Table 3. Physiological and biochemical identification of strain X16实验名称 结果 实验名称 结果 革兰氏染色 − 麦芽糖 + V-P实验 + 乳糖 − 甲基红(MR)实验 − 明胶水解 + 过氧化氢酶 + 产H2S实验 − 葡萄糖 + 蛋白酶 + 蔗糖 + 脂肪酶 + 注:“+”为阳性,“−”为阴性。 2.2.3 菌株分子生物学鉴定
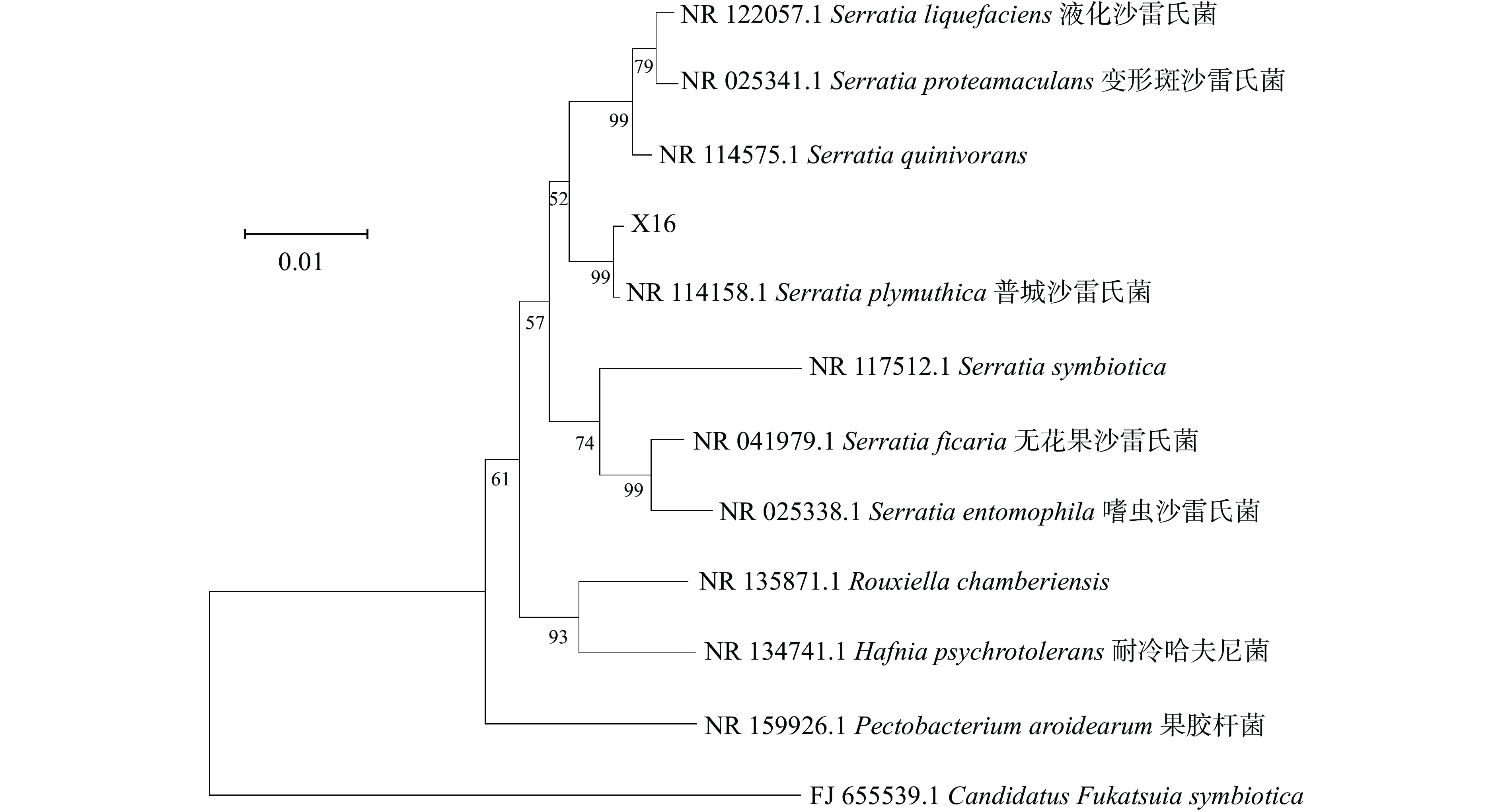
将测序结果在NCBI上进行BLAST同源性比对,通过形态学与分子生物学鉴定,并结合《伯杰氏细菌鉴定手册》,使用MEGA11构建系统发育树(图3),比较不同菌株间的同源性,确定菌株X16为普城沙雷氏菌(Serratia plumuthica)。
2.3 产低温脂肪酶菌株发酵条件优化
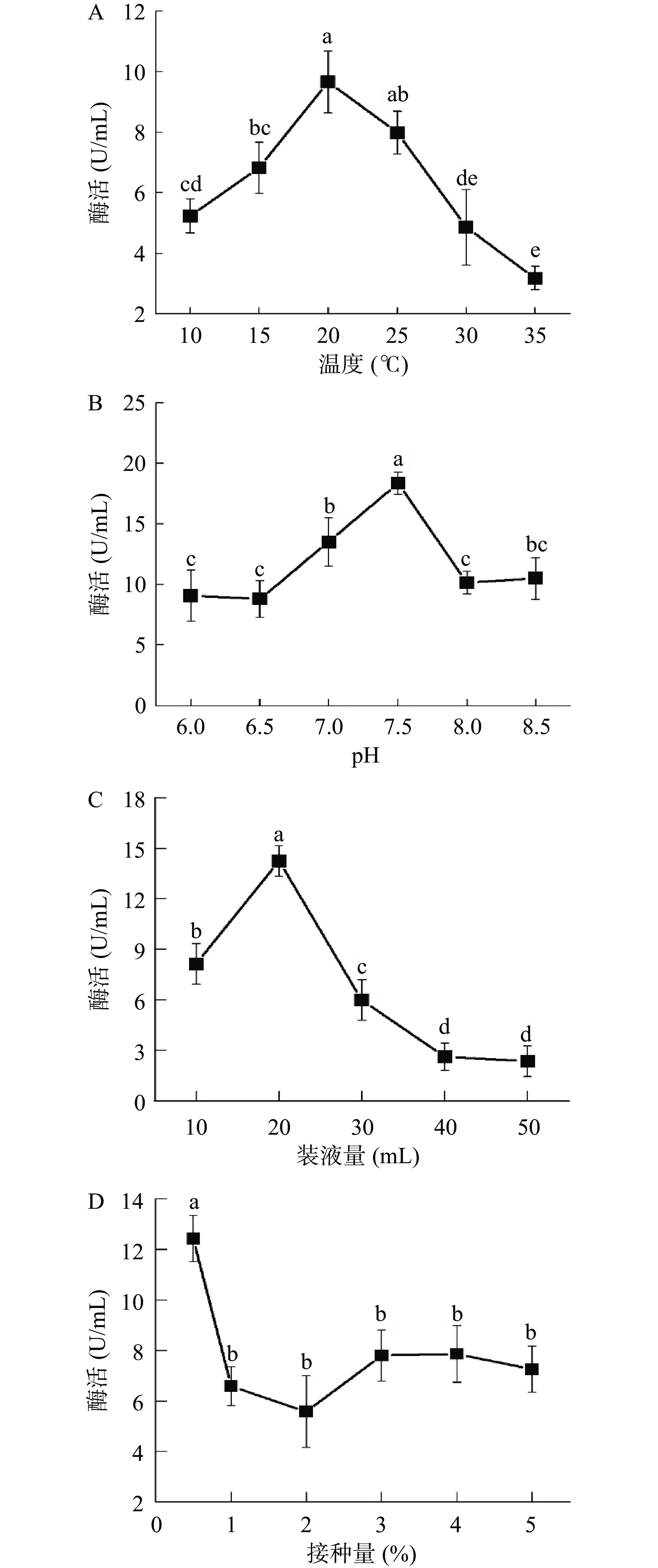
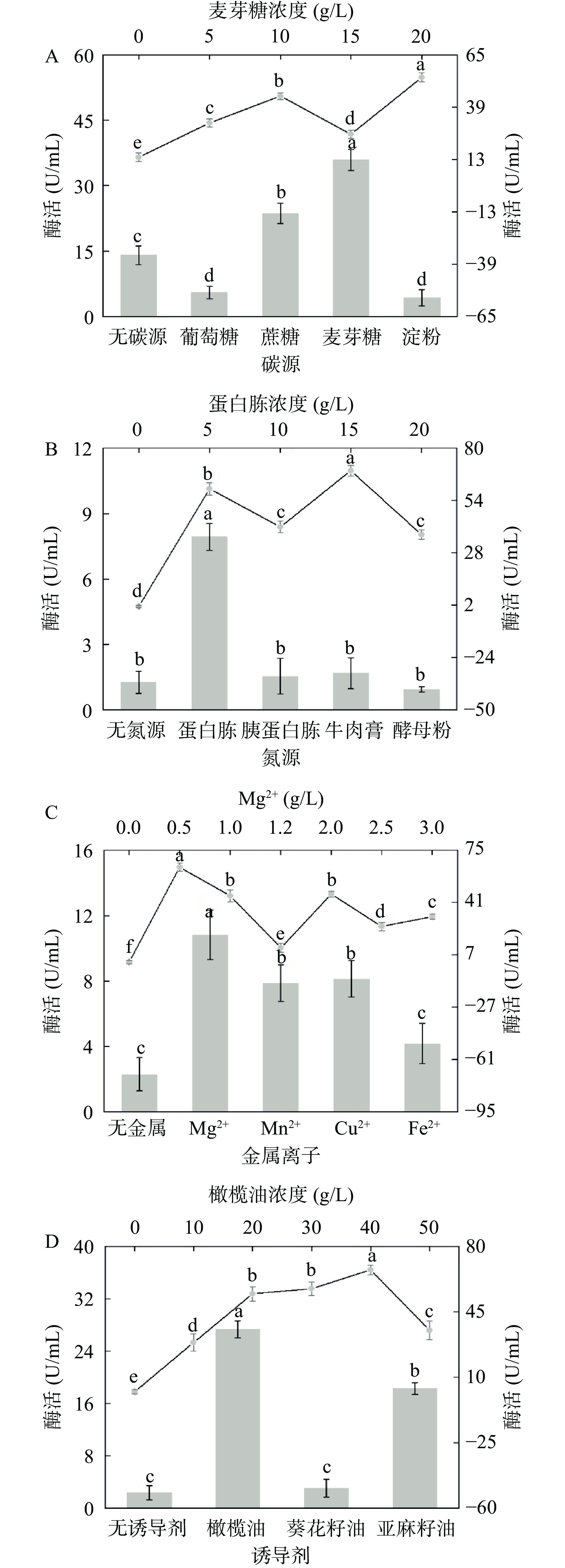
在10~20 ℃之间,菌株X16的酶活逐渐增加,在20 ℃时,酶活达到最大值,为9.66 U/mL,随着温度逐渐上升,酶的活性呈现下降的趋势(图4A)。随着pH从6升至7.5时,酶活逐渐增大,在pH 7.5时达到最大值,为18.35 U/mL,当pH大于7.5后,酶活逐渐下降(图4B)。当装液量为20 mL/50 mL时,酶活最大为14.25 U/mL,随着装液量逐渐增加,酶活呈下降趋势(图4C)。当接种量为0.5%时,酶活最大为12.43 U/mL,当接种量大于0.5%时,酶活逐渐降低(图4D)。
探究不同碳源对菌株X16产酶的影响,结果如图5A所示,当以麦芽糖为单一碳源时,酶活最高,其次为蔗糖,无碳源,葡萄糖,淀粉。同时麦芽糖的添加量对酶活也有显著影响,当麦芽糖浓度为20 g/L时酶活最高。如图5B,当分别添加胰蛋白胨,牛肉膏,酵母粉为氮源时,菌株酶活很低,以蛋白胨为唯一氮源时酶活最高。蛋白胨浓度对菌株酶活影响如图表明,当蛋白胨浓度为15 g/L时,菌株酶活最高。金属离子同样会对菌株的产酶情况存在影响,由图5C所示,在发酵培养基中添加不同成分的金属离子均对菌株的酶活存在促进效应,当Mg2+为唯一金属离子时,菌株酶活最高。当Mg2+浓度达到0.5 g/L时,此时菌株酶活达到最高值。诱导剂的添加会促进酶活的提高,如图5D所示,当添加橄榄油和亚麻籽油时,菌株酶活显著提高,当添加橄榄油时,菌株的酶活有最大值,当诱导剂为葵花籽油时,菌株酶活并没有明显上升。进一步探究橄榄油浓度对酶活的影响时,发现当橄榄油浓度为40 mL/L时,菌株酶活达到最大。
2.4 响应面试验设计
2.4.1 Plackett-Burman 试验设计
采用 Plackett-Burman 试验设计进行脂肪酶活性测定,试验设计及结果见表4,各试验因素显著性分析见表5。
表 4 Plackett-Burman试验设计及结果Table 4. Plackett-Burman experimental design and results实验号 A
麦芽糖B
蛋白胨C
镁离子D
橄榄油E
温度F
pHG
装液量H
接种量酶活
(U/mL)1 1 −1 1 1 −1 1 −1 −1 39.05 2 1 1 −1 1 −1 −1 −1 1 46.90 3 1 1 1 −1 1 1 −1 1 32.10 4 −1 −1 −1 −1 −1 −1 −1 −1 21.45 5 −1 −1 1 1 1 −1 1 1 57.99 6 1 −1 −1 −1 1 1 1 −1 41.48 7 −1 1 1 1 −1 1 1 −1 81.53 8 1 1 −1 1 1 −1 1 −1 88.21 9 −1 1 1 −1 1 −1 −1 −1 32.14 10 −1 1 −1 −1 −1 1 1 1 40.35 11 −1 −1 −1 1 1 1 −1 1 45.64 12 1 −1 1 −1 −1 −1 1 1 24.37 表 5 Plackett-Burman试验各因素显著性分析Table 5. Significance analysis of each factor in Plackett-Burman来源 自由度 Adj SS Adj MS F值 P值 T值 模型 8 4624.94 578.12 14.46 0.025 线性 8 4624.94 578.12 14.46 0.025 A麦芽糖 1 4.08 4.08 0.1 0.77 −0.32 B蛋白胨 1 694.06 694.06 17.37 0.025 4.17 C镁离子 1 23.64 23.64 0.59 0.498 −0.77 D橄榄油 1 2335.95 2335.95 58.44 0.005 7.64 E温度 1 160.73 160.73 4.02 0.139 2.01 F pH 1 6.88 6.88 0.17 0.706 0.41 G装液量 1 1133.66 1133.66 28.36 0.013 5.33 H接种量 1 265.95 265.95 6.65 0.082 −2.58 误差 3 119.91 39.97 合计 11 4744.84 各因素P值由表可知,该线性回归模型显著。在发酵条件优化实验中,各个因素对产酶影响的重要性排序为:橄榄油>装液量>蛋白胨>接种量>温度>镁离子>pH>麦芽糖,其中装液量,蛋白胨添加量,橄榄油添加量三者P值均小于0.05,表明3个因素对菌株产脂肪酶有显著影响,因此选择这3个因素进行后续爬坡实验。
2.4.2 最陡爬坡试验设计及结果
根据上述PB试验确定的单因素正负效应,确定爬坡试验设计。由表6可知,第4组酶活最高,选定第4组为中心点进行响应曲面优化。
表 6 最陡爬坡试验设计及结果Table 6. Experimental design and results of steepest climbing实验号 A装液量 B蛋白胨 C橄榄油 酶活(U/mL) 1 10 0 10 19.76 2 20 5 20 86.85 3 30 10 30 70.11 4 40 15 40 91.18 5 50 20 50 84.51 2.4.3 响应面设计及结果
以装液量、蛋白胨、橄榄油为响应面设计的三个因素,以脂肪酶活力为响应值,通过三因素三水平的Box-Behnken试验设计和响应面分析方法,探究菌株的最优发酵条件,设计及结果如表7所示。
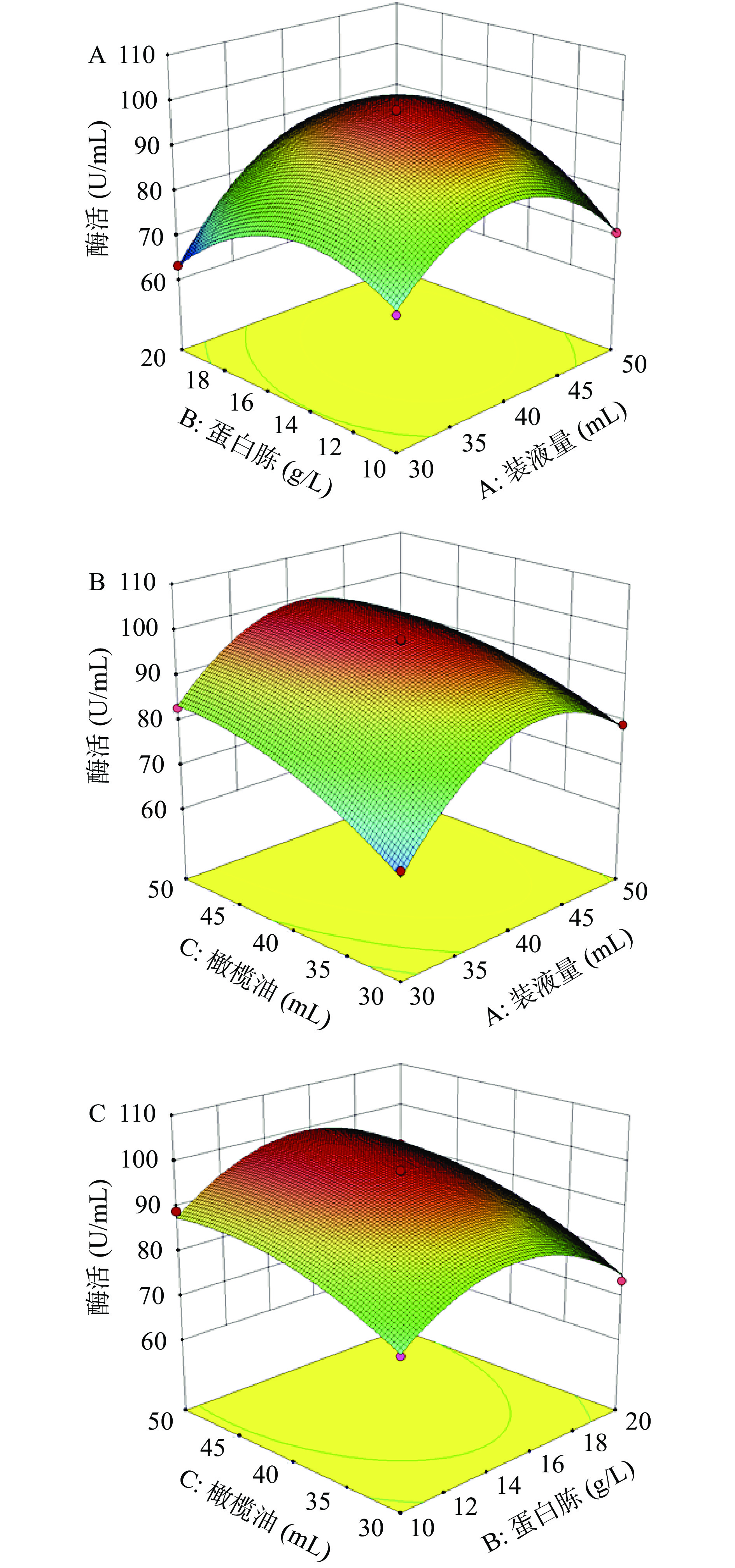
表 7 响应面设计方案及结果Table 7. Response surface design scheme and results实验组 A装液量 B蛋白胨 C橄榄油 酶活(U/mL) 1 +1 0 +1 85.56 2 0 +1 −1 73.53 3 +1 +1 0 82.72 4 0 0 0 96.33 5 −1 −1 0 72.28 6 0 −1 −1 76.12 7 −1 0 +1 82.95 8 −1 +1 0 63.13 9 +1 −1 0 70.75 10 −1 0 −1 66.78 11 0 −1 +1 89.17 12 +1 0 −1 79.18 13 0 0 0 97.84 14 0 +1 +1 90.58 15 0 0 0 98.13 如表8所示,响应曲面整体模型十分显著,但是失拟项并不显著,说明该模型可以真实反应装液量、蛋白胨、橄榄油与脂肪酶酶活之间的关系,可以用该模型进行分析与最优值预测。响应曲面结果如图6所示,酶活随着装液量、蛋白胨、橄榄油的变化先上升后下降,其中装液量和橄榄油的交互作用极为显著,但是蛋白胨与橄榄油的交互作用不显著。通过响应器优化得到的优化结果为装液量42.17 mL,蛋白胨13.95 g/L,橄榄油45.60 mL/L,优化后的脂肪酶酶活预测值为98.79 U/mL。考虑到实际操作的便捷性,将装液量调整为42 mL,蛋白胨调整为14 g/L,橄榄油为46 mL/L,其余因素为温度20℃,pH7.5,接种量0.5%,20g/L麦芽糖及0.5g/L MgSO4·7H2O,经过验证得到脂肪酶平均酶活为98.05 U/mL,与预测值拟合性较好。
表 8 响应面设计方差及结果Table 8. Response surface design variance and results来源 自由度 平方和 均方 F 值 P 值 模型 9 1764.80 196.088 80.65 < 0.0001 A 1 136.70 136.703 56.23 0.001 B 1 0.34 0.336 0.14 0.725 C 1 346.50 346.503 142.52 0.000 A2 1 773.41 773.410 318.11 0.000 B2 1 425.93 425.932 175.19 0.000 C2 1 69.64 69.640 28.64 0.003 AB 1 111.51 111.514 45.87 0.001 AC 1 23.96 23.961 9.86 0.026 BC 1 4.00 4.000 1.65 0.256 误差 5 12.16 2.431 失拟 3 10.29 3.429 3.67 0.221 纯误差 2 1.87 0.934 合计 14 1776.95 2.5 硫酸铵沉淀结果
硫酸铵沉淀法对酶活损伤小,且沉淀能长时间保存,不同饱和度硫酸铵对酶脂肪酶纯化效果存在差异,沉淀结果如表9所示,当硫酸铵饱和度为50%~80%时,酶活性较高,其中饱和度为70时酶活性最高,为93.18 U/mL,饱和度低于40%时,纯化效果降低。
表 9 硫酸铵沉淀结果Table 9. Results of ammonium sulfate precipitation饱和度(%) 酶活(U/mL) 饱和度(%) 酶活(U/mL) 10 40.98 60 81.73 20 45.34 70 93.18 30 67.52 80 74.61 40 53.98 90 66.55 50 77.06 2.6 低温脂肪酶酶学性质
2.6.1 酶最适反应温度及温度对酶稳定性的影响
取纯化后的酶液,在0~40 ℃条件下分别进行酶活测定。结果如图7A所示,菌株所产的脂肪酶活性在30 ℃达到最高,且在0 ℃时仍有30%的相对活性,证明该酶属于低温脂肪酶。将酶液在不同温度下保存一定时间后,酶的活性如图7B所示,该脂肪酶在30 ℃条件下相对酶活性最好,且热稳定性较好,处理60 min后仍有80%以上的相对活性。60 ℃时热稳定性最差,60 ℃下处理10 min酶活就损失了60%。
2.6.2 酶最适反应pH及其酸碱稳定性
30 ℃下,将纯化后的酶液置于不同pH反应体系中,分别测定酶活。pH为7~8时相对酶活达到了80%以上,最适反应pH为7(图7C)。将酶液在不同pH的缓冲液中处理3 h,每隔30 min测定酶活,结果显示该脂肪酶在pH为7和8时的稳定性最好,过酸或者过碱对酶的稳定性影响很大,pH为3时处理240 min酶活几乎完全丧失(图7D)。
2.6.3 金属离子对酶活的影响
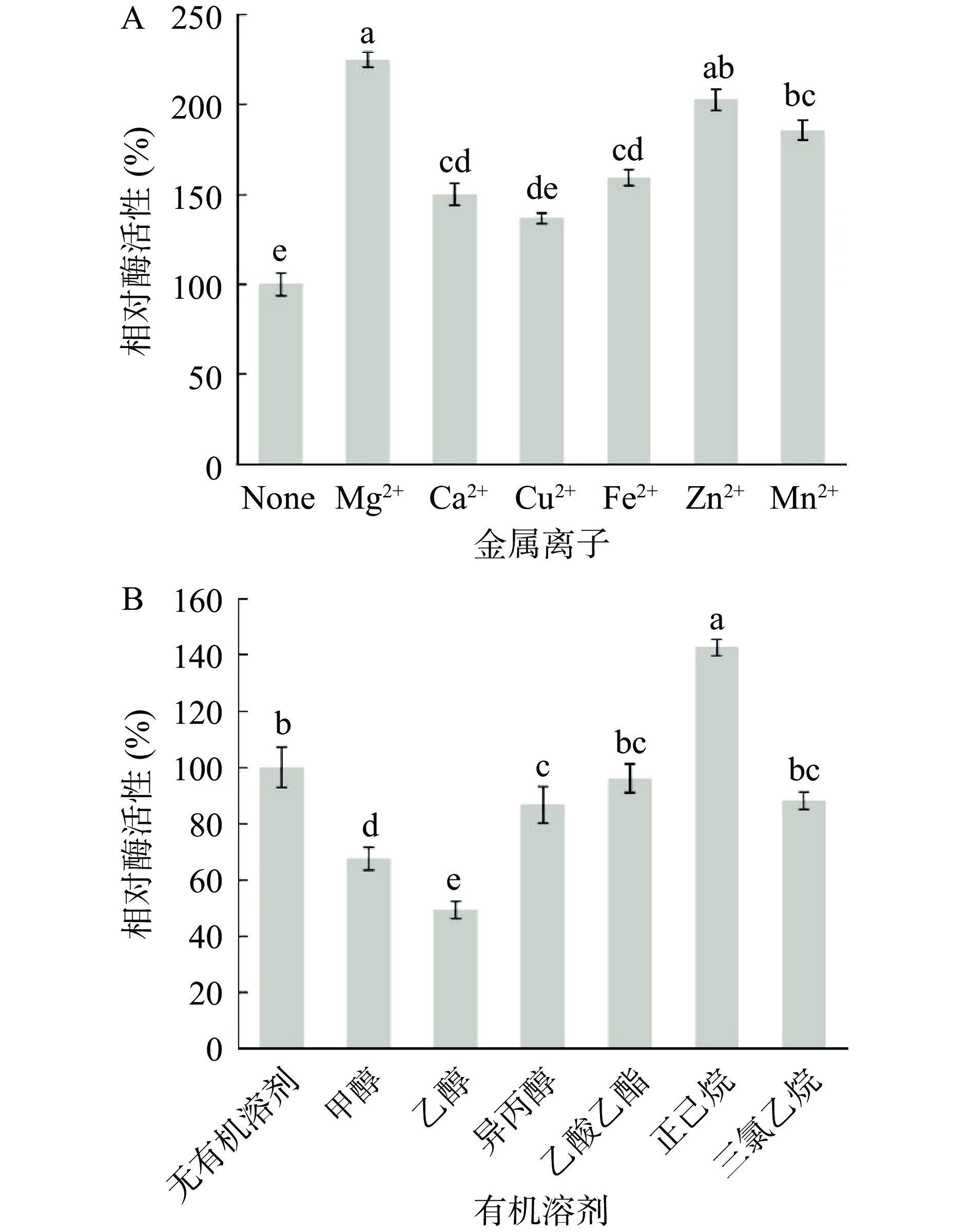
配制浓度为10 mmol/L的含有Mg2+、Ca2+、Cu2+、Fe2+、Zn2+、Mn2+的磷酸盐缓冲液,在缓冲液中加入纯化后的酶液,以不添加金属离子为对照。结果如图8A,不同的金属离子均对酶活有促进作用,其中Mg2+对酶活的促进作用最为显著,相对酶活性达到了224%。
2.6.4 有机溶剂对酶活的影响
不同的有机溶剂也会对酶活产生影响。由图8B可见,异丙醇,乙酸乙酯,三氯乙烷对酶活影响并不显著,但正己烷对酶活有明显的促进作用,经正己烷处理后相对酶活达到了142%,甲醇与乙醇对该酶有一定的抑制作用。
3. 讨论
脂肪酶在生产生活等多个领域中均起到重要的作用,近年来对脂肪酶的需求日益增加,微生物因其速生,种类繁多,易工业化等优点,已成为工业生产脂肪酶的重要来源。目前,细菌脂肪酶主要源自沙雷氏菌属,假单胞菌属(Pseudomonas),芽胞杆菌属(Bacillus),耶尔森菌属(Yersinia),红酵母属(Rhodotorula)等[23-29],而本文筛选的普城沙雷氏菌为沙雷氏菌属,与刘元利[15],李长春等[25]的研究有一定相似之处。
本研究利用Plackett-Burman实验,爬坡试验及响应曲面设计对普城沙雷氏菌产脂肪酶进行发酵条件优化,最终得到的酶活为98.05 U/mL。相比于程爽等[30]从油污污染土壤中筛选出的产脂肪酶粗酶活为2.39 U/mL的沙雷氏菌属,刘延波等[31]从酒曲筛选出产脂肪酶活为15.09 U/mL的枯草芽孢杆菌(Bacillus subtilis),本实验筛选的菌株有一定的产酶优势。但对比刘元利[15]从青海污染原油筛选出产低温脂肪酶酶活1326 U/mL的沙雷氏菌LHY-1,吴子君[32]从发酵芝麻饼中筛选得到产脂肪酶活262.81 U/mL的铜绿假单胞菌( Pseudomonas aeruginosa)和Neihaya等[33]从土壤分离的产脂肪酶活122 U/mL的粘质沙雷氏菌 (Serratia marcescens)有一定不足。
酶学性质研究表示,该脂肪酶在0 ℃时仍有活性,且最适反应温度为30 ℃,属于低温脂肪酶,该最适温度与史程风[34]的研究结果一致。在pH稳定性方面,该酶在较宽的pH范围内(7~9)均比较稳定。同样,腐生链霉菌(S. saprophyticus)的脂肪酶在pH 6~9范围内表现出稳定性,低于或高于这一范围均严重失活[35]。本研究表明Mg2+可显著提高脂肪酶活性,因其可参与底物活化和酶的静电稳定,对脂肪酶有较强的刺激作用[36]。该酶在正己烷处理下活性显著提高,同样溶酪链霉菌EX-17的胞外脂肪酶在正己烷存在下活性提高了1.5倍[37],与本实验结果有良好的一致性。
4. 结论
经过形态学、生理生化实验及分子生物学鉴定,确定本实验筛选菌株为普城沙雷氏菌。该菌株产脂肪酶的最优发酵条件为20 ℃、pH7.5、装液量42 mL、接种量0.5%、20 g/L麦芽糖,14 g/L蛋白胨、0.5 g/L的MgSO4·7H2O及46 mL/L橄榄油。在此优化条件下,脂肪酶活为98.05 U/mL,是优化前的5.85倍。酶学性质显示该脂肪酶最适温度为30 ℃,属于低温脂肪酶,最适反应pH为7,Mg2+明显可以促进酶活,甲醇和乙醇明显抑制酶活性,而正己烷明显促进酶活性。本研究筛选菌株酶活虽高于部分报道,但是其工业生产有待扩大研究,本实验后续可从盐度、摇床转速、高产脂肪酶基因等方面进一步优化脂肪酶活性及产量。该研究结果可以为微生物资源开发利用,工业生产低温脂肪酶提供一定的理论依据及方法指导。
-
表 1 Plackett-Burman试验设计
Table 1 Plackett-Burman experimental design
序号 因素 低水平 高水平 A 麦芽糖(g/L) 5 15 B 蛋白胨(g/L) 10 20 C Mg2+(g/L) 0 1 D 橄榄油(mL) 30 50 E 温度(℃) 15 25 F pH 7 8 G 装液量(mL) 10 30 H 接种量(%) 0.25 0.75 表 2 Box-Behnken试验因素水平
Table 2 Box-Behnken experimental factor level
水平 因素 B:蛋白胨(g/L) G:橄榄油(mL) D:装液量(mL) −1 10 30 10 0 15 40 20 +1 20 50 30 表 3 菌株X16生理生化鉴定
Table 3 Physiological and biochemical identification of strain X16
实验名称 结果 实验名称 结果 革兰氏染色 − 麦芽糖 + V-P实验 + 乳糖 − 甲基红(MR)实验 − 明胶水解 + 过氧化氢酶 + 产H2S实验 − 葡萄糖 + 蛋白酶 + 蔗糖 + 脂肪酶 + 注:“+”为阳性,“−”为阴性。 表 4 Plackett-Burman试验设计及结果
Table 4 Plackett-Burman experimental design and results
实验号 A
麦芽糖B
蛋白胨C
镁离子D
橄榄油E
温度F
pHG
装液量H
接种量酶活
(U/mL)1 1 −1 1 1 −1 1 −1 −1 39.05 2 1 1 −1 1 −1 −1 −1 1 46.90 3 1 1 1 −1 1 1 −1 1 32.10 4 −1 −1 −1 −1 −1 −1 −1 −1 21.45 5 −1 −1 1 1 1 −1 1 1 57.99 6 1 −1 −1 −1 1 1 1 −1 41.48 7 −1 1 1 1 −1 1 1 −1 81.53 8 1 1 −1 1 1 −1 1 −1 88.21 9 −1 1 1 −1 1 −1 −1 −1 32.14 10 −1 1 −1 −1 −1 1 1 1 40.35 11 −1 −1 −1 1 1 1 −1 1 45.64 12 1 −1 1 −1 −1 −1 1 1 24.37 表 5 Plackett-Burman试验各因素显著性分析
Table 5 Significance analysis of each factor in Plackett-Burman
来源 自由度 Adj SS Adj MS F值 P值 T值 模型 8 4624.94 578.12 14.46 0.025 线性 8 4624.94 578.12 14.46 0.025 A麦芽糖 1 4.08 4.08 0.1 0.77 −0.32 B蛋白胨 1 694.06 694.06 17.37 0.025 4.17 C镁离子 1 23.64 23.64 0.59 0.498 −0.77 D橄榄油 1 2335.95 2335.95 58.44 0.005 7.64 E温度 1 160.73 160.73 4.02 0.139 2.01 F pH 1 6.88 6.88 0.17 0.706 0.41 G装液量 1 1133.66 1133.66 28.36 0.013 5.33 H接种量 1 265.95 265.95 6.65 0.082 −2.58 误差 3 119.91 39.97 合计 11 4744.84 表 6 最陡爬坡试验设计及结果
Table 6 Experimental design and results of steepest climbing
实验号 A装液量 B蛋白胨 C橄榄油 酶活(U/mL) 1 10 0 10 19.76 2 20 5 20 86.85 3 30 10 30 70.11 4 40 15 40 91.18 5 50 20 50 84.51 表 7 响应面设计方案及结果
Table 7 Response surface design scheme and results
实验组 A装液量 B蛋白胨 C橄榄油 酶活(U/mL) 1 +1 0 +1 85.56 2 0 +1 −1 73.53 3 +1 +1 0 82.72 4 0 0 0 96.33 5 −1 −1 0 72.28 6 0 −1 −1 76.12 7 −1 0 +1 82.95 8 −1 +1 0 63.13 9 +1 −1 0 70.75 10 −1 0 −1 66.78 11 0 −1 +1 89.17 12 +1 0 −1 79.18 13 0 0 0 97.84 14 0 +1 +1 90.58 15 0 0 0 98.13 表 8 响应面设计方差及结果
Table 8 Response surface design variance and results
来源 自由度 平方和 均方 F 值 P 值 模型 9 1764.80 196.088 80.65 < 0.0001 A 1 136.70 136.703 56.23 0.001 B 1 0.34 0.336 0.14 0.725 C 1 346.50 346.503 142.52 0.000 A2 1 773.41 773.410 318.11 0.000 B2 1 425.93 425.932 175.19 0.000 C2 1 69.64 69.640 28.64 0.003 AB 1 111.51 111.514 45.87 0.001 AC 1 23.96 23.961 9.86 0.026 BC 1 4.00 4.000 1.65 0.256 误差 5 12.16 2.431 失拟 3 10.29 3.429 3.67 0.221 纯误差 2 1.87 0.934 合计 14 1776.95 表 9 硫酸铵沉淀结果
Table 9 Results of ammonium sulfate precipitation
饱和度(%) 酶活(U/mL) 饱和度(%) 酶活(U/mL) 10 40.98 60 81.73 20 45.34 70 93.18 30 67.52 80 74.61 40 53.98 90 66.55 50 77.06 -
[1] CONTESINI F J. Aspergillus sp. lipase: Potential biocatalyst for industrial use[J]. Journal of Molecular Catalysis,2010,67(3−4):163−171. doi: 10.1016/j.molcatb.2010.07.021
[2] 李志国, 任敏, 闫清泉, 等. 不同来源脂肪酶对乳制品风味的影响[J]. 食品科技,2022,47(7):32−37. [LI Z G, REN M, YAN Q Q, et al. Effects of different sources of lipase on the flavor of dairy products[J]. Food Science and Technology,2022,47(7):32−37. LI Z G, REN M, YAN Q Q, et al. Effects of Different Sources of Lipase on the Flavor of Dairy Products[J]. Food Science and Technology, 2022, 47(7): 32-37.
[3] 多拉娜, 徐伟良, 李春冬, 郭梁. 产脂肪酶微生物的研究进展及其在食品中的应用[J]. 粮食与油脂,2020,33(10):8−10. [DUO L N, XU W L, LI C D, GUO L. Research progress on the lipase-producing microbial and its application in food[J]. Cereals& Oils,2020,33(10):8−10. doi: 10.3969/j.issn.1008-9578.2020.10.004 [DUO L N, XU W L, LI C D, GUO L. Research progress on the lipase-producing microbial and its application in food. [J]. Cereals&Oils, 2020, 33(10): 8-10. doi: 10.3969/j.issn.1008-9578.2020.10.004
[4] WEN H J, CHEN Q, ZHENG G J. Enantioselective synthesis of (1S, 4R)-N-(benzylcarbamoyl)-4-aminocyclopent-2-en-1-ol by Candida antarctica lipase B[J]. Laboratory of Chemical Resources Engineering Beijing University of Chemical Technology,2015,26(11):1431−1434.
[5] SHUAI H, SHAO Z, HUANG, et al. Efficient synthesis of the intermediate of abacavir and carbovir using a novel (+)-gamma-lactamase as a catalyst[J]. Bioorganic and Medicinal Chemistry Letters,2015,25(18):3878−3881.
[6] BACHA A B, AL-ASSAF A, MOUBAYED N M S, et al. Evaluation of a novel thermo-alkaline Staphylococcus aureus lipase for application in detergent formulations[J]. Saudi Journal of Biological Sciences,2018,25(3):409−417. doi: 10.1016/j.sjbs.2016.10.006
[7] BHARATHIRAJA B, KUMAR R R, PRAVEENKUMAR R, et al. Biodiesel production from different algal oil using immobilized pure lipase and tailor made rPichia pastoris with Cal A and Cal B genes[J]. Bioresource Technology,2016,213:69−78. doi: 10.1016/j.biortech.2016.02.041
[8] DING L, LI M, WANG W, et al. Advances in plant GDSL lipases: from sequences to functional mechanisms[J]. Acta Physiologiae Plantarum,2019,41(9):151−162. doi: 10.1007/s11738-019-2944-4
[9] MENDES A A, OLIVEIRA P C, CASTRO H. Properties and biotechnological applications of porcine pancreatic lipase[J]. Journal of Molecular Catalysis B Enzymatic,2012,78:119−134. doi: 10.1016/j.molcatb.2012.03.004
[10] KANMANI P, ARAVIND J, KUMARESAN K. An insight into microbial lipases and their environmental facet[J]. International Journal of Environmental Science & Technology,2015,12:1147−1162.
[11] BEHERA A R, VELUPPAL A, DUTTA K. Optimization of physical parameters for enhanced production of lipase from Staphylococcus hominis using response surface methodology[J]. Environmental Science and Pollution Research,2019,26:34277−34284. doi: 10.1007/s11356-019-04304-0
[12] 柳萌, 刘瑞玲, 郜海燕, 等. 蓝莓采后病原菌胞外脂肪酶的提取及粗酶性质研究[J]. 中国食品学报,2019,19(11):62−69. [LIU M, LIU R L, GAO H Y, et al. Extraction and enzymatic properties of lipase from pathogenic fungi of postharvested blueberry[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(11):62−69. LIU M, LIU R L, GAO H Y, et al. Extraction and enzymatic properties of lipase from pathogenic fungi of postharvested blueberry[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(11): 62-69.
[13] SALGADO V, FONSECA C, SILVA T L D, et al. Isolation and identification of magnusiomyces capitatus as a lipase-producing yeast from olive mill wastewater[J]. Waste and Biomass Valorization,2020,11(4):3207−3221.
[14] 林仙菊, 叶秀云, 周智敏, 等. 洋葱伯克霍尔德菌产脂肪酶的条件研究[J]. 中国食品学报,2017,17(2):69−76. [LIN X J, YE X Y, ZHOU Z M, et al. Studies on the lipase-producing conditions ofBurkholderia cepacia[J]. Journal of Chinese Institute of Food Science and Technology,2017,17(2):69−76. LIN X J, YE X Y, ZHOU Z M, et al. Studies on the Lipase-producing Conditions of Burkholderia cepacia[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(2): 69-76.
[15] 刘元利, 陈吉祥, 李彦林, 等. 一株产低温脂肪酶沙雷氏菌的鉴定、基因表达及酶学性质[J]. 中国食品学报,2018,18(6):121−129. [LIU Y L, CHEN J X, LI Y L, et al. Identification, gene expression and enzyme characterization of Serratia sp. producing cold adapted lipase[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(6):121−129. LIU Y L, CHEN J X, LI Y L, et al. Identification, Gene Expression and Enzyme Characterization of Serratia sp. Producing Cold Adapted Lipase[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(6): 121-129.
[16] SINGH A K, MUKHOPADHYAY M. Overview of fungal lipase: A review[J]. Applied Biochemistry and Biotechnology, Part A. Enzyme Engineering and Biotechnology,2012,166(2):486−520.
[17] 陈贵元, 魏云林. 低温脂肪酶的研究现状与应用前景[J]. 生物技术通报,2006(2):29−32. [CHEN G Y, WEI Y L. The research status and application prospect of cold-adapted lipases[J]. Biotechnology Bulletin,2006(2):29−32. CHEN G Y, WEI Y L. The research status and application prospect of cold-adapted lipases[J]. Biotechnology Bulletin, 2006(2): 29-32.
[18] 王剑锋, 刘建玲, 王璋. 从土壤中筛选产漆酶微生物菌株的研究[J]. 食品与发酵工业,2007(10):35−39. [WANG J F, LIU J L, WANG Z. Screening of laccse-producing microbial stains from soil[J]. Food and Fermentation Industries,2007(10):35−39. WANG J F, LIU J L, WANG Z. Screening of Laccse-producing microbial stains from soil[J]. Food and Fermentation Industries, 2007, (10): 35-39.
[19] PLOU F J, FERRER M, NUERO O M, et al. Analysis of Tween 80 as an esterase lipase substrate for lipolytic activity assay[J]. Biotech Techniques,1998,12(3):183−186. doi: 10.1023/A:1008809105270
[20] 雷启义, 邹凯, 周江菊, 等. 脂肪酶活力测定方法及其比较[J]. 凯里学院学报,2011,29(6):43−45. [LEI Q Y, ZOU K, ZHOU J J, et al. The determination method of activity of lipase and its comparision[J]. Journal of Kaili University,2011,29(6):43−45. LEI Q Y, ZOU K, ZHOU J J, et al. The determination method of activity of lipase and its comparision[J]. Journal of Kaili University, 2011, 29(6): 43-45.
[21] 魏景超, 真菌鉴定手册[M]. 上海: 科学技术出版社, 1979 WEI J C. Identification manual[M]. Shanghai: Science Press, 1979.
[22] 汪璞, 王方华, 唐庆芸, 等. 固定化嗜热嗜碱土芽孢杆菌T1脂肪酶的制备及其催化特性研究[J]. 现代食品科技,2015,31(5):175−180. [WANG P, WANG F H, TANG Q Y, et al. Preparation and catalytic properties of immobilized thermoalkaliphilic T1 lipase from Geobacillus sp. strain T1[J]. Modern Food Science and Technology,2015,31(5):175−180. WANG P, WANG F H, TANG Q Y, et al. Preparation and catalytic properties of immobilized thermoalkaliphilic t1 lipase from geobacillus sp. strain T1[J]. Modern Food Science and Technology, 2015, 31(5): 175-180.
[23] 刘虹蕾, 缪铭, 江波, 等. 微生物脂肪酶的研究与应用[J]. 食品工业科技,2012,33(12):376−381. [LIU H L, LIAO M, JIANG B, et al. Research and applications of microbial lipases J]. Science and Technology of Food Industry,2012,33(12):376−381.
[24] 谈重芳, 王雁萍, 陈林海, 等. 微生物脂肪酶在工业中的应用及研究进展[J]. 食品工业科技,2006(7):193−195. [TAN C F, WANG Y P, CHEN L H, et al. Study on development and idustrial application of microbial lipase[J]. Science and Technology of Food Industry,2006(7):193−195. TAN C F, WANG Y P, CHEN L H, et al. Study on development and idustrial application of microbial lipase[J]. Science and Technology of Food Industry 2006, (7): 193-195.
[25] 李长春. 碱性脂肪酶高产菌株Serratia sp. SL-11的筛选及酶的分离纯化与部分性质研究[D]. 重庆: 西南大学, 2006 LI C C. Screening, purification and characterization of the lipase produced by Serratia sp. SL-11[D]. Chongqing: Southwest University, 2006.
[26] 刘明丽, 李崇萍, 刘琨毅, 等. 脂肪酶的应用进展[J]. 食品工业,2021,42(7):249−253. [LIU M L, LI C P, LIU K Y, et al. Application progress of lipase[J]. The Food Industry,2021,42(7):249−253. LIU M L, LI C P, LIU K Y, et al. Application progress of lipase[J]. The Food Industry, 2021, 42(7): 249-253.
[27] MAHARANA A K, SINGH S M. A cold and organic solvent tolerant lipase produced by Antarctic strain Rhodotorula sp. Y-23[J]. Journal of Basic Microbiology,2018,58(4):331−342. doi: 10.1002/jobm.201700638
[28] JI X, LI S, WANG B, et al. Expression, purification and characterization of a functional, recombinant, cold-active lipase (LipA) from psychrotrophic Yersinia enterocolitica[J]. Protein Expr Purif,2015,115:125−31. doi: 10.1016/j.pep.2015.08.002
[29] SALWOOM L, RAHMAN R, SALLEH A B, et al. New recombinant cold-adapted and organic solvent tolerant lipase from Psychrophilic pseudomonas sp. LSK25, isolated from signy island antarctica[J]. International Journal of Molecular Sciences,2019,20(6):1264−1269. doi: 10.3390/ijms20061264
[30] 程爽, 包朋鑫, 徐玉晨, 等. 一株脂肪酶产生菌的筛选鉴定及其发酵条件优化[J]. 中国食品添加剂,2021,32(11):73−80. [CHENG S, BAO P X, XU Y C, et al. Isolation, identification of a lipase-producing bacterium and its optimized fermentation conditions[J]. China Food Additives,2021,32(11):73−80. CHENG S, BAO P X, XU Y C, et al. Isolation, identification of a lipase-producing bacterium and its optimized fermentation conditions[J]. China Food Additives, 2021, 32(11): 73-80.
[31] 刘延波, 邢星月, 赵志军, 等. 高产脂肪酶菌株的筛选鉴定及产酶条件优化[J]. 中国酿造,2019,38(7):54−59. [LIU Y B, XING X Y, ZHAO Z J, et al. Screening and identification of high yield lipase strains and optimization of enzyme production conditions[J]. China Brewing,2019,38(7):54−59. doi: 10.11882/j.issn.0254-5071.2019.07.011 LIU Y B, XING X Y, ZHAO Z J, et al. Screening and identification of high yield lipase strains and optimization of enzyme production conditions[J]. China Brewing, 2019, 38(7): 54-59. doi: 10.11882/j.issn.0254-5071.2019.07.011
[32] 吴子君, 陈思沅, 杜昭君, 等. 产脂肪酶菌株的筛选、鉴定及产酶条件优化[J]. 河南工业大学学报(自然科学版),2021,42(6):10−16. [WU Z J, CHEN S R, DU Z J, et al. Screening and identification of lipase producing strains and optimization of lipase producing conditions[J]. Journal of Henan University of Technology (Natural Science Edition),2021,42(6):10−16. WU Z J, CHEN S R, DU Z J, et al. Screening and identification of lipase producing strains and optimization of lipase producing conditions[J]. Journal of Henan University of Technology (Natural Science Edition), 2021, 42(6): 10-16.
[33] ZAKI N H, SAEED S E, BAHO S. Production, purification and characterization of extra cellular lipase from serratia marcescens and its potential activity for hydrolysis of edible oils[J]. Al-Nahrain University,2012,15(1):94−102.
[34] 史程风, 贾冉冉, 阎振丽, 等. 一株产低温脂肪酶酵母菌的鉴定及酶学性质[J]. 化工进展,2022,41(10):5541−5548. [SHI C F, JIA R R, YAN Z L, et al. Identification of a cold-adapted lipase-producing yeast and its enzyme characterization[J]. Chemical Industry and Engineering Progress,2022,41(10):5541−5548. SHI C F, JIA R R, YAN Z L, et al. Identification of a cold-adapted lipase-producing yeast and its enzyme characterization[J]. Chemical Industry and Engineering Progress, 2022, 41(10): 5541-5548.
[35] SAKINÇ T, KLEINE B, GATERMANN S G. Biochemical characterization of the surface-associated lipase of Staphylococcus saprophyticus[J]. FEMS Microbiology Letters,2007,274:335−341. doi: 10.1111/j.1574-6968.2007.00857.x
[36] ANDREINI C, BERTINI I, CAVALLARO G, et al. Metal ions in biological catalysis: from enzyme databases to general principles[J]. Jbic Journal of Biological Inorganic Chemistry,2008,13(8):1205−1218. doi: 10.1007/s00775-008-0404-5
[37] VOLPATO G, RODRIGUES R C, HECK J X, et al. Production of organic solvent tolerant lipase by Staphylococcus caseolyticus EX17 using raw glycerol as substrate[J]. Journal of Chemical Technology & Biotechnology,2008,83(6):821−828.
-
期刊类型引用(5)
1. 龙腾发,林清钰,张忠兰,孙雨暄,金尧,霍强,陈春强. 餐厨易腐有机垃圾中油脂降解菌的筛选和产酶条件优化. 环境工程. 2024(06): 103-110 .  百度学术
百度学术
2. 许琳琳,刘慧乾,张梦瑶,张慧静,李家兴,戚晨晨,王成涛. 低温脂肪酶产生菌的筛选、表达及酶学性质分析. 食品工业科技. 2024(20): 133-140 .  本站查看
本站查看
3. 陈志娜,尹琳琳,刘锦,邵孟元,叶韬,黄晓辰. 1株抑MRSA植物乳植杆菌CHEN1的全基因组测序及产细菌素基因分析. 食品科学. 2024(22): 43-50 .  百度学术
百度学术
4. 吴涛,李一豪,胡珀,何婷婷,赵祥杰,杨荣玲,李晓滟,朱伟杰. 具有催化熊果苷酰化反应能力的微生物全细胞培养条件的优化. 食品与发酵工业. 2024(22): 137-142 .  百度学术
百度学术
5. 陈梦越,孙劲,张文丽,王洁,周星朴,黄诗维,楚菲菲. 产脂肪酶菌株筛选及发酵条件与酶学性质研究. 西昌学院学报(自然科学版). 2024(03): 78-89 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:

 下载:
下载:
