Optimization of Peeling Process of Dried ‘Hui’ Jujube and Changes of the Functional Components
-
摘要: 本研究以新疆干灰枣为试材,优化碱液去皮工艺,采用ABTS+自由基的清除能力与铁还原力评价抗氧化活性,采用液相色谱-质谱(LC-MS/MS)分析其代谢物的变化;以色泽、风味、质地、去皮率等为考察因素,结合去皮前后干灰枣的抗氧化活性和其功效成分变化,采用单因素和响应面试验优化最佳去皮工艺。结果表明,最佳工艺组合为碱液浓度3%、去皮时间3 min、去皮温度79 ℃。在此工艺条件下,干灰枣去皮率达到99.99%,感官评分最高为80.50±0.50分;与去皮前相比,去皮后枣肉的总酚含量、可溶性固形物含量和ABTS+自由基的清除能力与铁还原能力均呈下降趋势(P<0.05);通过LC-MS/MS对干灰枣去皮前后的功效成分进行分析,共鉴定出968种代谢物,通过KEGG富集分析发现,黄酮类化合物和核苷酸类化合物是干灰枣去皮处理过程中损失的主要功能成分。本研究采用多种手段综合评价了红枣碱液去皮工艺,为新疆灰枣进一步精细加工生产提供了理论依据。Abstract: In this study, Xinjiang dry ‘Hui’ jujube was peeled by lye. The antioxidant activity was evaluated on the scavenging ability on ABTS+ free radicals and iron reducing ability. The changes of metabolites were analyzed by liquid chromatography-tandem mass spectrometry (LC-MS/MS). The peeling process of dyr ‘Hui’ jujube was optimized through the single-factor experiments response surface experiments based on the quality (i.e. color, flavor, texture, peeling rate), the antioxidant activity and the changes of functional components in the jujube. The optimal conditions were as follows: The concentration of lye was 3%, the peeling time was 3 min, and the speeling temperature was 79 ℃. In comparison, under these process conditions, 99.99% of dried ‘Hui’ jujube were peeled, with the highest sensory score of 80.50±0.50. Compared with before peeling, the total phenol content, soluble solid content, ABTS+ free radical scavenging ability and iron reduction ability of jujube meat after peeling showed a decreasing trend (P<0.05). Up to 968 metabolites were identified by LC-MS/MS. The KEGG enrichment analysis revealed that flavonoids and nucleotides were the main loss functional components during the peeling process. In this study, various methods were used to comprehensively evaluate the peeling technology of jujube with alkali liquor, which provided theoretical basis for further fine processing and production of Xinjiang ‘Hui’ jujube.
-
Keywords:
- Ziziphus jujube cv. Hui /
- lye peeling /
- process optimization /
- active ingredients /
- metabolome
-
灰枣(Ziziphus jujube cv.‘Hui’),属鼠李科(Rhamnaceae)枣属(Ziziphus Mill.)落叶乔木或小乔木植物,又名新郑灰枣,是我国特有的果品[1]。在《中国果树志·枣卷》中记载灰枣起源于河南新郑,后引种于全国各地,现是新疆红枣的主要品种之一[2]。灰枣含有大量的糖类化合物、酚类化合物、维生素、氨基酸、有机酸和多种有益微量元素,具有很高的药用价值和经济价值[3−5]。
去皮是食品加工中不可缺少的一部分,大多数农作物在食品加工的早期阶段都要去皮处理,如苹果、橘子、桃子、梨、南瓜、芒果、洋葱、胡萝卜、西红柿、土豆和枣等[6]。红枣皮主要含粗纤维,质地较硬,难以咀嚼和吞咽,影响红枣产品口感,并且红枣果皮随着打浆过程进入果汁,始终带着红枣皮固有的黑红色,严重影响红枣后续产品的外观及稳定性[7]。所以在红枣加工成红枣粉、醋、酸奶、糖浆、果汁等枣产品的过程中,通常先将红枣果皮去除[8]。常用的去皮方法有手工去皮、机械去皮、热水去皮和碱液去皮[8−9]。手工去皮可以获得更高质量的最终产品,但费时费力,对于工业用途来说效率低,因此仅局限于家庭和小规模加工[10−11]。机械去皮优点是水果和蔬菜保持新鲜和无损,但成本较高,形状不规则的果蔬难以去皮[12]。热水去皮的去皮效果较差、时间较长,另外去皮过程中存在水溶性矿物质、碳水化合物等可溶性营养物质的流失[13−14]。碱液去皮是食品工业中广泛使用的一种商业脱皮方法,通过高温和化学反应的协同作用而实现[15],碱液通过果皮扩散到皮下细胞时,果胶半乳糖电子单元中的α-1,4键可能被裂解,从而削弱了细胞壁中由果胶多糖单元支持的纤维素和半纤维素网络,达到去皮的目的,因此碱液去皮相较于前几个方法适用范围更广,操作简单、时间短、成本低,易实现规模化生产[15−16]。
目前对红枣去皮的工艺优化研究多以去皮效果为主要考察对象,缺乏去皮后红枣营养物质及活性的定量分析。因此,本实验选择新疆灰枣为原料,通过单因素及响应面优化灰枣碱液去皮工艺,并综合考察去皮过程中的灰枣感官评价、总酚含量和抗氧化活性变化及其代谢组学分析,为新疆红枣进一步精细加工生产提供一定的实验依据。
1. 材料与方法
1.1 材料与仪器
灰枣 新疆阿拉尔市塔里木大学园艺试验站提供,经园艺与林学学院吴翠云教授鉴定为灰枣,经过阴干制成干灰枣,挑选果形整齐饱满、无虫蛀、无霉变、大小均匀、无外伤的红枣为实验原材料。在4 ℃下储存,30 d内使用;氢氧化钠(食品级) 安琪酵母股份有限公司;福林酚(分析纯) 上海源叶生物科技有限公司;ABTS、TPTZ、芦丁 阿拉丁试剂(上海)有限公司。
集热式恒温磁力搅拌浴 郑州长城科工贸有限公司;UV-2600型紫外可见分光光度计 岛津仪器(苏州)有限公司;LB32T手持式糖度计 广州市速为电子科技有限公司;PT-3502C型全波长酶标仪 北京普天新桥技术有限公司;LXJ-ⅡB型大容量离心机 上海安亭科学仪器厂;Vanquish UPLC超高效液相色谱、Q Exactive HFX高分辨质谱 Thermo。
1.2 实验方法
1.2.1 碱液去皮工艺
参照张少颖等[17]和王晓涧[18]的研究方法,干灰枣在60 ℃蒸馏水浸泡6 h复水后(复水率为150%),经过在一定浓度的碱液和一定温度下浸泡一定时间,用蒸馏水冲洗去皮。
1.2.2 单因素实验
以去皮率、感官评分、多酚含量及抗氧化活性为考察指标,以碱液浓度、时间和温度为考察因素,设计三个因素不同水平,碱液浓度为0.5%、1%、2%、3%、4%、5%,时间为0.5、1、2、3、4、5、6 min,温度为40、50、60、70、80、90 ℃,固定温度为80 ℃、时间为3 min、碱液浓度为3%(W/V)进行单因素实验,考察不同因素对灰枣去皮率和感官评分的影响。
1.2.3 响应面优化试验设计
根据单因素实验结果,初步确定红枣去皮较合适的实验条件:碱液浓度为3%、时间为3 min,温度为80 ℃,结合耗能等因素,以碱液浓度、时间和温度为影响因素,以去皮效果及感官评分为考察指标,采用Design−Expert 8.0.6软件,根据Box−Behnken设计原理,进行3因素3水平17个实验点Box−Behnken设计响应面分析试验,因素水平设计见表1。
表 1 响应面试验设计的因素与水平Table 1. Response surface test design factors and levels水平 因素 X1时间(min) X2温度(℃) X3碱浓度(%) −1 2 70 2 0 3 80 3 1 4 90 4 1.2.4 去皮效果指标测定
1.2.4.1 去皮率
参照Zhou等[19]的研究方法并稍微作修改,去皮后的灰枣用游标卡尺约测量长度和直径并计算去皮面积,去皮率为去皮表面积与枣总表面积的百分比值。
1.2.4.2 感官评价
10名(5男和5女:18岁到25岁)专门感官培训的食品专业人员组成一个感官评价小组,对枣去皮效果进行感官评价。按照表2对去皮难易程度、去皮后果肉色泽、风味和质地进行评分。
表 2 灰枣去皮效果感官评价标准Table 2. Criteria for sensory evaluation of peeling effect of ‘Hui’ jujube指标 10~9分 8~6分 5~1分 0分 权重 去皮难易程度 去皮容易 去皮较容易 去皮较差 不能去皮 3 去皮后果肉色泽 黄绿色 黄色 黄褐色 黑褐色 3 风味 浓枣味 枣味>碱味 枣味<碱味 浓碱味 2 质地 脆 较脆 较软或绵 软 2 各项满分为10分,A1去皮难易程度权重为3,A2去皮后果肉颜色权重为3,A3去皮后风味权重为2,A4去皮后质地权重为2,总分为100分。
感官评分(A)=3×A1+3×A2+2×A3+2×A4
1.2.4.3 总酚含量测定
称取1.0 枣果肉样品,用80%的CH3OH定容到100 mL,在室温超声萃取30 min后离心后取上清液(提取液)冷藏备用。参照Liu等[20]的方法,总酚含量用Foline−Ciocalteau试剂法测定,将100 μL提取物与2 mL蒸馏水加入到试管混匀,加入200 μL Folin−Ciocalteu试剂并混合,静置5 min,再加入1 mL 20% Na2CO3溶液,并将混合物在室温下在黑暗反应40 min。通过分光光度计在765 nm处测量吸光度值,总酚含量表示为每克样品的没食子酸毫克当量(mg GAE/g DW)。
1.2.4.4 可溶性固形物含量测定
参照Sun等[21]研究方法,可溶性固形物用手持式糖度计测定。每颗枣去皮后果肉切成三到五片,切片榨汁,然后在4000 r/min离心10 min,取上清液用手持式糖度计测定可溶性固形物含量,进行三次测量取平均值。
1.2.4.5 抗氧化活性测定
将1.2.4.3项得到的提取液进行抗氧化活性测定。参照Yan 等[22]的方法并稍微作修改,测定ABTS+自由基清除能力。在96孔微孔板中加50 μL提取液与200 μL ABTS+溶液,摇动混合并在室温下保持10 min,芦丁作为阳性对照,在734 nm下进行测量,以Trolox为标准品,结果以μmol TE/g DW表示。
参照Jiang等[23]的方法并稍微作修改,测定铁还原能力。在96孔微孔板中加50 μL提取液与200 μL FRAP溶液,摇动混合并在37 ℃下避光,并保持10 min,芦丁作为阳性对照,然后在593 nm波长下进行测量,结果以μmol TE/g DW表示。
1.2.4.6 代谢组学分析
参照Shi等[24]和Feng等[25]研究方法并稍微作修改,对不同去皮过程枣进行代谢组学分析。样品在-80 ℃冻10~12 h,在真空冷冻干燥48 h后用粉碎机粉碎3 min。称取100 mg粉末,加入1 mL水:乙腈:异丙醇(1:1:1,V/V/V),涡旋30 s,低温下超声25 min,在4 ℃ 12000 r/min离心10 min取上清液,−20 ℃沉淀蛋白1 h,4 ℃ 12000 r/min离心10 min,上清液真空干燥溶解于200 μL 50% ACN,涡旋30 s,4 ℃ 14000 r/min离心10 min,上清液储存在−20 ℃备用上机检查。
使用超高效液相色谱和高分辨质谱进行数据收集和分析。
色谱柱:Waters HSS T3(100 mm×2.1 mm,1.8 μm);流动相A为超纯水(含0.04%甲酸),有机相B为乙腈(含0.04%乙酸),洗脱梯度:0.0~1.0 min A/B(100:0 V/V),1.0~9.0 min A/B(5:95 V/V),9~13 min A/B(5:95 V/V),13.0~17.0 min A/B(100:0 V/V);流速0.3 mL/min;柱温40 ℃;注射量2 μL;整个分析过程中样品置于4 ℃自动进样器中。
高分辨质谱系统进行一级、二级谱图的采集。电喷雾离子源(Electrospray Ionization,ESI)条件如下:温度为350 ℃,鞘气流速40 arb;扫描模式为Full-ms-ddMS2模式;扫描方式为正离子/负离子,离子喷雾电压:3 kV/-2.8 kV(正/负离子);一级与二级扫描范围分别为:70~1050 Da和200~2000 Da,分辨率分别为70000和17500。
1.3 数据处理
使用Excel 2020进行分析计算,Origin 2019与GraphPad Prism软件绘制图,采用SPSS 25相关性分析,Design Expert 8.0.6软件拟合响应面并优化去皮参数,原始数据用代谢组学处理软件Progenesis QI (Waters Corporation,Milford, USA)进行处理(数据库为http://www.hmdb.ca/、https://metlin.scripps.edu/等公共数据库);所有数据平行测定三次,结果以$ \overline {\text{X}} $±SD表示。
2. 结果与分析
2.1 不同碱液浓度、温度和时间对灰枣去皮率和感官评价的影响
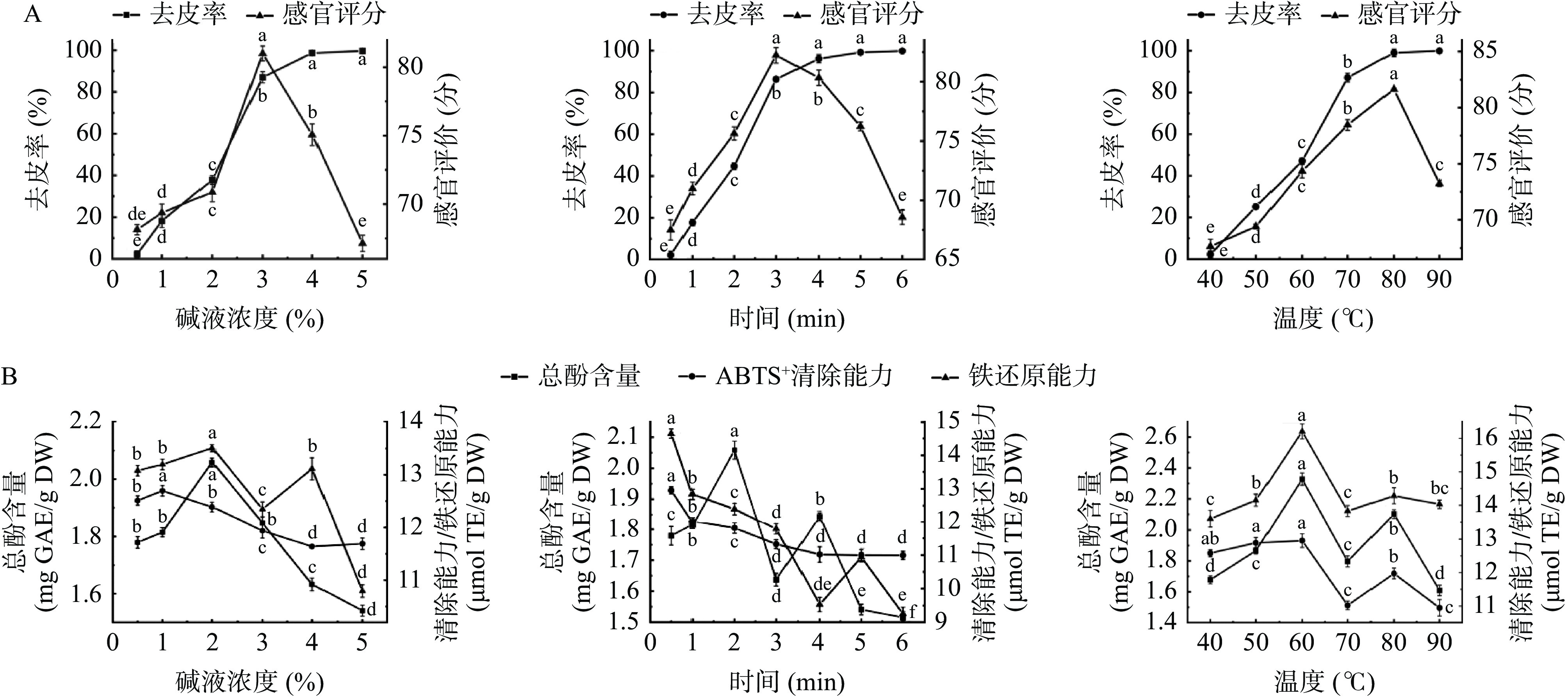
由图1A可知,随着碱液浓度的增加去皮率明显提高,当碱液浓度在3%以上时,去皮率变化差异性不显著(P>0.05),接近完全去皮效果,但随着碱液浓度的再增加枣肉颜色逐渐变成黑褐色,碱味也慢慢变浓,枣肉开始变软进而影响枣的质量,说明高浓度的碱液对红枣去皮感官评价影响较大[17],还有高浓度的碱液具有腐蚀性,碱液会去除水果的可食用部分[26],所以碱液浓度为3%时感官评价分最高,为81.3分,去皮过程中碱液浓度选择为3%比较适宜。随着时间的延长灰枣的去皮率逐渐增加,2~3 min去皮率迅速增加,4~6 min以后去皮率变化差异性不显著(P>0.05)接近完全去皮效果,随着碱液去皮时间的延长,红枣颜色逐渐变黑褐色,碱味变浓,还会导致可溶性营养成分的流失[27],所以碱液去皮过程3 min是较合适的去皮时间。温度为40~80 ℃去皮率迅速提高,80 ℃以后去皮率变化不显著(P>0.05),达到去皮率99%以上;在40~70 ℃范围内去皮效果不是很理想,温度逐渐增大过程中枣肉颜色有稍微变黑现象,枣肉风味变浓,Kaleoglu等[28]发现温度的升高会导致榛子脱皮时间的缩短,但温度过高时果皮蜡层的溶解,使碱液流入果实,导致果肉污染和营养成分流失[29−30]。所以在80 ℃时枣肉碱味、颜色、去皮效果合适,感官评价分达到最高,去皮过程中碱液温度选择为80 ℃比较适宜。
![]() 图 1 不同处理对灰枣去皮率和感官评价(A)及灰枣总酚含量和抗氧化活性(B)的影响注:图中不同字母表示差异显著(P<0.05),图3同。Figure 1. Effects of different treatments on peeling rate, sensory evaluation (A), total phenol content and antioxidant activity (B) of ‘Hui’jujube
图 1 不同处理对灰枣去皮率和感官评价(A)及灰枣总酚含量和抗氧化活性(B)的影响注:图中不同字母表示差异显著(P<0.05),图3同。Figure 1. Effects of different treatments on peeling rate, sensory evaluation (A), total phenol content and antioxidant activity (B) of ‘Hui’jujube2.2 不同碱液浓度、温度和时间的去皮处理对总酚含量和抗氧化活性的影响
灰枣在不同条件下去皮,枣肉总酚含量和抗氧化能力不同(图1B),随着碱液浓度增大,枣肉总酚含量和抗氧化活性呈现下降趋势(P<0.05),表明碱液浓度增大,活性成分损失较多[31],碱液浓度0.5%~3%之间,总酚含量为1.78±0.02~2.09±0.04 mg GAE/g DW、ABTS+自由基清除能力与铁还原能力分别为11.94±0.13~12.65±0.10 μmol TE/g DW和12.37±0.20~13.49±0.11 μmol TE/g DW都保持较高清除水平,所以去皮过程中碱液浓度为3%比较适宜。不同时间去皮处理后,枣肉中总酚含量和抗氧化能力随着时间延长基本呈现下降趋势,去皮时间0.5~3 min之间ABTS+自由基清除能力与铁还原能力分别为11.33±0.13~12.95±0.10 μmol TE/g DW和11.78±0.15~14.64±0.13 μmol TE/g DW,保持较强的抗氧化活性,去皮时间大于3 min铁还原能力和总酚含量下降比较明显,所以对总酚含量和抗氧化活性而言去皮时间为3 min比较合适。不同温度去皮过程中,枣肉中总酚含量和抗氧化活性变化趋势基本相似,铁还原能力比ABTS+自由基清除能力强,在40~60 ℃之间ABTS+自由基清除能力保持较高水平,当碱液温度在60和80 ℃时,总酚含量较高和铁还原能力较强,分别为2.32±0.03 mg GAE/g DW、15.25±0.18 μmol TE/g DW和2.10±0.03 mg GAE/g DW、13.65±0.20 μmol TE/g DW,ABTS+自由基清除能力也在碱液温度在60和80 ℃时保持较高水平,所以去皮过程中对总酚和抗氧化活性而言碱液温度为80 ℃比较适宜。
2.3 响应面试验工艺优化结果
通过单因素实验的基础上,感官评价为指标进行三因素三水平响应面试验,优化灰枣减液法去皮工艺进,响应面试验结果如表3所示。
表 3 响应面设计与结果Table 3. Response surface design and results试验号 X1:时间
(min)X2:温度
( ℃)X3:碱液浓度
(%)感官评价
(分)1 4.00 90.00 3.00 75 2 3.00 80.00 3.00 81.7 3 3.00 90.00 2.00 69.5 4 4.00 80.00 4.00 71.2 5 3.00 80.00 3.00 80.5 6 4.00 70.00 3.00 76.3 7 2.00 80.00 2.00 68.9 8 2.00 80.00 4.00 72.6 9 3.00 70.00 4.00 73.5 10 3.00 90.00 4.00 69.6 11 4.00 80.00 2.00 71.2 12 3.00 80.00 3.00 80.6 13 2.00 70.00 3.00 72.5 14 3.00 80.00 3.00 81.3 15 2.00 90.00 3.00 72.9 16 3.00 70.00 2.00 70.0 17 3.00 80.00 3.00 80.5 通过响应面试验结果得到回归模拟方程为:Y感官评价=80.92+0.85X1−0.66X2+0.91X3−0.42X1X2−0.92X1X3−0.85X2X3−3.21X12−3.53X22−6.74X32。
响应面方程分析结果见表4,模型的F=44.87,P<0.0001极显著。失拟项F=5.14且P=0.0738说明模型纯误差很小,模型能够很好预测实验结果。通常信噪比(Adeq Precision)大于4即为理想模型,实验信噪比为17.993≥4,证明该模型足以覆盖实验设计范围;C.V.%=1.23(<5),说明模型再现性好。R2=0.9830,调整后R2=0.9611,表明实验结果可用且与响应面模型预测值拟合较好。由表4可知X1和X3项影响显著(P<0.05),X12、X22、X32项影响极显著(P<0.01),X2、X1X2、X1X3和X2X3项影响不显著(P>0.05),通过丢弃不显著的项来获得优化模型方程:Y感官评价=80.92+0.85X1+0.91X3−3.21X12 −3.53X12 −6.74X32,表明,所建立的响应面模型准确、有效、可靠,可用于灰枣泡腾片制备工艺的预测。
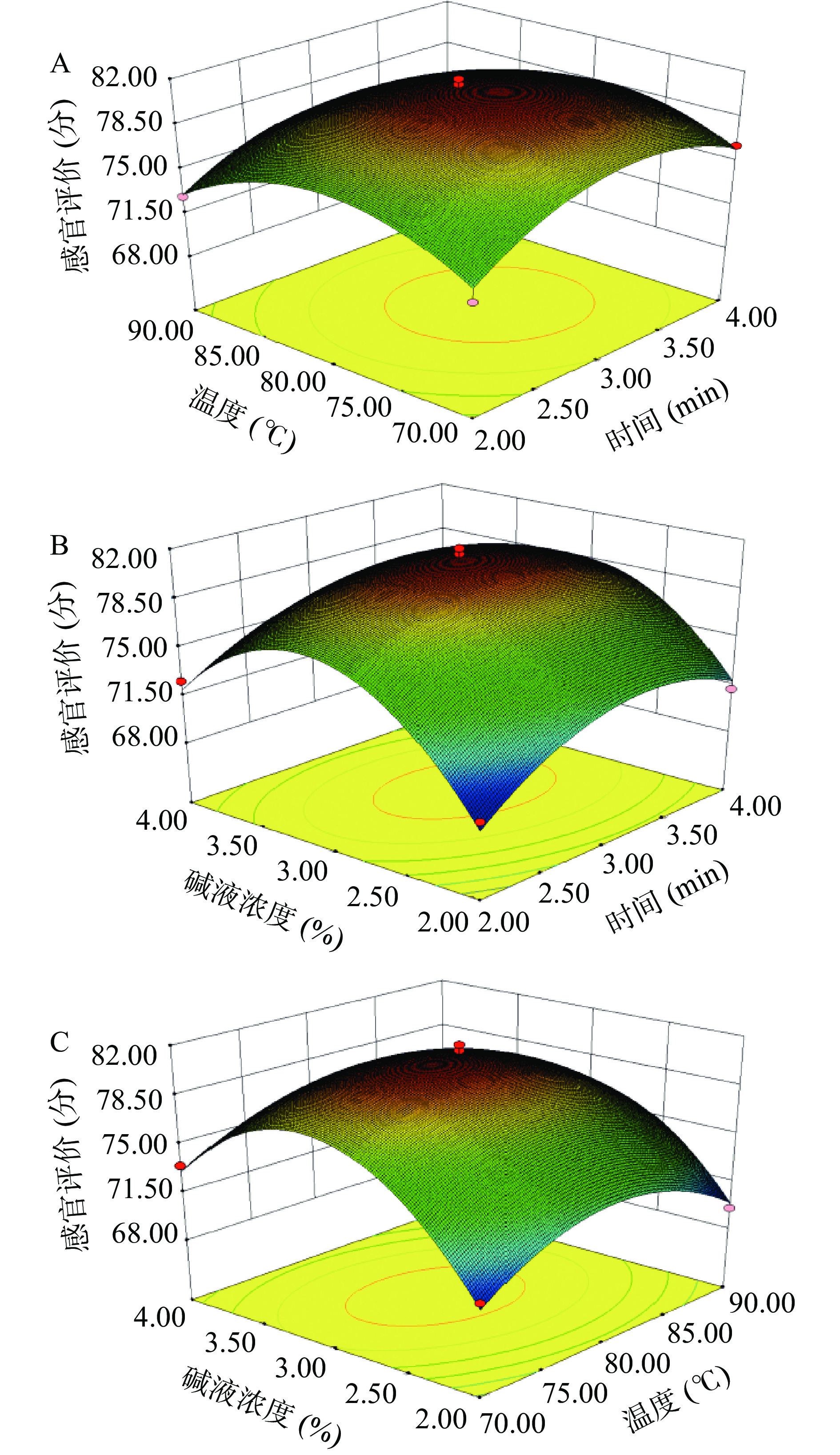
表 4 回归方程及方差分析Table 4. Regression equation and analysis of variance来源 平方和 自由度 均方 F值 P值 显著性 模型 338.39 9 37.60 44.87 <0.0001 ** X1 5.78 1 5.78 6.90 0.0341 * X2 3.51 1 3.51 4.19 0.0799 - X3 6.66 1 6.66 7.95 0.0258 * X1X2 0.72 1 0.72 0.86 0.3840 - X1X3 3.42 1 3.42 4.08 0.0830 - X2X3 2.89 1 2.89 3.45 0.1057 - X12 43.93 1 43.39 51.78 0.0002 ** X22 52.62 1 52.62 62.79 <0.0001 ** X32 190.99 1 190.99 227.93 <0.0001 ** 残差 5.87 7 0.84 失拟 4.66 3 1.55 5.14 0.0738 - 误差 1.21 4 0.30 总和 344.25 16 R2 0.9830 C.V. % 1.23 R2adj 0.9611 Adeq Precision 17.993 注:“**”表示极显著水平(P<0.01),“*”表示显著水平(P<0.05),“-”表示不显著(P>0.05)。 利用Design-Expert 8.0.6 软件进行优化(图2),得到灰枣去皮的最优工艺条件为:碱液浓度为3.07%,去皮温度为78.91 ℃,去皮时间为3.13 min,在此条件下所得到的灰枣感官评价分为81.08分,去皮率为:99.99%。由表中三个因素F值可知,三个因素对灰枣去皮的影响程度依次是碱液浓度(X3)>去皮时间(X1)>去皮温度(X2)。预测实验结果的基础上将条件调试为:碱浓度3%、时间3 min、温度79 ℃,此条件下去皮后感官评价80.50±0.50分跟预实验结果基本一致。
2.4 红枣去皮前后多酚含量以及可溶性固形物的变化
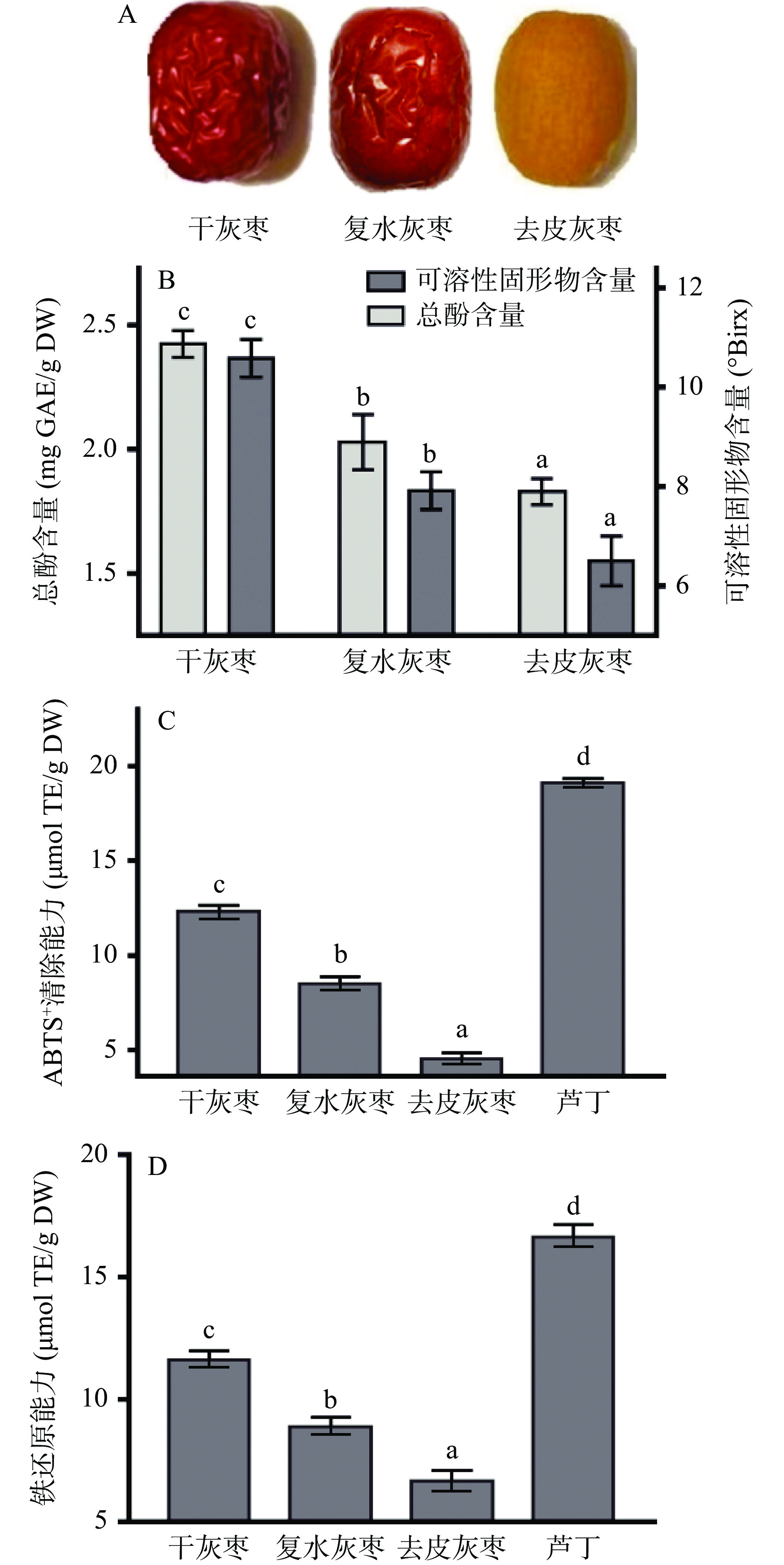
总酚是植物中一类含有多个酚羟基的化学物质,通常具有良好的生物活性[31]。干灰枣、复水后及碱液去皮后灰枣果肉总酚含量如图3B所示。复水处理的枣总酚含量为2.05±0.02 mg GAE/g DW,总酚含量为干灰枣的85.82%;碱液去皮处理的枣总酚含量为1.81±0.02 mg GAE/g DW,总酚含量为干灰枣的75.76%,去皮过程中总酚含量变化差异性显著(P<0.05),表明红枣碱液去皮处理导致枣总酚含量损失,这可能是复水后碱液和果肉接触导致酚类物质损失。
可溶性固形物一般是指食品中所有溶解于水化合物的总称,是评价水果质量的重要指标之一[32]。干灰枣、复水后及碱液去皮后的灰枣果肉可溶性固形物含量变化,结果如图3B所示,去皮过程中可溶性固形物含量呈降低趋势,干灰枣可溶性固形物含量为10.50±0.25 °Brix,灰枣复水后可溶性固形物含量降低到8.00±0.25 °Brix,是干灰枣的78.04%(P<0.05),复水后水分含量增大导致可溶性固形物含量下降;灰枣碱液去皮后可溶性固形物含量降到干灰枣61.91%,这可能是复水后在碱液中浸泡过程中一部分可溶性物质流失导致。
2.5 去皮前后抗氧化活性变化
由图3C可知,去皮过程中不同阶段对 ABTS+ 自由基清除能力有所不同,干灰枣清除能力为12.07±0.49 μmol TE/g DW,是芦丁清除能力的62.19%;复水后灰枣清除能力比干灰枣清除能力明显降低,是芦丁的41.77%;经碱液去皮处理后灰枣ABTS+自由基清除能力只有芦丁的22.82%。灰枣铁还原能力如图3D所示,未经过去皮处理的干灰枣铁还原能力是芦丁的71.24%;复水后的灰枣铁还原能力为8.78±0.20 μmol TE/g DW,是芦丁的53.97%;经碱液去皮后灰枣铁还原能力为6.62±0.36 μmol TE/g DW,是芦丁的40.65%。
2.6 代谢组学结果
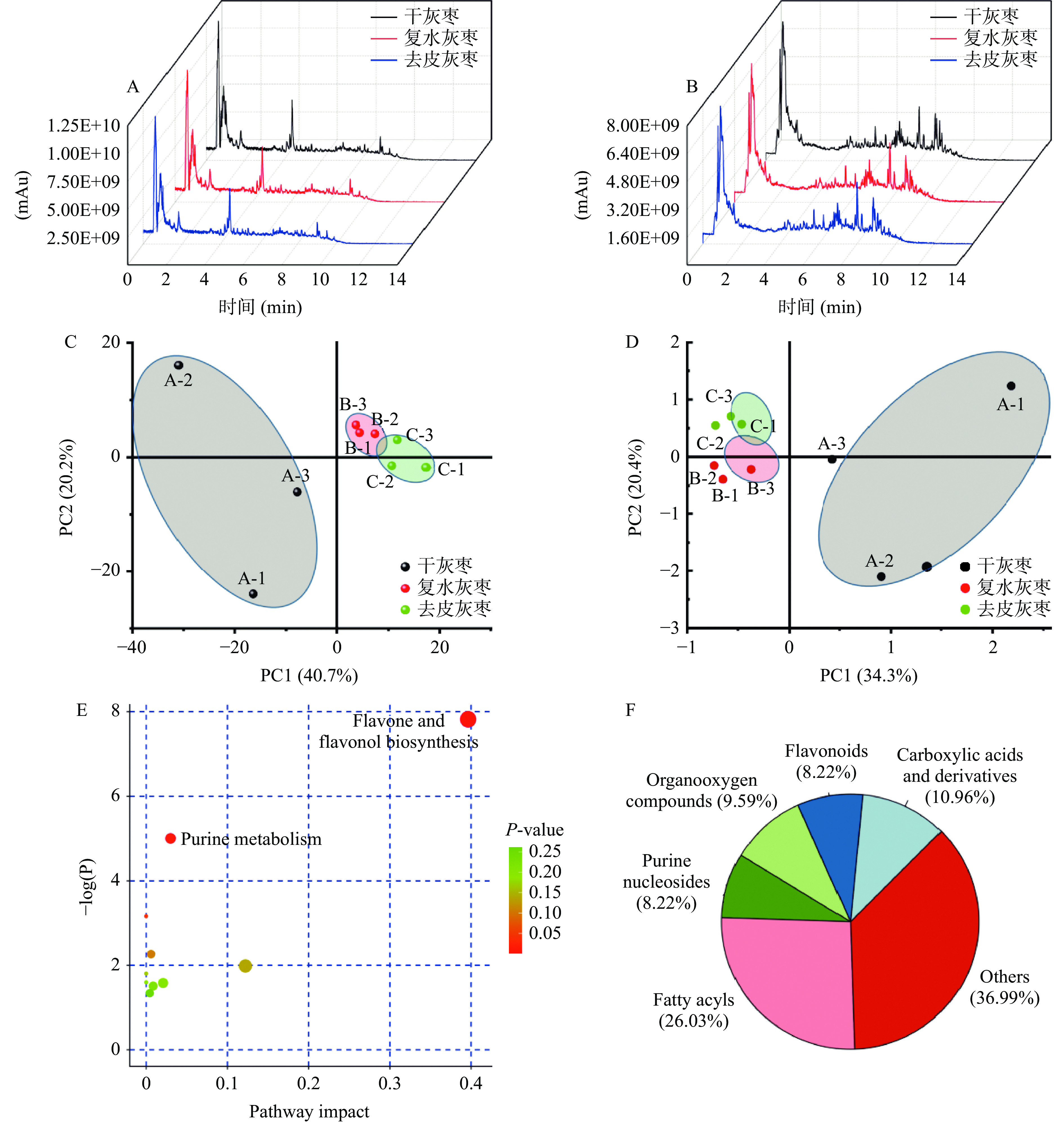
为了进一步了解干灰枣在经过复水和去皮处理后其中的代谢产物种类、数量及其变化规律,本文采用了非靶向代谢组学方法对不同处理的灰枣样本中各类代谢产物进行大规模和系统性的检测分析。通过LC−MS/MS的定性和定量检测,结果如图4A和图4B所示,经过与二级质谱数据库的比对分析,共鉴定出干灰枣968种次级代谢物,其中负离子模式下378种(图4A),正离子模式下590种(图4B)。通过对干灰枣中次级代谢物进行归纳分析,结果如图4E所示,干灰枣中主要含有脂质类化合物(26.03%)、有机酸及羧酸衍生物(10.96%)、有机氧化物(9.59%)、黄酮类化合物(8.22%)和核苷酸(8.2%),还有36.99%其他次级代谢物,包括生物碱、甾醇、萜类化合物等。PCA主成分分析结果表明(图4C和4D),复水灰枣和去皮灰枣样品间相互接近,而距离未做处理的干灰枣较远,说明干灰枣经过复水处理后,去皮过程并引起次级代谢物含量发生较大变化,造成干灰枣成分显著性变化的是复水处理。此外,通过对干灰枣与去皮灰枣的差异化合物进行KEGG富集分析(图4F)发现经过复水和去皮处理后,干灰枣主要损失的成分为黄酮类化合物与核苷酸类化合物。
3. 结论
碱液去皮法可以有效地提高去皮效果,缩短去皮时间。碱液去皮最佳工艺条件为碱液浓度3%,去皮温度79 ℃,去皮时间3 min,实际实验得到感官评价分80.50±0.50分,去皮率为99.99%,具有一定的可行性;总酚含量、可溶性固形物含量、ABTS+自由基的清除能力和铁还原能力在去皮过程中均稍微下降趋势,主要原因是在复水和碱液去皮过程中水分含量增大导致活性成分含量下降。对灰枣热碱液去皮前后的代谢产物进行定性和定量分析,共鉴定出968种代谢产物。其中,干枣在去皮处理过程中流失的功能成分主要为黄酮类化合物与核苷酸类化合物。本研究提供了有效的灰枣去皮工艺,评价了干灰枣碱液去皮前后活性成分变化,为灰枣加工前处理提供理论依据,有助于灰枣加工行业生产高质量的灰枣制品。
-
图 1 不同处理对灰枣去皮率和感官评价(A)及灰枣总酚含量和抗氧化活性(B)的影响
注:图中不同字母表示差异显著(P<0.05),图3同。
Figure 1. Effects of different treatments on peeling rate, sensory evaluation (A), total phenol content and antioxidant activity (B) of ‘Hui’jujube
表 1 响应面试验设计的因素与水平
Table 1 Response surface test design factors and levels
水平 因素 X1时间(min) X2温度(℃) X3碱浓度(%) −1 2 70 2 0 3 80 3 1 4 90 4 表 2 灰枣去皮效果感官评价标准
Table 2 Criteria for sensory evaluation of peeling effect of ‘Hui’ jujube
指标 10~9分 8~6分 5~1分 0分 权重 去皮难易程度 去皮容易 去皮较容易 去皮较差 不能去皮 3 去皮后果肉色泽 黄绿色 黄色 黄褐色 黑褐色 3 风味 浓枣味 枣味>碱味 枣味<碱味 浓碱味 2 质地 脆 较脆 较软或绵 软 2 表 3 响应面设计与结果
Table 3 Response surface design and results
试验号 X1:时间
(min)X2:温度
( ℃)X3:碱液浓度
(%)感官评价
(分)1 4.00 90.00 3.00 75 2 3.00 80.00 3.00 81.7 3 3.00 90.00 2.00 69.5 4 4.00 80.00 4.00 71.2 5 3.00 80.00 3.00 80.5 6 4.00 70.00 3.00 76.3 7 2.00 80.00 2.00 68.9 8 2.00 80.00 4.00 72.6 9 3.00 70.00 4.00 73.5 10 3.00 90.00 4.00 69.6 11 4.00 80.00 2.00 71.2 12 3.00 80.00 3.00 80.6 13 2.00 70.00 3.00 72.5 14 3.00 80.00 3.00 81.3 15 2.00 90.00 3.00 72.9 16 3.00 70.00 2.00 70.0 17 3.00 80.00 3.00 80.5 表 4 回归方程及方差分析
Table 4 Regression equation and analysis of variance
来源 平方和 自由度 均方 F值 P值 显著性 模型 338.39 9 37.60 44.87 <0.0001 ** X1 5.78 1 5.78 6.90 0.0341 * X2 3.51 1 3.51 4.19 0.0799 - X3 6.66 1 6.66 7.95 0.0258 * X1X2 0.72 1 0.72 0.86 0.3840 - X1X3 3.42 1 3.42 4.08 0.0830 - X2X3 2.89 1 2.89 3.45 0.1057 - X12 43.93 1 43.39 51.78 0.0002 ** X22 52.62 1 52.62 62.79 <0.0001 ** X32 190.99 1 190.99 227.93 <0.0001 ** 残差 5.87 7 0.84 失拟 4.66 3 1.55 5.14 0.0738 - 误差 1.21 4 0.30 总和 344.25 16 R2 0.9830 C.V. % 1.23 R2adj 0.9611 Adeq Precision 17.993 注:“**”表示极显著水平(P<0.01),“*”表示显著水平(P<0.05),“-”表示不显著(P>0.05)。 -
[1] 梁丰志. 环塔里木盆地灰枣及骏枣果实品质分析及优势产区划分[D]. 阿拉尔:塔里木大学, 2021 LIANG F Z. Fruit quality analysis and dominant zone division of ‘Hui’ and ‘Jun’ around Tarim Basin[D]. Alaer:Tarim University, 2021.
[2] 王鑫. 灰枣优系的比较及鉴定[D]. 阿拉尔:塔里木大学, 2021 WANG X. Comparison and identification of excellent strains of ‘Hui’ Jujube[D]. Alaer:Tarim University, 2021.
[3] GOU M, CHEN Q, QIAO Y, et al. Comprehensive investigation on free and glycosidically bound volatile compounds in Ziziphus jujube cv. Hui[J]. Journal of Food Composition and Analysis,2022,112(6):104665.
[4] SANG Y, SUN, P, WANG Y, et al. Postharvest treatment with 1-methylcyclopropene and chitosan enhances the antioxidant capacity and maintains the quality of hui jujube ( Ziziphus jujube Mill. cv. Huizao) during cold storage[J]. Journal of Food Processing and Preservation,2022,46(4):1−11.
[5] YANG N, WU C, YANG H, et al. Bioactive compounds, antioxidant activities and flavor volatiles of lager beer produced by supplementing six jujube cultivars as adjuncts[J]. Food Bioscience,2022,50(1):102008.
[6] PAN Z L, XUAN L, CHANDRASEKAR V, et al.Food peeling:Conventional and new approaches[J]. In Reference MModule in Food Science, 2016. doi: 10.1016/B978-0-08-100596-5.03091-2.
[7] 李琳, 邓艳, 代绍娟, 等. 红枣果肉汁加工中的去皮工艺研究[J]. 食品科技,2010,35(2):91−92, 100 LI Lin, DENG Yan, DAI Shaojuan, et al. Jujube cloudy juice peeled and processing technology[J]. Food Science and Technology,2010,35(2):91−92, 100.
[8] WANG B, KHIR R, PAN Z, et al. Feasibility of jujube peeling using novel infrared radiation heating technology[J]. Lebensmittel-Wissenschaft Technologie,2016,69(1):458−467.
[9] MURAKAM S, YAMAGUCHI K, HASHIMOTO N. Ethylene facilitates boil-peeling in fruits[J]. Food Science & Nutrition,2019,7(9):2836−2841.
[10] OKONKWO C E, OJEDIRAN J O, BARIBEFE A V, et al. Microwave-assisted infrared dry-peeling of beetroot:Peeling performance, product quality, and cell integrity[J]. Innovative Food Science & Emerging Technologies,2022,77(3):102982.
[11] 王丽娟, 宋思圆, 姜鹏, 等. 不同去皮方法对番茄去皮效果和品质的影响[J]. 食品科学,2017,38(5):26−31 doi: 10.7506/spkx1002-6630-201705005 WANG Lijuan, SONG Siyuan, JIANG Peng, et al. Effect of different peeling methods on the peeling efficiency and quality of tomatoes[J]. Food Science,2017,38(5):26−31. doi: 10.7506/spkx1002-6630-201705005
[12] CHEN Y, JING H, DU X , et al. Investigation on physicochemical, structural, and functional properties of protein from pecan (Carya illinoinensis (Wangenh.) K. Koch) treated by three different peeling methods[J]. Journal of Food Measurement & Characterization, 2022, 16 (5):3512−3525.
[13] WANG Y, LI D, SUN G, et al. A comparison of dynamic mechanical properties of processing-tomato peel as affected by hot lye and infrared radiation heating for peeling[J]. Journal of Food Engineering,2014,126(1):27−34.
[14] WANG W, LIU D, WANG L, et al. Ultrasound-assisted lye peeling of peach and comparison with conventional methods[J]. Innovative Food Science & Emerging Technologies,2018,47, 204−213.
[15] LAVELLI V, POMPEI C, CASADEI M A. Quality of nectarine and peach nectars as affected by lye-peeling and storage[J]. Food Chemistry,2009,115(4):1291−1298. doi: 10.1016/j.foodchem.2009.01.047
[16] LIU Y, QU W, LIU Y, et al. Chemical, structural and functional properties of pectin from tomato pulp under different peeling methods[J]. Food Chemistry,2022,403(9):134373.
[17] 张少颖, 梁志强. 干红枣去皮方法研究[J]. 农产品加工(学刊),2013,26(2):46−47, 55 ZHANG S Y, LIANG Z Q. Peeling method research of dry red jujube[J]. Agricultural Products Processing,2013,26(2):46−47, 55.
[18] 王晓涧. 红枣饮料泡腾片的研制[D]. 杨凌:西北农林科技大学, 2016 WANG X J. Preparation of beverage effervescent tablets of red jujube[D]. Yangling:Northwest Agriculture & Forestry University, 2016.
[19] ZHOU Y, SUTAR P P, VIDYARTHI S K, et al. High-humidity hot air impingement blanching (HHAIB):An emerging technology for tomato peeling[J]. Innovative Food Science & Emerging Technologies,2022,77(4):102987.
[20] LIU Yuxing, LIAO Yaxuan, GUO Minrui, et al. Comparative elucidation of bioactive and volatile components in dry mature jujube fruit ( Ziziphus jujube Mill. ) subjected to different drying methods[J]. Food Chemistry:X,2022,14(6):100311.
[21] SUN H, ZHANG S, REN R, et al. Detection of soluble solids content in different cultivated fresh jujubes based on variable optimization and model update[J]. Foods (Basel, Switzerland),2022,11(16):1−12.
[22] YAN M, WANG Y, WATHARKAR R B, et al. Physicochemical and antioxidant activity of fruit harvested from eight jujube ( Ziziphus jujube Mill. ) cultivars at different development stages[J]. Scientific Reports , 2022,12(1):1−14. doi: 10.1038/s41598-021-99269-x
[23] JIANG H, WU F, JIANG X, et al. Antioxidative, cytoprotective and whitening activities of fragrant pear fruits at different growth stages[J]. Frontiers in Nutrition,2022,9:1020855. doi: 10.3389/fnut.2022.1020855
[24] SHI Q, HAN G, LIU Y, et al. Nutrient composition and quality traits of dried jujube fruits in seven producing areas based on metabolomics analysis[J]. Food Chemistry,2022,385:132627. doi: 10.1016/j.foodchem.2022.132627
[25] FENG Z, GAO Z, JIAO X, et al. Widely targeted metabolomic analysis of active compounds at different maturity stages of ‘Hupingzao’jujube[J]. Subtropical Plant Science,2020,88(1):103417.
[26] KOHLI D, CHAMPAWAT P S, MUDGAL V D, et al. Advances in peeling techniques for fresh produce[J]. Journal of Food Process Engineering,2021,44(10):1−18.
[27] VIDYARTHI S K, EL MASHADH M, KHIR R, et al. Viscoelastic properties of tomato peels produced from catalytic infrared and lye peeling methods[J]. Food and Bioproducts Processing,2020,119(1):337−345.
[28] KALEOGLU M, BAYINDIRLI L, BAYINDIRLI A. Lye peeling of “tombul” hazelnuts and effect of peeling on quality[J]. Food and Bioproducts Processing,2004,82:201–206. doi: 10.1205/fbio.82.3.201.44184
[29] ZHOU Y, VIDYARTHI S K, YANG X, et al. Conventional and novel peeling methods for fruits and vegetables:A review[J]. Innovative Food Science & Emerging Technologies,2022,77(2):102961.
[30] QU W, LIU Y, FENG Y, et al. Research on tomato peeling using flame-catalytic infrared radiation[J]. Lebensmittel-Wissenschaft Technologie,2022,163:113542. doi: 10.1016/j.lwt.2022.113542
[31] SHI Q, ZHANG Z, SU J, et al. Comparative analysis of pigments, phenolics, and antioxidant activity of chinese jujube ( Ziziphus jujube Mill. ) during fruit development[J]. Molecules,2018,23(8):1−14.
[32] SU Z, ZHANG C, YAN T, et al. Application of hyperspectral imaging for maturity and soluble solids content determination of strawberry with deep learning approaches[J]. Frontiers in Plant Science,2021,12(9):736334.





 下载:
下载:
 下载:
下载:



