Study on the Correlation between Microbe and Volatile Flavor Substances in Five Rounds of Brewing Process of Dongniang Sauce-flavor Baijiu
-
摘要: 堆积发酵是酱香白酒生产过程中至关重要的环节,其微生物多样性与挥发性风味物质间的关系复杂多变。为了更好地了解洞酿酱香酒在五轮次堆积发酵酒醅中微生物与风味代谢物质间的相关性,利用高通量测序技术(HTS)与顶空固相微萃取气相色谱质谱联用技术(HS-SPME/GC-MS)对五轮次堆积发酵酒醅中微生物菌群多样性和挥发性风味化合物进行检测,并计算二者之间Pearson相关系数,绘制可视化相关性网络图。结果显示:共鉴定出55种挥发性风味物质,分别为25种酯类、5种醇类、7种醛类、4种酸类、4种酚类、3种烷烃类与7种其他类,其中乳酸乙酯、苯乙醇、苯乙酸乙酯、乙酸苯乙酯为关键挥发性成分。从菌群结构上看,枝芽孢杆菌属、Kroppenstedtia、芽孢杆菌属、海洋芽孢杆菌、嗜热真菌属、接合酵母菌属、嗜热子囊菌属等为优势菌群。其中,Kroppenstedtia、红曲霉属、芽孢杆菌属与接合酵母菌属是对风味物质影响显著的微生物属。本研究旨为洞酿酱香酒品质提升提供理论依据。Abstract: Stacking fermentation is a crucial step in producing sauce-flavor Baijiu. The relationship between microbial diversity and volatile flavor substances is complex and dynamic. To better understand the correlation between microorganisms and flavor substances in Dongniang sauce-flavor Baijiu during the five-round stacking fermentation of Jiupei, high-throughput sequencing (HTS) technology and headspace solid-phase microextraction gas chromatography-mass spectrometry (HS-SPME/GC-MS) were used to identify the microbial flora diversity and volatile flavor compounds. In addition, the Pearson correlation coefficient was computed, and a visualizable correlation network diagram was drawn based on the detection results. The results identified 55 volatile flavor compounds, including 25 esters, 5 alcohols, 7 aldehydes, 4 acids, 4 phenols, 3 alkanes, and 7 others. The main volatile components were ethyl lactate, phenylethyl alcohol, ethyl phenylacetate, and phenethyl acetate. The dominant microorganism genera in the floral structure were Virgibacillus, Kroppenstedtia, Bacillus, Oceanobaciillus, Thermomyces, Zygosaccharomyces, and Thermoascus. Kroppenstedtia, Monascus, Bacillus, and Zygosaccharomyces significantly affected flavor substances among the flora. Overall, the purpose and significance of this study are to provide a theoretical foundation for enhancing the quality of Dongniang sauce-flavor Baijiu.
-
Keywords:
- Dongniang sauce-flavor Baijiu /
- five-round /
- microbial diversity /
- flavor compounds /
- correlation
-
白酒是一种起源于中国的蒸馏酒,以其古老的酿造工艺和独特的风味而闻名,是世界上七大著名蒸馏酒之一[1],酱香型白酒是最常见的四种基本风味类型之一[2]。由于酿造原料、酒曲种类、环境和制作工艺的不同,影响着酿酒微生物菌群的形成[3]。酱香型白酒酿造的地域要求严格、生产需求大[4],而由贵州喀斯特地貌形成的天然古溶洞—龟仙洞,溶洞常年恒温、恒湿,洞口通风条件良好,为酿酒藏酒所需的微生物提供繁衍与生产的温床,是经基尼斯认证的目前全球最大的天然溶洞白酒酿藏基地[5]。洞酿酱香酒与传统酱香型白酒一致经过“12987”过程完成一个周期,“12987”即为一年一个生产周期,需经过两次投料、九次蒸煮、八次发酵和七次取酒过程[2],但洞酿酒整个生产过程均在天然溶洞内进行。洞酿酒研究中张超等[6]通过平板计数法探索不同季节浓香型白酒微生物菌群在整个发酵周期的动态变化情况,发现3个季节微生物消长变化无明显差异,由此说明洞酿车间能够为有益微生物提供适宜的生长环境,维持正常代谢。而目前对于天然溶洞酿造酱香型白酒的研究鲜见报道。
发酵分为堆积发酵和窖池发酵。堆积发酵是指原料或酒醅经过高温蒸煮糊化后,加入高温大曲收拢成椎体,在地面堆积发酵2~7 d[7]。堆积发酵富集到了大量的微生物和产生大量风味前体物质,对酱香白酒品质至关重要[8]。因此评价堆积发酵过程中微生物菌群多样性对于其在洞酿酱香白酒生产中的功能和价值以及提高工艺效率具有重要意义。Dai等[9]对利用高通量测序对三四五轮次酱香型白酒的微生物多样性进行研究,并且结合相应的理化特性与感官品评结果发现,三四五轮次白酒质量最佳。张春林等[10]采用高通量测序技术对茅台镇酱香型白酒二轮次堆积发酵酒醅样品中微生物结构多样性及其风味之间的关系进行研究,结果发现芽孢杆菌属、裸胞壳属、海洋芽孢杆菌属等是酱香型白酒堆积过程中的主要微生物,对酱香型白酒的风格形成有重大贡献。目前,已经有了许多堆积发酵过程中微生物对代谢物影响的研究,但大多都是在车间内进行,而针对洞内发酵的研究较少。由于五轮次作为酱香型白酒中酒质最好的轮次之一,因此本研究主要集中在洞酿酱香酒五轮次堆积发酵过程,通过系统分析五轮次酒醅微生物区系的动态变化和风味物质及其相关性,探讨风味物质形成机制。旨在为推进洞酿酱香酒的稳定发展提供基础理论和科学依据。
1. 材料与方法
1.1 材料与仪器
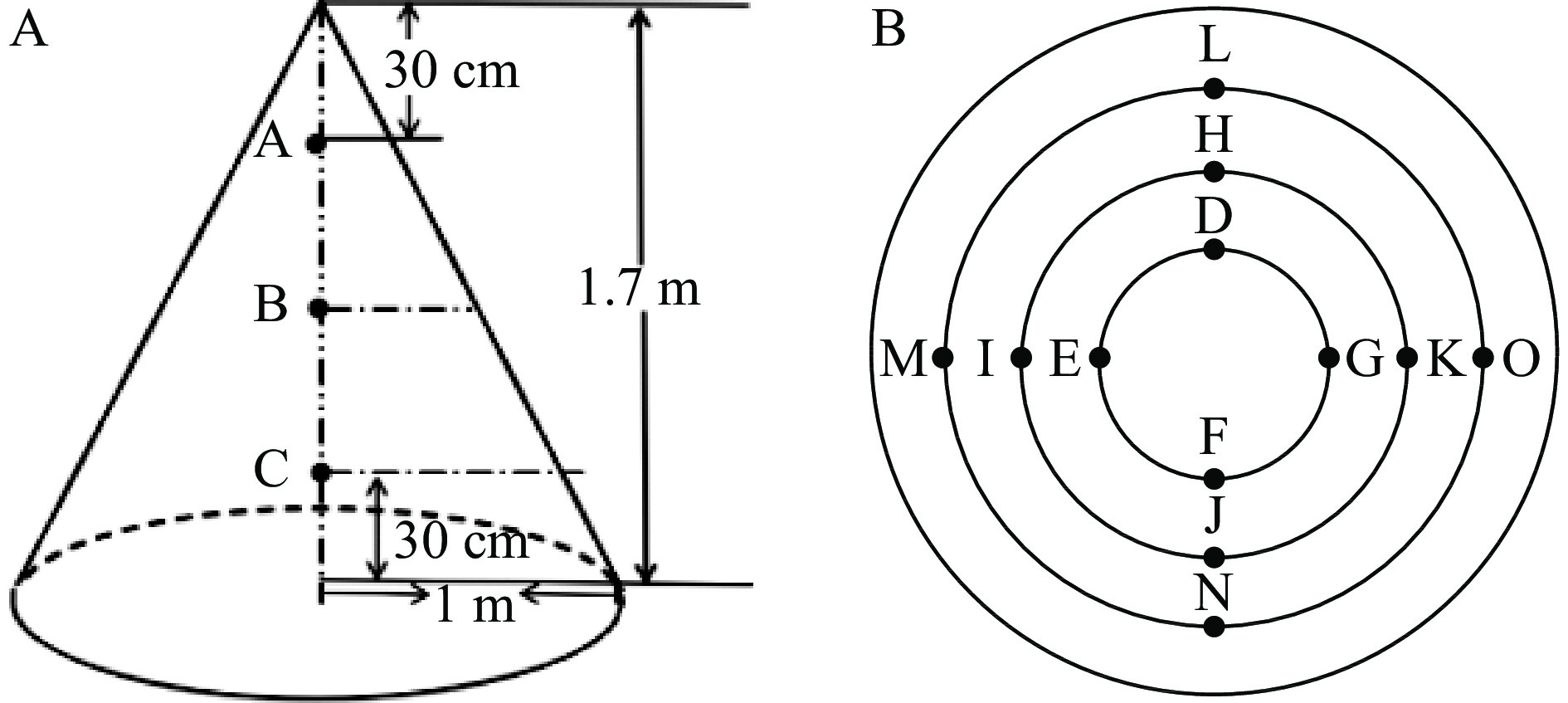
样品取自某洞内第五轮次堆积发酵酒醅,洞内温度25 ℃,相对湿度80%~90%,堆子高1.7 m、长2 m。五轮次堆积发酵三天后下窖,参考任婷婷等[11]洞口一轮次的采样方法与堆子温度变化情况(0~24 h升温速率最快,48 h到达顶峰后趋于稳定,72 h后堆积发酵结束),将取样时间选择为0、24、48、72 h,在每个时间节点分别采集酒醅上、中、下三个层次样品,每个层面分别采集中间及四周边缘位置(如图1)混合后作为一个层面的酒醅样,随后将3个层面的酒醅样混合均匀作为一个样,混合样立即装入无菌密封袋,每个样品取三次平行,置于−80 ℃下保存用于高通量测序及风味分析;脱氧核糖核酸试剂盒(deoxyribonucleic acid,DNA)抽提试剂盒 美国MP Biomedicals公司;2%琼脂糖凝胶 西班牙Biowest公司;FastPfu聚合酶 北京全式金生物技术股份有限公司;AxyPrep DNA凝胶回收试剂盒 美国Axygen公司;正反引物 深圳市英俊生物技术有限公司;缓冲液:Phusion High-Fidelity PCR Master Mix with GC Buffer 美国New England Biolabs公司;环己酮(>99.5%,GC)、正构烷烃(C7~C40) 上海安谱实验科技股份有限公司。
HS-SPME/GC-MS(Trace 1300-TSQ 8000) 美国赛默飞世尔科技公司;NanoDrop 2000超微量分光光度计 美国Thermo Fisher Scientific公司;DYY-6C电泳仪 北京市六一仪器厂;ABI GeneAmp® 9700型PCR仪 美国ABI公司;Illumina MiseqMISEQ测序仪 美国Illumina公司。
1.2 实验方法
1.2.1 总DNA提取与PCR扩增
根据FastDNA SPIN Kit for Soil 试剂盒(MP Biomedicals,USA)对酒醅样品进行总DNA提取。对细菌V3~V4可变区用基因上游引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')与下游引物806R(5'-GGACTACHVGGGTWTCTAAT-3')以及真菌ITS1区域引物ITS1(5'-CTTGGTCATTTAGAGGAAGTAA-3')与ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')进行扩增。扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,循环35次。PCR扩增总体积为20 µL,包括Forward Primer (5 µmol/L) 0.8 µL,Reverse Primer(5 µmol/L) 0.8 µL,2.5 mmol/L dNTPs 2 µL,5×FastPfu Buffer 2 µL,FastPfu Polymerase 0.2 µL,BSA 0.2 µL和样本Template DNA 10 ng的反应体系。
1.2.2 文库构建和Illumina Miseq测序
使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City,CA,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluor™-ST(Promega,USA)进行检测定量。根据Illumina MiSeq 平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库。利用Illumina公司的Miseq PE300平台进行测序。
1.2.3 Illumina Miseq数据统计分析
用QIIME tools import 插件,将原始序列fastq文件,导入为可进行QIIME2后续处理的文件格式。然后运用QIIME2 dada2插件进行质控、修剪、去噪、拼接以及去除嵌合体后,得到了最终的特征序列表格接着,运用QIIME2 feature-classifier插件将ASV的代表序列比对到预先训练好的13_8版本99%相似度的GREENGENES与Greengenes Database 13_8版本数据库(根据338F/806R引物对将数据库修剪到V3~V4的区域),得到了物种的分类信息表[12]。基于细菌和真菌群落的组成,在门和属两个水平上进行样品的多样性分析。
1.2.4 GC-MS测定挥发性风味物质
称取1 g已磨碎混匀的酒醅样品放入20 mL的顶空瓶内,加入2 g氯化钠和7 mL的纯净水,再加入10 μL环己酮(20 μg/mL)作为内标物,并用PTFE隔膜紧密覆盖。使用已老化的50/30 μm DVB/Carboxen/PDMS萃取头在40 ℃下振摇并提取180 min。提取完成后,立即将SPEM纤维插入进样端口,并在230 ℃下解析分离5 min[13]。
色谱条件:毛细管柱为DB-WAX(30 m×0.25 mm,0.25 μm),氦气(99.999%)为载气,流速为1.0 mL/min,无分流模式。升温程序:在40 ℃下保持5 min,然后以5 ℃/min的速率上升到150 ℃ ,保持在150 ℃下3 min,最后以5 ℃/min的速率升至240 ℃,保持5 min。
质谱条件:电子轰击离子源(EI),电子能量为70 eV,传输线温度为280 ℃,离子源温度为230 ℃,在50~450 amu的范围内采集数据,速率为1 scan/s[13]。
1.2.5 挥发性风味物质的数据分析
定性分析:参考王涵钰[13]的分析方法,将实验结果与数据库(NIST)进行比较,筛选出匹配度大于800的挥发性化合物。在相同条件下运行C7~C40的正构烷烃混合标准液以确定化合物的保留系数(RI),计算公式如下:
RI=100n+100×Rt(x)−Rt(n)Rt(n+1)−Rt(n) 式中:Rt(x)、Rt(n)、Rt(n+1)分别为待测的挥发性成分、含n个碳原子正构烷烃和含n+1个碳原子的正构烷烃保留时间。
定量分析:采用内标法对挥发性成分进行相对定量分析,计算公式如下:
Ci=Cis×AiAis 式中:Ci为任一组分的质量浓度(μg·kg−1);Cis为内标的质量浓度(μg·kg−1);Ai任一组分的色谱峰面积;Ais为内标的色谱峰面积。
1.3 数据处理
所有统计分析均采用SPSS(26.0)进行分析,采用单因素方差分析(ANOVA)确定差异显著性(P<0.05),数据用平均值±标准差(mean±SD)来表示。使用TBtools和SPSS软件绘制热图,SIMCA软件进行PCA和OPLS-DA模型分析,Cytoscape软件进行可视化网络分析。数据绘图使用Origin 2019b,相关性分析采用R软件进行绘制分析。
2. 结果与分析
2.1 Alaph多样性分析
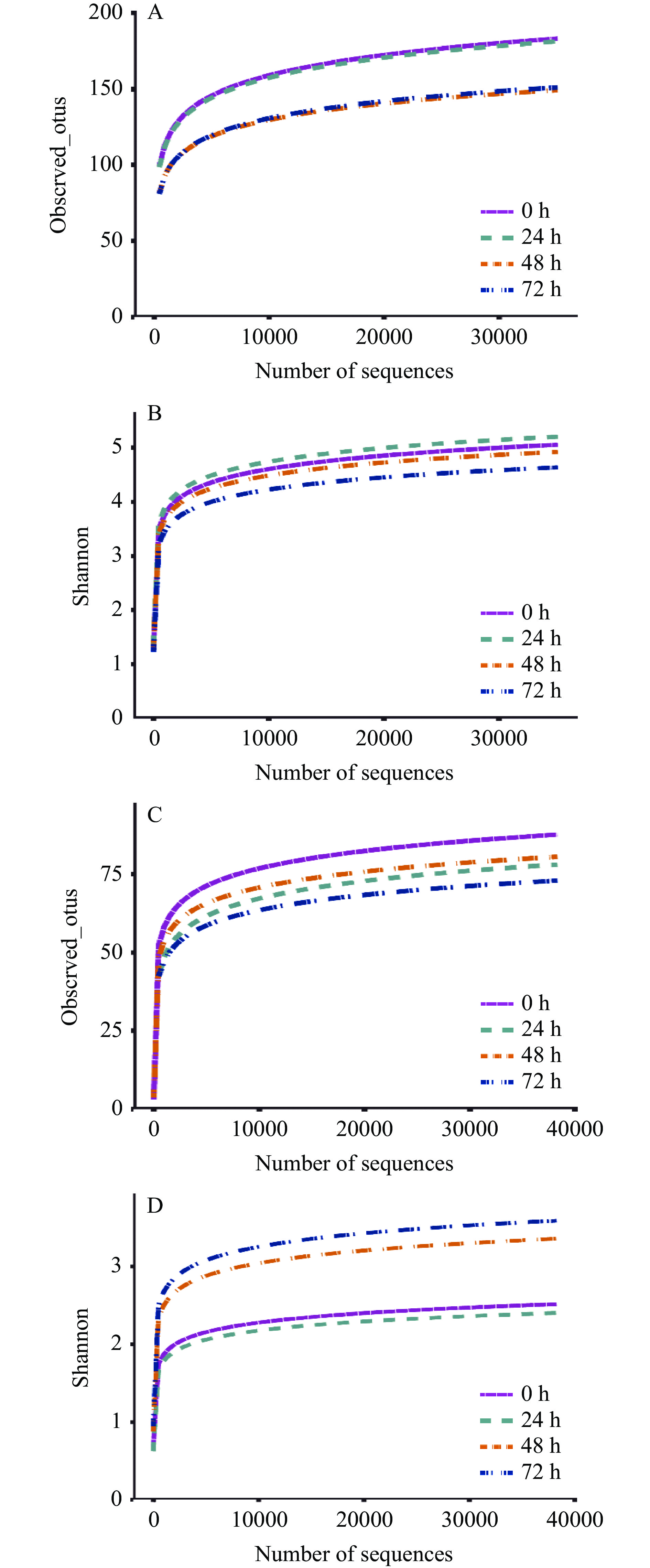
Alaph多样性通常用于分析样品中微生物群落多样性,单个样品Alaph多样性分析可以反映样品内微生物群落物种丰度及物种多样性[14]。由图2所示,细菌与真菌的稀释曲线与香农曲线逐渐趋于平坦,则说明本研究的测序数据量足够大,可以反映样品中绝大多数的微生物信息。此外由表1可知,在堆积发酵过程中,细菌的Chao1指数在0~48 h降低,72 h时略有上升,细菌的Simpson指数变化不大;真菌的Chao1指数逐渐降低,Simpson指数与Shannon指数则逐渐增加,说明在洞酿环境下微生物之间竞争激烈,与车间环境下酱香酒细菌与真菌多样性规律变化不同[6]。总体来说,细菌菌群的Chao1指数、Simpson和Shannon指数明显高于真菌菌群,则说明细菌的物种丰富度与多样性较高。
表 1 细菌和真菌在不同发酵时间的丰富度和多样性Table 1. Richness and diversity of bacteria and fungi at different fermentation timesSample ID Chao1 Simpson Shannon 真菌 细菌 真菌 细菌 真菌 细菌 0 h 85±12.8 182±21.7 0.5±0.1 0.9±0 2.4±0.5 4.8±0.2 24 h 78±3.7 179.8±5.5 0.6±0 0.9±0 2.3±0.1 4.9±0 48 h 77.3±9 147.7±3.9 0.8±0 0.9±0 3.2±0.4 4.6±0.1 72 h 70.7±2.6 150.8±20.2 0.8±0 0.9±0 3.4±0.2 4.4±0.3 2.2 样品中微生物菌落结构分析
2.2.1 基于门水平和属水平分析样品中细菌群落结构
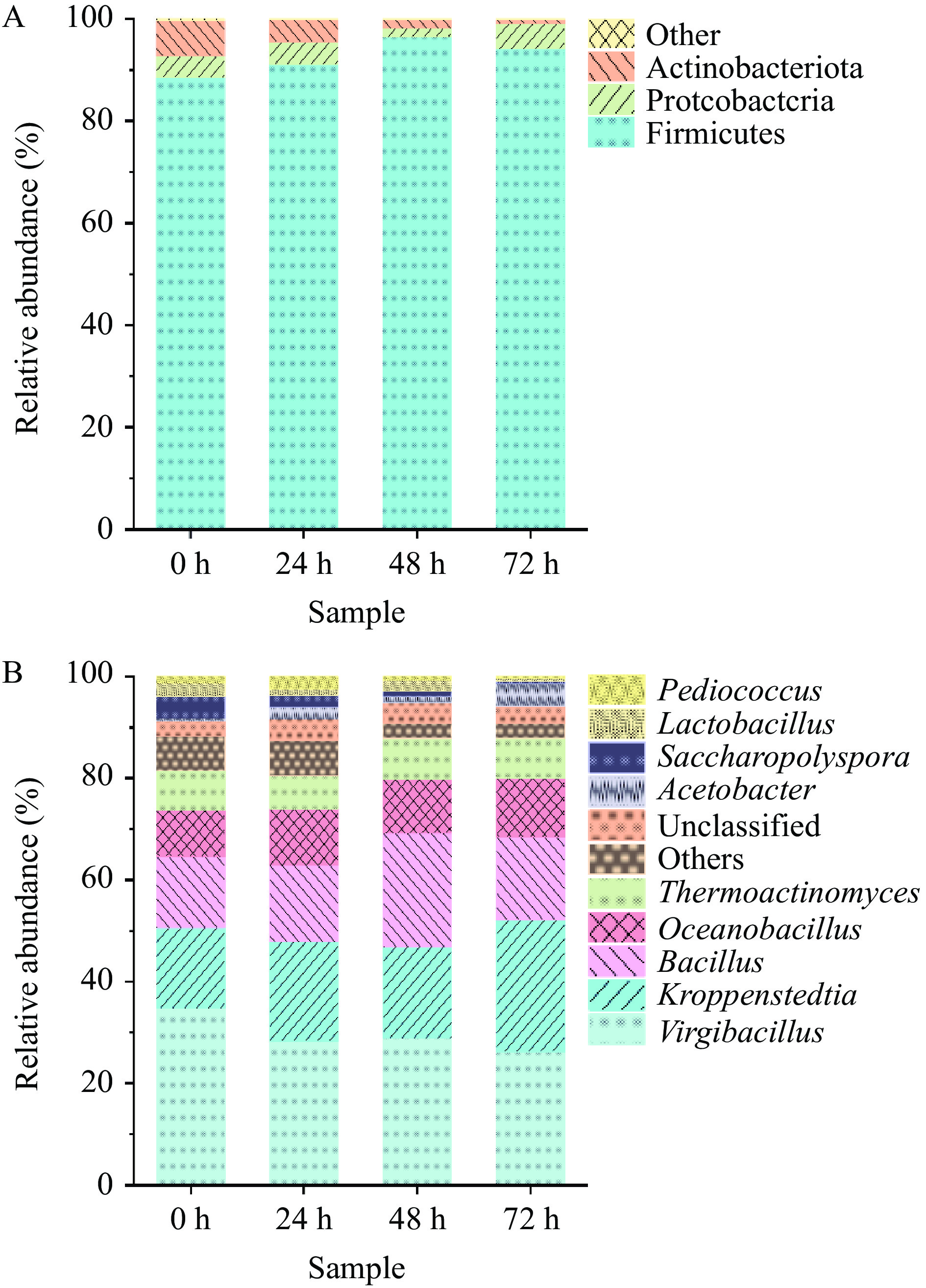
如图3A所示,在门水平上,4个样品中共检测出3个优势细菌门(平均相对丰度≥1.00%),分别为厚壁菌门(Firmicutes,95.2%)、变形菌门(Proteobacteria,3.80%)和放线菌门(Actinobacteriota,3.52%),这与Wang等[15]对车间内生产的酱香型白酒第五轮次优势细菌门的研究结果一致。由于厚壁菌门主要由芽孢杆菌纲(Bacilli)和梭菌纲(Clostridia)等微生物组成[16],环境适应能力强,可以在相对极端的条件保持生长代谢,因此厚壁菌门具有绝对优势。
如图3B所示,在属水平上,4个样品中共检测出9个优势细菌属(相对丰度≥1.00%),分别为枝芽孢杆菌属(Virgibacillus,29.54%)、Kroppenstedtia(19.84%)、芽孢杆菌属(Bacillus,16.95%)、海洋芽孢杆菌(Oceanobaciillus,10.62%)、高温放线杆菌属(Themnactionomyces,7.56%)、醋酸杆菌属(Acetobacter,2.15%)、糖多孢菌属(Saccharopplyspora,2.07%)、乳酸杆菌属(Lactobacillus,1.64%)、片球菌属(Pediococcus,1.11%)。在堆积发酵整个阶段(0~72 h),枝芽孢杆菌属、Kroppenstedtia与海洋芽孢杆菌属为主导优势菌。在车间酿造酱香白酒中,主要优势细菌属为高温放线菌属、芽孢杆菌属和海洋芽孢杆菌属[10],说明不同的酿造环境对酱香型白酒微生物区系有一定的影响。在发酵初期(0 h)枝芽孢杆菌属相对丰度最高为33.72%,其原因可能是发酵前期可能存在一些有害菌,而枝芽孢杆菌可以抑制有害菌和病原菌等繁殖进一步筛选有益菌群,且具有较强分泌蛋白酶和其他酶的能力,使大分子物质被分解形成十二酸乙酯、3-甲基-1-丁醇等风味化合物[17],以增加白酒风味。在发酵后期(72 h)Kroppenstedtia与枝芽孢杆菌属相对丰度较高,Kroppenstedtia是高温放线菌科的主要属,能在大曲高温高湿的环境下生长旺盛[18]。此外,在本研究0~72 h期间里芽孢杆菌属相对丰度均较高(13.56%~22.40%),聂士昊等[19]的研究发现加强芽孢杆菌能够提升酱香型白酒的微生物群落分布丰度和促进微生物生长。
2.2.2 基于门水平和属水平分析样品中真菌群落结构
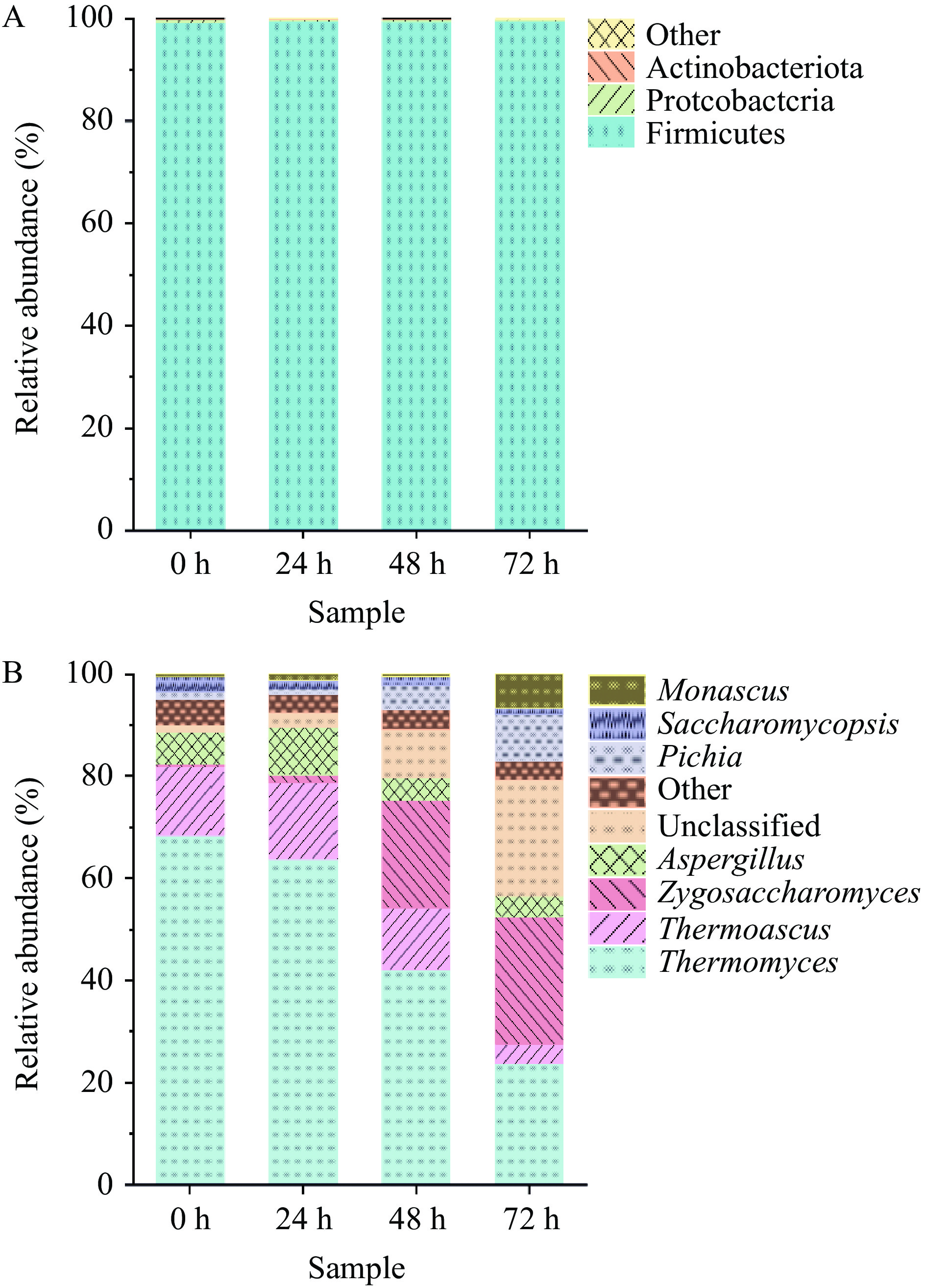
如图4A所示,在门水平上,4个样品共检测出1个优势真菌门(相对丰度≥1.00%)为子囊菌门(Ascomycota,99.48%),这与Son等[20]通过高通量测序揭示传统固体发酵酱香型白酒中核心微生物群落中优势真菌门的研究结果一致。
如图4B所示,在属水平上共检测出7个优势真菌属(相对丰度≥1.00%),分别为嗜热真菌属(Thermomyces,49.52%)、接合酵母菌属(Zygosaccharomyces,11.98%)、嗜热子囊菌属(Thermoascus,11.12%)、曲霉菌属(Aspergillus,6.05%)、毕赤酵母属(Pichia,4.04%)、红曲霉属(Monasaus,2.11%)、复膜孢酵母属(Saccharomycopsis,1.95%)。在堆积发酵初期(0~24 h)主要优势真菌属为嗜热真菌属与嗜热子囊菌属,这与Wang等[7]对贵州地区不同堆积发酵时期酱香型白酒微生物多样性研究结果相似,这种情况与酱香型酒白酒的生产工艺有关,溶洞酿造与车间酿造一致使用高温大曲,该类大曲容易分离耐高温真菌属[21]。但洞酿酱香酒堆积发酵72 h后嗜热真菌属、嗜热子囊菌属相对丰度降低至23.74%、3.85%,而毕赤酵母属、接合酵母属呈上升趋势,到72 h时相对丰度升至9.19%、24.86%,成为堆积发酵后期的主导优势菌。研究表明,毕赤酵母属的活性影响乳酸乙酯的代谢[22],在发酵后期乳酸乙酯也成为主要挥发性风味物质。接合酵母属成为优势真菌属后对发酵后期淀粉糖化提供很大的贡献,增加洞酿酒香气,使酒体更加醇厚绵柔[23]。与洞内酿造不同,传统车间第五轮次发酵后期的优势真菌属主要是Issatchenkia属,有研究表明,温度、湿度与酸度会影响发酵食品微生物的组成[24],因此推测可能是因为溶洞内湿度及氧气等差异造成洞内微生物群落结构与传统厂房有较大差异,后续将对洞内空气微生物进行取样并监测洞内湿度、氧气浓度等参数,进一步分析洞内酿造对酱香白酒微生物群落结构及品质的影响。
2.3 洞酿酱香酒五轮次堆积发酵过程中挥发性风味化合物的变化
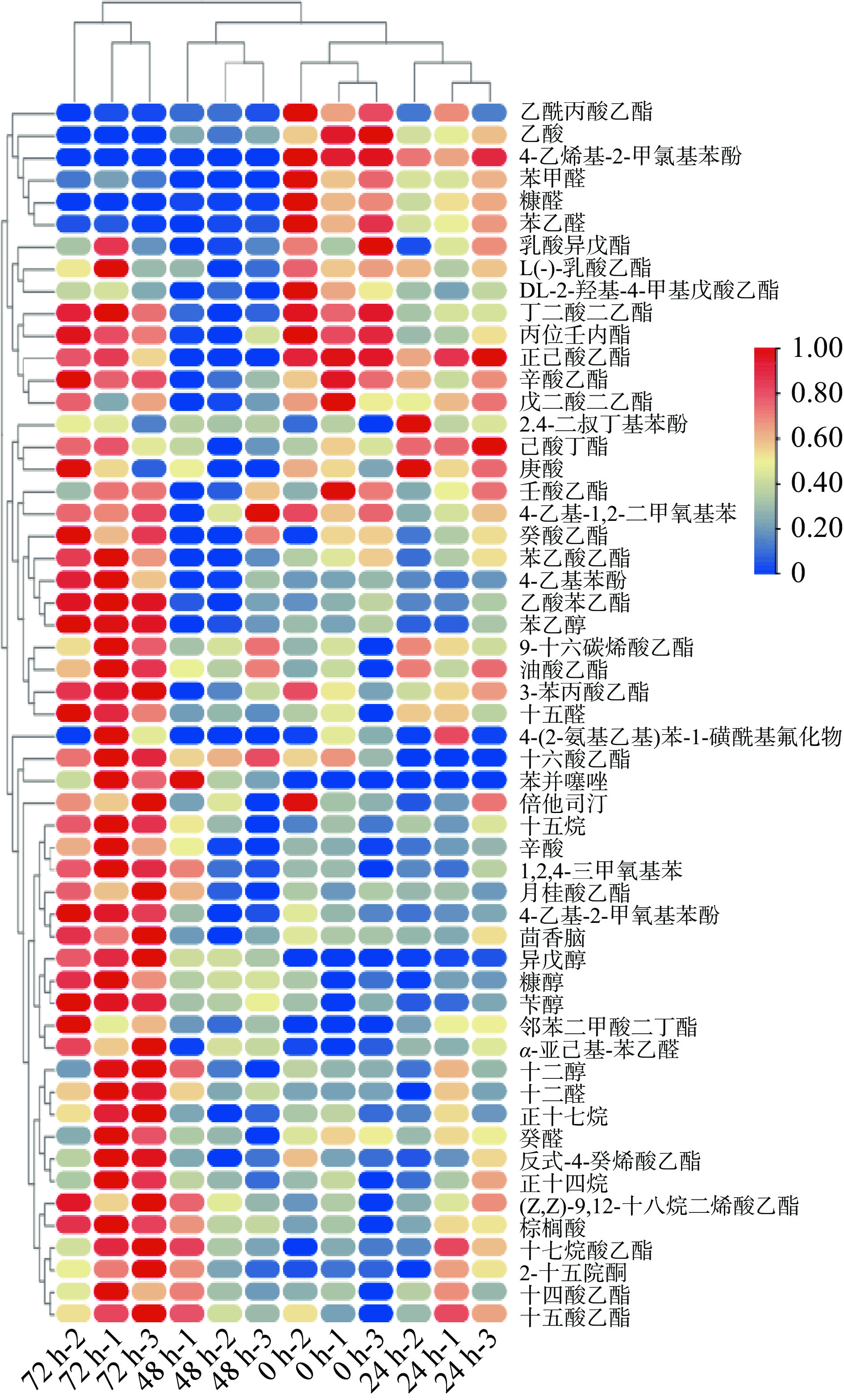
洞酿酱香酒在五轮次堆积发酵过程中产生各种挥发性风味物质,其中醇类、醛类、酯类、酸类等是赋予洞酿酱香酒风味的关键物质。如下表2与图5所示,采用顶空固相微萃取气相色谱质谱联用技术对堆积发酵过程中产生的挥发性化合物进行检测,根据匹配值(SI)>800共鉴定出55种挥发性化合物,分为6类,分别为25种酯类、5种醇类、7种醛类、4种酸类、4种酚类、3种烷烃类,其余7种风味物质归为一类。
表 2 五轮次洞酿酱香酒发酵过程中挥发性风味物质含量的变化Table 2. Dynamic changes of volatile flavor compounds in five rounds of Dongniang sauce-flavor Baijiu序号 保留时间 化合物名称 含量(μg·kg−1) 0 h 24 h 48 h 72 h 酯类 (24种) (25种) (24种) (25种) Z1 7.19 乳酸乙酯 112.6±6.52a 102.13±9.65b 75.77±10.2b 108.35±25.1a Z2 14.12 正己酸乙酯 30.73±0.99a 27.09±5.97a − 23.65±5.13a Z3 16.05 DL-2-羟基-4-甲基戊酸乙酯 18.23±2.81a 13.74±0.9b 10.71±0.6c 14.27±1.04b Z4 16.17 乙酰丙酸乙酯 1.62±0.35a 0.63±0.63b 0.18±0.06b 0.06±0.05b Z5 16.41 乳酸异戊酯 11.04±2.15a 9.18±2.09ab 7.07±0.52b 9.6±2.27ab Z6 19.92 丁二酸二乙酯 23.03±1.09a 18.23±0.6b 14.95±0.53c 23±1.32a Z7 20.28 己酸丁酯 1.38±0.17bc 1.99±0.23a 0.97±0.31c 1.73±0.28ab Z8 20.45 辛酸乙酯 6.92±0.69a 6.25±0.52a 4.7±0.54b 7.27±0.45a Z9 21.78 苯乙酸乙酯 70.84±3.91b 66.07±7.8b 56.11±3.64bc 84.67±6.19a Z10 22.13 乙酸苯乙酯 46.86±3.49b 44.85±3.71b 40.63±3.94b 70.77±0.87a Z11 22.83 戊二酸二乙酯 1.21±0.15a 1.14±0.07a 0.83±0.07b 1.11±0.16a Z12 23.29 壬酸乙酯 1.35±0.28a 1.22±0.18a 1.01±0.24a 1.29±0.19a Z13 24.73 3-苯丙酸乙酯 8.7±1.31b 8.8±0.55b 7.22±0.9b 10.57±0.3a Z14 25.03 丙位壬内酯 10.33±0.46a 7.78±0.61b 6.6±1.19b 9.95±0.63a Z15 25.55 反式-4-癸烯酸乙酯 4.36±0.99ab 4.19±1b 3.63±0.48b 6.21±1.4a Z16 25.97 癸酸乙酯 7.13±1.26a 6.98±0.82a 6.57±1.62a 8.9±0.81a Z17 32.04 月桂酸乙酯 8.1±0.43b 7.97±0.3b 7.78±1.68b 10.59±1.06a Z18 37.61 十四酸乙酯 11.93±2.85b 15.96±3.41ab 15.35±4.33ab 20±4.53a Z19 39.94 十五酸乙酯 2.93±1.33b 4.61±1.34ab 4.22±1.31ab 5.63±1.2a Z20 41.19 邻苯二甲酸二丁酯 − 0.06±0.02ab 0.03±0.02bc 0.11±0.04a Z21 41.62 9-十六碳烯酸乙酯 10.72±4.78b 17.58±3.02ab 16.34±4.64ab 22.39±5.06a Z22 42.11 十六酸乙酯 370.21±140.39b 0.99±0.24c 482.1±96.42ab 643.39±99.22a Z23 44.07 十七烷酸乙酯 0.28±0.09b 0.57±0.24ab 0.53±0.23ab 0.75±0.22a Z24 45.32 (Z,Z)-9,12-十八烷二烯酸乙酯 80.07±35.86b 138.45±43.43ab 146.9±48.93ab 214.54±49.79a Z25 45.45 油酸乙酯 89.97±42.49b 172.38±40.78a 152.8±36.76ab 214.53±43.1a 醇类 (4种) (5种) (5种) (5种) C1 4.71 异戊醇 − 0.23±0.12c 2.57±0.32b 5.86±0.72a C2 8.74 糠醇 15.96±3.6b 15.81±2.4b 21.25±0.86b 30.76±3.42a C3 15.26 苄醇 12.58±1.54bc 12.07±0.85c 14.41±0.82b 19.7±0.44a C4 17.9 苯乙醇 509.77±19.67b 472.18±42.39bc 448.68±29.5c 708.55±7.03a C5 28.08 十二醇 2.08±0.33a 2.26±1.37a 2.01±2.24a 4.43±2.53a 醛类 (7种) (7种) (7种) (6种) Q1 7.89 糠醛 52.89±14.37a 36.13±7.63b 1.82±0.45c − Q2 12.73 苯甲醛 14.49±2.05a 11.74±0.98b 6.89±0c 8.43±0.54c Q3 15.6 苯乙醛 24.85±3.1a 20.18±1.9b 12.38±0.46c 12.58±0.42c Q4 20.74 癸醛 3.74±0.22ab 3.51±0.54ab 2.57±0.73b 4.45±1.53a Q5 22.53 α-亚乙基-苯乙醛 2.74±0.08b 3.36±0.22b 3.24±0.48b 4.32±0.45a Q6 26.38 十二醛 0.69±0.01b 0.75±0.4b 0.93±0.22b 1.52±0.32a Q7 35.59 十五醛 0.54±0.23b 0.76±0.11b 0.49±0.06b 1.1±0.14a 酸类 (4种) (4种) (4种) (3种) S1 5.79 乙酸 3.04±0.85a 1.81±0.3b 0.76±0.25c − S2 16.8 庚酸 3.97±0.54a 4.75±0.6a 3.18±0.75a 4.16±1.19a S3 19.75 辛酸 8.32±1.28b 8.43±0.71b 8.19±2.4b 13.18±1.82a S4 41.37 棕榈酸 5.19±2.47b 8.86±2.49b 9.53±2.42b 15.67±1.3a 酚类 (4种) (4种) (3种) (3种) F1 19.45 4-乙基苯酚 2.36±0.13b 2.11±0.12b 1.98±0.52b 4.1±0.66a F2 22.66 4-乙基-2-甲氧基苯酚 11.62±1.52b 10.41±0.59b 9.82±1.59b 17.74±0.79a F3 23.68 4-乙烯基-2-甲氧基苯酚 1.71±0.06a 1.34±0.23b − − F4 29.02 2,4-二叔丁基苯酚 12.32±3.01b 19.58±5.42a 15.44±0.33ab 15.65±3.03ab 烷类 (3种) (3种) (3种) (3种) W1 26.14 正十四烷 3.66±1.15a 4.4±1.51a 3.81±0.8a 6.48±1.96a W2 28.89 十五烷 3.15±0.42b 3.71±0.53b 3.46±1.07b 6.02±0.46a W3 35.21 正十七烷 1.66±0.32b 1.71±0.46b 1.31±0.26b 2.83±0.54a 其他 (6种) (6种) (7种) (7种) T1 10.07 4-(2-氨基乙基)苯-1-磺酰基氟化物 1.95±1.74a 2.18±3.55a 0.02±0.01a 3.83±3.83a T2 13.37 倍他司汀 2.93±0.58a 2.65±0.51a 2.5±0.33a 3.26±0.32a T3 21.29 苯并噻唑 − − 2.3±1.8a 3.18±1.31a T4 23.06 茴香脑 3.65±0.35b 3.56±0.75b 2.57±0.64b 6±0.69a T5 23.93 4-乙基-1,2-二甲氧基苯 1.7±0.09a 1.48±0.12a 1.52±0.37a 1.73±0.05a T6 25.25 1,2,4-三甲氧基苯 1.9±0.29b 1.93±0.24b 2.06±0.63b 3.11±0.19a T7 35.12 2-十五烷酮 0.73±0.03b 1±0.31ab 0.95±0.28ab 1.31±0.23a 注:同一行的不同字母表示具有显著差异(P<0.05),“−”表示未检出该物质。 酯类物质是酱香型白酒中重要的挥发性香味物质[25]。在检测的25种酯类化合物中,含量较高的有乳酸乙酯、苯乙酸乙酯、十六酸乙酯(棕榈酸乙酯)、油酸乙酯、乙酸苯乙酯和(Z,Z)-9,12-十八烷二烯酸乙酯。其中油酸乙酯(89.97~214.53 μg·kg−1)属于高级脂肪酸乙酯,孙优兰等[26]对清酱型白酒风味特征研究中发现,系列酒中高级脂肪酸乙酯含量越高其酱香风味越明显,同时能保持酒的酱香和空杯留香的风格特征[27]。从优势细菌属看,在整个堆积发酵期间存在片球菌属与乳酸杆菌属,片球菌属与乳酸杆菌属能与乙醇发生酯化反应生成乳酸乙酯,因此乳酸乙酯在发酵期间含量较高[28]。苯乙酸乙酯(70.84~84.67 μg·kg−1),乙酸苯乙酯(46.86~70.77 μg·kg−1),二者都属于芳香族化合物,芳香族化合物香味突出且具有阈值低、沸点高、难挥发的特点,这是使酒体优雅、醇厚等风味形成的关键[29]。
醇类化合物是酱香型白酒中的重要风味物质,也是形成酒体爽口、醇厚、助香的主要成分。在洞酿酱香酒五轮次堆积发酵过程中共检测出5种醇类,分别是异戊醇、糠醇、苄醇、苯乙醇、十二醇。从优势真菌属看,接合酵母属与毕赤酵母属随着发酵的进行,相对丰度逐渐升高,研究表明苯乙醇是由酵母菌在发酵过程中通过转化发酵液中的苯丙氨酸产生的,或者从发酵初始开始产生[30]。因此在本研究中苯乙醇含量随着发酵时间的进行从509.77 μg·kg−1上升708.55 μg·kg−1,同时其具有柔和、愉快而持久玫瑰花香。异戊醇呈杂醇油香、糠醇呈焦糖甜香、苄醇呈苦杏仁气味[31-32]。十二醇作为一种高级醇,一方面衬托酯香,另一方面可使酒体口感丰满柔和、醇厚,给人愉快舒适的感觉[33]。这些醇类在酿造过程中含量逐渐升高,能够增加酒体的风味和口感[34]。
醛类物质也是构成酱香型白酒的重要风味物质,主要来源于脂肪氧化与氨基酸降解[35]。在堆积发酵过程中共检测出7种醛类。分别为:糠醛、苯甲醛、苯乙醛、癸醛、α-亚乙基-苯乙醛、十二醛、十五醛。在0 h时糠醛含量最高52.89 μg·kg−1,其次是苯乙醛;但随着发酵进行到72 h时,糠醛含量降至0,原因可能是随着发酵的进行,其作为反应的前体物质转化为酸类或醇类[13]。发酵后期苯乙醛含量相对其他醛类含量最高,但对比0 h阶段含量降至一半,可能是随着发酵的进行通过苯丙氨酸经Strecker降解产生醛后还原生成苯乙醇[36]。
另外还检测到4种酸类物质和4种酚类物质。酸类物质是形成酯类化合物的前体物质,产生的酯类物质赋予酱香型白酒特殊的香气。其中,乙酸、辛酸分别为乙酸乙酯、辛酸乙酯的前体。酚类物质中4-乙烯基-2-甲氧基苯酚只存在于发酵前期,可能是由于毕赤酵母属能够利用还原酶将酒醅中4-乙烯基-2-甲氧基苯酚还原为4-乙基愈创木酚[37]。
2.4 微生物与挥发性风味代谢物之间的相关性分析
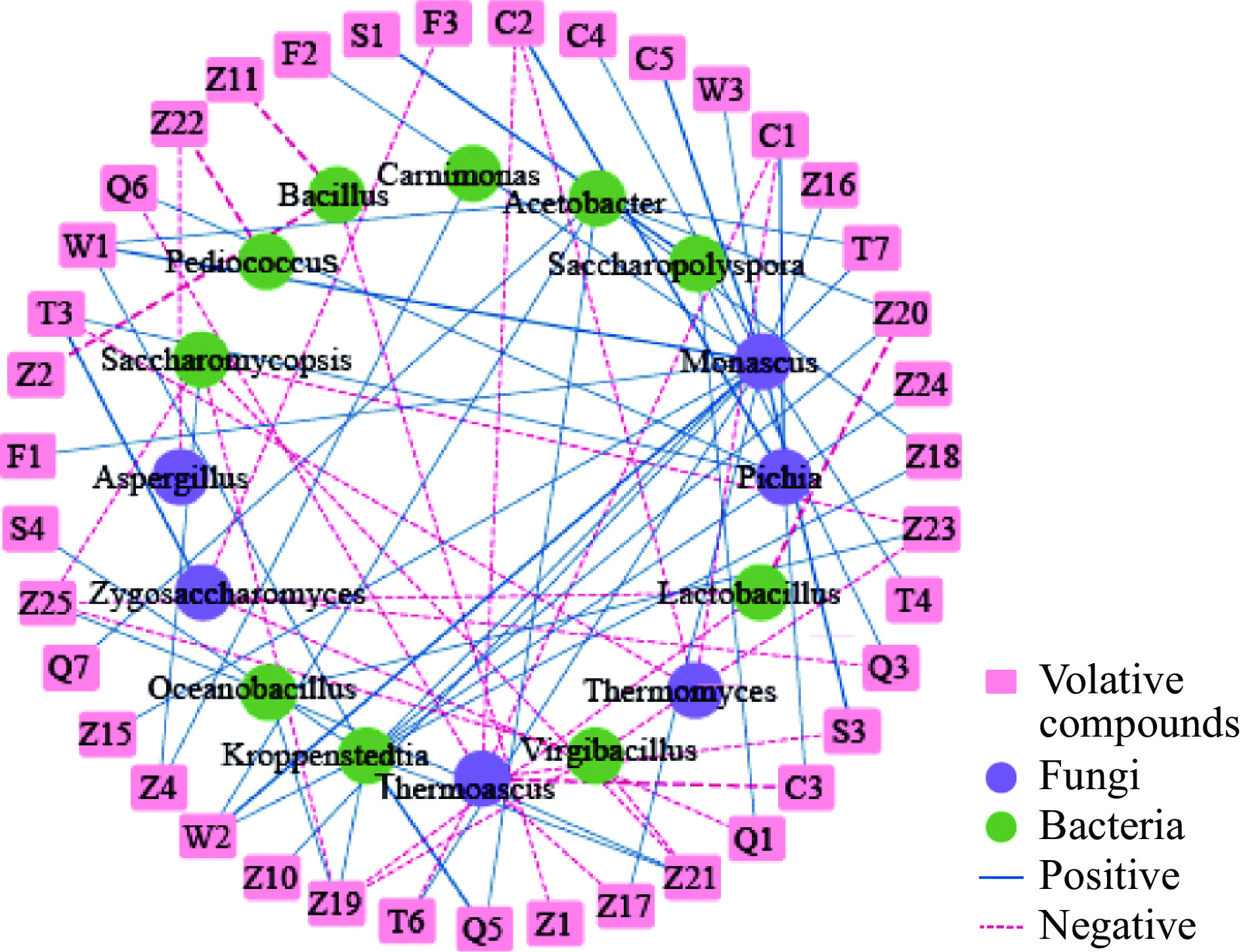
为了研究洞酿酱香酒五轮次堆积发酵过程中微生物群与挥发性风味物质之间的关系,选取相对丰度大于1%的优势微生物属与55种挥发性风味物质进行相关性分析。基于Pearson相关性分析结果显示出共有935个两两之间的相关性,通过相关系数|r|>0.7和P<0.05两个条件同时满足筛选出75个两两强相关,通过Ctyoscape对其进行可视化。如图6所示,其中共有47个正相关(蓝色实线)和28个负相关(粉色虚线)。
![]() 图 6 洞酿酱香酒五轮次堆积发酵过程中微生物菌群(VIP(pred)>1)与挥发性物质之间的相关性分析注:Pearson相关系数(|r|>0.7)表明相关性较强,差异有统计学意义(P<0.05)。粉色长方形代表挥发性风味物质,图中风味物质的序号同表2,紫色、绿色圆圈分别代表真菌和细菌。蓝色实线和红色虚线分别代表正相关(r>0.7,P<0.05)和负相关(r<−0.7,P<0.05)。Figure 6. Correlation analysis between miccroorganisms (VIP(pred)>1) and volative compounds with significant difference during the fermentation of Dongniang sauce-flavor Baijiu
图 6 洞酿酱香酒五轮次堆积发酵过程中微生物菌群(VIP(pred)>1)与挥发性物质之间的相关性分析注:Pearson相关系数(|r|>0.7)表明相关性较强,差异有统计学意义(P<0.05)。粉色长方形代表挥发性风味物质,图中风味物质的序号同表2,紫色、绿色圆圈分别代表真菌和细菌。蓝色实线和红色虚线分别代表正相关(r>0.7,P<0.05)和负相关(r<−0.7,P<0.05)。Figure 6. Correlation analysis between miccroorganisms (VIP(pred)>1) and volative compounds with significant difference during the fermentation of Dongniang sauce-flavor Baijiu在细菌方面,与Kroppenstedtia相关的挥发性风味物质最多,主要与酯类物质具有较强的相关性,Du等[38]研究结果显示Kroppenstedtia也同脂肪酸酯如十四酸乙酯密切相关,十四酸乙酯可以提供花香和蜂蜜香气,可以增强白酒的风味。在真菌方面,红曲霉菌属作为洞酿酱香酒五轮次堆积发酵过程中的优势真菌属,与14种挥发性风味物质呈正相关,主要与酯类、酚类、烷类、醇类具有较强相关,说明其在洞酿酱香酒五轮次堆积发酵过程中对挥发性风味物质的产生起了很大作用。红曲霉菌属在分泌酯化酶的同时,在进行液态发酵时可以产生醇、醛、酸、酯类物质,散发出酒香、果香、蜜甜香味[39]。毕赤酵母属是一种非酵母菌属,是产生丰富醇类、酯类的功能菌[40],在五轮次洞酿酱香酒中与异戊醇、糠醇、苄醇、十二醛、苯并噻唑呈正相关,其中异戊醇、糠醇、十二醇、苄醇与嗜热子囊菌属呈负相关。
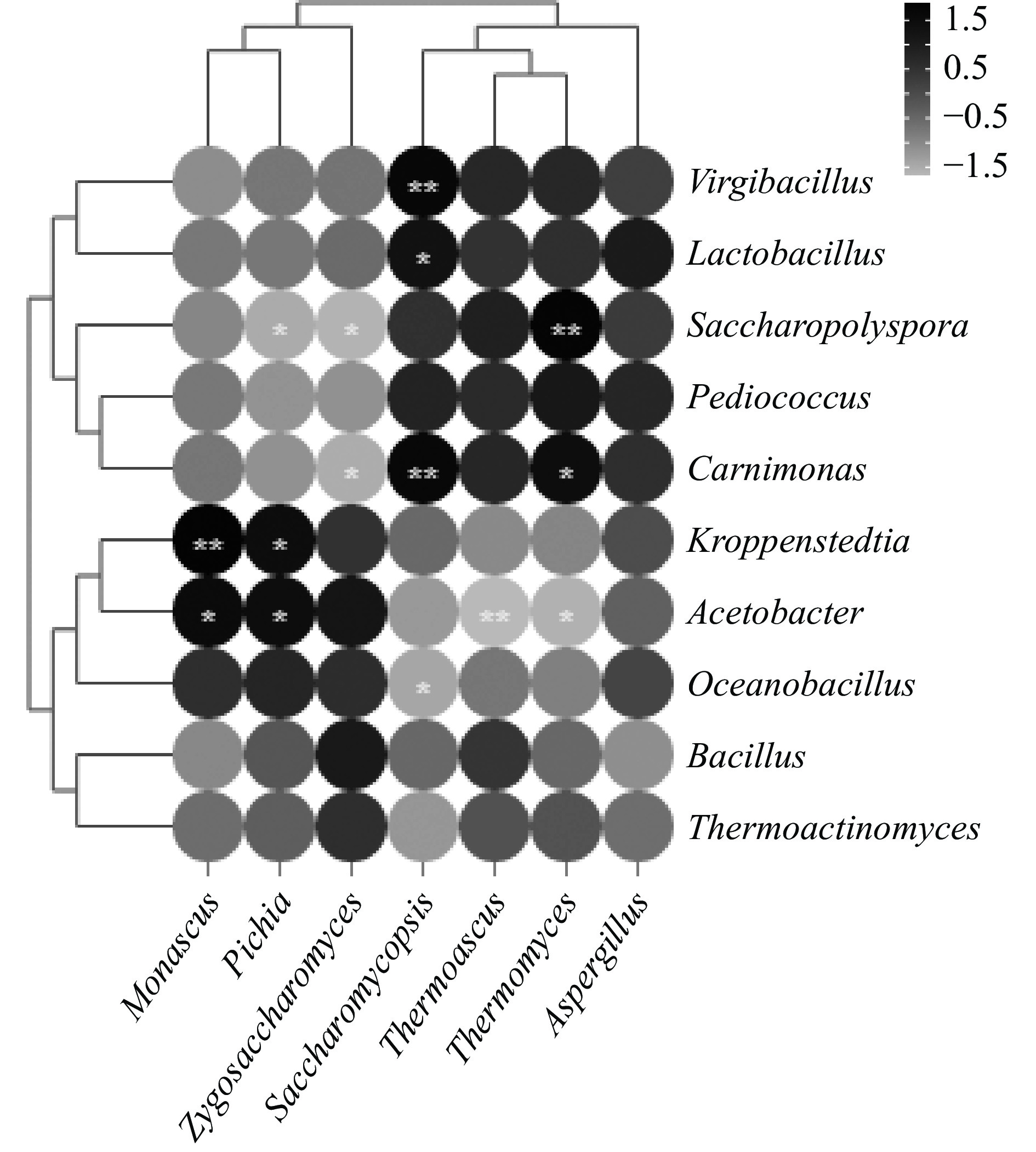
2.5 微生物属间相互作用对风味物质的影响
微生物相互作用被认为是支撑微生物结构的重要因素[41]。菌群之间复杂的关系维持着整个堆积发酵体系的稳定,推进酿造风味向富集方向发展[42]。基于Pearson相关系数和P值分析真菌优势属与细菌优势属之间的相关性。如图7所示,复膜孢酵母菌属与乳酸杆菌属呈正相关(r>0.5,P<0.05)。张艳等[43]研究发现乳酸菌通过分泌乳酸形成弱酸性培养环境,促进酵母菌生长。研究表明,在葡萄酒发酵过程中乳酸菌与酵母菌共同培养时,可增加水果香气[44]及与乳酸乙酯相关的奶油香气。相反,乳酸杆菌属抑制了毕赤酵母属的生长,罗青春等[45]对酿酒酵母、毕赤酵母、布氏乳杆菌和耐酸乳杆菌进行纯培养和共培养对比研究发现,乳酸菌代谢合成乳酸使环境中pH下降,抑制毕赤酵母的生长和乙醇代谢。另外,枝芽孢杆菌属与复膜孢酵母菌属呈极显著正相关(P<0.01),芽孢杆菌属与接合酵母菌属呈正相关(P<0.05),基本上所有的芽孢杆菌都可以适应pH在5.5~9.0的生长环境[46],并已被证明在酱香型白酒风味的形成起重要作用。由此可知,不同酵母属受环境pH的影响不同,但由于本研究乳酸菌的丰度较低,酵母菌的丰度较大,因此枝芽孢杆菌属、芽孢杆菌属、接合酵母菌属属于优势菌。
3. 结论
本研究对第五轮次洞酿酱香酒堆积发酵过程中微生物群多样性、挥发性风味物质以及二者之间的潜在相关性进行分析。高通量测序分析结果显示,细菌属以枝芽孢杆菌属、Kroppenstedtia、芽孢杆菌属、海洋芽孢杆菌、高温放线杆菌属、醋酸杆菌属、糖多孢菌属、乳酸杆菌属、片球菌属为主。真菌属以嗜热真菌属、接合酵母菌属、嗜热子囊菌属、曲霉菌属、毕赤酵母属、红曲霉属、复膜孢酵母属为主。采用HS-SPME/GC-MS共检测出55种挥发性风味物质,分别为25种酯类、5种醇类、7种醛类、4种酸类、4种酚类、3种烷烃类及其他7类。基于皮尔逊相关性分析五轮次洞酿酱香酒堆积发酵过程中微生物菌群与挥发性风味物质以及优势真菌属与优势细菌属之间的相关性,结果显示Kroppenstedtia、红曲霉属、芽孢杆菌属与复膜孢酵母菌属对乳酸乙酯、十四酸乙酯、乙酸苯乙酯、糠醇等风味物质的形成起关键作用。本研究对加强洞酿酱香型白酒香味特性的了解具有重要的研究意义,为提高产品生产品质提供理论。
-
图 6 洞酿酱香酒五轮次堆积发酵过程中微生物菌群(VIP(pred)>1)与挥发性物质之间的相关性分析
注:Pearson相关系数(|r|>0.7)表明相关性较强,差异有统计学意义(P<0.05)。粉色长方形代表挥发性风味物质,图中风味物质的序号同表2,紫色、绿色圆圈分别代表真菌和细菌。蓝色实线和红色虚线分别代表正相关(r>0.7,P<0.05)和负相关(r<−0.7,P<0.05)。
Figure 6. Correlation analysis between miccroorganisms (VIP(pred)>1) and volative compounds with significant difference during the fermentation of Dongniang sauce-flavor Baijiu
表 1 细菌和真菌在不同发酵时间的丰富度和多样性
Table 1 Richness and diversity of bacteria and fungi at different fermentation times
Sample ID Chao1 Simpson Shannon 真菌 细菌 真菌 细菌 真菌 细菌 0 h 85±12.8 182±21.7 0.5±0.1 0.9±0 2.4±0.5 4.8±0.2 24 h 78±3.7 179.8±5.5 0.6±0 0.9±0 2.3±0.1 4.9±0 48 h 77.3±9 147.7±3.9 0.8±0 0.9±0 3.2±0.4 4.6±0.1 72 h 70.7±2.6 150.8±20.2 0.8±0 0.9±0 3.4±0.2 4.4±0.3 表 2 五轮次洞酿酱香酒发酵过程中挥发性风味物质含量的变化
Table 2 Dynamic changes of volatile flavor compounds in five rounds of Dongniang sauce-flavor Baijiu
序号 保留时间 化合物名称 含量(μg·kg−1) 0 h 24 h 48 h 72 h 酯类 (24种) (25种) (24种) (25种) Z1 7.19 乳酸乙酯 112.6±6.52a 102.13±9.65b 75.77±10.2b 108.35±25.1a Z2 14.12 正己酸乙酯 30.73±0.99a 27.09±5.97a − 23.65±5.13a Z3 16.05 DL-2-羟基-4-甲基戊酸乙酯 18.23±2.81a 13.74±0.9b 10.71±0.6c 14.27±1.04b Z4 16.17 乙酰丙酸乙酯 1.62±0.35a 0.63±0.63b 0.18±0.06b 0.06±0.05b Z5 16.41 乳酸异戊酯 11.04±2.15a 9.18±2.09ab 7.07±0.52b 9.6±2.27ab Z6 19.92 丁二酸二乙酯 23.03±1.09a 18.23±0.6b 14.95±0.53c 23±1.32a Z7 20.28 己酸丁酯 1.38±0.17bc 1.99±0.23a 0.97±0.31c 1.73±0.28ab Z8 20.45 辛酸乙酯 6.92±0.69a 6.25±0.52a 4.7±0.54b 7.27±0.45a Z9 21.78 苯乙酸乙酯 70.84±3.91b 66.07±7.8b 56.11±3.64bc 84.67±6.19a Z10 22.13 乙酸苯乙酯 46.86±3.49b 44.85±3.71b 40.63±3.94b 70.77±0.87a Z11 22.83 戊二酸二乙酯 1.21±0.15a 1.14±0.07a 0.83±0.07b 1.11±0.16a Z12 23.29 壬酸乙酯 1.35±0.28a 1.22±0.18a 1.01±0.24a 1.29±0.19a Z13 24.73 3-苯丙酸乙酯 8.7±1.31b 8.8±0.55b 7.22±0.9b 10.57±0.3a Z14 25.03 丙位壬内酯 10.33±0.46a 7.78±0.61b 6.6±1.19b 9.95±0.63a Z15 25.55 反式-4-癸烯酸乙酯 4.36±0.99ab 4.19±1b 3.63±0.48b 6.21±1.4a Z16 25.97 癸酸乙酯 7.13±1.26a 6.98±0.82a 6.57±1.62a 8.9±0.81a Z17 32.04 月桂酸乙酯 8.1±0.43b 7.97±0.3b 7.78±1.68b 10.59±1.06a Z18 37.61 十四酸乙酯 11.93±2.85b 15.96±3.41ab 15.35±4.33ab 20±4.53a Z19 39.94 十五酸乙酯 2.93±1.33b 4.61±1.34ab 4.22±1.31ab 5.63±1.2a Z20 41.19 邻苯二甲酸二丁酯 − 0.06±0.02ab 0.03±0.02bc 0.11±0.04a Z21 41.62 9-十六碳烯酸乙酯 10.72±4.78b 17.58±3.02ab 16.34±4.64ab 22.39±5.06a Z22 42.11 十六酸乙酯 370.21±140.39b 0.99±0.24c 482.1±96.42ab 643.39±99.22a Z23 44.07 十七烷酸乙酯 0.28±0.09b 0.57±0.24ab 0.53±0.23ab 0.75±0.22a Z24 45.32 (Z,Z)-9,12-十八烷二烯酸乙酯 80.07±35.86b 138.45±43.43ab 146.9±48.93ab 214.54±49.79a Z25 45.45 油酸乙酯 89.97±42.49b 172.38±40.78a 152.8±36.76ab 214.53±43.1a 醇类 (4种) (5种) (5种) (5种) C1 4.71 异戊醇 − 0.23±0.12c 2.57±0.32b 5.86±0.72a C2 8.74 糠醇 15.96±3.6b 15.81±2.4b 21.25±0.86b 30.76±3.42a C3 15.26 苄醇 12.58±1.54bc 12.07±0.85c 14.41±0.82b 19.7±0.44a C4 17.9 苯乙醇 509.77±19.67b 472.18±42.39bc 448.68±29.5c 708.55±7.03a C5 28.08 十二醇 2.08±0.33a 2.26±1.37a 2.01±2.24a 4.43±2.53a 醛类 (7种) (7种) (7种) (6种) Q1 7.89 糠醛 52.89±14.37a 36.13±7.63b 1.82±0.45c − Q2 12.73 苯甲醛 14.49±2.05a 11.74±0.98b 6.89±0c 8.43±0.54c Q3 15.6 苯乙醛 24.85±3.1a 20.18±1.9b 12.38±0.46c 12.58±0.42c Q4 20.74 癸醛 3.74±0.22ab 3.51±0.54ab 2.57±0.73b 4.45±1.53a Q5 22.53 α-亚乙基-苯乙醛 2.74±0.08b 3.36±0.22b 3.24±0.48b 4.32±0.45a Q6 26.38 十二醛 0.69±0.01b 0.75±0.4b 0.93±0.22b 1.52±0.32a Q7 35.59 十五醛 0.54±0.23b 0.76±0.11b 0.49±0.06b 1.1±0.14a 酸类 (4种) (4种) (4种) (3种) S1 5.79 乙酸 3.04±0.85a 1.81±0.3b 0.76±0.25c − S2 16.8 庚酸 3.97±0.54a 4.75±0.6a 3.18±0.75a 4.16±1.19a S3 19.75 辛酸 8.32±1.28b 8.43±0.71b 8.19±2.4b 13.18±1.82a S4 41.37 棕榈酸 5.19±2.47b 8.86±2.49b 9.53±2.42b 15.67±1.3a 酚类 (4种) (4种) (3种) (3种) F1 19.45 4-乙基苯酚 2.36±0.13b 2.11±0.12b 1.98±0.52b 4.1±0.66a F2 22.66 4-乙基-2-甲氧基苯酚 11.62±1.52b 10.41±0.59b 9.82±1.59b 17.74±0.79a F3 23.68 4-乙烯基-2-甲氧基苯酚 1.71±0.06a 1.34±0.23b − − F4 29.02 2,4-二叔丁基苯酚 12.32±3.01b 19.58±5.42a 15.44±0.33ab 15.65±3.03ab 烷类 (3种) (3种) (3种) (3种) W1 26.14 正十四烷 3.66±1.15a 4.4±1.51a 3.81±0.8a 6.48±1.96a W2 28.89 十五烷 3.15±0.42b 3.71±0.53b 3.46±1.07b 6.02±0.46a W3 35.21 正十七烷 1.66±0.32b 1.71±0.46b 1.31±0.26b 2.83±0.54a 其他 (6种) (6种) (7种) (7种) T1 10.07 4-(2-氨基乙基)苯-1-磺酰基氟化物 1.95±1.74a 2.18±3.55a 0.02±0.01a 3.83±3.83a T2 13.37 倍他司汀 2.93±0.58a 2.65±0.51a 2.5±0.33a 3.26±0.32a T3 21.29 苯并噻唑 − − 2.3±1.8a 3.18±1.31a T4 23.06 茴香脑 3.65±0.35b 3.56±0.75b 2.57±0.64b 6±0.69a T5 23.93 4-乙基-1,2-二甲氧基苯 1.7±0.09a 1.48±0.12a 1.52±0.37a 1.73±0.05a T6 25.25 1,2,4-三甲氧基苯 1.9±0.29b 1.93±0.24b 2.06±0.63b 3.11±0.19a T7 35.12 2-十五烷酮 0.73±0.03b 1±0.31ab 0.95±0.28ab 1.31±0.23a 注:同一行的不同字母表示具有显著差异(P<0.05),“−”表示未检出该物质。 -
[1] CAI W, WANG Y, WANG W, et al. Insights into the aromaprofile of sauce-flavor Baijiu by GC-IMS combined with multivariate statistical analysis[J]. Journal of Analytical Methods in Chemistry,2022,2022:1−14.
[2] DUAN J, YANG S, LI H, et al. Why the key aroma compound of soy sauce aroma type Baijiu has not been revealed yet?[J]. LWT,2022,154:112735. doi: 10.1016/j.lwt.2021.112735
[3] WANG W, XU Y, HUANG H, et al. Correlation between microbial communities and flavor compounds during the fifth and sixth rounds of sauce-flavor Baijiu fermentation[J]. Food Research International,2021,150:110741. doi: 10.1016/j.foodres.2021.110741
[4] 杨国华, 邱树毅, 黄永光. 酱香白酒生产中产香微生物研究[J]. 中国酿造,2011(4):24−27 doi: 10.3969/j.issn.0254-5071.2011.04.006 YANG G H, QIU S Y, HUANG Y G. Microbiology research of liquor production[J]. China Brewing,2011(4):24−27. doi: 10.3969/j.issn.0254-5071.2011.04.006
[5] 贺卫, 李坡. 贵州喀斯特洞穴资源特征及开发利用[J]. 贵州师范大学学报(自然科学版),2016,34(3):1−6 doi: 10.3969/j.issn.1004-5570.2016.03.001 HE L, LI P. Resources features of Guizhou Karst cave and development and utilization[J]. Journal of Guizhou Normal University (Natural Sciences),2016,34(3):1−6. doi: 10.3969/j.issn.1004-5570.2016.03.001
[6] 张超, 田鹏, 徐秋硕, 等. 浓香型白酒生态洞酿糟醅中微生物的变化研究[J]. 酿酒科技,2019(9):65−67 doi: 10.13746/j.njkj.2019079 ZHANG C, TIAN P, XU Q Y, et al. Microbial change in fermented grains of Nongxiang Baijiu in cave fermentation[J]. Liquor-Making Science & Technology,2019(9):65−67. doi: 10.13746/j.njkj.2019079
[7] WANG H, HUANG Y, HUANG Y. Microbiome diversity and evolution in stacking fermentation during different rounds of Jiang-flavoured Baijiu brewing[J]. LWT,2021,143:111119. doi: 10.1016/j.lwt.2021.111119
[8] 杨漫江. 堆积发酵对酱香型白酒风味物质形成的影响[J]. 酿酒科技,2011(7):72−73 doi: 10.13746/j.njkj.2011.07.035 YANG M J. Effects of stacking fermentation on the formation of flavoring components of Maotai-flavor liquor[J]. Liquor-Making Science & Technology,2011(7):72−73. doi: 10.13746/j.njkj.2011.07.035
[9] DAI Y, TIAN Z, MENG W, et al. Microbial diversity and physicochemical characteristics of the Maotai-flavored liquor fermentation process[J]. Journal of Nanoscience and Nanotechnology,2020,20(7):4097−4109. doi: 10.1166/jnn.2020.17522
[10] 张春林, 杨亮, 李喆, 等. 酱香型白酒酒醅堆积微生物多样性及其与风味物质的关系[J]. 食品科技,2022,47(4):111−118 doi: 10.13684/j.cnki.spkj.2022.04.036 ZHANG C L, YANG L, LU J, et al. Microbial community and its relationship with volatile compounds in Moutai-flavor Baijiu stacking fermentation process[J]. Food Science and Technology,2022,47(4):111−118. doi: 10.13684/j.cnki.spkj.2022.04.036
[11] 任婷婷, 苏伟, 母应春, 等. 洞口酱香酒第一轮次堆积发酵过程中微生物群落结构及其与理化因子关联性分析[J]. 食品与发酵科技,2023,59(1):30−38 doi: 10.3969/j.issn.1674-506X.2023.01-005 REN T T, SU W, MU Y C, et al. Analysis of microbial community structure and its correlation with physicochemical properties during the first round of stacking fermentation of the Dongkou sauce-flavor Baijiu[J]. Food and Fermentation Science & Technology,2023,59(1):30−38. doi: 10.3969/j.issn.1674-506X.2023.01-005
[12] BOKULICH N A, KAEHLER B D, RIDEOUT J R, et al. Optimizing taxonomic classification of marker-gene amplicon sequences with QIIME 2’s q2-feature-classifier plugin[J]. Microbiome,2018,6(1):1−17. doi: 10.1186/s40168-017-0383-2
[13] 王涵钰. 玉米酒发酵过程中微生物多样性及风味品质研究[D]. 贵阳:贵州大学, 2021 WANG H Y. Study on microbial diversity and flavor quality of corn wine during fermentation[D]. Guiyang:Guizhou University, 2021.
[14] TIAN N, GUO X, WANG M, et al. Bacterial community diversity of Shilixiang Baijiu Daqu based on metagenomics[J]. Journal of Food Biochemistry,2020,44(10):e13410.
[15] WANG L, ZHONG K, LUO A, et al. Dynamic changes of volatile compounds and bacterial diversity during fourth to seventh rounds of Chinese soy sauce aroma liquor[J]. Food Science & Nutrition,2021,9(7):3500−3511.
[16] WOLF M, MÜLLER T, DANDEKAR T, et al. Phylogeny of Firmicutes with special reference to Mycoplasma (Mollicutes) as inferred from phosphoglycerate kinase amino acid sequence data[J]. International Journal of Systematic and Evolutionary Microbiology,2004,54(3):871−875. doi: 10.1099/ijs.0.02868-0
[17] DU F, ZHANG X, GU H, et al. Dynamic changes in the bacterial community during the fermentation of traditional Chinese fish sauce (TCFS) and their correlation with TCFS quality[J]. Microorganisms,2019,7(9):371. doi: 10.3390/microorganisms7090371
[18] 丁芳, 张原頔, 蒋英丽, 等. 不同等级高温大曲微生物群落和代谢物的特征分析[J]. 中国酿造,2022,41(11):24−30 DING F, ZHANG Y D, JIANG Y L, et al. Microbial communities and metabolites characteristics of high temperature Daqu with different grades[J]. China Brewing,2022,41(11):24−30.
[19] 聂士昊, 张志伟, 汪俊卿, 等. 芽孢杆菌加强菌对酱香型白酒酒醅微生物群落及蛋白酶活力的影响[J]. 中国酿造,2022,41(8):137−142 NIE S H, ZHANG Z W, WANG J Q, et al. Effect of addition of Bacillus on microbial communities and protease activity of fermented[J]. China Brewing,2022,41(8):137−142.
[20] SONG Z, DU H, ZHANG Y, et al. Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics ssequencing[J]. Frontiers in Microbiology,2017,8:1294. doi: 10.3389/fmicb.2017.01294
[21] JIANG Q, WU X, XU Y, et al. Microbial composition and dynamic succession during the Daqu production process of Northern Jiang-flavored liquor in China[J]. 3 Biotech,2021,11(5):1−15.
[22] WANG X, WANG B, SUN Z, et al. Effects of modernized fermentation on the microbial community succession and ethyl lactate metabolism in Chinese Baijiu fermentation[J]. Food Research International,2022,159:111566. doi: 10.1016/j.foodres.2022.111566
[23] CHEN C, LIU Y, TIAN H, et al. Metagenomic analysis reveals the impact of Jiuyao microbial diversity on fermentation and the volatile profile of Shaoxing-jiu[J]. Food Microbiology,2020,86:103326. doi: 10.1016/j.fm.2019.103326
[24] XIAO C, LU Z, ZHANG X, et al. Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J]. Applied and Environmental Microbiology,2017,83(23):e01550−17.
[25] FRANITZA L, GRANVOGL M, SCHIEBERLE P. Influence of the production process on the key aroma compounds of rum:From molasses to the spirit[J]. Journal of Agricultural and Food Chemistry,2016,64(47):9041−9053. doi: 10.1021/acs.jafc.6b04046
[26] 孙优兰, 黄永光, 朱晓春, 等. 清酱香型白酒特征风味化合物分析[J]. 食品科学,2020,41(24):199−208 doi: 10.7506/spkx1002-6630-20191203-035 SUN Y L, HUANG Y G, ZHU C X, et al. Analysis of characteristic flavor compounds of Chinese light-soy sauce aroma type liquors[J]. Food Science,2020,41(24):199−208. doi: 10.7506/spkx1002-6630-20191203-035
[27] 蔡心尧, 尹建军. 毛细管色谱直接进样法测定白酒中高碳脂肪酸乙酯的研究[J]. 分析测试学报,1998(3):65−67 CAI X Y, YIN J J. Study on determination of ethyl esters of long-chain fatty acids in Chinese spirits by capillary gas chromatography with direct injection[J]. Journal of Instrumental Analysis,1998(3):65−67.
[28] 罗晶, 祝水兰, 王丽, 等. 浓香型白酒酿造微生物与风味物质组成的研究进展[J]. 中国酿造,2020,39(4):1−6 LUO J, ZHU S L, WANG L, et al. Research progress on the composition of brewing microorganisms and flavor substances in strong-flavor Baijiu[J]. China Brewing,2020,39(4):1−6.
[29] 马宇, 黄永光. 清酱香型白酒挥发性风味组分及香气特征[J]. 食品科学,2019,40(20):241−248 MA Y, HUANG Y G. Volatile components and aroma characteristics of Fen-Maotai-flavored liquor[J]. Food Science,2019,40(20):241−248.
[30] 黄亚东, 印伯星. 关于啤酒酵母产生苯乙醇的研究[J]. 酿酒科技,2003(5):62−63 doi: 10.3969/j.issn.1001-9286.2003.05.020 HUANG Y D, YIN B X. Study on phenethyl alcohol derived from beer yeast[J]. Liquor-Making Science & Technology,2003(5):62−63. doi: 10.3969/j.issn.1001-9286.2003.05.020
[31] WANG Z, WANG S, LIAO P, et al. HS-SPME combined with GC-MS/O to analyze the flavor of strong aroma Baijiu Daqu[J]. Foods,2022,11(1):116. doi: 10.3390/foods11010116
[32] 唐平, 山其木格, 王丽, 等. 白酒风味化学研究方法及酱香型白酒风味化学研究进展[J]. 食品科学,2020,41(17):315−324 doi: 10.7506/spkx1002-6630-20190822-228 TANG P, SHAN Q M G, WANG L, et al. A review of research methods in Baijiu flavor chemistry and recent progress in the flavor chemistry of Maotai-flavored Baijiu[J]. Food Science,2020,41(17):315−324. doi: 10.7506/spkx1002-6630-20190822-228
[33] 郭学武, 范恩帝, 马冰涛, 等. 中国白酒中微量成分研究进展[J]. 食品科学,2020,41(11):267−276 GUO X W, FAN E D, MA B T, et al. Recent progress in micro components of Chinese Baijiu[J]. Food Science,2020,41(11):267−276.
[34] HAN Q, SHI J, ZHU J, et al. Enzymes extracted from apple peels have activity in reducing higher alcohols in Chinese liquors[J]. Journal of Agricultural and Food Chemistry,2014,62(39):9529−9538. doi: 10.1021/jf5018862
[35] LUO T, FAN W, XU Y. Characterization of volatile and semi-volatile compounds in chinese rice wines by headspace solid phase microextraction followed by gas chromatography‐mass spectrometry[J]. Journal of the Institute of Brewing,2008,114(2):172−179. doi: 10.1002/j.2050-0416.2008.tb00323.x
[36] 高航, 续丹丹, 王文平, 等. 基于多元统计学分析红曲米醋醋酸发酵阶段挥发性风味特征组分[J]. 食品科学,2022,43(12):219−227 GAO X, XU D D, WANG W P, et al. Identification of characteristic volatiles in vinegar prepared with monascus-fermented rice during acetic acid fermentation using multivariate statistical analysis[J]. Food Science,2022,43(12):219−227.
[37] 祝贺, 杨涛, 郝哲兵, 等. 酚类对酒的风味影响及白酒酚类控制策略[J]. 食品工业科技,2019,40(18):361−367 doi: 10.13386/j.issn1002-0306.2019.18.057 ZHU H, YANG T, HE Z B, et al. Effect of phenols on liquor flavor and control strategy of phenols in Baijiu[J]. Science and Technology of Food Industry,2019,40(18):361−367. doi: 10.13386/j.issn1002-0306.2019.18.057
[38] DU Y K, XIN W, XIA Y, et al. Analysis of fermentation control factors on volatile compounds of primary microorganisms in Jiang-flavor Daqu[J]. Journal of Food Biochemistry,2022,46(10):e14277.
[39] 孙利林, 李立郎, 胡萍, 等. 酱香型白酒大曲的微生物菌群结构及风味成分分析[J]. 现代食品科技,2020,36(8):299−306 doi: 10.13982/j.mfst.1673-9078.2020.8.0044 SUN L L, LI L L, HU P, et al. Analysis of microbial community structure and flavor composition of Maotai-flavor Daqu[J]. Modern Food and Technology,2020,36(8):299−306. doi: 10.13982/j.mfst.1673-9078.2020.8.0044
[40] ZHANG H, WANG L, TAN Y, et al. Effect of Pichia on shaping the fermentation microbial community of sauce-flavor Baijiu[J]. International Journal of Food Microbiology,2021,336:108898. doi: 10.1016/j.ijfoodmicro.2020.108898
[41] WANG C, ZHANG Q, HE L, et al. Determination of the microbial communities of Guizhou Suantang, a traditional Chinese fermented sour soup, and correlation between the identified microorganisms and volatile compounds[J]. Food Research International,2020,138:109820. doi: 10.1016/j.foodres.2020.109820
[42] 王欢, 席德州, 黄永光, 等. 酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性分析[J]. 食品科学,2020,41(2):188−195 doi: 10.7506/spkx1002-6630-20181218-202 WANG H, XI D, HUANG Y G, et al. Bacterial community structure and diversity in different stacking fermentation rounds in mechanized Maotai-flavor liquor brewing[J]. Food Science,2020,41(2):188−195. doi: 10.7506/spkx1002-6630-20181218-202
[43] 张艳, 杜海, 吴群, 等. 酱香型白酒发酵中两株主要乳酸菌对酿造微生物群体的影响[J]. 微生物学通报,2015,42(11):2087−2097 doi: 10.13344/j.microbiol.china.150120 ZHANG Y, DU H, WU Q, et al. Impacts of two main lactic acid bacteria on microbial communities during Chinese Maotai-flavor liquor fermentation[J]. Microbiology China,2015,42(11):2087−2097. doi: 10.13344/j.microbiol.china.150120
[44] BRAVO-FERRADA B M, HOLLMANN A, DELFEDERICO L, et al. Patagonian red wines:Selection of Lactobacillus plantarum isolates as potential starter cultures for malolactic fermentation[J]. World Journal of Microbiology and Biotechnology,2013,29(9):1537−1549. doi: 10.1007/s11274-013-1337-x
[45] 罗青春, 郑佳, 赵东, 等. 浓香型白酒中优势乳酸菌和酵母菌间的相互关系[J]. 应用与环境生物学报,2019,25(5):1192−1199 doi: 10.19675/j.cnki.1006-687x.2018.12031 LUO Q C, ZHENG J, ZHAO D, et al. Interaction between dominant lactic acid bacteria and yeasts strains in strong aroma Baijiu[J]. Chinese Journal of Applied and Environmental Biology,2019,25(5):1192−1199. doi: 10.19675/j.cnki.1006-687x.2018.12031
[46] 倪鑫鑫, 龚海燕, 马顶虹, 等. 芽孢杆菌生理生化特性分析[J]. 安徽农学通报,2015,21(7):47−48 doi: 10.3969/j.issn.1007-7731.2015.07.018 NI X X, GONG H Y, MA D H, et al. Analysis of physiological and biochemical characteristics about Bacillus[J]. Anhui Agricultural Science Bulletin,2015,21(7):47−48. doi: 10.3969/j.issn.1007-7731.2015.07.018
-
期刊类型引用(7)
1. 胡春红,李新涛,肖冬光,卢君,唐贤星,罗桂花,程明星,杜宇,陈双宇,杨芳. 不同品种糯高粱在酱香型白酒生产中的应用. 食品与发酵工业. 2025(01): 99-107 .  百度学术
百度学术
2. 陈诺,母应春,苏伟,齐琦,林彩霞. 不同糯米、小米与高粱混合酿造白酒风味对比分析. 中国酿造. 2025(01): 35-43 .  百度学术
百度学术
3. 杨婷婷,黄永光,左乾程,赵聪. 酱香白酒酿造过程糠醛及糠醇的时空分布规律及溯源分析. 食品科学. 2025(05): 38-47 .  百度学术
百度学术
4. 任婷婷,晏培,山其木格,唐平,谭壹,李冰冰,尹学忠,陈双宇,曾大刚,侯玉祥,卢君. 控温控湿高温大曲在制酒生产过程中的应用. 食品科学. 2025(07): 151-161 .  百度学术
百度学术
5. 曹丹,吕嘉枥,楚京嬴,许双双,金成勇,张永利,张宇航. 3种凤香型大曲中心区域特性的多维度表征及其差异性和相关性分析. 食品科学. 2024(20): 20123-20135 .  百度学术
百度学术
6. 赵侨,杨花,田茂玲,李瑞杰,胡永芯,汪茜,杨阳,钟小忠,赵建,王松涛,李姝. 酱香型白酒堆积发酵微生物与风味物质相关性研究进展. 中国酿造. 2024(12): 6-12 .  百度学术
百度学术
7. 李亭,郎莹,胡胜兰,刘彩婷,黄明泉. 酱香型白酒风味成分研究进展. 香料香精化妆品. 2023(06): 18-35+109 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:
 下载:
下载:



