Heterologous Expression of Leghemoglobin in Saccharomyces cerevisiae
-
摘要: 豆血红蛋白是一种植物源血红蛋白,在植物蛋白肉加工中可作为重要的风味催化剂和着色剂,大大增加植物蛋白肉的拟真性。为实现豆血红蛋白在食品级微生物中的异源表达,将携带豆血红蛋白LBC2基因的质粒PESC-TRP转入酿酒酵母CEN.PK2-1C中,通过添加kozak序列促进其翻译,并进一步对启动子序列进行选择,以提高豆血红蛋白表达量。对重组菌株进行发酵,用Western blot分析LegH蛋白表达水平。结果显示,诱导型启动子GAL1,10较三种组成型启动子TEF1、ADH1、GAP在表达LegH能力上具有显著优势,较产量最低的ADH1启动子提升了3.93倍。在组成型启动子中,TEF1启动子能力较优,是ADH1启动子的2.91倍,是GAP启动子的1.2倍。最后,利用Ni柱亲和层析对蛋白进行浓缩纯化,测得LegH发酵浓度为2.79 mg/L。本研究成功实现了豆血红蛋白在酿酒酵母中的异源表达,经后续优化有可能成为豆血红蛋白异源表达的又一途径。Abstract: Leghemoglobin is a kind of plant-derived hemoglobin, which can be used as an important flavor catalyst and colorant in the processing of plant protein-based meat because of the property of increasing the fidelity of the product greatly. In order to realize the heterologous expression of leghemoglobin in food-grade microorganisms, the plasmid PESC-TRP carrying leghemoglobin LBC2 gene was transformed into S. cerevisiae CEN.PK2-1C. Kozak sequence was added to promote protein translation, and different promoter sequences were selected to improve the expression of leghemoglobin. The recombinant strain was fermented, and the expression level of LegH protein was analyzed by western blot. The results showed that the inducible promoter GAL1,10 had a significant advantage over the three constitutive promoters TEF1, ADH1 and GAP in LegH expression ability, which was 3.93 times higher than the lowest yield ADH1 promoter. Among the constitutive promoters, TEF1 promoter had the best ability, which was 2.91times that of the ADH1 promoter and 1.2 times that of the GAP promoter. Finally, the protein was concentrated and purified by Ni-column affinity chromatography, and the fermentation concentration of LegH was 2.79 mg/L. This study successfully achieved the heterologous expression of leghemoglobin in Saccharomyces cerevisiae, and after subsequent optimization, it would become another way of leghemoglobin heterologous expression.
-
豆血红蛋白(Leghemoglobin,LegH)是豆科植物感染根瘤菌后共同产生的植物源血红蛋白[1-2],由一条单链脱辅基蛋白和血红素辅基构成,三维结构与动物血红蛋白高度相似[3],在植物蛋白肉加工中可以作为风味催化剂和着色剂,大大增加植物蛋白肉的拟真性[4-5]。目前,LegH主要从大豆根瘤中提取获得,但由于工艺复杂、植物种植周期长、含量低等原因,生产成本较高,难以进行大规模生产。因此,利用微生物作为细胞工厂合成血红蛋白是未来的发展方向[6],包括豆血红蛋白[7-9]、人血红蛋白[10]、猪肌红蛋白[11]在内的多种血红蛋白已实现异源表达[12]。以毕赤酵母作为表达宿主的LegH已被美国食品药品监督管理局(Food and Drug Administration,FDA)批准作为“人造肉”中的着色剂[13-15]。但目前豆血红蛋白异源表达的相关研究主要集中于大肠杆菌和毕赤酵母[8-9]。大肠杆菌的表达量较低[16],存在形成包涵体、血红素供应不足等问题,同时细菌内毒素会使豆血红蛋白结合形成高铁血红蛋白致使蛋白纯化变得更为复杂[17]。而毕赤酵母为甲醇营养型菌株,在表达过程中需要使用甲醇作为碳源和诱导表达,经超滤纯化过程后并不能完全去除[15],这不仅增加了蛋白纯化的难度,而且在食品中的应用带来了潜在的安全风险。酿酒酵母被认为是GRAS(generally recognized as safe)生物,作为表达体系研究历史悠久,已有多种血红蛋白在酿酒酵母中实现了异源表达[18-20],而目前关于酿酒酵母表达豆血红蛋白的研究鲜有报道。
本研究对酿酒酵母异源表达豆血红蛋白进行了初步研究。将编码豆血红蛋白的LBC2的基因序列进行密码子优化,并在N端添加可以促进真核生物基因翻译效率和提高基因表达水平的kozak序列[21-22],将优化序列连接在表达载体pECS-TRP上,通过对TEF1、ADH1、GAP、GAL1,10不同启动子的替换,确定启动子与LBC2基因的适配性,成功实现了豆血红蛋白在酿酒酵母中的表达,为酿酒酵母异源表达豆血红蛋白提供了理论和技术参考。
1. 材料与方法
1.1 材料与仪器
所涉及的菌株 见表1;表达克隆的基因 见表2;设计的引物信息 见表3;涉及的LegH序列 经酿酒酵母密码子优化[23](http://www.jcat.de/)后交北京擎科生物科技有限公司合成;PCR引物(见表3) 北京擎科生物技术公司合成;PrimeSTAR Max DNA Polymerase、Lysis Buffer for Microorganism to Direct PCR、DNA限制性快切酶 北京宝日医生物技术公司;Green Taq Mix 南京诺维赞生物科技公司;T4 DNA连接酶、酵母基因组提取试剂盒、质粒抽提试剂盒、PCR产物纯化试剂盒、胶回收试剂盒、酵母蛋白提取试剂盒、脱脂奶粉、SDS-PAGE凝胶制备试剂盒、TBST、YNB、半乳糖、氨苄青霉素、咪唑及其他常用试剂 上海生工生物工程公司;DNA marker 北京全式金生物技术公司;Anti-His Antibody鼠单抗、超敏 ECL 化学发光液、快速转膜液、稳定性抗体稀释液、高效封闭液 上海七纯生物科技公司;HRP-山羊抗小鼠IgG(H+I)二抗、GAPDH rabbit pAb、HRP-山羊抗兔IgG(H+I)二抗 苏州博奥龙科技公司;Western一抗二抗去除液 碧云天生物;HisSep Ni-NTA 6FF Chromatography Column 上海翌圣生物科技公司。
表 1 本研究涉及的菌株信息Table 1. Strains used in this study菌株 基因型 来源 E. coli DH5α F-;ɸ80(lacZ)∆M15;∆(lacZYA-argF)U169;deoR;recA1;endA1;hsdR17(rK-,mK+); phoA;supE44λ-thi-1;gyrA96 relA1 Tsingke S. cerevisiae CEN.PK2-1C MATa leu2-3,112;trp1-289;ura3-52;his3Δ1 实验室保存 表 2 本研究涉及的基因Table 2. Genes used in this study基因 注释 编号 LegH Coding gene of the Soybean (Glycine max) leghemoglobin NM_001248319.3 TEF1p Promoter for translation elongation factor EF-1 alpha NM_001184177.1 ADH1p Promoter for alcohol dehydrogenase 1 NM_001183340.1 GAPp Promoter for glyceraldehyde-3-phosphate dehydrogenase NM_001179829.3 表 3 本研究设计的引物Table 3. Primers designed in this study引物 序列(5’-3’) S-LegH-F CGGGATCCGCCACCATGGGTGCTTTC
ACTGAAAAGCS-LegH-R CGGTCGACTTAGTGGTGGTGGTGGTGGTGGAA ADH1-EcoRI-F CCGAATTCCAACTTCTTTTCTTTTTTTTT
CTTTTCTCTCADH1-BamHI-R CGGGATCCAGTTGATTGTATGCTTGGTATAGC GAP-EcoRI-F CCGAATTCTCATTATCAATACTGCC
ATTTCAAAGAGAP-BamHI-R CGGGATCCTTTGTTTGTTTATGTGTGTTTATTCG TEF1-EcoRI-F CCGAATTCCCACACACCATAGCTTCAAAA TEF1-BamHI-R CGGGATCCCTTAGATTAGATTGCTATG
CTTTCTTTCpECS-TRP-EcoRI-R CGGAATTCCGCTCCAATTCAGCTGGC ALLEGRA X-30R型高速冷冻离心机 美国贝克曼库尔特有限公司;HZQ-X300型恒温培养振荡器 上海一恒科学仪器有限公司;DYY-6C电泳仪 北京六一仪器厂;Omega Lum W型化学发光多色荧光成像系统 环亚生物科技公司;AH100D型高压均质机 安拓思纳米技术有限公司;SpectraMax iD3型多功能酶标仪 美谷分子仪器有限公司。
1.2 实验方法
1.2.1 培养基的配制
LB培养基(g/L):胰蛋白胨10,酵母提取物5,氯化钠10;pH7.0~7.4。根据实验需求添加2%(w/v)琼脂粉。
YPD液体培养基(g/L):蛋白胨20,酵母提取物10,葡萄糖20;根据实验需求添加2%(w/v)琼脂粉。
SC-Trp筛选培养基(g/L):葡萄糖20,YNB5,硫酸铵1.7。添加过滤除菌的Leu、His、Ura至终质量浓度为50 μg/mL。
1.2.2 LegH重组表达载体构建
针对酿酒酵母对大豆血红蛋白LBC2基因序列进行密码子优化,并在N端添加kozak序列以增强基因的翻译效率,在C端添加6×His标签用于后续蛋白分离纯化。通过在LegH序列上下游分别添加BamH Ⅰ和Sal Ⅰ酶切位点,将其插入pESC-TRP质粒中,获得诱导型pESC-TRP-GAL1,10-LegH重组表达载体。通过设计引物S-LegH-F、pECS-TRP-EcoRI-R对质粒pESC-TRP-GAL1,10-LegH进行PCR扩增获得不含启动子序列的质粒框架pESC-TRP-LegH。对S.cerevisiae CEN.PK2-1C进行基因组提取并扩增获得组成型启动子ADH1,GAP,TEF1序列,并在其两端分别添加EcoR Ⅰ和BamH Ⅰ酶切位点,通过EcoR Ⅰ和BamH Ⅰ酶切,将pESC-TRP-LegH与三种组成型启动子ADH1,GAP,TEF1通过T4连接酶酶连,连接产物转化入E. coli DH5α感受态细胞中,涂布于含氨苄青霉素的LB固体平板上,对阳性转化子进行菌落PCR筛选,提取质粒并送擎科测序验证。获得含有不同启动子的重组表达载体pESC-TRP-GAL1, 10-LegH、pESC-TRP-TEF1-LegH、pESC-TRP-ADH1-LegH、pESC-TRP-GAP-LegH,重组示意图如图1所示。
1.2.3 酿酒酵母转化及重组菌发酵
根据《酿酒酵母遗传学方法实验指南》[24]中酵母感受态细胞制备和高效转化方法,将重组表达质粒转化入S. cerevisiae CEN.PK2-1C中,涂布于SD-TRP营养缺陷型筛选培养基,获得转化子。将转化子通过Lysis Buffer for Microorganism to Direct PCR(Takara)裂解后进行菌落PCR筛选检验。
将验证后的阳性转化子接种于SD-TRP液体培养基,30 ℃,220 r/min培养24 h。接种1×107 CFU/mL的菌体细胞于YPD培养基中发酵并额外添加10 μg/mL的豆血红蛋白辅基血红素,诱导型表达菌株发酵20 h后补充诱导剂半乳糖至终浓度2%,30 ℃,220 r/min总共发酵48 h。发酵液于4 ℃,8000 r/min下离心10 min收集菌体,并用PBS缓冲液清洗菌体2遍去除培养基及血红素残留。通过高压均质机对酿酒酵母进行细胞破碎,4 ℃,11000 r/min离心20 min,取上清获得胞内蛋白样品,添加PMSF至终浓度1 mmol/L,4 ℃保存备用。
1.2.4 Western blot检测LegH表达水平
采用生工酵母蛋白提取试剂盒对发酵48 h菌液进行总蛋白提取。取8 μL抽提液进行SDS-PAGE分析,分离胶按照15%进行配制将蛋白转至PVDF膜,快速封闭液封闭1 h,1:10000稀释Anti-His Antibody鼠单抗4 ℃低温摇床封闭过夜,TBST漂洗三次后1:5000稀释HRP-山羊抗小鼠IgG(H+I)二抗室温孵育1 h,超敏ECL化学发光处理10 min,送化学发光成像检测。Western一抗二抗去除液处理10 min,去除his抗体及其二抗。选择酵母GAPDH蛋白作为内参蛋白,采取与his抗体相同方法孵育内参抗体,1:10000稀释GAPDH rabbit pAb(Yeast)一抗,1:5000稀释HRP-山羊抗兔IgG(H+I)二抗。对检测结果进行ImageJ数据处理。
1.2.5 LegH蛋白纯化浓缩
按照10%(w/v)对菌体进行重悬,130 MPa高压均质破碎细胞, 11000 r/min离心30 min获取上清液。通过AKTA pure利用HisSep Ni-NTA 6FF纯化柱对蛋白进行纯化。纯化样品通过15% SDS-PAGE和全波段扫描进行蛋白定性分析。
1.2.6 蛋白浓度测定
纯化样品适当稀释后通过Bradford蛋白浓度测定法[25]测定总蛋白浓度,根据纯化样品SDS-PAGE图进行ImageJ灰度分析,计算LegH在总蛋白中所占百分比,从而算出豆血红蛋白浓度。
2. 结果与分析
2.1 不同启动子PCR扩增产物鉴定
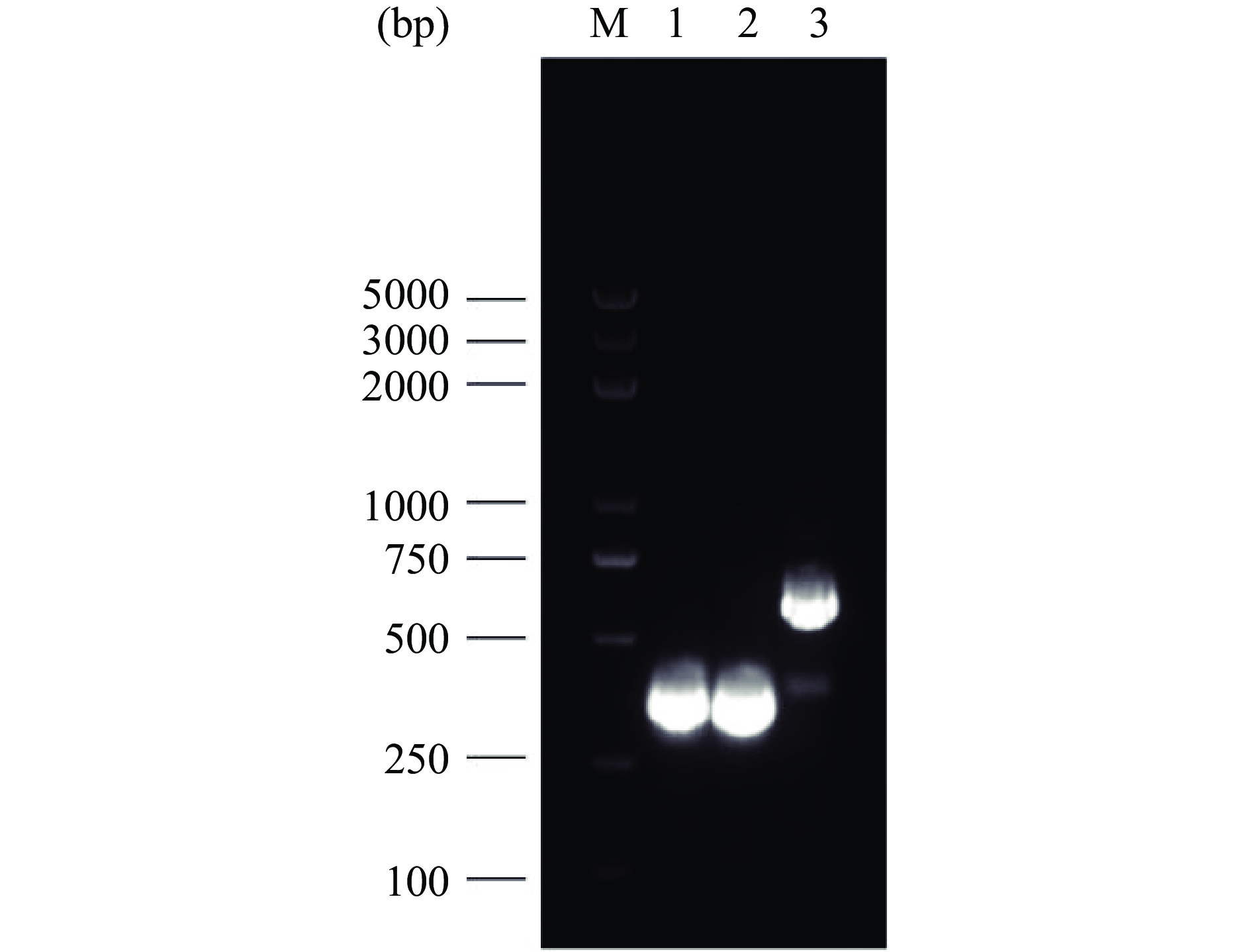
通过对S. cerevisiae CEN.PK2-1C基因组进行扩增获得三种不同启动子片段TEF1(424 bp)、ADH1(413 bp)、GAP(683 bp),经1.5%琼脂糖凝胶电泳验证,如图2所示,片段大小符合目标条带大小。
2.2 重组表达载体鉴定及重组菌构建
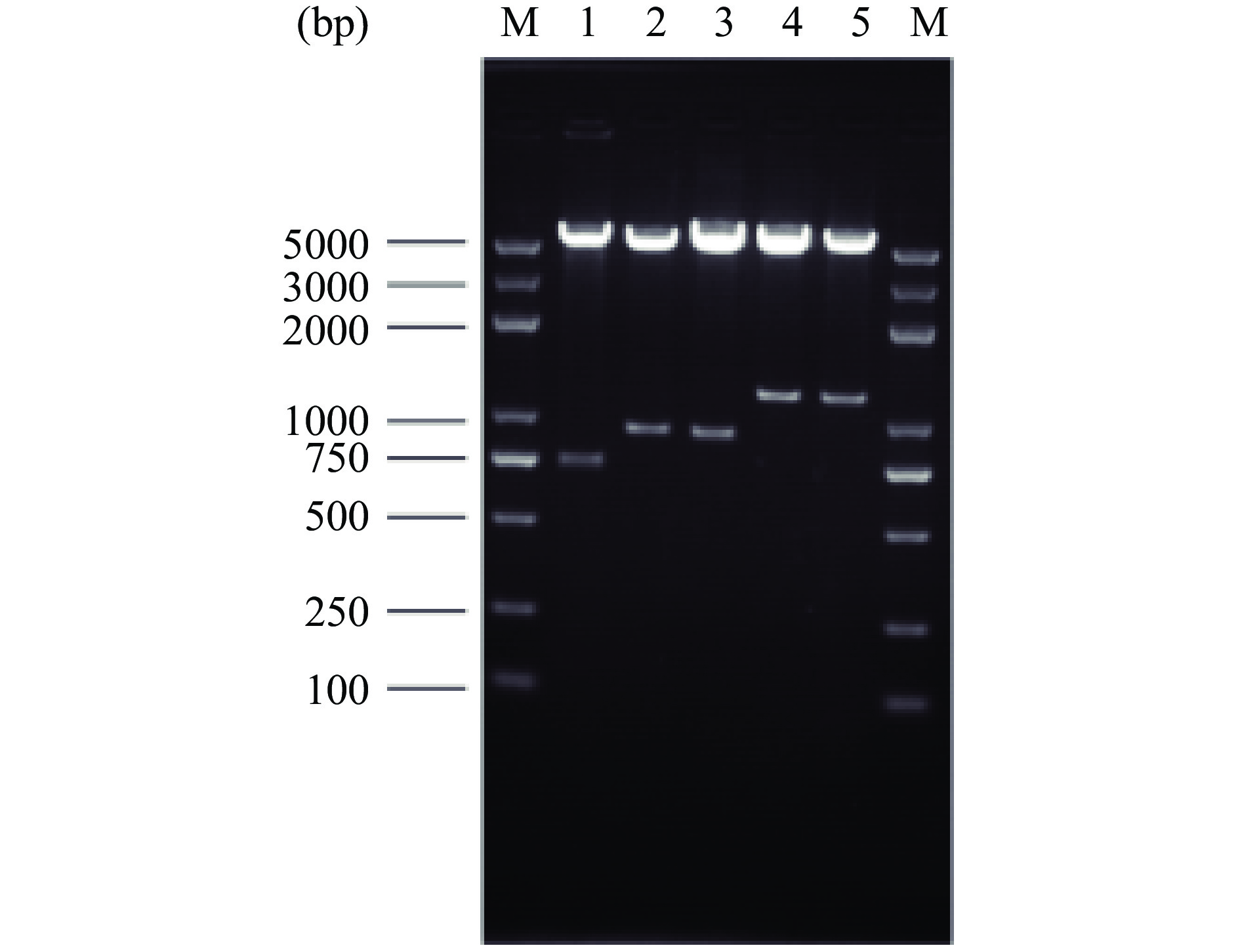
通过对重组转化大肠杆菌阳性克隆菌落PCR验证,提取阳性克隆重组质粒,EcoR Ⅰ和Sal Ⅰ酶切验证表达框TEF1-LegH(882 bp)、ADH1-LegH(871 bp)、GAP-LegH(1141 bp)、GAL1,10-LegH(1146 bp),经1.5%琼脂糖凝胶电泳,结果如图3所示。
由图3可见,重组表达载体成功转入大肠杆菌,片段大小符合目标条带大小。重组质粒送北京擎科生物科技有限公司测序,测序结果与设计序列一致,表明含不同启动子的LegH表达质粒构建成功。
将鉴定正确的重组表达载体转入酿酒酵母感受态细胞中,转化子通过菌落PCR验证,成功获得相应重组酿酒酵母表达菌株。
2.3 Western blot检测不同启动子LegH表达水平
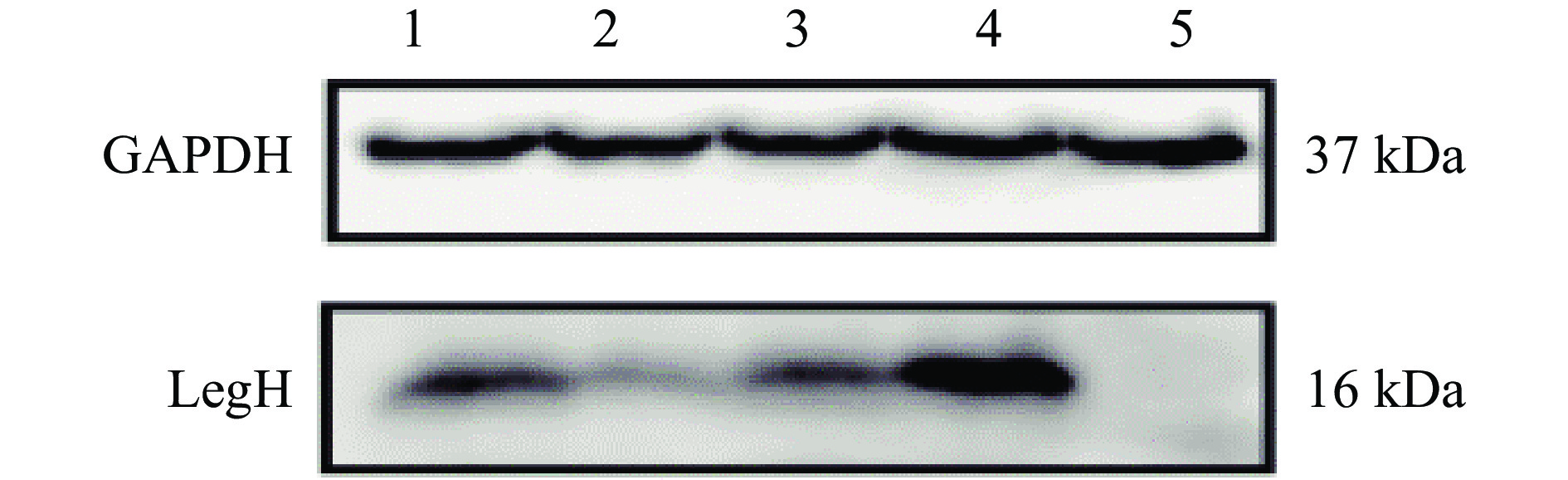
启动子的选择在基因转录起始过程中起到重要的调控作用,选择合适的启动子与外源基因适配对基因的高效表达十分重要。酿酒酵母表达系统常用的启动子主要分为诱导型启动子和组成型启动子两种。组成型启动子在启动转录起始时无需转录因子的参与,可以维持一定的基因转录水平,而诱导型启动子则受调控基因严格调控,基因表达需要添加特定诱导剂进行诱导表达[26]。根据表达需求选择合适的启动子对于外源基因的表达至关重要。本研究中选择酿酒酵母中较为常见的三种组成型强启动子(TEF1、ADH1、GAP)和诱导型强启动子GAL1,10分别表达LegH并进行比较,通过Western blot验证LegH蛋白表达情况,结果见图4和图5。
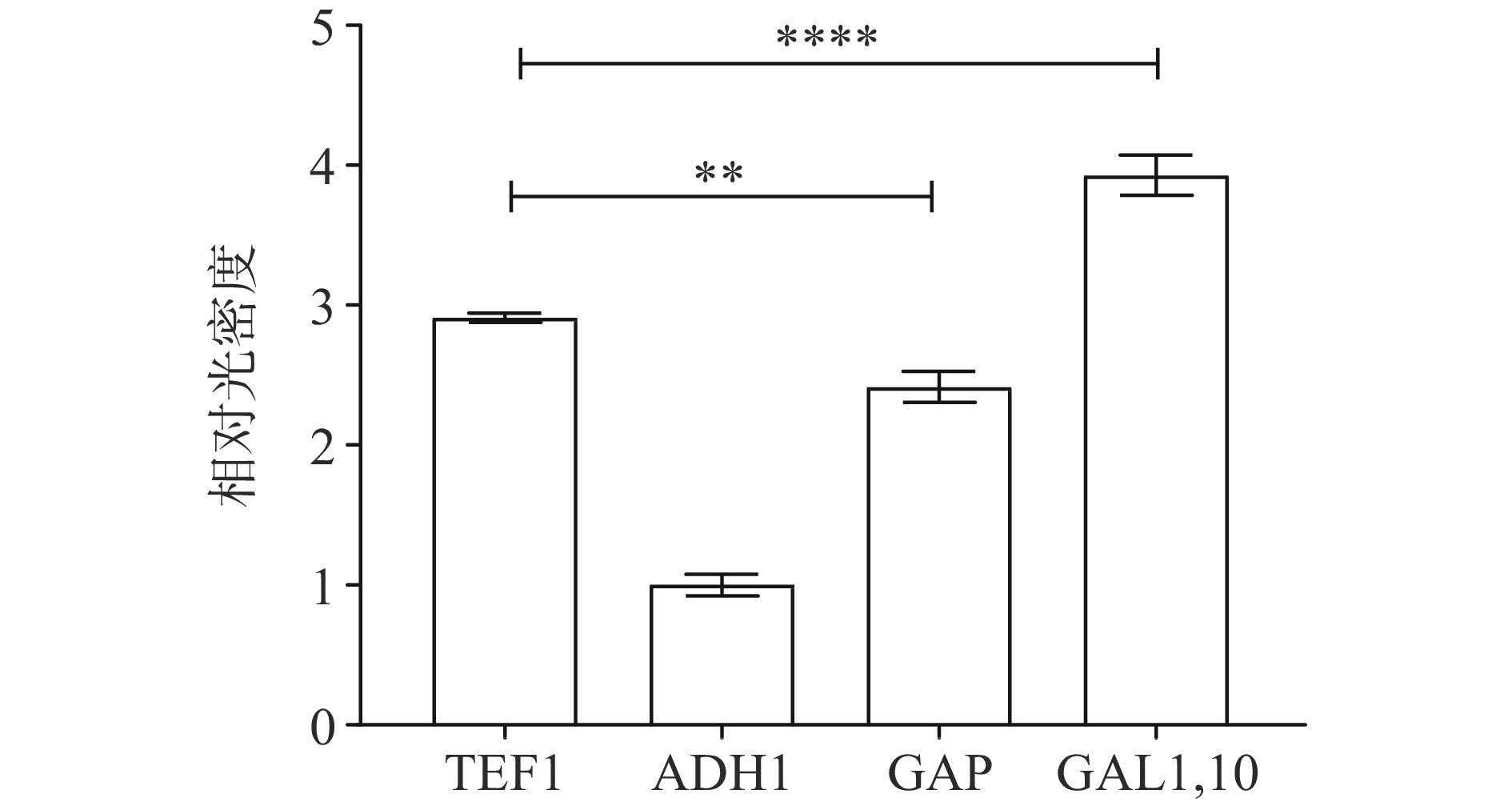
由图4可见,四种启动子在16 kDa处都存在明显特异性条带,且本底S. cerevisiae CEN.PK2-1C在目标位置无任何条带,蛋白大小与预期一致,说明在酿酒酵母中采用TEF1、ADH1、GAP、GAL1,10四种启动子均成功表达目的蛋白LegH。通过Image J灰度分析不同启动子表达LegH水平(见图5),可以发现诱导型启动子GAL1,10较三种组成型启动子TEF1、ADH1、GAP在表达LegH能力上具有显著优势,GAL1,10启动子较产量最低的ADH1启动子提升了3.93倍。在组成型启动子中,TEF1较优,是ADH1启动子的2.91倍,是GAP启动子的1.2倍。分析其原因,可能是由于过早质粒表达LegH对菌体生长具有一定负担,不利于细胞的增长。而诱导型启动子在葡萄糖存在的条件下,GAL1,10表达受到抑制,菌株正常生长,当培养基中葡萄糖消耗殆尽时,GAL1,10启动子被激活,在半乳糖的诱导下开始正常表达,此时细胞已经具备一定密度,蛋白的表达对细胞生长的影响不再明显,因此诱导型启动子对LegH表达具有一定优势。组成性启动子相对强度TEFp1>GAPp>ADH1p,这与Sun等[27]的研究结果一致。诱导型启动子在表达蛋白所展示出的优势也与邱玲等[28]在酿酒酵母中表达乙肝抗原时相同,但其组成型启动子相对强度结果显示ADH1p>TEF1p。因此,需要根据表达蛋白的不同进行启动子的优化选择,以调整转录强度进而提升目标物质的产量。
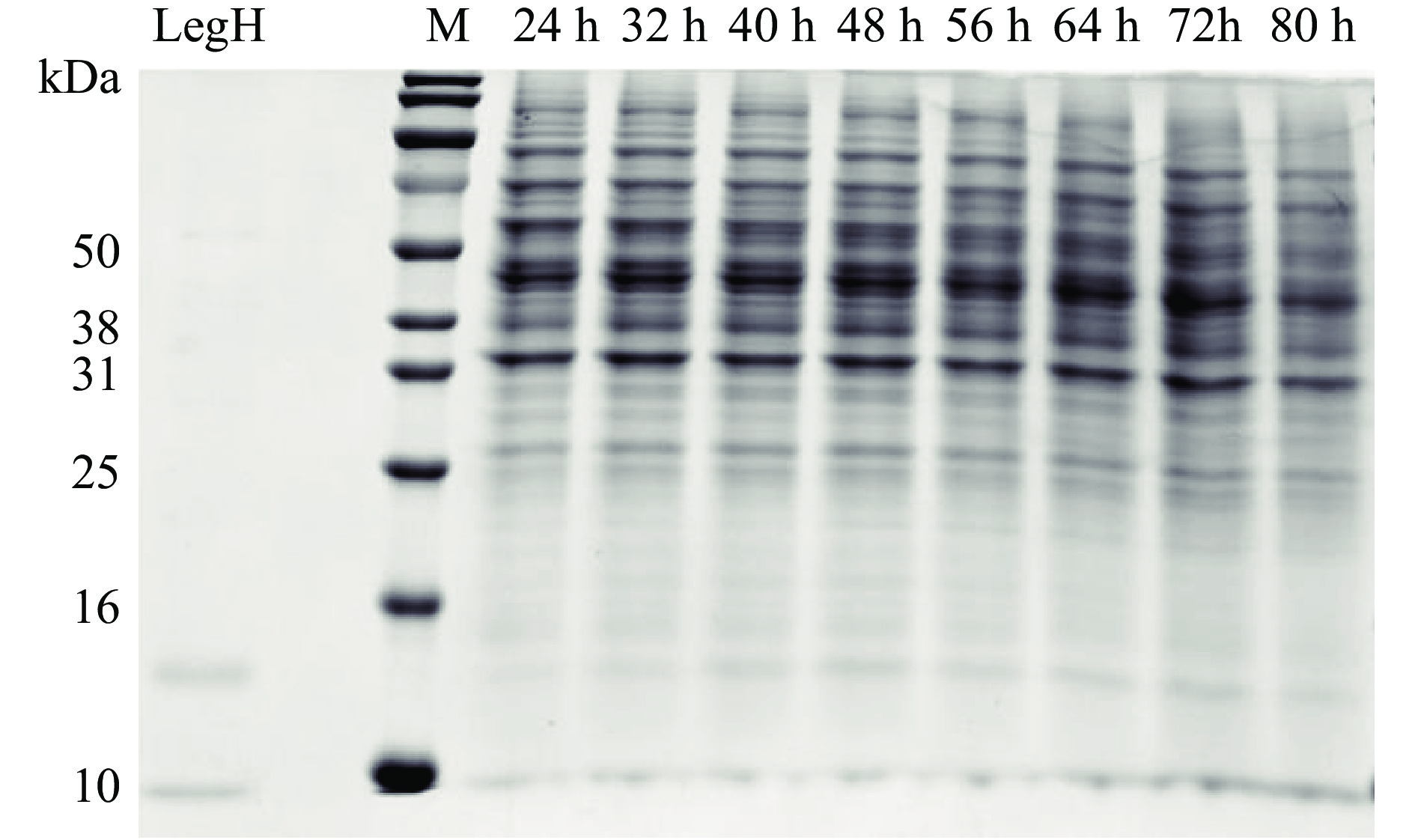
2.4 LegH表达结果
对重组酵母菌株在发酵培养基中进行发酵,在不同发酵时间测定菌体密度,以SDS-PAGE蛋白电泳检测目标蛋白表达情况,结果如图6和图7所示。由图6中可以看出,菌体在12~36 h菌体大量扩增,处于指数增长期,48 h后细胞增长速率缓慢,菌体密度趋于稳定。图7中发酵液SDS-PAGE蛋白电泳结果显示,随着发酵时间的增加,LegH的表达量呈上升趋势,在发酵48 h时表达量达到最高,随着发酵时间延长,LegH表达量没有明显提升,甚至有所降解,因此确定最佳发酵时间为48 h。
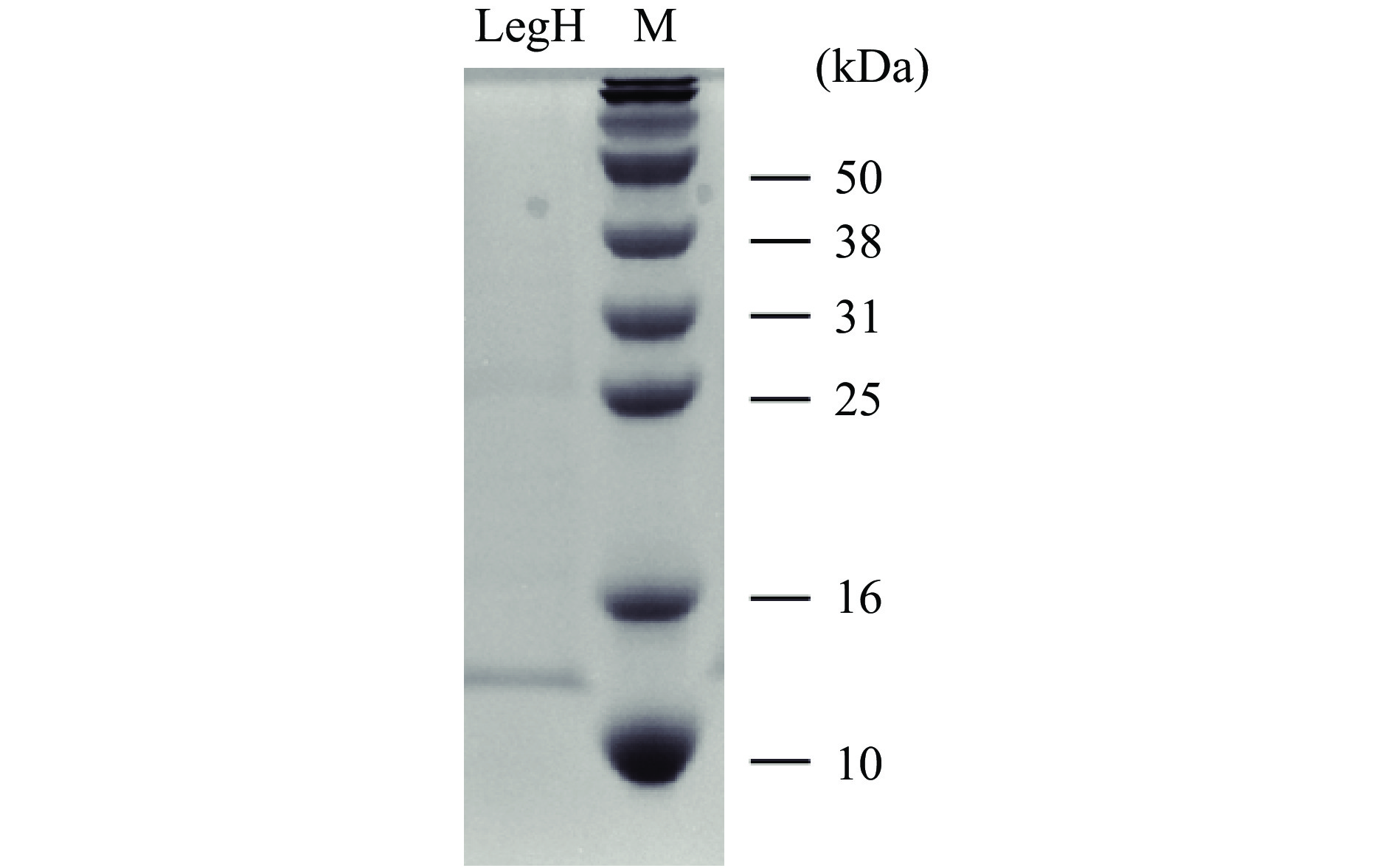
因蛋白表达量较低,SDS-PAGE电泳显示杂蛋白条带较多,直接对蛋白定量不准确,因此对发酵48 h的蛋白进行了浓缩纯化以更好地定量。
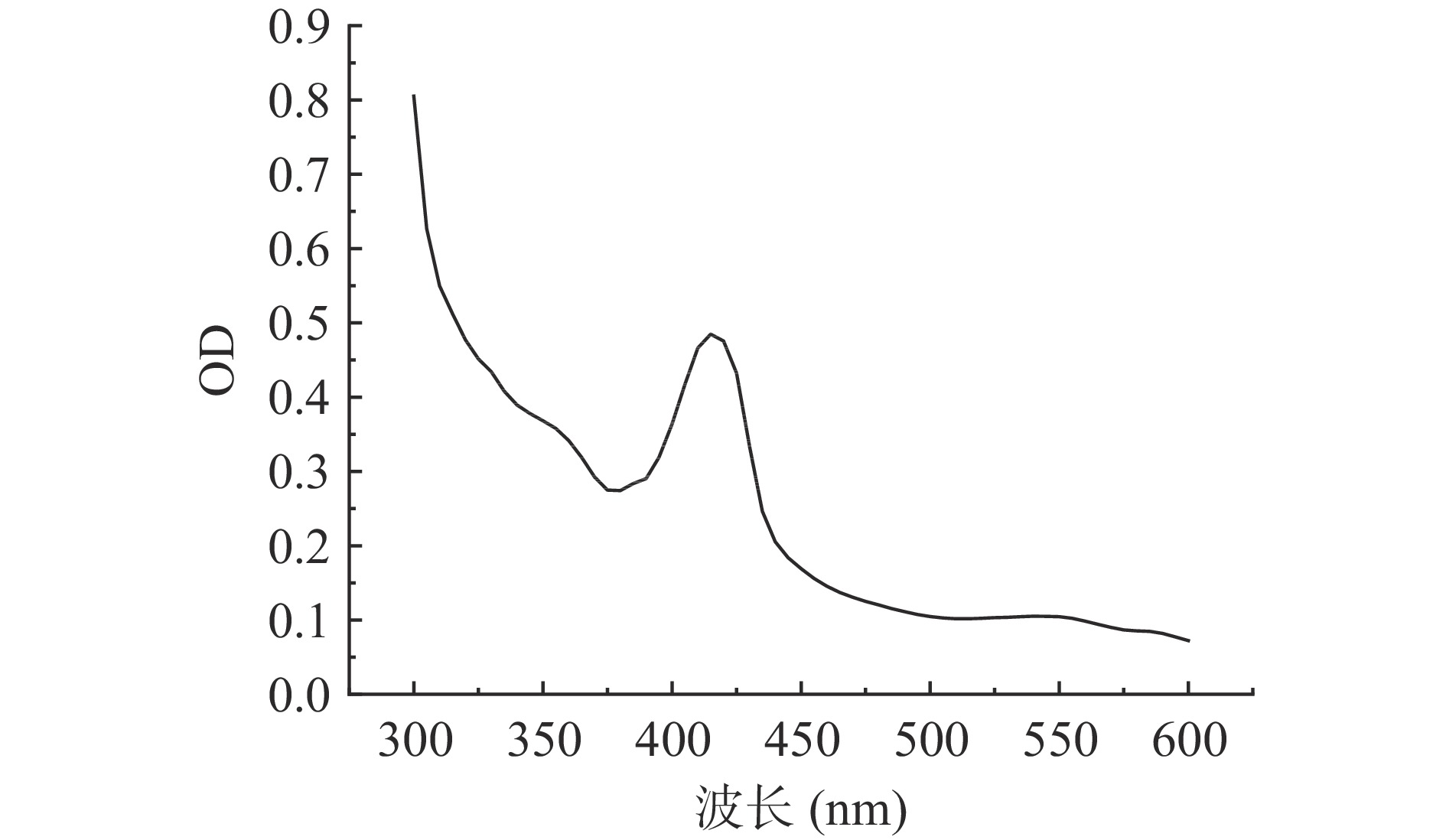
在进行重组质粒设计时LegH碳末端加有His纯化标签,因此可以通过镍柱对LegH进行亲和层析。在咪唑洗脱浓度为250 mmol/L的条件下获得了目标蛋白,蛋白经15% SDS-PAGE电泳验证,在目标区域出现明显条带,如图8所示。蛋白经全波段光谱扫描显示,在420 nm波长下有特征吸收峰,如图9所示,符合血红素辅基卟啉化合物的特征吸收[29-30]。蛋白分子量与通过氨基酸序列预测的一致,表明豆血红蛋白在酿酒酵母中成功表达。通过Bradford法测定蛋白浓度结合灰度分析,测得蛋白浓度达到698.33 mg/L,折算成发酵浓度为2.79 mg/L。该表达水平与现有报道的毕赤酵母菌株相比[8],尚有一定差距。但该水平仅是目前的初步研究结果,尚未进行发酵工艺优化,后续通过发酵优化以及相关代谢途径的强化(添加信号肽进行分泌型表达、构建血红素合成途径等),有望进一步提升菌株的表达水平。
3. 结论
本研究成功构建了豆血红蛋白酿酒酵母异源表达菌株,在不同启动子下实现了LegH的表达,其中诱导型启动子GAL1,10获得了较高表达水平,蛋白经镍柱浓缩纯化后,测得LegH浓度达到698.33 mg/L,折算成发酵浓度为2.79 mg/L。酿酒酵母作为一种GRAS生物,其在食品工业中应用的安全性是无法比拟的,经过深入研究,酿酒酵母有可能成为豆血红蛋白异源表达的又一途径。
-
表 1 本研究涉及的菌株信息
Table 1 Strains used in this study
菌株 基因型 来源 E. coli DH5α F-;ɸ80(lacZ)∆M15;∆(lacZYA-argF)U169;deoR;recA1;endA1;hsdR17(rK-,mK+); phoA;supE44λ-thi-1;gyrA96 relA1 Tsingke S. cerevisiae CEN.PK2-1C MATa leu2-3,112;trp1-289;ura3-52;his3Δ1 实验室保存 表 2 本研究涉及的基因
Table 2 Genes used in this study
基因 注释 编号 LegH Coding gene of the Soybean (Glycine max) leghemoglobin NM_001248319.3 TEF1p Promoter for translation elongation factor EF-1 alpha NM_001184177.1 ADH1p Promoter for alcohol dehydrogenase 1 NM_001183340.1 GAPp Promoter for glyceraldehyde-3-phosphate dehydrogenase NM_001179829.3 表 3 本研究设计的引物
Table 3 Primers designed in this study
引物 序列(5’-3’) S-LegH-F CGGGATCCGCCACCATGGGTGCTTTC
ACTGAAAAGCS-LegH-R CGGTCGACTTAGTGGTGGTGGTGGTGGTGGAA ADH1-EcoRI-F CCGAATTCCAACTTCTTTTCTTTTTTTTT
CTTTTCTCTCADH1-BamHI-R CGGGATCCAGTTGATTGTATGCTTGGTATAGC GAP-EcoRI-F CCGAATTCTCATTATCAATACTGCC
ATTTCAAAGAGAP-BamHI-R CGGGATCCTTTGTTTGTTTATGTGTGTTTATTCG TEF1-EcoRI-F CCGAATTCCCACACACCATAGCTTCAAAA TEF1-BamHI-R CGGGATCCCTTAGATTAGATTGCTATG
CTTTCTTTCpECS-TRP-EcoRI-R CGGAATTCCGCTCCAATTCAGCTGGC -
[1] JIN Y, HE X Y, ANDOH-KUMI K, et al. Evaluating potential risks of food allergy and toxicity of soy leghemoglobin expressed in Pichia pastoris[J]. Molecular Nutrition & Food Research,2018,62(1):13.
[2] APPLEBY C A. Leghemoglobin and rhizobium respiration[J]. Annual Review of Plant Physiology,1984,35(1):443−478. doi: 10.1146/annurev.pp.35.060184.002303
[3] HARGROVE M S, BARRY J K, BRUCKER E A, et al. Characterization of recombinant soybean leghemoglobin a and apolar distal histidine mutants[J]. Journal of Molecular Biology,1997,266(5):1032−1042. doi: 10.1006/jmbi.1996.0833
[4] SIMSA R, YUEN J, STOUT A, et al. Extracellular heme proteins influence bovine myosatellite cell proliferation and the color of cell-based meat[J]. Foods,2019,8(10):521. doi: 10.3390/foods8100521
[5] FRASER R Z, SHITUT M, AGRAWAL P, et al. Safety evaluation of soy leghemoglobin protein preparation derived from Pichia pastoris, intended for use as a flavor catalyst in plant-based meat[J]. International Journal of Toxicology,2018,37(3):241−262. doi: 10.1177/1091581818766318
[6] 周景文, 张国强, 赵鑫锐, 等. 未来食品的发展:植物蛋白肉与细胞培养肉[J]. 食品与生物技术学报,2020,39(10):1−8. [ZHOU Z W, ZHANG G Q, ZHAO X R, et al. Future of food: plant-based and cell-cultured meat[J]. Journal of Food Science and Technology,2020,39(10):1−8. doi: 10.3969/j.issn.1673-1689.2020.10.001 ZHOU Z W, ZHANG G Q, ZHAO X Y, et al. Future of food: plant-based and cell-cultured meat[J]. Journal of Food Science and Technology, 2020, 39(10): 1-8. doi: 10.3969/j.issn.1673-1689.2020.10.001
[7] 陈林杰, 薛常鲁, 苏悦, 等. 豆血红蛋白在毕赤酵母中的表达条件优化[J]. 微生物学通报,2022,49(6):2050−2061. [CHEN L J, XUE C L, SU Y, et al. Optimization of leghemoglobin expression conditions in Pichia pastoris[J]. Microbiology China,2022,49(6):2050−2061. doi: 10.13344/j.microbiol.china.210944 CHEN L J, XUE C L, SU Y, et al. Optimization of leghemoglobin expression conditions in Pichia pastoris[J]. Microbiology China, 2022, 49(6): 2050-2061. doi: 10.13344/j.microbiol.china.210944
[8] SHAO Y R, XUE C L, LIU W J, et al. High-level secretory production of leghemoglobin in Pichia pastoris through enhanced globin expression and heme biosynthesis[J]. Bioresource Technology,2022,363:127884. doi: 10.1016/j.biortech.2022.127884
[9] ARREDONDO-PETER R, MORAN J F, SARATH G, et al. Molecular cloning of the cowpea leghemoglobin II gene and expression of its cDNA in Escherichia coli (purification and characterization of the recombinant protein)[J]. Plant Physiology,1997,114(2):493−500. doi: 10.1104/pp.114.2.493
[10] LIU L F, MARTINEZ J L, LIU Z H, et al. Balanced globin protein expression and heme biosynthesis improve production of human hemoglobin in Saccharomyces cerevisiae[J]. Metabolic Engineering,2014,21:9−16. doi: 10.1016/j.ymben.2013.10.010
[11] ZHANG B H, ZHAO X R, WANG Z W, et al. Efficient secretory expression and purification of food-grade porcine myoglobin in Komagataella phaffii[J]. Journal of Agricultural and Food Chemistry,2021,69(35):10235−10245. doi: 10.1021/acs.jafc.1c04124
[12] ZHAO X R, ZHOU J W, DU G C, et al. Recent advances in the microbial synthesis of hemoglobin[J]. Trends in Biotechnology,2021,39(3):286−297. doi: 10.1016/j.tibtech.2020.08.004
[13] SUMAN S P, JOSEPH P. Myoglobin chemistry and meat color[J]. Annual Review of Food Science and Technology,2013,4(1):79−99. doi: 10.1146/annurev-food-030212-182623
[14] FRASER R, BROWN P O, KARR J, et al. Impossible Foods Inc. Methods and compositions for affecting the flavor and aroma profile of consumables: US, 9700067B2[P]. 2017−07−11.
[15] SHANKAR S, HOYT M A. Impossible Food Inc. Expression construction and methods of genetically engineering methylotrophic yeast: US, WO 2016/183163A1[P]. 2018−01−19.
[16] 苏悦. 微生物高效表达异源豆血红蛋白的研究[D]. 杭州: 浙江大学, 2020 SU Y. Study on efficient expression of heterologous leghemoglobin in microorganisms[D]. Hangzhou: Zhejiang University, 2020.
[17] CURRELL D L, LEVIN J. The oxidative effect of bacterial lipopolysaccharide on native and cross-linked human hemoglobin as a function of the structure of the lipopolysaccharide[J]. Febs Journal,2010,269(18):4635−4640.
[18] MARTINEZ J L, LIU L F, PETRANOVIC D, et al. Engineering the oxygen sensing regulation results in an enhanced recombinant human hemoglobin production by Saccharomyces cerevisiae[J]. Biotechnology and Bioengineering,2015,112(1):181−188. doi: 10.1002/bit.25347
[19] MOULD R M, HOFMANN O M, BRITTAIN T. Production of human embryonic haemoglobin (Gower II) in a yeast expression system[J]. Biochemical Journal,1994,298(3):619−622. doi: 10.1042/bj2980619
[20] BUISSON N, LABBE-BOIS R. Flavohemoglobin expression and function in Saccharomyces cerevisiae: No relationship with respiration and complex response to oxidative stress[J]. Journal of Biological Chemistry,1998,273(16):9527. doi: 10.1074/jbc.273.16.9527
[21] OUTTEN C E, CULOTTA V C. Alternative start sites in the Saccharomyces cerevisiae GLR1 gene are responsible for mitochondrial and cytosolic isoforms of glutathione reductase[J]. The Journal of Biological Chemistry,2004,279(9):7785−7791. doi: 10.1074/jbc.M312421200
[22] STUART J A, HARPER J A, BRINDLE K M, et al. Physiological levels of mammalian uncoupling protein 2 do not uncouple yeast mitochondria[J]. The Journal of Biological Chemistry,2001,276(21):18633−9. doi: 10.1074/jbc.M011566200
[23] GROTE A, HILLER K, SCHEER M, et al. JCat: A novel tool to adapt codon usage of a target gene to its potential expression host[J]. Nucleic Acids Research, 2005, 33(Web Server issue): W526.
[24] 安伯格. 酵母遗传学方法实验指南[M]. 第二版. 北京: 科学出版社, 2009: 98 ANBERG D C. Methods in yeast genetics[M]. Second edition. Beijing: Science Press, 2019: 98.
[25] JIN Q, PAN F, HU C F, et al. Secretory production of spider silk proteins in metabolically engineered Corynebacterium glutamicum for spinning into tough fibers[J]. Metabolic Engineering,2022,70:102−114. doi: 10.1016/j.ymben.2022.01.009
[26] MNAIMNEH S, DAVIERWALA A P, HAYNES J, et al. Exploration of essential gene functions via titratable promoter alleles[J]. Cell,2004,118(1):31−44. doi: 10.1016/j.cell.2004.06.013
[27] SUN J, SHAO Z Y, ZHAO H, et al. Cloning and characterization of a panel of constitutive promoters for applications in pathway engineering in Saccharomyces cerevisiae[J]. Biotechnology & Bioengineering,2012,109(8):2082−2092.
[28] 邱玲, 钱俊佳, 康振, 等. 乙肝表面抗原在酿酒酵母中的异源表达[J]. 食品与生物技术学报,2015,34(9):906−913. [QIU L, QIAN J J, KANG C, et al. Heterologous expression of HBsAg in Saccharomyces Cerevisiae[J]. Journal of Food Science and Biotechnology,2015,34(9):906−913. doi: 10.3969/j.issn.1673-1689.2015.09.002 QIU L, QIAN J J, KANG C, et al. Heterologous expression of HBsAg in Saccharomyces Cerevisiae[J]. Journal of Food Science and Biotechnology, 2015, 34(9): 8. doi: 10.3969/j.issn.1673-1689.2015.09.002
[29] 夏炳乐, 李敏莉, 刘清亮, 等. 烟草过氧化物酶Ⅰ的紫外-可见吸收光谱研究[J]. 光谱学与光谱分析,2004,24(7):830−833. [XIA C L, LI M L, LIU Q L, et al. Uv-vis absorption spectral characteristics of tobacco peroxidase Ⅰ from nicotiana tabacum[J]. Spectroscopy and Spectral Analysis,2004,24(7):830−833. doi: 10.3321/j.issn:1000-0593.2004.07.017 XIA C L, LI M L, LIU Q L, et al. Uv-vis absorption spectral characteristics of tobacco peroxidase Ⅰ from nicotiana tabacum[J]. Spectroscopy and Spectral Analysis, 2004, 24(7): 4. doi: 10.3321/j.issn:1000-0593.2004.07.017
[30] DOMINGUES E, BRILLET T, VASSEUR C, et al. Construction of a new polycistronic vector for over-expression and rapid purification of human hemoglobin[J]. Plasmid,2009,61(1):71−77. doi: 10.1016/j.plasmid.2008.09.006





 下载:
下载:


 下载:
下载:



