Protective Effect of Sauchinone on Apoptosis and Oxidative Stress of Islet β Cells in STZ Induced Diabetic Mice
-
摘要: 目的:探讨三白草酮(Sauchinone,Sch)对链脲佐菌素(Streptozocin,STZ)糖尿病小鼠胰岛β细胞凋亡及氧化应激的保护作用及其机制。方法:将雄性BALB/C小鼠50只,随机取出8只为正常对照组,其余小鼠用40 mg/kg STZ腹腔注射造模。测空腹血糖确认造模成功的32只小鼠,平均分为模型组、Sch低剂量组、Sch高剂量组和二甲双胍阳性对照组。分组后Sch低剂量组和Sch高剂量组分别灌胃Sch 10和30 mg/kg/次,二甲双胍阳性对照组灌胃100 mg/kg/次,每日一次,连续给药4周。正常对照组和模型组灌胃相同体积的生理盐水。Sch给药过程中每周测定体重,末次给药12 h后测定空腹血糖、血清胰岛素浓度、胰岛素抵抗指数(Homeostasis model assessment insulin resistance,HOMA-IR)、血清TNF-α,IL-6含量;检测胰腺组织中丙二醛(MDA)含量、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性;Western blot法检测胰腺组织中Bcl-2、Caspase-3和NF-κB蛋白的表达。结果:与模型组比较,Sch高剂量组在给药第3周和第4周体重显著增加(P<0.05),Sch低剂量和高剂量组小鼠空腹血糖显著降低(P<0.05),血清胰岛素浓度显著升高,并有剂量依赖性(P<0.05),且胰岛素抵抗指数显著降低(P<0.05);血清炎症因子TNF-α,IL-6含量显著下降(P<0.05);胰腺组织中MDA降低,而SOD和GSH-Px活性显著升高,且有剂量依赖性(P<0.05)。胰腺组织中Bcl-2蛋白表达显著增多,Caspase-3和NF-κB蛋白表达显著下调,并且有剂量依赖性(P<0.05)。结论:三白草酮具有保护糖尿病小鼠胰岛β细胞的作用,其机制可能通过抗炎症、抗氧化应激以及抑制凋亡所介导。Abstract: Objective: To investigate the protective effect of sauchinone (Sch) on apoptosis and oxidative stress of pancreatic β-cells in Streptozocin (STZ)-induced diabetic mice and its relevant mechanisms. Methods: Among 50 male BALB/C mice, 8 mice were randomly selected and grouped to be the normal control group, and the other mice were intraperitoneally received 40 mg/kg STZ. After the confirmation of the onset of diabetes mellitus in 32 mice by measuring the fasting blood glucose level (FBGL), the mice were evenly divided into the model group, low-dose Sch group, high-dose Sch group and metformin-treated positive control group. And the mice in low-dose Sch group and high-dose Sch group were respectively gavaged with 10 or 30 mg/kg Sch, and the mice in metformin-treated positive control group were gavaged with 100 mg/kg metformin once a day for 4 weeks, while the mice in the normal control group and the model group were gavaged with the same volume of saline. During the treatment period, the body weight of each mouse was weekly checked, and at 12 h after the last dosing, the FBGL, the serum insulin concentration, the homeostasis model assessment insulin resistance (HOMA-IR), the serum TNF-α and IL-6 levels were determined. The malondialdehyde (MDA) concentration, the superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) activities in pancreatic tissues were measured. Moreover, the pancreatic protein expressions of Bcl-2, Caspase-3 and NF-κB were detected by Western blot. Results: Compared with the model group, the body weights in the high-dose Sch groups checked on the 3rd and 4th week were significantly increased (P<0.05). The FBGL and the serum insulin concentration in Sch-treated groups rose significantly in a dose-dependent manner (P<0.05). The HOMA-IR was significantly decreased (P<0.05). The levels of TNF-α and IL-6 in serum were significantly decreased (P<0.05). The MDA concentrations in the Sch-treated pancreatic tissues decreased, while the SOD and GSH-Px activities increased significantly in a dose-dependent manner (P<0.05). Additionally, the Sch treatments significantly raised the pancreatic Bcl-2 protein expression while lowed the pancreatic Caspase-3 and NF-κB protein expressions in a dose-dependent manner compared with the model group (P<0.05). Conclusions: Sch protects diabetic mice islet β cells, and the mechanism may be mediated by its anti-inflammation and anti-oxidative stress as well as anti-apoptosis actions.
-
Keywords:
- sauchinone /
- diabetic mice /
- islet β cells /
- apoptosis /
- oxidative stress
-
糖尿病(Diabetes mellitus,DM)已成为威胁人类健康的慢性代谢性疾病,而中国是全球糖尿病患者数最多的国家,其中2型糖尿病(Type 2 diabetes mellitus,T2DM)是最常见的类型[1-3]。其发病机制复杂,认为胰岛β细胞损伤导致其功能衰竭和胰岛素抵抗是T2DM发病的中心环节[4-5]。氧化应激是T2DM发生发展的重要因素。长期高糖环境使胰岛β细胞发生氧化应激导致机体氧化系统与抗氧化系统失衡,自由基过度释放诱导胰岛β细胞凋亡减少胰岛素分泌。研究表明抑制胰岛β细胞氧化应激和凋亡是控制糖尿病发展的有效治疗手段[6-8]。基于复杂的发病机制临床上尚无治疗效果良好的药物,晚期会带来严重的并发症。
三白草(Saururus chinensisi(Lour.)Baill),又叫塘边藕,是我国民间广泛利用的药食两用植物,含有木脂素类、黄酮类、多糖类等成分[9-11]。三白草酮(Sauchinone,Sch)是三白草中提取的单体类化合物,具有清热解毒、消肿利尿、抗炎等众多的药理活性,它能抑制ROS的增生,清除过量自由基,通过抗氧化、抗炎机制对一些肿瘤和炎症性疾病具有良好的治疗作用[12-13]。然而目前Sch对于降糖作用及其机制的研究限于起步阶段,利用体内实验对氧化应激与凋亡等途径的调控及其机制的实验尚未有深入的研究。本研究利用STZ诱导糖尿病小鼠模型,观察氧化应激指标和凋亡的变化,探讨三白草酮对胰岛β细胞的保护作用及其机制,为临床上对糖尿病治疗药物的中药研发提供可靠的基础实验依据。
1. 材料与方法
1.1 材料与仪器
小鼠 随机选取体重在8周龄25~28 g,SPF级雄性BALB/C小鼠50只,由齐齐哈尔医学院动物实验中心提供;实验动物饲养在恒温恒湿的独立通气系统中,昼夜日光节律,室温(22±1)℃,湿度45%~55%,实验期间饮食饮水自由。实验动物使用许可证:SYXK(黑)2016-001。本实验已通过齐齐哈尔医学院实验动物伦理委员会批准,并所有操作均按照相关指南执行。小鼠普通标准饲料(蛋白25%、碳水化合物55%、脂肪5%、辅料15%),由齐齐哈尔医学院实验动物中心提供;三白草酮(纯度>98%) 湖州展舒科技有限公司(CAS号:177931-17-8);高糖高脂饲料 武汉亚法生物技术公司(批号040508);STZ 美国Sigma公司(S0130-100);MDA、SOD、GSH-Px试剂盒 碧云天生物技术公司;血清胰岛素ELISA试剂盒 南京建成生物工程研究所;TNF-α、IL-6 上海酶联生物科技有限公司;Bcl-2、Caspase-3、NF-κB抗体 美国Cell Signaling Technology。
Tecan Infinite® 200 Pro多功能酶标仪 奥地利Tecan公司;1658001小型垂直电泳槽、1703935电泳转印系统 美国BIO-RAD公司;UVP Chemstudio touch多功能成像仪 德国Analytikjena公司;ACCU-CHEK Active罗氏血糖仪 德国罗氏诊断有限公司。
1.2 实验方法
1.2.1 实验分组、模型建立、给药
将雄性BALB/C小鼠50只适应环境饲养7 d,随机取出8只为正常对照组,给予普通标准饲料喂养;其余小鼠用高糖高脂喂养2周后,禁食8 h,用0.1 mmol/L柠檬酸钠缓冲液将STZ配成1%的溶液,按40 mg/kg腹腔注射;正常对照组小鼠注射等量柠檬酸钠缓冲液。72 h后用血糖测试仪取尾静脉血测空腹血糖,大于11.1 mmol/L作为糖尿病小鼠模型[3,14]。造模后继续给予高糖高脂喂养2周后,取持续维持空腹血糖大于11.1 mmol/L小鼠,随机分为模型组、Sch低剂量组、Sch高剂量组、二甲双胍阳性对照组(Metformin),每组8只,立即进行灌胃给药。Sch剂量按照人-小鼠体表面积换算系数10计算等效药物剂量[15],Sch低剂量组和Sch高剂量组分别每日灌胃一次Sch 10和30 mg/kg,二甲双胍阳性对照组每日灌胃一次100 mg/kg/次,连续给药4周。正常对照组和模型组灌胃等量无菌生理盐水。
1.2.2 各组小鼠体重的测定
实验期间每天观察小鼠的进食、排尿、生长、活动等一般情况。Sch给药开始后每周测定一次各组小鼠的体重。
1.2.3 各组小鼠空腹血糖(Fasting blood glucose,FBG)、血清胰岛素(Fasting insulin,FINS)、炎症因子TNF-α、IL-6浓度的测定
末次给药后禁食12 h, 利用血糖测试仪取尾静脉血测定FBG。用5%水合氯醛腹腔注射麻醉小鼠后从眼眶静脉丛采血,3000 r/min离心15 min收集血清。按照试剂盒说明用酶联免疫吸附(ELISA)法检测FINS、TNF-α和IL-6浓度。胰岛素抵抗指数(Homeostasis model assessment insulin resistance,HOMA-IR)按以下公式计算。
HOMA−IR=空腹胰岛素(mIU/L)×空腹血糖(mmol/L)22.5 1.2.4 胰腺组织中氧化应激指标的检测
取胰腺组织充分研磨后,用RIPA蛋白裂解液提取总蛋白,3000 r/min离心15 min取上清液,用试剂盒检测胰腺组织中的超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)含量。
1.2.5 Western Blot检测胰腺组织Bcl-2、Caspase-3和NF-κB蛋白表达
将胰腺组织充分研磨后,利用RIPA蛋白裂解液(含有蛋白酶抑制剂)进行匀浆离心,然后利用上清液按照蛋白浓度检测试剂盒的说明进行蛋白质定量。每孔上样30 μg蛋白质,并按照常规操作方法进行电泳、转膜、封闭后加入Bcl-2、Caspase-3和NF-κB一抗4 ℃孵育24 h,再加入二抗孵育1 h后,用ECL显色。利用图像分析系统扫描,GAPDH作为内参对照。
1.3 数据处理
采用GraphPad Prism 6.02统计软件进行数据分析,数据均采用均数±标准差(Mean±SD)表示,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用Newman–Keuls法进行检验,P<0.05为差异有统计学意义。
2. 结果与分析
2.1 三白草酮对糖尿病小鼠体重的影响
与正常对照组相比,模型组小鼠出现多饮、多食、多尿现象,各组小鼠的体重变化如表1所示,STZ注射造模后各组小鼠体重与正常对照组比较无显著性差异(P>0.05),Sch给药过程中正常对照组小鼠体重逐渐增加而模型组小鼠体重减少,且在给药第2周开始,模型组小鼠体重显著减少(P<0.05),第3周、第4周极显著减少(P<0.01)。与模型组比较,Sch低剂量组、Sch高剂量组、Metformin组小鼠“三多一少”症状显著缓解,体重的增加速度比较缓慢,Sch高剂量组在第3周和第4周体重增加的速度快于其他组,但Sch低剂量、高剂量组对体重的变化无显著剂量依赖性(P>0.05)。此结果说明高糖高脂联合STZ诱导糖尿病模型成功,同时Sch对体重的增加有促进作用。
表 1 Sch对糖尿病小鼠体重的影响(n=8)Table 1. Effect of sauchinone on body weight in diabetic mice (n=8)组别 0周(g) 1周(g) 2周(g) 3周(g) 4周(g) 正常对照组 22.93±2.88 23.17±2.95 23.85±2.79 24.89±2.44 26.98±2.63 模型组 23.54±2.61 22.85±1.96 20.17±2.85# 18.23±2.05 ## 17.86±1.95 ## Sch低剂量组 22.58±2.43 20.26±2.15 19.16±1.89 20.58±2.65 22.78±2.83* Sch高剂量组 21.38±2.12 21.78±2.36 22.75±2.92 23.54±2.94** 25.84±2.48** 二甲双胍阳性对照组 22.76±2.32 22.95±2.92 22.69±2.76 24.31±2.18** 25.14.±2.52** 注:与正常组比较,##表示有极显著差异(P<0.01);与模型组比较,*表示有显著差异(P<0.05);**表示有极显著差异(P<0.01);表2~表4。 2.2 三白草酮对糖尿病小鼠空腹血糖(FBG)、血清胰岛素(FINS)、胰岛素抵抗的影响
各组小鼠FBG、FINS、HOMA-IR的变化如表2所示,与正常对照组比较,模型组小鼠FBG显著增高(P<0.05),FINS水平明显降低而胰岛素抵抗指数极显著升高(P<0.01);与模型组比较,Sch低剂量组小鼠FBG显著下降、FINS水平升高且胰岛素抵抗显著减弱(P<0.05),Sch高剂量组、Metformin组小鼠FBG极显著下降,FINS水平极显著升高而胰岛素抵抗指数呈极显著下降趋势(P<0.01);Sch低剂量组和Sch高剂量组FBG(P<0.01)和FINS(P<0.05)水平均有剂量依赖性。以上结果可知,STZ对诱导糖尿病造模后,小鼠胰岛β细胞损伤使胰岛素分泌减少,诱导胰岛素抵抗性导致显著的血糖升高。利用Sch低剂量、高剂量干预后血糖显著控制而且胰岛素水平有显著升高趋势,表明Sch具有一定的降糖作用与二甲双胍阳性对照组效果接近,而且有剂量依赖性,可推测Sch可以改善胰岛β细胞功能降低糖尿病小鼠胰岛素抵抗性,提高胰岛素敏感性,增加胰岛β细胞的胰岛素分泌功能。
表 2 Sch对糖尿病小鼠FBG、FINS、胰岛素抵抗的影响(n=8)Table 2. Effect of sauchinone on fasting blood glucose, fasting insulin and insulin resistance in diabetic mice (n=8)组别 FBG(mmol/L) FINS(mIU/L) HOMA−IR 正常对照组 6.25±0.83 26.32±3.28 7.31±0.95 模型组 18.74±2.33## 14.67±2.85## 12.22±1.94## Sch低剂量组 12.78±1.85* 18.29±2.08* 10.39±1.23* Sch高剂量组 8.99±1.17**&& 22.48±2.97**& 8.98±0.97** 二甲双胍阳性对照组 7.88±0.92** 22.69±2.84** 7.95±0.99** 注:与Sch低剂量组比较,&表示有显著差异(P<0.05),&&表示有极显著差异(P<0.01);表4同。 2.3 三白草酮对糖尿病小鼠血清炎症因子表达的影响
糖尿病的发生过程中存在明显的炎症反应,TNF-α和IL-6是体内主要的炎症因子,会诱导胰岛素抵抗的同时降低胰岛β细胞对葡萄糖的敏感性,促进胰岛β细胞的损伤导致细胞凋亡的发生最终影响胰岛素分泌[16]。ELISA检测各组小鼠血清中TNF-α和IL-6变化如表3所示,与正常对照组比较,模型组小鼠血清TNF-α和IL-6极显著升高(P<0.01);与模型组比较,Sch低剂量组TNF-α和IL-6水平显著降低(P<0.05),Sch高剂量组小鼠血清中TNF-α和IL-6水平极显著降低(P<0.01);Sch低剂量组和Sch高剂量组血清中TNF-α和IL-6的变化无剂量依赖趋势(P>0.05)。此结果说明,在糖尿病的发病过程中炎症因子TNF-α和IL-6的表达增高会促进机体炎症的发生,引起胰腺组织的炎症损伤影响胰岛β细胞的胰岛素分泌功能,可推断炎症反应在糖尿病发病机制中的重要作用。Sch的干预可以抑制体内炎症反应减轻胰岛β细胞的损伤,抑制胰岛β细胞的凋亡而保护胰岛β细胞。
表 3 Sch对糖尿病小鼠血清TNF-α和IL-6水平的影响(n=8)Table 3. Effect of sauchinone on the serum concentrations of TNF-α and IL-6 in diabetic mice (n=8)组别 TNF-α(pg/mL) IL-6(pg/mL) 正常对照组 81.34±8.25 64.77±7.56 模型组 105.36±15.23## 83.83±8.57## Sch低剂量组 88.59±10.43* 70.61±7.56* Sch高剂量组 84.72±9.05** 68.36±7.55** 二甲双胍阳性对照组 91.78±10.06 75.88±8.07 2.4 三白草酮对糖尿病小鼠胰腺组织氧化应激指标的影响
长期的高糖环境能诱发体内氧化应激状态。MDA是评价体内氧化应激反应的主要指标,具有强烈的细胞毒性,可以反映氧化应激的强度以及细胞损伤的程度。SOD是一种抗氧化酶,能清除体内产生的自由基,具有抗氧化作用。GSH-Px是一种抗氧化物分解酶,以GSH为底物与SOD协同清除体内的各种氧自由基,使细胞免受氧化损伤而保护细胞的作用[17-18]。各组小鼠胰腺组织中氧化应激指标的变化如表4所示,与正常对照组比较,模型组小鼠胰腺组织MDA水平极显著升高,而SOD和GSH-Px活性极显著降低(P<0.01);与模型组比较,Sch低剂量组小鼠胰腺组织中MDA水平显著降低,而SOD和GSH-Px活性显著升高(P<0.05),Sch高剂组MDA水平极显著降低,而SOD和GSH-Px活性极显著升高(P<0.01);Sch低剂量组和Sch高剂量组小鼠胰腺组织中MDA、SOD和GSH-Px活性的变化均有剂量依赖性,具有极显著差异(P<0.01)。因此可以认为,体内在氧化应激状态下,会失去机体中氧化与抗氧化系统的动态平衡,诱导胰岛β细胞的应激损伤,破坏胰岛细胞功能,减少胰岛素分泌,能进一步说明糖尿病发病机制中氧化应激的重要作用。Sch干预后体内MDA、SOD、GSH-Px等氧化与抗氧化指标明显得到改善,因此能够缓解体内氧化应激状态,提高抗氧化能力,减轻胰岛β细胞的损伤。
表 4 Sch对糖尿病小鼠胰腺组织MDA、SOD和GSH-Px活性的影响(n=8)Table 4. Effect of sauchinone on pancreatic MDA, SOD and GSH-Px in diabetic mice (n=8)组别 MDA(µmol/g) SOD(U/mg) GSH-Px(U/mg) 正常对照组 4.78±0.58 84.62±9.28 96.54±10.25 模型组 9.85±1.25## 42.75±5.87## 67.81±7.83## Sch低剂量组 8.03±0.91* 55.28±6.49* 81.64±8.15* Sch高剂量组 5.69±0.6.2**&& 72.27±9.42**&& 91.56±10.28**&& 二甲双胍阳性对照组 6.89±0.86** 68.33±8.17** 75.77±9.25 2.5 三白草酮对糖尿病小鼠胰腺组织中Bcl-2、Caspase-3、NF-κB蛋白表达的影响
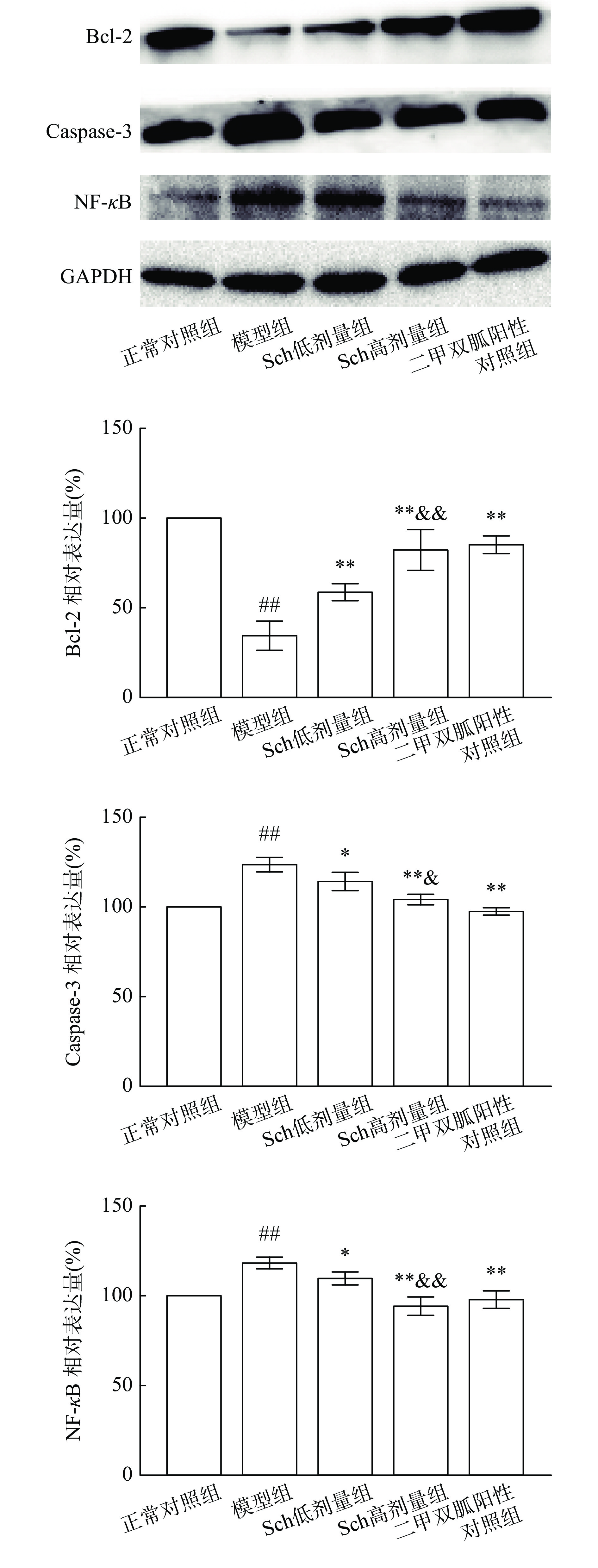
氧化应激与炎症会导致胰岛β细胞的损伤与凋亡。Caspase和Bcl-2蛋白家族是细胞凋亡过程中最关键的调控因子。Caspase-3是细胞凋亡的关键因子,是细胞凋亡发生的不可逆标志,Bcl-2蛋白在凋亡的发生过程中发挥抑制凋亡的作用,NF-κB是与细胞的生长、分化、凋亡、炎症等相关的重要调控因子,被激活后可以促进各种炎症因子的表达和氧化应激的产生,导致细胞的凋亡[19-21]。Western blot检测各组小鼠胰腺组织中相关蛋白表达结果如图1所示,与正常对照组比较,模型组Bcl-2表达极显著减少,而Caspase-3、NF-κB蛋白表达极显著增加(P<0.01);与模型组相比较,Sch低剂量组胰腺组织中Bcl-2蛋白表达极显著增高(P<0.01),Caspase-3、NF-κB蛋白表达显著减少(P<0.05),而Sch高剂量组Bcl-2蛋白表达极显著增高,Caspase-3、NF-κB蛋白表达极显著减少(P<0.01);Sch低剂量组和Sch高剂量组比较, Caspase-3蛋白表达有剂量依赖性,有显著差异( P<0.05)而Bcl-2、NF-κB蛋白表达剂量依赖性具有极显著差异( P<0.01)。由此可以说明,高糖环境容易导致炎症和氧化应激使胰岛细胞损伤产生胰岛素抵抗,影响胰岛细胞的功能逐渐诱导β细胞凋亡,凋亡相关蛋白的表达与糖尿病发病机制密切相关。
3. 讨论与结论
糖尿病(Diabetes Mellitus,DM)是由于遗传以及体内外各种因素而导致的复杂的内分泌代谢性疾病,是全球范围内危害人类健康的三大疾病之一,而且发病率逐年增高,给社会和家庭带来严重的负担。其中90%以上为T2DM[1]。因此,目前对T2DM发病机制及其治疗的研究是众多学者关注的热点问题。首先,本研究利用STZ诱导T2DM小鼠模型后,检测小鼠的体重等一般状况,FBG、FINS和胰岛素抵抗指数等生化指标,成功得出稳定的糖尿病动物模型,并且用Sch干预后发现Sch对糖尿病小鼠胰岛β细胞具有明显的保护作用。
很多研究认为二甲双胍是临床上常用的糖尿病治疗药物,虽然降糖效果良好,但是长期服用具有明显的胃肠道刺激作用。因此,降糖作用显著同时没有副作用的糖尿病治疗药物的研发具有非常重要的临床意义[22]。本研究发现,Sch低剂量和高剂量干预显著降低糖尿病小鼠FBG,分别降低31.8%和52.03%,增加胰岛素分泌同时改善胰岛素抵抗作用。因此Sch有显著的降血糖作用且对胰岛β细胞具有保护作用,但是目前对其机制没有详细而系统的解释。糖尿病的发病机制非常复杂,与多种因素有关。其中氧化应激与凋亡导致胰岛β细胞功能降低是重要发病机制[7]。长期的高血糖诱导氧化应激状态,体内产生过多的ROS,使机体对抗氧化功能的负荷过重,最终导致体内氧化与抗氧化调节失衡,从而造成蛋白质、脂类、核酸等分子的过度氧化影响胰岛β细胞的正常功能,导致胰岛β细胞损伤和胰岛素抵抗。因此目前认为氧化应激是糖尿病及其并发症发生发展的关键机制之一[23-24]。本研究发现,糖尿病小鼠胰腺组织中MDA明显增多,而抗氧化酶SOD和GSH-Px活性明显降低,说明高糖导致体内氧自由基的聚集使脂质发生过氧化,同时体内抗氧化酶的活性降低促进氧自由基的堆积,加快细胞的损伤,符合氧化与抗氧化失去平衡导致细胞自我保护机制破坏造成组织损伤的理论[8,18]。本研究发现Sch干预后可以有效改善胰岛细胞的氧化应激状态。近年研究表明,三白草的不同成分对糖尿病动物模型中有明显降血糖的作用,通过对氧化与抗氧化指标的作用,改善胰岛β细胞的功能[25-26]。
氧化应激状态下产生的过多的ROS还可以激活细胞凋亡信号,发生胰岛β细胞凋亡,减少胰岛素分泌,产生胰岛素抵抗。细胞凋亡是由多种基因调控的细胞程序性死亡过程,与细胞内胞质、线粒体以及内质网的多种信号通路相关。其中Caspase家族和Bcl-2家族是最常见的调控因子。Caspases在体内维持内稳态中发挥关键作用,控制细胞凋亡和炎症等重要过程。目前认为Caspase家族是细胞凋亡过程中发挥主要作用的蛋白质,其中Caspase-3起关键作用[27-28]。当细胞受到凋亡刺激后立即激活并活化相关信号通路诱导细胞进入凋亡阶段。Bcl-2家族蛋白激活内源性凋亡途径,诱导细胞的凋亡。Bcl-2蛋白定位于细胞内膜、内质网和线粒体,一些家族成员在细胞死亡的刺激下从细胞质移位到线粒体。Bcl-2的家族中有促进凋亡蛋白和抑凋亡蛋白组成,其中Bcl-2是目前认为最普遍的抑制凋亡的蛋白,其表达降低与细胞凋亡的加快有密切相关[29]。一些文献报道显示,糖尿病大鼠胰腺组织中Bax/Bcl-2及Caspase-3水平升高,如果上调抗凋亡基因Bcl-2的表达水平,能有效抑制Caspase-3的表达水平,可以降低细胞凋亡[14,30]。
NF-κB是一种核转录因子,参与各种细胞的增殖分化以及免疫应答相关的信号通路,在细胞凋亡的过程中起重要的调节作用。在DM的发病过程中,高血糖导致细胞内ROS的含量增多,激活细胞内的NF-κB,会破坏NF-κB与其他各种核转录因子的相对稳定和动态平衡,激活IκB激酶(IKK),使之发生磷酸化导致与NF-κB解离,游离的NF-κB进入细胞核内启动炎症因子TNF-α和IL-6等的表达[21,31]。TNF-α和IL-6是炎症反应中最重要的炎性介质,也是外源性激活细胞内凋亡的细胞因子,能加快胰岛β细胞凋亡的同时促进胰腺组织的炎症损伤,诱导胰岛素抵抗[32-33]。本研究结果发现,模型组小鼠胰腺组织中Bcl-2蛋白表达明显减少而Caspase-3、NF-κB蛋白表达明显升高,同时血清中炎症因子的表达也明显增高,此结果说明凋亡可以诱导胰岛β细胞损伤紊乱体内糖脂代谢使胰岛素分泌减少FBG升高,产生明显的胰岛素抵抗。
糖尿病是病因复杂的代谢性疾病,长期的高血糖导致糖代谢的紊乱会影响脂类和蛋白质等营养物质的代谢,没有及时调整健康的膳食环境或治疗不当容易诱发严重的并发症。因此在日常生活中,利用食品或保健品的多途径、多靶点和多系统的作用特点,开发有效的调节糖代谢的食品资源来治疗DM及其并发症是关键问题。三白草酮(sauchinone,Sch)是从传统三白草中提取的主要单体类化合物之一,具有清热解毒、消肿利尿、抗炎之功效,通过抗炎、抗病毒、抗氧化等机制对肿瘤、肝炎、神经退行性病变、急性肺损伤、气道变应性疾病、细菌感染等具有良好的治疗作用,尤其通过降血糖、抗氧化作用及其对细胞的保护作用备受关注[12,34]。本研究发现,利用Sch低剂量、高剂量给药过程中,糖尿病小鼠的“三多一少”症状明显改善,降血糖作用显著。为进一步分析其机制,检测胰腺组织中氧化应激指标,Sch干预后与模型组比较MDA水平降低,SOD、GSH-Px活性明显升高,说明有效清除高糖所引起的氧自由基的堆积,改善机体内氧化应激状态,缓解胰岛β细胞的损伤。还发现Sch能增加胰腺组织的抗凋亡蛋白Bcl-2的表达,抑制Caspase-3和NF-κB蛋白的表达,从而明显抑制炎症因子TNF-α和IL-6的水平。
综上所述,Sch减轻胰岛β细胞的损伤,增加胰岛素分泌,抑制胰岛素抵抗,主要通过DM发病机制中的氧化应激和凋亡为靶点,能抑制高糖所致的氧化应激,维持内环境稳态,减少细胞的凋亡而发挥保护胰岛β细胞的作用。今后进一步深入研究Sch的作用靶点和探讨调控相关信号通路的作用机制,为糖尿病治疗药物的研发提供更加可靠的基础实验依据。
-
表 1 Sch对糖尿病小鼠体重的影响(n=8)
Table 1 Effect of sauchinone on body weight in diabetic mice (n=8)
组别 0周(g) 1周(g) 2周(g) 3周(g) 4周(g) 正常对照组 22.93±2.88 23.17±2.95 23.85±2.79 24.89±2.44 26.98±2.63 模型组 23.54±2.61 22.85±1.96 20.17±2.85# 18.23±2.05 ## 17.86±1.95 ## Sch低剂量组 22.58±2.43 20.26±2.15 19.16±1.89 20.58±2.65 22.78±2.83* Sch高剂量组 21.38±2.12 21.78±2.36 22.75±2.92 23.54±2.94** 25.84±2.48** 二甲双胍阳性对照组 22.76±2.32 22.95±2.92 22.69±2.76 24.31±2.18** 25.14.±2.52** 注:与正常组比较,##表示有极显著差异(P<0.01);与模型组比较,*表示有显著差异(P<0.05);**表示有极显著差异(P<0.01);表2~表4。 表 2 Sch对糖尿病小鼠FBG、FINS、胰岛素抵抗的影响(n=8)
Table 2 Effect of sauchinone on fasting blood glucose, fasting insulin and insulin resistance in diabetic mice (n=8)
组别 FBG(mmol/L) FINS(mIU/L) HOMA−IR 正常对照组 6.25±0.83 26.32±3.28 7.31±0.95 模型组 18.74±2.33## 14.67±2.85## 12.22±1.94## Sch低剂量组 12.78±1.85* 18.29±2.08* 10.39±1.23* Sch高剂量组 8.99±1.17**&& 22.48±2.97**& 8.98±0.97** 二甲双胍阳性对照组 7.88±0.92** 22.69±2.84** 7.95±0.99** 注:与Sch低剂量组比较,&表示有显著差异(P<0.05),&&表示有极显著差异(P<0.01);表4同。 表 3 Sch对糖尿病小鼠血清TNF-α和IL-6水平的影响(n=8)
Table 3 Effect of sauchinone on the serum concentrations of TNF-α and IL-6 in diabetic mice (n=8)
组别 TNF-α(pg/mL) IL-6(pg/mL) 正常对照组 81.34±8.25 64.77±7.56 模型组 105.36±15.23## 83.83±8.57## Sch低剂量组 88.59±10.43* 70.61±7.56* Sch高剂量组 84.72±9.05** 68.36±7.55** 二甲双胍阳性对照组 91.78±10.06 75.88±8.07 表 4 Sch对糖尿病小鼠胰腺组织MDA、SOD和GSH-Px活性的影响(n=8)
Table 4 Effect of sauchinone on pancreatic MDA, SOD and GSH-Px in diabetic mice (n=8)
组别 MDA(µmol/g) SOD(U/mg) GSH-Px(U/mg) 正常对照组 4.78±0.58 84.62±9.28 96.54±10.25 模型组 9.85±1.25## 42.75±5.87## 67.81±7.83## Sch低剂量组 8.03±0.91* 55.28±6.49* 81.64±8.15* Sch高剂量组 5.69±0.6.2**&& 72.27±9.42**&& 91.56±10.28**&& 二甲双胍阳性对照组 6.89±0.86** 68.33±8.17** 75.77±9.25 -
[1] LI Y, TENG D, SHI D, et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American diabetes association: National cross sectional study[J]. BMJ,2020,369:m997.
[2] SEMWAL D K, KUMAR A, ASWAL S, et al. Protective and therapeutic effects of natural products against diabetes mellitus via regener-ating pancreatic β-cells and restoring their dysfunction[J]. Phytother Res,2020,35(3):1218−1229.
[3] 尤丽, 党娅, 杨彬彦. 蓝莓花青素对2型糖尿病小鼠糖脂代谢的调节作用[J]. 食品工业科技,2022,43(9):381−388. [YOU L, DANG Y, YANG B Y. Regulation effects of blueberry anthocyanins on glucose-lipid metabolism in type 2 diabetic mice[J]. Science and Technology of Food Industry,2022,43(9):381−388. YOU L, DANG Y, YANG B Y. Regulation effects of blueberry anthocyanins on glucose-lipid metabolism in type 2 diabetic mice[J]. Science and Technology of Food Industry, 2022, 43(9): 381-388.
[4] DAI B, WU Q X, ZENG C X, et al. The effect of Liuwei Dihuang decoction on PI3K/Akt signaling pathway in liver of type 2 diabetes mellitus (T2DM) rats with insulin resistance[J]. J Ethnopharmacol,2016,19(2):382−389.
[5] GHADGE A A, KUBALEKAR A A. Controversy of oral hypoglycemic agents in type 2 diabetes mellitus: Novel move towards combinationtherapies[J]. Diabetes & Metabolic Syndrome Clinical Research & Reviews,2017,11(Suppl 1):S5−S13.
[6] HANCHANG W, KHAMCHAN A, WONGMANEE N, et al. Hesperidin ameliorates pancreatic β-cell dysfunction and apoptosis in streptozotocin-induced diabetic rat model[J]. Life Sci,2019,235:116858. doi: 10.1016/j.lfs.2019.116858
[7] GURZOV E N, KE P C, AHIGREN U, et al. Novel strategies to protect and visualize pancreatic β-cells in diabetes[J]. Trends Endocrinol Metab,2020,31(12):905−917. doi: 10.1016/j.tem.2020.10.002
[8] WU X, HUANG L T, ZHOU X L, et al. Curcumin protects cardiomyopathy damage through inhibiting the production of reactive oxygen species in type 2 diabetic mice[J]. Biochem Biophys Res Commun,2020,5301(1):15−21.
[9] 赵培媛, 唐泳楠, 林上伟, 等. 三白草本草考证[J]. 亚太传统医药,2022,18(7):175−183. [ZHAO P Y, TANG Y N, LIN S W, et al. Herbal textual research of Saururus chinensis (Lour.) Baill[J]. Asia-Pacific Traditional Medicine,2022,18(7):175−183. ZHAO P Y, TANG Y N, LIN S W, et al. Herbal textual research of Saururus chinensis(Lour. ) Baill[J]. Asia-pacific Traditional Medicine, 2022, 18(7): 175-183.
[10] 何传波, 邓婷, 魏好程, 等. 仙草多糖对细胞氧化损伤的保护作用[J]. 食品科学,2020,41(13):160−168. [HE C B, DENG T, WEI H C, et al. Protective effect of polysaccharide from mesona blumes on oxidative damage of cells[J]. Food Science,2020,41(13):160−168. doi: 10.7506/spkx1002-6630-20190714-183 HE C B, DENG T, WEI H C, et al. Protective effect of polysaccharide from mesona blumes on oxidative damage of cells[J]. Food Science, 2020, 41(13): 160-168. doi: 10.7506/spkx1002-6630-20190714-183
[11] 随家宁, 李芳婵, 郭勇秀, 等. 三白草化学成分与药理作用研究进展及质量标志物预测分析[J]. 食品工业科技,2020,41(18):353−359,367. [SUI J N, LI F C, GUO Y X, et al. Research progress on chemical composition and pharmacological effects of Saururus chinensis and predictive analysis on quality marker[J]. Science and Technology of Food Industry,2020,41(18):353−359,367. SUI J N, LI F C, GUO Y X, et al. Research progress on chemical composition and pharmacological effects of Saururus chinensis and predictive analysis on quality marker[J]. Science and Technology of Food Industry, 2020, 41(18): 353-359, 367.
[12] JEONG H J, KOO B S, KANG T H, et al. Inhibitory effects of Saururus chinensis and its components on stomach cancer cells[J]. Phytomedicine,2015,22(2):256−261. doi: 10.1016/j.phymed.2014.12.003
[13] 姜敏, 李露露, 吴桐, 等. 三白草酮通过调控海马Nrf2/HO -1表达减少酒精戒断大鼠抑郁样行为[J]. 中国病理生理杂志,2022,38(10):1803−1811. [JIANG M, LI L L, WU T, et al. Sauchinone attenuates alcohol withdrawal -induced depression like behaviors in rats by modulating hippocampal Nrf2/HO -1 expressionr[J]. Chinese Journal of Pathophysiology,2022,38(10):1803−1811. JIANG M, LI L L, WU T, et al. Sauchinone attenuates alcohol withdrawal-induced depression like behaviors in rats by modulating hippocampal Nrf2/HO-1 expressionr[J]. Chinese Journal of Pathophysiology, 2022, 38(10): 1803-1811.
[14] 吴丽娜, 范晓萌, 武爽, 等. 人参皂苷Rg1调节氧化应激和炎症因子表达改善糖尿病大鼠周围神经损伤[J]. 中国免疫学杂志,2021,37(4):486−491. [WU L N, FAN X M, WU S, et al. Ginsenoside Rg1 attenuates diabetic peripheral neuropathy in rats via anti-oxidant and anti inflammatory mechanisms[J]. Chinise J Immunology,2021,37(4):486−491. WU L N, FAN X M, WU S, et al. Ginsenoside Rg1 attenuates diabetic peripheral neuropathy in rats via anti-oxidant and anti inflammatory mechanisms[J]. Chinise J Immunology, 2021, 37(4): 486-491.
[15] 黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学,2004,9(9):1069−1072. [HUANG J H, HUANG X H, CHEN Z Y, et al. Dose conversion among different animals and healthy volunteers in pharmacological study[J]. Chin J Clin Pharmacol Ther,2004,9(9):1069−1072. HUANG J H, HUANG X H, CHEN Z Y, et al. Dose conversion among different animals and healthy volunteers in pharmacological study[J]. Chin J Clin Pharmacol Ther, 2004, 9(9): 1069-1072.
[16] VELIKVA T V, KABAKCHIEVA P P, ASSYOV Y S, et al. Targeting inflammatory cytokines improve type 2 diabetes control[J]. Biomed Res Int,2021(2021):7297419.
[17] ZHANG P, LI T, WU X, et al. Oxidatuve stress and diabetes: antioxidative strategies[J]. Front Med,2020,14(5):583−600. doi: 10.1007/s11684-019-0729-1
[18] 王宏杨, 苑天彤, 张福利. 中医药基于氧化应激途径防治糖尿病研究机制进展[J]. 辽宁中医药大学学报,2022,24(1):198−204. [WANG H Y, YUAN T T, ZHANG F L. Progress in research mechnism of traditional Chinese medicine in preventing and treating diabetes based on oxidative stress[J]. J Liaoning University of Traditional Chinese Medicine,2022,24(1):198−204. WANG H Y, YUAN T T, ZHANG F L. Progress in research mechnism of traditional Chinese medicine in preventing and treating diabetes based on oxidative stress[J]. J Liaoning University of Traditional Chinese Medicine, 2022, 24(1): 198-204.
[19] LI H, WANG G, YU Y, et al. α-1, 2-Mannosidase MAN1C1 inhibits proliferation and invasion of clear cell renal cell car-cinoma[J]. J Cancer,2018,9(24):4618−4626. doi: 10.7150/jca.27673
[20] HONG Y, HUANG X, AN L, et al. Overexpression of COPS3 promotes clear cell renal cell carcinoma progression via regulation of Phospho-AKT (Thr308), Cyclin D1 and Caspase-3[J]. Exp Cell Res,2018,365(2):163−170. doi: 10.1016/j.yexcr.2018.02.025
[21] YANG S X, ZHANG Z C, BAI H L. ClC-5 alleviates renal fibrosis inunilateral ureteral obstruction mice[J]. Hum Cell,2019,32(3):297−305. doi: 10.1007/s13577-019-00253-5
[22] 高婷婷, 叶鸣, 吴凤瑶, 等. 二甲双胍对二型糖尿病大鼠肠道刺激影响[J]. 临床医药文献电子杂志,2019,6(23):178. [GAO T T, YE M, WU F Y, et al. Effect of metformin on intestinal stimulation in type 2 diabetic rats[J]. Journal of Clinical Medical Literature (Electronic Edition),2019,6(23):178. GAO T T, YE M, WU F Y, et al. Effect of metformin on intestinal stimulation in type 2 diabetic rats[J]. Journal of Clinical Medical Literature (Electronic Edition), 2019, 6(23): 178.
[23] BO J S, XIE S Y, GUO Y, et al. Methylglyoxal impairs insulin secretion of pancreatic β-cells through increased production of ROS and mitochondrial dysfunction mediated by upregulation of UCP2 and MAPKs[J]. Journal of Diabetes Research, 2016: 2029854.
[24] YANG M, KAN L, WU L, et al. Effect of baicalin on renal function in patients with diabetic nephropathy and its therapeutic mechanism[J]. Exp Ther Med,2019,17(3):2071−2076.
[25] 叶蕻芝, 许雪琴, 林薇, 等. 三白草对四氧嘧啶型糖尿病小鼠治疗作用的实验研究[J]. 福建中医学院学报,2004,14(3):34−35. [YE H Z, XU X Q, LIN W, et al. The study of Saururus on alloxan diabetic mice[J]. Journal of Fujian College of Traditional Medicine,2004,14(3):34−35. YE H Z, XU X Q, LIN W, et al. The study of Saururus on alloxan diabetic mice[J]. Journal of Fujian College of Traditional Medicine, 2004, 14(3): 34-35.
[26] 郭翔宇, 段颖, 李娟娥, 等. 三白草提取物对肥胖Zucker大鼠胰岛素抵抗的疗效观察[J]. 中华中医药杂志,2010,25(12):2291−2294. [GUO X Y, DUAN Y, LI J E, et al. Study on antidiabetic effects of Saururus Chinensis on obese Zucker rats[J]. CJTCMP,2010,25(12):2291−2294. GUO X Y, DUAN Y, LI J E, et al. Study on antidiabetic effects of Saururus Chinensis on obese Zucker rats[J]. CJTCMP, 2010, 25(12): 2291-2294.
[27] LEE M S, ZHAO H X, LIU X M, et al. Protective effect of hydroxysafflor yellow a on nephropathy by attenuating oxidative stress and inhibiting apoptosis in induced type 2 diabetes in rat[J]. Oxid Med Cell Longev, 2020, 2020(1):1-11
[28] LIAO Z Z, ZHANG J Y, WANG J Y, et al. The anti-nephritic activity of a polysaccharide from okra (Abelmoschus esculentus (L.) Moench) via modulation of AMPK-Sirt1-PGC-1α signaling axis mediated anti-oxidative in type 2 diabetes model mice[J]. Int J Biol Macromol,2019,140(11):568−576.
[29] ROJAS J, BERMUDEZ V, PALMAR J, et al. Pancreatic beta cell death: Novel potential mechanisms in diabetes therapy[J]. J Diabetes Res,2018,2018:9601801.
[30] 张芸绮, 蔺晓菁, 王妙然, 等. 橙皮苷对高脂高糖诱导胰岛β细胞损伤的保护作用[J]. 中国药理学通报,2021,37(5):652−656. [ZHANG Y Q, LIN X J, WANG M R, et al. The protective effect of hesperidin on injury induced by glucolipotoxicity in islet beta cells[J]. Chinese Pharmacological Bulletin,2021,37(5):652−656. ZHANG Y Q, LIN X J, WANG M R, et al. The protective effect of hesperidin on injury induced by glucolipotoxicity in islet beta cells[J]. Chinese Pharmacological Bulletin, 2021, 37(5): 652-656.
[31] MALIK S, SUCHAL K, KHAN SI, et al. Apigenin ameliorates streptozotocin induced diabetic nephropathy in rats via MAPK -NF-κB- TNF-α and TGF-β1-MAPK-fibronectin pathways[J]. Am J Physiol Renal Physiol,2017,313(2):F414−F422. doi: 10.1152/ajprenal.00393.2016
[32] JI L, CHEN Y, WANG H, et al. Overexpression of Sirt6 promotes M2 macrophage transformation, alleviating renal injury in diabetic nephropathy[J]. Int J Oncol,2019,55(1):103−115.
[33] YANG P Y, LI P C, FENG B. Protective effects of gliclazide on high glucose and AGEs induced damage of glomerular mesangial cells and renal tubular epithelial cells via inhibiting RAGE -p22phox -NF -kB pathway[J]. Eur Rev Med Pharmacol Sci,2019,23(20):9099−9107.
[34] ALAKLABIA, ARIFIA, AHAMED A, et al. Evaluation of antioxidant and anticancer activities of chemical constituents of the saururus chinensis root extracts[J]. Saudi Journal of Biological Sciences,2018,25(7):1387−1392. doi: 10.1016/j.sjbs.2016.12.021
-
期刊类型引用(4)
1. 张艳,王圣开,聂青玉,付勋,冯婷婷,熊春梅,李翔. 基于非靶向代谢组学分析不同包装方式预制烤鱼代谢物的差异. 食品工业科技. 2024(09): 288-295 .  本站查看
本站查看
2. 李剑,李永桂,陈旭升,刘刚,杜付军. 一种食品包装用PET阻光母粒的制备和性能研究. 轻工科技. 2024(03): 129-131 .  百度学术
百度学术
3. 伍天佑,刘玉梅,熊双丽,冯小平. 包装方式对油炸小酥肉贮藏品质的影响. 中外食品工业. 2024(08): 123-125 .  百度学术
百度学术
4. 黄晓霞,游云,刘巧瑜,董浩,曾宪军,李湘銮,钱敏,曾晓房. 不同剂量~(60)Co-γ射线辐照对烟鸡胸肉贮藏过程中滋味的影响. 食品安全质量检测学报. 2023(07): 56-64 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:
 下载:
下载:



