Optimization of Ultrasonic Wave and Cellulase Synergistic Extraction Technology of Total Flavonoids from Bambusae Caulis in Taeniam and Their Antioxidant Capacity in Vitro
-
摘要: 为优化超声波处理与纤维素酶协同提取竹茹总黄酮的工艺条件,并探究其体外抗氧化活性。以总黄酮得率为指标,通过单因素实验筛选出适宜的纤维素酶添加量、提取溶液pH、乙醇浓度、超声功率、超声温度、料液比、超声时间,采用响应面法优化竹茹总黄酮的最佳提取工艺条件,并利用1,1-二苯基-2-三硝基苯肼(DPPH)法、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)(ABTS)法和铁离子还原法(FRAP)评价其体外抗氧化活性。结果表明,最佳工艺条件为:纤维素酶添加量5%、提取溶液pH4.7、乙醇浓度61%、超声功率240 W、超声温度60 ℃、料液比1:30 (g/mL)、超声时间30 min。在此条件下,竹茹总黄酮的得率为0.83%±0.02%,所得提取物中总黄酮的含量为16.21%±0.42%。体外抗氧化实验结果表明,竹茹总黄酮提取物对DPPH 和ABTS+自由基均具有一定的清除能力,相应的IC50值为150.1和44.6 μg/mL,分别为VC的1.22和1.27倍,竹茹总黄酮提取物对铁离子的还原能力略高于VC。该优化工艺简便、可行,且提取的竹茹总黄酮具有良好的体外抗氧化活性,可为竹茹黄酮的深入研究开发提供科学依据。Abstract: The present study aimed to optimize the ultrasonic wave and cellulase synergistic extraction technology of total flavonoids from Bambusae Caulis in Taeniam and evaluate their antioxidant capacity in vitro. Taking yield of total flavonoids as the metric, the appropriate amount of cellulase added, pH of extraction solvents, ethanol concentration, ultrasonic power, ultrasonic temperature, material-liquid ratio and ultrasonic time were scouted by single-factor experiments, and the optimal conditions for the extraction of total flavonoids from Bambusae Caulis in Taeniam were optimized by response surface methodology (RSM). Meanwhile, the antioxidant capacity was investigated in vitro using scavenging 1,1-diphenyl-2-picrylhydrazyl (DPPH), 2,2'-azino-bis-3-ethylbenzothiaz-oline-6-sulfonic acid (ABTS) free radicals and iron ion reduction method (FRAP). As the result showed that the optimum extraction parameters were the amount of cellulase added: 5%, pH of extraction solvents: 4.7, ethanol concentration: 61%, ultrasonic power: 240 W, ultrasonic temperature: 60 ℃, material-liquid ratio: 1:30 (g/mL), ultrasonic time: 30 min. The total flavonoids yield of Bambusae Caulis in Taeniam was 0.83%±0.02% under these conditions, and the content of total flavonoids in Bambusae Caulis in Taeniam extract was 16.21%±0.42%. The results of antioxidant experiments showed that the total flavonoids could scavenge DPPH and ABTS+ radicals with IC50 values of 150.1 and 44.6 μg/mL, respectively, which were 1.22 and 1.27 times greater than VC. The ferric ion reducing ability of total flavonoids from Bambusae Caulis in Taeniam was slightly higher than that of VC. This optimized extraction process is simple and feasible, and the extracted total flavonoids shows strong antioxidant effects in vitro, which provides scientific evidence for the further study and exploit of flavonoids from Bambusae Caulis in Taeniam.
-
竹茹(Bambusae Caulis in Taeniam)为禾本科植物淡竹、大头典竹或青秆竹的茎秆的干燥中间层,具有清热化痰、除烦止呕等功效,是卫健委公布的药食同源类物质[1]。化学成分研究表明,竹茹中主要含有黄酮类、五环三萜类、多糖类等物质[2]。现代药理研究显示,竹茹三萜类成分具有良好的降脂、降压、抗炎、抗肿瘤等活性[2-4]。竹茹多糖具有显著的免疫调节活性[5]。竹茹黄酮具有延缓皮肤细胞衰老的效能,这可能与其具有抗氧化活性有关[6]。因此,本研究针对于竹茹中黄酮的提取及其抗氧化活性的分析,对其资源的开发以及高值化应用具有重要的经济效益和实际意义。
天然产物中黄酮类成分的提取方法有许多种,较为常见的有回流提取法、超声波提取法、酶提取法、微波提取法、超临界流体萃取法等[7-10]。其中纤维素酶提取法是利用纤维素酶将植物细胞壁中的纤维素等成分进行降解,提高胞内黄酮类成分的溶出速度,且具有提取条件温和、提取黄酮的品质高等特点[10-11];超声波提取法是利用超声波的振动作用使植物组织结构形成空洞,结合其具有的热效应能加速胞内黄酮类物质的溶出,因而该法具有提取时间短、黄酮得率高的特点[12-13]。超声-纤维素酶协同提取法结合了上述两种方法的优点,已广泛应用于天然产物活性成分的提取[14-16],但采用超声波处理与纤维素酶协同提取竹茹总黄酮的研究尚未见报道。
因此本研究以竹茹作为原料,总黄酮得率为评价指标,采用超声波处理与纤维素酶协同提取竹茹中的总黄酮,通过单因素实验及响应面法优选出最佳提取工艺条件,同时利用DPPH法、ABTS法和FRAP法评价竹茹总黄酮提取物的体外抗氧化活性,为竹茹的深入开发利用以及竹茹总黄酮提取物作为天然抗氧化剂在食品领域的应用提供科学依据。
1. 材料与方法
1.1 材料与仪器
竹茹 购自千金大药房(湖南省长沙市天心区),经长沙学院唐伟卓副教授鉴定为禾本科植物青秆竹Bambusa tuldoides Munro茎秆的干燥中间层;芦丁、VC标准品(纯度≥98%) 成都埃法生物科技有限公司;纤维素酶(活力≥400 U/mg) Sigma公司;ABTS、2,4,6-三吡啶基三嗪(TPTZ)、DPPH、硝酸铝、三氯化铁、硫酸亚铁、亚硝酸钠、氢氧化钠 分析纯,国药集团化学试剂有限公司。
F-040SD超声波清洗机 深圳福洋科技集团有限公司;Agilent Cary 60型紫外可见分光光度计 安捷伦科技公司;Bioteck Synergy2酶标仪 美国伯腾仪器有限公司;SN-HH-6型数显恒温水浴锅 上海尚仪仪器设备有限公司。
1.2 实验方法
1.2.1 竹茹总黄酮的提取
将竹茹干燥、粉碎。精密称取竹茹粉末2.0 g,置于250 mL锥形瓶中,加入50 mL 60%乙醇溶液(料液比为1:25 (g/mL)),在水浴中加热至60 ℃,用盐酸、氢氧化钠调节pH至5,在如下条件下进行提取:纤维素酶添加量5%(酶与物料的质量比)、超声温度60 ℃、超声功率240 W、超声时间30 min,提取完成后在100 ℃下加热5 min使纤维素酶失活,减压抽滤,得竹茹提取液,用60%乙醇溶液定容至100 mL,备用。
1.2.2 竹茹总黄酮的含量测定
1.2.2.1 芦丁标准曲线的绘制
参考Liu等[17]的方法并稍作修改。准确称取10 mg芦丁对照品,置于50 mL容量瓶中,加入60%乙醇超声溶解并定容,摇匀,得到浓度为0.2 mg/mL的对照品溶液。依次吸取上述标准溶液0、0.5、1.0、1.5、2.0、2.5、3.0 mL置于10 mL具塞比色管中,并加入5%亚硝酸钠0.5 mL,摇匀后静置7 min;再加入10%硝酸铝0.5 mL,摇匀后静置7 min;然后再加入4%氢氧化钠5 mL,摇匀后用60%乙醇定容至10 mL,静置15 min。以加0 mL芦丁标准液为空白对照,在510 nm处分别测定各溶液的吸光值。以吸光值A为纵坐标,芦丁对照品溶液浓度C (mg/mL)为横坐标,拟合出标准曲线的回归方程为A=5.9054C+0.0479(R2=0.9993)。结果表明芦丁标准品在0.01~0.06 mg/mL浓度范围内线性关系良好。
1.2.2.2 竹茹总黄酮的含量测定
精密吸取3.0 mL竹茹样液于10 mL比色管中,按“1.2.2.1”中的方法测定其吸光值,利用标准曲线回归方程获得样品溶液中的总黄酮浓度,并按照公式(1)计算样品的总黄酮得率。
(1) 式中:M为竹茹样品的取样量,mg;N为稀释倍数;V为提取液定容的最终体积,mL;C为测试液总黄酮浓度,mg/mL。
1.2.3 单因素实验
在固定纤维素酶添加量5%、提取溶液pH5、乙醇浓度60%、超声功率240 W、超声温度60 ℃、料液比1:25 (g/mL)、超声时间30 min的条件下,每个因素设6个水平:纤维素酶添加量(1%、3%、5%、7%、9%、11%)、提取溶液pH(3、4、5、6、7、8)、乙醇浓度(40%、50%、60%、70%、80%、90%)、超声功率(160、200、240、280、320、360 W)、超声温度(30、40、50、60、70、80 ℃)、料液比(1:10、1:15、1:20、1:25、1:30、1:35 g/mL)和超声时间(20、30、40、50、60、70 min),考察各单因素对竹茹总黄酮得率的影响。
1.2.4 响应面优化试验
基于单因素实验结果,选择3个对竹茹总黄酮得率影响较大的因素:乙醇浓度(A)、提取溶液pH(B)和超声功率(C)为考察因素,以总黄酮得率为指标,采用Design-Expert 10软件设计响应面试验,优化超声波处理与纤维素酶协同提取竹茹总黄酮的最佳工艺条件。响应面试验因素与水平设计见表1。
表 1 响应面试验因素与水平设计Table 1. Factors and levels of response surface methodology design水平 因素 A乙醇浓度(%) B提取溶液pH C超声功率(W) −1 50 4 200 0 60 5 240 1 70 6 280 1.2.5 竹茹总黄酮体外抗氧化活性分析
1.2.5.1 DPPH法测定抗氧化活性
参考IryanaIhsanpuro等[18]的方法并稍作修改。精密吸取100 μL不同浓度的竹茹总黄酮溶液(10、20、40、80、160、320 μg/mL)和100 μL 0.3 mmol/L DPPH无水乙醇溶液,置于96孔板中,摇匀,在37 ℃下避光条件下放置30 min,于517 nm处测定吸光值;采用VC作为阳性对照。DPPH自由基清除率按公式(2)计算。
(2) 式中,A1为100 μL DPPH无水乙醇溶液+100 μL样品液的吸光值;A2为100 μL无水乙醇溶液+100 μL样品液的吸光值;A0为100 μL DPPH无水乙醇溶液+100 μL无水乙醇溶液的吸光值。
1.2.5.2 ABTS法测定抗氧化活性
参考Pablo等[19]的方法并加以修改。精密吸取100 μL不同浓度的竹茹总黄酮溶液(10、20、40、80、160、320 μg/mL)和100 μL ABTS工作液,置于96孔板中,摇匀,在37 ℃下避光条件下放置30 min,于734 nm处测定吸光值;采用VC作为阳性对照。ABTS+自由基清除率按公式(3)计算。
(3) 式中,A1为100 μL ABTS工作液+100 μL样品液的吸光值;A2为100 μL无水乙醇溶液+100 μL样品液的吸光值;A0为100 μL ABTS工作液+100 μL无水乙醇溶液的吸光值。
1.2.5.3 FRAP法测定抗氧化能力
参照Wang等[20]的方法,并稍作修改。将300 mmol/L的醋酸缓冲液(pH3.6)、10 mmol/L TPTZ溶液(用40 mmol/L HCl配制)、20 mmol/L的FeCl3溶液按体积比10:1:1的比例混匀,37 ℃保温30 min,得FRAP工作液[9]。精密吸取5 μL不同浓度的FeSO4·7H2O溶液(0.1、0.2、0.3、0.4、0.6、0.8、1.0 mmol/L)和150 μL FRAP工作液,置于96孔板中,摇匀,在37 ℃避光条件下放置30 min,于593 nm处测定吸光值。以FeSO4·7H2O溶液浓度C (mmol/L) 对吸光值(A)进行线性回归分析,绘制标准曲线为:A=0.329C+0.3461,R2=0.9997,FeSO4·7H2O线性范围为0.1~1.0 mmol/L。
准确配制不同浓度的竹茹总黄酮溶液(0.1、0.2、0.3、0.4、0.6、0.8、1.0 mg/mL)。实验组加入5 μL不同浓度样品和150 μL FRAP工作液,空白组加入5 μL无水乙醇与150 μL FRAP工作液,对照组加入5 μL不同浓度样品和150 μL醋酸缓冲液 (pH3.6)。避光放置30 min,于593 nm处测定吸光值,空白组吸光值为A0,实验组吸光值为A1,对照组吸光值为A2。然后根据FeSO4·7H2O标准曲线,将样品的实际吸光值(即A1-A2-A0)换算为FeSO4·7H2O的浓度值(FRAP,mmol/L),FRAP值越大,表示其抗氧化活性越强。另取VC作为阳性对照,同法测定其总抗氧化能力。
1.3 数据处理
所有实验均平行进行3次,实验数据用平均值±标准差表示。采用Design-Expert 10软件进行响应面试验设计;采用Origin 2021、Excel 2021对数据进行分析处理、制图。
2. 结果与分析
2.1 单因素实验结果
2.1.1 纤维素酶添加量对总黄酮得率的影响
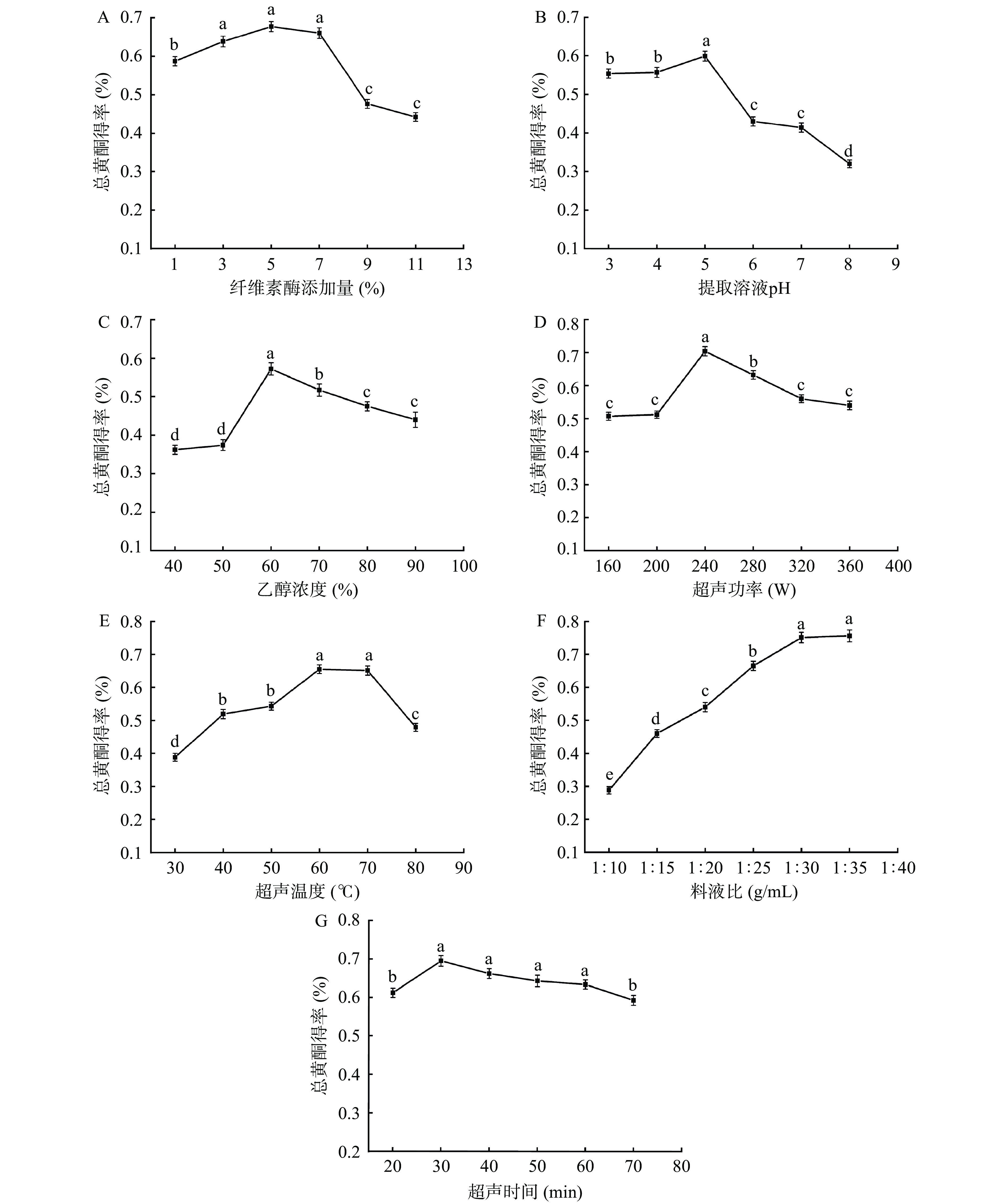
由图1A可知,纤维素酶添加量为5%时,竹茹总黄酮得率最大,为0.68%±0.01%。当纤维素酶添加量在1%~5%范围时,随纤维素酶添加量的增加,竹茹总黄酮的得率呈上升趋势,这可能是由于随着纤维素酶含量的增加,其对细胞壁的破坏作用增强,促进了黄酮类物质的溶出。当纤维素酶添加量超过5%时,竹茹总黄酮得率呈现下降趋势,这可能是因为酶解部分纤维素和过多的酶附着在竹茹颗粒表面,阻塞了黄酮类成分的溶出,导致总黄酮得率下降[21]。因此,选择最佳纤维素酶添加量为5%。
![]() 图 1 纤维素酶添加量(A)、提取溶液pH(B)、乙醇浓度(C)、超声功率(D)、超声温度(E)、料液比(F)和超声时间(G)对竹茹总黄酮得率的影响注:不同小写字母表示差异显著,P<0.05。Figure 1. Effects of amount of cellulase added (A), pH of extraction solvents (B), ethanol concentration (C), ultrasonic power (D), ultrasonic temperature (E), material-liquid ratio (F) and ultrasonic time (G) on the total flavonoids yield of Bambusae Caulis in Taeniam
图 1 纤维素酶添加量(A)、提取溶液pH(B)、乙醇浓度(C)、超声功率(D)、超声温度(E)、料液比(F)和超声时间(G)对竹茹总黄酮得率的影响注:不同小写字母表示差异显著,P<0.05。Figure 1. Effects of amount of cellulase added (A), pH of extraction solvents (B), ethanol concentration (C), ultrasonic power (D), ultrasonic temperature (E), material-liquid ratio (F) and ultrasonic time (G) on the total flavonoids yield of Bambusae Caulis in Taeniam2.1.2 提取溶液pH对总黄酮得率的影响
由图1B可知,当pH在3~5范围时,竹茹总黄酮的得率呈现上升趋势;当pH大于5时,总黄酮得率显著(P<0.05)下降。这可能是因为纤维素酶的最适pH在5附近,在最适pH下,该酶的活力最强。当大于或小于最适pH时,纤维素酶的活性都会降低,从而导致酶作用于提取竹茹总黄酮的效果受到影响,得率降低[22]。因此,选择提取溶液pH(4、5、6)三个水平进行响应面试验。
2.1.3 乙醇浓度对总黄酮得率的影响
由图1C可知,乙醇浓度为60%时,竹茹总黄酮的得率最高,为0.57%±0.01%。当乙醇浓度在40%~50%范围时,竹茹总黄酮的得率呈现缓慢上升趋势;乙醇浓度在50%~60%范围时,竹茹总黄酮的得率呈现显著(P<0.05)上升趋势,这可能是因为黄酮类化合物大多为醇溶性成分,在一定范围内,其溶出率随着醇浓度的增加而提高[23]。当乙醇浓度超过60%时,竹茹总黄酮的得率呈现下降趋势,这可能是因为乙醇浓度大于60%时,脂溶性杂质溶出增多,另外,乙醇浓度过高会使纤维素酶活性降低,从而导致总黄酮得率下降[24]。因此,选择乙醇浓度50%、60%、70%三个水平进行响应面试验。
2.1.4 超声功率对总黄酮得率的影响
由图1D可知,超声功率为240 W时,竹茹总黄酮得率最高,为0.71%±0.01%。当超声功率在160~200 W范围时,竹茹总黄酮的得率呈现缓慢上升趋势;超声功率在200~240 W时,竹茹总黄酮的得率呈现显著(P<0.05)上升趋势;当超声功率超过240 W时,竹茹总黄酮的得率呈现下降趋势。这是因为当超声功率较低时,产生的机械及空化效应对细胞壁的破坏程度较小,故总黄酮得率不高。随着超声功率不断增加,分子运动加剧,细胞壁破碎程度加大,总黄酮得率升高。当超声功率超过240 W时,总黄酮得率随着超声波功率的增加而减少,是因为超声波功率大,在强大的机械振动作用下,提取剂的流动加快,导致超声波的停留时间减少,同时空化作用增强后,将产生大量的无用空化泡,会增加超声波的散射衰减,同时超声波功率增大,也会加快黄酮的氧化作用,从而导致总黄酮得率下降[25]。因此,选择超声功率200、240、280 W三个水平进行响应面试验。
2.1.5 超声温度对总黄酮得率的影响
由图1E可知,超声温度为60 ℃时,竹茹总黄酮的得率最高,为0.66%±0.01%。当超声温度在30~60 ℃范围时,竹茹总黄酮的得率随超声温度的升高而增大,这可能是因为温度升高有利于加快分子运动速度和提高纤维素酶的活性,使黄酮类成分更易于从细胞内溶出,从而提高总黄酮得率。当超声温度超过60 ℃时,总黄酮的得率随超声温度的升高而下降,这可能是因为温度超过一定极限后,黄酮类物质分子结构易被破坏,且温度过高会使纤维素酶活力下降,另外,温度过高时,超声所产生的气泡中蒸汽压增大,气泡闭合时增强了缓冲作用而使空化作用减弱,从而导致总黄酮得率降低[26]。因此,超声温度选择60 ℃为最佳。
2.1.6 料液比对总黄酮得率的影响
由图1F可知,料液比为1:30(g/mL)时,竹茹总黄酮得率最大,为0.75%±0.02%。当料液比在1:10~1:30(g/mL)范围时,竹茹总黄酮得率随料液比的增加呈现上升趋势,当料液比超过1:30(g/mL)时,继续提高料液比竹茹总黄酮得率差异不显著(P>0.05)。原因为料液比过低,原料与提取溶剂接触不充分,黄酮未被有效溶出;增大料液比,原料被充分浸没在提取溶剂中,在超声波作用下黄酮被充分溶出,得率提高;料液比过大时,体系中的可溶性物质会与黄酮竞争溶剂,影响黄酮提取,另外,过高的料液比会造成纤维素酶的稀释,使其活力下降,导致总黄酮得率降低[27]。因此,选择最佳料液比为1:30(g/mL)。
2.1.7 超声时间对总黄酮得率的影响
如图1G所示,超声时间在20~30 min范围时,竹茹总黄酮的得率呈现上升趋势。超声时间为30 min时,竹茹总黄酮的得率最高,为0.69%±0.01%。当超声时间超过30 min时,竹茹总黄酮的得率呈现缓慢下降趋势。原因可能是在提取黄酮的最开始阶段,溶剂内外存在较大的浓度差,因此随着超声时间的增加,黄酮会迅速进入提取溶剂中,从而提高黄酮得率;但随着超声时间的不断延长,样品中其他醇溶性物质被浸提出来,导致总黄酮得率有所下降[28]。综合考虑时间和成本问题,超声时间选择30 min为最佳。
2.2 响应面法优化竹茹总黄酮提取工艺
2.2.1 响应面试验设计及结果
由以上几组单因素实验结果可知,乙醇浓度、提取溶液pH和超声功率对工艺的影响较大,而料液比、超声时间、纤维素酶添加量和超声温度则可分别固定为1:30(g/mL)、30 min、5%和60 ℃。根据三因素三水平的原则,将乙醇浓度定为50%、60%、70%;提取溶液pH定为4、5、6;超声功率定为200、240、280 W,设计17组试验(表2)。
表 2 竹茹总黄酮提取的响应面试验设计与结果Table 2. Design and results of response surface methodology of extracting total flavonoids of Bambusae Caulis in Taeniam实验号 A:乙醇浓度(%) B:提取溶液pH C:超声功率(W) Y:总黄酮得率(%) 1 60 5 240 0.82±0.03 2 50 5 200 0.76±0.01 3 60 5 240 0.82±0.03 4 60 6 200 0.77±0.02 5 50 6 240 0.78±0.02 6 60 5 240 0.82±0.03 7 70 5 280 0.78±0.02 8 50 5 280 0.76±0.01 9 60 5 240 0.82±0.03 10 60 5 240 0.82±0.03 11 70 5 200 0.79±0.02 12 70 6 240 0.76±0.02 13 60 6 280 0.79±0.02 14 50 4 240 0.80±0.02 15 70 4 240 0.79±0.02 16 60 4 280 0.80±0.02 17 60 4 200 0.80±0.02 2.2.2 方差分析
采用Design-Expert 10软件对表2中数据进行拟合,得二次多元回归方程为Y=0.84+3.125×10−3A−9.625×10−3B+1.000×10−3C−2.500×10−3AB−3.750×10−3AC+3.750×10−3BC−0.035A2−0.017B2−0.030C2。方差分析结果见表3。
表 3 回归模型方差分析Table 3. Variance analysis of regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 0.012 9 1.374×10−3 25.42 0.0007 ** A 7.812×10−5 1 7.812×10−5 8.081 0.0031 ** B 7.411×10−4 1 7.411×10−4 2.77 0.0123 * C 8.000×10−6 1 8.000×10−6 18.27 0.0012 ** AB 2.500×10−5 1 2.500×10−5 0.26 0.8768 NS AC 5.625×10−5 1 5.625×10−5 5.058 0.00816 ** BC 5.625×10−5 1 5.625×10−5 0.58 0.8164 NS A2 5.247×10−3 1 5.247×10−3 15.42 0.00527 ** B2 1.260×10−3 1 1.260×10−3 8.30 0.00913 ** C2 3.802×10−3 1 3.802×10−3 13.93 0.00879 ** 残差 6.772×10−3 7 9.674×10−4 失拟项 7.547×10−4 3 2.516×10−4 0.17 0.9132 NS 纯误差 6.017×10−3 4 1.504×10−3 总离差 0.019 16 R2 0.9916 R2Adj 0.9866 注:*表示有显著差异(0.01<P<0.05);**表示极显著差异(P<0.01);NS表示无显著差异(P>0.05)。 由表3可知,回归模型方差分析显著性检验表明,该回归模型显著(P<0.001),失拟项不显著(P=0.9132>0.05),表明该模型具有统计学意义。模型的决定系数R2=0.9916,说明该模型拟合度好,相关性好,调整决定系数R2Adj=0.9866,说明该回归模型能较好地反应出因素和因变量的关系,可信度高,可用于超声波处理与纤维素酶协同提取竹茹总黄酮工艺参数的初步分析和预测。由表3中P值可知,其中一次项A、C,交互项AC,二次项A2、B2、C2对竹茹总黄酮得率有极显著影响(P<0.01);一次项B对竹茹总黄酮得率有显著影响(0.01<P<0.05);交互项AB、BC对竹茹总黄酮得率无显著影响(P>0.05)。由F值可知,各因素对竹茹总黄酮得率的影响的大小顺序为超声功率(C)>乙醇浓度(A)>提取溶液pH(B)。
2.2.3 交互作用分析
乙醇浓度(A)、提取溶液pH(B)和超声功率(C)两两交互作用对竹茹总黄酮得率的影响结果如图2所示。
由图2可知,乙醇浓度(A)和超声功率(C)交互作用的曲面有极大值,坡度较陡峭,说明这一组交互作用对竹茹总黄酮得率的影响显著,而乙醇浓度(A)与提取溶液pH(B)交互作用、提取溶液pH(B)与超声功率(C)交互作用的曲面坡度较平缓,说明这两组交互作用对竹茹总黄酮得率的影响不显著,这与表3中交互项P值分析结果一致。
2.2.4 验证实验
根据响应面优化试验结果,得到竹茹总黄酮的最佳提取工艺条件为超声功率239.8 W、乙醇浓度60.54%、提取溶液pH4.72,该条件下竹茹总黄酮的理论得率为0.84%。根据实际情况,将提取工艺调整为纤维素酶添加量5%、提取溶液pH4.7、乙醇浓度61%、超声功率240 W、超声温度60 ℃、料液比1:30 (g/mL)、超声时间30 min,在此条件下进行验证实验,得到竹茹总黄酮的得率为0.83%±0.02%,这与理论估计值0.84%非常接近,表明该模型准确可靠,能对试验进行准确预测,因此将此提取工艺作为竹茹总黄酮的最优提取工艺参数。此外,利用本研究建立的总黄酮含量测定方法对所得竹茹提取物中的总黄酮含量进行测定,结果为16.21%±0.42%。
2.3 不同提取方法的比较
根据课题组前期实验及“1.2.3”项单因素实验和“1.2.4”项响应面优化试验结果,设置回流提取法、超声波提取法、纤维素酶提取法和超声波处理与纤维素酶协同提取法的工艺参数,考察不同提取方法对竹茹总黄酮得率的影响,结果见表4。与超声波提取法相比,超声波处理与纤维素酶协同提取法的竹茹总黄酮得率提高了53.70%,原因可能是使用纤维素酶后,细胞壁上的纤维素有部分降解,甚至有些细胞会破裂,促进了黄酮类成分的释放,所以总黄酮得率会提高[29]。与纤维素酶提取法相比,超声波处理与纤维素酶协同提取法的竹茹总黄酮得率提高了72.92%,原因可能是使用超声波,可以产生强烈振动、空化效应及搅拌作用,促进了黄酮类物质的溶出,所以总黄酮得率会提高[29]。与回流提取法相比,超声波处理与纤维素酶协同提取法的竹茹总黄酮得率提高了45.61%,原因可能是使用了纤维素酶和超声波,两者都能促进细胞内黄酮类物质的释放,所以总黄酮得率会更高,而且超声波处理与纤维素酶协同提取法还具有提取条件温和、提取时间短等优点[29]。综上所述,与其他几种提取方法相比,超声波处理与纤维素酶协同提取法更适合于竹茹总黄酮的提取。
表 4 不同提取方法对竹茹总黄酮得率的影响Table 4. Effects of different extraction methods on the total flavonoids yield of Bambusae Caulis in Taeniam提取方法 工艺参数 总黄酮得率(%) 回流提取法 料液比1:30(g/mL)、乙醇浓度80%、提取温度90 ℃、提取时间120 min 0.57±0.02 超声波提取法 设置纤维素酶添加量为0,其余条件与超声波处理与纤维素酶协同提取法一致 0.54±0.02 纤维素酶提取法 设置超声功率为0 W,其余条件与超声波处理与纤维素酶协同提取法一致 0.48±0.01 超声波处理与纤维素酶协同提取法 纤维素酶添加量5%、提取溶液pH4.7、乙醇浓度61%、超声功率240 W、超声温度60 ℃、
料液比1:30(g/mL)、超声时间30 min0.83±0.02 2.4 竹茹总黄酮的体外抗氧化活性
2.4.1 清除DPPH自由基能力
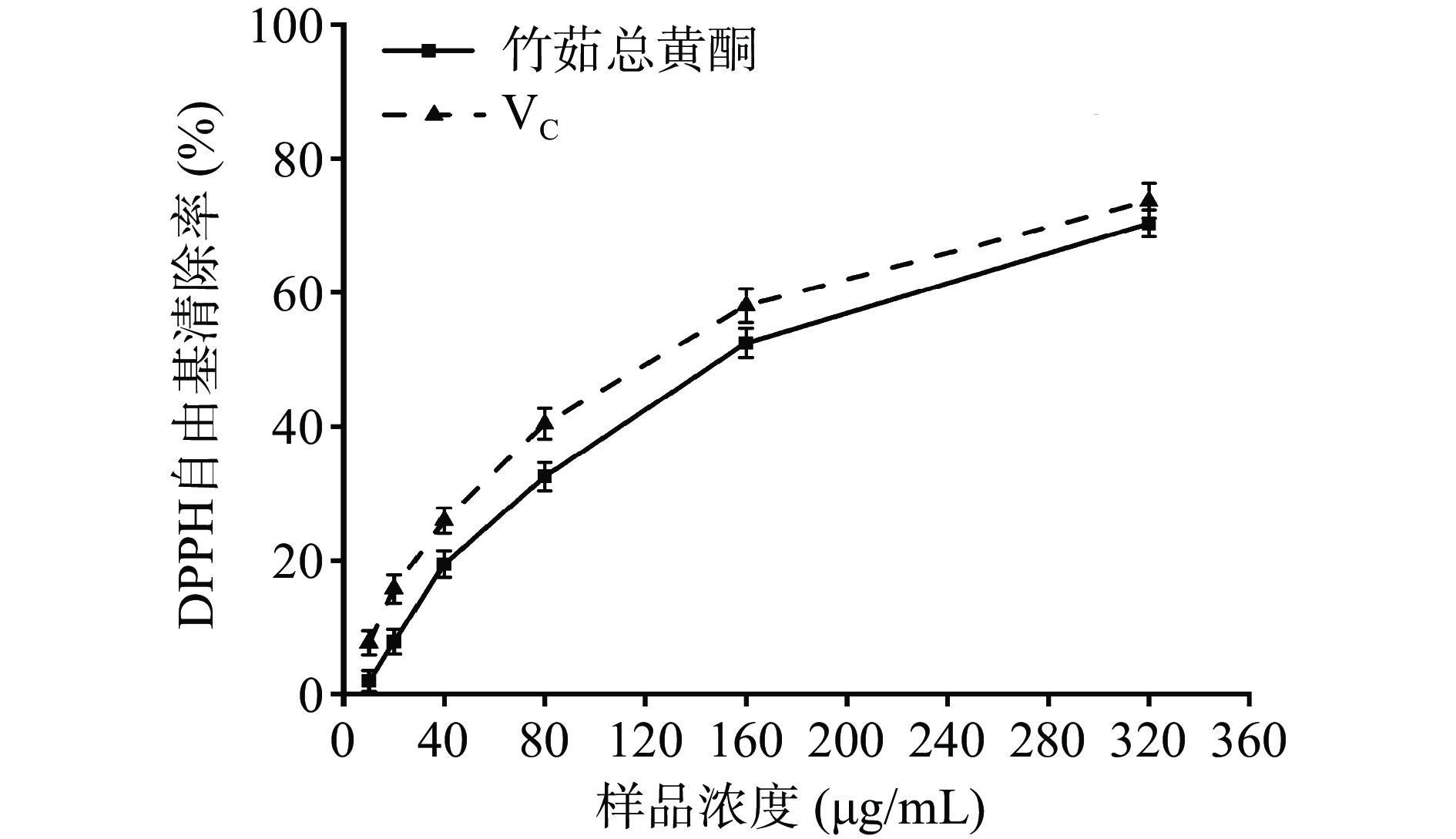
由图3可知,在10~320 μg/mL范围内,竹茹总黄酮提取物清除DPPH自由基的能力弱于同浓度的VC。随着浓度的增加,两者对DPPH自由基的清除作用均增大,在320 μg/mL时竹茹总黄酮提取物对DPPH自由基的清除率为70.33%±1.21%,低于VC的73.68%±2.25%。另外,在10~320 μg/mL范围时,VC及竹茹总黄酮提取物对DPPH自由基的清除率与其浓度相关性较好。由回归方程求得VC和竹茹总黄酮提取物的IC50值分别为123.5和150.1 μg/mL。以上结果表明,虽然竹茹总黄酮提取物对DPPH自由基的清除能力弱于VC,但也具有较强的清除能力,且与浓度具有量效关系。
2.4.2 清除ABTS+自由基能力
由图4可知,样品浓度在10~320 μg/mL范围时,竹茹总黄酮提取物和VC对ABTS+自由基清除率随着浓度的增加均逐渐增强,两者之间的差距也逐渐缩小。当样品浓度在80~320 μg/mL范围时,竹茹总黄酮提取物对ABTS+自由基的清除能力高于VC,浓度达到320 μg/mL时,竹茹总黄酮提取物对ABTS+自由基的清除率为76.97%±1.86%,略高于VC的76.77%±2.14%。另外,在10~320 μg/mL范围时,VC及竹茹总黄酮提取物对ABTS+自由基的清除率与其浓度相关性较好。由回归方程求得竹茹总黄酮提取物和VC的IC50值分别为44.6和35.1 μg/mL。以上结果表明,虽然竹茹总黄酮提取物对ABTS+自由基的清除能力弱于VC,但也具有较强的清除能力,且与浓度具有量效关系。竹茹中的黄酮类化合物具有抗氧化作用可能是由于其结构上存在羟基,其能够通过与自由基发生化学反应,干扰自由基链式反应发生,从而产生抗氧化作用[30]。
2.4.3 铁离子还原能力
在酸性条件下,Fe3+-TPTZ可被样品中抗氧化物质还原为Fe2+-TPTZ,并呈现出明显的蓝色,在593 nm处有强吸收。当体系中的Fe3+-TPTZ过量时,检测Fe2+-TPTZ的生成量可评价样品的还原能力,即铁离子还原能力(总抗氧化能力)[31]。铁离子还原能力以FRAP值衡量,FRAP值越大,还原能力越强[31]。由图5可知,样品浓度在0.1~1.0 mg/mL范围时,随着浓度的增加,竹茹总黄酮提取物和VC的FRAP值均有所提高。当样品浓度在0.1~0.4 mg/mL范围时,竹茹总黄酮提取物的FRAP值与VC相比,相差不大,当样品浓度在0.4~1.0 mg/mL范围时,竹茹总黄酮提取物的FRAP值与VC相差较大,且竹茹总黄酮提取物的FRAP值大于VC,当浓度为1.0 mg/mL时,竹茹总黄酮提取物的FRAP值为2.63 mmol/L,高于VC的1.75 mmol/L。以上结果表明竹茹总黄酮提取物具有良好的铁离子还原能力,且与浓度具有量效关系。
3. 结论
本研究采用超声波处理与纤维素酶协同法提取竹茹总黄酮,经单因素实验和响应面试验优选出竹茹总黄酮的最佳提取工艺条件为:纤维素酶添加量5%、提取溶液pH4.7、乙醇浓度61%、超声功率240 W、超声温度60 ℃、料液比1:30(g/mL)、超声时间30 min。在此条件下,竹茹总黄酮的得率为0.83%±0.02%,回归模型的实测值与理论预测值0.84%接近(<0.03%),表明该模型可靠。该结果可为今后的相关研究提供技术支持和工艺参考,加快竹茹资源的开发与利用。
体外抗氧化活性研究结果表明,竹茹总黄酮提取物对DPPH自由基、ABTS+自由基均具有一定的清除能力,其对DPPH自由基、ABTS+自由基的IC50值分别为150.1 μg/mL和44.6 μg/mL,同时还具有较好的铁离子还原能力(强于VC)。实验结果证明了竹茹总黄酮提取物具有较强的抗氧化活性,可为其今后作为天然抗氧化剂应用于食品等领域提供数据支撑。
-
图 1 纤维素酶添加量(A)、提取溶液pH(B)、乙醇浓度(C)、超声功率(D)、超声温度(E)、料液比(F)和超声时间(G)对竹茹总黄酮得率的影响
注:不同小写字母表示差异显著,P<0.05。
Figure 1. Effects of amount of cellulase added (A), pH of extraction solvents (B), ethanol concentration (C), ultrasonic power (D), ultrasonic temperature (E), material-liquid ratio (F) and ultrasonic time (G) on the total flavonoids yield of Bambusae Caulis in Taeniam
表 1 响应面试验因素与水平设计
Table 1 Factors and levels of response surface methodology design
水平 因素 A乙醇浓度(%) B提取溶液pH C超声功率(W) −1 50 4 200 0 60 5 240 1 70 6 280 表 2 竹茹总黄酮提取的响应面试验设计与结果
Table 2 Design and results of response surface methodology of extracting total flavonoids of Bambusae Caulis in Taeniam
实验号 A:乙醇浓度(%) B:提取溶液pH C:超声功率(W) Y:总黄酮得率(%) 1 60 5 240 0.82±0.03 2 50 5 200 0.76±0.01 3 60 5 240 0.82±0.03 4 60 6 200 0.77±0.02 5 50 6 240 0.78±0.02 6 60 5 240 0.82±0.03 7 70 5 280 0.78±0.02 8 50 5 280 0.76±0.01 9 60 5 240 0.82±0.03 10 60 5 240 0.82±0.03 11 70 5 200 0.79±0.02 12 70 6 240 0.76±0.02 13 60 6 280 0.79±0.02 14 50 4 240 0.80±0.02 15 70 4 240 0.79±0.02 16 60 4 280 0.80±0.02 17 60 4 200 0.80±0.02 表 3 回归模型方差分析
Table 3 Variance analysis of regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 0.012 9 1.374×10−3 25.42 0.0007 ** A 7.812×10−5 1 7.812×10−5 8.081 0.0031 ** B 7.411×10−4 1 7.411×10−4 2.77 0.0123 * C 8.000×10−6 1 8.000×10−6 18.27 0.0012 ** AB 2.500×10−5 1 2.500×10−5 0.26 0.8768 NS AC 5.625×10−5 1 5.625×10−5 5.058 0.00816 ** BC 5.625×10−5 1 5.625×10−5 0.58 0.8164 NS A2 5.247×10−3 1 5.247×10−3 15.42 0.00527 ** B2 1.260×10−3 1 1.260×10−3 8.30 0.00913 ** C2 3.802×10−3 1 3.802×10−3 13.93 0.00879 ** 残差 6.772×10−3 7 9.674×10−4 失拟项 7.547×10−4 3 2.516×10−4 0.17 0.9132 NS 纯误差 6.017×10−3 4 1.504×10−3 总离差 0.019 16 R2 0.9916 R2Adj 0.9866 注:*表示有显著差异(0.01<P<0.05);**表示极显著差异(P<0.01);NS表示无显著差异(P>0.05)。 表 4 不同提取方法对竹茹总黄酮得率的影响
Table 4 Effects of different extraction methods on the total flavonoids yield of Bambusae Caulis in Taeniam
提取方法 工艺参数 总黄酮得率(%) 回流提取法 料液比1:30(g/mL)、乙醇浓度80%、提取温度90 ℃、提取时间120 min 0.57±0.02 超声波提取法 设置纤维素酶添加量为0,其余条件与超声波处理与纤维素酶协同提取法一致 0.54±0.02 纤维素酶提取法 设置超声功率为0 W,其余条件与超声波处理与纤维素酶协同提取法一致 0.48±0.01 超声波处理与纤维素酶协同提取法 纤维素酶添加量5%、提取溶液pH4.7、乙醇浓度61%、超声功率240 W、超声温度60 ℃、
料液比1:30(g/mL)、超声时间30 min0.83±0.02 -
[1] 周冰倩, 高喜梅, 狄留庆, 等. 不同来源竹茹药材HPLC指纹图谱和化学计量学分析[J]. 中草药,2022,53(3):853−857. [ZHOU B Q, GAO X M, DI L Q, et al. Quality analysis of Caulis Bambusae in Taeniam from different origins by HPLC coupled with chemometrics[J]. Chinese Traditional and Herbal Drugs,2022,53(3):853−857. ZHOU B Q, GAO X M, DI L Q, et al. Quality analysis of Caulis Bambusae in Taeniam from different origins by HPLC coupled with chemometrics [J]. Chinese Traditional and Herbal Drugs, 2022, 53(3): 853-857.
[2] 张建友, 吴晓琴, 张 英. 竹茹提取物成分分析及功能初探[J]. 食品工业科技,2011,32(2):151−154. [ZHANG J Y, WU X Q, ZHANG Y. Components analysis and functions of bamboo shavings extract[J]. Science and Technology of Food Industry,2011,32(2):151−154. doi: 10.13386/j.issn1002-0306.2011.02.048 ZHANG J Y, WU X Q, ZHANG Y. Components analysis and functions of bamboo shavings extract [J]. Science and Technology of Food Industry, 2011, 32(2): 151-154. doi: 10.13386/j.issn1002-0306.2011.02.048
[3] 楼鼎鼎. 竹茹超临界萃取物的组成分析和功能性研究[D]. 杭州: 浙江大学, 2005 LOU D D. Components analysis and functions research of the extract of bamboo bark by SFE[D]. Hangzhou: Zhejiang University, 2005.
[4] JIN G H, PARK S Y, LEE S J, et al. Anti-inflflammatory activity of Bambusae Caulis in Taeniam through heme oxygenase-1 expression via Nrf-2 and p38 MAPK signaling in macrophages[J]. Environmental Toxicology and Pharmacology,2012,34:315−323. doi: 10.1016/j.etap.2012.05.001
[5] 黄菊青, 齐睿婷, 张英. 竹茹多糖的化学结构及体外免疫活性研究[J]. 中国食品学报,2017,17(7):34−40. [HUANG J Q, QI R T, ZHANG Y. Structure andin vitro immunomodulatory activity of polysaccharides from Bamboo (Phyllostachys pubescens Mazel) Shavings[J]. Journal of Chinese Institute of Food Science and Technology,2017,17(7):34−40. HUANG J Q, Qi R T, ZHANG Y. Structure and in vitro immunomodulatory activity of polysaccharides from Bamboo (Phyllostachys pubescens Mazel) Shavings [J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(7): 34-40.
[6] 洪新宇, 朱云龙, 陈林根, 等. 竹茹提取物黄酮和内酯延缓皮肤细胞衰老的效能[J]. 日用化学工业,2003,33(5):302−304. [HONG X Y, ZHU Y L, CHEN L G, et al. Efficacy of flavone and lactone in caulis bambusae extract on delaying of skin-cell aging[J]. China Surfactant Detergent & Cosmetics,2003,33(5):302−304. doi: 10.13218/j.cnki.csdc.2003.05.009 HONG X Y, ZHU Y L, CHEN L G, et al. Efficacy of flavone and lactone in caulis bambusae extract on delaying of skin-cell aging [J]. China Surfactant Detergent & Cosmetics, 2003, 33(5): 302-304. doi: 10.13218/j.cnki.csdc.2003.05.009
[7] DUROVIĆ S, ŠORGIĆ S, POPOV S, et al. Recovery of biologically active compounds from stinging nettle leaves part I: Supercritical carbon dioxide extraction[J]. Food Chemistry,2022,373:131724. doi: 10.1016/j.foodchem.2021.131724
[8] 王敏, 徐国辉, 黄赣辉, 等. 黄蜀葵花总黄酮提取工艺优化及其对黄嘌呤氧化酶的抑制作用[J]. 食品工业科技,2022,43(12):223−229. [WANG M, XU G H, HUANG G H, et al. Optimization of extraction process for total flavonoids from Abelmoschus manihot and its inhibitory effect on xanthine oxidase[J]. Science and Technology of Food Industry,2022,43(12):223−229. WANG M, XU G H, HUANG G H, et al. Optimization of extraction process for total flavonoids from Abelmoschus manihot and its inhibitory effect on xanthine oxidase [J]. Science and Technology of Food Industry, 2022, 43(12): 223-229.
[9] 桂利利, 吴正坤, 李飞, 等. 黄药叶总黄酮提取工艺优化及其抗氧化活性研究[J]. 食品研究与开发,2021,42(19):100−108. [GUI L L, WU Z K, LI F, et al. Optimization of extraction and antioxidant activity of total flavonoids from Premna cavaleriei Levl. leaves[J]. Food Research and Development,2021,42(19):100−108. doi: 10.12161/j.issn.1005-6521.2021.19.015 GUI L L, WU Z K, LI F, et al. Optimization of extraction and antioxidant activity of total flavonoids from Premna cavaleriei Levl. leaves [J]. Food Research and Development, 2021, 42(19): 100-108. doi: 10.12161/j.issn.1005-6521.2021.19.015
[10] 杜蕾, 谷令彪, 张光杰, 等. 酶解法提取花生壳黄酮及其抗氧化性、抑菌性研究[J]. 中国调味品,2022,47(1):195−199. [DU L, GU L B, ZHANG G J, et al. Study on extraction of flavonoids from peanut shells by enzymatic hydrolysis method and their antioxidant activity and antibacterial activity[J]. China Condiment,2022,47(1):195−199. doi: 10.3969/j.issn.1000-9973.2022.01.038 DU L, GU L B, ZHANG G J, et al. Study on extraction of flavonoids from peanut shells by enzymatic hydrolysis method and their antioxidant activity and antibacterial activity [J]. China Condiment, 2022, 47(1): 195-199. doi: 10.3969/j.issn.1000-9973.2022.01.038
[11] MEINI M R, CABEZUDO I, BOSCHETTI C E, et al. Recovery of phenolic antioxidants from Syrah grape pomace through the optimization of an enzymatic extraction process[J]. Food Chemistry,2019,283:257−264. doi: 10.1016/j.foodchem.2019.01.037
[12] ZHU J P, KOU X H, WU C E, et al. Enhanced extraction of bioactive natural products using ultrasound-assisted aqueous two-phase system: Application to flavonoids extraction from jujube peels[J]. Food Chemistry,2022,395:133530. doi: 10.1016/j.foodchem.2022.133530
[13] 胡栋宝, 黄淑佩, 祝晓慧, 等. 响应面优化鸡油菌多酚的超声辅助提取工艺及其抗氧化活性[J]. 食品工业科技,2022,43(18):177−184. [HU D B, HUANG S P, ZHU X H, et al. Ultrasound-assisted extraction of polyphenols from the mushroom of Cantharelles cibarius and its antioxidant activity[J]. Science and Technology of Food Industry,2022,43(18):177−184. HU D B, HUANG S P, ZHU X H, et al. Ultrasound-assisted extraction of polyphenols from the mushroom of Cantharelles cibarius and its antioxidant activity [J]. Science and Technology of Food Industry, 2022, 43(18): 177-184.
[14] 丁梁斌, 马春梅, 赵苹苹, 等. 响应面法优化酶解-超声辅助提取鸡血藤多糖工艺研究[J]. 中国食品添加剂,2021,7:88−96. [DING L B, MA C M, ZHAO P P, et al. Optimization of enzymatic hydrolysis-ultrasonic assisted extraction of polysaccharides from Spatholobi by response surface methodology[J]. China Food Additives,2021,7:88−96. doi: 10.19804/j.issn1006-2513.2021.07.014 DING L B, MA C M, ZHAO P P, et al. Optimization of enzymatic hydrolysis-ultrasonic assisted extraction of polysaccharides from spatholobi by response surface methodology [J]. China Food Additives, 2021, 7: 88-96. doi: 10.19804/j.issn1006-2513.2021.07.014
[15] 希力阿扎提·阿不力米提, 詹羽姣, 赵军, 等. 酶辅助超声提取阿尔泰金莲花总黄酮工艺研究[J]. 中国食品添加剂,2020,4:68−75. [XILIAZHATI A, ZHAN Y J, ZHAO J, et al. Study on enzymatic-assisted ultrasonic extraction of total flavonoids from Trollius altaicus[J]. China Food Additives,2020,4:68−75. doi: 10.19804/j.issn1006-2513.2020.04.006 XILIAZHATI A, ZHAN Y J, ZHAO J, et al. Study on enzymatic-assisted ultrasonic extraction of total flavonoids from Trollius altaicus [J]. China Food Additives, 2020, 4: 68-75. doi: 10.19804/j.issn1006-2513.2020.04.006
[16] SAEED R, AHMED D, MUSHTAQ M. Ultrasound-aided enzyme-assisted efficient extraction of bioactive compounds from Gymnema sylvestre and optimization as per response surface methodology[J]. Sustainable Chemistry and Pharmacy,2021,34(4):123−128.
[17] LIU X M, LIU Y, SHAN C H, et al. Effects of five extraction methods on total content, composition, and stability of flavonoids in jujube[J]. Food Chemistry: X,2022,14:100287. doi: 10.1016/j.fochx.2022.100287
[18] IRYANAIHSANPURO S, GUNAWAN S, APARAMARTA H W, et al. Extract with high 1,1-diphenyl-2-picrylhydrazyl (DPPH) inhibitory capability from pericarp and seed of mangosteen (Garcinia mangostana L.) using microwave-assisted extraction (MAE) two-phase solvent technique[J]. Arabian Journal of Chemistry,2022,15(12):104310. doi: 10.1016/j.arabjc.2022.104310
[19] PABLO R C, ESTRELLA E B, DOLORES B M, et al. An electrochemical alternative for evaluating the antioxidant capacity in walnut kernel extracts[J]. Food Chemistry,2022,393:133417. doi: 10.1016/j.foodchem.2022.133417
[20] WANG X Y, LIU X Y, LI Y P, et al. Response surface methodology optimization and HPLC-ESI-QTOF-MS/MS analysis on ultrasonic-assisted extraction of phenolic compounds from okra (Abelmoschus esculentus) and their antioxidant activity[J]. Food Chemistry,2023,405:134966. doi: 10.1016/j.foodchem.2022.134966
[21] 穆易君, 陈洋, 刘崑, 等. 纤维素酶-超声联合提取菠菜中总黄酮及其成分分析[J]. 食品工业科技,2019,40(19):187−193. [MU Y J, CHEN Y, LIU K, et al. Extraction of total flavonoids from spinach by cellulase-ultrasound and its composition analysis[J]. Science and Technology of Food Industry,2019,40(19):187−193. doi: 10.13386/j.issn1002-0306.2019.19.031 MU Y J, CHEN Y, LIU K, et al. Extraction of total flavonoids from spinach by cellulase-ultrasound and its composition analysis [J]. Science and Technology of Food Industry, 2019, 40(19): 187-193. doi: 10.13386/j.issn1002-0306.2019.19.031
[22] 芦宇, 吕长鑫, 纪秀凤, 等. 超声波-纤维素酶辅助提取红树莓籽黄酮及其体外消化研究[J]. 中国食品学报,2019,19(11):100−108. [LU Y, LÜ C X, JI X F, et al. Extraction of flavonoids from red raspberry seed and its in vitro simulated digestion[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(11):100−108. doi: 10.16429/j.1009-7848.2019.11.012 LU Y, LÜ C X, JI X F, et al. Extraction of flavonoids from red Raspberry seed and its in vitro simulated digestion [J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(11): 100-108. doi: 10.16429/j.1009-7848.2019.11.012
[23] LIU Z Q, ZHAO M T, LIU Z Y, et al. Response surface methodology-optimized extraction of flavonoids with antioxidant and antimicrobial activities from the exocarp of three genera of coconut and characterization by HPLC-IT-TOF-MS/MS[J]. Food Chemistry,2022,391:132966. doi: 10.1016/j.foodchem.2022.132966
[24] XU L, HE W J, HE Z Y, et al. Enzyme-assisted ultrasonic-microwave synergistic extraction and UPLC-QTOF-MS analysis of flavonoids from Chinese water chestnut peels[J]. Industrial Crops and Products,2018,117:179−186. doi: 10.1016/j.indcrop.2018.03.012
[25] 阮尚全, 陈蓉, 倪萍, 等. 纤维素酶联合超声波协同提取攀枝花石榴皮总黄酮[J]. 内江师范学院学报,2018,33(10):65−69. [RUAN S Q, CHEN R, NI P, et al. Synergistic extraction of total flavonoids from Pomegranate peel in Panzhihua by joint use of cellulase and ultrasonic wave[J]. Journal of Neijiang Normal University,2018,33(10):65−69. doi: 10.13603/j.cnki.51-1621/z.2018.10.013 RUAN S Q, CHEN R, NI P, et al. Synergistic extraction of total flavonoids from Pomegranate Peel in Panzhihua by joint use of cellulase and ultrasonic wave [J]. Journal of neijiang normal university, 2018, 33(10): 65-69. doi: 10.13603/j.cnki.51-1621/z.2018.10.013
[26] VO T P, NGUYEN L N H, NGUYEN D Q, et al. Optimization of the ultrasonic-assisted extraction process to obtain total phenolic and flavonoid compounds from watermelon (Citrullus lanatus) rind[J]. Current Research in Food Science,2022,5:2013−2021. doi: 10.1016/j.crfs.2022.09.021
[27] 杨宗玲, 李晗, 范方宇, 等. 超声辅助酶法提取无籽刺梨果渣中黄酮的工艺优化及其抗氧化活性[J]. 食品工业科技,2021,42(13):184−192. [YANG Z L, LI H, FAN F Y, et al. Ultrasound-assisted enzymatic extraction of flavonoids from Rosa sterilis pomace and its antioxidant activity[J]. Science and Technology of Food Industry,2021,42(13):184−192. doi: 10.13386/j.issn1002-0306.2020090273 YANG Z L, LI H, FAN F Y, et al. Ultrasound-assisted enzymatic extraction of flavonoids from Rosa sterilis Pomace and its antioxidant activity [J]. Science and Technology of Food Industry, 2021, 42(13): 184-192. doi: 10.13386/j.issn1002-0306.2020090273
[28] 张小梅, 王聪, 靳晓琳, 等. 百香果皮总黄酮的复合酶辅助超声波提取工艺优化及其抗氧化活性分析[J]. 食品工业科技,2022,43(12):215−222. [ZHANG X M, WANG C, JIN X L, et al. Optimization of extraction technology of total flavonoids from Passiflora edulis peel by ultrasonic assisted with complex enzyme and its antioxidant activity[J]. Science and Technology of Food Industry,2022,43(12):215−222. ZHANG X M, WANG C, JIN X L, et al. Optimization of extraction technology of total flavonoids from Passiflora edulis peel by ultrasonic assisted with complex enzyme and its antioxidant activity [J]. Science and Technology of Food Industry, 2022, 43(12): 215-222.
[29] 邢颖, 雷宏杰, 徐怀德, 等. 超声波纤维素酶法提取紫苏叶活性物质及其抗氧化活性[J]. 食品科学,2016,37(10):111−115. [XING Y, LEI H J, XU H D, et al. Extraction of active compounds from Purple Perilla (Perilla frutescens var. acuta) leaves by ultrasonic-cellulase treatment and the related antioxidant activity[J]. Food Science,2016,37(10):111−115. doi: 10.7506/spkx1002-6630-201610019 XING Y, LEI H J, XU H D, et al. Extraction of active compounds from Purple Perilla (Perilla frutescens var. acuta) leaves by ultrasonic-cellulase treatment and the related antioxidant activity [J]. Food Science, 2016, 37(10): 111-115. doi: 10.7506/spkx1002-6630-201610019
[30] 李亚军, 易鹊, 杨军衡, 等. 黑老虎花总黄酮超声辅助提取工艺优化及其抗氧化性研究[J]. 食品工业科技,2021,42(13):179−183. [LI Y J, YI Q, YANG J H, et al. Study on optimization of ultrasonic-assisted extraction technology of total flavonoids from Kadsura coccinea flowers and its antioxidant activity[J]. Science and Technology of Food Industry,2021,42(13):179−183. doi: 10.13386/j.issn1002-0306.2020090267 LI Y J, YI Q, YANG J H, et al. Study on optimization of ultrasonic-assisted extraction technology of total flavonoids from Kadsura coccinea Flowers and its antioxidant activity [J]. Science and Technology of Food Industry, 2021, 42(13): 179-183. doi: 10.13386/j.issn1002-0306.2020090267
[31] 李生茂, 李倩茹, 周春阳, 等. 益智总黄酮超声辅助提取工艺的响应面法优化及其抗氧化活性评价[J]. 保鲜与加工,2021,21(8):43−49. [LI S M, LI Q R, ZHOU C Y, et al. Optimization of ultrasound-assisted extraction technology of total flavonoids from Alpinia oxyphylla fructus by response surface methodology and its antioxidant activities[J]. Storage and Process,2021,21(8):43−49. doi: 10.3969/j.issn.1009-6221.2021.08.007 LI S M, LI Q R, ZHOU C Y, et al. Optimization of ultrasound-assisted extraction technology of total flavonoids from Alpinia oxyphylla Fructus by response surface methodology and its antioxidant activities [J]. Storage and Process, 2021, 21(8): 43-49. doi: 10.3969/j.issn.1009-6221.2021.08.007
-
期刊类型引用(1)
1. 何纪元,陈慧玲,刘盛荣,魏奇. 食用菌蛋白肽生物活性及其应用的研究进展. 食品工业. 2025(02): 182-186 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:



 下载:
下载:
