Study on Process Optimization and Immunomodulatory Effect of Dendrobium Huoshanense Tea
-
摘要: 为了探究霍山石斛(Dendrobium huoshanense,DH)与祁门红茶(Keemun black tea,KBT)协同预防免疫力降低的效果,以石斛多糖提取率和红茶多酚提取率为指标,通过单因素实验和正交试验对霍山石斛和祁门红茶的料液比、提取时间和提取次数因素进行研究,分别优化霍山石斛与祁门红茶的提取工艺,再通过对RAW264.7细胞的毒性试验和吞噬活力试验确定红茶与石斛的最佳配比。结果表明,石斛多糖的最佳提取条件为:料液比1:80(g/mL),提取时间80 min,提取次数4次;茶多酚的最佳提取条件为:料液比1:80(g/mL),提取时间25 min,提取次数5次。通过观察不同比例的混合物对巨噬细胞的影响,确定红茶与石斛的配比。体外试验结果表明,75%红茶和25%石斛配比的祁门红茶和霍山石斛提取混合物(Keemun black tea and Dendrobium huoshanense,KTDH)具有最佳的免疫增强效果。体内试验结果表明KTDH高剂量组对小鼠由于免疫抑制而显著上调作用的细胞因子IL-2和IL-6水平有显著回调作用(P<0.01)。综上所述,霍山石斛与祁门红茶可协同增强免疫力并预防免疫力下降,可为霍山石斛和祁门红茶的开发应用途径提供新思路。Abstract: To explore the synergisic effect of DH (Dendrobium huoshanense) and KBT (Keemun black tea) on preventing immunity reduction. The solid-liquid ratio, extraction time and extraction times of DH and KBT were studied by single factor test and orthogonal test with the extraction rate of Dendrobium polysaccharide and black tea polyphenols as indexes, the extraction techniques of DH and Keemun black tea were optimized respectively. The optimal ratio of KBT and DH was determined by toxicity test and phagocytosis test on RAW264.7 cells. The results showed that the optimum extraction conditions of DH polysaccharide were as follows: The ratio of material to liquid was 1:80 (g/mL), the extraction time was 80 min, and the extraction times were 4 times. The optimum extraction conditions of KBT polyphenols were as follows: The ratio of material to liquid was 1:80 (g/mL), the extraction time was 25 min, and the extraction times were 5 times. The ratio of KBT to DH was determined by observing the effect of different proportions of the mixture on macrophages. The results of the in vitro experiment showed that the extract mixture of 75% KBT and 25% DH had the best immune-enhancing effect. The results of the in vivo test showed that the high-dose group of KTDH could significantly reduce the changes of levels of cytokines IL-2 and IL-6 due to immunosuppression in mice (P<0.01). To sum up, DH and KBT can synergistically enhance immunity and prevent immune decline, which can provide new ideas for the development and application of DH and KBT.
-
Keywords:
- Dendrobium huoshanense /
- Keemun black tea /
- extraction process /
- immunoregulation
-
霍山石斛(Dendrobium hooshanense C.Z.Tang et S.J.Cheng,兰科)的茎在许多东南亚国家被用作泡茶、汤和粥的原料,已有数百年的历史[1],其中霍山石斛是兰科石斛属(Dendrobium)的一种重要的食用药用植物[2]。主产地为安徽大别山,常生长于石缝,树木以及地势陡峭之地。霍山石斛具有多种活性成分,如多糖类、双苄基类、倍半萜类、酚类等化学成分,其中多糖类成分是其主要成分,药理活性也多来源于霍山石斛多糖[3]。近年来,霍山石斛被报道具有多种药理活性,如抗炎、抗氧化、抗肿瘤和免疫调节作用[3-6],因此霍山石斛的价值也飞速上涨,但是关于霍山石斛的产品开发却还处于探索之中。目前关于霍山石斛的产品主要有石斛花茶,石斛鲜叶速溶粉,石斛功能性酸奶等[7],仍需进一步的研究和探索。 茶是世界上最畅销的饮料,根据发酵程度分为绿茶、乌龙茶和红茶[8],其中红茶在世界范围内受到广泛的追捧和喜爱[9]。红茶作为一种健康饮料,对人体有许多有益的作用,如增强免疫力、降压、抗肿瘤、抗癌等[10-13]。而茶多酚是茶叶中主要的活性成分,有报道表明其具有免疫调节作用[14-15]。红茶中的祁门红茶作为中国四大红茶之一,具有口感好,营养价值丰富等优点[16]。而作为一种日常饮品来说,祁门红茶具有容易被人接受,价格亲民等优势,因此在将来,茶类资源会得到更为充分的利用,而增强其核心竞争力便要对其进行改良和创新。
随着年龄的增长,大多数人免疫力的下降是不可避免的,部分人群也会因为工作,生活节奏等原因导致免疫力下降[17-18]。而免疫能力的下降对机体免疫外界病原微生物有着巨大影响。霍山石斛与祁门红茶都具有调节免疫的功效,同时广大人民对红茶的接受程度性较高,因此开发一款具有免疫调节功能,同时能为广大消费者接受的饮品不仅是对茶类资源的充分利用,对霍山石斛的资源开发也有着重要意义。本研究主要是通过对祁门红茶和霍山石斛有效成分的提取条件优化,再以细胞免疫活性为指标制备出增强免疫能力的茶饮,同时进一步探索其体外免疫活性,为后续的霍山石斛资源的开发和应用提供理论基础。
1. 材料与方法
1.1 材料与仪器
霍山石斛干茎(生产批号:20220622133612) 中国中药霍山石斛科技有限公司;祁门红茶(生产批号:SC11434102405025) 祁门县祁雅茶业有限公司;苯酚(生产批号:200705) 西陇科学股份有限公司;RAW264.7细胞T25(批号:CL-0190) 武汉普诺赛生命科技有限公司;DMEM(Dulbecco’s Modified Eagle Medium)培养基(生产批号:8121701) 南京锦在生物科技有限公司;PBS(磷酸缓冲盐溶液)(生产批号:8122056) 赛默飞世尔生物化学制品有限公司;胎牛血清 武汉普诺赛生命科技有限公司;CCK-8(Cell Counting Kit-8)试剂 亚科因生物技术有限公司;冰醋酸(生产批号:20181101) 天津市大茂化学试剂厂;无水乙醇(生产批号:E809056)、环磷酰胺(生产批号:Art.No.C849559-500 mg) 上海麦克林生化科技有限公司;中性红染剂 上海碧云天生物技术有限公司;清洁级KM小鼠(许可证号:SCXK(豫)2020-0005)(生产批号:No.410000000000002551) 河南斯克贝斯生物科技股份有限公司;小鼠IL-2、IL-6、TNF-α ELISA(Enzyme-Linked Immuno Sorbent Assay)试剂盒(生产批号:YXL-20176、YNL-20188、YXL-20852) 四川成都源诺天成科技有限公司;4%多聚甲醛(生产批号:22105339) 合肥兰杰柯科技有限公司。
UPT-II-10纯水机 上海杲森仪器设备有限公司;H1-16K离心机 湖南可成仪器设备有限公司;Synergy H1多功能酶标仪 合肥远明科技有限公司。
1.2 实验方法
1.2.1 祁门红茶与霍山石斛煎煮工艺
称取一定量的祁门红茶与霍山石斛,分别按照不同料液比加入超纯水,经过不同煎煮时间和次数进行提取,分别得到霍山石斛与祁门红茶提取液。
1.2.1.1 单因素提取实验
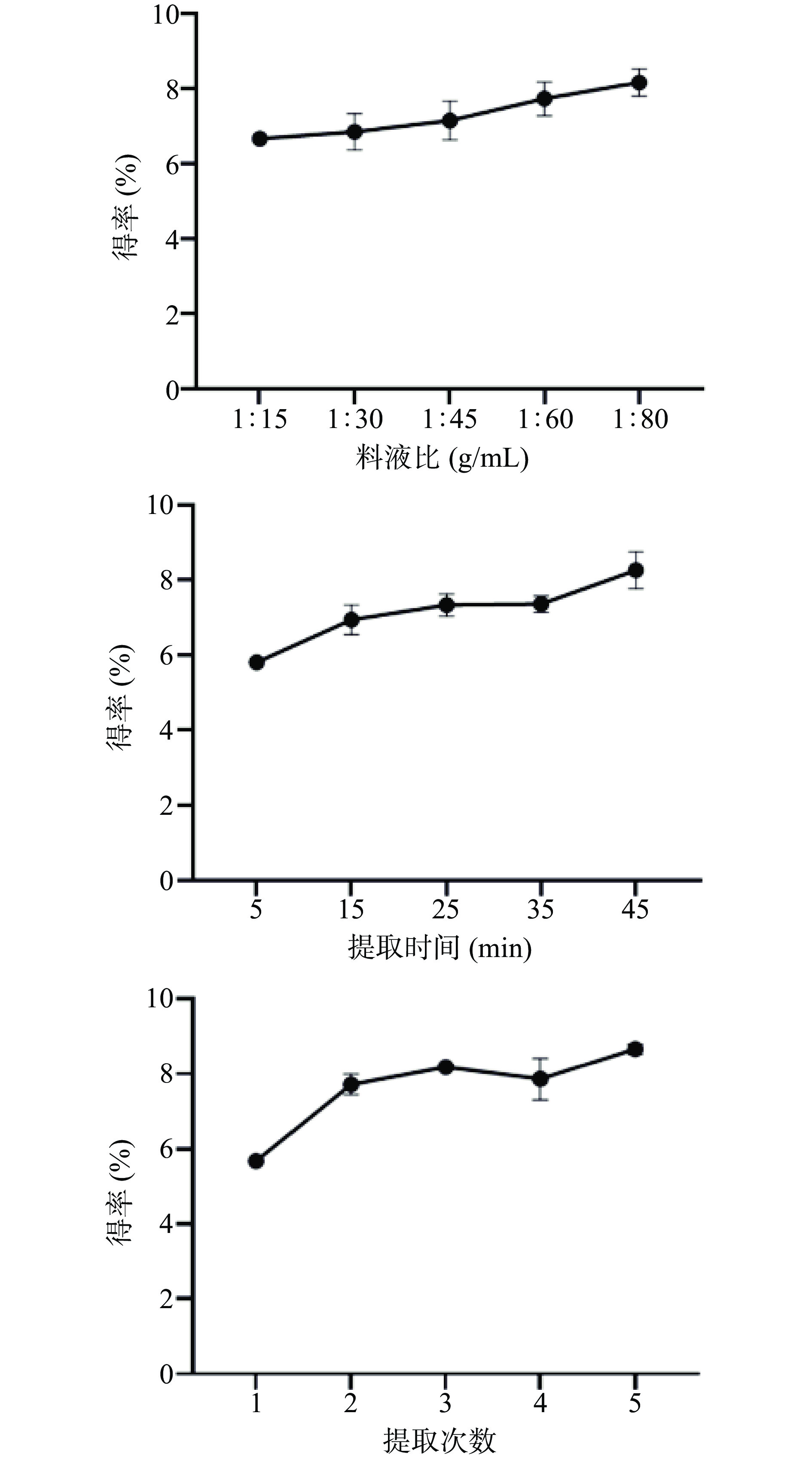
准确称取祁门红茶1.0 g,放入圆底烧瓶中,用冷凝回流法煎煮提取,以煎煮后提取液的茶多酚得率为指标,以福林酚法[19]测定提取液中的多酚含量,考察不同料液比(g/mL)(1:15、1:30、1:45、1:60、1:80)、提取时间(5、15、25、35、45 min)、提取次数(1、2、3、4、5)对祁门红茶煎煮效果的影响。在固定提取时间为25 min、提取次数为3次的条件下,考察料液比(g/mL)(1:15、1:30、1:45、1:60、1:80)对祁门红茶提取效果的影响;在固定料液比为1:80(g/mL)、提取次数为3次的条件下,考察提取时间(5、15、25、35、45 min)对祁门红茶提取效果的影响;在固定料液比为1:80(g/mL)、提取时间为45 min的条件下,考察提取次数(1、2、3、4、5)对祁门红茶提取效果的影响。
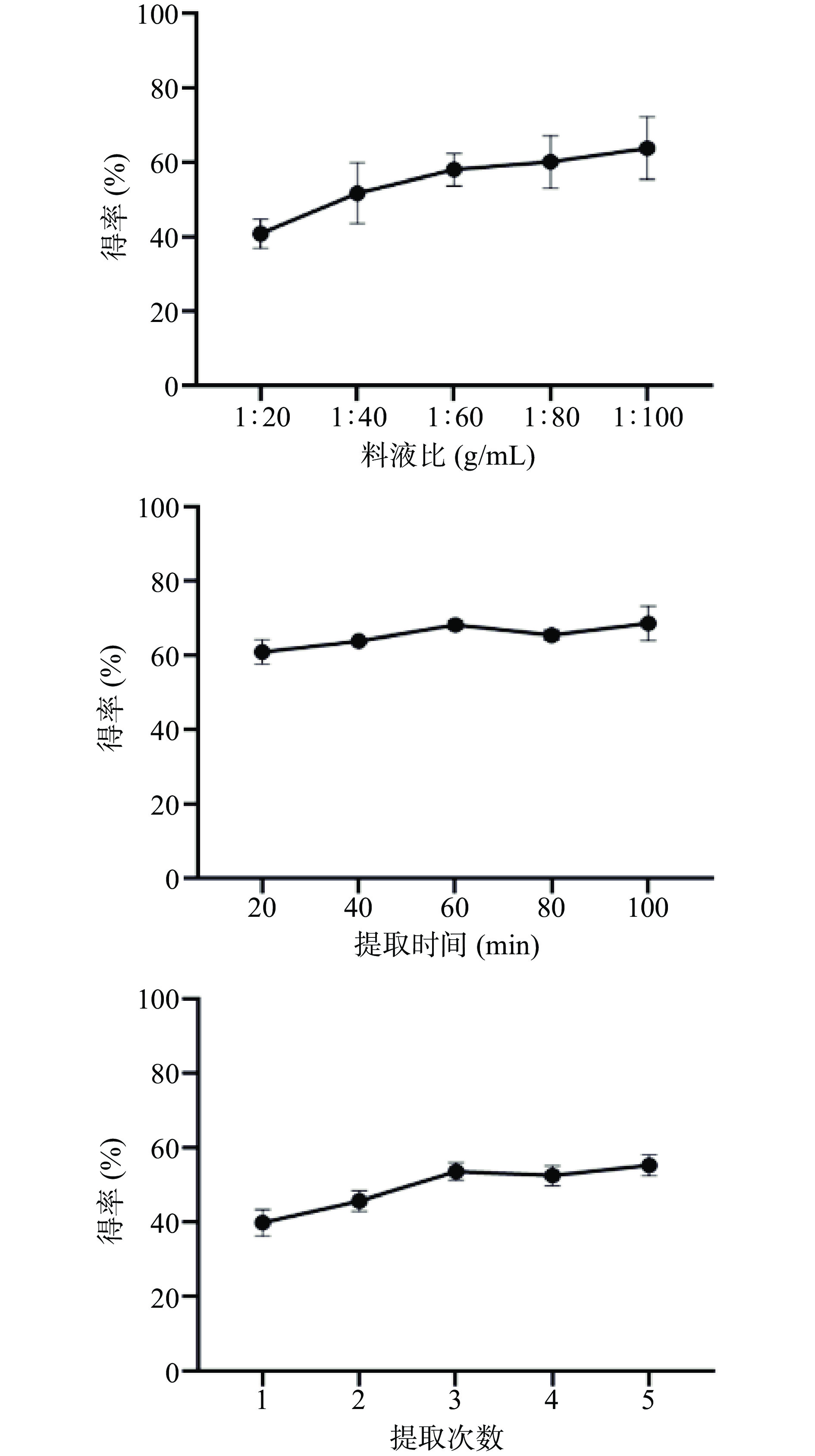
准确称取霍山石斛粉末1.0 g,放入圆底烧瓶中,用冷凝回流法煎煮提取,以石斛多糖得率为指标,以硫酸苯酚法[20]测定提取液中的多糖含量,考察不同料液比(g/mL)(1:20、1:40、1:60、1:80、1:100)、提取时间(20、40、60、80、100 min)、提取次数(1、2、3、4、5)对霍山石斛提取效果的影响。在固定提取时间为60 min、提取次数为3次的条件下,考察料液比(g/mL)(1:20、1:40、1:60、1:80、1:100)对霍山石斛提取效果的影响;在固定料液比为1:100(g/mL)、提取次数为3次的条件下,考察提取时间(20、40、60、80、100 min)对祁门红茶提取效果的影响;在固定料液比为1:100(g/mL)、提取时间为60 min的条件下,考察提取次数(1、2、3、4、5)对祁门红茶提取效果的影响。
1.2.1.2 正交试验
根据单因素实验结果,采用L9(34)正交试验设计,分别对祁门红茶和霍山石斛的工艺参数进行优化,因素水平如表1、表2所示。
表 1 祁门红茶提取工艺正交试验因素水平Table 1. Factors and levels of the orthogonal experiment for Keemum black tea extraction process水平 因素 A料液比(g/mL) B提取时间(min) C提取次数 1 1:45 25 3 2 1:60 35 4 3 1:80 45 5 表 2 霍山石斛提取工艺正交试验因素水平Table 2. Factors and levels of the orthogonal experiment for Dendrobium huoshanensis extraction process水平 因素 A料液比(g/mL) B提取时间(min) C提取次数 1 1:60 40 3 2 1:80 60 4 3 1:100 80 5 1.2.1.3 标准曲线的制作
采用福林酚法和硫酸苯酚法绘制标准曲线和作为后续测试提取液中指标成分的检测方法。
茶多酚标准曲线:以没食子酸标准工作液浓度为横坐标(X),反应液吸光度为纵坐标(Y),绘制标准曲线。标准曲线线性方程为:Y=0.0052X+0.0137(R2=0.9984)。
多糖标准曲线:以葡萄糖标准工作液浓度为横坐标(X),反应液吸光度为纵坐标(Y),绘制标准曲线。标准曲线线性方程为:Y=8.4223X−0.0058(R2=0.9990)。
1.2.1.4 得率的计算
多糖得率(%)=C1V1M1×100 多酚得率(%)=C2V2M2×100 注:C1为石斛多糖浓度(g/mL),V1为石斛水提物总体积(mL),M1为霍山石斛质量(g);C2为祁门红茶多酚浓度(g/mL),V2为祁门红茶水提物总体积(mL),M2为祁门红茶质量(g)。
1.2.2 茶与石斛提取液混合液对细胞增殖活力的影响
根据文献[21]方法,将霍山石斛提取液和祁门红茶提取液按照不同比例混合,再将其稀释成不同的浓度梯度后过0.22 μm微孔滤膜除菌。将购买的RAW264.7细胞在添加了10%胎牛血清的DMEM培养基中,放置于细胞培养箱中培养,培养箱条件为37 ℃,5% CO2的潮湿环境。培养一段时间后,将1×105的RAW 264.7细胞接种在96孔板中,每组平行6孔,并培养24 h以供其贴壁生长。用不同配比(100%石斛,100%祁门红茶,75%的祁门红茶加25%霍山石斛,50%祁门红茶加50%霍山石斛,25%祁门红茶加75%霍山石斛)和不同浓度(0、2.5、5、10、20、40、50、100 μg/mL)的茶与石斛提取混合液(KTDH)处理细胞24 h,每孔加入10 μL CCK-8试剂后,在细胞培养箱中孵育RAW 264.7细胞4 h。使用酶标仪在450 nm波长下测量吸光度值。
细胞活力(%)=OD给药组OD对照组×100 1.2.3 茶与石斛提取液混合液对细胞吞噬活力的影响
RAW264.7细胞接种于96孔板中,每组平行6孔,使每孔细胞为1×105。培养24 h后,弃去上清液。用10 μL不同配比(100%石斛,100%祁门红茶,75%的祁门红茶加25%霍山石斛,50%祁门红茶加50%霍山石斛,25%祁门红茶加75%霍山石斛)和不同浓度(2.5、5、10、20、40、50、100 μg/mL)的茶与石斛提取混合液(KTDH)和10 μL的10 μg/mL LPS预处理RAW264.7细胞24 h,然后加入100 μL的5%中性红溶液,将RAW264.7细胞置于细胞培养箱中培养4 h,弃上清液,用pH7.4的磷酸盐缓冲液(PBS)洗涤2次。最后加入200 μL细胞裂解缓冲液(乙醇:1%冰醋酸=1:1),室温孵育30 min,使用酶标仪在540 nm波长下测量吸光度值。根据不同配比对免疫细胞的影响筛选出最佳配方以供后续实验使用。
吞噬活力(%)=OD给药组OD对照组×100 1.2.4 茶与石斛提取液混合液对环磷酰胺造成的免疫抑制的预防作用
1.2.4.1 动物分组与处理
KM小鼠适应性饲养3 d后用于实验。在实验之前和在实验期间,将小鼠饲养在温度(25±2)℃和12 h明暗循环的受控环境条件下,并且充足饲料和水源的条件下自由进食。将小鼠随机分为5组(n=10):正常对照组(NC)、Cy(环磷酰胺)模型组(MC)、Cy+低剂量组(KTDH(100))、Cy+中剂量组(KTDH(200))、Cy+高剂量组(KTDH(400))。第1~10 d给NC组和MC组灌胃生理盐水,给KTDH(400)组,KTDH(200)组和KTDH(100)组分别以400、200、100 mg/kg剂量的KTDH灌胃小鼠;从第8~10 d,除NC组外,其余各组小鼠腹腔注射80 mg/kg Cy,NC组注射等量生理盐水,每天一次,连续3 d。末次给药后24 h禁食禁水,称量体重,取血,取脾脏,脱脊椎处死小鼠。
1.2.4.2 指标测定及病理形态观察
摘眼球取血后,静置1 h,离心(6000×g,3 min,4 ℃)获得血清。按照试剂盒说明通过试剂盒检测血清中IL-2、IL-6、TNF-α水平。
将脾脏切片依次置于二甲苯I中20 min,二甲苯II中20 min,无水乙醇I中5 min,无水乙醇II中5 min, 75%乙醇中5 min,最后用自来水冲洗。切片浸苏木精染色液3~5 min后,用自来水冲洗,用分化液分化,再用自来水冲洗,反蓝液反蓝,最后用流水冲洗。切片在85%、95%梯度酒精中脱水5 min,在伊红染色液中染色5 min。切片先后置于无水乙醇I中5 min、无水乙醇II中5 min、无水乙醇III中5 min、二甲苯I中5 min、二甲苯II中5 min,最后用中性胶密封。显微镜检查后采集图像并进行分析。
所有动物实验皆经过皖西学院科学研究伦理审查委员会的许可,批准编号为202207001。
1.3 数据处理
实验数据采用SPSS.26.0软件进行统计分析,用Origin 2019b作图,所有检测结果以均值±标准差(¯X±SD)表示,采用单因素方差分析(ANOVA)比较各组间的均值。
2. 结果与分析
2.1 祁门红茶提取工艺单因素实验结果
料液比对祁门红茶的提取效果的影响如图1中所示,茶多酚得率在料液比小于等于1:80(g/mL)时随着料液比的升高而逐渐升高且后续增多的量逐渐减少,其主要原因应该是由于溶剂的增多导致多酚溶出率的增加。得率在料液比1:80(g/mL)时达到最高值,多酚得率为(8.16±0.37)%。考虑到浓度过低会影响后续产品保健效果,因此选取1:80(g/mL)的料液比进行后续实验。
提取时间对祁门红茶的提取效果如图1中所示,茶多酚得率在45 min时提取效果最佳,多酚得率为(8.25±0.49)%。可能是因为提取时间较长,茶叶完全舒展之后接触面积增大导致多酚溶出率增加。考虑到后续工业化生产的因素,提取时间更长对多酚含量的影响已经很小,因此综合时间成本考虑选取45 min的提取时间进行后续实验。
提取次数对祁门红茶的提取效果影响如图1所示,在提取次数达到3次时,其提取效果较好,多酚得率为(8.13±0.05)%,后续继续增加提取次数对多酚得率的影响并不大,综合考虑性价比和提取效率等因素,将提取次数定为3次。
2.2 霍山石斛提取工艺单因素实验结果
料液比对霍山石斛多糖得率的影响如图2中所示,其多糖得率随着料液比的增加逐渐增加,在料液比1:100(g/mL)时达到最大值,此时的多糖得率为(63.83±8.34)%。考虑到后续浓度较低会对产品的保健效果有影响,因此选取料液比1:100(g/mL)进行后续实验。
提取时间对霍山石斛多糖得率的影响如图2所示,多糖得率在60 min时达到最大值,其主要原因应是提取液中多糖含量过高时,提取时间过久反而导致溶液过于粘稠,导致石斛粉末成团,接触面积下降,导致溶出率下降。因此最后多糖得率为(68.11±1.01)%。因此选取最佳提取时间为60 min进行后续实验。
提取次数对霍山石斛多糖得率的影响如图2所示,多糖得率在提取次数为3次时最高,为(53.57±2.40)%。主要原因可能是在多次提取中石斛粉末多次反复接触溶剂导致提取率升高。且后续增加提取次数对多糖得率的影响并不大,因此选取最佳提取次数3次进行后续实验。
2.3 正交试验结果
祁门红茶的正交试验结果由表3所示,根据极差分析,对祁门红茶的提取因素影响程度大小顺序为C>A>B,也就是提取次数>料液比>提取时间。因此可以确定在实际操作中提取次数对祁门红茶提取效果影响最大,提取时间影响最小。由表3可知其组别中得率最高的提取条件为A3B1C3,而根据各条件K值推断得出的最佳提取条件则是A3B3C3,对两种方法进行重复实验对比,发现两种提取条件无显著性差异,为了节约时间成本,因此最终选用A3B1C3作为最后的提取条件。将该条件经过3次重复性验证,确定其方法具有稳定性和较好的提取效果。
表 3 祁门红茶正交试验结果Table 3. Results of orthogonal test of Keemun black tea实验号 A料液比 B提取时间 C提取次数 多酚得率(%) 1 1 1 1 8.89 2 1 2 2 9.11 3 1 3 3 9.96 4 2 1 1 9.08 5 2 2 3 9.42 6 2 3 2 9.15 7 3 1 3 11.18 8 3 2 1 9.38 9 3 3 2 10.11 K1 27.96 29.15 27.35 K2 27.65 27.91 28.37 K3 30.67 29.22 30.56 R 3.02 1.31 3.21 最佳条件 A3B1C3 霍山石斛的正交试验结果如表4所示,根据极差分析,影响霍山石斛多糖得率的各提取因素的主次顺序为A>C>B,也就是料液比>提取次数>提取时间。说明在提取过程中料液比对霍山石斛多糖得率的影响最大,提取时间影响最小。由表4可知,最佳提取条件为A2B3C2。将该条件经过3次重复性验证,确定其方法具有稳定性和较好的提取效果。
表 4 霍山石斛正交试验结果Table 4. Results of orthogonal test of Dendrobium huoshanensis实验号 A料液比 B提取时间 C提取次数 多糖得率(%) 1 1 1 1 62.52 2 1 2 2 71.55 3 1 3 3 68.25 4 2 1 1 73.10 5 2 2 3 70.25 6 2 3 2 76.40 7 3 1 3 70.32 8 3 2 1 71.67 9 3 3 2 74.94 K1 202.32 205.94 207.29 K2 219.75 213.47 222.89 K3 216.93 219.59 208.82 R 17.43 13.65 15.60 最佳条件 A2B3C2 2.4 提取混合液对免疫细胞增殖活力与吞噬活力的影响
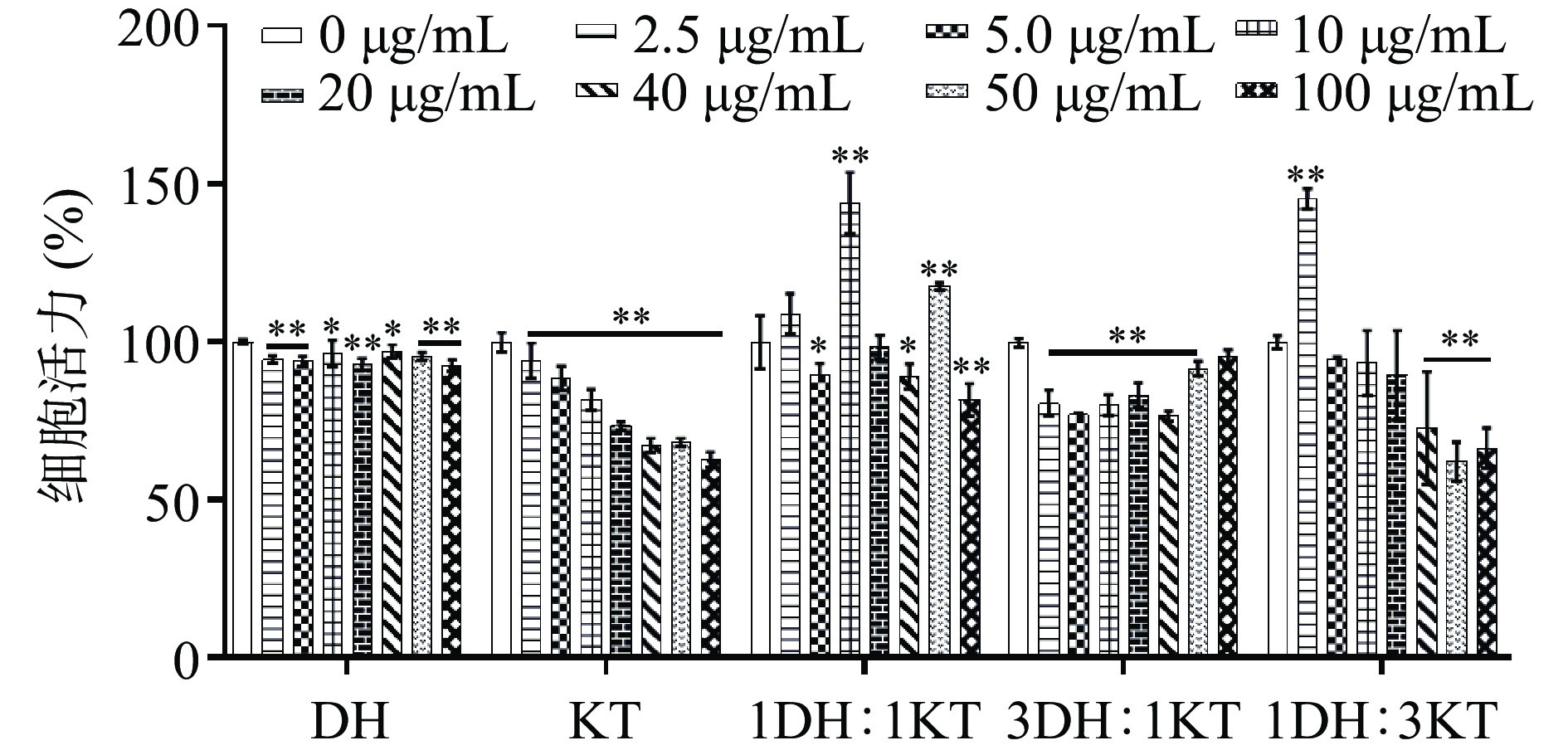
以不同浓度的KTDH(0、2.5、5、10、20、40、50、100 μg/mL)孵育RAW264.7细胞24 h,观察KTDH对RAW264.7细胞的毒性作用。从图3可以看出,KTDH(100%霍山石斛)对细胞活力没有明显增强甚至略有降低,该结果可能是由于霍山石斛多糖具有免疫调节作用,而其他成分对细胞有微弱毒性,细胞吞噬过程中二者皆有摄入,因此导致本组的免疫细胞活力增强不明显甚至降低。KTDH(100%祁门红茶)对细胞的抑制作用随着浓度的增加而增强可能是由于祁门红茶中的细胞毒性成分含量较高。KTDH(75%霍山石斛加25% 祁门红茶)对细胞的抑制趋势与KTDH(100%霍山石斛)相似,皆呈现抑制效果,但KTDH(75%霍山石斛加25% 祁门红茶)抑制作用更强,原因可能是由于加入了祁门红茶配比的提取液整体中具有细胞毒性的物质增多。KTDH(50%霍山石斛加50%祁门红茶)和KTDH(25%霍山石斛加75%祁门红茶)在一定浓度范围内显著增强细胞活力(P<0.05),且增强幅度相似的原因有可能是因为霍山石斛的多糖成分和祁门红茶的多酚成分发挥的免疫调节作用[6,10]。
![]() 图 3 不同浓度和比例的混合溶液对细胞增殖活性的影响(n=6)注:DH:100%霍山石斛、KT:100%祁门红茶、1KT:1DH:50%祁门红茶+50%霍山石斛、1KT:3DH:25%祁门红茶+75%霍山石斛、3KT:1DH:75%祁门红茶+25%霍山石斛;*表示与空白组相比P<0.05,**表示与空白组相比P<0.01;图4同。Figure 3. Effects of different concentrations and ratios of mixed solution on cell proliferation activity (n=6)
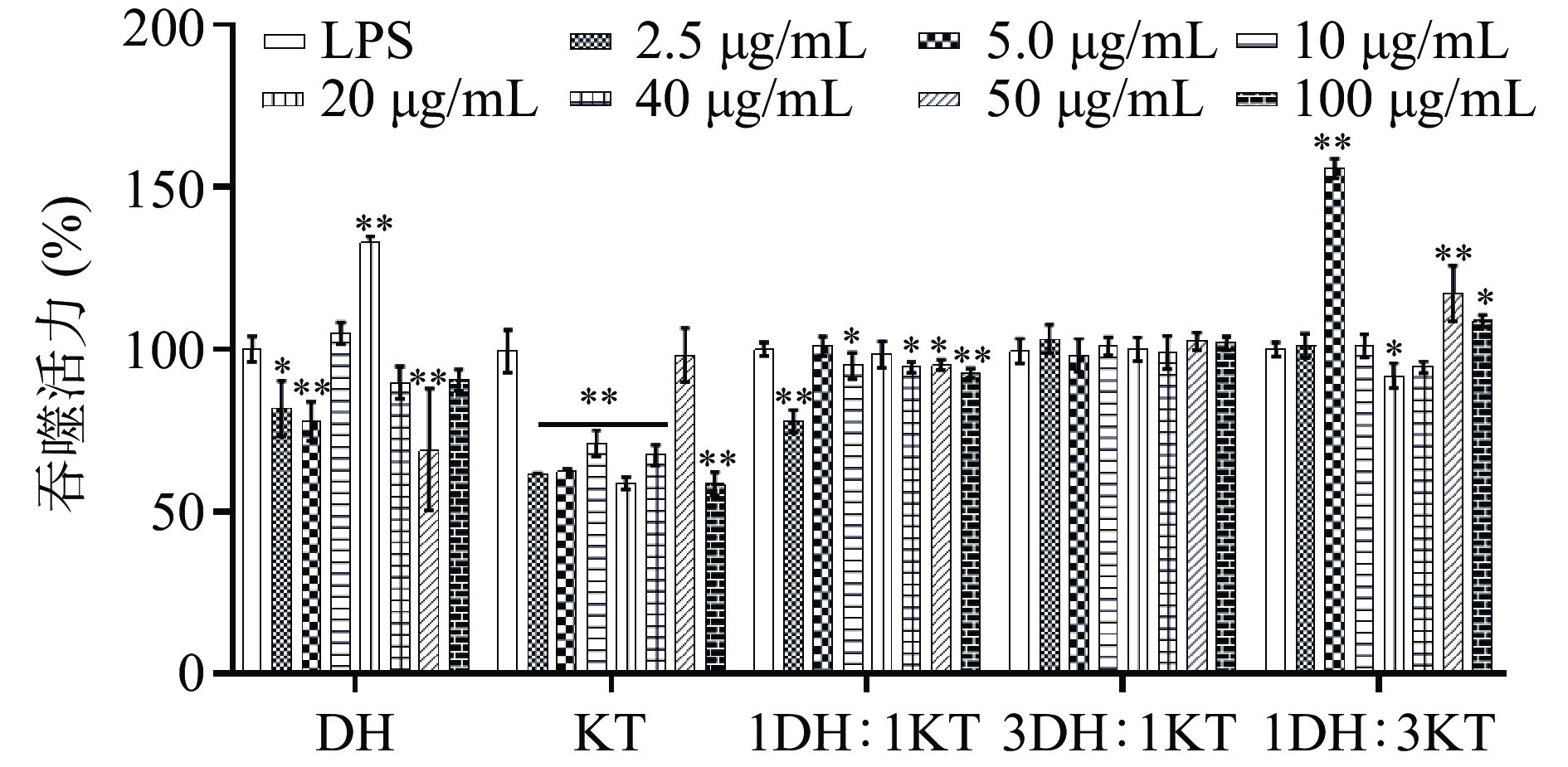
图 3 不同浓度和比例的混合溶液对细胞增殖活性的影响(n=6)注:DH:100%霍山石斛、KT:100%祁门红茶、1KT:1DH:50%祁门红茶+50%霍山石斛、1KT:3DH:25%祁门红茶+75%霍山石斛、3KT:1DH:75%祁门红茶+25%霍山石斛;*表示与空白组相比P<0.05,**表示与空白组相比P<0.01;图4同。Figure 3. Effects of different concentrations and ratios of mixed solution on cell proliferation activity (n=6)以不同浓度的KTDH(2.5、5、10、20、40、50和100 μg/mL)和LPS(10 μg/mL)孵育细胞24 h,用中性红染色法检测细胞的吞噬活性。从图4中可以看出,除KTDH(100%霍山石斛)和KTDH(25%霍山石斛加75%祁门红茶)外,其他处理对细胞吞噬活性的增强效果都不如LPS,KTDH(25%霍山石斛加75%祁门红茶)的免疫增强效果强于KTDH(100%霍山石斛)。综合考虑,选择KTDH(25%霍山石斛加75%祁门红茶)作为后续动物实验的给药配方。
2.5 茶与石斛提取液混合液对环磷酰胺造成的免疫抑制的预防作用
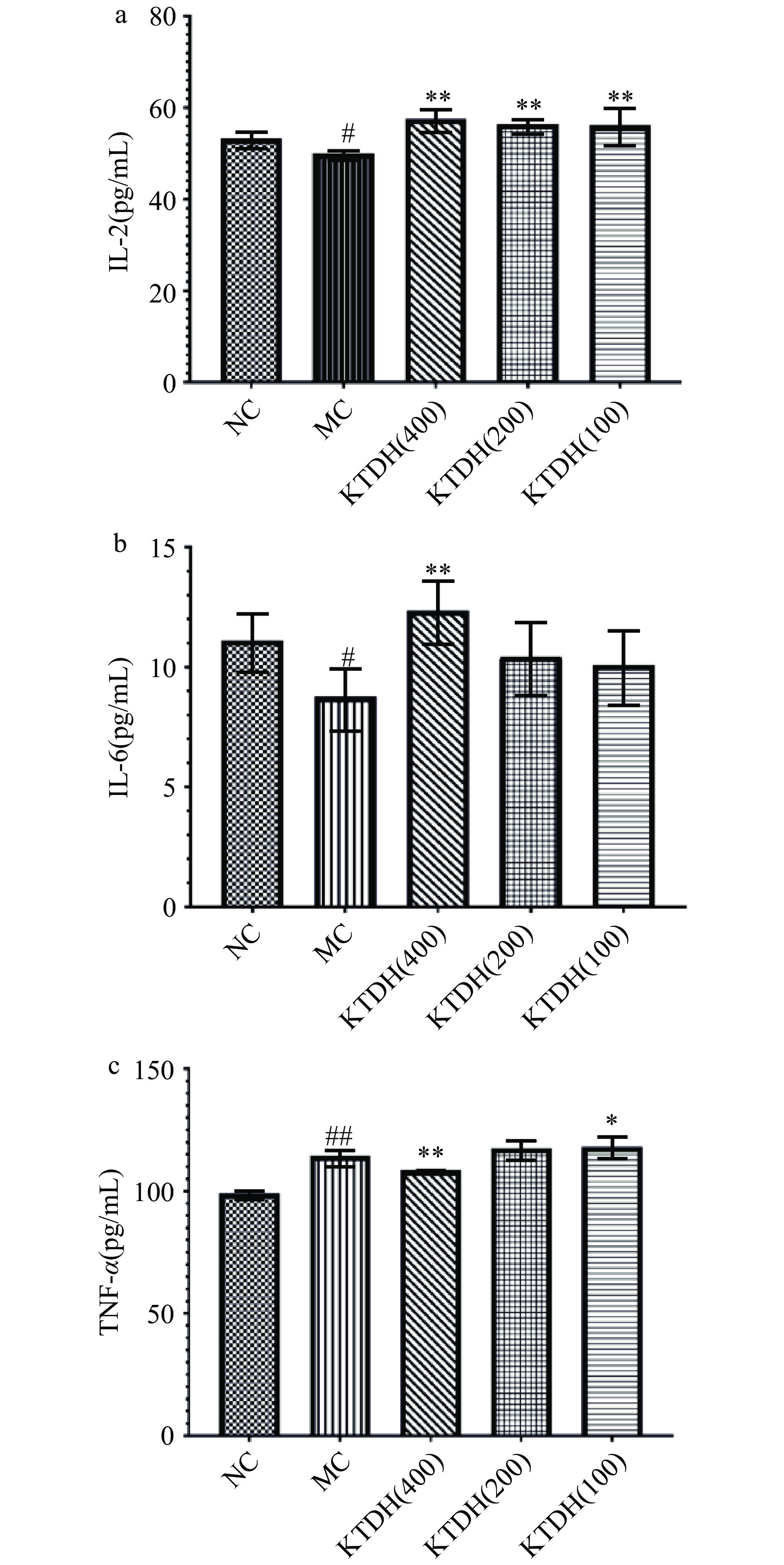
通过建立环磷酰胺诱导的动物模型,探讨KTDH对血液生化指标的影响;采用相关试剂盒检测血清IL-2、IL-6和TNF-α水平。不同组小鼠IL-2和IL-6的含量如图5a和图5b所示,与NC组相比,MC组IL-2和IL-6水平显著降低(P<0.05)。同时,图5a显示各浓度KTDH对IL-2水平的恢复均有积极作用(P<0.01),图5b显示KTDH(400)对IL-6水平的恢复有积极作用(P<0.01)。从图5c可以看出,与NC组相比,MC组的TNF-α水平明显升高(P<0.01)。KDTH(400)对TNF-α水平的恢复起正向作用(P<0.01),而KDTH(100)对TNF-α水平的恢复起负向作用(P<0.05)。
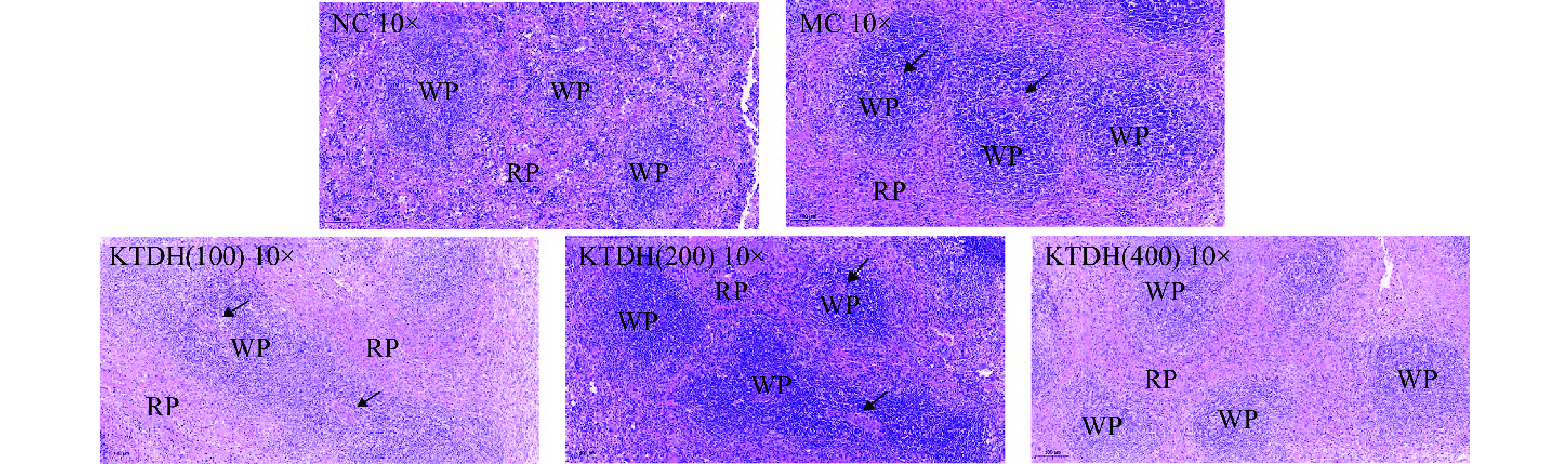
如图6所示,NC组和KDTH(400)组细胞形态相似。脾髓、脾体形态结构规整有序。脾脏内淋巴细胞数量多,排列紧密。脾红髓形态正常,无异常充血。MC组脾体结构疏松,淋巴细胞数量较少。而且,脾的红髓淤血也很严重。与MC组比较,KTDH组(100、200、400 mg/kg)脾小体数量和面积增加,红髓充血程度也不同程度减轻。因此,环磷酰胺可能部分通过减少脾小体发挥免疫抑制作用,而KTDH可能通过保护脾小体,恢复淋巴细胞数量,增强免疫功能。实验结果表明,祁门红茶与霍山石斛的提取物混合液对于环磷酰胺导致的免疫力低下有明显预防作用。
3. 结论与讨论
环磷酰胺是临床上常用的用于肿瘤治疗和血液及骨髓移植的药物,具有良好的免疫抑制效果[22]。因此,通过注射环磷酰胺在小鼠中诱导免疫抑制是一种被广泛接受的免疫抑制模型。白细胞和单核巨噬细胞是免疫系统的重要组成部分,血清中IL-2、IL-6和TNF-α的水平变化是反映免疫活动的重要指标[23-24]。细胞因子作为机体免疫应答系统中的重要因素,不仅可以单独起效,还可以与其他细胞因子相互诱生,相互影响而在免疫反应过程中发挥生物学效应[25]。因此IL-2、IL-6和TNF-α水平变化在一定程度上会影响到免疫反应的进程。有报道表明,霍山石斛多糖可通过激活p38、ERK、JNK和核NF-κB易位,显著刺激RAW 264.7巨噬细胞分泌NO、TNF-α、IL-6和IL-10,具有良好的免疫调节活性[26]。而关于茶多酚的研究表明其对白细胞介素的表达具有一定的抑制作用[27]。因此推测霍山石斛与祁门红茶之间的配伍可以发挥免疫调节作用,不仅可以预防免疫系统被抑制,还可以在免疫系统活动过强时抑制其炎症相关因子的分泌,机制可能是与IL-2、IL-6和TNF-α等炎症因子的表达通路相关。
本研究通过KTDH连续灌胃10 d,随后腹腔注射环磷酰胺的方法,研究了KTDH对免疫抑制的预防作用。结果表明,模型组IL-6、IL-2水平显著性降低(P<0.05),这与之前的研究一致。经KTDH治疗后,小鼠血清中细胞因子IL-6、IL-2水平较模型组有明显升高,证明KTDH可能是通过提高IL-6、IL-2血清水平改善免疫功能。有研究表明,环磷酰胺可引起炎症反应[28]。从血清TNF-α水平的变化来看,环磷酰胺明显引起炎症反应,从而使血清TNF-α水平显著升高(P<0.01)。经KTDH处理后,高剂量组TNF-α水平明显受到抑制(P<0.01)。表明高剂量KTDH可抑制环磷酰胺诱导的炎症反应。
实验结果表明,祁门红茶与霍山石斛的提取物混合液对于环磷酰胺导致的免疫力低下有明显预防效果,可以作为日常生活中的免疫调节剂以及在临床上对病患的免疫预防起到一定作用。本研究为探究中草药与一些常规饮品的配伍奠定基础以及开发方向。同时,此研究对于霍山石斛资源和红茶的资源开发具有重要意义,对未来的本草产品和茶产品的开发应用也具有指示意义。最后,本研究为霍山石斛茶饮作为一种有效的免疫调节剂的应用奠定了基础,并为未来发现和开发具有医疗价值的本草产品提供了丰富的理论支持和数据支持。
-
图 3 不同浓度和比例的混合溶液对细胞增殖活性的影响(n=6)
注:DH:100%霍山石斛、KT:100%祁门红茶、1KT:1DH:50%祁门红茶+50%霍山石斛、1KT:3DH:25%祁门红茶+75%霍山石斛、3KT:1DH:75%祁门红茶+25%霍山石斛;*表示与空白组相比P<0.05,**表示与空白组相比P<0.01;图4同。
Figure 3. Effects of different concentrations and ratios of mixed solution on cell proliferation activity (n=6)
表 1 祁门红茶提取工艺正交试验因素水平
Table 1 Factors and levels of the orthogonal experiment for Keemum black tea extraction process
水平 因素 A料液比(g/mL) B提取时间(min) C提取次数 1 1:45 25 3 2 1:60 35 4 3 1:80 45 5 表 2 霍山石斛提取工艺正交试验因素水平
Table 2 Factors and levels of the orthogonal experiment for Dendrobium huoshanensis extraction process
水平 因素 A料液比(g/mL) B提取时间(min) C提取次数 1 1:60 40 3 2 1:80 60 4 3 1:100 80 5 表 3 祁门红茶正交试验结果
Table 3 Results of orthogonal test of Keemun black tea
实验号 A料液比 B提取时间 C提取次数 多酚得率(%) 1 1 1 1 8.89 2 1 2 2 9.11 3 1 3 3 9.96 4 2 1 1 9.08 5 2 2 3 9.42 6 2 3 2 9.15 7 3 1 3 11.18 8 3 2 1 9.38 9 3 3 2 10.11 K1 27.96 29.15 27.35 K2 27.65 27.91 28.37 K3 30.67 29.22 30.56 R 3.02 1.31 3.21 最佳条件 A3B1C3 表 4 霍山石斛正交试验结果
Table 4 Results of orthogonal test of Dendrobium huoshanensis
实验号 A料液比 B提取时间 C提取次数 多糖得率(%) 1 1 1 1 62.52 2 1 2 2 71.55 3 1 3 3 68.25 4 2 1 1 73.10 5 2 2 3 70.25 6 2 3 2 76.40 7 3 1 3 70.32 8 3 2 1 71.67 9 3 3 2 74.94 K1 202.32 205.94 207.29 K2 219.75 213.47 222.89 K3 216.93 219.59 208.82 R 17.43 13.65 15.60 最佳条件 A2B3C2 -
[1] ZHA X Q, ZHAO H W, BANSAL V, et al. Immunoregulatory activities of Dendrobium huoshanense polysaccharides in mouse intestine, spleen and liver[J]. International Journal Of Biological Macromolecules,2014,64:377−82. doi: 10.1016/j.ijbiomac.2013.12.032
[2] SI H Y, CHEN N F, CHEN N D, et al. Structural characterisation of a water-soluble polysaccharide from tissue-cultured Dendrobium huoshanense C.Z. Tang et S.J. Cheng[J]. Natural Product Research,2018,32(3):252−60. doi: 10.1080/14786419.2017.1350670
[3] SHANG Z Z, QIN D Y, LI Q M, et al. Dendrobium huoshanense stem polysaccharide ameliorates rheumatoid arthritis in mice via inhibition of inflammatory signaling pathways[J]. Carbohydrate Polymers,2021,258:117657. doi: 10.1016/j.carbpol.2021.117657
[4] WAN J, GONG X, WANG F, et al. Comparative analysis of chemical constituents by hplc-esi-ms(n) and antioxidant activities of Dendrobium huoshanense and dendrobium officinale[J]. Biomedical Chromatography,2022,36(1):e5250.
[5] LIN J, CHANG Y J, YANG W B, et al. The multifaceted effects of polysaccharides isolated from Dendrobium huoshanense on immune functions with the induction of interleukin-1 receptor antagonist (IL-1ra) in monocytes[J]. PLoS One,2014,9(4):e94040. doi: 10.1371/journal.pone.0094040
[6] LEE C T, KUO H C, CHEN Y H, et al. Current advances in the biological activity of polysaccharides in dendrobium wit source[J]. Current Medicinal Chemistry,2017,24:1−19. doi: 10.2174/092986732401170116154528
[7] 李囡囡, 周远远. 霍山石斛药理学研究及其在保健食品中的应用进展[J]. 宜春学院学报,2022,44(6):25−27, 107. [LI N N, ZHOU Y Y. Pharmacological research of dendrobium huoshanense and its application in health food[J]. Journal of Yichun College,2022,44(6):25−27, 107. Li N N, ZHOU Y Y. Pharmacological research of dendrobium huoshanense and its application in health food [J]. Journal of Yichun College, 202, 44(6): 25-27+107.
[8] GAO Y, XU Y, RUAN J, et al. Selenium affects the activity of black tea in preventing metabolic syndrome in high-fat diet-fed Sprague-Dawley rats[J]. Journal of The Science of Food And Agriculture,2020,100(1):225−34. doi: 10.1002/jsfa.10027
[9] DAS A S, DAS D, MUKHERJEE M, et al. Phytoestrogenic effects of black tea extract (Camellia sinensis) in an oophorectomized rat (Rattus norvegicus) model of osteoporosis[J]. Life Sciences,2005,77(24):3049−57. doi: 10.1016/j.lfs.2005.02.035
[10] HAYAT K, IQBAL H, MALIK U, et al. Tea and its consumption: Benefits and risks[J]. Critical Reviews in Food Science and Nutrition,2015,55(7):939−954.
[11] AHAMMED G J, LI X. Hormonal regulation of health-promoting compounds in tea (Camellia sinensis L.)[J]. Plant Physiology and Biochemistry,2022,185:390−400. doi: 10.1016/j.plaphy.2022.06.021
[12] SUN L, ZHANG Y, ZHANG W, et al. Green tea and black tea inhibit proliferation and migration of HepG2 cells via the pi3k/akt and mmps signalling pathway[J]. Biomed Pharmacotherapy,2020,125:109893. doi: 10.1016/j.biopha.2020.109893
[13] SINGH B N, RAWAT A K, BHAGAT R M, et al. Black tea: Phytochemicals, cancer chemoprevention, and clinical studies[J]. Critical Reviews in Food Science and Nutrition,2017,57(7):1394−1410. doi: 10.1080/10408398.2014.994700
[14] KHAN N, MUKHTAR H. Tea polyphenols in promotion of human health[J]. Nutrients,2018,11(1):39. doi: 10.3390/nu11010039
[15] WANG S, LI Z, MA Y, et al. Immunomodulatory effects of green tea polyphenols[J]. Molecules,2021,26(12):3755. doi: 10.3390/molecules26123755
[16] ZHANG L, SANTOS J S, CRUZ T M, et al. Multivariate effects of Chinese keemun black tea grades (Camellia sinensis var. sinensis) on the phenolic composition, antioxidant, antihemolytic and cytotoxic/cytoprotection activities[J]. Food Research International,2019,125:108516. doi: 10.1016/j.foodres.2019.108516
[17] WEISKOPF D, WEINBERGER B, GRUBECK-LOEBENSTEIN B. The aging of the immune system[J]. Transplant International,2009,22(11):1041−1050. doi: 10.1111/j.1432-2277.2009.00927.x
[18] HILL Q A, NEWLAND A C. Fatigue in immune thrombocytopenia[J]. Br J Haematol,2015,170(2):141−9. doi: 10.1111/bjh.13385
[19] 李晓萌, 李佳惠, 王雨行, 等. 响应面优化莲藕多酚提取工艺及其生物活性研究[J]. 食品科技,2022,47(1):203−211. [LI X M, LI J H, WANG Y X, et al. Optimization of extraction process and bioactivities of polyphenols from lotus root by response surface method[J]. Food Sci Technol,2022,47(1):203−211. doi: 10.3969/j.issn.1005-9989.2022.1.spkj202201031 LI X M, LI J H, WANG Y X, et al. Optimization of extraction process and bioactivities of polyphenols from lotus root by response surface method [J]. Food Sci Technol, 2022, 47(1): 203-211. doi: 10.3969/j.issn.1005-9989.2022.1.spkj202201031
[20] 田先娇, 罗雪维, 杨新周, 等. 不同炮制方式对黄精有效成分含量的影响[J]. 化学试剂,2021,43(6):790−794. [TIAN X J, LUO X W, YANG X Z, et al. The effects of different processing methods on components in Polygonatum kingianum Coll. et Hemsl[J]. Chem Reagents,2021,43(6):790−794. doi: 10.13822/j.cnki.hxsj.2021007907 TIAN X J, LUO X W, YANG X Z, et al. The effects of different processing methods on components in polygonatum kingianum coll. et Hemsl [J]. Chem Reagents, 2021, 43(6): 790-794. doi: 10.13822/j.cnki.hxsj.2021007907
[21] 贾小演, 赵晓歌, 谢丹等. 蘘荷根茎乙醇提取物对LPS诱导巨噬细胞RAW264.7炎症反应的影响[J]. 中药药理与临床,2023,39(3):71−77. [JIA X Y, ZHAO X G, XIE D, et al. Effects of ethanol extract from rhizome of Yanghe rhizome on lps-induced inflammatory response of macrophage RAW264.7[J]. Pharmacology and Clinics of Chinese Materia Medica,2023,39(3):71−77. JIA X Y, ZHAO X G, XIE D, et al. Effects of ethanol extract from rhizome of Yanghe rhizome on lps-induced inflammatory response of macrophage RAW264.7[J]. Pharmacology and Clinics of Chinese Materia Medica, 2023, 39(3): 71-77
[22] KING W, TOLER K, WOODELL-MAY J. Role of white blood cells in blood- and bone marrow-based autologous therapies[J]. Biomed Research International,2018,2018:6510842.
[23] LOCATI M, CURTALE G, MANTOVANI A. Diversity, mechanisms, and significance of macrophage plasticity[J]. Annual Review of Pathology-mechanisms of Disease,2020,15:123−47. doi: 10.1146/annurev-pathmechdis-012418-012718
[24] FANG X, HENAO-MEJIA J, HENRICKSON S E. Obesity and immune status in children[J]. Current Opinion In Pediatrics,2020,32(6):805−15. doi: 10.1097/MOP.0000000000000953
[25] LIN Q S. Mitochondria and apoptosis[J]. Sheng Wu Hua Xue Yu Sheng Wu Wu LI Xue Bao,1999,10(3−4):116−118.
[26] LI F, CUI S H, ZHA X Q, et al. Structure and bioactivity of a polysaccharide extracted from protocorm-like bodies of dendrobium huoshanense[J]. International Journal of Biological Macromolecules,2015,72:664−72. doi: 10.1016/j.ijbiomac.2014.08.026
[27] 申羽佳, 李卫国, 张惠, 等. 绿茶多酚对小鼠皮肤伤口愈合时白介素-1β表达的影响[J]. 分子细胞生物学报,2009,42(Z1):179−185. [SHEN Y J, LI W G, ZHANG H, et al. Effect of green tea polyphenols on the expression of interleukin-1β during skin wound healing in mice[J]. Journal of Molecular Cell Biology,2009,42(Z1):179−185. SHEN Y J, LI W G, ZHANG H, et al. Effect of green tea polyphenols on the expression of interleukin-1β during skin wound healing in mice [J]. Journal of Molecular Cell Biology, 2009, 42(Z1): 179-185.
[28] SARKAR A A, ALLYN D M, DELAY R J, et al. Cyclophosphamide-induced inflammation of taste buds and cytoprotection by amifostine [J]. Chem Senses, 2021, 46: 1−10.
-
期刊类型引用(8)
1. 张巧,何雨婕,李贤,雷激. 改性方法对柠檬皮渣粉结构及功能特性的影响. 食品工业科技. 2024(01): 88-96 .  本站查看
本站查看
2. 韩海珠,刘亚平,高宇虹,狄建兵,李泽珍,孙胜. 超微粉碎对水果番茄粉理化性质与结构特性的影响. 核农学报. 2024(08): 1512-1522 .  百度学术
百度学术
3. 肖佳豪,张群,潘兆平,李涛,孙恬,江盛宇,李绮丽,付复华. 低温超微粉碎对茶枝柑果肉粉理化性质和功能特性的影响. 食品科学. 2024(20): 220-231 .  百度学术
百度学术
4. 胡龙彪,翟晓娜,李媛媛,郝光飞,裴海生. 超微粉碎技术在农副产品中的应用进展. 食品科技. 2023(02): 92-99 .  百度学术
百度学术
5. 黄浩燃,张星启,温辉翠,李育瑶,黄子桐,范振梅,宋贤良. 球磨处理对菠萝蜜果皮不溶性膳食纤维结构及性能的影响. 食品工业科技. 2023(11): 211-218 .  本站查看
本站查看
6. 张明宇,宋雅婕,牟庆庆,侯晓鸥,宋子龙,段乐心,马冉,杨嫣婕,于克学,陈庆敏,程媛媛. 金银花雪梨超微粉制备低糖果冻的研究. 中国果菜. 2023(09): 35-40 .  百度学术
百度学术
7. 王缓,王乐姣,岳陈林瑞,罗程,祝媛,杨林伟,张涛,李超,陈银基. 超微粉碎预处理对碱提和水提麦麸多糖理化特性的影响. 食品工业科技. 2023(22): 19-27 .  本站查看
本站查看
8. 赵愉涵,陈庆敏,岳凤丽,迟晓君,闫琰,焦文晓,杜雅珉,傅茂润,崔波,崔照林. 超微粉碎处理对五谷杂粮粉特性的影响. 中国果菜. 2022(07): 28-35 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:
 下载:
下载:



