Application of Droplet Microfluidic Technology Combined with Nucleic Acid Amplification in the Detection of Foodborne Pathogens
-
摘要: 食源性致病菌是影响食品安全的重要因素,随着生物技术发展及人们对食品安全要求的提高,食源性致病菌的检测方法也不断更新和升级。微流控技术将样品预处理、分离、检测等过程集成在微小的芯片上完成多种功能,而液滴微流控作为其中一个重要的分支,可利用两液体互不相溶特性形成的分散微液滴进行高通量的测试。本文针对核酸扩增方式的不同,比较总结了液滴微流控-数字化聚合酶链式反应、液滴微流控-数字化环介导等温扩增、液滴微流控-数字化重组酶聚合酶扩增检测方法的特点,介绍了其在食源性致病菌检测中的应用,并对该技术的未来发展前景进行了展望。液滴微流控技术结合数字化核酸扩增,可实现对食源性致病菌的智能化、连续化、精准化和微型化的快速检测,本文为其在食源性致病菌快速检测领域的发展提供了参考资料。Abstract: Foodborne pathogen is an important factor affecting food safety. With the biotechnology development and the improved requirements for food safety, the detection methods of foodborne pathogens are constantly updated and improved. By microfluidic technology, the processes of sample pretreatment, separation and detection are integrated on a tiny chip, and a variety of functions are completed. As an important branch, droplet microfluidic technology can be used for high-throughput detection with the dispersed microdroplets formed by two insoluble liquids. In this paper, according to the different ways of nucleic acid amplification, the characteristics of droplet microfluidic-digital polymerase chain reaction, droplet microfluidic-digital loop-mediated isothermal amplification, and droplet microfluidic-digital recombinase polymerase amplification are compared and summarized. The applications of these methods in the detections of foodborne pathogens are also presented. In addition, the future developments of these technologies are prospected. The intelligent, continuous, precise and miniaturized rapid detections of foodborne pathogens are realized by droplet microfluidic technology combined with digital nucleic acid amplification. This paper would provide references for the development of the technology in the field of rapid detection of foodborne pathogens.
-
食源性致病菌(foodborne pathogen)是指以食物为载体而导致人类发生疾病的一大类细菌,包括致病性大肠杆菌、沙门氏菌、致病性金黄色葡萄球菌、单核细胞增生李斯特氏菌、志贺氏菌等。近年来,国内外食源性致病菌引起的食源性疾病事件层出不穷,引起了各界广泛关注。常规的食源性致病菌检测方法主要有培养法和化学分析法(如化学发光分析法和化学传感器法)等[1],传统培养法作为金标准的检测方法,使用较广,但操作繁琐、耗时长、灵敏度较低[2];化学分析法需要高纯度样品,轻微污染将导致假阳性结果[3]。随着科技的发展,许多相对较新的检测技术应运而生,如分子生物学检测、免疫学检测、生物传感器检测和基质辅助激光解吸电离飞行时间质谱法等,这些技术具有特异性强、准确度较高和快速等优势,但由于通常需要较昂贵的仪器,前处理过程也比较复杂,因此大多无法满足实时快速和便携化检测的要求[4]。近年来,一种基于微芯片的高通量检测筛选技术—微流控技术发展起来。
微流控技术是目前发展迅猛的新兴技术,又名芯片实验室(lab-on-a-chip),主要是依托微电子技术[5],采用特殊工艺,将生化领域所涉及到的多种分析程序集成到单一平台-芯片上[6],将样品处理、反应、分离、检测等与分析相关的基本操作单元集成在一起,利用其微型、耗样量少、快速分析、灵敏度和分辨率高等显著优势,实现快速高效、小型化、集成化的检测[7],迅速成为当前分析领域的焦点。将微流控技术与数字化核酸扩增相结合应用于食源性致病菌检测,进一步提升了检测性能与水平,是当前研究的热点。本文介绍了液滴微流控技术的原理、芯片材料和应用范围,重点对液滴微流控技术结合三种数字化核酸扩增方式的检测技术进行分析总结,展望了其发展前景和在应用中存在的问题,为液滴微流控数字化核酸扩增技术的进一步普及和应用提供借鉴。
1. 液滴微流控芯片技术
1.1 概述
随着现代科技发展越来越趋向于微型化和集成化,微流控技术也逐渐走入大家视野,甚至被美国Business 2.0杂志封面列为“改变世界的七种技术之一”[8]。上世纪90年代,Manz等[9]最早提出了微流控芯片的概念,从2001年至今,微流控技术得到了广泛的关注和长足发展。
近些年来,在微流控芯片的基础上发展起来了一种利用微量液体作为微反应器的技术—液滴微流控技术,该技术以连续液滴进样为特征,是芯片实验室领域的一个重要分支。液滴微流控技术主要包括液滴产生、液滴分散、液滴融合,在极小的体系中实现高通量的分析,并探索大量小至纳升体积液滴的合成条件[10]。数字微流控技术和连续微流控技术是目前液滴微流控技术的两个分支[11]。连续微流控以低雷诺数流态为特点,两互不相溶的流体在结构化的微通道中混合和输送,基本上所有流体都是层流;数字微流控技术是利用电压对图案化电极阵列中的微小液滴进行操控[12]。液滴微流控技术结合微流控和液滴的特点,具有体积微小、反应快速、节省试剂、防止污染等优点。
液滴微流控技术因其自身独特的优势,在诸多领域得到广泛应用。在DNA的提取和纯化、聚合酶链式反应集成全自动芯片的发展和应用、DNA测序的集成式发展等方面,液滴微流控技术都显示了卓越的性能和优势[13]。在蛋白质组学方面,利用微流控芯片自动快速的提取蛋白质,提高了检测灵敏度和集成程度。在医学临床诊断方面[14],液滴数字微流控技术可在很大程度上克服传统分析的长耗时、高成本、操作复杂等缺点。在细胞分析方面[15],液滴数字微流控技术可进行单细胞培养,在一个设备上完成细胞的培养和分析等过程。
1.2 基本原理
微流控技术主要利用微电子加工技术,通过设计微通道,利用电场或磁场结合各种微流控器件来控制流体,使其能够流通于微流控系统中的微通道网络,进而在芯片上将各个反应操作单元集成,实现检测过程的一体化和自动化[16]。与此同时,还可以加快反应速度、提高反应效率、降低反应成本,增强实验的可控性[17]。
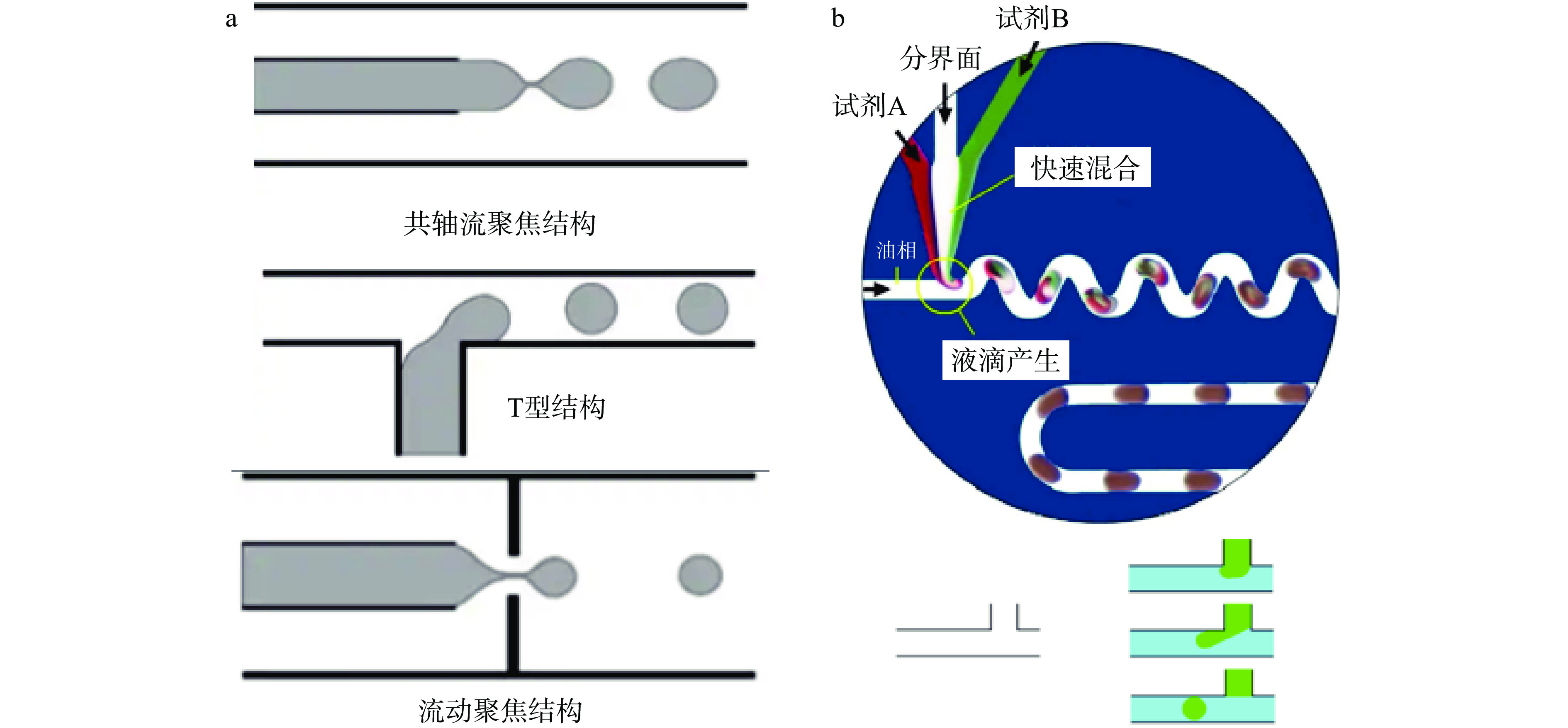
液滴微流控技术的基本原理是利用不相溶两个流动相碰撞接触形成乳化液滴,在液滴内部依靠湍流实现不同试剂之间的充分混合,通过独立控制每个液滴,形成可以单独反应、混合和分析的微反应器,避免弥散现象发生[6]。液滴的生成是通过芯片的几何结构来实现的,主要有T型结构、流动聚集结构和共轴流聚焦结构等(图1a)。如图1b所示,当油相与水相按照合适比例和速率进行混合进样时,在T形交叉口可以形成连续稳定液滴,当液滴经过S形通道时,样品中各组分得以混合均匀[7]。以液滴作为微反应器,具有体积小、反应条件稳定、混合迅速且均匀、防止样品扩散和交叉污染等优点。并且此技术可以在短时间内形成多个相同的微反应器单元,因此可以很容易地实现并行处理和实验,从而有效地获得大数据集[18-19]。
1.3 芯片的制备及其集成化
微流控技术的核心是芯片,芯片材料的选择十分关键,一般常用的材料有玻璃、石英、单晶硅片以及包含聚二甲基硅氧烷(polydimethylsiloxane, PDMS)、聚碳酸酯(polycarbonate,PC)和聚甲基丙烯酸甲酯(polymethylmethacrylate,PMMA)在内的有机聚合物。目前研究热点是纸质芯片,主要是应用3D和2D技术,利用纸张纤维素为基质材料制备微流控芯片[20]。李露等[21]系统论述了微流控纸基芯片的制备方法和其中流体智能化操纵技术,以及其在食品安全检测中的应用和前景。而在食源性致病菌快速检测上常用的芯片材料有硅、聚二甲基硅氧烷和聚甲基丙烯酸甲酯。这三种材料具有明显的优点:制备较为简单,工艺相对成熟,无毒,成本较低。
芯片制备是微流控技术的基础,即在芯片材料上利用微细加工技术构建通道和相应组件,微细加工技术主要有光刻和蚀刻技术,工艺流程一般包括预处理、涂胶、前烘、曝光、显影、腐蚀和去胶等。不同类型的芯片制备在具体工艺流程上可根据实际情况有所增减。微细加工技术成本低,工艺较为简单,密封的芯片可以在很大程度上减少污染和损失,因此应用较为广泛。
微流控芯片的作用是将分析实验室中包括取样、进样、预处理、反应、分离和检测在内的所有操作集成在一个芯片上[22],目前一些微流控芯片仍需外源驱动装置或检测仪器,未能实现高度集成化,没有实现真正意义上的Lab-on-a-chip[23]。为满足便携、集成化和自动化程度高的微流控芯片发展要求,许多学者对此做出研究,周文超[24]针对微流控芯片高灵敏度光学检测及其系统集成化进行相关研究,设计了一种新型滤光片,实现光学检测器件在微流控芯片上的阵列化和集成化,并基于导模共振原理提出一种可以进一步提高光学检测系统与微流控芯片的集成度的新型结构。陈琛[25]为将核酸提取、扩增和检测整合在同一块芯片上,摆脱对泵和注射器等额外装置的依赖,设计了一种纸-聚二甲基硅氧烷(PDMS)杂合芯片,这种基于胶体金试纸条的核酸检测纸芯片,利用比色方法即可裸眼观察扩增结果,整个芯片具有采样-反馈的完整功能。邹晶晶等[26]设计和制作了一种集成式微流控芯片,可将基于液滴的核酸提取、样本分散以及核酸等温扩增等过程集成于一个芯片上,实现从样品输入到结果输出的全流程检测。随着微流控芯片的普及和深入研究,其必然朝着微型化、集成化与便携化的趋势发展。
2. 液滴微流控结合核酸扩增技术
为防止待检样品中核酸含量低而无法被特异性检出,一般检测过程需要进行核酸扩增,扩增技术包括聚合酶链式反应(Polymerase chain reaction,PCR)等变温扩增技术和等温扩增技术,如环介导等温扩增(Loop-mediated isothermal amplification,LAMP)、重组酶聚合酶链式反应(Recombinase polymerase amplification,RPA)、滚环扩增(Rolling circle amplification,RCA)、解旋酶依赖扩增(Helicase-dependent amplification,HDA)和核酸序列依赖扩增(Nucleic acid sequence-based amplification,NASBA)等[27]。数字化液滴核酸扩增技术是将核酸样品分散至成千上万个独立液滴中进行大规模的平行核酸扩增反应,利用荧光信号的泊松分布,实现精确定量[28]。滚环扩增、解旋酶依赖扩增和核酸序列依赖扩增等核酸扩增方式与液滴微流控结合在食源性致病菌检测方面的应用极少,故本文不进行介绍,下面分别针对聚合酶链式反应、环介导等温扩增和重组酶聚合酶链式反应结合液滴微流控技术在食源性致病菌检测上的应用进行阐述。
2.1 微流控-数字PCR
聚合酶链式反应经过几十年的发展,已经从常规PCR(第一代PCR)经由第二代PCR(实时荧光定量PCR)发展至第三代PCR(数字PCR)。数字PCR(digital PCR,dPCR)技术因其高灵敏度、特异性和精确性,已成为研究的热点并逐渐推广应用[29]。
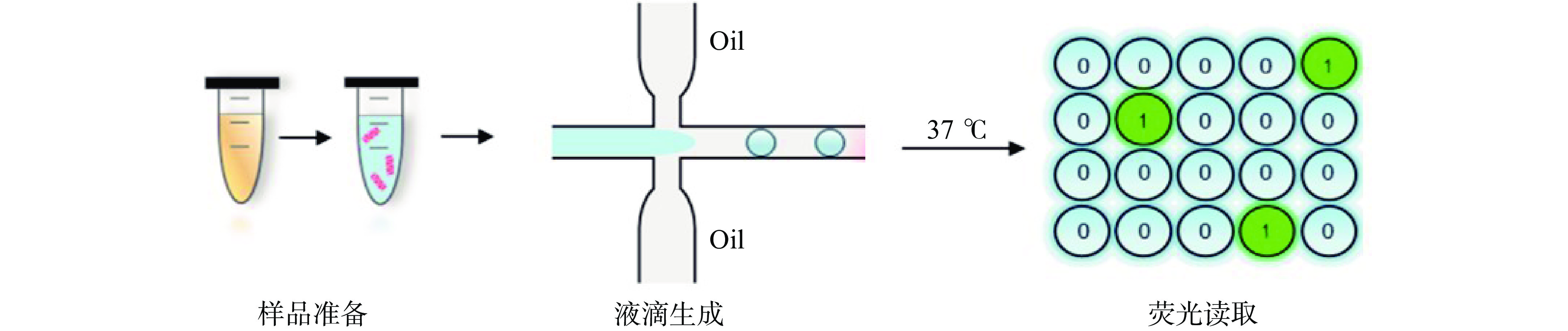
dPCR是近年来发展迅速的一种核酸分子绝对定量检测技术。最早是由Sykes等[30]在1992年提出。液滴数字PCR(droplet digital PCR,ddPCR)技术的原理示意图如图2,主要是将PCR反应体系高度稀释并分配至上万个独立反应中(理论上每个反应含有1或0个目标分子),然后进行单分子的PCR扩增,通过统计反应室中阳性单元和阴性单元的荧光信号,借助泊松分布精确得出样品中目标分子浓度,实现目标分子核酸绝对定量[28]。根据分液方式的不同,数字PCR主要分为微流体数字PCR(microfluidic digital PCR,mdPCR)、微滴数字PCR、以及芯片数字PCR(chip digital PCR,cdPCR)[31]。dPCR技术有效避免了前两代PCR技术的弊端:常规PCR技术不能进行定量检测,且样品容易发生污染问题;与实时荧光定量PCR技术相比,数字PCR不需要依赖Ct值和标准曲线即可绝对定量检测,而且在灵敏度和准确性方面均有很大突破[32]。
在致病菌检测方面,赵新等[33]根据沙门氏菌invA毒力基因序列,建立沙门氏菌ddPCR的快速定量检测方法,有较好的特异性,检测灵敏度可达到102 CFU/mL。ddPCR技术在单增李斯特菌的检测上也发挥了作用,赵丽青等[34]建立了一种ddPCR技术对食品中单增李斯特菌定量检测的方法,以hlyA为靶序列,该方法的特异性和重复性均较好,检出限可达90 CFU/mL。另外,Bian等[35]建立了一种基于矿物油饱和PDMS微流控芯片和双色荧光探针的double ddPCR平台,可同时检测致病性大肠杆菌O157和单增李斯特菌,此方法对两种病原菌的检出限低至10 CFU/mL,两种菌的回收率均在90%左右。邓雪蕾等[36]采用聚二甲基硅氧烷和玻璃(PDMS-Glass)为材料设计制作了一款多功能集成式ddPCR芯片,成功地对副溶血弧菌基因组DNA进行了绝对定量。方佩佩等[37]利用ddPCR技术快速定量检测副溶血弧菌,检测菌悬液的浓度范围为50~4.86×105 CFU/mL。Lei等[38]根据副溶血弧菌的特异性基因,建立了基于完整单细胞的多重ddPCR方法,高效精准地对副溶血弧菌进行绝对定量检测,还能区分不同致病性的副溶血弧菌。dPCR技术与微流控技术相结合应用于食源性致病菌检测,灵敏度和准确性均较高,在多种致病菌检测及同时检测方面显示出实用性和良好的发展前景。
2.2 微流控-数字LAMP
dPCR技术虽然应用广泛,但是由于仍然需要高温变性-低温退火-升温延伸等温度变化的过程,这样的温度循环过程使得扩增过程复杂且费时,核酸等温扩增技术应运而生。LAMP技术于2000年由Notomi等[39]提出,其基本原理是针对靶基因的6个区域设计4条特异引物,利用链置换DNA聚合酶在60~65 ℃恒温条件下扩增30~60 min,实现对核酸109~1010倍的扩增[40]。
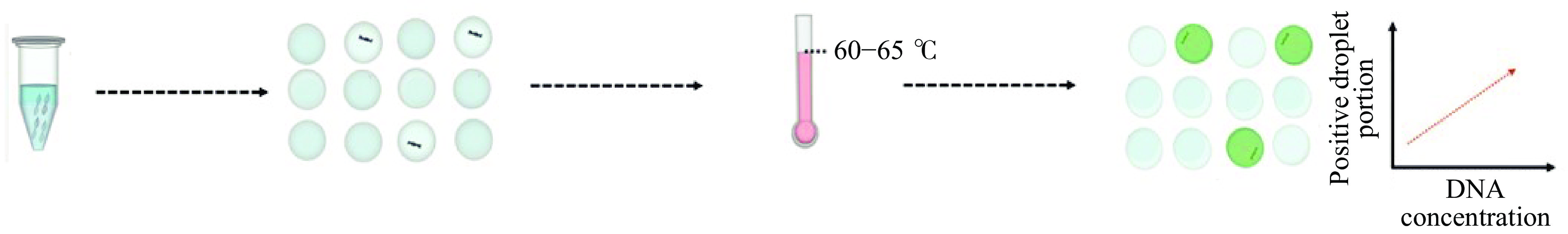
液滴数字LAMP(droplet digital LAMP,ddLAMP)技术即是在微流控芯片上进行环介导等温扩增反应,原理如图3所示:通过微流控系统将反应体系分隔在大量大小均一的液滴中,每一滴即为一个反应单元,根据泊松分布在60~65 ℃进行独立的单分子等温扩增,从而达到绝对定量的目的。ddLAMP可以在等温条件下高效快速的完成扩增反应[42],特异性、灵敏度和扩增效率都得到了提高,试剂消耗少,便于携带等优点也较为突出。
近年来ddLAMP的应用逐渐广泛。王珍等[43]建立了一种检测蜡样芽胞杆菌的ddLAMP方法,对菌液的检出限为1.70×102 CFU/mL,灵敏度是传统LAMP方法的10倍;对米饭样品中蜡样芽胞杆菌的检出限为57 CFU/mL,优于国家标准方法(检出限为1.04×102 CFU/mL)。Tao等[44]应用一个集离心富集、自动DNA提取和基于界面乳化的ddLAMP于一体的自动化系统对全脂牛奶中牛分歧杆菌进行绝对定量,该方法简化了牛奶中牛分歧杆菌超低浓度检测的操作和快速定量,并且无需标准曲线即可在2 h内完成,检出限为14 CFU/mL。Sayad等[45]开发了一种将微流控技术与环介导等温扩增技术结合的沙门氏菌检测平台装置,该装置将试剂制备、LAMP检测等步骤集成在一个微流控光盘上,检测样品中沙门氏菌的最低检出限为3.4×104 CFU/mL。鞠鹤鹏等[46]建立了一种ddLAMP技术,可同时快速检测沙门氏菌、大肠杆菌O157、金黄色葡萄球菌三种食源性致病菌,方法的特异性较好,三种致病菌的检测限均可达到1×102 CFU/mL。针对不同的检测样品和目标菌,ddLAMP技术的检测灵敏度存在一定的差异,可进一步优化检测体系。ddLAMP特异性、灵敏性和扩增效率高,且在恒温条件下进行,已成为致病菌检测的重要工具和手段,未来也将会得到更为广泛的应用和发展。
2.3 微流控-数字RPA
LAMP技术有明显的优势,但因其扩增所需要的恒定温度是60~65 ℃,这就意味着仍然需要加热设备,而且引物设计复杂、特异性扩增容易出现假阳性,成本也相对较高,因此另一种等温核酸扩增技术—重组酶聚合酶扩增技术随之映入人们视野。RPA技术自2006年被Piepenburg等[47]提出以来,即受到研究人员的广泛关注。RPA技术扩增核酸所需要的温度仅为37~42 ℃,甚至在室温下即可反应,突破了环境和设备的限制,使得RPA技术虽然目前在应用中还不如LAMP技术,但已经成为最近发展最快的等温扩增技术[48]。RPA技术是利用重组酶促进寡核苷酸引物在DNA双链互补序列中的插入,单链DNA结合蛋白(Single-stranded DNA-binding protein,SSB)用于与置换出的DNA序列结合,以及使用类似于PCR的方式实现对DNA特定区域进行指数扩增,RPA技术只需要两个引物,不需加热,扩增时间20~40 min[49-52]。而且,由于该方法温度较低,可在很大程度上减少液滴蒸发的问题。
数字化重组酶聚合酶扩增技术(digital RPA,dRPA)的原理如图4所示[53],即将RPA检测食源性致病菌的过程集中在单个微流控芯片上,根据泊松分布原理,将核酸模板分散成单分子反应单元,通过对反应室中阳性反应单元计数即可达到绝对定量的目的[54-55],实现“样本进结果出”的快速检测[56]。
Schuler等[57]首次建立液滴数字RPA(droplet digital RPA,dd RPA)方法以定量检测单增李斯特菌DNA,检测时间不超过30 min。目前ddRPA技术发展迅速,Chio等[58]开发了一种同时快速检测大肠杆菌O157:H7、副溶血弧菌和沙门氏菌的集成多重ddRPA芯片,该芯片集核酸提取、多重ddRPA和荧光检测于一体,在30 min内即可完成检测,并且每种菌的检测限为4 CFU/3.2 μL。Kersting等[59]建立了一种ddRPA芯片技术检测淋球菌、肠道沙门氏菌和耐甲氧西林金黄色葡萄球菌,该方法可在20 min内完成酶反应,对淋球菌检出限为100 CFU/mL,对耐甲氧西林金黄色葡萄球菌、肠道沙门氏菌检出限为10 CFU/mL。RPA技术具有不需高温即可反应的优势,与液滴微流控技术相结合,可实现超灵敏和精准的定量检测,在便携设备和现场诊断上具有广泛的应用前景[60]。
液滴微流控结合三种核酸扩增技术在集成化程度显著提高的前提下,检测准确性和灵敏度也不亚于传统核酸扩增检测方法。表1列出了这三种技术在食源性致病菌检测方面的应用实例,如检测食品中的沙门氏菌,ddPCR技术检测实际样品的结果与国标法相符,检测限为102 CFU/mL,检测时间24 h[33];ddLAMP技术灵敏度明显优于传统LAMP,检出限为100 CFU/mL,检测时间30 min~3 h[46,65-66];ddRPA技术的检出限为10 CFU/mL,检出时间20 min[59]。与本文其他两种技术相比,ddRPA技术极大地缩短了检测时间,一般可在30 min完成检测,适合高通量快速检测。
表 1 微流控技术结合核酸扩增技术在致病菌检测方面的应用Table 1. Application of microfluidic technology combined with nucleic acid amplification technology in detecting pathogenic bacteria检测方法 致病菌 食物类型 检出限 检测时间 参考文献 微流控数字化PCR 沙门氏菌 金针菇、肉类 102 CFU/mL 24 h [33,61] 单增李斯特菌 水产品、肉及肉制品 90 CFU/mL [34] 志贺氏菌 肉、蛋及奶制品 10−1 CFU/mL 4 h [62] 金黄色葡萄球菌 发酵乳 3.3×101 CFU/g [63] 大肠杆菌O157和单增李斯特菌 奶及奶制品 10 CFU/mL [35] 副溶血弧菌 海产品 5.0×101 CFU/mL 5 h [36−38] 检测伤寒沙门氏菌、金黄色葡萄球菌及
单增李斯特菌剩饭、未煮熟的肉、
蛋、奶制品0.23 copies/µL0.18 copies/µL0.42 copies/µL [64] 微流控数字化LAMP 蜡样芽胞杆菌 米饭 57 CFU/mL 45 min [43] 牛分歧杆菌 全脂牛奶 14 CFU/mL 2 h [44] 沙门氏菌 动物内脏、牛奶、蛋类 3.4×104 CFU/mL 70 min [45] 大肠杆菌O157、鼠伤寒沙门氏菌和
副溶血弧菌102 个/mL 1 h [65] 金黄色葡萄球菌、沙门氏菌和
大肠杆菌O157奶及奶制品、肉及肉制品 100 CFU/mL 3 h [46] 志贺菌、沙门菌、沙门菌、副溶血性弧菌、
空肠弯曲菌、肠聚集性大肠埃希氏菌、
肠侵袭性大肠埃希氏菌、
肠道致病性大肠埃希氏菌、
肠产毒素大肠埃希氏菌污染肉、奶制品 100 CFU/mL 30 min [66] 微流控数字化RPA 单增李斯特菌 乳及乳制品、肉制品 30 min [57] 产志贺毒素大肠埃希菌 生肉制品、污染生菜、豆芽菜 9.5×103 CFU/mL 20 min [67] 大肠杆菌O157:H7、
单增李斯特菌和肠炎沙门氏菌牛奶 1.25×103 CFU/mL 30 min [59] 肠道沙门氏菌 10 CFU/mL 20 min [57] 3. 总结及展望
微流控技术因其高通量、高效率和易操作等优点,在微生物检测上应用广泛。利用微流控技术进行数字化核酸扩增,具有快速、准确、灵敏、样品量少等优点,为食源性致病菌检测提供了准确、高效的平台。
与目前应用较为广泛的实时荧光定量PCR相比,dPCR技术与微流控技术相结合,实现了绝对定量,并在灵敏度和检测时间上显示出较大的优势;而dLAMP技术可以解决dPCR技术温度循环所带来的能量消耗大、操作复杂等问题,将病原菌的核酸提取步骤集成在微流控芯片上,达到单分子基因检测水平,可以进一步提高准确度和灵敏度;dRPA技术突破了前两者温度的限制,在室温下即可进行核酸扩增,进一步降低了对仪器的依赖性,且可无需破碎细胞在短时间内完成检测。但是目前由于技术限制,仍然存在一些亟待解决的问题,例如这几种检测方法在对复杂样品检测时可能会出现准确性下降等问题;数字LAMP和数字RPA技术的引物和探针设计需要耗费较多的时间和精力,非特异性扩增会导致假阳性结果的出现。
随着科技的进一步发展,微流控技术将会在温度控制、流体控制以及传感分析方面实现更新更快的突破,芯片的体积也将会越来越小,核酸扩增的操作会更加准确和高效;数字PCR芯片、数字LAMP芯片和数字RPA芯片在质量得到显著提高的同时,将成本更低,检测更准确,将会与目前的智能设备紧密结合,朝着更加智能化的方向发展,具有良好的市场前景。
-
表 1 微流控技术结合核酸扩增技术在致病菌检测方面的应用
Table 1 Application of microfluidic technology combined with nucleic acid amplification technology in detecting pathogenic bacteria
检测方法 致病菌 食物类型 检出限 检测时间 参考文献 微流控数字化PCR 沙门氏菌 金针菇、肉类 102 CFU/mL 24 h [33,61] 单增李斯特菌 水产品、肉及肉制品 90 CFU/mL [34] 志贺氏菌 肉、蛋及奶制品 10−1 CFU/mL 4 h [62] 金黄色葡萄球菌 发酵乳 3.3×101 CFU/g [63] 大肠杆菌O157和单增李斯特菌 奶及奶制品 10 CFU/mL [35] 副溶血弧菌 海产品 5.0×101 CFU/mL 5 h [36−38] 检测伤寒沙门氏菌、金黄色葡萄球菌及
单增李斯特菌剩饭、未煮熟的肉、
蛋、奶制品0.23 copies/µL0.18 copies/µL0.42 copies/µL [64] 微流控数字化LAMP 蜡样芽胞杆菌 米饭 57 CFU/mL 45 min [43] 牛分歧杆菌 全脂牛奶 14 CFU/mL 2 h [44] 沙门氏菌 动物内脏、牛奶、蛋类 3.4×104 CFU/mL 70 min [45] 大肠杆菌O157、鼠伤寒沙门氏菌和
副溶血弧菌102 个/mL 1 h [65] 金黄色葡萄球菌、沙门氏菌和
大肠杆菌O157奶及奶制品、肉及肉制品 100 CFU/mL 3 h [46] 志贺菌、沙门菌、沙门菌、副溶血性弧菌、
空肠弯曲菌、肠聚集性大肠埃希氏菌、
肠侵袭性大肠埃希氏菌、
肠道致病性大肠埃希氏菌、
肠产毒素大肠埃希氏菌污染肉、奶制品 100 CFU/mL 30 min [66] 微流控数字化RPA 单增李斯特菌 乳及乳制品、肉制品 30 min [57] 产志贺毒素大肠埃希菌 生肉制品、污染生菜、豆芽菜 9.5×103 CFU/mL 20 min [67] 大肠杆菌O157:H7、
单增李斯特菌和肠炎沙门氏菌牛奶 1.25×103 CFU/mL 30 min [59] 肠道沙门氏菌 10 CFU/mL 20 min [57] -
[1] 姚帮本, 闫超, 姚丽, 等. 食源性致病菌快速检测方法研究进展[J]. 分析测试学报,2021,40(5):617−627. [YAO B B, YAN C, YAO L, et al. Advance on rapid detection of foodborne pathogenic bacteria[J]. Journal of Instrumental Analysis,2021,40(5):617−627. YAO B B, YAN C, YAO L, et al. Advance on rapid detection of foodborne pathogenic bacteria[J]. Journal of Instrumental Analysis, 2021, 40(5): 617-627
[2] KANT K A, MOHAMMAD S A, DAVE V P, et al. Microfluidic devices for sample preparation and rapid detection of foodborne pathogens[J]. Biotechnology Advances,2018,36(4):1003−1024. doi: 10.1016/j.biotechadv.2018.03.002
[3] UMESHA S, MANUKUMAR H M. Advanced molecular diagnostic techniques for detection of food-borne pathogens; Current applications and future challenges[J]. Critical Reviews in Food Science & Nutrition,2018,58(1):84−104.
[4] 冯波, 谢文佳, 张晓光, 等. 食源性致病菌快速检测技术研究进展[J]. 食品科技,2022,47(11):290−296. [FENG B, XIE W J, ZHANG X G, et al. Research progress on rapid detection technology of foodborne pathogens[J]. Food Science and Technology,2022,47(11):290−296. FENG B, XIE W J, ZHANG X G, et al. Research progress on rapid detection technology of foodborne pathogens[J]. Food Science and Technology, 2022, 47(11): 290-296
[5] SAMIWI E, TABRIZIAN M, HOORFAR M. A review of digital microfluidics as portable platforms for lab-on a-chip applications[J]. Lab on A Chip,2016,16(13):2376. doi: 10.1039/C6LC00387G
[6] 林炳承, 秦建华. 图解微流控芯片实验室[M]. 北京: 科学出版社, 2008: 258−265 LIN B C, QIN J H. Illustration of a microfluidic chip lab[M]. Beijing: Science Press, 2008: 258−265
[7] RAJAPAKSHA P, ELBOURNE A, GANGADOO S, et al. A review of methods for the detection of pathogenic microorganisms[J]. The Analyst,2019,144(2):396−411. doi: 10.1039/C8AN01488D
[8] ZHANG J, YAN S, YUAN D, et al. Fundamentals and applications of inertial microfluidics: A review[J]. Lab Chip,2016,16(1):10−34. doi: 10.1039/C5LC01159K
[9] MANZ A, GRABER N, WIDMER H M. Miniaturized total chemical analysis systems: A novel concept for chemical sensing[J]. Sensors and Actuators B:Chemical,1990,1(1-6):244−248. doi: 10.1016/0925-4005(90)80209-I
[10] BAREA J S, LEE J, KANG D K. Recent advances in droplet-based microfluidic technologies for biochemistry and molecular biology[J]. Micromachines,2019,10(6):412. doi: 10.3390/mi10060412
[11] 涂然, 李世新, 李昊霓, 等. 液滴微流控技术在微生物工程菌株选育中的应用进展[J]. 合成生物学,2022,3(21):2096−8280. [TU R, LI S X, LI H N, et al. Advances and applications of droplet-based microfluidics in evolution and screening of engineered microbial strains[J]. Synthetic Biology Journal,2022,3(21):2096−8280. TU R, LI S X, LI H N, et al. Advances and applications of droplet-based microfluidics in evolution and screening of engineered microbial strains[J]. Synthetic Biology Journal, 2022, 3(21): 2096-8280
[12] 郑杰. 基于数字微流控芯片的液滴生成驱动及检测技术研究[D]. 重庆: 重庆理工大学, 2021 ZHENG J, Research on droplet generation drive and detection technology based on digital microfluidic chip[D]. Chongqing: Chongqing University of Technology, 2021
[13] 李安一, 吕雪飞, 邓玉林, 等. 基于微流控芯片的核酸提取技术研究进展[J]. 分析试验室,2021,40(7):761−771. [LI A Y, LV X F, DENG Y L, et al. Progress of nucleic acid extraction techniques based on microfluidic chips[J]. Chinese Journal of Analysis Laboratory,2021,40(7):761−771. LI A Y, LV X F, DENG Y L, et al. Progress of nucleic acid extraction techniques based on microfluidic chips[J]. Chinese Journal of Analysis Laboratory: 2021, 40(7): 761-771
[14] 闫嘉航, 赵磊, 申少斐, 等. 液滴微流控技术在生物医学中的应用进展[J]. 分析化学,2016,44(4):562−568. [YAN J H, ZHAO L, SHEN S F, et al. Application progress of droplet-based microfluidics in biomedicine[J]. Chinese Journal of Analytical Chemistry,2016,44(4):562−568. YAN J H, ZHAO L, SHEN S F, et al. Application progress of droplet-based microfluidics in biomedicine[J]. Chinese Journal of Analytical Chemistry, 2016, 44(4): 562-568
[15] LEI S W, CHEN S, ZHONG Q P. Digital PCR for accurate quantification of pathogens: Principles, applications, challenges and future prospects[J]. International Journal of Biological Macromolecules,2021,184(4):750−759.
[16] SONG H, TICE J D, ISMAGILOV R F. A microfluidic system for controlling reaction networks in time[J]. Angewandte Chemie International Edition,2003,42(7):768−72. doi: 10.1002/anie.200390203
[17] HASSAN S U, ZHANG X, NIU X. Droplet-based microfluidics: formation, detection and analytical characterization[J]. Crimson Publishers Wings to the Research, 2019, 774
[18] 任春艳, 马圆圆, 王景冉, 等. 微流控芯片设计和应用[J]. 实验技术与管理,2018,35(10):84−87. [REN C Y, MA Y Y, WANG J R, et al. Design and application of microfluidic chips[J]. Experimental Technology and Management,2018,35(10):84−87. REN C Y, MA Y Y, WANG J R, et al. Design and application of microfluidic chips[J]. Experimental Technology and Management, 2018, 35(10): 84-87
[19] 郭肖杰. 液滴微流控技术在微生物分离分析中的应用[D]. 合肥: 中国科学技术大学, 2016 GUO X J. The application of droplet microfluidic in microorganism separation and analysis[D]. Hefei: University of Science and Technology of China, 2016
[20] 张若剑, 刘俊. 微流控纸芯片专利技术综述[J]. 科技视界,2018(24):198−199. [ZHANG R J, LIU J. Microfluidic paper chip patent technology overview[J]. Science & Technology Vision,2018(24):198−199. ZHANG R J, LIU J. Microfluidic paper chip patent technology overview[J]. Science & Technology Vision, 2018(24): 198-199
[21] 李露, 杨金易, 徐振林, 等. 纸基微流控技术及其在食品安全检测中的研究进展[J]. 分析测试学报,2021,40(8):1235−1245. [LI L, YANG J Y, XU Z L, et al. Application advances of paper-based microfluidic analytical devices in food safety inspection[J]. Journal of Instrumental Analysis,2021,40(8):1235−1245. LI L, YANG J Y, XU Z L, et al. Application advances of paper-based microfluidic analytical devices in food safety inspection[J]. Journal of Instrumental Analysis, 2021, 40(8): 1235-1245
[22] 贾志舰. 微流控芯片加工和试样引入技术的研究[D]. 杭州: 浙江大学, 2005 JIA Z J. Studies on fabrication and sample introduction techniques for microfluidic chips[D]. Hangzhou: ZheJiang University, 2005
[23] MAO X L, HUANG T J. Microfluidic diagnostics for the developing world[J]. Lab on A Chip,2012,12(8):1412−1416. doi: 10.1039/c2lc90022j
[24] 周文超. 多通道微流控芯片的光探测及系统集成化方法研究[D]. 长春: 中国科学院研究生院(长春光学精密机械与物理研究所), 2014 ZHOU W C. Study on optical detection and integration in microfluidic chip with multi-channel cell[D]. Changchun: Changchun Institute of Optics (Fine Mechanics and Physics Chinese Academy of Sciences), 2014
[25] 陈琛. 核酸等温扩增的集成化微流控芯片研究[D]. 武汉: 华中科技大学, 2017 CHEN C. Fully integrated loop-mediated isothermal amplification microdevices for nucleic acid detection[D]. Wuhan: Huazhong university of science& technology, 2017
[26] 邹晶晶, 黎柱均, 刘云帆, 等. 集成式微流控液滴数字化等温扩增用于尿路感染细菌快速检测[J]. 分析化学,2022,50(8):1158−1167. [ZOU J J, LI Z Y, LIU Y F, et al. Integrated microfluidic droplet digital isothermal amplification enabled rapid detection of urinary tract infection bacteri[J]. Chinese Journal of Analytical Chemistry,2022,50(8):1158−1167. ZOU J J, LI Z Y, LIU Y F, et al. Integrated microfluidic droplet digital isothermal amplification enabled rapid detection of urinary tract infection bacteri[J]. Chinese Journal of Analytical Chemistry. 2022, 50(8): 1158-1167
[27] 李楠, 徐友春, 程京. 便携式全集成核酸分析系统技术综述[J]. 中国生物医学工程学报,2022,41(5):602−613. [LI N, XU Y C, CHENG J. Review of the portable fully integrated nucleic acid analysis system[J]. Chinese Journal of Biomedical Engineering,2022,41(5):602−613. doi: 10.3969/j.issn.0258-8021.2022.05.009 LI N, XU Y C, CHENG J. Review of the portable fully integrated nucleic acid analysis system[J]. Chinese Journal of Biomedical Engineering, 2022, 41(5): 602-613. doi: 10.3969/j.issn.0258-8021.2022.05.009
[28] 王哲, 雷舒文, 段林洁, 等. 数字PCR应用研究进展[J]. 顺德职业技术学院学报,2020,18(1):1−4,11. [WANG Z, LEI S W, DUAN L J, et al. On the current research of digital PCR application[J]. Journal of Shunde Polytechnic,2020,18(1):1−4,11. WANG Z, LEI S W, DUAN L J, et al. On the current research of digital PCR application[J]. Journal of Shunde Polytechnic, 2020, 18(01): 1-4, 11
[29] 李春勇. 数字PCR技术原理及应用[J]. 生物技术世界,2014(11):10−13. [LI C Y. Principle and application of digital PCR technology[J]. Biotech World,2014(11):10−13. LI C Y. Principle and application of digital PCR technology[J]. Biotech World, 2014(11): 10-13
[30] SYKES P J, NEOH S H, et al. Quantitation of targets for PCR by use of limiting dilution[J]. BioTechniques,1992,13(3):444−449.
[31] 李智杰, 刘占悝, 李健友, 等. 数字PCR技术研究进展[J]. 特产研究,2019,41(1):120−123. [LI Z J, LI Z L, LI J Y, et al. Research progress of digital PCR technology[J]. Special Wild Economic Animal and Plant Research,2019,41(1):120−123. LI Z J, LI Z L, LI J Y, et al. Research progress of digital PCR technology [J]. Special Wild Economic Animal and Plant Research, 2019, 41(1): 120-123
[32] 黄瑾, 梁涛波, 许恒毅. 数字PCR在生物学检测中应用的研究进展[J]. 生命科学,2021,33(2):255−264. [HUANG J, LIANG T B, XU H Y. Research progress of application of digital PCR in biological detection[J]. Chinese Bulletin of Life Sciences,2021,33(2):255−264. HUANG J, LIANG T B, XU H Y. Research progress of application of digital PCR in biological detection[J]. Chinese Bulletin of Life Sciences, 2021, 33(2): 255-264
[33] 赵新, 兰青阔, 陈锐, 等. 应用微滴数字PCR技术快速检测食用菌中沙门氏菌[J]. 食品与生物技术学报,2017,36(3):315−321. [ZHAO X, LAN Q K, CHEN R, et al. Rapid detection of Salmonellla spp. in edible fungi by droplet digital PCR[J]. Journal of Food Science and Biotechnology,2017,36(3):315−321. ZHAO X, LAN Q K, CHEN R, et al. Rapid Detection of Salmonellla spp.in Edible Fungi by Droplet Digital PCR[J]. Journal of Food Science and Biotechnology, 2017, 36(3): 315-321
[34] 赵丽青, 方佩佩, 唐静, 等. 数字PCR定量检测食品中单核细胞增生李斯特氏菌方法的研究[J]. 食品安全质量检测学报,2017,8(11):4133−4138. [ZHAO L Q, FANG P P, TANG J, et al. Detection of Listeria monocytogenes in foods by droplet digital PCR[J]. Journal of Food Safety & Quality,2017,8(11):4133−4138. doi: 10.3969/j.issn.2095-0381.2017.11.009 ZHAO L Q, FANG P P, TANG J, et al. Detection of Listeria monocytogenes in foods by droplet digital PCR[J]. Journal of Food Safety & Quality, 2017, 8(11): 4133-4138 doi: 10.3969/j.issn.2095-0381.2017.11.009
[35] BIAN X J, JING F X, LI G, et al. A microfluidic droplet digital PCR for simultaneous detection of pathogenic Escherichia coli O157 and Listeria monocytogenes[J]. Biosensors & bioelectronics,2015,74:770−777.
[36] 邓雪蕾, 张苑怡, 袁浩钧, 等. 液滴数字聚合酶链式反应芯片及其在致病菌检测中的应用[J]. 分析测试学报,2017,36(10):1191−1196. [DENG X L, ZHANG Y Y, YUAN H J, et al. Fabrication of a droplet digital PCR chip and its application in pathogenic bacteria detection[J]. Journal of Instrumental Analysis,2017,36(10):1191−1196. DENG X L, ZHANG Y Y, YUAN H J, et al. Fabrication of a droplet digital PCR chip and its application in pathogenic bacteria detection[J]. Journal of Instrumental Analysis, 2017, 36(10): 1191-1196
[37] 方佩佩, 赵丽青, 马云, 等. 副溶血性弧菌微滴数字PCR定量方法的建立[J]. 食品工业科技,2018,39(19):252−257. [FANG P P, ZHAO L Q, MA Y, et al. Establishment of digital PCR assay for detection of Vibrio parahemolyticus[J]. Science and Technology of Food Industry,2018,39(19):252−257. FANG P P, ZHAO L Q, MA Y, et al. Establishment of Digital PCR Assay for Detection of Vibrio parahemolyticus[J]. Science and Technology of Food Industry, 2018, 39(19): 252-257
[38] LEI S W, GU X K, ZHONG Q P, et al. Absolute quantification of Vibrio parahaemolyticus by multiplex droplet digital PCR for simultaneous detection of tlh, tdh and ureR based on single intact cell[J]. Food Control,2020,114:107207. doi: 10.1016/j.foodcont.2020.107207
[39] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research,2000,28(12):E63. doi: 10.1093/nar/28.12.e63
[40] MEI X A, TLCD E, XIONG X A, et al. Multiplex detection of foodborne pathogens by real-time loop-mediated isothermal amplification on a digital microfluidic chip[J]. Food Control,2022,136:108824. doi: 10.1016/j.foodcont.2022.108824
[41] TAN Y L, WANG T, HE J, et al. Droplet microfluidic-based loop-mediated isothermal amplification (dLAMP) for simultaneous quantification of multiple targets[J]. Star Protocols,2022,3(2):101335. doi: 10.1016/j.xpro.2022.101335
[42] YUAN H, CHAO Y C, SHUM H C. Droplet and microchamber-based digital loop-mediated isothermal amplification (dLAMP)[J]. Small,2020,16(9):1904469. doi: 10.1002/smll.201904469
[43] 王珍, 贺磊, 肖英平, 等. 微流控芯片恒温扩增技术快速检测米饭中的蜡样芽孢杆菌[J]. 浙江大学学报(农业与生命科学版),2021,47(2):193−202. [WANG Z, HE L, XIAO Y P, et al. Rapid detection of Bacillus cereus in rice by isothermal amplification with microfluidic chip method[J]. Journal of Zhejiang University (Agriculture & Life Sciences),2021,47(2):193−202. WANG Z, HE L, XIAO Y P, et al. Rapid detection of Bacillus cereus in rice by isothermal amplification with microfluidic chip method[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2021, 47(2): 193-202
[44] TAO Y, YUN J, WANG J, et al. High-performance detection of Mycobacterium bovis in milk using digital LAMP[J]. Food Chemistry,2020,327:126945. doi: 10.1016/j.foodchem.2020.126945
[45] SAYAD A A, IBRAHIM F, UDDIN S M, et al. A microfluidic lab-on-a-disc integrated loop mediated isothermal amplification for foodborne pathogen detection[J]. Sensors and Actuators: B. Chemical,2016,227:600−609. doi: 10.1016/j.snb.2015.10.116
[46] 鞠鹤鹏, 戴菁, 谢逸欣, 等. LAMP微流控芯片快速检测三种食源性致病菌[J]. 解放军预防医学杂志,2018,36(3):309−313. [JU H P, DAI J, XIE Y X, et al. Quick detection of three food-borne pathogens by LAMP microfluidic chip[J]. Journal of Preventive Medicine of Chinese People's Liberation Army,2018,36(3):309−313. JU H P, DAI J, XIE Y X, et al. Quick detection of three food-borne pathogens by LAMP microfluidic chip[J]. Journal of Preventive Medicine of Chinese People's Liberation Army, 2018, 36(3): 309-313
[47] PIEPENBURG O, WILLIAM C H, STEMPLE D L, et al. DNA detection using recombination proteins[J]. Plos Biology,2006,4(7):1115−1121.
[48] 杨健, 侯婷婷, 佐兆杭, 等. 牛乳中蜡样芽孢杆菌荧光定量PCR检测方法的建立及验证[J]. 中国生物制品学杂志,2019,32(3):324−327,332. [YANG J, HOU T T, ZUO Z H, et al. Establishment and verification of fluorescence quantitative PCR assay for Bacillus cereus in milk[J]. Chinese Journal of Biologicals,2019,32(3):324−327,332. YANG J, HOU T T, ZUO Z H, et al. Establishment and verification of fluorescence quantitative PCR assay for Bacillus cereus in milk[J]. Chinese Journal of Biologicals, 2019, 32(3): 324-327, 332
[49] 秦雪, 付世骞, 杨鑫焱, 等. 重组酶聚合酶等温扩增技术在食源性致病菌检测中的应用[J]. 食品工业科技,2021,42(20):449−455. [QIN X, FU S Q, YANG X Y, et al. Application of recombinase polymerase amplification in detection of foodborne pathogen[J]. Science and Technology of Food Industry,2021,42(20):449−455. QIN X, FU S Q, YANG X Y, et al. Application of recombinase polymerase amplification in detection of foodborne pathogen[J]. Science and Technology of Food Industry, 2021, 42(20): 449-455
[50] LI J, MACDONALD J, STETTEN F V. Correction: Review: A comprehensive summary of a decade development of the recombinase polymerase amplification[J]. The Analyst,2020,145(5):1950−1960. doi: 10.1039/C9AN90127B
[51] YIN J X, ZOU Z Y, HU Z M, et al. A “sample-in-multiplex-digital-answer-out” chip for fast detection of pathogens[J]. Lab on A Chip,2020,20(5):979−986. doi: 10.1039/C9LC01143A
[52] CRANNELL Z A, ROHRMAN B, RICHARDS-KORTUM R. Equipment-free incubation of recombinase polymerase amplification reactions using body heat[J]. PLoS One,2017,9(11):112146.
[53] CUI J Q, LIU F X, PARK H, et al. Droplet digital recombinase polymerase amplification (ddRPA) reaction unlocking via picoinjection[J]. Biosensors & Bioelectronics,2022,202:114019.
[54] DENG H M, GAO Z Q. Bioanalytical applications of isothermal nucleic acid amplification techniques[J]. Analytica Chimica Acta,2015,853:30−45. doi: 10.1016/j.aca.2014.09.037
[55] YIN J X, SUO Y J, ZOU Z Y, et al. Integrated microfluidic systems with sample preparation and nucleic acid amplification[J]. Lab on A Chip,2019,19(17):2769−2785. doi: 10.1039/C9LC00389D
[56] 高雯暄, 甘芝霖, 陈爱亮, 等. 核酸技术在食源性致病菌检测中的研究进展[J]. 食品安全质量检测学报,2020,11(24):9440−9450. [GAO W X, GAN Z L, CHEN A L, et al. Research progresses of nucleic acid technologies in the testing of food-borne pathogens[J]. Journal of Food Safety & Quality,2020,11(24):9440−9450. GAO W X, GAN Z L, CHEN A L, et al. Research progresses of nucleic acid technologies in the testing of food-borne pathogens[J]. Journal of Food Safety & Quality, 2020, 11(24): 9440-9450
[57] SCHULER F, SCHWEMMER F, TROTTER M, et al. Centrifugal step emulsification applied for absolute quantification of nucleic acids by digital droplet RPA[J]. Lab on A Chip,2015,15(13):2759−66. doi: 10.1039/C5LC00291E
[58] CHOI G, JUNG J H, PARK B H, et al. A centrifugal direct recombinase polymerase amplification (direct-RPA) microdevice for multiplex and real-time identification of food poisoning bacteria[J]. Lab on A Chip,2016,16(12):2309−2316. doi: 10.1039/C6LC00329J
[59] KERSTING S, RAUSCH V, BIER FF, et al. Multiplex isothermal solid-phase recombinase polymerase amplification for the specific and fast DNA-based detection of three bacterial pathogens[J]. Mikrochimica Acta,2014,181(13-14):1715−1723. doi: 10.1007/s00604-014-1198-5
[60] 施奕, 徐昌平, 余蓓蓓, 等. 重组酶聚合酶扩增技术研究进展[J]. 病毒学报,2020,36(3):522−532. [SHI Y, XU C P, YU B B. Research progress in recombinase polymerase amplification (RPA)[J]. Chinese Journal of Virology,2020,36(3):522−532. SHI Y, XU C P, YU B B. Research progress in recombinase polymerase amplification (RPA)[J]. Chinese Journal of Virology, 2020, 36(3): 522-532
[61] WANG M, YANG J J, GAI Z T, et al. Comparison between digital PCR and real-time PCR in detection of Salmonella typhimurium in milk[J]. International Journal of Food Microbiology,2017,266:251−256.
[62] YANG J, ZHANG N, LV J, et al. Comparing the performance of conventional PCR, RTQ-PCR, and droplet digital PCR assays in detection of Shigella[J]. Molecular and Cellular Probes,2020,51(3):101531.
[63] 周巍, 李月华, 孙勇, 等. 微滴式数字PCR技术定量检测发酵乳中金黄色葡萄球菌[J]. 食品科学,2017,38(16):287−291. [ZHOU W, LI Y H, SUN Y, et al. Quantitative detection of Staphylococcus aureus in yogurt by droplet digital PCR assay[J]. Food Science,2017,38(16):287−291. ZHOU W, LI Y H, SUN Y, et al. Quantitative detection of Staphylococcus aureus in yogurt by droplet digital PCR assay[J]. Food Science, 2017, 38(16): 287-291
[64] 张明明, 肖剑, 林秀敏, 等. 多重微滴数字PCR同时定量检测三种食源性致病菌DNA拷贝数[J]. 农业生物技术学报,2022,30(3):606−618. [ZHANG M M, XIAO J, LIN X M, et al. Simultaneous quantification method of DNA copy number for three food-borne pathogens by multiplex droplet digital PCR[J]. Journal of Agricultural Biotechnology,2022,30(3):606−618. ZHANG M M, XIAO J, LIN X M, et al. Simultaneous quantification method of DNA copy number for three food-borne pathogens by multiplex droplet digital PCR[J]. Journal of Agricultural Biotechnology, 2022, 30(3): 606-618
[65] NGUYEN H V, NGUYEN V D, LEE E Y, et al. Point-of-care genetic analysis for multiplex pathogenic bacteria on a fully integrated centrifugal microdevice with a large-volume sample[J]. Biosensors & Bioelectrinics,2019,136:132−139.
[66] 宋娜, 刘朝阳, 李梦蓝, 等. 微流控芯片环介导恒温扩增技术快速检测8种肠道致病菌[J]. 国际检验医学杂志,2022,43(12):1425−1429. [SONG N, LIU C Y, LI M L, et al. Rapid detection of eight enteric pathogenic bacteria by isothermal amplification with microfluidic chip loop-mediated isothermal amplification[J]. International Journal of Laboratory Medicine,2022,43(12):1425−1429. SONG N, LIU C Y, LI M L, et al. Rapid detection of eight enteric pathogenic bacteria by isothermal amplification with microfluidic chip loop-mediated isothermal amplification[J]. International Journal of Laboratory Medicine, 2022, 43(12): 1425-1429
[67] 范一灵, 王淑娟, 李琼琼, 等. 重组酶聚合酶扩增检测产志贺毒素大肠埃希菌的微流控芯片技术[J]. 食品科学,2021,42(10):297−304. [FAN Y L, WANG S J, LI X X, et al. Rapid detection of shiga toxin-producing Escherichia coli by recombinase polymerase amplification combined with centrifugal compact disc microfluidic chip[J]. Food Science,2021,42(10):297−304. FAN Y L, WANG S J, LI X X, et al. Rapid detection of shiga toxin-producing Escherichia coli by recombinase polymerase amplification combined with centrifugal compact disc microfluidic chip [J]. Food Science, 2021, 42(10): 297-304
-
期刊类型引用(1)
1. 安红玉,陶泽,陈晨,卢增慧,万世园,李拖平,李苏红. 环介导等温扩增技术在食品安全检测领域的研究进展. 食品与发酵工业. 2024(21): 388-396 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:

 下载:
下载:



