Optimization of Fermentation Process for Antifungal Peptide Production by Lacticaseibacillus paracasei ALAC
-
摘要: 抗菌肽作为天然防腐剂因其高效、稳定、安全的作用机制在食品工业中有广泛的应用前景。为确定副干酪乳杆菌(Lacticaseibacillus paracasei)ALAC产抗真菌肽的最佳发酵工艺,本研究以抑菌圈为指标,通过单因素实验考察发酵时间、发酵温度、初始pH以及接种量对其产抗菌肽的影响,采用Box-Behnken设计对影响显著的发酵时间、接种量和初始pH三个参数进行响应面优化。结果表明,接种量4%、培养基初始pH为7.0、发酵时间24 h时,此条件下发酵生产的抑菌物质抗菌性最优,抑菌圈直径达到17.33±0.17 mm,该结果可为抗菌肽粉的生产及其在食品中的应用提供理论基础。Abstract: Antimicrobial peptides, as natural preservatives, had a wide application prospect in the food industry due to their high efficiency, stability and safety. To determine the optimal fermentation condition for producing antifungal peptides from Lacticaseibacillus paracasei ALAC, this study took the antibacterial zone as the indicator, the effects of fermentation time, fermentation temperature, initial pH and inoculum volume on the production of antimicrobial peptides were studied by single factor experiments and the response surface optimization was performed using Box-Behnken design on three parameters that significantly affect fermentation time, inoculation amount, and initial pH. Results showed that, when the inoculum amount of 4%, initial pH of 7.0, and fermentation time of 24 h, under this condition, the antibacterial substances produced by fermentation had the best antibacterial activity, with a diameter of 17.33±0.17 mm, this result could provide a theoretical basis for the production of antimicrobial peptide powder and its application in food.
-
乳酸菌是日常生活中人们较为熟悉的菌种,不论是酸奶、泡菜还是各类饮品都有其参与发酵,并且在自然界中分布广泛。乳酸菌在帮助肠道蠕动、促进消化的同时,可以降低胆固醇吸收,调节免疫系统,使乳糖不耐受的症状得到缓解[1−3]。目前已被证实某些乳酸菌能够产生抗菌肽,除抑制细菌、真菌外,还能对癌细胞产生灭杀作用[4−5]。乳酸菌抗菌肽因其生物安全性及抑菌活性在食品加工保藏、饲料生产、及医药领域已有较成功应用[6]。自乳链球菌素Nisin和片球菌素Pediocins PA1被批准作为食品防腐剂以来[4],新型乳酸菌抗菌肽已成为最主要研究热点和重要资源。因此,新型乳酸菌抗菌肽资源的开发挖掘势在必行。
真菌污染是食品、饲料、医疗及环境领域最广泛的污染类别,不仅给生产带来明显经济损失,而且真菌毒素直接危害人类健康[7]。现有化学防霉剂的大量使用导致致腐霉菌和酵母耐药性增加,采用天然生物防霉剂代替化学防腐剂势在必行[8−9]。由于抗真菌肽提取成本过高,目前商业化乳酸菌防霉产品几乎全部采用了活菌剂型或无细胞提取物。
乳酸菌抗菌肽的生物合成发生在对数生长期,一般分泌到细胞外,但在特殊条件下会留在细胞内,导致抑菌活性降低。有研究表明,乳酸菌的培养基内主要营养物质改变后,其产生抗菌肽抑菌活性就会发生改变[10−12]。影响乳酸菌抑菌活性的主要因素除了培养基外还有菌株生长的环境与营养条件。封成玲等[13]采用单因素与正交试验对产酶溶杆菌L-43的发酵条件进行了优化,使抗菌肽产量进一步得到了提高。江晨等[14]采用单因素实验和响应面试验对花生抗菌肽复合物的工艺进行了优化,研究发现制备的花生抗菌肽复合物可以提高对枯草芽孢杆菌、大肠杆菌和米曲霉的抑菌效果。秦楠等[15]采用单因素实验和响应面法优化解淀粉芽孢杆菌HRH317菌株产抗菌肽的发酵条件。Amiri等[16]对嗜酸乳杆菌LA-5、乳酸芽孢杆菌BB-12生物生产抗菌肽及其混合培养物的发酵温度、发酵时间等进行优化,从而增强了对单核细胞增生李斯特菌的抑制活性。目前虽对于乳酸菌产抗菌肽的发酵条件做了大量研究,但是大多针对具有抑制细菌作用的抗菌肽,而对于抑真菌肽研究很少。
本课题组前期从内蒙古传统发酵食品中分离出副干酪乳杆菌ALAC,发现其分泌的抗真菌肽对常见食品致腐霉菌和酵母具有强烈抑制活性,且安全无毒[17−18]。本研究将菌株ALAC在前期优化的乳清培养基中发酵,通过单因素实验与响应面分析探究接种量、培养基初始pH、发酵时间及发酵温度对其产抗真菌肽的影响,并确定最佳发酵工艺,为后期制备无细胞提取物生产抗真菌肽粉奠定基础。
1. 材料与方法
1.1 材料与仪器
副干酪乳杆菌ALAC 本实验室保存;指示菌白假丝酵母(Candida albicans) 编号为32819,来自中国工业微生物菌种保藏管理中心;乳清粉 浙江一诺生物科技有限公司;牛肉膏、酵母膏、细菌学蛋白胨、大豆蛋白胨、胰蛋白胨、酵母提取粉 广东环凯维生物科技有限公司;氯化钠、柠檬酸氢二胺、磷酸氢二钾、硫酸锰、琼脂粉、硫酸铵、TWEEN80、硫酸镁、蔗糖、磷酸氢二钾 国药集团化学试剂有限公司;无水乙酸钠、葡萄糖 天津市大茂化学试剂厂;酶水解酪蛋白 北京酷来博科技有限公司;所用试剂均为分析纯。
HZQ-F100型全温震荡培养箱 苏州培英实验设备有限公司;H3018DR型高速冷冻离心机 上海知信实验仪器技术有限公司;DHG-9053A型电热鼓风干燥箱、HZQ-311C型落地振荡器 上海一恒科学仪器有限公司;JM-A6002型电子天平 诸暨市超泽衡器设备有限公司;SW-CJ-2FD型双人单面垂直净化工作台 哈尔滨市东联公司;XH-C型漩涡混匀器 常州未来仪器制造有限公司;IKARV10digital型旋转蒸发仪 广州仪科实验室技术有限公司;SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司;P0-1000型单道移液器 梅特勒-托利多仪器有限公司;LDZX-75KBS型立式压力蒸汽灭菌锅 上海申安医疗器械厂;SYNERGY H1型酶标仪 雷康恒泰商贸有限公司;MCCWS乳成分分析仪 Milkotronic有限公司。
1.2 实验方法
1.2.1 培养基的配制
MRS培养基:葡萄糖20 g/L、Tween 80 1 mL/L、酵母提取粉5 g/L、柠檬酸氢二铵2 g/L、硫酸锰0.25 g/L、柠檬酸氢二铵2 g/L、硫酸镁0.58 g/L、无水乙酸钠5 g/L、磷酸氢二氨2 g/L、柠檬酸氢二铵2 g/L、牛肉浸膏10 g /L、细菌学蛋白胨10 g/L,调节pH至6.5,121 °C灭菌20 min。
YEPD液体培养基:葡萄糖20 g/L、大豆蛋白胨20 g/L、酵母提取粉10 g/L,调节pH至6.0,121 ℃灭菌20 min。
YEPD固体培养基:葡萄糖20 g/L、大豆蛋白胨20 g/L、酵母提取粉10 g/L,琼脂粉15 g/L,调节pH至6.0,121 ℃灭菌20 min。
水琼脂固体培养基:琼脂粉15 g/L,121 °C灭菌20 min。
乳清培养基:乳清液100 g/L、酶水解酪素5 g/L、葡萄糖1 g/L、酵母提取粉2 g/L。
1.2.2 乳杆菌ALAC的活化
将斜面保存的乳杆菌ALAC按4%接种量接种于MRS液体培养基中,180 r/min,37 ℃条件下培养24 h,活化至三代后备用。
1.2.3 指示菌(白假丝酵母)的活化
将斜面保存的白假丝酵母菌按4%接种量接种于YEPD液体培养基中,180 r/min,30 ℃条件下48 h,活化至三代后备用。
1.2.4 指示菌菌悬液制备
将活化三代的白假丝酵母稀释,将0.1 mL菌液吸入0.9 mL生理盐水的无菌EP管中,混合均匀,重复操作,稀释至10−6倍备用。
1.2.5 乳清培养基中乳清液的制备
将100 g乳清粉加入1 L、90 ℃蒸馏水中(先加热水,再加乳清粉以防糊状)。用0.1 mol/L盐酸溶液把以上溶液pH调成4.5,90 ℃恒温水浴30 min,使酪蛋白凝结沉淀成块。用脱脂棉、纱布过滤,然后用1 mol/L氢氧化钠溶液将滤后乳清液的pH调成6.5,煮沸后进行抽滤,115 ℃灭菌20 min后4 ℃冷藏备用。
1.2.6 乳杆菌抗真菌肽发酵液的处理
将活化至三代的乳酸菌ALAC按4%接种量分别接种到乳清培养基中,在180 r/min条件下培养24 h,发酵液离心分离去除菌体及沉淀(8000 r/min,20 min,4 ℃),取上清液在50 ℃、0.075 MPa条件下浓缩至10%。
1.2.7 单因素实验
1.2.7.1 菌株接种量对乳酸菌产抑菌活性物质的影响
将乳杆菌ALAC分别按1%、2%、3%、4%、5%的接种量接入乳清培养基,37 ℃下培养24 h,发酵液离心分离浓缩后进行抑菌试验。
1.2.7.2 发酵时间对乳酸菌产抑菌活性物质的影响
将乳杆菌ALAC按4%的接种量接入培养基,37 ℃下分别培养18、24、30、32、36、42 h,同上处理后进行抑菌试验。
1.2.7.3 发酵温度对乳酸菌产抑菌活性物质的影响
将乳杆菌ALAC按4%接种量接入乳清培养基,分别在27、32、37、42、47 ℃下培养24 h,发酵液同上处理后进行抑菌试验。
1.2.7.4 培养基初始pH对乳酸菌产抑菌活性物质的影响
将乳杆菌ALAC按4%接种量接入乳清培养基,分别调节pH到6.0、6.5、7.0、7.5、8.0,37 ℃下培养24 h,发酵液同上处理后进行抑菌试验。
1.2.8 响应面试验
由单因素实验得出最佳发酵条件后,结合试验结果,选取对抑菌圈影响较大的3个因素,培养基初始pH、培养时间、培养温度,利用响应面分析法进行优化设计。以各因最优取值为中心,上下区域各取1个水平值作为响应面试验设计水平 见表1。通过发酵浓缩液的抑菌圈大小作为评价指标,设计三因素三水平17个试验点的响应面试验,其中零点实验重复5次,采用Design-Expert 8.0.6统计软件对实验结果进行响应面回归分析。
表 1 Box-Behnken试验因素与水平设计Table 1. Factors and levels of Box-Behnken因素 −1 0 1 A接种量(%) 3 4 5 B发酵时间(h) 18 24 30 C初始pH 6.5 7 7.5 1.2.9 牛津杯法检测抑菌性
配制水琼脂及YEPD培养基,灭菌备用。将水琼脂加热融化,取15 mL倒入培养皿中,凝固后在固体琼脂上放置三只牛津杯(呈正三角形形状)。将稀释后的白假丝酵母按4%比例接入35 ℃左右25 ml YEPD培养基中,将其倒入已凝固的琼脂培养基待凝固。凝固后培养皿呈明显两层状态,遂取出牛津杯,在孔洞中加入200 μL发酵浓缩液,37 ℃培养24 h观察结果。每组试验进行三次,计算平均值。可以通过比较抑菌圈大小(包含牛津杯的直径7 mm)来反应其抑菌性强弱。
1.2.10 抗菌肽粗提粉的品质分析
抗菌肽发酵液粗提粉制备,将浓缩至10%的发酵粗提液进行冷冻干燥,36 h后取出研磨成均匀粉末4 ℃保存备用。
理化指标测定:将抗菌肽粗提粉添加10倍的蒸馏水溶解均匀,通过乳成分分析仪进行蛋白质、乳糖、脂肪理化指标测定。水分含量测定根据GB 5009.3-2016中的直接干燥法测定。抗菌肽粗提粉微生物指标检测,菌落总数测定方法参考GB 4789.2-2016。大肠菌群数测定方法参考GB 4789.3-2016。致病菌(志贺氏菌、沙门氏菌、金黄色葡萄球菌)测定方法参考GB 4789.10-2016。
1.3 数据处理
所有实验进行3次重复,采用SPSS 19.0软件统计处理数据,采用Design-Expert 8.0.6统计软件进行响应面分析,采用Originpro 2019,excle 2016软件作图。
2. 结果与分析
2.1 乳杆菌ALAC发酵条件单因素实验
2.1.1 接种量对菌株产抗菌肽的影响
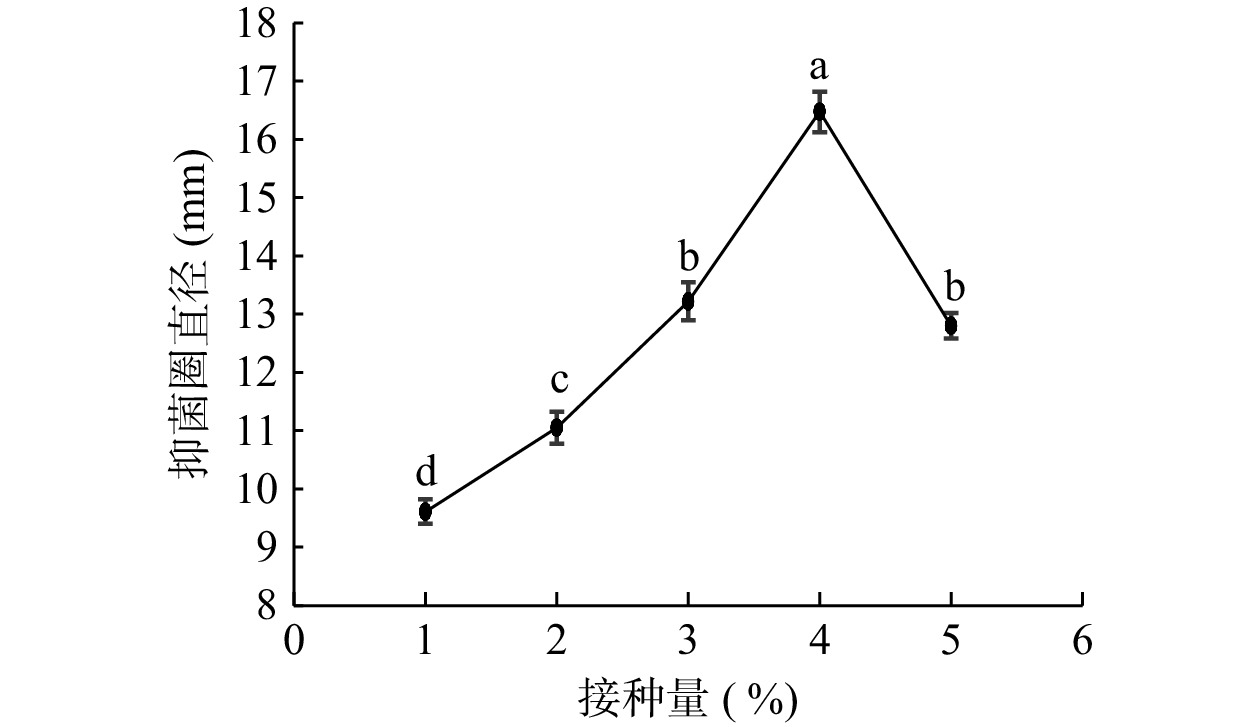
通过前期研究结果发现试验菌株对大多数霉菌和酵母具有抑菌性,尤其对白假丝酵母具有极强抑菌性,且白假丝酵母为食品中常见的致病致腐酵母,故将其作为指示菌来测定乳杆菌产抑菌活性物质的抑菌效果。通过研究不同接种量对乳杆菌产抑菌活性物质的影响(图1),发现接种量对菌株抑菌效果有显著影响(P<0.05),随着接种量的增加,抑菌圈直径迅速增大,在接种量为4%条件下发酵液的抑菌圈直径达到峰值16.47 mm,再继续增大接种量抑菌圈直径减小。据研究表明,细菌素合成在对数期,一定程度加大接种量会加速菌种生长,快速到达对数期,从而加速合成细菌素,使抑菌活性增强[19]。从图1中可以看出当接种量高于4%时抑菌圈直径有明显的下降趋势,可能是由于乳酸菌发酵过程中,一定的空间内微生物数量增加会引起生存空间和营养物质的争夺,因而造成菌株生长情况下降,抗菌物质合成受阻,抑菌圈直径变小。也可能是接种量过大,缩短合成时间,产量有很大程度的下降,抗菌肽的活性也会降低,这可能也与细菌素吸附到产生菌菌体表面有关[20]。
2.1.2 发酵时间对菌株产抗菌肽的影响
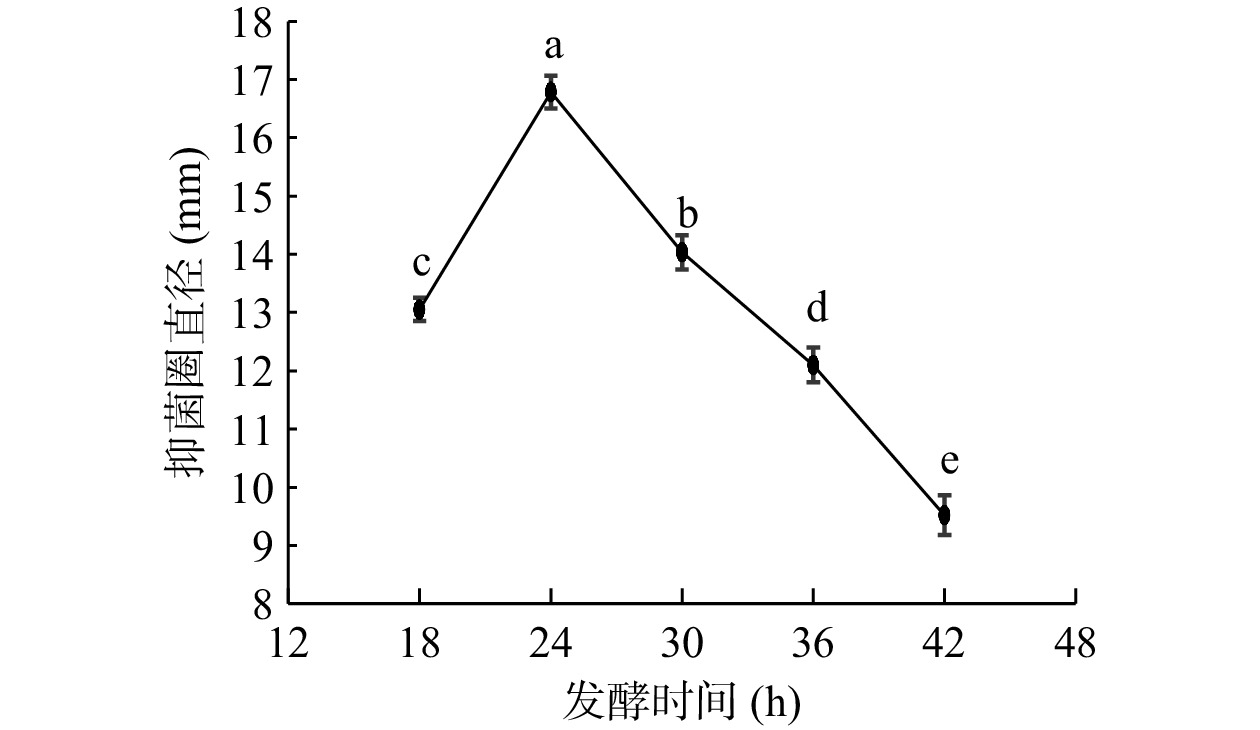
由图2所示,发酵时间对抑菌效果有显著影响(P<0.05),抑菌圈直径随发酵时间的延长先迅速增高,在24 h达到峰值16.78 mm,后随着发酵时间增长发酵液抑菌活性呈逐渐下降趋势。通常来说,抗菌肽在对数生长前期开始合成,在指数生长末期或稳定前期达到最大量[21]。副干酪乳杆菌ALAC的对数生长期为18~30 h[22],生长24 h时乳杆菌正处于对数生长期中期,产生的抑菌物质活性最强,菌株抑菌活性与生长曲线变化基本一致,这与王瑶等[23]研究发现相符,即植物乳杆菌LPL-1菌株的细菌素产量与生长曲线有一致性。随着发酵时间延长但抑菌活性逐渐降低,这可能是菌体进入衰亡期,合成抗菌肽能力减弱导致抗菌活性下降。
2.1.3 发酵温度对菌株产抗菌肽的影响
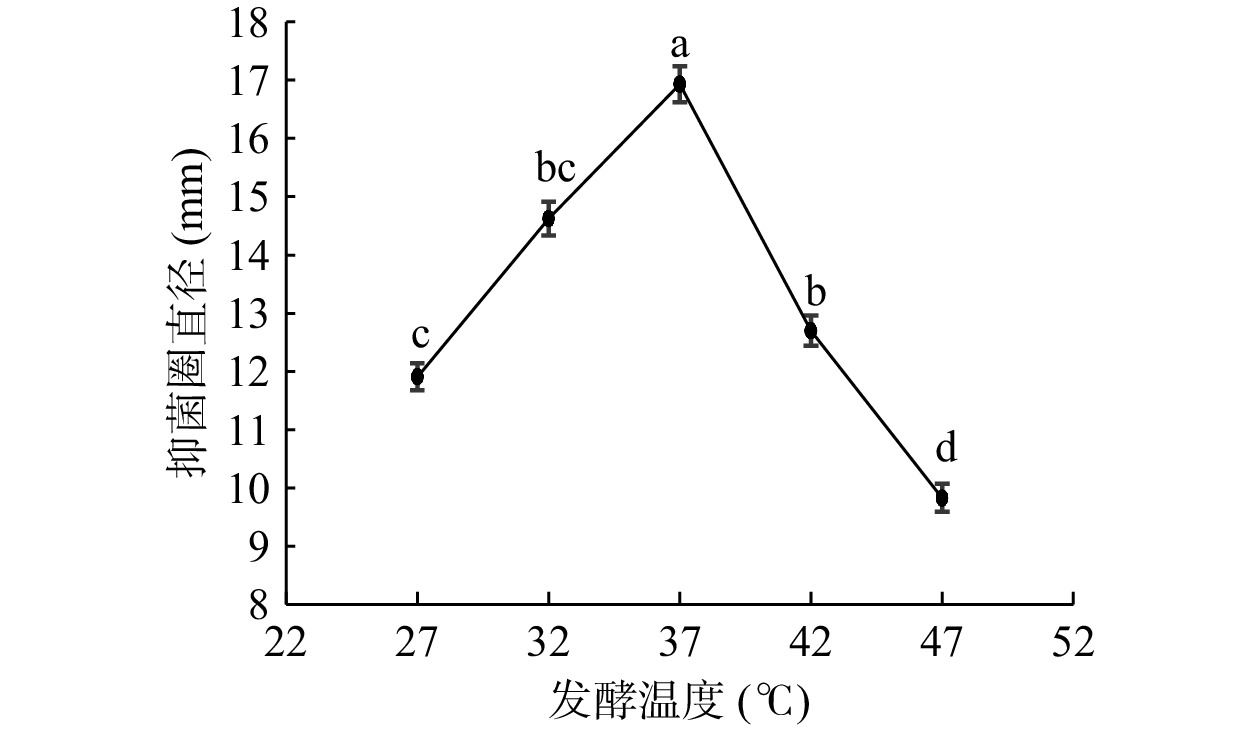
研究不同的发酵温度对菌株合成抗菌肽的影响,结果发现(图3)随着发酵温度的增长,抑菌圈直径呈现先增大后减小的趋势,在37 ℃达到峰值16.93 mm,超过37 ℃后抑菌圈直径大幅降低。Ogunbanwo等[24]研究发现30 ℃时最有利于植物乳杆菌产细菌素,这与本研究结果不同,说明不同菌株产抗菌肽的最适发酵温度不同,这与抗菌肽的合成机制有关[25],也有可能该菌株抗菌物质代谢途径受到阻碍导致抑菌活性下降。
2.1.4 初始pH对菌株产抗菌肽的影响
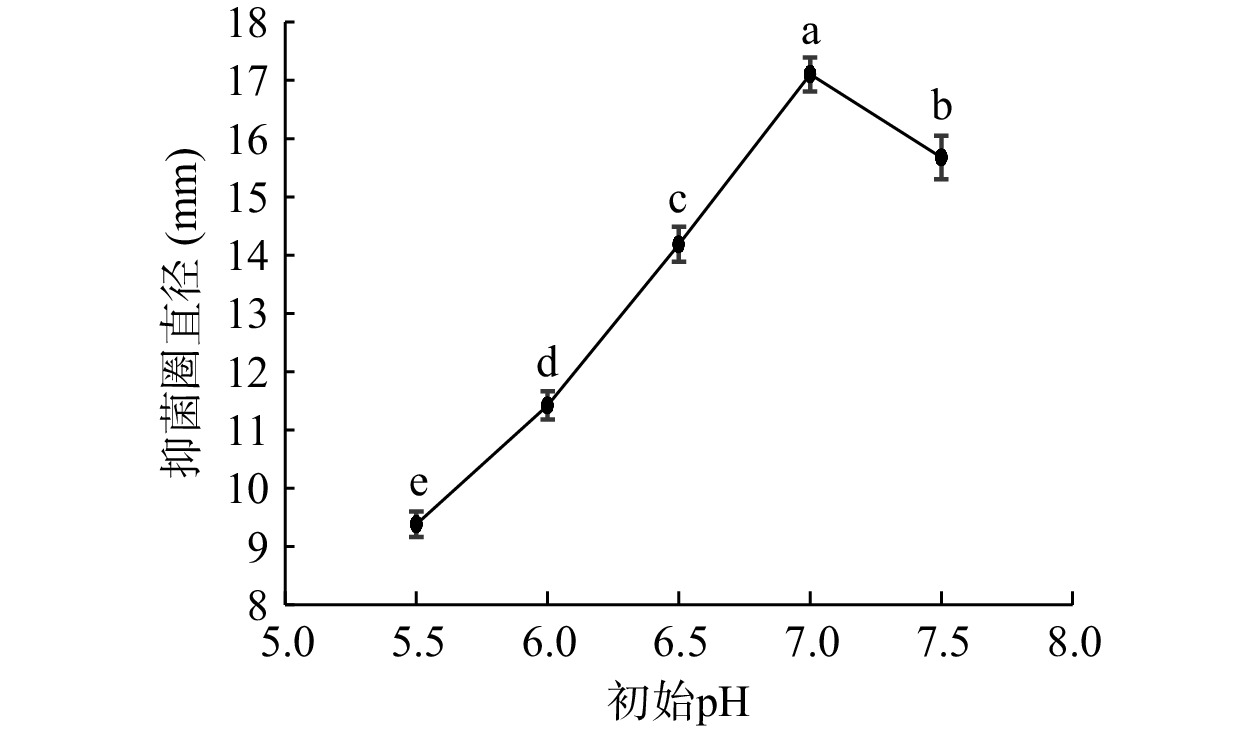
培养基初始pH在5.5~7.0范围内时(图4),抑菌圈直径不断增加,在pH为7时抑菌圈直径达到峰值17.1 mm,随后抑菌圈直径下降。研究表明乳酸菌的最适生长pH与细菌素合成的最适pH可能不相同[26]。乳杆菌最适生长pH在5.5~6.0左右,但在酸性条件下抗菌肽的转录翻译过程受阻,导致抑菌活性低;也可能是菌体细胞在不同pH条件下对抗菌肽的吸附能力不同[27],不利于代谢生成抑菌物质。在培养基初始pH为7.0时尽管菌体生长未处于最佳状态,但此时生成的抑菌物质活性最强。
2.2 响应面试验优化发酵工艺
2.2.1 响应面试验设计及结果
在单因素实验的基础上,选取A接种量、B发酵时间、C初始pH 3个因素,采用三因素三水平的响应面分析试验对乳杆菌ALAC培养基发酵条件优化。利用Design-Expert 8.0.6软件进行试验设计、数据处理及模型的建立。试验结果与分析见表2。
表 2 Box-Behnken试验设计及结果Table 2. Experimental design and results of Box-Behnken实验号 A接种量(%) B发酵时间(h) C初始pH 抑菌圈直径(mm) 1 3 18 7 13.9±0.20 2 5 18 7 12.9±0.23 3 3 30 7 13.5±0.37 4 5 30 7 13.4±0.18 5 3 24 6.5 14.0±0.33 6 5 24 6.5 13.8±0.35 7 3 24 7.5 13.6±0.29 8 5 24 7.5 12.4±0.31 9 4 18 6.5 13.9±0.40 10 4 30 6.5 13.7±0.44 11 4 18 7.5 13.2±0.32 12 4 30 7.5 12.7±0.23 13 4 24 7 16.7±0.25 14 4 24 7 17.0±0.41 15 4 24 7 18.1±0.36 16 4 24 7 17.2±0.27 17 4 24 7 16.5±0.42 将得到的实验结果用Design-Expert10.0.7软件对所得试验数据进行二次多项式回归拟合,得到抑菌圈直径与各因素变量的二次回归方程如下:Y=17.10−0.31A−0.075B−0.44C+0.22AB−0.25AC+0.075BC−1.80A2−1.88B2−1.85C2,此方程试验方差分析见表3。
表 3 Box-Behnken回归模型方差分析Table 3. ANOVA for Box-Behnken regression model方差源 平均和 自由度 均方 F值 P值 显著性 模型 50.73 9 5.64 24.17 0.0002 显著 A 0.78 1 0.78 3.35 0.1099 B 0.045 1 0.045 0.19 0.6737 C 1.53 1 1.53 6.57 0.0374 AB 0.20 1 0.20 0.87 0.3824 AC 0.25 1 0.25 1.07 0.3349 BC 0.023 1 0.023 0.096 0.7651 A2 13.64 1 13.64 58.50 0.0001 显著 B2 14.80 1 14.80 63.47 <0.0001 显著 C2 14.41 1 14.41 61.79 0.0001 显著 残差 1.63 7 0.23 失拟项 0.093 3 0.031 0.080 0.9674 不显著 误差项 1.54 4 0.39 总和 52.36 16 由表3可知,模型决定系数R2为0.9688,说明抑菌圈直径的实际值与预测值拟合较好,96.88%的抑菌圈直径大小变化可用此回归方程模型来解释,可以较好的反映出抑菌圈直径与接种量、发酵时间和初始pH之间的关系。调整决定系数R2Adj为0.9287,说明92.87%实验数据的变异性可用该方程解释且抑菌圈大小由92.87%受实验因素影响。该模型的P值<0.01,具有显著性,失拟项P值0.9674>0.05,表明失拟项不显著,模型拟合度好,能较好的反映响应面的变化,描述本实验结果。综上所述,以抑菌圈直径为响应值建立的乳酸菌最佳发酵工艺模型,可对不同发酵条件下乳酸菌抑菌能力进行分析和预测。对回归模型进行显著性检验可知,A2、B2、C2抑菌圈直径大小的影响极显著(P<0.01),C对抑菌圈直径大小的影响显著(P<0.05)。根据表中F值可知,各因素对抑菌圈大小影响程度为C>A>B,即:初始pH>接种量>发酵时间。
2.2.2 响应面交互效应分析
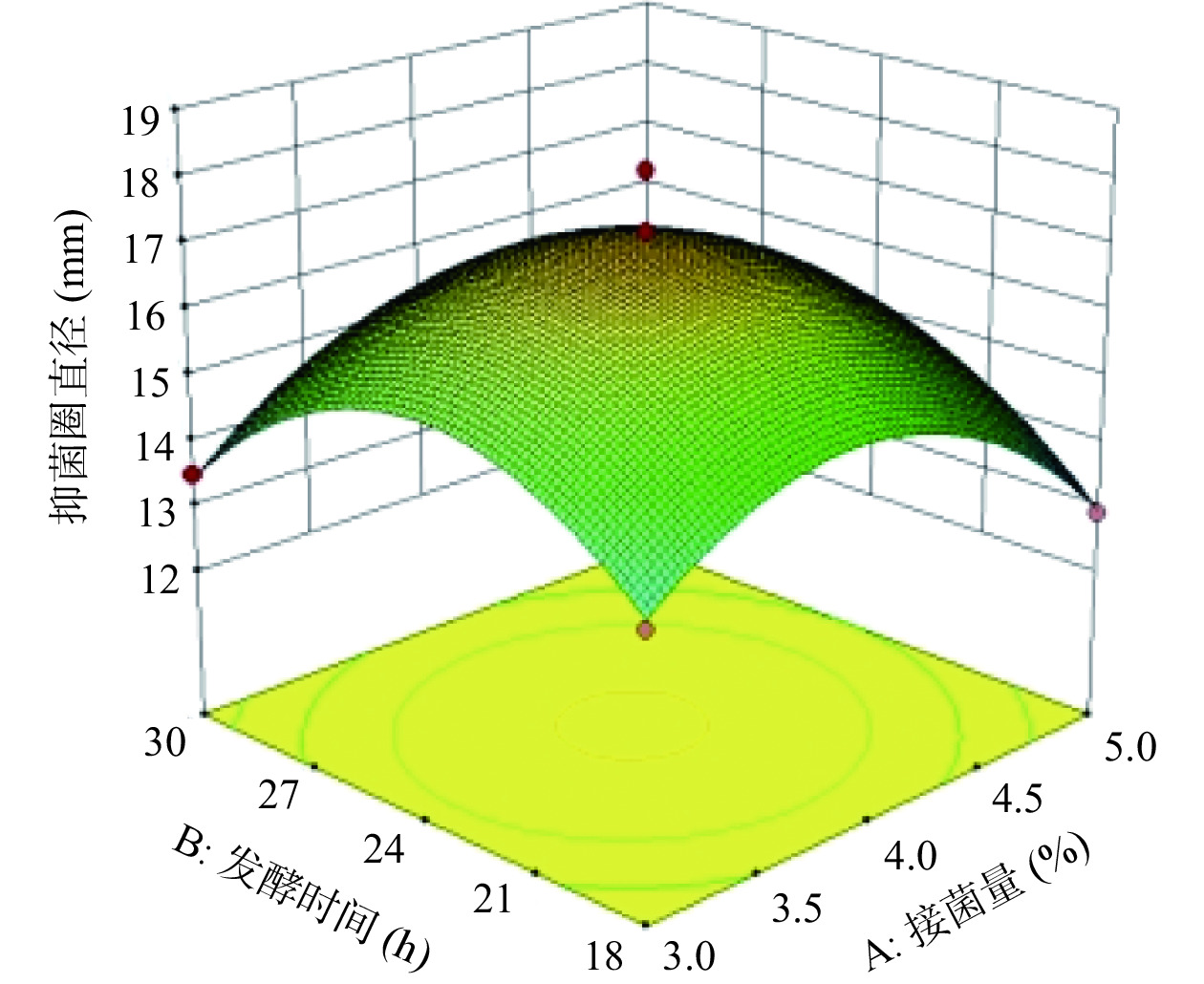
图5是接种量和发酵时间影响抑菌活性的响应面图。从图中可以看出当初始pH不变,发酵时间处于最值时,随着接种量的增加,抑菌圈直径呈先增加后下降趋势;接种量处于最值时,随着发酵时间增加,抑菌圈大小呈现出相同趋势。发酵时间与接种量的曲面较陡,对抑菌活性影响显著。
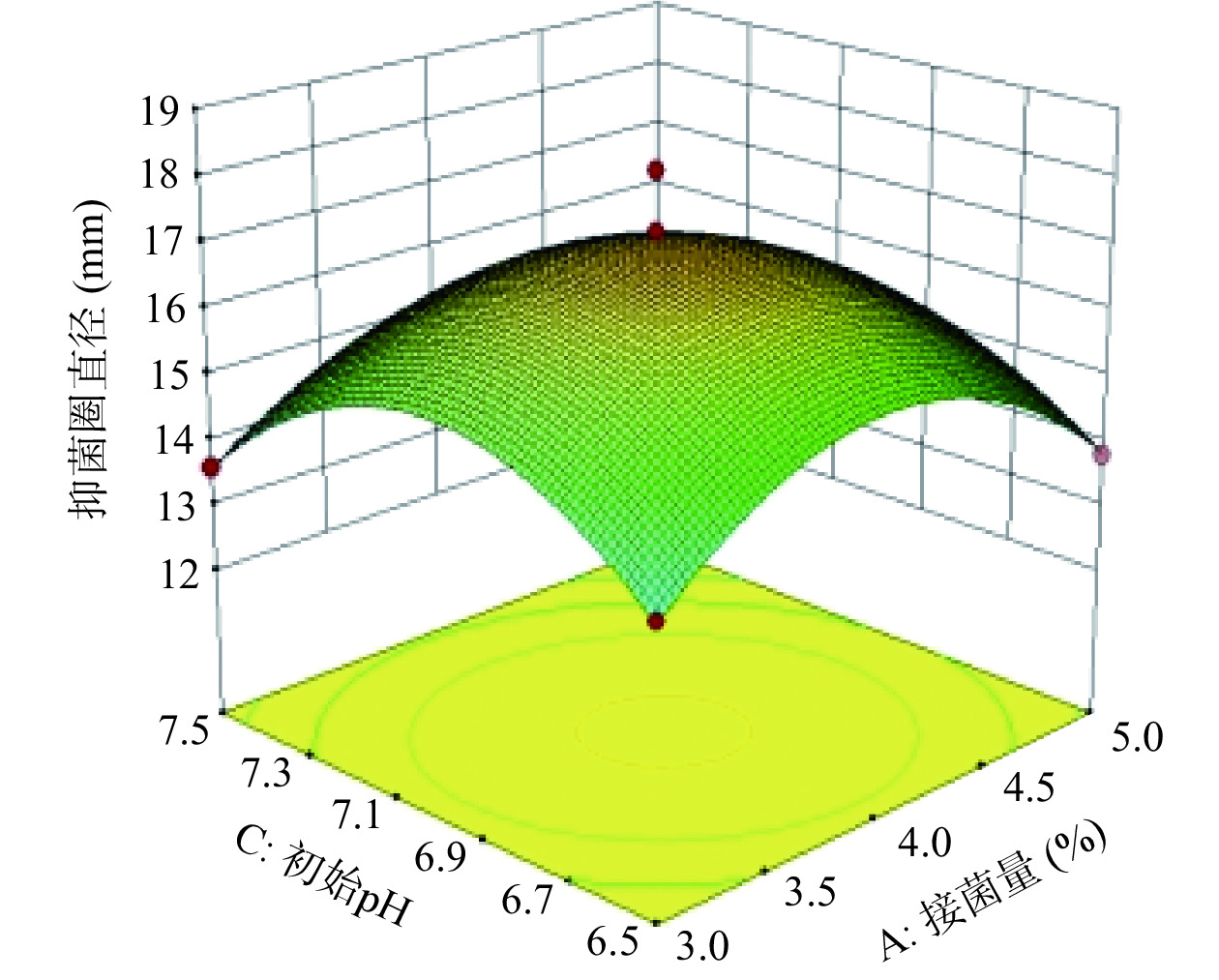
从图6可以看出,当发酵时间不变,接种量处于最值时,随着初始pH的增加,抑菌圈直径呈先增加后下降趋势;初始pH处于最值,随着接种量的增加,抑菌圈大小呈相同趋势。接种量与初始pH的曲面较陡,对抑菌活性影响显著。
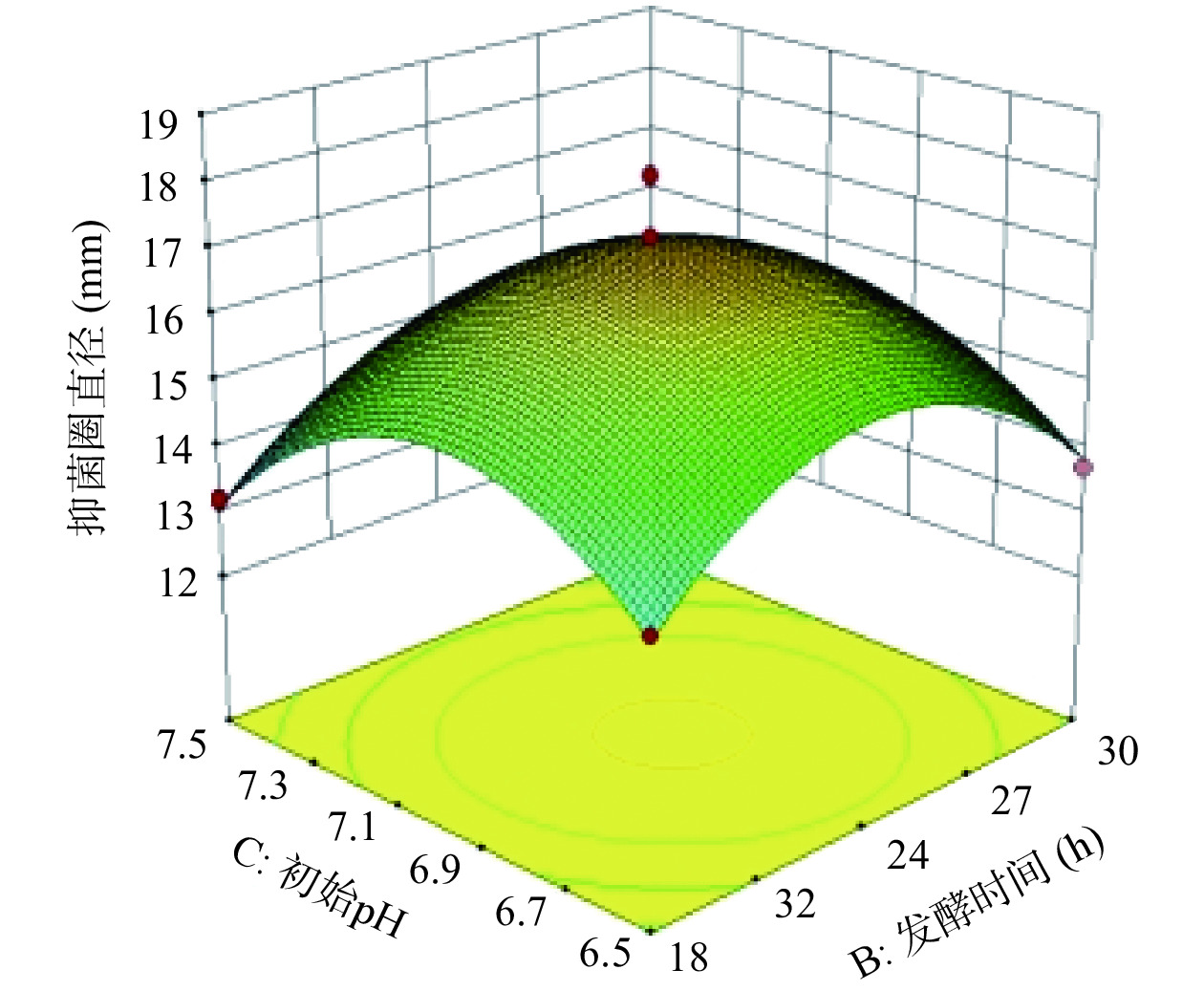
图7是发酵时间和初始pH影响抑菌活性的响应面图。当接种量固定,发酵时间处于最值时,随着初始pH的增加,抑菌圈直径呈先增加后下降趋势;初始pH处于最值时,随着发酵时间增加,抑菌圈大小呈相同趋势。代表初始pH的响应曲面坡度较陡,说明初始pH的变化对抑菌活性的影响比发酵时间对其影响大。
2.2.3 工艺条件验证实验
根据抑菌圈直径大小模型的二次回归方程,利用 Design-Expert 8.0.6软件对乳酸菌发酵条件工艺参数进行优化,得到最优参数为接种量3.907%、发酵时间23.706 h、初始pH为6.946,在此条件下抑菌圈直径为17.143 mm。为验证响应面优化的可行性,在此最佳条件下进行乳酸菌最优发酵条件的验证试验,同时考虑实际操作可行性,调整参数为接种量4%、发酵时间24 h、初始pH为7.0,进行3次平行试验,得到抑菌圈直径平均值为17.33±0.17 mm,与理论值较为接近。说明采用响应面法对乳酸菌发酵工艺参数优化得出的结果可靠,具有实用价值。
2.3 抗菌肽粗提粉的品质分析
采用本实验优化的最佳发酵工艺制得发酵粗提液,经过浓缩蒸发,冷冻干燥制得抗菌肽粗提粉。抗菌肽粗提粉有较好的组织状态,滋味气味正常,色泽均一。组织状态整体均匀、松散,粉质干燥且无结块,具有良好的流动性;滋气味有较浓的乳香味及乳酸菌发酵后特有的淡香味;色泽呈均匀一致的乳黄色、有光泽。
抗菌肽粗提粉的理化指标如表4所示,由表4可知,抗菌粗提粉的脂肪含量为0.53 g/100 g,蛋白质含量为34 g/100 g,含水量为3.4%(w/w),乳糖含量77 g/100 g,溶水后溶液pH为4.5。
表 4 抗菌肽粗提粉理化指标Table 4. Physical and chemical indexes of crude powder of antimicrobial peptides脂肪含量
(g/100 g)蛋白含量
(g/100 g)灰分
(g/100 g)乳糖
(g/100 g)水分
(w/w)pH 0.53 34 7.68 77 3.42 4.5 抗菌肽粗提粉的根据微生物检测结果见表5,抗菌肽粗提粉中菌落总数<3000 cfu/g,大肠菌群数<90 MPN/100 g。沙门氏菌、志贺氏菌及金黄色葡萄球菌这三种食品中常见致病菌没有被检测出。考虑后期可以安全应用于食品中延长食品保质期。
表 5 抗菌肽粗提粉微生物指标Table 5. Test results of microbial indexes of crude powder of antimicrobial peptides项目 抗菌肽粉 菌落总数(cfu/g) <3000 大肠菌群(MPN/100 g) <90 沙门氏菌 未检出 志贺氏菌 未检出 金黄色葡萄球菌 未检出 3. 结论
安全高效的天然抑菌产品有望代替化学防腐剂用于食品、饲料等行业[28−29]。当下发酵乳酸菌抗菌肽的培养基以MRS、M17培养基居多,采用农业、工业副产物为培养基主要成分发酵乳酸菌抗菌肽成为研究热点[30]。本研究选用乳清发酵培养基,以自主分离的具有抑真菌特性的副干酪乳杆菌ALAC生产抗菌肽粉。采用响应面分析对副干酪乳杆菌的发酵条件进行了优化,确定了最佳发酵工艺条件为培养基初始pH为7.0、接种量4%、发酵时间24 h,此条件下乳杆菌产抗菌肽的抑菌圈达到17.33±0.17 mm。最佳发酵条件制得的抗菌肽粗提粉感官状态良好,理化指标和微生物指标符合要求。研究结果表明副干酪乳杆菌ALAC发酵生产的抗菌肽具有较强的抑菌特性,为后期进一步优化后处理工艺,从而生产抗菌肽粉奠定了基础。
-
表 1 Box-Behnken试验因素与水平设计
Table 1 Factors and levels of Box-Behnken
因素 −1 0 1 A接种量(%) 3 4 5 B发酵时间(h) 18 24 30 C初始pH 6.5 7 7.5 表 2 Box-Behnken试验设计及结果
Table 2 Experimental design and results of Box-Behnken
实验号 A接种量(%) B发酵时间(h) C初始pH 抑菌圈直径(mm) 1 3 18 7 13.9±0.20 2 5 18 7 12.9±0.23 3 3 30 7 13.5±0.37 4 5 30 7 13.4±0.18 5 3 24 6.5 14.0±0.33 6 5 24 6.5 13.8±0.35 7 3 24 7.5 13.6±0.29 8 5 24 7.5 12.4±0.31 9 4 18 6.5 13.9±0.40 10 4 30 6.5 13.7±0.44 11 4 18 7.5 13.2±0.32 12 4 30 7.5 12.7±0.23 13 4 24 7 16.7±0.25 14 4 24 7 17.0±0.41 15 4 24 7 18.1±0.36 16 4 24 7 17.2±0.27 17 4 24 7 16.5±0.42 表 3 Box-Behnken回归模型方差分析
Table 3 ANOVA for Box-Behnken regression model
方差源 平均和 自由度 均方 F值 P值 显著性 模型 50.73 9 5.64 24.17 0.0002 显著 A 0.78 1 0.78 3.35 0.1099 B 0.045 1 0.045 0.19 0.6737 C 1.53 1 1.53 6.57 0.0374 AB 0.20 1 0.20 0.87 0.3824 AC 0.25 1 0.25 1.07 0.3349 BC 0.023 1 0.023 0.096 0.7651 A2 13.64 1 13.64 58.50 0.0001 显著 B2 14.80 1 14.80 63.47 <0.0001 显著 C2 14.41 1 14.41 61.79 0.0001 显著 残差 1.63 7 0.23 失拟项 0.093 3 0.031 0.080 0.9674 不显著 误差项 1.54 4 0.39 总和 52.36 16 表 4 抗菌肽粗提粉理化指标
Table 4 Physical and chemical indexes of crude powder of antimicrobial peptides
脂肪含量
(g/100 g)蛋白含量
(g/100 g)灰分
(g/100 g)乳糖
(g/100 g)水分
(w/w)pH 0.53 34 7.68 77 3.42 4.5 表 5 抗菌肽粗提粉微生物指标
Table 5 Test results of microbial indexes of crude powder of antimicrobial peptides
项目 抗菌肽粉 菌落总数(cfu/g) <3000 大肠菌群(MPN/100 g) <90 沙门氏菌 未检出 志贺氏菌 未检出 金黄色葡萄球菌 未检出 -
[1] 孙二娜, 张小妹, 赵伊凡, 等. 副干酪乳杆菌LC-37乳酸菌饮料对人体的促消化和调节肠道菌群作用[J]. 中国食品学报,2021,21(10):95−100. [SUN Ernan, ZHANG Xiaomei, ZHAO Yifan, et al. Effects of Lactobacillus paracasei LC-37 lactic acid bacteria beverage on human digestion and regulation of intestinal flora[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(10):95−100.] SUN Ernan, ZHANG Xiaomei, ZHAO Yifan, et al. Effects of Lactobacillus paracasei LC-37 lactic acid bacteria beverage on human digestion and regulation of intestinal flora[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(10): 95−100.
[2] 陈大卫, 任晨瑜, 申菲菲, 等. 混合乳酸菌及其发酵乳对小鼠肠道菌群失衡的调节作用[J]. 中国乳品工业,2020,48(12):4−9. [CHEN Dawei, REN Chenyu, SHEN Feifei, et al. Regulation of mixed lactic acid bacteria and their fermented milk on intestinal flora imbalance in mice[J]. China Dairy Industry,2020,48(12):4−9.] doi: 10.19827/j.issn1001-2230.2020.12.001 CHEN Dawei, REN Chenyu, SHEN Feifei, et al. Regulation of mixed lactic acid bacteria and their fermented milk on intestinal flora imbalance in mice[J]. China Dairy Industry, 2020, 48(12): 4−9. doi: 10.19827/j.issn1001-2230.2020.12.001
[3] HUANG Y, WANG X, WANG J, et al. Lactobacillus plantarum strains as potential probiotic cultures with cholesterol-lowering activity[J]. Journal of Dairy Science,2013,96(5):2746−2753. doi: 10.3168/jds.2012-6123
[4] 王利君, 郦萍, 付碧石. 乳酸菌细菌素抗菌作用机制研究进展[J]. 食品科技,2020,45(1):36−42. [WANG Lijun, LI Ping, FU Bishi1, et al. Advances in research on antibacterial mechanism of lactic acid bacteria bacteriocin[J]. Food Science and Technology,2020,45(1):36−42.] doi: 10.13684/j.cnki.spkj.2020.01.007 WANG Lijun, LI Ping, FU Bishi1, et al. Advances in research on antibacterial mechanism of lactic acid bacteria bacteriocin[J]. Food Science and Technology, 2020, 45(1): 36−42. doi: 10.13684/j.cnki.spkj.2020.01.007
[5] MORADI M, KOUSHEH S A, ALMASI H, et al. Postbiotics produced by lactic acid bacteria:The next frontier in food safety[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(3):3390−3415.
[6] 周荣雪, 陈山乔, 马文静. 微生物防腐剂在食品工业中的应用[J]. 粮食与油脂,2020,33(1):15−17. [ZHOU Rongxue, CHEN Shanqiao, MA Wenjing. Application of microbial food preservative in food industry[J]. Cereals & Oils,2020,33(1):15−17.] doi: 10.3969/j.issn.1008-9578.2020.01.006 ZHOU Rongxue, CHEN Shanqiao, MA Wenjing. Application of microbial food preservative in food industry[J]. Cereals & Oils, 2020, 33(1): 15−17. doi: 10.3969/j.issn.1008-9578.2020.01.006
[7] KHARA J S, OBUOBI S, WANG Y. Disruption of drug-resistant biofilms using de novo designed short α-helical antimicrobial peptides with idealized facial amphiphilicity[J]. Acta Biomaterialia,2017,57(3):114−118.
[8] SILVA C C G, SILVA S P M, RIBEIRO S C. Application of bacteriocins and protective cultures in dairy food preservation[J]. Front Microbiol,2018,9(2):594−604.
[9] STREEKSTRA H, VERKENNIS A E, JACOBS R, et al. Fungal strains and the development of tolerance against natamycin[J]. Int J Food Microbiol,2016,238(10):15−22.
[10] KHAN M M, KIM Y K, CHO S S, et al. Response surface optimization of culture conditions for cyclic lipopeptide MS07 from bacillus siamensis reveals diverse insights targeting antimicrobial and antibiofilm activity[J]. Processes,2020,8(6):744. doi: 10.3390/pr8060744
[11] 黄升, 陈利, 苏国旗, 黄金秀. 类芽孢杆菌产脂环七肽的中试发酵参数优化[J]. 中国畜牧杂志,2022,58(10):319−323. [HAUNG Sheng, CHEN Li, SU Guoqi, et al. Optimization of pilot fermentation parameters for producing alicyclic heptapeptide by Paenibacillus[J]. Chinese Journal of Animal Science,2022,58(10):319−323.] HAUNG Sheng, CHEN Li, SU Guoqi, et al. Optimization of pilot fermentation parameters for producing alicyclic heptapeptide by Paenibacillus[J]. Chinese Journal of Animal Science, 2022, 58(10): 319−323.
[12] MODIRI S, KASRA K R, REZA S M, et al. Growth optimization of lactobacillus acidophilus for production of antimicrobial peptide acidocin 4356:Scale up from flask to lab-scale fermenter[J]. Iranian Journal of Biotechnology,2021,19(3):2686.
[13] 封成玲, 刘洋, 贾紫伟, 等. 产酶溶杆菌L-43合成抗菌肽的发酵工艺优化[J]. 食品与发酵工业,2022,48(19):196−203. [FENG Chengling, LIU Yang, JIA Ziwei, et al. Optimization of fermentation process for production of antimicrobial peptides with lysobacter enzymogenes L-43[J]. Food and Fermentation Industries,2022,48(19):196−203.] FENG Chengling, LIU Yang, JIA Ziwei, et al. Optimization of fermentation process for production of antimicrobial peptides with lysobacter enzymogenes L-43[J]. Food and Fermentation Industries, 2022, 48(19): 196−203.
[14] 江晨, 齐宏涛, 于丽娜, 等. 响应面优化花生蛋白抗菌肽制备工艺[J]. 山东农业科学,2021,53(11):111−119. [JIANG Chen, QI Hongtao, YU Lina, et al. Optimization of peanut antibacterial peptide preparation by response surface methodology[J]. Shandong Agricultural Sciences,2021,53(11):111−119.] JIANG Chen, QI Hongtao, YU Lina, et al. Optimization of peanut antibacterial peptide preparation by response surface methodology[J]. Shandong Agricultural Sciences, 2021, 53(11): 111−119.
[15] 秦楠, 杨金梅, 梁莹支, 等. 解淀粉芽孢杆菌HRH317菌株抗菌肽发酵条件优化及其抑菌活性研究[J]. 食品安全质量检测学报,2021,12(15):6169−6176. [QIN Nan, YANG Jinmei, LIANG Yingzhi, et al. Optimization of fermentation conditions and antibacterial activity of antimicrobial peptides from Bacillus amylolytica HRH317 strain[J]. Journal of Food Safety & Quality,2021,12(15):6169−6176.] QIN Nan, YANG Jinmei, LIANG Yingzhi, et al. Optimization of fermentation conditions and antibacterial activity of antimicrobial peptides from Bacillus amylolytica HRH317 strain[J]. Journal of Food Safety & Quality, 2021, 12(15): 6169−6176.
[16] AMIRI S, REZAEI M R, SOWTI K M, et al. Characterization of antimicrobial peptides produced by Lactobacillus acido philus LA-5 and Bifidobacterium lactis BB-12 and their inhibitory effect against foodborne pathogens[J]. LWT,2022,153(10):112449.
[17] CHEN Zhongjun, LIU Jing, LI Haixuan, et al. Antifungul mechanism of active substances produced by lactobacillus against yeast[J]. Journal of Microbiology and Biotechnology,2016,5(4):53−59.
[18] CHEN Zhongjun, LI Xiaoting, GAO Hechen. Production of proteinaceous antifungal substances from Lactobacillus plantarum ALAC-4 isolated from Inner Mongolia traditional fermented dairy food[J]. International Journal of Dairy Technology,2018,71(1):223−229.
[19] HERNANDEZ D, CARDELL E, ZARATE V. Antimicrobial activity of lactic acid bacteria isolated from Tenerife cheese:Initial characterization of plantaricin TF711, a bacteriocin like substance produced by Lactobacillus plantarum TF711[J]. Journal of Applied Microbiology,2010,99(1):77−84.
[20] ASEN I M, MORETRO T, KATLA T, et al. Influence of complex nutrients, temperature and pH on bacteriocin production by Lactobacil lus sakei CCUG42687[J]. Applied Microbiology and Biotechnology,2000,53(2):159−166. doi: 10.1007/s002530050003
[21] VAN DEN BERGHE E, DE WINTER T, DE VUYST L. Enterocin A production by Enterococcus faecium FAIR-E 406 is characterised by a temperature-and pH-dependent switch-off mechanism when growth is limited due to nutrient depletion[J]. Int J Food Microbiol,2006,107(2):159−170. doi: 10.1016/j.ijfoodmicro.2005.08.027
[22] 李海瑄, 高鹤尘, 陈忠军. 乳杆菌产生的抑酵母活性物质抑菌机理的研究[J]. 中国乳品工业,2015,43(10):9−12,17. [LI Haixuan, GAO Hechen, CHEN Zhongjun. Study on inhibiting mechanism of antiyeast substances produced by Lactobacillus[J]. China Dairy Industry,2015,43(10):9−12,17.] LI Haixuan, GAO Hechen, CHEN Zhongjun. Study on inhibiting mechanism of antiyeast substances produced by Lactobacillus[J]. China Dairy Industry, 2015, 43(10): 9−12,17.
[23] 王瑶, 李琪, 李平兰. 响应面法优化植物乳杆菌LPL-1产细菌素发酵条件及细菌素理化性质分析[J]. 食品科学,2018,39(22):101−109. [WANG Yao, LI Qi, LI Pinglan. Optimization of fermentation conditions for plantaricin production by Lactobacillus plantarum LPL-1 by response surface methodology and its physicochemical properties[J]. Food Science,2018,39(22):101−109.] doi: 10.7506/spkx1002-6630-201822016 WANG Yao, LI Qi, LI Pinglan. Optimization of fermentation conditions for plantaricin production by Lactobacillus plantarum LPL-1 by response surface methodology and its physicochemical properties[J]. Food Science, 2018, 39(22): 101−109. doi: 10.7506/spkx1002-6630-201822016
[24] OGUNBANWO S T, SANNI A I, ONILUDE A A. Influence of cultural conditions on the production of bacteriocin by Lactobacillus brevis OGI[J]. Africa Journal of Biotechnology,2003,2(7):179−184. doi: 10.5897/AJB2003.000-1037
[25] ZAMFIR M, CALLEWAERT R, CORNEA P C, et al. Purification and characterization of a bacteriocin produced by Lactobacillus acidophilus IBB801[J]. Applied Microbiology,2010,87(6):923−931.
[26] 陈琳, 孟祥晨. 响应面法优化植物乳杆菌代谢产细菌素的发酵条件[J]. 食品科学,2011,32(3):176−180. [CHEN Lin, MENG Xiangchen. Optimization of fermentation conditions of lactobacillus plantarum for bacteriocin production by response surface methodology[J]. Food Science,2011,32(3):176−180.] CHEN Lin, MENG Xiangchen. Optimization of fermentation conditions of lactobacillus plantarum for bacteriocin production by response surface methodology[J]. Food Science, 2011, 32(3): 176−180.
[27] 胡彦新, 刘小莉, 王英, 等. 香肠乳杆菌(Lactobacillus farcimini)FM-MM-4产细菌素发酵条件和培养基优化[J]. 食品工业科技,2016,37(10):255−259,272. [HU Yanxin, LIU Xiaoli, WANG Ying, et al. Optimization on fermentation conditions and medium for bacteriocin produced by Lactobacillus farcimini[J]. Science and Technology of Food Industry,2016,37(10):255−259,272.] HU Yanxin, LIU Xiaoli, WANG Ying, et al. Optimization on fermentation conditions and medium for bacteriocin produced by Lactobacillus farcimini[J]. Science and Technology of Food Industry, 2016, 37(10): 255−259,272.
[28] 樊振江, 孟楠. 微生物防腐剂在食品保鲜上应用[J]. 现代食品,2017(4):12−14. [Fan Zhenjiang, Meng Nan. The application of microbial preservatives in food preservation[J]. Modern Food,2017(4):12−14.] doi: 10.16736/j.cnki.cn41-1434/ts.2017.04.005 Fan Zhenjiang, Meng Nan. The application of microbial preservatives in food preservation[J]. Modern Food, 2017(4): 12−14. doi: 10.16736/j.cnki.cn41-1434/ts.2017.04.005
[29] CANO-GARRIDO O, SERAS-FRANZOSO J, GARCIA-FRUITÓS E. Lactic acid bacteria:Reviewing the potential of a promising delivery live vector for biomedical purposes[J]. Microbial Cell Factories,2015,14(1):137. doi: 10.1186/s12934-015-0313-6
[30] 满丽莉, 向殿军, 布日额, 等. 提高乳酸菌细菌素合成量方法的研究进展[J]. 现代食品科技,2019,35(4):293−300. [MAN Lili, XIANG Dianjun, BU Rie, et al. Research progress on methods to increase the bacteriocin synthesis in lactic acid bacteria[J]. Modern Food Science and Technology,2019,35(4):293−300.] doi: 10.13982/j.mfst.1673-9078.2019.4.040 MAN Lili, XIANG Dianjun, BU Rie, et al. Research progress on methods to increase the bacteriocin synthesis in lactic acid bacteria[J]. Modern Food Science and Technology, 2019, 35(4): 293−300. doi: 10.13982/j.mfst.1673-9078.2019.4.040





 下载:
下载:
 下载:
下载:



