Enzymatic Preparation of Corn Protein Hydrolysate and Its Alleviating Effect on Colitis
-
摘要: 为了探究玉米蛋白水解物对肠道屏障功能的保护作用,本文首先以玉米蛋白粉为原料,采用Alcalase对其进行酶解,考察了不同酶解条件对水解物中谷氨酰胺含量的影响,建立了玉米蛋白的最适水解体系。然后以葡聚糖硫酸钠为诱导剂构建小鼠结肠炎模型,系统的评价了玉米蛋白水解物对小鼠结肠炎的缓解作用。结果表明:Alcalase的最适酶解条件为酶解温度64 ℃,酶解时间2.5 h,加酶量1300 U/g;在此条件下,水解物中谷氨酰胺含量可达到8.79%。所制得的玉米蛋白水解物(375和625 mg/kg·bw)能够明显改善结肠炎小鼠体重下降,缓解结肠缩短,降低疾病活动指数,减轻结肠组织中炎症细胞的浸润,调节炎症细胞因子水平。玉米蛋白水解物对小鼠结肠炎具有良好的缓解作用,本研究旨为拓宽玉米蛋白粉的高值化利用及开发肠道保护的功能性食品提供理论依据。Abstract: In order to explore the protective effect of corn protein hydrolysate on intestinal barrier function, corn gluten meal was used as raw material and Alcalase was used as catalyst for enzymatic hydrolysis in current study. The effects of different enzymatic hydrolysis conditions on the content of glutamine in the hydrolysate were investigated, and the optimum hydrolysis system of corn protein was established. Then the sodium dextran sulfate was used as inducer to construct colitis model, and the alleviating effect of corn protein hydrolysate on colitis in mice was systematically evaluated. The results showed that the optimum hydrolysis conditions for Alcalase were a temperature of 64 ℃, hydrolysis time of 2.5 h, amount of enzyme of 1300 U/g. Under such condition, the content of glutamine in the hydrolysate could reach 8.79%. Corn protein hydrolysate (375 and 625 mg/kg·bw) significantly improved weight loss in colitis mice, reduced the colonic shortening and the disease activity index, diminished the infiltration of inflammatory cells in the colonic tissue, regulated the level of inflammatory cytokines, and played a good role in relieving colitis in mice. This study would provide theoretical basis for expanding high-value utilization of corn gluten meal and developing functional food for intestinal protection.
-
Keywords:
- corn gluten meal /
- corn protein hydrolysate /
- sodium dextran sulfate /
- colitis
-
炎症性肠病(IBD)是一种典型的因肠道屏障功能障碍而引发的慢性胃肠道疾病,流行病学调查数据显示,IBD的发病率在欧洲和北美洲相对较高[1-2],我国的患病率虽然相对较低,但也呈现逐年增加趋势[3],预计2025年,患病人数将达到150万例,成为常见疾病[4]。此外,肠道屏障功能出现异常还会导致营养物质的消化吸收功能紊乱、生长缓慢、抗病能力下降、对病原微生物的易感性增强,进而引起其它各种疾病的发生[5-6]。因此,保护肠道屏障功能对维护肠道健康,减少炎症性肠病的发生具有重要的意义。
谷氨酰胺(Glutamine,Gln)是人体中含量最丰富的一种氨基酸,具有保护肠道屏障功能、提高机体抗氧化能力、增强机体免疫能力等多种生理功能[7-9],但由于Gln单体溶解度低且易分解,严重限制了其应用。研究发现谷氨酰胺结合肽不仅保留了Gln多种生理功能和营养,还具有吸收性好、致敏性低、稳定性强等优点,可以作为Gln稳定化的替代品[10]。目前,国外对谷氨酰胺肽的研究主要集中在人工合成的二肽(丙氨酰-L-谷氨酰胺和甘氨酰-L-谷氨酰胺)在人体或动物体内的生理功能研究,而国内对谷氨酰胺肽的研究主要集中在小麦谷氨酰胺肽的肠道营养功能方面的研究[11]。张海华[12]研究发现小麦面筋蛋白源谷氨酰胺肽能够促进鼠脾细胞增殖,对人胃癌细胞和小鼠淋巴瘤细胞生长具有抑制作用。王延州[13]研究发现小麦谷氨酰胺肽对氨甲喋呤致大鼠肠道粘膜损伤有一定的修复作用。以上结果表明,谷氨酰胺肽具有良好的功能活性,但现阶段还未见其它植物蛋白来源谷氨酰胺肽的生理活性研究,因此,积极开发新型植物蛋白源谷氨酰胺肽具有重要意义。
玉米蛋白粉是湿法生产玉米淀粉后的主要副产物,具有来源广、产量高、易于加工等优点[14]。玉米蛋白粉中含有多种必需氨基酸和疏水性氨基酸,在抗氧化、降血压、醒酒护肝等多种生理活性中发挥着重要的作用[15-17]。此外,玉米蛋白粉中还含有大量酰胺基氨基酸,其中谷氨酰胺含量约占谷蛋白总氨基酸含量的三分之一,是制备富含谷氨酰胺多肽玉米蛋白水解物的优质原料。研究表明,采用酶法改性技术可将玉米蛋白的功能性质更好的释放出来[18]。因此,为实现玉米蛋白粉的高值化利用,开发玉米活性肽更多的生理功能,本文以玉米蛋白粉为原料,采用Alcalase对其进行酶解,建立玉米蛋白的最适水解体系,然后系统的评价了富含谷氨酰胺的碱性蛋白酶水解物(Alcalase Hydrolysate,AH)对小鼠结肠炎的缓解作用,旨在为玉米活性肽类产品的开发提供理论基础。
1. 材料与方法
1.1 材料与仪器
玉米蛋白粉(蛋白质含量60.1%) 齐齐哈尔龙江阜丰生物科技有限公司;Alcalase(3.1×104 U/mL) 丹麦诺维信公司;α-淀粉酶(2.85×103 U/g) 北京双旋微生物培养基制品厂;葡聚糖硫酸钠盐(DSS,分子量36~50 kDa)、TNF-α、IL-1β、IL-6、IL-10试剂盒购自南京建成科技有限公司;磷酸氢二钠、磷酸二氢钠等试剂 均为国产分析纯;KM雄性小鼠 50只,体重18~22 g,实验动物生产许可证号为SCXK(吉)2020-0002,长春亿斯实验动物技术有限责任公司,动物实验方案经齐齐哈尔大学食品与生物工程学院实验动物伦理委员会审查批准。
PB-10 pH计 北京赛多利斯仪器有限公司;S10谷氨酸生物传感器分析仪 深圳西尔曼科技有限公司;LD-53真空冷冻干燥机 西班牙Telstar集团公司;TDL-5-A离心机 上海安亭科学仪器厂;DS32-II双螺杆挤压膨化机 上海跃进医疗器械厂;L-8800型氨基酸自动分析仪 日本日立公司。
1.2 实验方法
1.2.1 玉米蛋白粉预处理方法
玉米蛋白粉首先采用挤压膨化和去淀粉进行预处理[19]。具体操作为:将玉米蛋白粉用双螺杆挤压膨化机膨化。调节玉米蛋白粉含水量至16%,膨化机在160~180 ℃,1.0~1.5 MPa条件下进行膨化。膨化后在室温下干燥,粉碎、过60目筛。再用pH6.0的0.02 mol/L磷酸盐缓冲溶液将挤压膨化后的玉米蛋白粉配制成浓度为10%(m/v)的悬浮液,加入α-淀粉酶(30 U/g),60 ℃水解2 h。反应结束后酶解液在100 ℃灭酶20 min,离心后沉淀用等量的水洗涤3次,彻底去除淀粉水解产物,烘干,备用。
1.2.2 玉米蛋白酶解工艺
称取一定量的经预处理后的玉米蛋白粉(蛋白质含量73.05%)放入烧杯中,在搅拌条件下缓慢加入去离子水配制成底物浓度为10%(m/v)的均匀悬浮液,在设定的反应温度下,调节溶液pH并加入蛋白酶进行酶解,然后将酶解液放入沸水浴中灭酶10 min。4500 r/min离心15 min后取上清液,冷冻干燥即得AH。
1.2.3 单因素实验设计
试验设定基本酶解条件为:底物浓度10%(m/v),酶解温度60 ℃,酶解时间1.5 h,酶解pH8.0,加酶量1000 U/g。固定各因素基本条件不变,分别改变酶解温度(50、55、60、65、70 ℃)、酶解时间(0.5、1、1.5、2、2.5 h)和加酶量(600、800、1000、1200、1400 U/g)等因素,考察各因素对酶解产物中Gln含量和蛋白水解度(DH)的影响。
1.2.4 响应面试验设计
基于单因素实验结果,选取酶解温度(A)、酶解时间(B)和加酶量(C)3个因素为自变量,以Gln含量为响应值(Y),进行Box-Behnken试验设计,共17个试验点。各因素变化区间由单因素试验确定。试验因素及水平见表1。
表 1 响应面设计因素及水平Table 1. Design factors and levels of response surface水平 A温度(℃) B时间(h) C加酶量(U/g) −1 55 1.5 1000 0 60 2 1200 1 65 2.5 1400 1.2.5 水解度(DH)的测定
采用pH-stat法[20]测定水解度。蛋白质水解过程中,肽键断裂会使反应体系pH降低,通过滴加NaOH溶液来维持反应体系pH稳定,通过记录所消耗的NaOH溶液体积可以计算出DH。DH按照公式(1)进行计算。
DH(%)=VNaOH×NNaOHα×Mp×htot×100 (1) 式中:VNaOH:消耗的碱体积,mL;NNaOH:消耗的碱当量浓度,mol/L;
α :α -氨基酸解离度,α =10pH−pK/(1+10pH−pK),pH为反应起始pH,pK按7.0计;Mp:蛋白总量,g;htot:每克蛋白中肽键的克当量数(玉米蛋白取8.38)。1.2.6 Gln含量的测定
酶解物中Gln含量的测定参考陶冠军等[21]的方法略作修改。准确移取0.5 mL100 mg/mL蛋白水解液于安瓿瓶中,加入2 mL BTI乙腈-水溶液和0.5 mL 50 μmol/mL吡啶溶液,混合均匀后置于50 ℃烘箱中反应2 h。另一份等量水解液不经BTI保护处理。然后移取5 mL 6 mol/L HCl分别加入到蛋白水解液中,真空封管后于110 ℃烘箱中水解24 h后取出,冷却。
然后用谷氨酸生物传感器分析仪分别测定谷氨酸含量,两者的差值即为Gln的含量。
1.2.7 AH基本成分测定
水分含量按照GB 5009.3-2016方法测定;灰分含量按照GB 5009.4-2016方法测定;蛋白质含量按照GB 5009.5-2016方法测定;脂肪含量按照GB 5009.6-2016方法测定;氨基酸含量按照GB 5009.124-2016方法,采用全自动氨基酸分析仪测定。
1.2.8 动物分组及处理
实验动物适应性喂养一周后,随机分为5组,每组10只,分别为空白组、DSS模型组、AH低剂量组、AH中剂量组和AH高剂量组。各剂量组给药剂量参照王延州[13]的方法略作调整,中剂量组给药剂量按照活性肽推荐人体用量(2 g蛋白/70 kg)的10倍换算小鼠的灌胃剂量,高剂量组给药剂量约为人体用量16倍,低剂量组给药剂量约为人体用量的3倍。实验开始后,AH低、中、高剂量组小鼠每日分别按照125、375和625 mg/kg·bw进行灌胃AH,空白组和DSS模型组按相同方法灌胃等量生理盐水,共灌胃14 d。实验前7 d,所有小鼠均自由饮用无菌水,从第8 d开始,除空白组小鼠继续自由饮用无菌水外,其余各组小鼠自由饮用3% DSS水溶液7 d,诱导急性结肠炎。实验过程中每天记录小鼠体重及粪便特征。第14 d末次灌胃后,各组小鼠禁食12 h,颈椎脱位处死小鼠,取结肠于−80 ℃冰箱保存,用于下一步分析检测实验。
1.2.9 疾病活动性指数(Disease activity index,DAI)评分
DAI评分以体重变化、粪便黏度和便血情况的评分表示。具体标准见表2。
表 2 DAI评分标准Table 2. Standard of DAI score评分 体重下降(%) 粪便性状 便血情况 0 0 正常 无 1 1~5 − − 2 6~10 稀软 轻微便血 3 11~15 − − 4 >16 水样便 血便 1.2.10 组织病理学观察
采用苏木精和伊红染色法观察结肠组织病理变化情况。首先将结肠标本放入10%的福尔马林溶液中固定24 h,然后进行石蜡包埋、切片、脱蜡和染色处理,并在光学显微镜下观察结肠组织炎症程度、病变深度、隐窝及上皮损伤情况。
1.2.11 细胞炎症因子测定
称取结肠标本100 mg,冰水浴中制备10%(m/v)的组织匀浆液,3000 r/min离心20 min后取上清液,按照酶联免疫吸附(ELISA)试剂盒说明书操作步骤,分别测定结肠组织中细胞炎症因子的含量。
1.3 数据处理
每个实验重复3次,所有数据均以平均值±标准差表示,用SPSS Statistics 26进行统计分析。采用Duncan检验进行差异显著性分析,P<0.05为差异显著性水平。
2. 结果与分析
2.1 酶法制备AH的影响因素研究
2.1.1 酶解温度对水解物中Gln含量和DH的影响
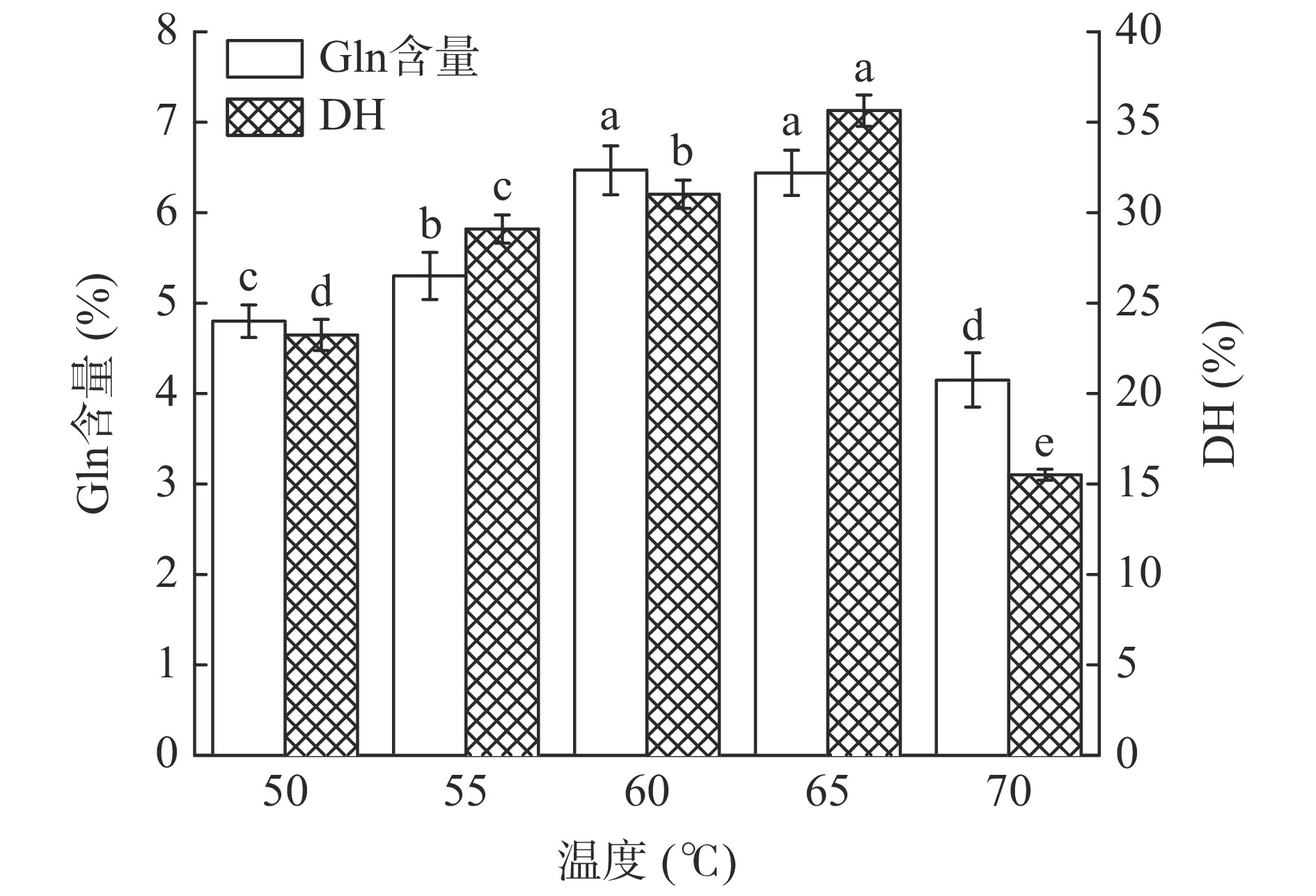
在底物浓度10%,酶解时间1.5 h,酶解pH8.0,加酶量1000 U/g的条件下,研究了酶解温度在50~70 ℃范围内对水解物中Gln含量和DH的影响,结果如图1所示。水解物中Gln含量和DH随着酶解温度的升高而呈现先逐渐增大后降低的趋势,这是因为温度的变化直接影响酶活性的变化,酶在最适温度条件下表现出最大酶活,偏离最适温度条件,酶活性受到抑制,水解效率降低,从而导致产物中Gln含量和DH降低。因此,从节约能源角度考虑,选择55~65 ℃作为响应面试验的因素水平。
2.1.2 酶解时间对水解物中Gln含量和DH的影响
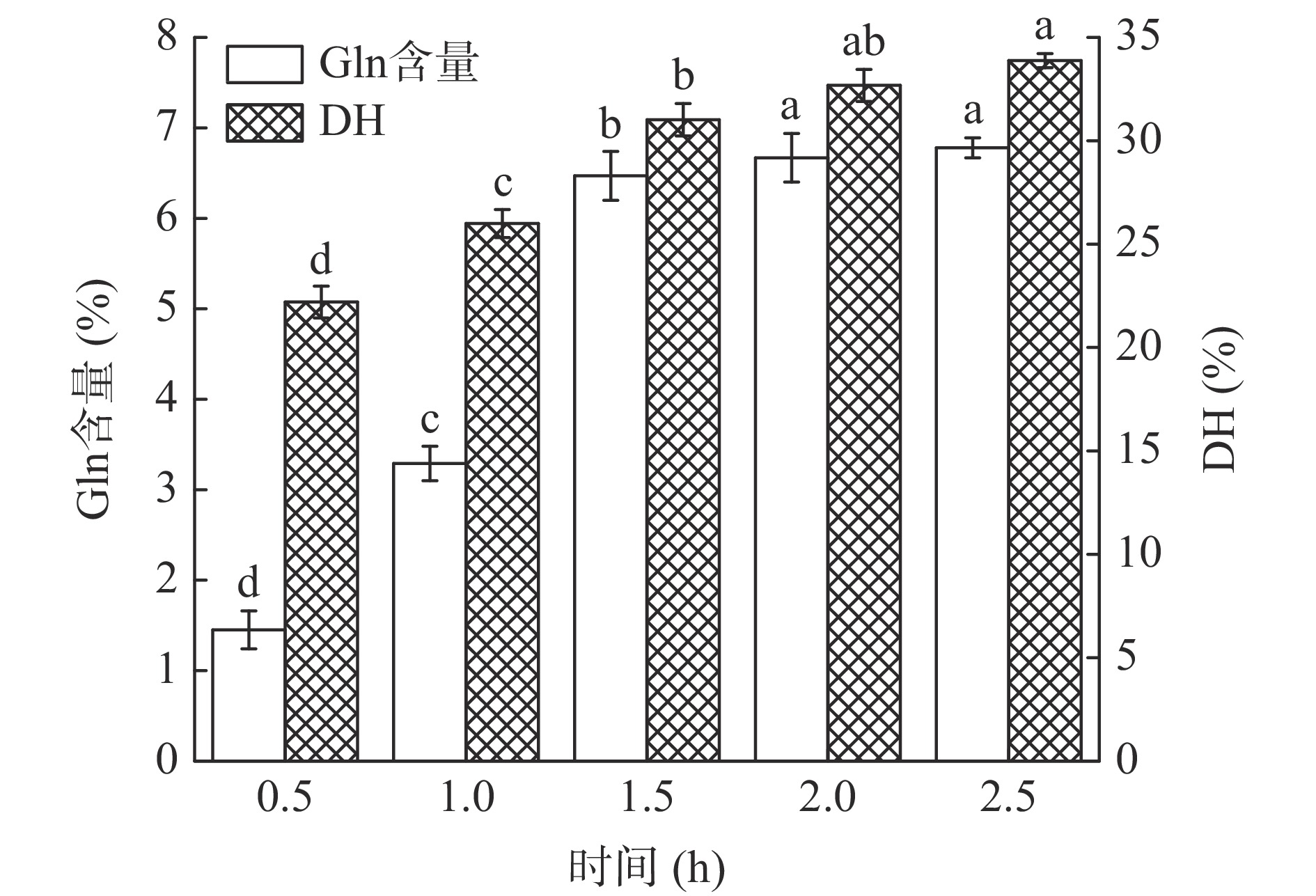
在底物浓度10%,酶解温度60 ℃,酶解pH8.0,加酶量1000 U/g的条件下,研究了酶解时间在0.5~2.5 h范围内对水解物中Gln含量和DH的影响,结果如图2所示。水解物中的Gln含量随着酶解时间的延长而逐渐增加,当酶解时间超过2 h时,Gln含量增加缓慢且差异不显著,而DH则随着酶解时间的延长而呈现先逐渐增大后趋于平缓的趋势。这可能是因为在酶解反应前期,底物中大分子蛋白含量高且蛋白酶活性高,大量底物蛋白质被迅速水解为小分子肽,而随着酶解时间的延长,底物中大分子蛋白质逐渐减少,而产物逐渐增多,蛋白酶的水解作用逐渐趋于平缓,使得DH变化不显著[22]。因此,选择1.5~2.5 h的酶解时间作为响应面试验的因素水平。
2.1.3 加酶量对水解物中Gln含量和DH的影响
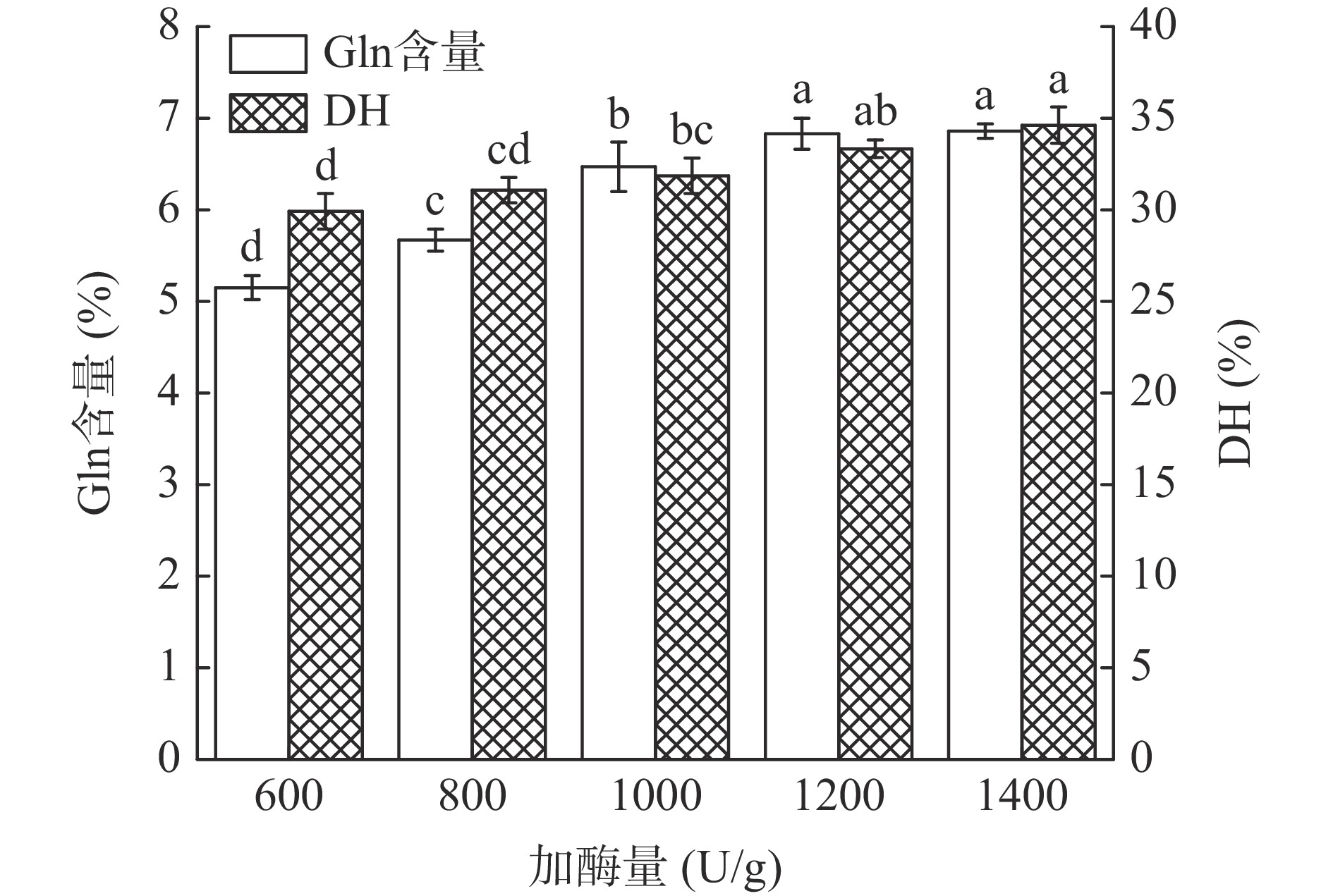
在底物浓度10%,酶解温度60 ℃,酶解时间1.5 h,酶解pH8.0的条件下,研究了加酶量在600~1400 U/g范围内对水解物中Gln含量和DH的影响,结果如图3所示。Gln含量和DH随着加酶量的增大而逐渐增加,而当加酶量超过1200 U/g时,Gln含量和DH增加缓慢且差异不显著。这可能是因为随着加酶量的增大,酶与底物接触面积逐渐增大,底物蛋白被酶解成可溶的小分子多肽,并将Gln释放出来,但当加酶量过多时,酶与底物之间达到过饱和状态,抑制酶的催化作用,从而使Gln含量和水解度增加缓慢。因此,从降低成本角度考虑,选择1000~1400 U/g的加酶量作为响应面试验的因素水平。
2.2 酶法制备AH的响应面优化试验
按照响应面设计方案进行试验,结果如表3所示。对表3中的实验数据进行多元回归拟合,得到了Gln含量(Y)的标准回归方程为:Y=6.91+0.50A+0.77B+0.69C+0.052AB−0.038AC+0.17BC−0.17A2+0.23B2−0.27C2
表 3 响应面试验设计及结果Table 3. Response surface test design and results实验号 A温度 B时间 C加酶量 Gln含量
(%)1 0 −1 −1 5.47 2 −1 0 −1 5.36 3 0 0 0 6.92 4 0 0 0 6.88 5 0 1 −1 6.66 6 1 0 1 7.51 7 1 1 0 8.29 8 0 0 0 7.01 9 −1 1 0 7.18 10 1 0 −1 6.44 11 0 0 0 6.77 12 1 −1 0 6.65 13 −1 −1 0 5.75 14 0 1 1 8.61 15 −1 0 1 6.58 16 0 −1 1 6.73 17 0 0 0 6.97 对表3中的试验结果进行回归统计分析,得到的方差分析结果见表4。由方差分析结果可知,所得回归模型极显著(P<0.01),且失拟检验不显著(P>0.05),说明其他因素对试验结果的干扰很小,模型的决定系数为0.9877,即98.77%的变更能够通过这个模型解释,这说明此回归模型很理想,方程与实际情况相符且对试验拟合良好,故可用此回归模型对试验结果进行分析。由表4可知,一次项A、B、C和二次项C2对Gln含量有极显著的影响(P <0.01),交互项BC和二次项A2、B2均对Gln含量有显著的影响(P<0.05),影响顺序依次为B>C>A,即酶解时间>加酶量>酶解温度。
表 4 响应面回归模型方差分析Table 4. Analysis of variance for response surface regression model变异来源 平方和 自由度 均方 比值F 显著水平P 显著性 模型 11.27 9 1.25 62.60 <0.0001 ** A 2.02 1 2.02 101.00 <0.0001 ** B 4.71 1 4.71 235.62 <0.0001 ** C 3.78 1 3.78 189.06 <0.0001 ** AB 0.01 1 0.01 0.55 0.4820 AC 0.01 1 0.01 0.28 0.6123 BC 0.12 1 0.12 5.95 0.0448 * A2 0.12 1 0.12 6.00 0.0442 * B2 0.22 1 0.22 10.78 0.0134 * C2 0.30 1 0.30 15.21 0.0059 ** 残差 0.14 7 0.02 失拟项 0.11 3 0.04 4.12 0.1023 不显著 纯误差 0.03 4 0.01 总离差 11.41 16 注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。 利用Design-Expert 8.0.6软件工艺优化,得到最佳工艺组合为:酶解温度64.90 ℃,酶解时间2.47 h,加酶量1376.83 U/g,模型预测在此条件下,Gln含量可达到8.73%。为便于实际生产,设定酶解温度64 ℃,酶解时间2.5 h,加酶量1300 U/g,并在此条件下进行3次验证试验,测得Gln含量为8.79%±0.21%,蛋白水解度为33.92%±0.85%,与理论预测值差异不显著,说明优化得到的酶解条件准确可靠,利用响应面分析法优化酶解工艺条件是可行的。
2.3 AH基本组成分析
按照2.2中优化的最佳酶解条件进行制备AH,并测定了AH的基本组成成分,结果如表5所示。AH中的主要成分为蛋白质,含量可达到77.28%,其次是灰分,约占15.13%,而脂肪和水分含量相对较少。灰分含量高主要是因为蛋白酶水解CGM过程中,需要不断向溶液中添加NaOH来保持溶液pH恒定,而加入的NaOH会以钠盐的形式保留在溶液中,进而导致AH中灰分含量较高。后续可通过纳滤的方式除掉溶液中的盐分,提高AH的纯度。
表 5 AH基本组成成分Table 5. Basic components of AH成分 蛋白质 水分 灰分 脂肪 含量(%) 77.28±0.42 4.87±0.06 15.13±0.31 1.26±0.12 2.4 氨基酸组成分析
采用全自动氨基酸分析仪测定AH中氨基酸含量,结果如表6所示。AH中可检测出17种氨基酸,其中Glu含量最高,可达到15.40%。AH中还富含Leu、Pro、Ala等疏水性氨基酸,总疏水性氨基酸含量可达到39.56%,占总氨基酸含量的52.13%。有研究表明,疏水性氨基酸具有较高的抗氧化和抗炎活性,且活性的高低与其在多肽氨基酸序列中的位置有关。此外,AH中EAA/TAA和EAA/NEAA分别达到35.79%和55.74%,基本符合FAO/WHO所推荐的理想蛋白模式,说明AH具有较高的营养价值。
表 6 AH的氨基酸组成Table 6. Amino acid composition of AH名称 含量(g/100 g) 名称 含量(g/100 g) 天冬氨酸(Asp) 4.10±0.02 亮氨酸(Leu)* 12.05±0.12 苏氨酸(Thr)* 2.55±0.04 酪氨酸(Tyr) 3.93±0.07 丝氨酸(Ser) 3.77±0.02 苯丙氨酸(Phe)* 4.37±0.04 谷氨酸(Glu) 15.40±0.09 赖氨酸(Lys)* 0.94±0.01 甘氨酸(Gly) 1.85±0.03 组氨酸(His) 1.25±0.03 丙氨酸(Ala) 6.23±0.07 精氨酸(Arg) 2.04±0.02 半胱氨酸(Cys) 0.50±0.01 脯氨酸(Pro) 9.66±0.08 缬氨酸(Val)* 2.88±0.02 必需氨基酸(EAA) 27.16±0.09 甲硫氨酸(Met)* 1.73±0.03 非必需氨基酸(NEAA) 48.73±0.13 异亮氨酸(Ile)* 2.64±0.06 总氨基酸(TAA) 75.89±0.18 注:*为必需氨基酸。 2.5 AH对结肠炎小鼠体重变化率和DAI评分的影响
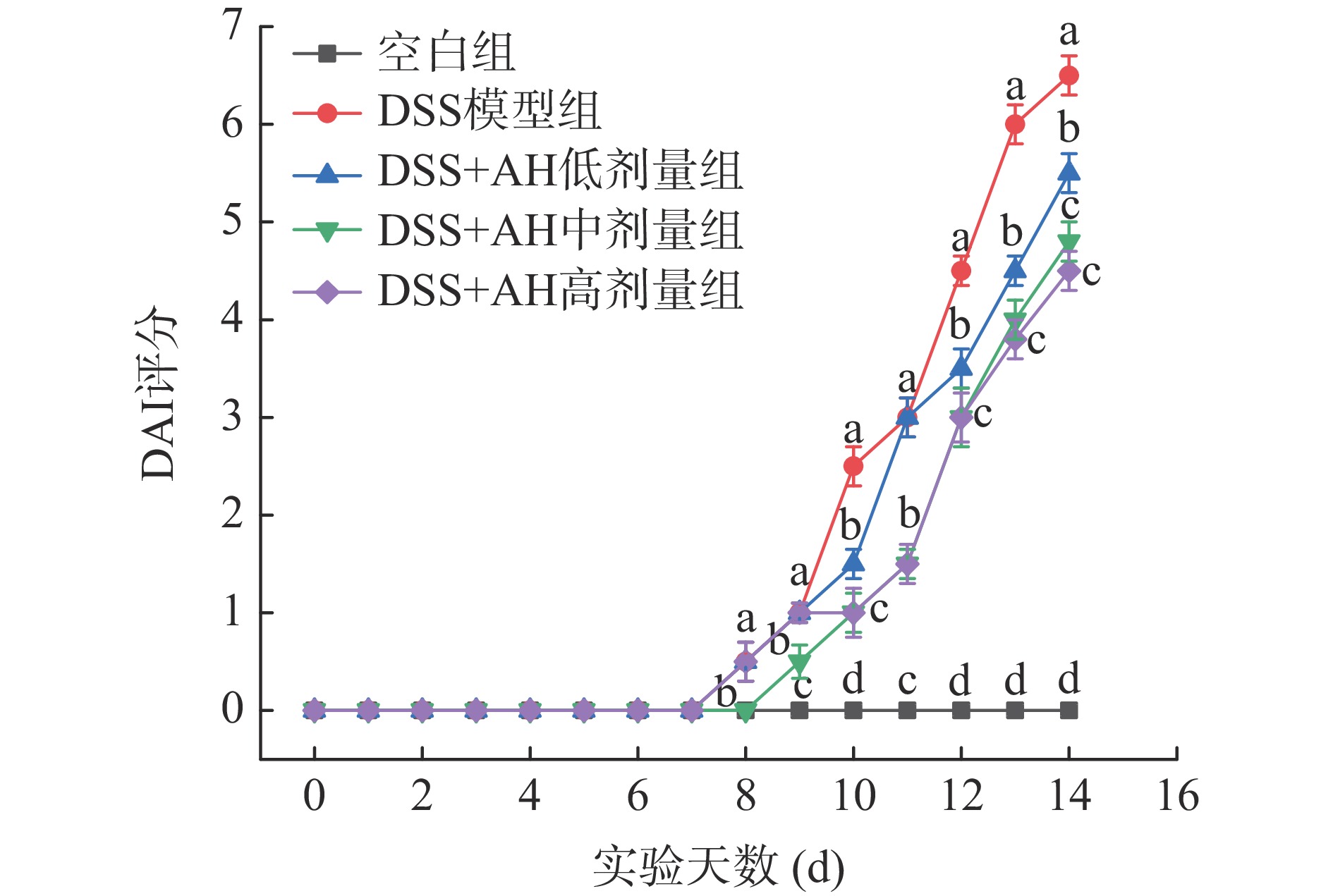
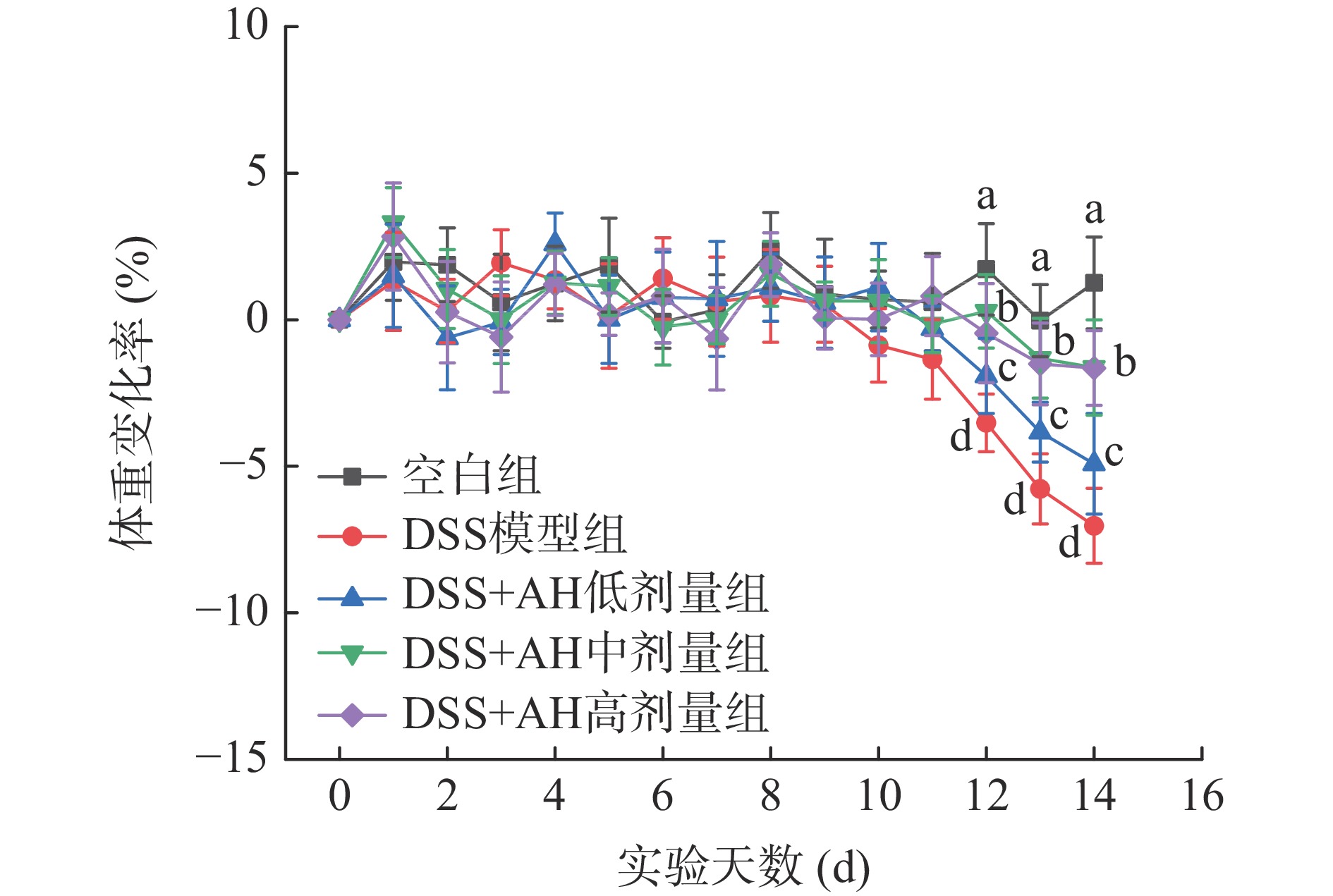
体重变化率和DAI评分是评估小鼠结肠炎严重程度的重要指标[8]。由图4可以看出,DSS造模前所有组别小鼠体重变化率较小,活动状态正常。第8 d开始饮用DSS水溶液后,DSS模型组小鼠体重逐渐降低,活动减少,DAI评分呈现上升趋势;造膜后期小鼠逐渐出现稀便、粘便和血便现象。以上现象表明,小鼠结肠炎模型造模成功。与DSS模型组相比,AH低、中、高剂量组对小鼠体重变化率均有明显提升,腹泻血便程度明显得到改善,特别是AH高剂量组,小鼠体重变化率和DAI评分均与模型组有显著差异。这表明,AH可以缓解结肠炎小鼠体重下降,对腹泻和便血情况具有一定的改善作用。以上研究结果与Zhang等[23]报道的皮蛋蛋白多肽缓解结肠炎小鼠体重减轻和临床症状的结果相似。
2.6 AH对结肠炎小鼠结肠长度的影响
结肠缩短是结肠炎小鼠的典型特征,由图5可以看出,与空白组相比,DSS模型组小鼠的结肠长度发生明显缩短,由10.20±0.26 cm缩短至8.30±0.26 cm。而不同剂量的AH干预处理可以显著(P<0.05)的抑制小鼠结肠缩短,特别是AH中剂量组和高剂量组,与模型组相比,小鼠的结肠长度分别增加了12.05%和8.43%,这可能是因为AH有效的抑制了由DSS刺激而引起的肠道应激反应,进而改善了小鼠结肠缩短的情况。
2.7 AH对结肠炎小鼠组织病理学的影响
为进一步探究AH对结肠炎小鼠结肠组织的影响,采用HE染色法观察分析各组小鼠结肠组织病理的变化情况。由图6可以看出,空白组小鼠结肠黏膜层完整,腺体排列整齐,未见炎症细胞浸润。而DSS模型组小鼠结肠黏膜层受损严重,出现水肿、部分腺体及隐窝缺失、炎症细胞浸润等现象。而不同剂量的AH处理组小鼠结肠黏膜损伤程度及炎症细胞浸润程度均有所减轻,尤其是AH中剂量组和高剂量组小鼠结肠上皮结构更为完整,结肠组织损伤较DSS模型组明显改善。这表明AH能明显减轻DSS诱导结肠炎小鼠结肠组织的损伤,对结肠组织具有一定的保护作用。
研究表明,Gln可为肠道粘膜提供营养和能量,并增强肠上皮细胞屏障功能[24-25],本研究所制得的AH富含Gln,其含量可达到8.79%,因此,推测Gln在AH拮抗结肠炎中发挥着重要的作用,可增加结肠粘膜细胞合成,降低肠道通透性,防止细菌和内毒素侵入肠道,进而减轻结肠组织损伤,起到抗炎作用。Marcela等[26]报道称发芽大豆蛋白水解物中具有抗炎活性的多肽均含有至少1个Gln残基,并且鉴定得到多种富含Gln的抗炎肽。
2.8 AH对结肠炎小鼠炎症因子的影响
炎症细胞因子是体内炎症反应的重要信号分子,其表达水平与结肠炎的严重程度密切相关[23]。由图7可以看出,与空白组相比,DSS模型组小鼠结肠组织中抗炎细胞因子IL-10的水平显著(P<0.05)降低,促炎细胞因子IL-6、IL-1β和TNF-α的水平显著(P<0.05)升高。而与模型组相比,AH低、中、高剂量组小鼠结肠组织中抗炎细胞因子IL-10水平分别升高了48.23%、73.45%和80.53%;促炎细胞因子IL-6水平分别降低了25.66%、34.51%和40.71%;IL-1β水平分别降低了15.50%、28.68%和32.56%;TNF-α水平分别降低了34.97%、36.55%和35.28%。这表明AH对小鼠结肠组织中的炎症因子具有一定的调节作用。
正常情况下,机体中促炎因子和抗炎因子处于平衡状态,当机体受到外界刺激时,这种平衡状态被打破,促炎因子的过量产生及抗炎因子的降低会加剧炎症级联,引起肠道损伤,形成恶性循环。因此,调节机体炎症因子水平是缓解结肠炎的有效途径。Gln是免疫系统的重要燃料,可增强免疫系统的功能,在免疫调节中发挥关键作用[27]。同时Gln也是谷胱甘肽合成的前体物质,能够帮助人体维持正常的免疫系统,并提高机体抗氧化能力。此外,在本课题组之前的研究中也发现玉米蛋白水解物具有较强的抗氧化活性,可以有效的缓解因氧化应激引起的机体组织损伤[28-29]。本研究中,DSS促使小鼠结肠粘膜受损,中性粒细胞浸润加剧,引起结肠炎症反应。不同剂量的AH处理显著(P<0.05)降低了促炎细胞因子水平,升高了抗炎细胞因子水平,有效的抑制了炎症反应。这表明富含Gln的玉米蛋白水解物对DSS诱导的结肠炎的缓解作用可能是通过调节炎症因子水平来实现的。方颂平等[30]研究发现小麦谷氨酰胺肽可以通过减少促炎因子的分泌来缓解小鼠肠道炎症。Sun等[31]报道称从松子蛋白中得到的谷氨酰胺四肽(Gln-Trp-Phe-Met)具有较强的免疫活性。以上研究表明富含Gln的多肽在调节炎症方面发挥了重要的作用。
3. 结论
本研究以玉米蛋白粉为原料,采用Alcalase对其进行酶解,通过单因素实验和响应面优化试验,构建了制备富含谷氨酰胺玉米蛋白水解物的最适水解体系。Alcalase酶解玉米蛋白粉制备AH的最佳酶解条件为:酶解温度64 ℃,酶解时间2.5 h,加酶量1300 U/g,在此条件下,AH中Gln含量可达到8.79%。在此基础上进一步评价了AH对小鼠结肠炎的缓解作用,结果表明AH能够显著(P<0.05)改善结肠炎小鼠体重下降,缓解结肠缩短,降低疾病活动指数,减轻结肠组织中炎症细胞的浸润,调节炎症细胞因子水平,AH对小鼠结肠炎具有良好的缓解作用。可进一步探索AH拮抗结肠炎的作用机制,为开发玉米蛋白源肠道保护功能食品及食品基料奠定理论基础。
-
表 1 响应面设计因素及水平
Table 1 Design factors and levels of response surface
水平 A温度(℃) B时间(h) C加酶量(U/g) −1 55 1.5 1000 0 60 2 1200 1 65 2.5 1400 表 2 DAI评分标准
Table 2 Standard of DAI score
评分 体重下降(%) 粪便性状 便血情况 0 0 正常 无 1 1~5 − − 2 6~10 稀软 轻微便血 3 11~15 − − 4 >16 水样便 血便 表 3 响应面试验设计及结果
Table 3 Response surface test design and results
实验号 A温度 B时间 C加酶量 Gln含量
(%)1 0 −1 −1 5.47 2 −1 0 −1 5.36 3 0 0 0 6.92 4 0 0 0 6.88 5 0 1 −1 6.66 6 1 0 1 7.51 7 1 1 0 8.29 8 0 0 0 7.01 9 −1 1 0 7.18 10 1 0 −1 6.44 11 0 0 0 6.77 12 1 −1 0 6.65 13 −1 −1 0 5.75 14 0 1 1 8.61 15 −1 0 1 6.58 16 0 −1 1 6.73 17 0 0 0 6.97 表 4 响应面回归模型方差分析
Table 4 Analysis of variance for response surface regression model
变异来源 平方和 自由度 均方 比值F 显著水平P 显著性 模型 11.27 9 1.25 62.60 <0.0001 ** A 2.02 1 2.02 101.00 <0.0001 ** B 4.71 1 4.71 235.62 <0.0001 ** C 3.78 1 3.78 189.06 <0.0001 ** AB 0.01 1 0.01 0.55 0.4820 AC 0.01 1 0.01 0.28 0.6123 BC 0.12 1 0.12 5.95 0.0448 * A2 0.12 1 0.12 6.00 0.0442 * B2 0.22 1 0.22 10.78 0.0134 * C2 0.30 1 0.30 15.21 0.0059 ** 残差 0.14 7 0.02 失拟项 0.11 3 0.04 4.12 0.1023 不显著 纯误差 0.03 4 0.01 总离差 11.41 16 注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。 表 5 AH基本组成成分
Table 5 Basic components of AH
成分 蛋白质 水分 灰分 脂肪 含量(%) 77.28±0.42 4.87±0.06 15.13±0.31 1.26±0.12 表 6 AH的氨基酸组成
Table 6 Amino acid composition of AH
名称 含量(g/100 g) 名称 含量(g/100 g) 天冬氨酸(Asp) 4.10±0.02 亮氨酸(Leu)* 12.05±0.12 苏氨酸(Thr)* 2.55±0.04 酪氨酸(Tyr) 3.93±0.07 丝氨酸(Ser) 3.77±0.02 苯丙氨酸(Phe)* 4.37±0.04 谷氨酸(Glu) 15.40±0.09 赖氨酸(Lys)* 0.94±0.01 甘氨酸(Gly) 1.85±0.03 组氨酸(His) 1.25±0.03 丙氨酸(Ala) 6.23±0.07 精氨酸(Arg) 2.04±0.02 半胱氨酸(Cys) 0.50±0.01 脯氨酸(Pro) 9.66±0.08 缬氨酸(Val)* 2.88±0.02 必需氨基酸(EAA) 27.16±0.09 甲硫氨酸(Met)* 1.73±0.03 非必需氨基酸(NEAA) 48.73±0.13 异亮氨酸(Ile)* 2.64±0.06 总氨基酸(TAA) 75.89±0.18 注:*为必需氨基酸。 -
[1] MAK W Y, ZHAO M, NG S C, et al. The epidemiology of inflammatory bowel disease: East meets west[J]. Journal of Gastroenterology & Hepatology,2020,35(3):380−389.
[2] YIN S J, YANG H F, TAO Y, et al. Artesunate ameliorates DSS-induced ulcerative colitis by protecting intestinal barrier and inhibiting inflammatory response[J]. Inflammation,2020,43(2):765−776. doi: 10.1007/s10753-019-01164-1
[3] 陈爽. 壳寡糖对DSS诱导小鼠结肠炎的缓解作用研究[D]. 无锡: 江南大学, 2020 CHEN S. Ameliorating effects of chitooligosaccharides on DSS-induced colitis in mice[D]. Wuxi: Jiangnan University, 2020.
[4] KAPLAN G G. The global burden of IBD: From 2015 to 2025(Review)[J]. Nature Reviews Gastroenterology and Hepatology,2015,12(12):720−727. doi: 10.1038/nrgastro.2015.150
[5] BHAT Z F, KUMAR S, BHAT H F. Bioactive peptides of animal origin: A review[J]. Journal of Food Science and Technology,2015,52(9):5377−5392. doi: 10.1007/s13197-015-1731-5
[6] YU H B, GAO Q F, DONG S L, et al. Regulation of dietary glutamine on the growth, intestinal function, immunity and antioxidant capa city of sea cucumber Apostichopus japonicus (Selenka)[J]. Fish & Shellfish Immunology,2016,50:56−65.
[7] BAMIAS G. At the junction of immunity and barrier function: The immunomodulatory protein TL1A may also regulate intestinal permeability[J]. Digestive Diseases and Sciences,2019,64(7):1728−1730. doi: 10.1007/s10620-019-05671-x
[8] WOO J K. Fermented barley and soybean (BS) mixture enhances intestinal barrier function in dextran sulfate sodium (DSS)-induced colitis mouse model[J]. BMC Complementary and Alternative Medicine,2016,16(1):498. doi: 10.1186/s12906-016-1479-0
[9] TANG S Y, ZHANG S W, ZHANG J, et al. Effect of early fluid resuscitation combined with low dose cyclophosphamide on intestinal barrier function in severe sepsis rats[J]. Drug Delivery and Translational Research,2018,8(5):1254−1264. doi: 10.1007/s13346-018-0573-x
[10] 陈思思. 谷氨酰胺肽的制备及其性质的研究[D]. 无锡: 江南大学, 2014 CHEN S S. Study on the preparation and properties of glutamine peptides[D]. Wuxi: Jiangnan University, 2014.
[11] FREITAS A, SILVA M, SILVA C, et al. Alanyl-glutamine protects the intestinal barrier function in trained rats against the impact of acute exhaustive exercise[J]. Brazilian Journal of Medical and Biological Research,2020,53(5):9211. doi: 10.1590/1414-431x20209211
[12] 张海华. 小麦面筋蛋白源谷氨酰胺肽的酶解制备、结构分析与生理活性研究[D]. 无锡: 江南大学, 2011 ZHANG H H. Preparation, purification and physiological activities of glutamine peptides from wheat gluten hydrolysis[D]. Wuxi: Jiangnan University, 2011.
[13] 王延州. 小麦蛋白谷氨酰胺肽制备及对肠粘膜损伤修复效果的研究[D]. 北京: 中国农业科学院, 2014 WANG Y Z. Preparation of glutamine peptide from wheat gluten and it prevents intestinal mucosal injury[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014.
[14] LIANG Q F, REN X F, CHALAMAIAH M, et al. Simulated gastrointestinal digests of corn protein hydrolysate alleviate inflammation in caco-2 cells and a mouse model of colitis[J]. Journal of Food Science and Technology,2020,57(6):2079−2088. doi: 10.1007/s13197-020-04242-7
[15] HAYTA M, BENLI B, KAYA A. Optimization of antihypertensive and antioxidant hydrolysate extraction from rice bran proteins using ultrasound assisted enzymatic hydrolysis[J]. Journal of Food Measurement and Characterization,2020,14(5):2578−2589. doi: 10.1007/s11694-020-00504-2
[16] WANG Z Q, CUI Y Y, LIU P Y, et al. Small Peptides Isolated from Enzymatic Hydrolyzate of Fermented Soybean Meal Promote Endothelium-Independent Vasorelaxation and ACE Inhibition[J]. Journal of Agricultural and Food Chemistry,2017,65(50):10844−10850. doi: 10.1021/acs.jafc.7b05026
[17] GUO D J, ZHANG Y, ZHAO J J, et al. Selenium-biofortified corn peptides: attenuating concanavalin A-induced liver injury and structure characterization[J]. Journal of Trace Elements in Medicine and Biology,2018,51:57−64.
[18] 王晓杰, 丛万锁, 刘晓兰, 等. 玉米ACE抑制肽的制备工艺及中试生产[J]. 食品与发酵工业,2016,42(7):158−164. [WANG X J, CONG W S, LIU X L, et al. Preparation of ACE-inhibitiory peptide from corn gluten meal and pilot-scale production[J]. Food and Fermentation Industries,2016,42(7):158−164. [19] 郑喜群. 玉米黄粉的酶解工艺与抗氧化活性肽的制备[D]. 北京: 中国农业大学, 2006: 20 ZHENG X Q. Enzymatic hydrolysis of com gluten meal and preparation of antioxidant active peptide[D]. Beijing: China Agricultural University, 2006: 20.
[20] JENS A N. Enzymic hydrolysis of food proteins[M]. London: Elsevier Applied Science, 1986: 122−144.
[21] 陶冠军, 任国谱, 谷文英. 蛋白质和肽中谷氨酰胺的HPLC定量分析[J]. 郑州粮食学院学报,1999(4):65−67. [TAO G J, REN G P, GU W Y. Quantitative analysis of glutamine in proteins and peptides by HPLC method[J]. Journal of Zhengzhou Grain College,1999(4):65−67. [22] 赵谋明, 马梅, 苏国万, 等. 具有醒酒活性的玉米肽的制备、富集和鉴定[J]. 中国食品学报,2020,20(9):86−94. [ZHAO M M, MA M, SU G W, et al. Preparation, enrichment and identification of corn peptides with facilitating alcohol metabolism activity[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(9):86−94. doi: 10.16429/j.1009-7848.2020.09.011 [23] ZHANG M Y, ZHAO Y, WU N, et al. Anti-inflammatory activity of peptides from simulated gastrointestinal digestion of preserved egg white in DSS-induced mouse colitis[J]. Food & Function,2018,9(12):6444−6454.
[24] LU Y J, WANG J, SOLADOYE O P, et al. Preparation, receptors, bioactivity and bioavailability of γ-glutamyl peptides: A comprehensive review[J]. Trends in Food Science & Technology,2021,113:301−314.
[25] WANG B, WU G, ZHOU Z, et al. Glutamine and intestinal barrier function[J]. Amino Acids,2014,47(10):2143−2154.
[26] MARCELA G M, BLANCA H L, JOSE M S, et al. Peptides derived from in vitro gastrointestinal digestion of germinated soybean proteins inhibit human colon cancer cells proliferation and inflammation[J]. Food Chemistry,2018,242:75−82. doi: 10.1016/j.foodchem.2017.09.035
[27] CRUZAT V, TIRAPEGUI J. Effects of oral supplementation with glutamine and alanyl-glutamine on glutamine, glutamate, and glutathione status in trained rats and subjected to long-duration exercise[J]. Nutrition,2009,25:428−435. doi: 10.1016/j.nut.2008.09.014
[28] LIU X L, ZHENG X Q, SONG Z L, et al. Preparation of enzymatic pretreated corn gluten meal hydrolysate and in vivo evaluation of its antioxidant activity[J]. Journal of Functional Foods,2015,18:1147−1157. doi: 10.1016/j.jff.2014.10.013
[29] ZHENG X Q, WANG J, LIU X L, et al. Effect of hydrolysis time on the physicochemical and functional properties of corn glutelin by protamex hydrolysis[J]. Food Chemistry,2015,172:407−415. doi: 10.1016/j.foodchem.2014.09.080
[30] 方颂平, 严斌, 朱本国, 等. 小麦面筋蛋白酶解物对小鼠溃疡性结肠炎的影响[J]. 食品与机械,2016,32(2):124−127. [FANG S P, YAN B, ZHU B G, et al. Effect of wheat gluten hydrolysate on ulcerative colitis of mice[J]. Food & Machinery,2016,32(2):124−127. doi: 10.13652/j.issn.1003-5788.2016.02.032 [31] SUN L Z, ZHANG S Y, YUAN L Y, et al. Glutamine and methionine targeted pulsed electric field treatment for enhanced immune activity in pine nut Gln-Trp-Phe-Met peptides[J]. International Journal of Food Science & Technology,2020,55(8):2954−2961.





 下载:
下载:







 下载:
下载:



