Preparation, Characterization and Properties of Patchouli Essential Oil Nanoemulsion
-
摘要: 为改善广藿香精油的稳定性及抑菌性,采用高能乳化法,利用吐温80、焦磷酸硫胺素和壳聚糖共同乳化广藿香来制备纳米乳液,并且分析广藿香精油纳米乳液的结构、粒径、ζ电位、多分散项系数。结果表明,刚制备的广藿香精油纳米乳液粒径约为89.5 nm;包封率为95.85%,在室温条件下放置7 d,广藿香精油保留率保持在85%以上;荧光显微镜和扫描电子显微镜图像证实了所制备的乳液的液滴为均匀的球形,且乳液中油滴分布相对均匀;傅里叶变换红外光谱和X射线衍射实验表明广藿香精油被包裹在纳米乳液中;抗氧化实验表明广藿香精油纳米乳液具有良好的氧化稳定性;抑菌实验表明广藿香精油纳米乳液在7 d内对金黄色葡萄球菌和大肠杆菌有较好的抑制作用。研究发现,相对比于纯精油,广藿香精油纳米乳液表现出更好的稳定性和抑菌性,因此在食品保鲜领域具有十分广阔的发展前景。Abstract: In order to improve the stability and bacteriostasis of patchouli essential oil, high-energy emulsification method was used to prepare patchouli essential oil nanoemulsion by using a mixture of tween 80, thiamine pyrophosphate and chitosan, its structure, particle size, ζ potential and polymer dispersity index were analysed. The results showed that the particle size of the newly prepared patchouli essential oil nanoemulsion was about 89.5 nm. The encapsulation rate of patchouli essential oil was 95.85%, and the retention rate remained above 85% for up to 7 days at room temperature. Furthermore, fluorescence microscopy and scanning electron microscopy demonstrated that the droplets of the emulsion were spherical and the dispersion of oil droplets was relatively uniform. It was also showed that the patchouli essential oil was encapsulated in nanoemulsion based on the Fourier transform infrared spectroscopy and X-ray diffraction experiments. The results of the antioxidation and antibacterial experiments showed that the patchouli essential oil nanoemulsion exhibited a better oxidation stability, it had a good inhibitory effect on Staphylococcus aureus and Escherichia coli within a period of 7 days. Altogether, patchouli essential oil nanoemulsion showed a better stability and bacteriostatic activity compared to pure essential oil, and had a broad application prospect in the fields of food preservation.
-
Keywords:
- patchouli essential oil /
- nanoemulsion /
- stability /
- bacteriostasis
-
广藿香精油(Patchouli essential oil,PEO)是从唇形科刺蕊草属植物广藿香植株中提取的一种植物精油,是一种具有壤香、木香和草药香的天然植物精油,主要的功能性成分是百里香酚、4-异丙基甲苯、γ-松油烯和香芹酚等物质[1]。此外,还含有多种萜类、酚类、酯类和醇类化合物等成分,具有抗癌、抗炎、抗氧化和抗菌活性[2]。然而,由于PEO的味道有强烈刺激性、较强的挥发性和疏水性,还有对氧气和光的敏感性等各种缺点[3],这些缺点严重限制了PEO在食品领域的广泛应用。
利用近些年来兴起的纳米乳液(Nanoemulsion,NE)技术来包埋精油,解决精油水溶性及稳定性差等缺点,精油NE在食品的抗菌保鲜领域已经越来越多的应用[4],逐渐成为食品保鲜领域的热点技术。NE是一种由油相、水相、表面活性剂等按照一定的比例制备而成的粒径范围为50~500 nm的胶体分散系统[5]。大小均匀,透明或半透明[6],具有高速离心稳定的性质,是动力学稳定体系之一[7]。与纯精油相比较而言,精油NE的质地比较均匀、颗粒比较细腻、刺激性味道明显减弱,使用起来舒适感很强,在很长时间内都具有稳定性[8]。
国内外对NE的制备主要采用高能乳化法和低能乳化法两种[9]。低能乳化法是NE利用体系的内部化学能制备的,是由相变引起的。它包括相变温度、自发乳化和相反转合成过程[10]。这些过程主要依赖于油、表面活性剂和其他组分界面性质的变化,以此得到合适的配方[11]。如将肉桂[12]、迷迭香[13]和百里香酚[14]等天然植物精油制备成NE,再应用于新鲜蔬菜的保鲜。NE粒径受油相[15]和表面活性剂的亲水亲油平衡值[16](Hydrohile-ipohilie balance,HLB)的影响。陈良红[17]将木果油,吐温80分别加热至70 ℃,在普通搅拌条件下将水相加入油相制备粗乳液,在500 r/min转速下冷却至40 ℃,均质后冷却至室温,该法制备的体系稳定性很好。但是低能乳化法要考虑实验对象本身的理化性质,有一定的局限性。高能乳化法是通过机械装置利用高动能来制备NE。Kotta等[18]是用高速搅拌机将油相、表面活性剂和水相混匀,然后在10000 psi的压力下用高压均质机均质处理,使用UP200ST超声波细胞破碎仪在100 W功率下对粗乳液进行5 min的超声处理,得到的NE稳定性良好,在室温下贮藏较长时间都无分层现象。Adhavan等[19]研究广藿香精油纳米乳液(Patchouli essential oil nanoemulsion,PEO NE)对福氏志贺菌、金黄色葡萄球菌、变形链球菌和白色念珠菌的抗菌和生物膜根除活性,发现PEO NE有较强的抗念珠菌活性。Park等[20]研究广藿香精油对长角血蜱若虫的驱避活性,发现PEO NE提高了PEO的驱避害虫能力,是一种潜在的长角海蛾驱避剂。Une等[21]研究了PEO在三种不同温度下的保质期,探究了PEO应用在香水市场的可能性。Manjeshk等[22]研究了PEO NE对二斑叶螨成虫和斜纹夜蛾幼虫的杀虫效果,发现斜纹夜蛾幼虫表现出相当大的拒食和觅食威慑作用。
鉴于目前对PEO及PEO NE的研究较少,本文采用高能乳化法制备广藿香精油纳米乳液PEO NE,通过荧光显微镜和扫描电子显微镜这两种仪器对PEO NE的微观结构进行了研究,进一步分析比较了PEO NE冻干样品的傅里叶红外光谱和X衍射光谱。此外,还研究了PEO NE的抗氧化活性和抑菌性能。该研究对基于小分子乳化剂的NE的开发具有重要的指导意义,NE作为一种极具前景的抗菌剂,可以提高营养物质的贮藏期和生物利用度,改善生物活性化合物的递送,可进一步开发在食品保鲜等方面中的应用。
1. 材料与方法
1.1 材料与仪器
PEO(主要成分为藿香醇、广藿香烯,丁香酚、杜松烯) 江西华隆植物香料有限公司;壳聚糖(Chitosan,CTS,低分子量,脱乙酰度>90%)、焦磷酸硫胺素(Thiamine pyrophosphate,TPP)、二氯甲烷(Dichloromethane,DCM)、乙酸、二甲基亚砜(Dimethyl sulfoxide,DMSO)、吐温80、甲醇、ABTS和DPPH 上海麦克林生化科技有限公司;醋酸、氯化钠、乙醇、盐酸和氢氧化钠 中国上海国药集团化学试剂有限公司;实验中所有的水溶液 均用蒸馏水配制;2株细菌:金黄色葡萄球菌(Staphylococcus aureus ATCC 6538)和大肠杆菌(Escherichia coli ATCC 8739) 均来自南京师范大学食品与制药工程学院;其他化学品 均为分析级。
CR21N型高速离心机 Hinac;Secura分析天平 赛多利斯科学仪器(北京)有限公司;SM-3000C型超声波细胞破碎仪 南京舜玛仪器设备有限公司;752N/721/722N型紫外可见分光光度计 济南欧莱博科学仪器有限公司;奥龙Aolong X射线衍射仪(X-RAY XRD) 丹东奥龙射线仪器集团有限公司;DF-101S型恒温水浴锅 湖南力辰仪器科技有限公司;高速剪切机 上海思峻机械设备有限公司;马尔文激光纳米粒度仪 Malvern Panalytical;CKX53型奥林巴斯倒置荧光生物显微镜 上海巴玖实业有限公司;FEI Apreo美国赛默飞扫描电镜 北京亿诚恒达科技有限公司;ALPHA II型布鲁克傅立叶红外光谱仪 布鲁克(北京)科技有限公司。
1.2 实验方法
1.2.1 广藿香精油纳米乳液的制备过程
为了配制乳状液,根据陈莹莹等[23]的制备方法并进行改善。分别制备了油相和水相。在PEO中加入二氯甲烷(1:3,v/v),搅拌至溶液溶解,即油相。将1 g CTS粉末分散到100 mL 1% w/v醋酸溶液中,在室温条件下以1000 r/min转速搅拌16~24 h左右。为了清除未溶解掉的CTS和其他的杂质,将得到的CTS溶液进行4000 r/min离心10 min处理,取上清液用于后续实验。在乳化过程中,用蒸馏水将CTS溶液稀释至所需浓度,并调节pH至6.5,即水相。
采用高能乳化法制备PEO NE(图1)。将油相、乳化剂吐温80和交联剂(TPP)缓慢加入CTS溶液中,用高速剪切机在冰浴中以10000 r/min的速度操作3 min,再磁力搅拌15 min制备得到粗乳液。在剪切过程中,使用冰浴以避免加热效应。最后,通过超声波细胞破碎仪的作用,100 W,15 min,制备得到PEO NE,室温贮存。
1.2.2 广藿香精油纳米乳液的表征
1.2.2.1 粒径、多分散性指数(Polydispersity index,PDI)、ζ电位
将新鲜制备的PEO NE送到科学指南针公司进行测定;将广藿香精油纳米乳液在室温条件下贮藏30 d后再次送到科学指南针公司进行测定。用马尔文激光粒度仪测定PEO NE的粒径、ζ电位和PDI。样品在检测前稀释10倍左右,马尔文激光粒度仪测量范围0.02~2000 μm,扫描速度:1000次/s[24]。
1.2.2.2 包封率
采用超滤离心法[25]测定PEO NE的包封率,连续测定35 d。首先用移液枪吸取400 μL样品放到超滤离心管中,将离心管置于离心机中,10000 r/min转速下离心10 min,用移液枪吸取滤液,用无水乙醇定容至10 mL,通过紫外分光光度计来测定NE的吸光度,根据标准曲线和稀释倍数关系计算出游离活性物的含量(Wf)。然后根据公式(1)计算PEO NE的包封率:
EE(%)=Wt−WfWt×100 (1) 式中:EE为包封率,Wt为总活性物含量(mg),Wf为游离活性物的含量(mg)。
1.2.2.3 荧光显微镜
采用荧光显微镜测定乳液的微观结构,分别测定新鲜制备的PEO NE和室温贮藏30 d的PEO NE。在10×目镜和60×油镜下进行观测。用1 mg/mL尼罗红溶液对精油染色,样品染色30 min后进行观测。尼罗红溶液的激发波长是561 nm,发射波长是605 nm[26]。
1.2.2.4 扫描电子显微镜
为了用扫描电镜分析评价PEO NE的形貌,把新鲜制备的样品在−40 ℃、真空0.007大气压下冷冻干燥48 h。在5.0 kV的加速电压下,用扫描电子显微镜(SEM)对其形貌和大小进行成像。粉状样品在检查前涂上一层金[27]。
1.2.2.5 傅里叶变换红外光谱
用傅立叶变换红外光谱仪检测新鲜制备的PEO NE的结构变化。样品用溴化钾(1:100~1:200)在研钵中研磨成粉末。傅立叶变换红外光谱(FT-IR)的扫描范围为4000~500 cm−1[28]。
1.2.2.6 X射线衍射
用X射线衍射仪(Cu-Ka辐射,波长0.154 nm)获得CTS和新鲜制备的PEO NE的X射线衍射图。所有扫描均在2θ=5°~40°范围内进行,扫描速度为2°/min[29]。
1.2.2.7 抗氧化活性
采用DPPH(2,2-二苯基-1-苦基肼)法和ABTS法测定PEO NE的抗氧化活性。根据邹小波等[30]的方法测定DPPH自由基清除率。首先吸取0.2 mL PEO NE与3 mL的DPPH混合均匀,并于避光条件下放置30 min。将3 mL的DPPH甲醇溶液(150 μmol/L)与0.2 mL甲醇溶液混合用作参照,测定517 nm处的吸光度值,并按照以下公式计算DPPH自由基清除率。
DPPH自由基清除率(%)=Af−AcAf×100 (2) 式中:Af为所测样品的吸光度;Ac为所测参照的吸光度。
根据史亚濛[31]的实验方法来测定ABTS+自由基清除率。将7 mmol/L的ABTS+溶液和2.45 mmol/L K2S2O8溶液混合,常温避光12 h后得到ABTS+母液,并用超纯水稀释至其在734 nm处吸光度值为0.700±0.020,获得ABTS+工作液。0.5 mL PEO NE(实验组)或超纯水(空白对照组)与6.0 mL ABTS+稀释液混合,30 ℃反应15 min后在734 nm处测定吸光度值。ABTS+自由基清除率的计算公式如下:
ABTS+自由基清除率(%)=A0−AXA0×100 (3) 式中:A0表示空白对照组吸光度值,Ax表示实验组样品吸光度值。
1.2.2.8 抗菌活性
用抑菌圈直径(Mm)测定PEO NE的抗菌活性,连续测定7 d。用剪刀将滤纸裁剪成直径为6 mm的圆形滤纸片,然后将滤纸片分别浸染于PEO NE中。待滤纸片完全浸染后将滤纸片置于已经涂布好菌株的培养皿中,设置三个平行。操作完成后,将培养皿置于37 ℃培养箱中进行培养,记录培养时间。然后在不同时间测量其抑菌圈大小,根据直径大小判定其抑菌性能[32]。
1.3 数据处理
数据是三次实验的平均值±标准偏差,数据处理软件是Excel,图形绘制软件是Origin。使用IBM SPSS Statistics 27进行显著性差异分析。统计学差异采用单因素方差分析(ANOVA)和邓肯检验,差异有统计学意义(P<0.05)。
2. 结果与分析
2.1 PEO NE的特性——粒径、PDI和ζ电位
PEO NE制备完成后,首先测定了新鲜制备的PEO NE的粒径、ζ电位以及PDI。其次测定了置于室温下贮藏30 d的PEO NE的粒径、ζ电位以及PDI。如表1所示,刚制备完成的PEO NE的粒径是89.5 nm;室温下贮藏30 d的PEO NE的平均粒径达到了 160.8 nm。刚制备完成的 PEO NE 的 ζ 电位是 20.8 mV;室温下贮藏 30 d 的 PEO NE 的 ζ 电位达到了 9.67 mV。样品的 PDI 值在 0.253 到 0.363之间,这表明了PEO NE是均匀分布的、单分散的、稳定的颗粒群。
表 1 PEO NE的粒径、PDI和ζ电位Table 1. Particle size, PDI and ζ potential of PEO NE贮藏时间(d) 粒径(nm) Zeta电位(mV) PDI 0 89.5±5.4b +20.8±1.8a 0.253±0.009b 30 160.8±8.6a +9.67±0.7b 0.363±0.005a 注:实验数据以平均值±标准偏差的形式表示,同列不同字母表示具有显著性差异(P<0.05),相同字母表示不具有显著性差异(P>0.05)。 2.2 包封率
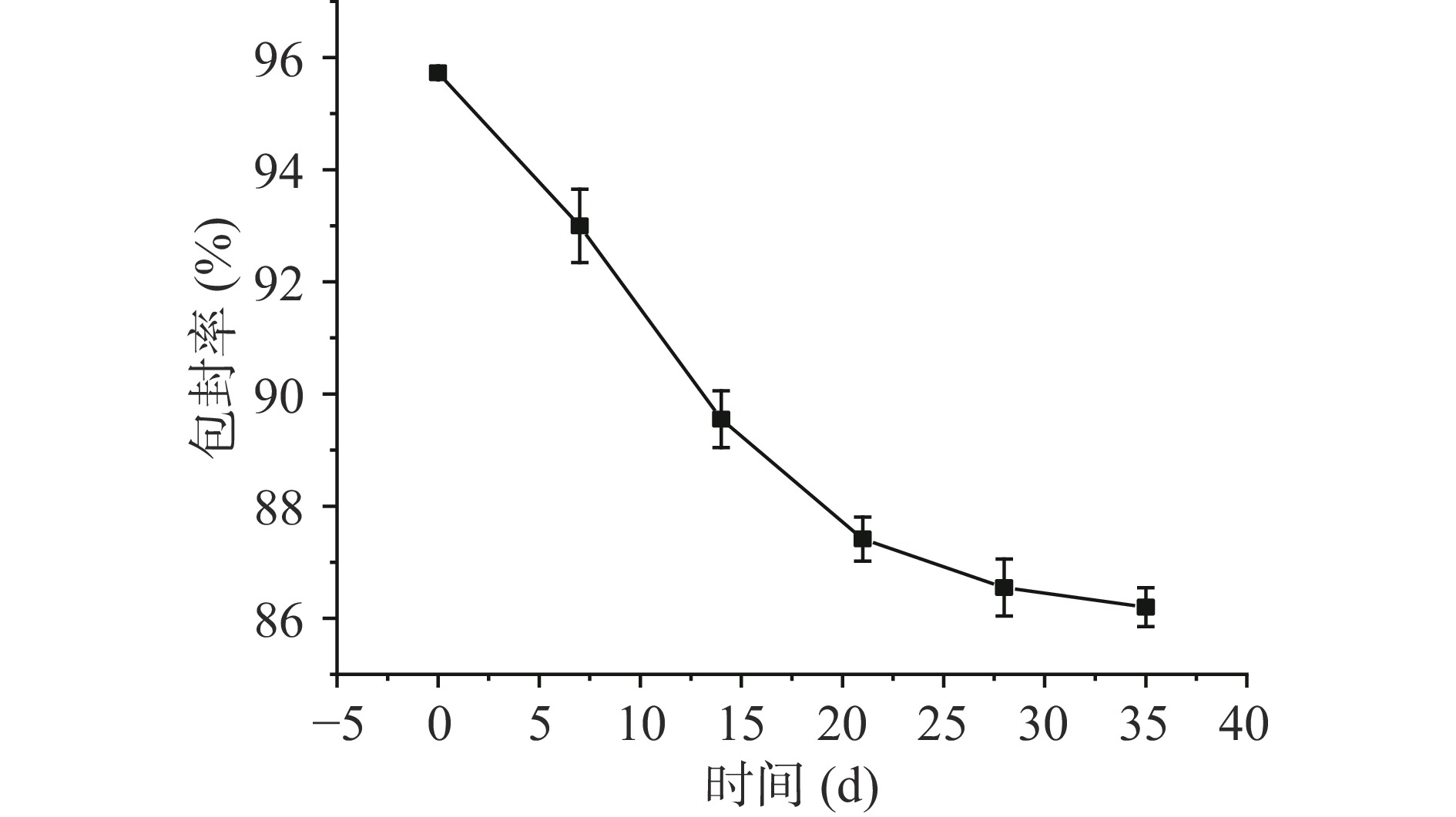
一般来说,包封率越高,载体的物理化学稳定性越高。Ruengdech等[32]研究的儿茶素NE的包封率为62%。李艺等[33]研究的茶黄素NE的包封率为56.89%。本文经过超滤离心法测定了PEO NE的包封率为95.85%,PEO被包裹于载体中。如图2所示,PEO NE在30 d内包封率依然保持在85%以上,表明PEO NE的包封率稳定性非常好,原因可能是由于通过配方的改进,体系中含有大量的CTS,CTS的粘度较大,阻碍了分子间的热运动,从而减小了被包裹的PEO分子之间的聚集从而结晶析出的过程[34];另一方面,CTS与聚甘油类的乳化剂具有非常好的亲和性,巨大的亲水基团向外与CTS结合,形成了紧密的乳化剂外壳,使PEO难以从中泄露出来,从而提高了PEO NE的包封稳定性[35]。
2.3 荧光显微镜
新鲜制备的 PEO NE 和室温贮藏 30 d 的 PEO NE 的荧光显微镜图如图3所示。由图3可见 PEO NE 在显微镜下呈现出非常微小、且分布均匀的小油滴,但是仍能观察到新鲜制备的 PEO NE 分布更加密集,并且 NE 的液滴尺寸较小,这与表1 中的数据是相对应的。通过对比新鲜制备的 PEO NE 和室温贮藏 30 d 的 PEO NE 的荧光显微镜图,可以发现,新鲜制备的 PEO NE 和室温贮藏 30 d 的 PEO NE 的油滴尺寸相差不大,乳液中油滴仍然是分布相对均匀的,表明 CTS 和吐温 80 共同乳化的 PEO NE 具有良好的稳定性。
2.4 扫描电子显微镜
PEO NE 的 SEM 图如图4 所示。PEO NE 具有颗粒均匀的球形表面形态,这是因为 PEO 中的酚类物质可以与CTS的酰胺基发生相关反应来形成共价键,从而增强PEO NE的凝胶网络。与此同时,共价交联降低了在水中分散的PEO NE的溶胀度,共价交联作用能够在冷冻干燥过程中保护PEO NE的完整,从而能够维持PEO NE的完整性[36]。
2.5 傅里叶变换红外光谱
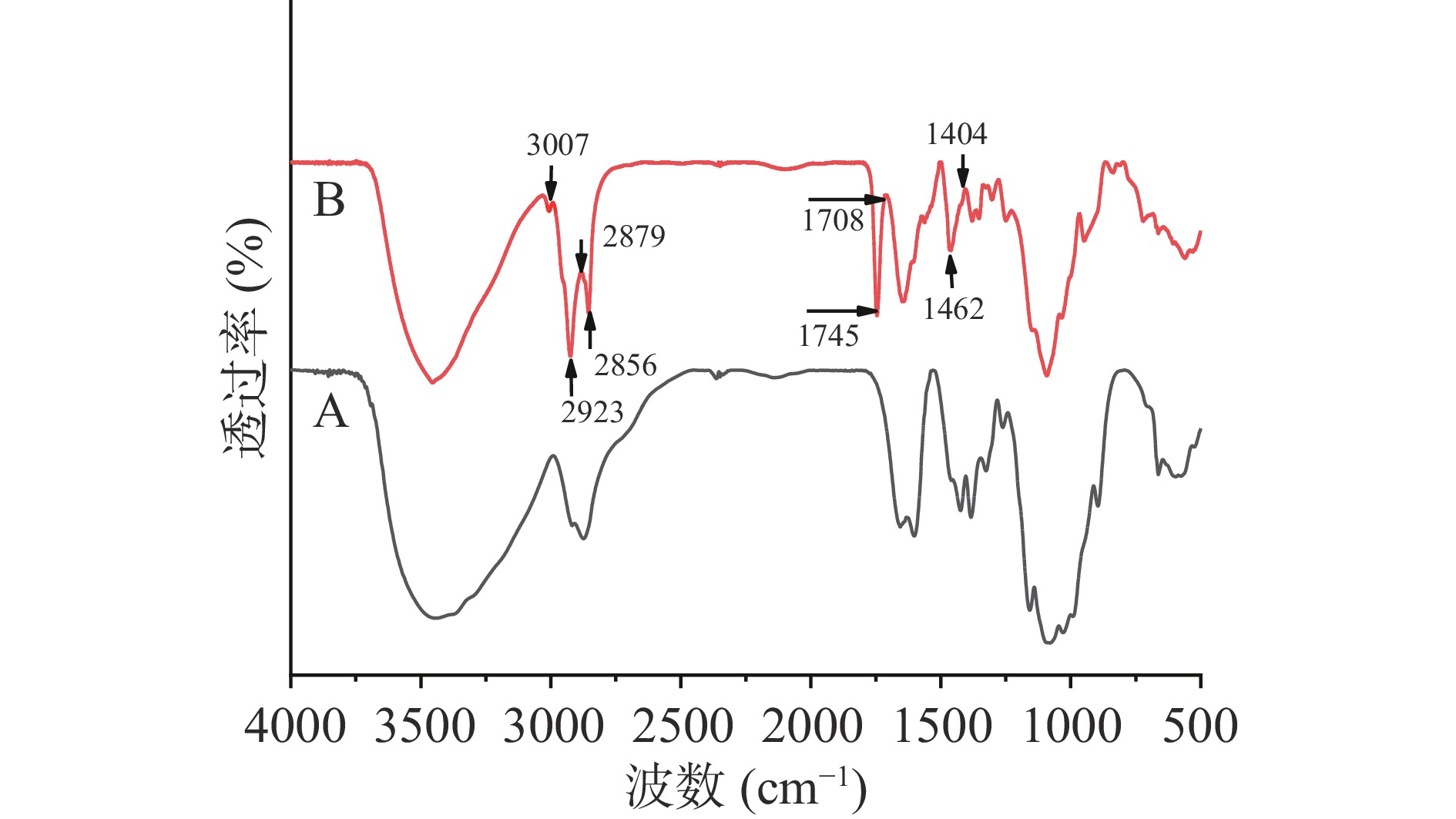
傅立叶变换红外光谱法(FT-IR)是确定纳米载体结构中各组分之间相互作用的一种很好的技术,可以分析关于有机和无机成分分子结构的基本信息,并提供从高空间分辨率(一般为10 μm)的生物样品中收集化学信息的独特可能性[37]。采用FT-IR对冷冻干燥过的PEO NE的化学结构进行了分析。如图5所示,PEO NE与CTS在3007、2923、2879、2856、1745、1708、1462和1404 cm−1处出现不同的峰值。3000~3400 cm−1范围内的典型峰被认为是氢键,氢键和疏水力都有助于大分子结构的稳定性。研究发现,氢键附近疏水残基的存在通过形成脱水环境提高了后者的稳定性,从而保护蛋白质或多肽免受水侵蚀。3007 cm−1处的宽而强的谱带可以归因于广藿香醇单体之间通过O-H键的分子间相互作用而产生的O-H键的伸缩振动模式。不同的样品在2800~3000 cm−1范围内有多个峰,这可能是由于-CH3基团在不同位置的拉伸振动模式引起的[38]。2923、2879和2856 cm−1处的谱带与PEO单体之间的C-H伸缩振动有关。蛋白质二级结构主要特征是酰胺I带,1600~1640 cm−1处的条带归属于β-折叠,1640~1650 cm−1处的条带对应于随机结构,1650~1660 cm−1处的条带表示α-螺旋结构,1660~1700 cm−1处的条带表示β-转角。1745 cm−1和1708 cm−1处的条带分别归因于PEO中δ-愈创木烯的不对称和对称振动。1462 cm−1和1404 cm−1处出现了指定的峰,可能跟PEO NE过程中添加的焦磷酸硫胺素有关[39]。
2.6 X射线衍射
图6显示了CTS(A)的晶体结构、PEO NE(B)的晶体结构。CTS的衍射光谱显示在20°的2θ处有一个尖峰,而PEO NE的衍射图中峰值较小,这可能是由于其无定形,其结晶度较高[40]。并且乳化过程中TPP的交联反应破坏了CTS的晶体结构,这表明PEO的加入可能导致CTS TPP复合物结构的改变,从而导致PEO NE的峰值较小。
2.7 DPPH和ABTS抗氧化性实验
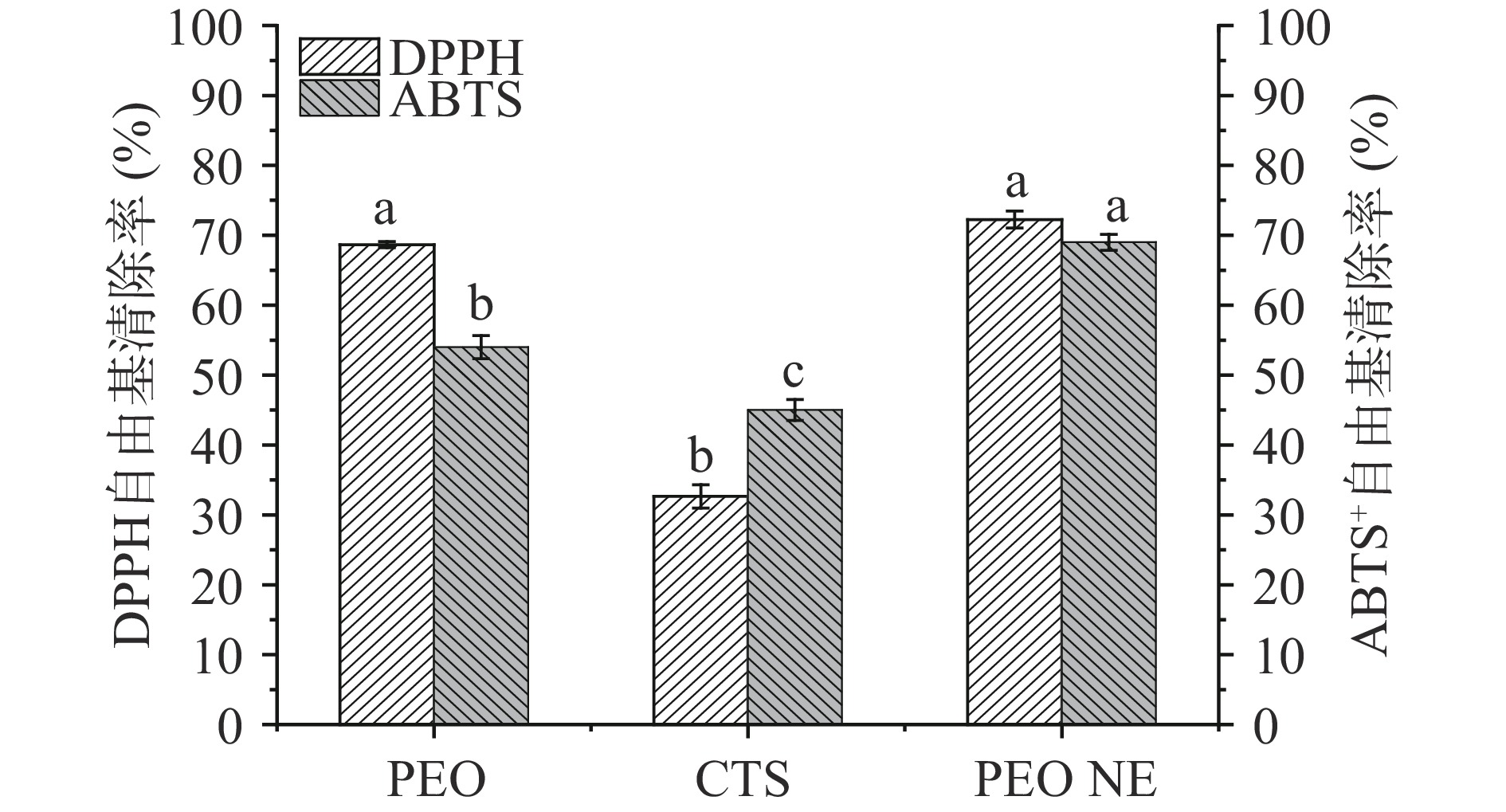
本研究通过DPPH和ABTS法对PEO NE的抗氧化活性进行测定,其结果如图7所示。DPPH和ABTS实验结果均表明,与纯浓度的PEO相比,PEO NE具有更强的抗氧化能力,DPPH自由基清除率达到69.64%,ABTS+自由基的清除能力可达到66.53%,PEO NE的自由基清除能力得到增强,表明PEO经过乳化作用,具有较好的抗氧化能力。NE对PEO的保护作用更强,抗氧化性能更好。这是由于PEO中强抗氧化组分百里香酚的成功负载。PEO强大的抗氧化活性归因于百里香酚结构中存在大量的酚基,其被认为是酚类物质抗氧化功能的活性位点[41]。已有研究报道酚基在姜黄素的抗氧化活性中起主要作用[42]。
2.8 抑菌性能
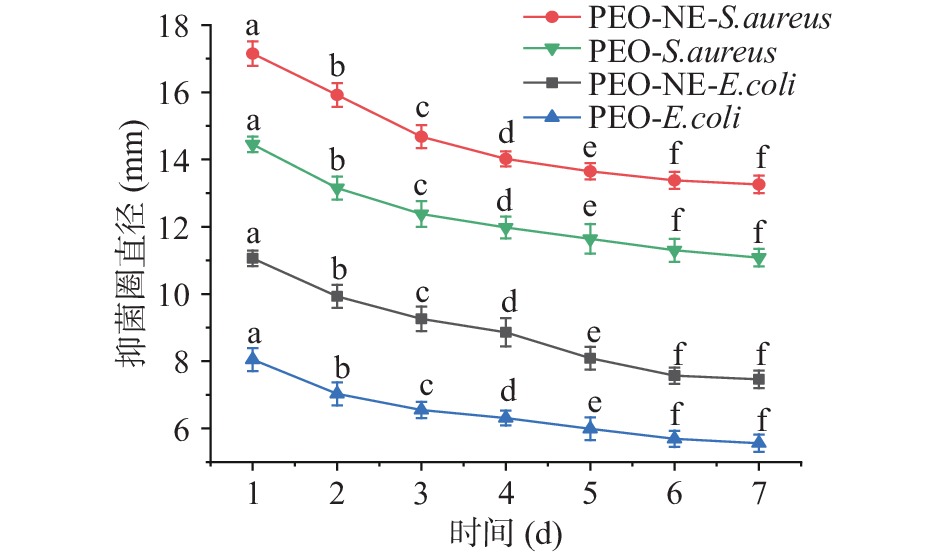
在抑菌实验中,选取金黄色葡萄球菌和大肠杆菌作为本实验的实验菌种,在不同的时间段分别检测 PEO NE 的抑菌性。如图8 所示,在 7 d 内 PEO 对金黄色葡萄球菌的抑菌圈变化范围是11.9~14.3 mm,PEO NE对金黄色葡萄球菌的抑菌圈变化范围是13.9~17.1 mm。在7 d内PEO对大肠杆菌的抑菌圈变化范围是5.6~8 mm,PEO NE对大肠杆菌的抑菌圈变化范围是7.9~11 mm。由此可见,在相同含量的PEO和PEO NE以及其他外界因素一致的情况下,PEO NE对2种供试菌抑菌效果均比PEO的抑菌效果好。这可能是因为NE通过运输活性物质,PEO NE在水中的溶解性和稳定性均明显提升,增加了分散性,提高了比表面积,并且可以与细菌细胞膜相互作用导致细胞裂解[43]。而且研究结果还表明PEO NE对金黄色葡萄球的抑制效果要好于大肠杆菌。
3. 结论
本文通过将PEO制备成NE,对PEO NE进行表征,还探究了PEO NE的稳定性和抑菌性等性能。荧光显微镜和扫描电镜结果显示PEO NE具有良好的稳定性;傅里叶变换红外光谱和X射线衍射图谱分析PEO NE的具体化学键变化。通过测定PEO NE 的 DPPH 和 ABTS 抗氧化活性,表明 PEO NE 具有良好的抗氧化稳定性;抑菌实验表明PEO NE对大肠杆菌、金黄色葡萄球菌具有良好的抑制效果。PEO NE对革兰氏阳性菌的敏感性大于其他种类的菌株,可在后续深入研究NE对革兰氏阳性菌的作用机制。NE作为一种极具前景的抗菌剂,可以提高营养物质的贮藏期和生物利用度,改善生物活性化合物的递送,可进一步开发在食品保鲜等方面中的应用。
-
表 1 PEO NE的粒径、PDI和ζ电位
Table 1 Particle size, PDI and ζ potential of PEO NE
贮藏时间(d) 粒径(nm) Zeta电位(mV) PDI 0 89.5±5.4b +20.8±1.8a 0.253±0.009b 30 160.8±8.6a +9.67±0.7b 0.363±0.005a 注:实验数据以平均值±标准偏差的形式表示,同列不同字母表示具有显著性差异(P<0.05),相同字母表示不具有显著性差异(P>0.05)。 -
[1] LALTHAFAMKIMI L, BHAU B S, KUMAR S, et al. Indirect organogenesis-mediated high frequency conversion of non-embryonic synthetic seeds, essential oil profiling and antibacterial activity in genetically stable plants of patchouli[J]. 3 Biotech,2022,12(12):349. doi: 10.1007/s13205-022-03302-3
[2] BUNRATHEP S, THONGPHASUK P, SETTHARAKSA S, et al. Effect of an essential oil blend of citronella, lemongrass, and patchouli on acne-causing bacteria[J]. Songklanakarin Journal of Science and Technology,2020,42(5):1106−1112.
[3] JIA Jingfu, DUAN Shulei, ZHOU Xue, et al. Long-term antibacterial film nanocomposite incorporated with patchouli essential oil prepared by supercritical CO2 cyclic impregnation for wound dressing[J]. Molecules,2021,26(16):5005. doi: 10.3390/molecules26165005
[4] ARAHMAN N, ROSNELLY C M, WINDANA D S, et al. Antimicrobial hydrophilic membrane formed by incorporation of polymeric surfactant and patchouli oil[J]. Polymers,2021,13(22):3872. doi: 10.3390/polym13223872
[5] ALOTAIBI W A, ALMOTWAA S M. Oxaliplatin-loaded nanoemulsion containing Teucrium polium L. essential oil induces apoptosis in colon cancer cell lines through ROS-mediated pathway[J]. Drug Delivery,2022,29(1):2190−2205. doi: 10.1080/10717544.2022.2096711
[6] PENICHE T, DUARTE J L, FERREIRA R M A, et al. Larvicidal effect of Hyptis suaveolens (L.) Poit. essential oil nanoemulsion on Culex quinquefasciatus (Diptera: Culicidae)[J]. Molecules,2022,27(23) :8433. doi: 10.3390/molecules27238433
[7] WANG Ke, HONG Yan, GU Zhengbiao, et al. Fabrication and characterisation of spice essential oil-based nanoemulsions: Physical, sensory and antimicrobial properties[J]. International Journal of Food Science & Technology,2022,57(12):7852−7861.
[8] POLAT Y G, SEZER E, SIÇRAMAZ H. Inhibitory effect of sodium alginate nanoemulsion coating containing myrtle essential oil ( Myrtus communis L.) on listeria monocytogenes in kasar cheese[J]. Molecules,2022,27(21):7298. doi: 10.3390/molecules27217298
[9] JAVANMARDI Z, KOUSHESH S M, NOURBAKHSH H, et al. Efficiency of nanoemulsion of essential oils to control Botrytis cinerea on strawberry surface and prolong fruit shelf life[J]. International Journal of Food Microbiology,2023,384:109979. doi: 10.1016/j.ijfoodmicro.2022.109979
[10] WALKER REBECCA M, DECKER ERIC A, MCCLEMENTS DAVID J. Physical and oxidative stability of fish oil nanoemulsions produced by spontaneous emulsification: Effect of surfactant concentration and particle size[J]. Journal of Food Engineering,2015,164:10−20. doi: 10.1016/j.jfoodeng.2015.04.028
[11] CHANG Y H, MCCLEMENTS D J. Optimization of orange oil nanoemulsion formation by isothermal low-energy methods:Influence of the oil phase, surfactant, and temperature[J]. Journal of Agricultural and Food Chemistry,2014,62(10):2306−2312. doi: 10.1021/jf500160y
[12] BADR M M, BADAWY M E I, TAKTAK N E M. Preparation, characterization, and antimicrobial activity of cinnamon essential oil and cinnamaldehyde nanoemulsions[J]. Journal of Essential Oil Research,2022,34(6):544−558. doi: 10.1080/10412905.2022.2107100
[13] RESTREPO ANDREA E, ROJAS JOSÉ D, GARCÍA OMAR R, et al. Mechanical, barrier, and color properties of banana starch edible films incorporated with nanoemulsions of lemongrass ( Cymbopogon citratus) and rosemary ( Rosmarinus officinalis) essential oils[J]. Food Science and Technology International,2018,24(8):705−712. doi: 10.1177/1082013218792133
[14] SUBAHARAN K, SENTHAMARAI S P, SUBRAMANYA T M, et al. Ultrasound-assisted nanoemulsion of trachyspermum ammi essential oil and its constituent thymol on toxicity and biochemical aspect of aedes aegypti[J]. Environmental Science and Pollution Research International,2022,29(47):71326−71337. doi: 10.1007/s11356-022-20870-2
[15] KUMAR H, SARMA A K, KUMAR P. A comprehensive review on preparation, characterization, and combustion characteristics of microemulsion based hybrid biofuels[J]. Renewable and Sustainable Energy Reviews,2020,117(C):109498−109510.
[16] SOMALA N, LAOSINWATTANA C, TEERARAK M. Formulation process, physical stability and herbicidal activities of cymbopogon nardus essential oil-based nanoemulsion[J]. Scientific Reports,2022,12(1):10280. doi: 10.1038/s41598-022-14591-2
[17] 陈良红. 含乳木果油NE的制备技术及其应用研究[D]. 上海:上海应用技术学院, 2015 CHEN Lianghong. Study on the preparation technology and application of shea butter containing nano lotion[D]. Shanghai:Shanghai Institute of Applied Technology, 2015.
[18] KOTTA S, KHAN A W, ANSARI S H, et al. Formulation of nanoemulsion: A comparison between phase inversion composition method and high-pressure homogenization method[J]. Drug Delivery,2015,22(4):455−466. doi: 10.3109/10717544.2013.866992
[19] ADHAVAN P, KAUR G, PRINCY A, et al. Essential oil nanoemulsions of wild patchouli attenuate multi-drug resistant gram-positive, gram-negative and Candida albicans[J]. Industrial Crops & Products,2017,100:106−116.
[20] PARK J H, KIM H J, WIMALASENAB S H M P, et al. In vitro repellent efficacy of P ogostemon cablin (Blanco) Benth. [Lamiaceae] essential oil and its nanoemulsion against Haemaphysalis longicornis (Acari: Ixodidae)[J]. International Journal of Acarology,2022,48(6):466−471. doi: 10.1080/01647954.2022.2134925
[21] UNE VIDHITA R, BONDARDE M P, SOME S. Formulation and development of water-based fragrance from patchouli essential oils using nonionic surfactant[J]. Applied Nanoscience,2022,12(7):2117−2125. doi: 10.1007/s13204-022-02489-4
[22] MANJESH K, KUNDU A, DUTTA A, et al. Bio-Insecticidal nanoemulsions of essential oil and lipid-soluble fractions of pogostemon cablin[J]. Frontiers in Plant Science,2022,13:874221. doi: 10.3389/fpls.2022.874221
[23] 陈莹莹, 白礼涛, 刘抗, 等. 薄荷NE的制备及抗菌特性研究[J]. 合肥工业大学学报(自然科学版),2022,45(11):1569−1574 doi: 10.3969/j.issn.1003-5060.2022.11.021 CHEN Yingying, BAI Litao, LIU Kang, et al. Preparation and antibacterial properties of peppermint oil nanoemulsion[J]. Journal of Hefei University of Technology (Natural Science Edition),2022,45 (11):1569−1574. doi: 10.3969/j.issn.1003-5060.2022.11.021
[24] 李林竹, 盛赵越, 李艺, 等. 表没食子儿茶素-壳聚糖NE的制备及其性能分析[J]. 食品科技,2022,47(5):254−259 doi: 10.13684/j.cnki.spkj.2022.05.029 LI Linzhu, SHENG Zhaoyue, LI Yi, et al. Preparation and performance analysis of epigallocatechin chitosan nanoemulsion[J]. Food Science and Technology, 2022, 47 (5):254−259. doi: 10.13684/j.cnki.spkj.2022.05.029
[25] SANTOS J, TRUJILLOCAYADO L A, BARQUERO M, et al. Influence of type and concentration of biopolymer on β-carotene encapsulation efficiency in nanoemulsions based on linseed oil[J]. Polymers,2022,14(21):4640. doi: 10.3390/polym14214640
[26] 侯克洪, 冯潇, 高成成, 等. 肉桂精油NE的抑菌性和稳定性研究[J]. 中国粮油学报,2020,35(11):86−92 doi: 10.3969/j.issn.1003-0174.2020.11.015 HOU Kehong, FENG Xiao, GAO Chengcheng, et al. Study on bacteriostasis and stability of cinnamon essential oil nanoemulsion[J]. Chinese Journal of Cereals and Oils,2020,35 (11):86−92. doi: 10.3969/j.issn.1003-0174.2020.11.015
[27] ZHAO Tiaobin, XU Chao, MA Yitong, et al. Study on preparation and structure of chrysanthemum-shaped micron calcium carbonate based on inverse microemulsion[J]. Micro & Nano Letters,2020,15(15):1151−1155.
[28] SHARIFI-RAD A, MEHRZAD J, DARROUDI M, et al. Oil-in-water nanoemulsions comprising berberine in olive oil: Biological activities, binding mechanisms to human serum albumin or holo-transferrin and QMMD simulations[J]. Journal of Biomolecular Structure and Dynamics,2021,39(3):1029−1043. doi: 10.1080/07391102.2020.1724568
[29] 王策. 大麻二酚递送载体的构建、稳定性及生物利用率研究[D]. 长春:吉林大学, 2022 WANG Ce. Construction, stability and bioavailability of cannabinoid delivery vector[D]. Changchun:Jilin University, 2022.
[30] 邹小波, 王圣, 石吉勇, 等. 天然花青素提取物与壳聚糖明胶复合膜的制备和表征[J]. 农业工程学报,2016,32(17):294−300 doi: 10.11975/j.issn.1002-6819.2016.17.039 ZOU Xiaobo, WANG Sheng, SHI Jiyong, et al. Preparation and characterization of composite membrane of natural anthocyanin extract and chitosan gelatin[J]. Journal of Agricultural Engineering,2016,32 (17):294−300. doi: 10.11975/j.issn.1002-6819.2016.17.039
[31] 史亚濛. 花椒精油NE的制备、特性表征及其应用研究[D]. 无锡:江南大学, 2022 SHI Yameng. Preparation, characterization and application of zanthoxylum bungeanum essential oil nanoemulsion[D]. Wuxi:Jiangnan University, 2022.
[32] RUENGDECH A, SIRIPATRAWAN U. Improving encapsulating efficiency, stability, and antioxidant activity of catechin nanoemulsion using foam mat freeze-drying: The effect of wall material types and concentrations[J]. LWT, 2022, 162.
[33] 李艺, 甘晴, 李林竹, 等. 茶黄素-3, 3′-双没食子酸酯-壳聚糖NE制备及其性能分析[J]. 中国食品添加剂,2022,33(9):151−158 doi: 10.19804/j.issn1006-2513.2022.09.021 LI Yi, GAN Qing, LI Linzhu, et al. Preparation and performance analysis of theaflavin-3,3'-bis gallate chitosan nanoemulsion[J]. China Food Additives, 2022, 33 (9):151−158. doi: 10.19804/j.issn1006-2513.2022.09.021
[34] 邹长鑫, 吴鹏, 刘苗苗, 等. 溶剂非溶剂法制备四逆汤微囊研究[J]. 科技资讯,2019,17(12):178−180,182 doi: 10.16661/j.cnki.1672-3791.2019.12.178 ZOU Changxin, WU Peng, LIU Miaomiao, et al. Study on the preparation of Sini decoction microcapsules by solvent non solvent method[J]. Science and Technology Information, 2019, 17 (12):178−180,182. doi: 10.16661/j.cnki.1672-3791.2019.12.178
[35] 龙腾, 陈义强, 柯文林, 等. 超细SiO2改性壳聚糖膜的制备、表征及蛋白质分离性能研究[J]. 应用海洋学学报,2022,41(4):607−613 doi: 10.3969/J.ISSN.2095-4972.2022.04.006 LONG Teng, CHEN Yiqiang, KE Wenlin, et al. Ultrafine SiO2 preparation, characterization and protein separation performance of modified chitosan membrane[J]. Journal of Applied Oceanography,2022,41 (4):607−613. doi: 10.3969/J.ISSN.2095-4972.2022.04.006
[36] BARDHAN S, KUNDU K, PAUL B K, et al. Interfacial composition and characterization of a quaternary water-in-oil mixed surfactant (cationic of different alkyl chain lengths+polyoxyethylene type nonionic) microemulsions in absence and presence of inorganic salts[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2013,433(4):219−229.
[37] TABIBIAZAR M, DAVARAN S, HASHEMI M, et al. Design and fabrication of a food-grade albumin-stabilized nanoemulsion[J]. Food Hydrocolloids,2015,44:220−228. doi: 10.1016/j.foodhyd.2014.09.005
[38] LOEKER F, MARR P C, HOWDLE S M. FTIR analysis of water in supercritical carbon dioxide microemulsions using monofunctional perfluoropolyether surfactants[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2003,214(1):143−150.
[39] LONE I H, AHMED J, AHMAD T. Reverse micellar synthesis, characterization, magnetic and ferroelectric properties of YFeO3 nanoparticles[J]. Materials Today:Proceedings,2018,5(7):15303.
[40] YAN Xuechao, ZHANG Xiaoping, LI Qian. Preparation and characterization of CS/ β-CD/Nano-ZnO composite porous membrane optimized by Box-Behnken for the adsorption of Congo red[J]. Environmental Science and Pollution Research International,2018,25(22):22244−22258. doi: 10.1007/s11356-018-2110-3
[41] QUIDEAU S, DEFFIEUX D, DOUAT-CASASSUS C, et al. Plant polyphenols: Chemical properties, biological activities, and synthesis[J]. Angewandte Chemie (International ed. in English),2011,50(3):586−621. doi: 10.1002/anie.201000044
[42] PRIYADARSINI K I, MAITY D K, NAIK G H, et al. Role of phenolic O-H and methylene hydrogen on the free radical reactions and antioxidant activity of curcumin[J]. Free Radical Biology and Medicine,2003,35(5):475−484. doi: 10.1016/S0891-5849(03)00325-3
[43] RYU V, CORRADINI M G, MCCLEMENTS D J, et al. Impact of ripening inhibitors on molecular transport of antimicrobial components from essential oil nanoemulsions[J]. Journal of Colloid and Interface Science,2019,556(C):568−576.






 下载:
下载:



 下载:
下载:
