Research Progress on Nanoparticles of Flavonoids Based on Natural Macromolecules
-
摘要: 黄酮类化合物是存在于天然食品中一类重要的多酚类化合物,在食品、药品、保健品和化妆品等行业具有极大的应用潜力。然而黄酮类化合物却普遍因为自身的溶解度低、稳定性和渗透性差,导致其生物利用度差,因而限制了其在食品中的应用。利用纳米技术,以天然生物大分子为基质制备黄酮类化合物的纳米颗粒,进而改善黄酮类化合物的理化性质,是一种很有前途的策略。本文综合近年来国内外研究,简单介绍了黄酮类化合物的结构与性质,在此基础上,例举了多种蛋白质和多糖基质的纳米颗粒及相关的研究成果,讨论其结合机理和适用性,并展望黄酮类化合物纳米颗粒在食品行业中应用的发展前景。旨在为黄酮类化合物天然大分子纳米颗粒的开发利用提供理论基础和依据。Abstract: Flavonoids are an important group of polyphenolic compounds found in natural foods, showing great potential for the usage in food, pharmaceutical, nutraceutical, and cosmetic industries. Nevertheless, flavonoids are generally limited in their potential application in food industry due to their low solubility, poor stability and permeability, resulting in poor bioavailability. It is a promising strategy to use nanotechnology to prepare nanoparticles of flavonoids based on natural biological macromolecules and thus improve the physicochemical properties of flavonoids. Recent researches at home and abroad are comprehensive analyzed in this paper, and the structure and properties of flavonoids are briefly described. On this basis, examples of nanoparticles of various protein and polysaccharide matrices and related research results are presented in this paper to discuss their binding mechanisms and applicability. The development of flavonoid nanoparticles for applications in the food industry is also envisaged. The objective of this study is to provide a theoretical basis and rationale for the development and utilization of natural macromolecular nanoparticles of flavonoids.
-
Keywords:
- flavonoids /
- natural macromolecules /
- nanocarriers /
- stability /
- bioavailability
-
黄酮类化合物是一类重要的天然酚类化合物。黄酮类化合物不仅种类繁多,且大多都具有综合性的健康益处。已有许多研究指出了黄酮类化合物在食品、药品、保健品和化妆品行业的应用潜力[1-2]。然而,黄酮类化合物大多溶解度低且稳定性差,在复杂的胃肠道环境影响下,黄酮类化合物往往难以吸收且口服生物利用度较低[3],很大程度上限制了其在食品上的应用。
为了改善黄酮类化合物的理化性质,提高其生物利用度,拓宽黄酮类化合物在食品产业中的应用前景,已有许多的研究者选择利用纳米颗粒对黄酮类化合物进行包埋或吸附等处理。纳米颗粒可以保护生物活性成分免受环境不利因素的影响,调节其在胃肠道中的释放,从而达到提高生物利用度的目的,有的纳米颗粒还可以提高物质的生物活性[4-5]。纳米颗粒的这些优势对于黄酮类化合物的应用有极大的助益。纳米颗粒可以由多种材料制备,既有天然材料,如蛋白质、多糖和脂质等,也有人工合成材料,如金属纳米颗粒[6]、二氧化硅纳米颗粒[7]等。基于各种天然大分子制备的纳米颗粒,不仅具有上述纳米颗粒的自身优势,而且同时具有可消化性、可降解性、高安全性的优点[8],在开发黄酮类化合物的功能食品,提升黄酮类化合物生物利用率的方面,有重要的实用价值[9]。天然大分子物质种类繁多,包括蛋白质、多糖、多肽和天然橡胶等,但考虑到生物相容性和在食品领域应用的安全性与可加工性,目前应用于食品纳米颗粒的制备中几乎都是蛋白质或多糖[10]。
本文在简单介绍黄酮类化合物的结构与性质的基础上,综合国内外近年来研究,例举了多种蛋白质和多糖基质的纳米颗粒,对比了这些实例所得纳米颗粒的理化性质及其应用效果,对其进行总结归纳,讨论其结合机理、适用性,概述了黄酮类化合物纳米颗粒在食品行业中应用现状并对其发展前景进行了展望。
1. 黄酮类化合物
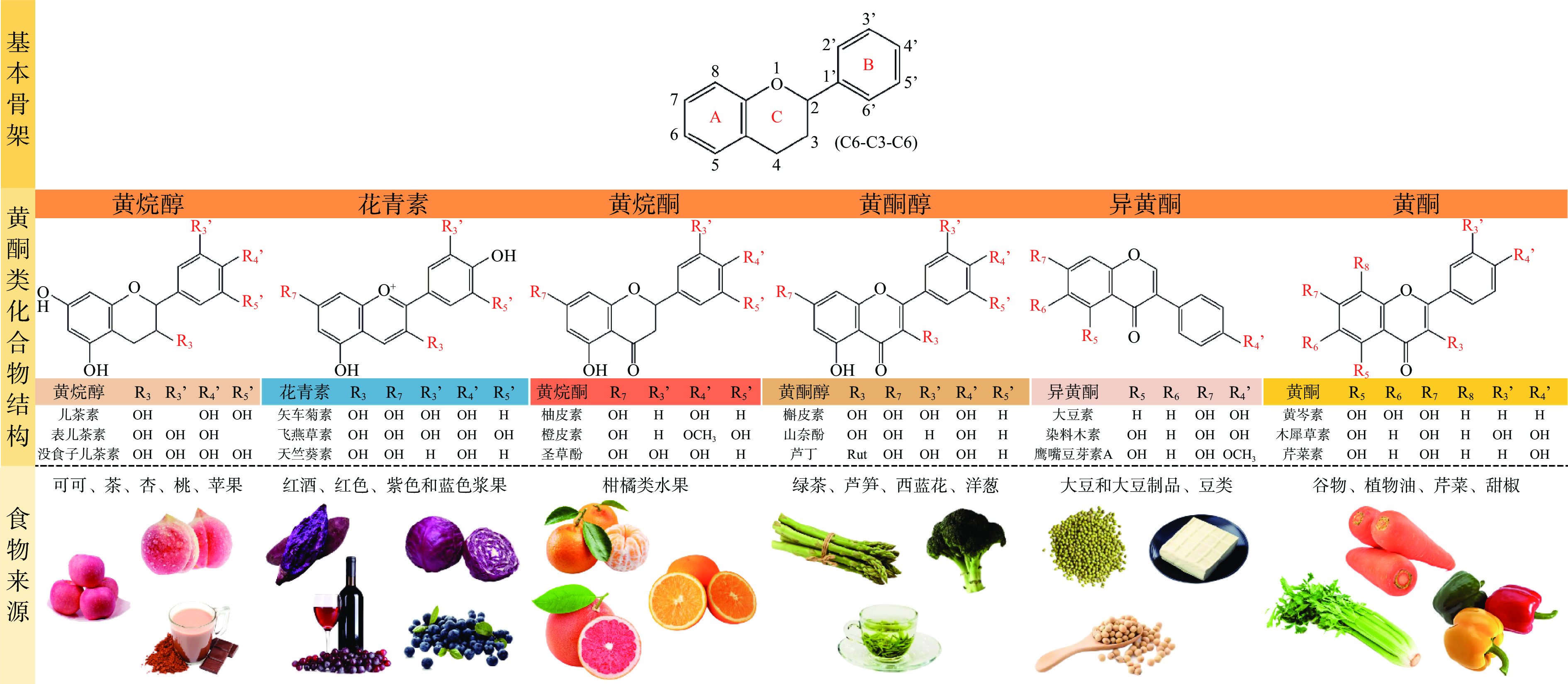
在化学结构上,黄酮类化合物由15碳构成骨架,两个苯环(A和B)通过中间三碳链相互连接形成一个杂环(C6-C3-C6),根据B环连接位点以及中间三碳链的不饱和度和氧化程度可分为黄烷醇、黄烷酮、黄酮、异黄酮、黄酮醇和花青素等亚类[11]。研究表明,黄酮类化合物具有广泛的健康促进作用,如有较强的抗氧化、抗炎活性[12],能够有效预防和辅助治疗癌症[13-14]和心血管疾病[15-16],帮助治疗神经退行性疾病[17],具有抗病毒作用[18],最近还有研究称其有对抗COVID-19的潜力[19],以及保护肝脏[20]等多种功效。作为高等植物中最具特征的化合物种类之一,黄酮类化合物广泛存在于植物性食品和饮料中,如柑橘、大豆、浆果、茶、可可和葡萄酒[11](图1)。
黄酮类化合物通常口服生物利用度有限[26],这可能是它们溶解度低、稳定性低难以被肠道细胞吸收的性质造成的。比如黄酮类和黄酮醇类,由于2、3号碳原子之间的双键容易形成平面结构,其分子排列紧密,导致溶剂分子很难穿透它们的分子结构[27],这使得它们的溶解度非常低。例如杨梅素,一种具有典型平面结构的黄酮醇,在水中的溶解度只有16.60 μg/mL[28],这或许是其在大鼠中的口服生物利用度只有9.62%的原因之一[29]。总的来说,黄酮类化合物具有很复杂的溶解特性,Zhang等[30]的研究表明,即使是同一亚类的黄酮类化合物,取代基的不同也会造成溶解度上的显著差异,这种个体上差异甚至比亚类间的差异还要大。当黄酮类化合物的C环含有双键时,其水溶性会随着B环上OH取代基数量的增加而增加,在1-辛醇中这一趋势是相反的,OCH3取代基则使黄酮类化合物在水中和1-辛醇中的溶解度都下降。而碳链结构的不同,如B环通过C2还是C3连接,C2和C3之间通过单键或是双键连接,其在水中和在1-辛醇中的溶解度同样会有变化。
此外,由于羟基和酮基以及不饱和双键的存在,黄酮类化合物对物理条件(光、热等)和生化条件(消化酶、pH等)造成的环境压力也很敏感,这可能导致其在加工[31-32]、储存和系统循环过程中发生降解或生物转化[33–35],同样也对其口服生物利用度产生不利影响[36]。另外,由于多余的游离羟基在肠道细胞中易被葡萄糖醛酸化和硫酸化,然后被一些转运载体排出胞外,羟基数量的增加致使黄酮类化合物难以被肠道细胞吸收,而这通常会导致口服吸收不良[37-38]。例如儿茶素,其结构中有5个酚羟基,导致其在肠道细胞上的表观渗透系数很低(Papp=6.0×10−7 cm/s),也因此它在大鼠中的口服生物利用度只有5%[39]。这些缺陷极大地限制了黄酮类化合物在食品中的应用以及潜在的健康益处的发挥。
已有大量研究证明,纳米颗粒系统的应用是克服这些缺陷,提高其生物学效益,打破黄酮类化合物应用瓶颈的一种很有前途的策略。下文将介绍常见的基于蛋白质和多糖的黄酮类化合物纳米颗粒,相关研究数据汇总于表1。
表 1 基于天然大分子的纳米颗粒对黄酮类化合物的运载效果Table 1. Effect of nanocarriers based on natural macromolecules on the delivery of flavonoids材料 纳米颗粒 运载物质
(溶解度)[30,80–82]粒径(nm) 制备方法 应用效果 文献 乳清蛋白 β-Lg纳米颗粒 AC 129.13~351.85 去溶剂法 AC包封率达77%,纳米颗粒提升了AC的热稳定性和在体外模拟消化实验中的稳定性 [41] 乳清蛋白浓缩物纳米颗粒 柑橘皮提取物 189.8 离子交联法 纳米颗粒能控制黄酮类化合物的释放,并在体外模拟消化条件下保持其抗氧化活性 [42] 乳清蛋白纳米颗粒 大豆异黄酮 54.09~59.96 乳化蒸发法 封装提高了大豆异黄酮的稳定性、抗氧化活性和生物
可及性[43] 明胶 明胶纳米颗粒 GEN(9.54)、ICA(185) 257~392 两步去溶剂法 纳米颗粒能有效的提升并在室温下保持黄酮类化合物的生物活性 [46] 明胶纳米颗粒 儿茶素 <200 混合 保护儿茶素的抗氧化活性,还能保护明胶免受
胰蛋白酶的降解[47] 明胶纳米颗粒 原花青素 22~138 混合 原花青素的抗氧化活性得到保护,在体外模拟消化中
可保持稳定[48] 酪蛋白 β-酪蛋白胶束 NAR(17.85) 28 酪蛋白自组装特性和酶促交联 NAR的包封率达89.7%,NAR在交联胶束的释放速度较慢,
并且显示出对胃蛋白酶活性的部分抗性,在模拟胃液中
NAR的释放被延缓[53] 酪蛋白纳米颗粒 QUE(0.529) 200 酪蛋白的自组
装特性包封率大于80%,纳米颗粒中的QUE口服时血浆中药物水平显著提升,相对生物利用度为溶液中的9倍 [54] 玉米醇溶蛋白 玉米醇溶蛋白-酪蛋白酸盐纳米颗粒 DMY(3710) 206.4 去溶剂法 DMY的包封率达90.2%,纳米颗粒显著提高了DMY的稳定性和在模拟消化液中的扩散速度,相较于混悬液的生物利用度提高了1.95倍 [57] 玉米醇溶蛋白纳米颗粒 QUE(0.529) 300 去溶剂法 QUE的包封率达80.7%,纳米颗粒提高了QUE的生物利用率,在动物实验中能持续提供高水平的QUE [58] 玉米醇溶蛋白纳米颗粒 橙子提取物 159.26 纳米沉淀法 该纳米颗粒具有高抗氧化能力,具有正的Zeta电位,研究人员认为这能促进其被细胞摄取。 [59] 壳聚糖 壳聚糖纳米颗粒 NAR(17.85) 407.47 离子凝胶法 封装在纳米颗粒中的NAR纳米颗粒在抗氧化、自由基清除活性和抗癌活性等方面均优于游离NAR [64] 壳聚糖纳米颗粒 P. alkekengi L提取物 167 离子凝胶法 在纳米颗粒中,提取物的稳定性及其抗氧化性能得到了提高 [65] 海藻酸盐/壳聚糖纳米颗粒 QUE(0.529) 172 ~254 离子凝胶法 QUE的包封率达82.4%,运载系统显著增强了QUE从纳米颗粒中释放的持续性,在酸性介质中稳定 [66] 淀粉 木薯淀粉纳米颗粒 MY(1.39) 55.27 高速射流 吸附MY的纳米颗粒具有生物相容性且无毒,在模拟消化液中能持续释放活性物质,其对自由基的清除效率得到了提升 [69] 藜麦淀粉纳米颗粒 芦丁(660) 107 超声处理 芦丁的包封率约64%,体外的模拟消化实验中,纳米颗粒能有效控制芦丁的释放,增加其生物利用度,显著提高其体外抗氧化活性 [71] 玉米淀粉纳米颗粒 222 马铃薯淀粉 QUE(0.529) 137.8 纳米沉淀法 三种纳米颗粒中QUE的抗氧化活性都得到了提升,其中马铃薯淀粉纳米颗粒负载率最高、提升效果最好,其次是豌豆淀粉,玉米淀粉的则最差,这可能是不同来源淀粉中支链淀粉含量的差异造成的 [72] 豌豆淀粉 165.3 玉米淀粉 214.3 藜麦淀粉纳米颗粒 QUE(0.529) 166.25 纳米沉淀法 QUE的储存稳定性和抗氧化活性得到了提升,QUE的存在由于抑制了淀粉酶的活性,减少了淀粉纳米颗粒的酶解 [73] 果胶 柑橘果胶纳米颗粒 柑橘皮提取物 271.2 离子凝胶法 纳米颗粒的包封提高了控释能力,且能使黄酮类化合物更容易被肠道吸收,并提升了其抗氧化活性 [78] 柑橘果胶纳米颗粒 ICA(185) 594~667 混合 ICA的生物可及性和稳定性都得到了显著改善 [79] 注:表中溶解度指纯该运载物质在298.15 K下水中的摩尔分数溶解度,单位为10−8 mol/mol。 2. 基于蛋白质的黄酮类化合物纳米颗粒
食品蛋白质是开发纳米颗粒的丰富原料,这主要归功于其具有出色的与各种生物活性分子结合的能力。蛋白质分子较大,生物活性分子可以包埋在其内部或吸附于表面。制备纳米颗粒载体的蛋白质来源广泛,如乳清蛋白、明胶、酪蛋白等动物性蛋白质以及玉米醇溶蛋白、大豆蛋白等植物性蛋白质。以下举例讨论了几种广泛用于制造运载黄酮类化合物的纳米颗粒系统的食品蛋白质。
2.1 乳清蛋白纳米颗粒
乳清蛋白,尤其是β-乳球蛋白(β-lactoglobulin,β-Lg,分子质量约为18 kDa),在制备食品蛋白纳米颗粒方面引起了广泛的关注。β-Lg是一种球状乳清蛋白,因其营养价值和形成凝胶的能力而被广泛用作食品成分。作为一种优秀的纳米颗粒,β-Lg纳米颗粒已被证明对肠道Caco-2细胞无细胞毒性,并可被Caco-2细胞高效吸收[40]。Salah等[41]采用去溶剂法(Desolvation method)结合超声处理,使花青素(Anthocyanidin,AC)和β-Lg结合形成粒径129.13~351.85 nm的共组装纳米颗粒,包封率(Encapsulation efficiency)约为77%。Hu等[42]用8 mmol/L的氯化钙作为交联剂通过离子交联法(Ionic cross-linking)制备乳清蛋白浓缩物纳米粒(WPC NPs),并将其用于包裹和保护四种富含黄酮类化合物的柑橘皮提取物,其粒径约189.8 nm,Zeta电位为−11.9 mV,呈球形,其包封率和负载率(Loading efficiency)范围分别为14.4%~27.9%和11.0%~18.6%。Liu等[43]用乳化蒸发法(Emulsification-evaporation method)将大豆异黄酮(Soy isoflavones)包裹在乳清蛋白纳米颗粒中,其纳米颗粒具有球形结构,具有粒径小(54.09~59.96 nm)、Zeta电位高(−35.63~−31.03 mV)和包封率适宜(91.29%~92.59%)的优点。
对所封装的黄酮类化合物,上述研究中的乳清蛋白纳米颗粒不仅能显著提高其在不同条件下的稳定性和抗氧化活性,还能在体外的模拟消化中起到缓释的效果,并在一定程度上提高其生物利用率。虽然研究者们采用了不同的方法来制备乳清蛋白纳米颗粒,并用于封装不同类型的黄酮类化合物,但大多殊途同归,利用了乳清蛋白特殊的疏水口袋结构[44],通过疏水相互作用和氢键,使黄酮类化合物与乳清蛋白相结合,形成稳定的、粒径较小的纳米颗粒。由此可见,乳清蛋白纳米颗粒对于不同类型的黄酮类化合物而言适用性较为广泛。
2.2 明胶纳米颗粒
明胶是一种变性蛋白质,可以从动物的皮、骨等结缔组织中的胶原蛋白中水解提取,明胶的来源影响其氨基酸组成,而分子量取决于提取方式与过程。明胶不是一种单分散的蛋白质,而是由不同分子量的不同链类型的混合物组成,这导致了它的多分散性[45]。在Song等[46]的工作中,通过改进的两步去溶剂法(Two-step desolvation method)制备了表面电位和粒径可控的明胶纳米颗粒(GNPs,来源于猪皮),在不同pH条件下,所得纳米颗粒粒径在257~392 nm范围内,形状为椭圆形或梭形。在优化条件下,GNPs能有效吸附低分子量的染料木素(Genistein,GEN)和高分子量的淫羊藿苷(Icariin,ICA)这两种黄酮类化合物,吸附容量可达90%以上,结构稳定,生物活性能保持至少180 d。Chen等[47]直接混合儿茶素(Catechin)和明胶,它们能在磁力搅拌下自组装形成表面光滑的球形纳米颗粒,其平均粒径小于200 nm,Zeta电位值在−14 mV左右。在自由基清除试验中,儿茶素的抗氧化活性在储存三周后几乎保持不变。这种纳米颗粒不仅能保护儿茶素的抗氧化活性,还能保护明胶免受胰蛋白酶的降解。Carmelo-Luna等[48]通过混合制备的高粱原花青素-明胶纳米颗粒,粒径在22~138 nm范围内,表面电位随使用的明胶种类变化,原花青素的抗氧化活性得到保护,在体外模拟消化中可保持稳定。
明胶纳米颗粒的制备方法较为简易,往往在合适的条件下通过简单的混合就能进行制备,所得的明胶纳米颗粒几乎都具有良好储存稳定性。在不同条件下所得的明胶纳米颗粒,其表面电位和粒径存在较大差异,这可能是明胶本身组成的复杂性导致的,也给这种纳米颗粒的加工带来了更多的可能性。在上述研究中,对于不同的黄酮类化合物,无论是吸附还是包埋,采用的各种分析方法都表明,明胶纳米颗粒与黄酮类化合物结合的主要相互作用是氢键,这种相互作用似乎是广泛存在于具有多羟基结构的多酚与明胶之间的[49-50],可以看出,明胶纳米颗粒能适用于不同类型的黄酮类化合物,甚至其他多酚。
2.3 酪蛋白纳米颗粒
酪蛋白(Casein)在牛奶中占蛋白质总量的80%~82%,是一种全价蛋白质,含有人体必需的8种氨基酸。酪蛋白在结构上具有独特的疏水和亲水结构域,其结构特征和表面电荷效应使它能自组装形成酪蛋白胶束,该胶束是直径在50~500 nm(平均150 nm)范围内的球形胶体颗粒[51]。Li等[52-53]对牛乳β-酪蛋白胶束作为疏水性黄酮类化合物的递送系统的研究指出,在一定条件下,β-酪蛋白能自组装形成纳米胶束并捕获疏水分子,利用这一特性,制备出载有柚皮素(Naringenin,NAR)的β-酪蛋白纳米胶束。所得胶束粒径分布集中在28 nm,包封率为89.7%。在pH7.4的缓冲液和胃肠道消化模型中,纳米胶束中的NAR的释放被延缓,并且显示出对胃蛋白酶活性的部分抗性。Peñalva等[54]通过凝聚法(Coacervation procedure),在纯净水中溶解酪蛋白酸钠、2-羟丙基-β-环糊精和赖氨酸(作为稳定剂)后,在磁力搅拌下加入槲皮素(Quercetin,QUE)乙醇溶液和氯化钙水溶液,制备纳米颗粒。所得纳米颗粒的粒径约200 nm,Zeta电位约15 mV,负载率约3.2%,包封率大于80%,其口服相对生物利用度(接近37%)是口服溶液中QUE的约9倍。除了酪蛋白纳米胶束之外,Pacheco等[55]的研究指出,在pH7.4时,β-酪蛋白单体和NAR之间存在疏水相互作用,并能形成在热力学上稳定的复合物,β-酪蛋白单体同样具有作为黄酮类化合物纳米载体的潜力。
酪蛋白独特的结构特征,使其能够通过简单的加工得到纳米颗粒。上述研究亦充分证明了酪蛋白纳米颗粒对黄酮类化合物能起到保护、控释和提高口服相对生物利用度的作用。对于疏水性黄酮类化合物,如黄烷酮和黄酮醇而言,β-酪蛋白能自组装形成纳米胶束并捕获疏水分子的特性,以及β-酪蛋白单体与疏水性黄酮类化合物之间的结合特性,无疑都是酪蛋白纳米颗粒作为潜在的纳米载体的有利条件。
2.4 玉米醇溶蛋白纳米颗粒
玉米醇溶蛋白是玉米胚乳中的主要储藏蛋白,约占玉米中蛋白质总量的80%,其平均分子量在40 kDa左右,主要由大量非极性氨基酸组成,其营养价值虽然较低,但是,由于具备良好的自组装特性,可制备形状规则、大小均一的纳米颗粒,并且具有良好生物相容性、可降解性和粘附性,在食品领域的应用具有天然优势[56]。Sun等[57]采用去溶剂法制备包埋二氢杨梅素(Dihydromyricetin,DMY)的玉米醇溶蛋白-酪蛋白酸钠(玉米醇溶蛋白:酪蛋白酸钠=1:2,酪蛋白酸钠为稳定剂)纳米粒(DZP)。测定DMY在DZP中的包封率和负载率分别为90.2%和22.6%。DZP形状为球形,粒径为206.4 nm,Zeta电位为−29.6 mV,DMY以无定形形式存在于DZP中,稳定性显著提高。此外,药代动力学研究表明,DMY在大鼠体内吸收迅速,综合计算得出DMY在大鼠体内的生物利用度相对提高了1.95倍。Penalva等[58]将QUE和2-羟丙基-β-环糊精(赋形剂,能提高载体的稳定性,降低基质的渗透性和孔隙率,并阻碍QUE扩散)通过去溶剂法封装在玉米醇溶蛋白纳米颗粒中,制得平均粒径约300 nm的纳米颗粒。所得的纳米颗粒为表面光滑的均匀球体,Zeta电位约为−44 mV,包封率可达80.7%,其负载率约7%。经口服吸收后,纳米颗粒能持续为血浆提供高水平的QUE,QUE口服生物利用度(约为60%)得到显著提高。Luque-Alcaraz等[59]使用纳米沉淀法将富含黄酮类化合物橙子提取物封装在玉米醇溶蛋白形成纳米颗粒,所得纳米颗粒粒径159.26 nm,具有高抗氧化能力。该纳米颗粒具有正的Zeta电位,研究人员认为这能促进其被细胞摄取。
玉米醇溶蛋白纳米颗粒与不同类型的黄酮类化合物之间的结合已经有许多研究,其适用性同样较为广泛。在最近的研究中,Li等[60]通过综合多光谱分析和分子对接分析,指出黄酮类化合物通过形成基态复合物与玉米醇溶蛋白相互作用,并诱导玉米醇溶蛋白的二级结构构象发生变化。该研究的结果表明拓扑极性表面积(Topological polar surface area,TPSA,表示分子中极性原子表面积的总和)相对较低的黄酮类化合物可能与玉米醇溶蛋白结合更紧密,并且强调,这种相互作用的关键是疏水相互作用和氢键。
3. 基于多糖的黄酮类化合物纳米颗粒
多糖是各种食物的重要组成部分,常用于制备纳米颗粒载体的天然多糖包括壳聚糖、淀粉和果胶等,其他诸如海藻酸盐、纤维素、菊粉等多糖以及各种改性多糖亦有相关研究。多糖在制造食品纳米颗粒方面最吸引人的优势是其生物粘附性,尤其是粘附于粘膜表面,这一特性可用于靶向特定器官或细胞,并延长活性物质在肠道中的留存时间。
3.1 壳聚糖基纳米颗粒
壳聚糖,即脱乙酰甲壳素,是以甲壳素或虾、蟹壳为主要原料,经脱钙、脱蛋白、脱乙酰基等工艺加工制得的食品添加剂[61],是目前纳米颗粒系统中应用最广泛的多糖。壳聚糖是已知唯一的天然阳离子性多糖,这有助于其与带负电荷的生物活性物质相互作用。壳聚糖被认为有助于改善活性成分在肠道内的吸收,由于其生物相容性和生物降解性,是各个领域开发应用最广泛的生物聚合物之一,并且在许多国家与地区已被批准用于食品制造当中。壳聚糖基纳米颗粒体系同样以其可靠性高、合成路线简单等优势得到了广泛的研究,已有研究证明壳聚糖纳米颗粒具有良好的生物安全性[62]。Calvo等[63]最先开发了通过离子凝胶法制备壳聚糖基纳米颗粒的方法,他们以三聚磷酸钠(Tripolyphosphate,TPP)为交联剂合成壳聚糖纳米颗粒。该方法是基于壳聚糖带正电的氨基与带负电的三聚磷酸盐之间的强静电相互作用,交联形成纳米级大小的凝聚层,通过不断的搅拌,可以自发生成纳米颗粒。
Kumar等[64]以三聚磷酸盐为交联剂,通过离子凝胶法合成了壳聚糖封装的NAR纳米颗粒(CS-NPs/NAR)。壳聚糖纳米颗粒的粒径为53.2 nm,而在装载NAR后,粒径尺寸增加至407.47 nm,通过Folin-Ciocalteau法和高效液相色谱法两种方法分别测定其包封率约为70%和80%。该纳米颗粒在体外模拟消化中具有良好的缓释性能,且其抗氧化和抗癌活性均优于游离NAR。同样使用离子凝胶法,Mahmoudi等[65]将富含黄酮的P. alkekengi L提取物封装在壳聚糖纳米颗粒中。封装提取物的壳聚糖纳米颗粒,尺寸均匀,粒径约167 nm,Zeta电位约7.69 mV,包封率可达95%。在纳米颗粒中,提取物的稳定性及其抗氧化性能得到了提高。虽然壳聚糖具备许多的优越特性,但是在酸性条件下易降解一直是壳聚糖作为纳米颗粒的主要劣势,而为了给壳聚糖基质提供在酸性环境下的保护,在制备壳聚糖基纳米颗粒的时候,研究人员常常将其与另一种天然多糖,即海藻酸盐共用。海藻酸盐是从天然海洋藻类中获取的耐酸性阴离子多糖,它与壳聚糖的结合可以发挥协同作用,防止包封的活性物质在酸性条件下快速扩散,并保护其免受氧化、酶降解和水解,且海藻酸盐还可以发挥抗氧化剂的作用[66]。在Nalini等[66]的研究中,利用离子凝胶法制备了包封QUE的海藻酸盐/壳聚糖(壳聚糖:海藻酸盐=1:2)纳米颗粒。所得纳米颗粒粒径随QUE浓度变化,在172 ~254 nm范围内,呈杆状。实验观察到的最高封装率为82.4%,负载率为46.5%。合成的海藻酸盐/壳聚糖纳米颗粒显著增强了QUE从纳米颗粒中释放的持续性。聚合物基质中的海藻酸盐赋予了壳聚糖纳米颗粒在酸性介质中的稳定性,并保护其不受胃肠环境中pH和酶降解的影响。
目前,已有大量的研究证明,以离子凝胶法制备的壳聚糖纳米颗粒,对于多种包括黄酮类化合物在内的生物活性物质具有广泛的适用性。离子凝胶法的反应条件温和,不需要昂贵的设备或试剂,纳米颗粒生成的反应迅速,可以调整合成条件如试剂比例、添加稳定剂等控制纳米颗粒的粒径和Zeta电位,反应中不需要使用有机溶剂和醛类固化剂。但与此同时,离子凝胶法所得的纳米颗粒粒度分布范围较大,可能会影响到负载率,还会限制纳米颗粒与生物结构的相互作用,且此方法必须在水分散体系中才能产生颗粒[67]。
3.2 淀粉纳米颗粒
淀粉作为制备纳米材料的原料同样备受关注,已有大量关于淀粉纳米颗粒制备的研究,淀粉纳米颗粒具有在溶解度、反应面积、吸附能力和增强胃肠道吸收等方面上的多重优势[68]。
Xia等[69]将木薯淀粉经微粉化预处理后,通过高速射流(High speed jet,HSJ)制备成纳米淀粉颗粒[70]。HSJ处理后所得的淀粉纳米颗粒粒径均匀,约为55.27 nm,形态呈球形,表面光滑,对杨梅素(Myricetin,MY)的最大平衡吸附容量为453 mg/g。该纳米颗粒具有生物相容性且无毒,能持续释放活性物质,相较于纯MY,其对DPPH自由基的清除效率也得到了提升。Remanan等[71]使用超声处理分别制备了包封芦丁的藜麦淀粉和玉米淀粉纳米颗粒,所得藜麦和玉米淀粉纳米颗粒的平均粒径分别为107 nm和222 nm,包封率分别为64.7%和63.1%,载药量分别为26.6%和22.7%,Zeta电位分别为−18.0 mV和−18.6 mV。体外的模拟消化实验表明,芦丁的释放被有效控制,其生物利用度增加,体外抗氧化活性显著提高,在这一点上藜麦淀粉纳米颗粒的效果要好于玉米淀粉纳米颗粒。
Farrag等[72]通过纳米沉淀法制备淀粉纳米颗粒,将QUE分别封装到马铃薯、豌豆和玉米淀粉制得的纳米颗粒中。在淀粉浓度20 mg/mL下,三种纳米颗粒的粒径分别为137.8、165.3和214.3 nm。研究发现,马铃薯较豌豆淀粉的纳米颗粒的负载率略高,差异不大(分别为49%和44%),玉米淀粉的负载率则为20%,这影响到纳米颗粒的QUE释放和抗氧化活性,这种现象可能是因为马铃薯淀粉中支链淀粉含量较高,而支链淀粉在固定QUE分子方面更有效。Jiang等[73]同样通过纳米沉淀法制备藜麦淀粉纳米颗粒作为QUE的载体。该纳米颗粒呈球形,与玉米淀粉纳米颗粒相比,粒径更小为166.25 nm,具有更好的分散性和负载率(26.62%),并且能有效保护QUE的生物活性。该研究通过FTIR光谱分析揭示了淀粉纳米颗粒是通过氢键与QUE相互作用的。
作为一种常见且来源广泛的食品加工原料,淀粉不仅种类多种多样,由其制备纳米颗粒的方式也十分多样化,这些淀粉纳米颗粒大多都具有控制黄酮类化合物释放、提升其抗氧化活性的功能。研究者们一般认为,支链淀粉与直链淀粉的比例是影响其与黄酮类化合物结合的关键因素。然而,天然淀粉的结构与纳米颗粒的性质及适用性之间的关系尚未揭示,有待进一步研究。
3.3 果胶纳米颗粒
果胶是植物细胞壁中的一种复杂的杂多糖,主要由部分甲酯化的通过α-1,4-糖苷键连接的α-D-半乳糖醛酸的聚合物组成,是膳食纤维的重要来源,也是加工食品中的一种功能性成分[74]。果胶的理化性质受其来源的影响,商业果胶的主要来源是柑橘皮和苹果渣,根据酯化程度的不同,果胶会有不同的应用[75]。果胶被证实对口腔和胃中的酶消化有抵抗力,且可被结肠中的微生物群降解,这使其适合用于输送酸敏感的食品生物活性物质,有多项研究表明,果胶可用于制备输送生物活性成分的纳米颗粒,其表现出优异的生物相容性、持续的释放曲线和良好的靶向特性,很有成为递送黄酮类化合物的理想选择的潜力[76-77]。
Hu等[78]使用离子凝胶法制备了柑橘果胶纳米颗粒,并用其封装作为同源成分的柑橘皮提取物中的黄酮类化合物。研究发现,最佳条件下获得的果胶纳米颗粒形态呈球形,且形状完整,平均粒径为271.2 nm,Zeta电位为−17.8 mV,封装柑橘皮提取物的最佳浓度为6 mg/mL,对应的封装率和负载率分别为31.81%和18.53%。在体外模拟消化实验中,纳米颗粒具有控释能力,且能使黄酮类化合物更容易被肠道吸收。柑橘果胶作为一种天然的抗氧化剂,它保持并提高了黄酮类化合物的抗氧化活性。Chen等[79]的研究通过在搅拌下混合将ICA封装到柑橘果胶中,制得载有ICA的果胶纳米胶束。不同浓度下,制得的果胶纳米颗粒粒径从594~667 nm不等,Zeta电位约−25 mV,具有高包封率(>93%)和负载率(>18%),纳米颗粒中ICA的生物可及性和稳定性都得到了改善。核磁共振谱显示,ICA与果胶中的羟基之间存在氢键。
相较于其他的材料,果胶纳米颗粒的粒径要更大一些,但值得一提的是,与单纯的果胶纳米颗粒相比,封装了黄酮类化合物的果胶纳米颗粒粒径都更小,而一般来说,复合物的粒径会大于空白对照的粒径。Chen等[79]认为这是因为单纯的果胶Zeta电位绝对值较低,系统不稳定,随着分子间氢键的形成和其他相互作用,很容易聚集成大颗粒。由于果胶成分的复杂性,其结构和纳米颗粒的性质及适用性之间的关系也尚待研究。
4. 黄酮类化合物纳米颗粒在食品工业的应用前景
在我国,黄酮类化合物目前更多的以植物提取物的形式而被应用于医药和化妆品行业,而在食品方面的应用还没有具体的国家标准。不过,随着我国的食品新资源的不断发展,国家已将黄酮类化合物作为新食品原料,例如,卫生部在2010年发布的卫生部公告2010年第17号[83]中批准将表没食子儿茶素没食子酸酯作为新食品原料和国家卫生计生委在2014年发布的《关于批准番茄籽油等9种新食品原料的公告(2014年第20号)》[84]中批准将竹叶黄酮作为新食品原料。早年间,欧盟也先后通过了将光叶甘草中的黄酮类化合物作为一种新型食品成分投放市场和将富含花旗松素的提取物作为一种新型食品成分投放市场的法案。这些法案详细规定了以黄酮类化合物为检测标准的成分范围和用法用量。
基于黄酮类化合物的功能特性,可以预测到它在作为食品添加剂方面的巨大潜力,除了作为天然抗氧化剂外,黄酮类化合物也可以作为天然甜味剂[85]、天然色素[86]和天然防腐剂[87]使用。而考虑到对于癌症、心血管疾病、阿尔兹海默症等一系列慢性疾病预防和辅助治疗的功效,同样可以预见其未来在保健食品开发方面的广阔前景。目前,随着黄酮类化合物纳米颗粒技术的发展,已经有许多相关专利出现,如王金梅等[88]开发的水溶性的QUE纳米颗粒和丁传波等[89]开发的花旗松素纳米微粒,也有越来越多的将黄酮类化合物纳米颗粒应用于食物模型的研究出现。相信随着我国在农产品深加工方面的技术进步和食品加工方面的深化和细化,黄酮类化合物和纳米颗粒的应用边界都将会不断拓展,相关的规定将不断完善,也会有更多的应用专利直至产品出现。
5. 结论和展望
黄酮类化合物长久以来就以其具备的多种生理活性吸引着大量研究者的目光,然而其化学结构带来的稳定性差和生物利用率低一直是制约其开发利用的瓶颈。基于纳米技术,研究者们以天然的、可食用的大分子为材料制备黄酮类化合物的纳米颗粒,其研究与制备方法多种多样,所得纳米颗粒的粒径、表面电位以及其对黄酮类化合物性能的提升也各不相同,但总的来说,这些研究大多实现了帮助黄酮类化合物在食品的加工、运输、贮藏和利用中保持稳定;控制黄酮类化合物的释放或一定程度上提高其生物活性和生物利用率。现有的研究表明,疏水相互作用和氢键是黄酮类化合物纳米颗粒制备的关键所在,有许多天然大分子材料纳米颗粒与黄酮类化合物的结合机理已经被探明,但更多的天然大分子材料仍有待深入的研究。
黄酮类化合物的纳米颗粒仍处于实验室阶段,生产工艺技术不算成熟,距离能够投入生产还有很长的路要走。随着时代进步和科技发展,未来一定还会有越来越多的新技术和新材料用于制造黄酮类化合物的纳米颗粒,解决眼前和未来将要面对的问题,使黄酮类化合物的纳米颗粒能实际应用于食品产业的生产实践中,最终走入人们的生活。总的来说,黄酮类化合物纳米颗粒在食品行业的应用范围未来还有极大的开拓空间。
-
表 1 基于天然大分子的纳米颗粒对黄酮类化合物的运载效果
Table 1 Effect of nanocarriers based on natural macromolecules on the delivery of flavonoids
材料 纳米颗粒 运载物质
(溶解度)[30,80–82]粒径(nm) 制备方法 应用效果 文献 乳清蛋白 β-Lg纳米颗粒 AC 129.13~351.85 去溶剂法 AC包封率达77%,纳米颗粒提升了AC的热稳定性和在体外模拟消化实验中的稳定性 [41] 乳清蛋白浓缩物纳米颗粒 柑橘皮提取物 189.8 离子交联法 纳米颗粒能控制黄酮类化合物的释放,并在体外模拟消化条件下保持其抗氧化活性 [42] 乳清蛋白纳米颗粒 大豆异黄酮 54.09~59.96 乳化蒸发法 封装提高了大豆异黄酮的稳定性、抗氧化活性和生物
可及性[43] 明胶 明胶纳米颗粒 GEN(9.54)、ICA(185) 257~392 两步去溶剂法 纳米颗粒能有效的提升并在室温下保持黄酮类化合物的生物活性 [46] 明胶纳米颗粒 儿茶素 <200 混合 保护儿茶素的抗氧化活性,还能保护明胶免受
胰蛋白酶的降解[47] 明胶纳米颗粒 原花青素 22~138 混合 原花青素的抗氧化活性得到保护,在体外模拟消化中
可保持稳定[48] 酪蛋白 β-酪蛋白胶束 NAR(17.85) 28 酪蛋白自组装特性和酶促交联 NAR的包封率达89.7%,NAR在交联胶束的释放速度较慢,
并且显示出对胃蛋白酶活性的部分抗性,在模拟胃液中
NAR的释放被延缓[53] 酪蛋白纳米颗粒 QUE(0.529) 200 酪蛋白的自组
装特性包封率大于80%,纳米颗粒中的QUE口服时血浆中药物水平显著提升,相对生物利用度为溶液中的9倍 [54] 玉米醇溶蛋白 玉米醇溶蛋白-酪蛋白酸盐纳米颗粒 DMY(3710) 206.4 去溶剂法 DMY的包封率达90.2%,纳米颗粒显著提高了DMY的稳定性和在模拟消化液中的扩散速度,相较于混悬液的生物利用度提高了1.95倍 [57] 玉米醇溶蛋白纳米颗粒 QUE(0.529) 300 去溶剂法 QUE的包封率达80.7%,纳米颗粒提高了QUE的生物利用率,在动物实验中能持续提供高水平的QUE [58] 玉米醇溶蛋白纳米颗粒 橙子提取物 159.26 纳米沉淀法 该纳米颗粒具有高抗氧化能力,具有正的Zeta电位,研究人员认为这能促进其被细胞摄取。 [59] 壳聚糖 壳聚糖纳米颗粒 NAR(17.85) 407.47 离子凝胶法 封装在纳米颗粒中的NAR纳米颗粒在抗氧化、自由基清除活性和抗癌活性等方面均优于游离NAR [64] 壳聚糖纳米颗粒 P. alkekengi L提取物 167 离子凝胶法 在纳米颗粒中,提取物的稳定性及其抗氧化性能得到了提高 [65] 海藻酸盐/壳聚糖纳米颗粒 QUE(0.529) 172 ~254 离子凝胶法 QUE的包封率达82.4%,运载系统显著增强了QUE从纳米颗粒中释放的持续性,在酸性介质中稳定 [66] 淀粉 木薯淀粉纳米颗粒 MY(1.39) 55.27 高速射流 吸附MY的纳米颗粒具有生物相容性且无毒,在模拟消化液中能持续释放活性物质,其对自由基的清除效率得到了提升 [69] 藜麦淀粉纳米颗粒 芦丁(660) 107 超声处理 芦丁的包封率约64%,体外的模拟消化实验中,纳米颗粒能有效控制芦丁的释放,增加其生物利用度,显著提高其体外抗氧化活性 [71] 玉米淀粉纳米颗粒 222 马铃薯淀粉 QUE(0.529) 137.8 纳米沉淀法 三种纳米颗粒中QUE的抗氧化活性都得到了提升,其中马铃薯淀粉纳米颗粒负载率最高、提升效果最好,其次是豌豆淀粉,玉米淀粉的则最差,这可能是不同来源淀粉中支链淀粉含量的差异造成的 [72] 豌豆淀粉 165.3 玉米淀粉 214.3 藜麦淀粉纳米颗粒 QUE(0.529) 166.25 纳米沉淀法 QUE的储存稳定性和抗氧化活性得到了提升,QUE的存在由于抑制了淀粉酶的活性,减少了淀粉纳米颗粒的酶解 [73] 果胶 柑橘果胶纳米颗粒 柑橘皮提取物 271.2 离子凝胶法 纳米颗粒的包封提高了控释能力,且能使黄酮类化合物更容易被肠道吸收,并提升了其抗氧化活性 [78] 柑橘果胶纳米颗粒 ICA(185) 594~667 混合 ICA的生物可及性和稳定性都得到了显著改善 [79] 注:表中溶解度指纯该运载物质在298.15 K下水中的摩尔分数溶解度,单位为10−8 mol/mol。 -
[1] 王雪, 乔博, 张健鑫, 等. 黄酮类化合物的应用研究进展[J]. 中国食品添加剂,2020,31(4):159−163. [WANG X, QIAO B, ZHANG J, et al. Study progress of application of flavonoids[J]. China Food Additives,2020,31(4):159−163. doi: 10.19804/j.issn1006-2513.2020.04.020 WANG X, QIAO B, ZHANG J, et al. Study progress of application of flavonoids[J]. China Food Additives, 2020, 31(4): 159-163. doi: 10.19804/j.issn1006-2513.2020.04.020
[2] 刘婷, 刘芳, 陈亮, 等. 植物黄酮类化合物在化妆品功效应用中的研究进展[J]. 广东化工,2020,47(9):105−107. [LIU T, LIU F, CHEN L, et al. Research progress of plant flavonoids in the application of cosmetics[J]. Guangdong Chemical Industry,2020,47(9):105−107. doi: 10.3969/j.issn.1007-1865.2020.09.046 LIU T, LIU F, CHEN L, et al. Research progress of plant flavonoids in the application of cosmetics[J]. Guangdong Chemical Industry, 2020, 47(9): 105-107. doi: 10.3969/j.issn.1007-1865.2020.09.046
[3] CHEN L, CAO H, HUANG Q, et al. Absorption, metabolism and bioavailability of flavonoids: A review[J]. Critical Reviews in Food Science and Nutrition,2022,62(28):7730−7742. doi: 10.1080/10408398.2021.1917508
[4] HE X, DENG H, HWANG H M. The current application of nanotechnology in food and agriculture[J]. Journal of Food and Drug Analysis,2019,27(1):1−21. doi: 10.1016/j.jfda.2018.12.002
[5] HE X, HWANG H M. Nanotechnology in food science: Functionality, applicability, and safety assessment[J]. Journal of Food and Drug Analysis,2016,24(4):671−681. doi: 10.1016/j.jfda.2016.06.001
[6] HSIEH D S, LU H C, CHEN C C, et al. The preparation and characterization of gold-conjugated polyphenol nanoparticles as a novel delivery system[J]. International Journal of Nanomedicine,2012,7:1623−1633.
[7] ARRIAGADA F, GÜNTHER G, MORALES J. Nanoantioxidant-based silica particles as flavonoid carrier for drug delivery applications[J]. Pharmaceutics,2020,12(4):302. doi: 10.3390/pharmaceutics12040302
[8] JACOB J, HAPONIUK J T, THOMAS S, et al. Biopolymer based nanomaterials in drug delivery systems: A review[J]. Materials Today Chemistry,2018,9:43−55. doi: 10.1016/j.mtchem.2018.05.002
[9] HU B, LIU X, ZHANG C, et al. Food macromolecule based nanodelivery systems for enhancing the bioavailability of polyphenols[J]. Journal of Food and Drug Analysis,2017,25(1):3−15. doi: 10.1016/j.jfda.2016.11.004
[10] SAMPATHKUMAR K, TAN K X, LOO S C J. Developing nano-delivery systems for agriculture and food applications with nature-derived polymers[J]. IScience,2020,23(5):101055. doi: 10.1016/j.isci.2020.101055
[11] PANCHE A N, DIWAN A D, CHANDRA S R. Flavonoids: An overview[J]. Journal of Nutritional Science,2016,5(E47):1−15.
[12] SERAFINI M, PELUSO I, RAGUZZINI A. Flavonoids as anti-inflammatory agents[J]. Proceedings of the Nutrition Society,2010,69(3):273−278. doi: 10.1017/S002966511000162X
[13] ABOTALEB M, SAMUEL S M, VARGHESE E, et al. Flavonoids in cancer and apoptosis[J]. Cancers,2019,11(1):28.
[14] BIRT D F, HENDRICH S, WANG W. Dietary agents in cancer prevention: Flavonoids and isoflavonoids[J]. Pharmacology & Therapeutics,2001,90(2):157−177.
[15] HERTOG M G L, FESKENS E J M, KROMHOUT D, et al. Dietary antioxidant flavonoids and risk of coronary heart disease: The Zutphen elderly study[J]. The Lancet,1993,342(8878):1007−1011. doi: 10.1016/0140-6736(93)92876-U
[16] CIUMĂRNEAN L, MILACIU M V, RUNCAN O, et al. The effects of flavonoids in cardiovascular diseases[J]. Molecules,2020,25(18):4320. doi: 10.3390/molecules25184320
[17] MAHER P. The potential of flavonoids for the treatment of neurodegenerative diseases[J]. International Journal of Molecular Sciences,2019,20(12):3056. doi: 10.3390/ijms20123056
[18] BADSHAH S L, FAISAL S, MUHAMMAD A, et al. Antiviral activities of flavonoids[J]. Biomedicine and Pharmacotherapy,2021,140:111596. doi: 10.1016/j.biopha.2021.111596
[19] RUSSO M, MOCCIA S, SPAGNUOLO C, et al. Roles of flavonoids against coronavirus infection[J]. Chemico-Biological Interactions,2020,328:109211. doi: 10.1016/j.cbi.2020.109211
[20] VAN DE WIER B, KOEK G H, BAST A, et al. The potential of flavonoids in the treatment of non-alcoholic fatty liver disease[J]. Critical Reviews in Food Science and Nutrition,2017,57(4):834−855. doi: 10.1080/10408398.2014.952399
[21] CORCORAN M P, MCKAY D L, BLUMBERG J B. Flavonoid basics: Chemistry, sources, mechanisms of action, and safety[J]. Journal of Nutrition in Gerontology and Geriatrics,2012,31(3):176−189. doi: 10.1080/21551197.2012.698219
[22] SHEN N, WANG T, GAN Q, et al. Plant flavonoids: Classification, distribution, biosynthesis, and antioxidant activity[J]. Food Chemistry,2022,383:132531. doi: 10.1016/j.foodchem.2022.132531
[23] GARCÍA-LAFUENTE A, GUILLAMÓN E, VILLARES A, et al. Flavonoids as anti-inflammatory agents: Implications in cancer and cardiovascular disease[J]. Inflammation Research,2009,58(9):537−552. doi: 10.1007/s00011-009-0037-3
[24] CHUN O K, CHUNG S J, SONG W O. Estimated dietary flavonoid intake and major food sources of U. S. adults[J]. The Journal of Nutrition,2007,137(5):1244−1252. doi: 10.1093/jn/137.5.1244
[25] JUN S, SHIN S, JOUNG H. Estimation of dietary flavonoid intake and major food sources of Korean adults[J]. British Journal of Nutrition,2016,115(3):480−489. doi: 10.1017/S0007114515004006
[26] ZHAO J, YANG J, XIE Y. Improvement strategies for the oral bioavailability of poorly water-soluble flavonoids: An overview[J]. International Journal of Pharmaceutics,2019,570:118642. doi: 10.1016/j.ijpharm.2019.118642
[27] CHUANG S Y, LIN Y K, LIN C F, et al. Elucidating the skin delivery of aglycone and glycoside flavonoids: How the structures affect cutaneous absorption[J]. Nutrients,2017,9(12):1304. doi: 10.3390/nu9121304
[28] YAO Y, LIN G, XIE Y, et al. Preformulation studies of myricetin: a natural antioxidant flavonoid[J]. Die Pharmazie-An International Journal of Pharmaceutical Sciences,2014,69(1):19−26.
[29] DANG Y, LIN G, XIE Y, et al. Quantitative determination of myricetin in rat plasma by ultra performance liquid chromatography tandem mass spectrometry and its absolute bioavailability[J]. Drug Research,2014,64(10):516−522.
[30] ZHANG H, WANG M, CHEN L, et al. Structure-solubility relationships and thermodynamic aspects of solubility of some flavonoids in the solvents modeling biological media[J]. Journal of Molecular Liquids,2017,225:439−445. doi: 10.1016/j.molliq.2016.11.036
[31] 刘钰, 曹亚楠, 彭镰心, 等. 加工方式对苦荞中黄酮类化合物的影响研究进展[J]. 食品工业科技, 2021, 42(15): 351−357. LIU Y, CAO Y, PENG L, et al. Research progress on the effects of processing methods of flavonoids in tartary buckwheat[J], Science and Technology of Food Industry, 2021, 42(15): 351−357.
[32] BIESAGA M. Influence of extraction methods on stability of flavonoids[J]. Journal of Chromatography A,2011,1218(18):2505−2512. doi: 10.1016/j.chroma.2011.02.059
[33] QIAO L, SUN Y, CHEN R, et al. Sonochemical effects on 14 flavonoids common in citrus: Relation to stability[J]. Plos One,2014,9(2):e87766. doi: 10.1371/journal.pone.0087766
[34] CHAABAN H, IOANNOU I, CHEBIL L, et al. Effect of heat processing on thermal stability and antioxidant activity of six flavonoids[J]. Journal of Food Processing and Preservation,2017,41(5):e13203. doi: 10.1111/jfpp.13203
[35] XIANG D, WANG C, WANG W, et al. Gastrointestinal stability of dihydromyricetin, myricetin, and myricitrin: An in vitro investigation[J]. International Journal of Food Sciences and Nutrition,2017,68(6):704−711. doi: 10.1080/09637486.2016.1276518
[36] ROSS J A, KASUM C M. Dietary flavonoids: Bioavailability, metabolic effects, and safety[J]. Annual Review of Nutrition,2002,22:19−34. doi: 10.1146/annurev.nutr.22.111401.144957
[37] FANG Y, CAO W, XIA M, et al. Study of structure and permeability relationship of flavonoids in Caco-2 cells[J]. Nutrients,2017,9(12):1301. doi: 10.3390/nu9121301
[38] TIAN X J, YANG X W, YANG X, et al. Studies of intestinal permeability of 36 flavonoids using Caco-2 cell monolayer model[J]. International Journal of Pharmaceutics,2009,367(1):58−64.
[39] EZZAT H M, ELNAGGAR Y S R, ABDALLAH O Y. Improved oral bioavailability of the anticancer drug catechin using chitosomes: Design,in-vitro appraisal and in-vivo studies[J]. International Journal of Pharmaceutics,2019,565:488−498. doi: 10.1016/j.ijpharm.2019.05.034
[40] HA H K, KIM J W, LEE M R, et al. Cellular uptake and cytotoxicity of β-lactoglobulin nanoparticles: The effects of particle size and surface charge[J]. Asian-Australasian Journal of Animal Sciences,2015,28(3):420−427. doi: 10.5713/ajas.14.0761
[41] SALAH M, MANSOUR M, ZOGONA D, et al. Nanoencapsulation of anthocyanins-loaded β-lactoglobulin nanoparticles: Characterization, stability, and bioavailability in vitro[J]. Food Research International,2020,137:109635. doi: 10.1016/j.foodres.2020.109635
[42] HU Y, KOU G, CHEN Q, et al. Protection and delivery of mandarin (Citrus reticulata Blanco) peel extracts by encapsulation of whey protein concentrate nanoparticles[J]. LWT,2019,99:24−33. doi: 10.1016/j.lwt.2018.09.044
[43] LIU Q, SUN Y, CHENG J, et al. Development of whey protein nanoparticles as carriers to deliver soy isoflavones[J]. LWT,2022,155:112953. doi: 10.1016/j.lwt.2021.112953
[44] REN S, JIMÉNEZ-FLORES R, GIUSTI M M. The interactions between anthocyanin and whey protein: A review[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20(6):5992−6011. doi: 10.1111/1541-4337.12854
[45] HAUG I J, DRAGET K I. Gelatin[M]//Handbook of hydrocolloids. Woodhead Publishing, 2009: 142−163.
[46] SONG X, GAN K, QIN S, et al. Preparation and characterization of general-purpose gelatin-based co-loading flavonoids nano-core structure[J]. Scientific Reports,2019,9(1):6365. doi: 10.1038/s41598-019-42909-0
[47] CHEN Y C, YU S H, TSAI G J, et al. Novel technology for the preparation of self-assembled catechin/gelatin nanoparticles and their characterization[J]. Journal of Agricultural and Food Chemistry,2010,58(11):6728−6734. doi: 10.1021/jf1005116
[48] CARMELO-LUNA F J, MENDOZA-WILSON A M, RAMOS-CLAMONT M G, et al. Synthesis and experimental/computational characterization of sorghum procyanidins–gelatin nanoparticles[J]. Bioorganic & Medicinal Chemistry,2021,42:116240.
[49] LIN D, XIAO L, WEN Y, et al. Comparison of apple polyphenol-gelatin binary complex and apple polyphenol-gelatin-pectin ternary complex: Antioxidant and structural characterization[J]. LWT,2021,148:111740. doi: 10.1016/j.lwt.2021.111740
[50] ZHAO Y, SUN Z. Effects of gelatin-polyphenol and gelatin-genipin cross-linking on the structure of gelatin hydrogels[J]. International Journal of Food Properties,2017,20(sup3):S2822−S2832. doi: 10.1080/10942912.2017.1381111
[51] DE KRUIF C G, HUPPERTZ T, URBAN V S, et al. Casein micelles and their internal structure[J]. Advances in Colloid and Interface Science,2012,171-172:36−52. doi: 10.1016/j.cis.2012.01.002
[52] LI M, FOKKINK R, NI Y, et al. Bovine beta-casein micelles as delivery systems for hydrophobic flavonoids[J]. Food Hydrocolloids,2019,96:653−662. doi: 10.1016/j.foodhyd.2019.06.005
[53] LI M, KEMBAREN R, NI Y, et al. Effect of enzymatic cross-linking of naringenin-loaded β-casein micelles on their release properties and fate in vitro digestion[J]. Food Chemistry,2021,352:129400. doi: 10.1016/j.foodchem.2021.129400
[54] PEÑALVA R, ESPARZA I, MORALES-GRACIA J, et al. Casein nanoparticles in combination with 2-hydroxypropyl-β-cyclodextrin improves the oral bioavailability of quercetin[J]. International Journal of Pharmaceutics,2019,570:118652. doi: 10.1016/j.ijpharm.2019.118652
[55] PACHECO A F C, NUNES N M, DE PAULA H M C, et al. β-Casein monomers as potential flavonoids nanocarriers: Thermodynamics and kinetics of β-casein-naringin binding by fluorescence spectroscopy and surface plasmon resonance[J]. International Dairy Journal,2020,108:104728. doi: 10.1016/j.idairyj.2020.104728
[56] 葛思彤, 贾睿, 刘回民, 等. 玉米醇溶蛋白基纳米颗粒的制备及应用研究进展[J]. 食品科学, 2021, 42(15): 285-292. GE S T, JIA R, LIU H M, et al. Progress in preparation and application of zein-based nanoparticles[J], Food Science, 2021, 42(15): 285-292.
[57] SUN C C, SU H, ZHENG G D, et al. Fabrication and characterization of dihydromyricetin encapsulated zein-caseinate nanoparticles and its bioavailability in rat[J]. Food Chemistry,2020,330:127245. doi: 10.1016/j.foodchem.2020.127245
[58] PENALVA R, GONZÁLEZ-NAVARRO C J, GAMAZO C, et al. Zein nanoparticles for oral delivery of quercetin: Pharmacokinetic studies and preventive anti-inflammatory effects in a mouse model of endotoxemia[J]. Nanomedicine:Nanotechnology, Biology, and Medicine,2017,13(1):103−110. doi: 10.1016/j.nano.2016.08.033
[59] LUQUE-ALCARAZ A G, VELAZQUEZ-ANTILLÓN M, HERNÁNDEZ-TÉLLEZ C N, et al. Antioxidant effect of nanoparticles composed of zein and orange (Citrus sinensis) extract obtained by ultrasound-assisted extraction[J]. Materials,2022,15(14):4838. doi: 10.3390/ma15144838
[60] LI R, HUANG L, ZHANG Z, et al. Integrated multispectroscopic analysis and molecular docking analyses of the structure-affinity relationship and mechanism of the interaction of flavonoids with zein[J]. Food Chemistry,2022,386:132839. doi: 10.1016/j.foodchem.2022.132839
[61] 中华人民共和国国家卫生和计划生育委员会. GB 29941-2013 食品安全国家标准 食品添加剂 脱乙酰甲壳素(壳聚糖)[S]. 北京: 中国标准出版社. The State Health and Family Planning Commission of the People’s Republic of China. GB 29941-2013 National food safety standard. Food additive. Deacetylated chitin (Chitosan)[S]. Beijing: China Standards Press.
[62] SONIN D, POCHKAEVA E, ZHURAVSKII S, et al. Biological safety and biodistribution of chitosan nanoparticles[J]. Nanomaterials,2020,10(4):810. doi: 10.3390/nano10040810
[63] CALVO P, REMUÑÁN-LÓPEZ C, VILA-JATO J L, et al. Novel hydrophilic chitosan-polyethylene oxide nanoparticles as protein carriers[J]. Journal of Applied Polymer Science,1997,63(1):125−132. doi: 10.1002/(SICI)1097-4628(19970103)63:1<125::AID-APP13>3.0.CO;2-4
[64] KUMAR S P, BIRUNDHA K, KAVERI K, et al. Antioxidant studies of chitosan nanoparticles containing naringenin and their cytotoxicity effects in lung cancer cells[J]. International Journal of Biological Macromolecules,2015,78:87−95. doi: 10.1016/j.ijbiomac.2015.03.045
[65] MAHMOUDI R, TAJALI ARDAKANI M, HAJIPOUR VERDOM B, et al. Chitosan nanoparticles containing Physalis alkekengi-L extract: Preparation, optimization and their antioxidant activity[J]. Bulletin of Materials Science,2019,42(3):131. doi: 10.1007/s12034-019-1815-3
[66] NALINI T, BASHA S K, MOHAMED SADIQ A M, et al. Development and characterization of alginate/chitosan nanoparticulate system for hydrophobic drug encapsulation[J]. Journal of Drug Delivery Science and Technology,2019,52:65−72. doi: 10.1016/j.jddst.2019.04.002
[67] PEDROSO-SANTANA S, FLEITAS-SALAZAR N. Ionotropic gelation method in the synthesis of nanoparticles/microparticles for biomedical purposes[J]. Polymer International,2020,69(5):443−447. doi: 10.1002/pi.5970
[68] CAMPELO P H, SANT’ANA A S, PEDROSA SILVA CLERICI M T. Starch nanoparticles: Production methods, structure, and properties for food applications[J]. Current Opinion in Food Science,2020,33:136−140. doi: 10.1016/j.cofs.2020.04.007
[69] XIA W, ZHENG B, LI T, et al. Fabrication, characterization and evaluation of myricetin adsorption onto starch nanoparticles[J]. Carbohydrate Polymers,2020,250:116848. doi: 10.1016/j.carbpol.2020.116848
[70] XIA W, HE D, FU Y, et al. Advanced technology for nanostarches preparation by high speed jet and its mechanism analysis[J]. Carbohydrate Polymers,2017,176:127−134. doi: 10.1016/j.carbpol.2017.08.072
[71] REMANAN M K, ZHU F. Encapsulation of rutin using quinoa and maize starch nanoparticles[J]. Food Chemistry,2021,353:128534. doi: 10.1016/j.foodchem.2020.128534
[72] FARRAG Y, IDE W, MONTERO B, et al. Preparation of starch nanoparticles loaded with quercetin using nanoprecipitation technique[J]. International Journal of Biological Macromolecules,2018,114:426−433. doi: 10.1016/j.ijbiomac.2018.03.134
[73] JIANG F, DU C, ZHAO N, et al. Preparation and characterization of quinoa starch nanoparticles as quercetin carriers[J]. Food Chemistry,2022,369:130895. doi: 10.1016/j.foodchem.2021.130895
[74] MAXWELL E G, BELSHAW N J, WALDRON K W, et al. Pectin–An emerging new bioactive food polysaccharide[J]. Trends in Food Science & Technology,2012,24(2):64−73.
[75] DE MOURA F A, MACAGNAN F T, DOS SANTOS L R, et al. Characterization and physicochemical properties of pectins extracted from agroindustrial by-products[J]. Journal of Food Science and Technology,2017,54(10):3111−3117. doi: 10.1007/s13197-017-2747-9
[76] FATHI M, MARTÍN Á, MCCLEMENTS D J. Nanoencapsulation of food ingredients using carbohydrate based delivery systems[J]. Trends in Food Science & Technology,2014,39(1):18−39.
[77] YU C Y, WANG Y M, LI N M, et al. In vitro and in vivo evaluation of pectin-based nanoparticles for hepatocellular carcinoma drug chemotherapy[J]. Molecular Pharmaceutics,2014,11(2):638−644. doi: 10.1021/mp400412c
[78] HU Y, ZHANG W, KE Z, et al. In vitro release and antioxidant activity of Satsuma mandarin (Citrus reticulata Blanco cv. unshiu) peel flavonoids encapsulated by pectin nanoparticles[J]. International Journal of Food Science & Technology,2017,52(11):2362−2373.
[79] CHEN Y, JIANG Y, WEN L, et al. Structure, stability and bioaccessibility of icaritin-loaded pectin nanoparticle[J]. Food Hydrocolloids,2022,129:107663. doi: 10.1016/j.foodhyd.2022.107663
[80] WU J G, GE J, ZHANG Y P, et al. Solubility of genistein in water, methanol, ethanol, propan-2-ol, 1-butanol, and ethyl acetate from (280 to 333) K[J]. Journal of Chemical & Engineering Data,2010,55(11):5286−5288.
[81] WANG N, FU Q, YANG G. Determination of the solubility, dissolution enthalpy and entropy of icariin in water, ethanol, and methanol[J]. Fluid Phase Equilibria,2012,324:41−43. doi: 10.1016/j.fluid.2012.03.022
[82] ZI J, PENG B, YAN W. Solubilities of rutin in eight solvents at T=283.15, 298.15, 313.15, 323.15, and 333.15 K[J]. Fluid Phase Equilibria,2007,261(1):111−114.
[83] 中华人民共和国卫生部. 中华人民共和国卫生部公告2010年第17号[J]. 中国食品卫生杂志,2011,23(1):84. [Ministry of Health, PRC. Announcement No. 17, 2010 of the Ministry of Health of the People’s Republic of China[J]. Chinese Journal of Food Hygiene,2011,23(1):84. Ministry of Health, PRC. Announcement No. 17, 2010 of the Ministry of Health of the People’s Republic of China[J]. Chinese Journal of Food Hygiene, 2011, 23 (1): 84.
[84] 中华人民共和国国家卫生和计划生育委员会. 关于批准番茄籽油等9种新食品原料的公告[J]. 中国食品卫生杂志,2015,27(1):84. [The State Health and Family Planning Commission of the People’s Republic of China. Announcement on the approval of nine new food ingredients including tomato seed oil[J]. Chinese Journal of Food Hygiene,2015,27(1):84. The State Health and Family Planning Commission of the People’s Republic of China. Announcement on the approval of nine new food ingredients including tomato seed oil[J]. Chinese Journal of Food Hygiene, 2015, 27 (1): 84.
[85] ҪIÇEK S S. Structure-dependent activity of plant-derived sweeteners[J]. Molecules,2020,25(8):1946. doi: 10.3390/molecules25081946
[86] 邢金锋, 王稳航. 天然色素的来源、分类、稳定化及其在可食包装中的应用[J]. 食品与发酵工业,2021,47(13):286−295. [XING J, WANG W. Source, classification, and stabilization of natural pigments and its application in edible packaging[J]. Food and Fermentation Industries,2021,47(13):286−295. doi: 10.13995/j.cnki.11-1802/ts.025546 XING J, WANG W. Source, classification, and stabilization of natural pigments and its application in edible packaging[J]. Food and Fermentation Industries, 2021, 47(13): 286-295. doi: 10.13995/j.cnki.11-1802/ts.025546
[87] 李光辉, 孙思胜, 高雪丽, 等. 天然产物对食源性致病菌的抑菌机制研究进展[J]. 食品安全质量检测学报,2018,9(4):694−698. [LI G, SUN S, GAO X, et al. Research progress on the antibacterial mechanism of natural products to foodborne pathogenic bacteria[J]. Journal of Food Safety & Quality,2018,9(4):694−698. doi: 10.3969/j.issn.2095-0381.2018.04.002 LI G, SUN S, GAO X, et al. Research progress on the antibacterial mechanism of natural products to foodborne pathogenic bacteria[J]. Journal of Food Safety & Quality, 2018, 9(4): 694-698. doi: 10.3969/j.issn.2095-0381.2018.04.002
[88] 王金梅, 韦翠兰, 欧阳颖. 一种水溶性的槲皮素纳米颗粒及其制备方法: CN201710717633.8[P]. 2017-12-15. WANG J, WEI C, OUYANG Y. A water-soluble quercetin nanoparticles and its preparation method: CN201710717633.8[P]. 2017-12-15.
[89] 丁传波, 刘文丛, 郑毅男, 等. 一种花旗松素纳米微粒的制备及其在保健用品和食品中的应用: CN202010464381.4[P]. 2020-09-25. DING C, LIU W, ZHENG Y, et al. Preparation of a nano particle of Douglas fir and its application in health products and food: CN202010464381.4[P]. 2020-09-25.
-
期刊类型引用(3)
1. 陈思柳,容舒婷,陈丽艳,郭松,陈碧. 发酵温度对甘蔗茶酒的品质影响. 食品工业. 2024(10): 16-22 .  百度学术
百度学术
2. 邓乔允,夏爽,韩小雨,游义琳,黄卫东,战吉宬. 梨酒中酵母的研究进展. 食品与发酵工业. 2024(21): 349-356 .  百度学术
百度学术
3. 曾朝珍,慕钰文,袁晶,宋娟,张海燕,康三江. 不同发酵温度对苹果酒理化性质及香气成分的影响. 中国酿造. 2023(12): 192-197 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:
 下载:
下载:



