Research Progress on Formation, Germination and Control Methods of Bacterial Spores
-
摘要: 细菌芽孢因其特殊的结构和生理过程,对各种杀菌处理有极强的抗性,常导致热杀菌食品腐败变质。因此,在食品工业中控制芽孢萌发或灭活芽孢具有重要意义。本文综述了细菌芽孢的结构及形成过程和产孢调控机制,芽孢萌发过程及芽孢萌发影响因素,在芽孢的控制技术方面列举了部分物理控制技术(如热处理、超声处理、高压处理、等离子体处理等)、化学控制技术(如表面活性剂、化学防腐剂等)和生物控制技术单独处理芽孢或与其他处理技术相结合对芽孢的灭活效果及相关机制,以期为开发更安全、高效的芽孢控制技术提供参考。Abstract: Bacterial spores are extremely resistant to various processing techniques attributable to its special structure and physiological processes, and often lead to the spoilage of thermally sterilized food. Therefore, it is of great significance to inactivate spores or control spore germination in the food industry. This review summarizes the structure and the sporulation regulation mechanism in the formation process of bacterial spores, germination process and the factors of spore germination; then reviews the effects and mechanisms of action of some physical technologies (i.e., heat treatment, ultrasonic treatment, high pressure treatment and plasma treatment), chemical technologies (i.e., surfactants and chemical preservatives) and natural bio-antibacterial agents individually or in combination with other treatments against spore. This review is expected to provide reference for the development of safer and more efficient control technology of bacterial spores.
-
Keywords:
- bacterial spores /
- formation process /
- germination /
- control technologies
-
细菌芽孢(Spore)是芽孢杆菌属(Bacillus)和梭菌属(Clostridium)等细菌营养体在环境胁迫(如低温、干旱和营养缺乏等)条件下形成的一个圆形或椭圆形、壁厚、含水量低、抗逆性强的休眠体,对各种物理和化学杀菌处理有极强的抗性[1]。芽孢因抗逆性强难以在食品加工过程中被杀灭,因此食品加工后残存的未灭活芽孢待外界环境适宜时可迅速萌发成为细菌营养体,致使食品腐败、变质。如存在于乳品中的蜡样芽孢杆菌的芽孢,若加工过程中未被灭活,在乳品储藏期间会萌发为营养体,不仅导致巴氏杀菌乳的变质,造成经济损失,还会产生腹泻型与呕吐型等毒素,引起食源性疾病的爆发[2]。因而细菌芽孢的灭活是食品杀菌和保藏所面临的主要挑战之一。本文综述了芽孢的结构和形成过程及相关的分子机制、芽孢的萌发过程及芽孢对萌发信号的感应、目前使用的芽孢控制技术对芽孢的作用效果及其机理,以及这些芽孢控制技术单独或与其他技术相结合对芽孢的作用,以期为细菌芽孢控制技术的研究提供参考。
1. 细菌芽孢概述
1.1 芽孢的结构
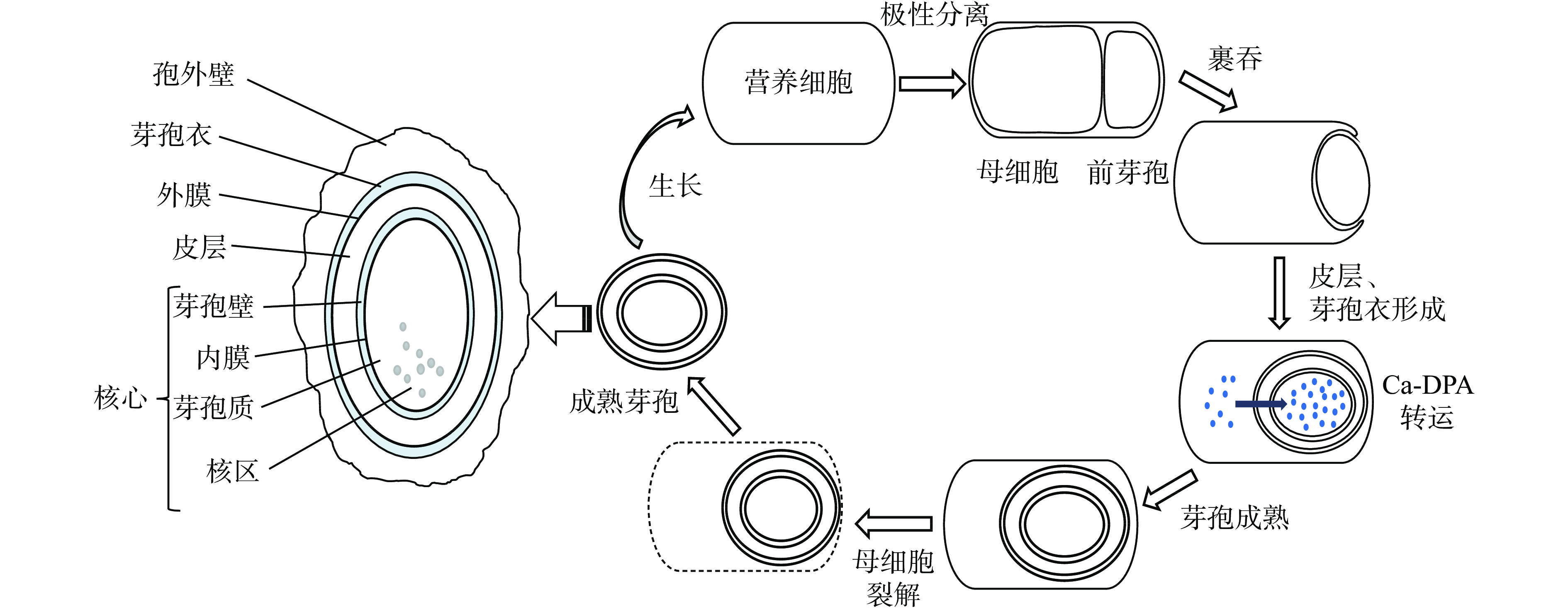
芽孢具有同心壳层形式的多层结构,其多层次结构是芽孢抗逆性的基础。芽孢的结构分别是:孢外壁、芽孢衣、外膜、皮层、芽孢核心。其中,孢外壁和芽孢衣构成芽孢抵御外界环境的第一道屏障。孢外壁主要含脂蛋白,通透性较差,只存在于某些种属(如蜡样芽孢杆菌、艰难梭菌等)的芽孢结构中[3]。芽孢衣是由多种蛋白质组成的多层结构,可保护芽孢免受酶和表面活性剂等物质的损伤。芽孢外膜是芽孢形成的必需结构,但其在芽孢萌发和抵御外界损伤过程中均不起作用。皮层由交联度低的肽聚糖构成,形成了芽孢物理上的刚性结构,可有效保持芽孢的低水分含量。另外,芽孢衣和皮层中分别含有皮层水解酶CwIJ和SleB,可在芽孢萌发时水解皮层,打破芽孢的休眠状态。
芽孢核心包括芽孢壁、内膜层和核区。芽孢壁由肽聚糖组成,可发展为新细胞的壁。内膜层由磷脂双分子层组成,其流动性小、透过性极低,可保护核区DNA免受外来物质损伤。核区含有DNA、RNA和大多数酶以及2, 6-吡啶二羧酸(2, 6-pyridinedicarboxylic acid,DPA)和一些α/β小分子酸溶蛋白(α/β-type small, acid-soluble proteins,SASPs)。DPA可与Ca2+ 螯合形成Ca-DPA并置换核区水分,导致芽孢核心脱水,增强芽孢抗湿热性;SASPs可与DNA紧密结合改变DNA结构和光化学性质,保护DNA免受部分杀菌处理(如热、辐射和化学物质等)导致的损伤。同时,SASPs在芽孢萌发时可降解为氨基酸从而为新蛋白质合成提供原料[4]。
1.2 芽孢的形成
1.2.1 芽孢形成的形态学特征
细菌的芽孢形成过程从形态学上可分为以下五个阶段(图1)[5]:a.轴丝形成:DNA浓缩,形成束状染色质;b.极性隔膜形成:细胞膜内陷形成极性隔膜,该隔膜将菌体分离成遗传物质相同但体积不同的前芽孢和母细胞两部分;c.裹吞作用:母细胞细胞膜快速增长,裹吞前芽孢形成双层膜结构;d.皮层、芽孢衣形成:前芽孢双膜间开始合成肽聚糖等物质形成初生芽孢壁、皮层和芽孢衣,母细胞产生大量Ca-DPA并将其泵入前芽孢中以置换前芽孢核区水分;e.芽孢成熟:母细胞裂解,释放成熟芽孢。
此外,芽孢杆菌属与梭菌属芽孢在皮层、芽孢衣形成与DPA转运过程中稍有不同[6]:芽孢杆菌属芽孢先形成皮层、芽孢衣,后母细胞将DPA泵入前芽孢置换水分;而梭菌属芽孢则在母细胞产生DPA泵入前芽孢后形成皮层、芽孢衣等结构。
1.2.2 芽孢形成的信号分子调控机制
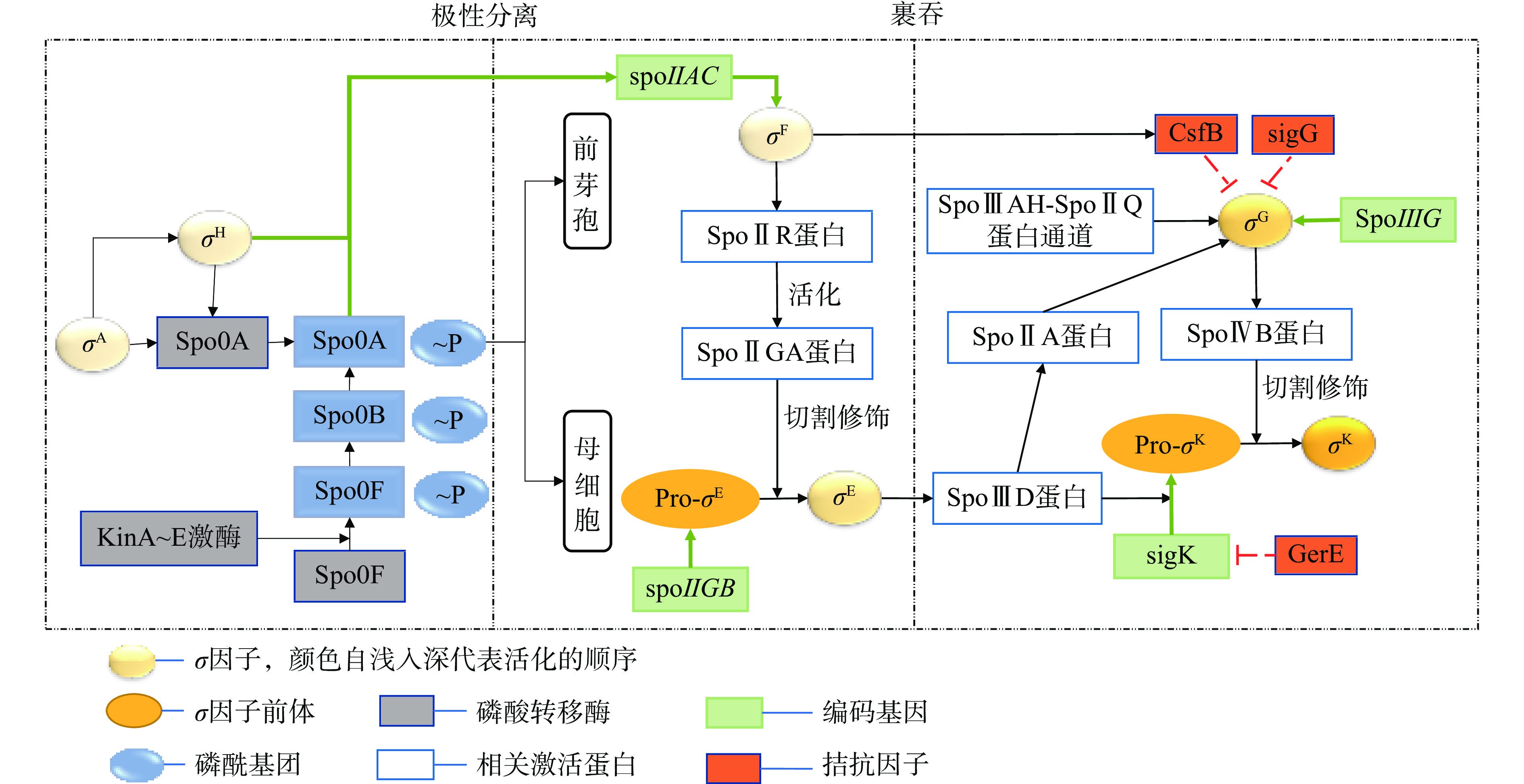
芽孢的形成受信号分子调控,该过程主要在主调节剂Spo0A和特异性的σ因子如前芽孢σ因子(σF、σG)、母细胞σ因子(σE、σK)等调控下完成。芽孢杆菌属尤其是枯草芽孢杆菌芽孢的信号分子调控机制研究较为深入,枯草芽孢杆菌芽孢经信号感应后,自磷酸化组氨酸激酶(KinA~E激酶)直接将磷酸转移酶Spo0F磷酸化,后依次将磷酸转移到主调节剂Spo0A(细胞进入芽孢形成期的关键应答调节蛋白),使得主调节剂Spo0A被激活[6]。当Spo0A的含量和磷酸化水平达到一定阈值时,磷酸化的Spo0A通过调控一系列芽孢形成相关基因(如spoIIA、spoIIE、spoIIG等)启动产孢(图2)。
产孢过程中,转录调节因子Spo0A和σ因子(是正确识别转录过程中启动子的关键因子)在母细胞和前芽孢的不同阶段相继活化,其中特异性的σ因子σH和Spo0A共同调控前芽孢的基因表达启动菌体产孢[7]。极性隔膜形成前菌体依赖σH的活性产孢;极性分离后Spo0A诱导前芽孢和母细胞中的σF和σE活化,σF和σE可促使母细胞裹吞前芽孢;裹吞完成后,
σE和σF可调控σG和σK的活化,并在σG和σK作用下形成皮层、芽孢衣等结构,最终导致母细胞裂解,芽孢游离出来。 σ因子在芽孢形成的不同阶段特定表达、发挥作用。极性分离后,前芽孢中σF立即被Spo0A活化,σF主要控制基因在母细胞和前芽孢中的不对称表达,并指导早期芽孢发育所需的基因以及编码σG的sigG基因的转录[8]。在母细胞中,σE在σF作用下被活化,σE可阻止母细胞进行第二次不对称分裂,促进母细胞对前芽孢的裹吞,并控制许多形态发生蛋白的表达(如调控芽孢衣的组装);此外,σE可调控母细胞产生大量膜蛋白(如与前芽孢DPA积累有关的SpoVV转运蛋白)[8]。裹吞完成后,前芽孢中σG发挥活性取代σF,σG主要调控DNA结合蛋白(该蛋白可调控DPA积累、萌发受体蛋白合成等过程)的表达[9]。母细胞中σK取代σE,σK负责芽孢衣相关蛋白的合成,并可调控皮层形成相关酶的合成。另外,σK控制母细胞合成DPA合酶SpoVFAB,该酶可将二羟基二吡啶甲酸转化为DPA,并将高水平DPA泵入前芽孢,使得前芽孢DPA积累[10]。此外,研究发现σA是枯草芽孢杆菌唯一必需的σ因子,σA降解会使芽孢萌发生长受阻[11]。
梭菌属芽孢与芽孢杆菌属芽孢具有不同的信号分子调控机制,如艰难梭菌芽孢在σH作用下磷酸化Spo0A,其后以类似于枯草芽孢杆菌芽孢的调控机制进行调控,即前芽孢中表达σF和σG,母细胞中表达σE和σK,但其σ因子的激活过程基本相互独立,并发现σG的表达可能由Spo0A激活[12]。相对于枯草芽孢杆菌和艰难梭菌,产气荚膜梭菌和肉毒梭菌芽孢在σK作用下激活Spo0A转录,启动芽孢的形成,产气荚膜梭菌芽孢中σK可调控σF、σE活化并表达,肉毒梭菌芽孢中σK调控σF活化并表达。产气荚膜梭菌和肉毒梭菌芽孢中σF和σK的产生具相互依赖性,且σK缺失将导致母细胞无法完成裹吞过程,而σE缺失会导致产孢阶段停滞,无法形成芽孢[6]。
2. 细菌芽孢的萌发
芽孢萌发是指在适宜条件下,芽孢经历DPA释放、皮层水解等一系列连续的降解事件,使休眠的芽孢萌发成新的营养体的过程。芽孢一旦开始萌发,其会迅速丧失对多种芽孢控制技术的抵抗力,使得芽孢易于被杀灭。
2.1 萌发过程
细菌芽孢虽处于休眠状态但其仍可感知外界环境的变化,当外界营养适宜尤其是有萌发剂存在时芽孢便可迅速萌发。以芽孢杆菌属芽孢为例,当萌发剂存在时,其芽孢衣外层GerP蛋白结构发生可逆性变化,促使萌发剂渗入芽孢中,与芽孢内膜(IM)中的相应受体相互作用并诱导芽孢启动萌发[1]。随后萌发信号开始转导,启动萌发的第一阶段,即H+、Na+等离子和Ca-DPA释放,芽孢折光性逐渐消失,芽孢核心部分水化。释放的Ca-DPA激活皮层水解酶启动萌发的第二阶段,即皮层开始水解,核心进一步水化、膨胀,核内新陈代谢相关的酶类活性恢复,芽孢完成萌发。之后芽孢开始后续代谢活动,转到营养体的生长阶段,此时芽孢中的多种蛋白质发生降解为新物质的合成提供原料[13]。
与芽孢杆菌属芽孢萌发不同,梭菌属芽孢如产气荚膜梭菌、艰难梭菌芽孢感知萌发剂的诱导进行萌发后,先产生皮层水解酶(SleC)诱导皮层水解,后释放Ca-DPA,致使核心水化、膨胀,内膜流动性增加,进而完成萌发[6]。
2.2 萌发剂
萌发剂是能与芽孢内物质结合后促使芽孢萌发的物质,包括营养性萌发剂(如一些特定的营养性物质)和非营养性萌发剂(如外源性Ca-DPA、十二烷基胺、肽聚糖)等。
2.2.1 营养性萌发剂
自然条件下,一些特定的营养性萌发剂(如特定的氨基酸类、嘌呤核苷类、糖类和特定的胆酸盐等)可与芽孢内膜上萌发受体蛋白GRs(germinant receptors,GRs)结合,诱导芽孢进行生理性萌发。其中氨基酸类物质如L-丙氨酸、L-缬氨酸、亮氨酸和脯氨酸等可与不同芽孢的萌发受体蛋白结合,单独触发芽孢萌发,如L-丙氨酸可分别与枯草芽孢杆菌GerA萌发受体蛋白复合物和蜡样芽孢杆菌的GerL或GerR萌发受体蛋白结合,诱导芽孢萌发;L-缬氨酸可与枯草芽孢杆菌GerA萌发受体蛋白复合物结合,诱导芽孢萌发[14]。亮氨酸和脯氨酸可分别与巨大芽孢杆菌GerU萌发受体蛋白结合,诱导芽孢萌发。嘌呤核苷类物质如肌苷可与蜡样芽孢杆菌的GerR、GerQ或GerI萌发受体蛋白结合,诱导芽孢萌发[15]。此外,一些氨基酸和糖类物质的混合物如L-天冬酰胺、D-葡萄糖、D-果糖和K+混合物(AGFK)可与枯草芽孢杆菌GerB和GerK萌发受体蛋白结合,诱导芽孢萌发;L-半胱氨酸、L-丝氨酸、L-苏氨酸、L-天冬酰胺和KCl的混合物可与产气荚膜梭菌芽孢的脂蛋白GerKC结合,诱导芽孢萌发。胆酸衍生物如牛磺胆酸盐可被艰难梭菌芽孢中所含丝氨酸蛋白酶CspC感应并在共激活剂(甘氨酸、钙离子)作用下促使芽孢萌发,但鹅去氧胆酸对该过程具拮抗作用[16]。
2.2.2 非营养性萌发剂
芽孢还可被不依赖GRs的非营养性萌发剂诱导萌发,如外源性Ca-DPA、十二烷基胺、肽聚糖等。其中外源性Ca-DPA可激活芽孢皮层水解酶CwlJ,该酶可水解皮层肽聚糖,引起芽孢内源性Ca-DPA释放,释放的内源性Ca-DPA再次激活皮层水解;十二烷基胺激活SpoVA蛋白通道释放内源性Ca-DPA,然后内源性Ca-DPA触发皮层水解。即外源性Ca-DPA和十二烷基胺皆可诱导芽孢内源性Ca-DPA释放、皮层水解完成萌发[17]。肽聚糖可与梭状芽孢杆菌芽孢内膜上真核样丝氨酸/苏氨酸激酶PrkC结合,诱导芽孢内源性Ca-DPA释放,进而诱导芽孢萌发。Liang等[18]发现肽聚糖低至0.1 μg/mL也具有诱导枯草芽孢杆菌和产孢梭菌芽孢萌发的作用。此外,肽聚糖来源不同,诱导芽孢萌发的情况也不同,如朱瑶迪等[19]发现仅产气荚膜梭菌营养体所含肽聚糖可诱导产气荚膜梭菌芽孢萌发,而芽孢皮层肽聚糖对诱导芽孢萌发基本无影响。
2.3 萌发相关的物理因素
物理因素如压力、温度、pH、水分活度(aw)等是影响芽孢萌发的另一主要因素。研究表明,150 MPa~600 MPa的压力处理可诱导芽孢萌发,但不同压力诱导机制不同。100~200 MPa压力可通过激活GRs诱导萌发;500~600 MPa高压可激活芽孢内膜中的SpoVA蛋白通道,诱导Ca-DPA释放,进而诱导芽孢萌发[20]。此外,一些对芽孢萌发水平与芽孢培养条件之间关系的研究表明,温度、pH、aw等过高或过低均会抑制芽孢的萌发。如枯草芽孢杆菌和蜡样芽孢杆菌的芽孢在最适生长温度37 ℃条件下培养,其萌发率高于30 ℃培养。Soni等[21]发现pH降低可抑制芽孢萌发,如pH为4可完全阻止蜡样芽孢杆菌芽孢萌发;与之相似,徐茜茜[22]研究发现pH降低可导致酸土脂环酸芽孢杆菌芽孢萌发过程延长甚至孢外壁损伤。Rao等[17]发现aw值降至0.92可抑制枯草芽孢杆菌和蜡样芽孢杆菌芽孢的萌发。因此,低温、低pH、低aw等条件均可抑制芽孢的萌发生长。
部分萌发影响因素与芽孢的相互作用如表1所示。
表 1 部分芽孢与萌发影响因素的相互作用Table 1. Interaction between some spores and influencing factors of germination萌发因素 芽孢 萌发剂及萌发因素 作用位点 作用方式 参考文献 营养性萌发剂 枯草芽孢杆菌芽孢 L-丙氨酸或L-缬氨酸 GerA受体蛋白 激活GRs,诱导Ca-DPA [17] AGFK GerB和GerK受体蛋白 蜡样芽孢杆菌芽孢 L-丙氨酸 GerR、GerL受体蛋白 [14] 肌苷 GerR、GerQ、GerI受体蛋白 巨大芽孢杆菌芽孢 葡萄糖,亮氨酸和脯氨酸等营养物质 GerU受体蛋白 [15] 产气荚膜梭菌 L-半胱氨酸、L-丝氨酸、L-苏氨酸、L-天冬酰胺和KCl混合物 GerKC受体蛋白 打开SpoVA蛋白通道,释放Ca-DPA,激活皮层水解酶 [6] 艰难梭菌 胆酸衍生物 丝氨酸蛋白酶CspC 激活皮层水解酶SleC,后打开SpoVA蛋白通道,释放Ca-DPA [16] 非营养性萌发剂 芽孢杆菌属和梭菌属芽孢 外源性Ca-DPA 皮层水解酶CwlJ 激活CwlJ,水解皮层,触发Ca-DPA释放 [17] 十二烷基胺 SpoVA蛋白通道 激活SpoVA蛋白通道,释放Ca-DPA,触发皮层水解 芽孢杆菌属和梭菌属芽孢 肽聚糖 真核样丝氨酸/苏氨酸激酶PrkC 诱导Ca-DPA释放 [18] 部分物理因素 芽孢杆菌属和梭菌属芽孢 100~200 MPa压力 萌发受体蛋白 激活GRs,诱导Ca-DPA释放 [20] 500~600 MPa高压 SpoVA蛋白通道 诱导Ca-DPA释放,激活皮层水解酶,使皮层水解 蜡样芽孢杆菌芽孢 70 ℃处理30 min L-丙氨酸消旋酶 失活L-丙氨酸消旋酶,增强芽孢对萌发剂的反应 [21] pH 尚无研究 pH降低可抑制芽孢萌发 芽孢杆菌属芽孢 aw 尚无研究 aw降低可抑制非营养性萌发剂诱导的芽孢萌发 [17] 3. 芽孢的控制技术及其应用
在极端环境中,芽孢休眠体可以存活数百年甚至几百万年[23]。若食品原料或加工过程中处理不当则很容易受其污染,导致食品腐败、变质甚至引起食源性疾病,造成严重危害。因此,必须对芽孢进行严格控制以保障食品安全。芽孢的控制技术主要包括物理控制技术、化学控制技术和生物控制技术三类,表2列举了部分控制技术对芽孢的灭活效果及机制。
表 2 部分控制技术对芽孢的作用效果及机制Table 2. The effect and mechanism of some control technologies on spores控制技术 控制手段 芽孢 技术参数 作用效果 作用机制 参考文献 物理控制
技术常规热处理 蜡样芽孢杆菌 大米为处理基质,90.5、95、99 ℃分别加热300、180、60 min 芽孢数量减少>5 logs 致使芽孢变形、芽胞膜损伤,孢内成分泄漏 [26] 欧姆加热处理 枯草芽孢杆菌 121 ℃处理4.4 s 芽孢数量减少2.2 logs 干扰芽孢核心成分,致使失活 [25] 超声处理 枯草芽孢杆菌 全脂牛奶为基质,
1.1 W/mL超声
处理5 min芽孢耐热性降低D100℃从4.51 min降至2.94 min 降低芽孢的耐热性 [28] HPCD处理 枯草芽孢杆菌PS533 6.5 MPa、30 ℃
处理30 min芽孢耐湿热性降低 增加内膜通透性,增加核心蛋白质敏感性 [46] 枯草芽孢杆菌 20 MPa、84~86 ℃ HPCD处理 致使DPA释放、芽孢衣破损、内膜破损 破坏芽孢内膜、芽孢衣
结构及参与芽孢生长的
成分或结构PAW处理 蜡样芽孢杆菌ATCC 11778-3 55 ℃、低BSA浓度、低芽孢浓度、低PAW活化量(50 mL) 芽孢数量降低
1.62~2.96 logs产生ROS、RNS等成分导致芽孢多层结构受损和孢内成分
泄漏[36] UV222处理 枯草芽孢杆菌、艰难梭菌、蜡样芽孢杆菌、苏云金芽孢杆菌 CARE222灯、23 ℃进行UV222照射 芽孢可被营养性萌发剂诱导萌发,但无法生长 导致DNA链断裂,产生嘧啶二聚体及芽孢特异性光产物等 [39] UV222、254处理 酸土脂环芽孢杆菌ATCC 49025 222 nm KrCl激发光处理与254 nm UV处理 222 nm KrCl激发光处理对芽孢的灭活作用优于254 nm UV辐射 破坏芽孢DNA完整性;KrCl激发光使芽孢内膜脂质过氧化,引起内膜损伤 [38] 脉冲光处理 枯草芽孢杆菌 10.8 J/cm2 脉冲光处理 芽孢数量减少>6 logs 切断氨基酸键使芽孢衣所含部分蛋白降解或分离,致使芽孢衣损伤 [41] HPTP处理 酸土脂环酸芽孢杆菌 600 MPa、80 ℃
处理1 min芽孢数量减少
4.1~4.5 logs芽孢形态改变,芽孢衣破损、核心中空变扁、芽孢裂解 [43] TS处理 枯草芽孢杆菌 6.67 W/mL 、80 ℃
处理40 min芽孢数量减少
1.8±0.14 log CFU/mL致使皮层受损、部分酶失活,并破坏GRs [31] 化学控制
技术十二烷基胺处理 枯草芽孢杆菌、艰难梭菌芽孢(约108 CFU/ml) 1 mol/L十二烷基胺于
45 ℃处理4 h芽孢失活率达99% 激活CaDPA通道,破坏IM渗透性,消散新陈代谢产生质子动力 [48] CTAB处理 枯草芽孢杆菌、蜡样芽孢杆菌、巨大芽孢杆菌 30 μg/mL CTAB、pH9.4 芽孢开始萌发,相差显微镜观察芽孢处于亮相与暗相之间 诱导芽孢萌发,后进行杀灭 [49] 甘油脂肪酸酯与碳酸化(CH)处理 枯草芽孢杆菌 2 mmol单辛酸甘油酯(MC10)与CH处理
(80 ℃、5 MPa,12 min)对芽孢具协同杀灭作用 CH处理增加芽孢表面疏水性,增强疏水性MC10对芽孢的吸附,引起芽孢内膜损伤,DPA释放,耐热性降低 [50] 微酸性电解水(SAEW)处理 蜡样芽孢杆菌 SAEW(有效氯浓度
60 mg/L)处理5 min芽孢数量减少4 logs 致使内膜损伤,DPA和核心内容物损失 [66] 生物控制
技术ceragenin-13处理 枯草芽孢杆菌芽孢 300 μg/mL ceragenin-13、70 ℃处理 增强芽孢敏感性 激活芽孢CaDPA通道诱导孢内CaDPA释放,引发芽孢萌发,进行灭活 [53] 短小芽孢杆菌噬菌体vB_BpuM_BpSp
裂解酶Ply67处理短小芽孢杆菌、蜡样芽孢杆菌、炭疽芽孢杆菌、苏云金芽孢杆菌、枯草芽孢杆菌和球形芽孢杆菌 pH 1~11和16~85 ℃ 对测试的芽孢均具有裂解活性,可杀灭芽孢 作用于芽孢皮层,导致芽孢结构变形、皮层降解,进而破坏内膜,致使内部物质溶出 [60] 细菌素plantaricin JLA-9处理 蜡样芽孢杆菌 32 µg/mL细菌素JLA-9 灭活萌发芽孢 破坏芽孢膜完整性,从而抑制芽孢萌发的代谢活性、抑制芽孢向营养细胞的生长 [61] 抗菌肽ceragenin-13处理 枯草芽孢杆菌 300 μg/mL ceragenin-13 70 ℃处理 诱导芽孢萌发后
灭活芽孢激活芽孢CaDPA通道诱导CaDPA释放,引发芽孢萌发而后灭活 [53] 甘露糖基赤藓糖醇脂(MEL)处理 蜡样芽孢杆菌 1.25 mg/mL 抑制芽孢萌发过程 在芽孢萌发时,附着于芽孢表面并破坏其蛋白质 [67] HPCD与nisin联用 枯草芽孢杆菌 HPCD(20 MPa+84~86 ℃)和nisin(200 IU/mL) 具协同杀灭芽孢作用,
导致高于2.5 logs的
芽孢失活HPCD破坏芽孢衣及皮层、增强内膜通透性,使得nisin进入芽孢,进一步破坏内膜 [64] 3.1 物理控制技术及其应用
控制芽孢常用的物理手段包括热处理和非热处理(如超声处理、高压处理、辐照处理、等离子体处理等)等技术,这些技术可通过诱导芽孢萌发降低芽孢抗逆性后,配合后续处理灭活芽孢或直接破坏芽孢结构达到杀灭芽孢的目的。
3.1.1 热处理技术及其应用
热处理技术是一种常用的杀菌方法,其作用位点主要为皮层和内膜,高温破坏芽孢皮层、损伤内膜完整性,导致孢内物质泄漏和热抗性降低,进而杀灭芽孢[24]。与常规加热不同,欧姆加热处理则通过干扰芽孢核心成分加剧芽孢失活,但欧姆加热处理与常规加热处理产生不同的灭活机制的原因尚不清楚[25]。
热处理对芽孢灭活的效果受热处理温度、菌株种类、加热方式及诱导萌发处理等工艺的影响。Juneja等[26]发现在相同时间(30 min)内热处理对大米中蜡样芽孢杆菌芽孢的失活效果随处理温度增加而增强:如温度自90.5 ℃升高至99 ℃,可使失活芽孢数量增加2.53 logs;说明提高杀菌温度可以显著缩短处理时间。此外,不同菌株所产芽孢的热抗性也不同:如韦氏芽孢杆菌芽孢的热抗性强于蕈状芽孢杆菌芽孢的热抗性,其中韦氏芽孢杆菌芽孢经107 ℃处理1.4 min使芽孢数量降低4 logs,蕈状芽孢杆菌芽孢仅95 ℃处理1.6 min芽孢数量可减少4 logs[27]。另外,加热方式不同及诱导萌发处理等工艺也会影响热处理对芽孢的灭活作用:Schottroff等[25]发现欧姆加热处理较常规加热对枯草芽孢杆菌芽孢的灭活作用更强(121 ℃处理4.4 s可使芽孢失活增加2.2 logs)。Ansari等[28]研究发现水、全脂牛奶、米粥等介质中的枯草芽孢杆菌芽孢的耐热性不同:水中芽孢的耐热性最弱,米粥中芽孢的耐热性最强,该现象可能与食物的粘稠度和脂肪等成分对微生物的保护作用有关。Buhr等[29]研究发现炭疽芽孢杆菌芽孢经萌发剂处理后对热处理的抗性大大降低:使用萌发剂处理30 min后,经60 ℃热处理1 h可使芽孢数量减少>2 logs,若再次进行萌发诱导处理,则可使芽孢数量减少≥6 logs。李素等[30]发现中温香肠中凝结芽孢杆菌芽孢经葡萄糖诱导萌发后,在后续灌制及杀菌过程中可被有效控制(芽孢生长量低于103 CFU/g)。因而,增加热处理温度、改变食品基质如使用脂肪含量低、流动性强的食品基质或使用萌发剂进行诱导处理等可增强热处理对食品中芽孢的灭活效果。
3.1.2 非热杀菌处理技术及其应用
3.1.2.1 超声处理技术
超声作为一种非热杀菌技术,其产生的剪切和空化效应可破坏芽孢衣的结构、改变芽孢内膜的通透性,导致水分子进入芽孢内部,降低芽孢的耐热性[28]。Fan等[31]发现超声处理对降低芽孢数量无显著影响,但超声处理可降低芽孢对热处理的抗性,使得超声处理与后续热处理产生协同作用。另外,超声处理可使萌发芽孢失活,且该失活效果随超声处理温度的增加而增加:如Fan等[32]发现55和63 ℃超声处理30 min可将枯草芽孢杆菌和蜡样芽孢杆菌萌发芽孢数量分别减少2.06和2.20 logs,说明超声处理作用可能与芽孢萌发状态有关,芽孢经诱导萌发后抗逆性降低,使用超声处理时便可达到灭活效果。Ansari等[28]将超声处理应用于全脂牛奶中的枯草芽孢杆菌芽孢的控制,发现使用114 µm振幅(1.1 W/mL)超声处理5 min可显著降低芽孢耐热性(D100 ℃从4.51 min降至2.94 min)。因而超声技术多与其他杀菌处理如热处理结合以增强其对芽孢的灭活效果。
3.1.2.2 高压处理技术
高压处理通过诱导芽孢萌发,进而破坏萌发芽孢结构显著提高芽孢的热敏感性。Wang等[33]研究发现200 MPa压力处理20 min后结合500 MPa压力处理20 min可破坏萌发芽孢的ATP的合成过程。但压力单独处理对芽孢的灭活作用较弱导致其应用于芽孢的控制效果受限,如550 MPa压力处理25 min仅对枯草芽孢杆菌芽孢造成亚致死性损伤[34]。因此,改进高压处理工艺或以高压为主的复合杀菌技术可能在芽孢的控制领域具有较好的应用潜力。
3.1.2.3 等离子体处理
等离子体是气体在受到外界高能量作用时电离产生的一种物态。利用低温等离子体技术处理水或气体后所得的低温等离子体活性水(plasma activated water,PAW)、大气压冷等离子体等可产生丰富的活性物质,具有灭菌效果好、品质破坏小、无毒副作用等优点,在食品工业中具有广阔应用前景。低温等离子体技术对芽孢作用靶位主要分为芽孢的外部结构及内部成分两种:对于芽孢外部结构,低温等离子体技术可导致芽孢形态改变,其产生的活性氧(ROS)、活性氮(RNS)等物质对芽孢外部结构产生刻蚀作用及改变膜组成成分并破坏GRs蛋白;对于芽孢内部成分,低温等离子体技术可导致孢内DPA释放、酶活性降低,损伤DNA[35]。此外,PAW对芽孢的灭活作用随处理温度的升高而加剧,且牛血清白蛋白等有机物会为芽孢提供屏障以抵抗PAW处理;初始芽孢浓度越低,PAW灭活作用越强,这可能是外层芽孢会为内部芽孢提供物理屏障导致[36]。即较高温度(55 ℃)、低牛血清白蛋白浓度、低芽孢浓度、低PAW活化量(50 mL)可增强PAW对芽孢的灭活作用。因而PAW对芽孢的灭活作用与工艺参数、芽孢所处环境因素等密切相关,导致其应用于芽孢的控制领域的难度增加。
3.1.2.4 辐照处理
辐照处理如UV-C,400 nm蓝光辐射及γ辐射等对芽孢具较好的杀灭作用。辐照处理对芽孢的主要作用位点是DNA,UV辐射导致DNA链断裂产生特定的光产物(嘧啶二聚体如CPD和6-4PP及芽孢特异性光产物等)杀灭休眠芽孢,并可引起高水平的芽孢形成突变[37]。KrCl激发光还可破坏DNA完整性并导致内膜脂质过氧化,引起芽孢内膜损伤[38]。Taylor等[39]发现222 nm辐射(140 μW/cm2)处理可有效杀灭约106 logs的枯草芽孢杆菌、蜡样芽孢杆菌和艰难梭菌芽孢,并发现辐照处理对芽孢的杀灭效果基本不受芽孢浓度的影响。Tremarin等[40]以污染酸土脂环酸芽孢杆菌芽孢的苹果汁为研究对象,发现使用UV-C处理8 min可将苹果汁中的芽孢数量减少5 logs。因此,辐照处理在食品(尤其是液体食品)中的芽孢控制方面有着重要应用,但也需要注意辐照处理产生的自由基可能会对食品的营养成分和感官品质等产生不良影响。
3.1.2.5 脉冲电场处理
脉冲电场处理可利用高压脉冲电源产生的电脉冲作用杀灭芽孢。脉冲光对芽孢的作用位点为芽孢衣,脉冲光处理可通过切割氨基酸键对芽孢衣所含部分蛋白进行降解或分离达到杀灭芽孢的目的。Clair等[41]使用脉冲光处理细菌芽孢,发现10.8 J/cm2 脉冲光处理可使枯草芽孢杆菌芽孢数量减少>6 logs。Soni等[42]发现高压脉冲电场在低电场强度(9.4 kV/cm)和中温(80 ℃)条件下可将蜡样芽孢杆菌芽孢数量减少3.1 logs。并揭示该处理可使涉及肽聚糖降解的寡糖脱乙酰酶的基因(BC1768)上调,芽孢形成时分离所需的青霉素结合蛋白的基因(BC2729)下调。
3.1.3 热处理与非热物理杀菌技术联合应用
非热物理杀菌技术(如高压、超声等)与热处理结合不仅具协同杀灭芽孢的作用,而且可降低热处理导致的食品营养物质损失[40]。其中,高压联合热处理(high pressure and thermal processing,HPTP)可引起芽孢形态改变,导致部分芽孢膜、芽孢衣受损、核心中空变扁甚至导致芽孢裂解。HPTP对芽孢的杀灭时间随处理温度的增高而缩短(如600 MPa时,80 ℃处理5 min或90 ℃处理1 min均可灭活酸土脂环酸芽孢杆菌芽孢)[43]。董鹏[44]使用350 MPa结合150 ℃处理0.24 s,可将牛奶中解淀粉芽孢杆菌芽孢数量降低3.5 logs。刘月[45]研究发现HPTP(600 MPa,75 ℃处理20 min)结合溶菌酶处理(0.05%)可有效灭活番茄汁中的枯草芽孢杆菌芽孢,且该处理不会明显影响番茄汁的营养和感官品质。但HPTP处理芽孢时存在短时处理灭活芽孢效果较差或高强度处理影响食品品质的问题,而HPTP处理与其他技术联用虽可降低HPTP对食品品质的不利影响,但HPTP处理与其他技术结合应用也导致操作步骤和成本的增加。此外,高压与其他处理技术联合如高压二氧化碳处理(high pressure carbon dioxide,HPCD)被应用于芽孢的控制领域,HPCD处理可增加内膜通透性、破坏芽孢衣结构及芽孢核心成分,从而导致芽孢失活[46]。但目前HPCD对芽孢灭活的数学模型还需进一步研究以确定其应用于芽孢灭活最佳工艺条件。
此外,热辅助超声波处理(thermosonication,TS)可损伤皮层和内膜,致使芽孢皮层部分酶(如皮层转移酶)失活,致使内膜GRs被破坏,部分蛋白泄漏,从而导致芽孢失活[31]。TS对芽孢的灭活效果随超声密度增加而增加:Fan等[31]研究发现超声波与80 ℃热处理联合使用40 min,超声波由6.67 W/mL增加至20 W/mL 会使枯草芽孢杆菌芽孢数量额外减少约0.45 logs。且TS处理对嗜冷蜡样芽孢杆菌芽孢的杀灭效果优于HPTP处理[47]。另外,超声预处理可降低热处理55%的热能需求,起到一定的节能作用[28]。
3.2 化学控制技术及其应用
控制芽孢常用的化学技术主要是通过添加一些化学类抑菌物质(如表面活性剂、化学防腐剂、商业消毒剂等)达到抑制或杀灭芽孢的作用。
3.2.1 表面活性剂
一些表面活性剂对芽孢具一定的杀灭作用,如阳离子表面活性剂十二烷基胺和十六烷基三甲基溴化铵(CTAB)不仅可诱导芽孢萌发,还能整合到萌发的芽孢内膜中破坏内膜渗透性对萌发芽孢起到杀灭作用。Mokashi等[48]使用1 mol/L十二烷基胺于45 ℃处理枯草芽孢杆菌、艰难梭菌芽孢(约108 CFU/mL)4 h发现芽孢灭活率高达99%。并发现十二烷基胺会消散萌发芽孢新陈代谢产生质子动力。Dong等[49]使用CTAB及其类似物(TAB、DTAB等)处理蜡样芽孢杆菌和巨大芽孢杆菌的芽孢,发现CTAB可诱导蜡样芽孢杆菌和巨大芽孢杆菌芽孢萌发,进而杀灭萌发芽孢,而TAB(C-14)和DTAB(C-12)诱导芽孢释放CaDPA的效果较差,这可能与烷基链长度有关。Hirokado等[50]发现一些非离子型表面活性剂如甘油脂肪酸酯处理对枯草芽孢杆菌芽孢也具有灭活作用,且甘油脂肪酸酯对芽孢的灭活效果随碳链延长而降低,其中2 mmol单辛酸甘油酯(MC10)对芽孢灭活作用最强。
3.2.2 化学防腐剂
化学防腐剂如硝酸盐、亚硝酸盐、柠檬酸盐等对芽孢的生长具抑制作用。Velugoti等[51]发现柠檬酸钙(Ca-Cit)、柠檬酸钾(K-Cit)和柠檬酸钠(Na-Cit)能抑制腌制火腿和未腌制火腿中的产气荚膜梭菌芽孢的萌发和生长,经0.5% Ca-Cit处理6.5 h后两种火腿中芽孢仅生长约0.5 logs,并发现其抑制作用与肉制品冷却时间无关;但对于K-Cit或Na-Cit处理,当肉制品冷却时间延长至12 h以上时,则需1.0%及以上浓度方对芽孢的萌发和生长具抑制作用。Cayemitte等[52]通过添加乳酸钙、抗坏血酸钙实现了鲑鱼中蜡样芽孢杆菌芽孢的高效灭活,使得芽孢数量减少7 logs。
3.2.3 商业消毒剂
一些商业消毒剂如次氯酸钠、过氧乙酸等处理可降低芽孢的存活能力。Ghosh等[53]发现芽孢对次氯酸盐和湿热的抵抗力与培养介质有关,于2×SG产孢平板制备的芽孢次氯酸盐抗性和耐湿热能力明显优于LB平板制备的芽孢。Sudhaus等[54]发现过氧乙酸对蜡样芽孢杆菌芽孢的灭活效果受温度和菌株的影响,如低温会降低过氧乙酸对芽孢的灭活效果;对于不耐受过氧乙酸的蜡样芽孢杆菌DSM 4384芽孢,经2.0%过氧乙酸处理30 min可使芽孢数量减少>6 logs,而耐受过氧乙酸的蜡样芽孢杆菌DSM 4313,需使用3.0%过氧乙酸处理60 min方可达到所需的灭活效果。
3.2.4 其他处理
抗生素、溶菌酶和金属离子等处理也会增强芽孢的敏感性。抗生素如尼生素可对萌发芽孢或去除芽孢衣芽孢发挥抑制作用,其主要在芽孢萌发后期作用于芽孢的内膜导致芽孢死亡[55]。溶菌酶可通过诱导去除芽孢衣芽孢的萌发达到降低芽孢抗逆性的目的[56]。金属离子如Tb3+、Dy3+ 等会扰乱芽孢内膜中Ca-DPA释放通道降低芽孢的萌发速度而对芽孢发挥抑制作用[57]。此外,F−积累会导致枯草芽孢杆菌芽孢耐湿热性显著降低,且F−(10~40 mmol/L)可在pH为5.5时显著抑制芽孢萌发,而芽孢衣及外膜可在一定程度上阻挡芽孢对水、F−等吸收[58]。
3.2.5 化学控制技术与其他技术联合应用
化学抑菌物质与其他技术联用,如过氧乙酸联合超临界二氧化碳技术、微酸性电解水联合超声技术、亚硝酸盐联合γ辐射等技术可协同灭活芽孢。其中,过氧乙酸联合超临界二氧化碳技术对芽孢的作用位点是芽孢膜,其可损害芽孢内膜、破坏膜电位,抑制芽孢萌发时的氧化代谢以灭活芽孢[56]。Setlow等[56]使用7 ppm过氧乙酸与超临界二氧化碳联合处理可在25 min内将枯草芽孢杆菌芽孢数量减少6 logs。微酸性电解水与超声技术联合处理可先通过超声处理破坏芽孢皮层,进而使得酸性电解水破坏内膜完整性,达到协同灭活芽孢的作用[59]。此外,为降低化学防腐剂如亚硝酸盐在食品中的添加量,Silva等[37]以含有较低亚硝酸盐含量(<100 mg/kg)的肉制品为样品,发现肉制品中亚硝酸盐添加量为50 mg/kg时,联合使用γ辐射(>3 kGy)可使肉制品中产孢梭菌芽孢数量减少2 logs及以上,且亚硝酸盐含量和辐射剂量越高对芽孢的杀灭作用越强。化学技术虽然在芽孢控制领域表现出较好的抑制效果,但在使用时应结合实际加工环境考虑其使用剂量及对食品安全性的影响。
3.3 生物控制技术及其应用
3.3.1 生物抑菌剂应用
生物抑菌物质因具有安全性高、对食品感官品质影响小等优点,被应用于芽孢的控制领域。已有研究表明nisin可破坏萌发芽孢膜完整性、抑制膜电位和氧化代谢,从而抑制萌发芽孢的生长,但其对休眠芽孢无抑制作用。Fan等[32]发现枯草芽孢杆菌和蜡样芽孢杆菌芽孢被诱导萌发后对nisin、百里香精油的敏感性增强:nisin(57 μg/mL)可将枯草芽孢杆菌和蜡样芽孢杆菌萌发芽孢数量分别降低1.29~1.64、1.14~1.36 logs。除nisin外,一些微生物源抑菌物质(如一些酶类、脂肽类物质等)和部分天然植物源化合物也可对芽孢起到一定的抑制作用。研究发现,酶类物质中噬菌体vB_BpuM_BpSp裂解酶Ply67可破坏芽孢皮层,导致芽孢结构变形,进而破坏内膜完整性,致使芽孢无法萌发、内部物质溶出从而导致芽孢死亡[60]。Zhao等[61]发现细菌素JLA-9(32 µg/mL)对蜡样芽孢杆菌芽孢具抑制作用,该细菌素可抑制萌发芽孢的代谢活性、破坏芽孢膜完整性从而有效抑制萌发芽孢的生长。Ghosh等[53]研究发现,高浓度抗菌肽ceragenin-13(300 μg/mL)在高温(70 ℃)条件下可激活枯草芽孢杆菌芽孢CaDPA通道诱导孢内CaDPA释放,诱导芽孢萌发增强其敏感性进而灭活芽孢。Cetin-Karaca等[62]发现天然植物源化合物反式肉桂醛(125 mg/L)在23 ℃时可完全抑制婴幼儿米粉中污染的蜡样芽孢杆菌及其芽孢的生长。
3.3.2 生物抑菌剂与其他技术联合应用
目前研究较多的生物抑菌剂联用组合为nisin与高压技术结合使用。Modugno等[63]发现nisin(50 IU/mL)和高压(500 MPa)联用对芽孢杆菌属芽孢具高度协同抑制作用(芽孢数量减少>4 logs),该联合处理通过高压破坏芽孢结构,增强nisin对芽孢的抑制效果,从而发挥协同作用。Fan等[32]发现55 ℃、超声频率为20 kHz的TS处理可增强萌发芽孢对nisin的敏感性(可将枯草芽孢杆菌和蜡样芽孢杆菌萌发芽孢数量分别降低2.38~2.39、1.38~1.50 logs)。Rao等[64]将HPCD处理(20 MPa、84~86 ℃)和nisin(200 IU/mL)联合使用,发现该联合处理对枯草芽孢杆菌芽孢具有协同灭活效果,其通过HPCD处理依次破坏芽孢衣及皮层、增强内膜通透性,使得nisin进入芽孢,进一步破坏内膜,从而发挥协同作用。除nisin外,Cho等[65]使用浓度为1%(w/v)的肉豆蔻、香菜及藏茴香粗提物分别处理枯草芽孢杆菌芽孢,发现三种提取物均可将芽孢数量减少90%以上。后使用提取物与乳酸联合处理,发现提取物浓度0.1%~2.5%(w/v)、pH为4~5时对芽孢灭活作用优于单独处理,可将芽孢数量额外降低1~3 logs。
4. 结语
本文主要从细菌芽孢的形成和萌发过程入手,综述了芽孢形成和萌发的相关机制,并对芽孢的控制手段进行了介绍,发现对芽孢的控制仍以物理和化学技术为主,这些技术虽对芽孢具较好的控制作用,但物理处理如热处理会破坏食品品质、影响营养价值,非热杀菌虽对芽孢具有较好的杀灭效果,但该技术成本较高,对芽孢的杀灭效果易受食品状态、处理工艺参数的影响,且部分非热杀菌技术在分子水平层面对芽孢的灭活机理未完全阐明,在食品中的应用研究较少,导致其在食品工业中的应用受阻;化学控制技术中多数处理仅可用于食品表面设备上芽孢的控制,无法直接应用于食品加工,化学防腐剂如亚硝酸盐虽可直接应用于食品行业,但其仍存在安全性不高等问题。生物抑菌剂因抑菌性能优良、成本低、安全性高等优点,被应用于食品的抗菌保鲜等领域,但该技术在芽孢控制方面的应用较少,且对芽孢的抑制机制还未能完全清楚,仍需对对生物抑菌技术的应用及相关机制进行进一步研究,进而推动生物抑菌技术对食品加工过程中芽孢的应用。因此,未来芽孢的控制技术需要寻找新型绿色、安全、高效的技术,实现高效控制芽孢,保证食品的安全与食用品质。
-
表 1 部分芽孢与萌发影响因素的相互作用
Table 1 Interaction between some spores and influencing factors of germination
萌发因素 芽孢 萌发剂及萌发因素 作用位点 作用方式 参考文献 营养性萌发剂 枯草芽孢杆菌芽孢 L-丙氨酸或L-缬氨酸 GerA受体蛋白 激活GRs,诱导Ca-DPA [17] AGFK GerB和GerK受体蛋白 蜡样芽孢杆菌芽孢 L-丙氨酸 GerR、GerL受体蛋白 [14] 肌苷 GerR、GerQ、GerI受体蛋白 巨大芽孢杆菌芽孢 葡萄糖,亮氨酸和脯氨酸等营养物质 GerU受体蛋白 [15] 产气荚膜梭菌 L-半胱氨酸、L-丝氨酸、L-苏氨酸、L-天冬酰胺和KCl混合物 GerKC受体蛋白 打开SpoVA蛋白通道,释放Ca-DPA,激活皮层水解酶 [6] 艰难梭菌 胆酸衍生物 丝氨酸蛋白酶CspC 激活皮层水解酶SleC,后打开SpoVA蛋白通道,释放Ca-DPA [16] 非营养性萌发剂 芽孢杆菌属和梭菌属芽孢 外源性Ca-DPA 皮层水解酶CwlJ 激活CwlJ,水解皮层,触发Ca-DPA释放 [17] 十二烷基胺 SpoVA蛋白通道 激活SpoVA蛋白通道,释放Ca-DPA,触发皮层水解 芽孢杆菌属和梭菌属芽孢 肽聚糖 真核样丝氨酸/苏氨酸激酶PrkC 诱导Ca-DPA释放 [18] 部分物理因素 芽孢杆菌属和梭菌属芽孢 100~200 MPa压力 萌发受体蛋白 激活GRs,诱导Ca-DPA释放 [20] 500~600 MPa高压 SpoVA蛋白通道 诱导Ca-DPA释放,激活皮层水解酶,使皮层水解 蜡样芽孢杆菌芽孢 70 ℃处理30 min L-丙氨酸消旋酶 失活L-丙氨酸消旋酶,增强芽孢对萌发剂的反应 [21] pH 尚无研究 pH降低可抑制芽孢萌发 芽孢杆菌属芽孢 aw 尚无研究 aw降低可抑制非营养性萌发剂诱导的芽孢萌发 [17] 表 2 部分控制技术对芽孢的作用效果及机制
Table 2 The effect and mechanism of some control technologies on spores
控制技术 控制手段 芽孢 技术参数 作用效果 作用机制 参考文献 物理控制
技术常规热处理 蜡样芽孢杆菌 大米为处理基质,90.5、95、99 ℃分别加热300、180、60 min 芽孢数量减少>5 logs 致使芽孢变形、芽胞膜损伤,孢内成分泄漏 [26] 欧姆加热处理 枯草芽孢杆菌 121 ℃处理4.4 s 芽孢数量减少2.2 logs 干扰芽孢核心成分,致使失活 [25] 超声处理 枯草芽孢杆菌 全脂牛奶为基质,
1.1 W/mL超声
处理5 min芽孢耐热性降低D100℃从4.51 min降至2.94 min 降低芽孢的耐热性 [28] HPCD处理 枯草芽孢杆菌PS533 6.5 MPa、30 ℃
处理30 min芽孢耐湿热性降低 增加内膜通透性,增加核心蛋白质敏感性 [46] 枯草芽孢杆菌 20 MPa、84~86 ℃ HPCD处理 致使DPA释放、芽孢衣破损、内膜破损 破坏芽孢内膜、芽孢衣
结构及参与芽孢生长的
成分或结构PAW处理 蜡样芽孢杆菌ATCC 11778-3 55 ℃、低BSA浓度、低芽孢浓度、低PAW活化量(50 mL) 芽孢数量降低
1.62~2.96 logs产生ROS、RNS等成分导致芽孢多层结构受损和孢内成分
泄漏[36] UV222处理 枯草芽孢杆菌、艰难梭菌、蜡样芽孢杆菌、苏云金芽孢杆菌 CARE222灯、23 ℃进行UV222照射 芽孢可被营养性萌发剂诱导萌发,但无法生长 导致DNA链断裂,产生嘧啶二聚体及芽孢特异性光产物等 [39] UV222、254处理 酸土脂环芽孢杆菌ATCC 49025 222 nm KrCl激发光处理与254 nm UV处理 222 nm KrCl激发光处理对芽孢的灭活作用优于254 nm UV辐射 破坏芽孢DNA完整性;KrCl激发光使芽孢内膜脂质过氧化,引起内膜损伤 [38] 脉冲光处理 枯草芽孢杆菌 10.8 J/cm2 脉冲光处理 芽孢数量减少>6 logs 切断氨基酸键使芽孢衣所含部分蛋白降解或分离,致使芽孢衣损伤 [41] HPTP处理 酸土脂环酸芽孢杆菌 600 MPa、80 ℃
处理1 min芽孢数量减少
4.1~4.5 logs芽孢形态改变,芽孢衣破损、核心中空变扁、芽孢裂解 [43] TS处理 枯草芽孢杆菌 6.67 W/mL 、80 ℃
处理40 min芽孢数量减少
1.8±0.14 log CFU/mL致使皮层受损、部分酶失活,并破坏GRs [31] 化学控制
技术十二烷基胺处理 枯草芽孢杆菌、艰难梭菌芽孢(约108 CFU/ml) 1 mol/L十二烷基胺于
45 ℃处理4 h芽孢失活率达99% 激活CaDPA通道,破坏IM渗透性,消散新陈代谢产生质子动力 [48] CTAB处理 枯草芽孢杆菌、蜡样芽孢杆菌、巨大芽孢杆菌 30 μg/mL CTAB、pH9.4 芽孢开始萌发,相差显微镜观察芽孢处于亮相与暗相之间 诱导芽孢萌发,后进行杀灭 [49] 甘油脂肪酸酯与碳酸化(CH)处理 枯草芽孢杆菌 2 mmol单辛酸甘油酯(MC10)与CH处理
(80 ℃、5 MPa,12 min)对芽孢具协同杀灭作用 CH处理增加芽孢表面疏水性,增强疏水性MC10对芽孢的吸附,引起芽孢内膜损伤,DPA释放,耐热性降低 [50] 微酸性电解水(SAEW)处理 蜡样芽孢杆菌 SAEW(有效氯浓度
60 mg/L)处理5 min芽孢数量减少4 logs 致使内膜损伤,DPA和核心内容物损失 [66] 生物控制
技术ceragenin-13处理 枯草芽孢杆菌芽孢 300 μg/mL ceragenin-13、70 ℃处理 增强芽孢敏感性 激活芽孢CaDPA通道诱导孢内CaDPA释放,引发芽孢萌发,进行灭活 [53] 短小芽孢杆菌噬菌体vB_BpuM_BpSp
裂解酶Ply67处理短小芽孢杆菌、蜡样芽孢杆菌、炭疽芽孢杆菌、苏云金芽孢杆菌、枯草芽孢杆菌和球形芽孢杆菌 pH 1~11和16~85 ℃ 对测试的芽孢均具有裂解活性,可杀灭芽孢 作用于芽孢皮层,导致芽孢结构变形、皮层降解,进而破坏内膜,致使内部物质溶出 [60] 细菌素plantaricin JLA-9处理 蜡样芽孢杆菌 32 µg/mL细菌素JLA-9 灭活萌发芽孢 破坏芽孢膜完整性,从而抑制芽孢萌发的代谢活性、抑制芽孢向营养细胞的生长 [61] 抗菌肽ceragenin-13处理 枯草芽孢杆菌 300 μg/mL ceragenin-13 70 ℃处理 诱导芽孢萌发后
灭活芽孢激活芽孢CaDPA通道诱导CaDPA释放,引发芽孢萌发而后灭活 [53] 甘露糖基赤藓糖醇脂(MEL)处理 蜡样芽孢杆菌 1.25 mg/mL 抑制芽孢萌发过程 在芽孢萌发时,附着于芽孢表面并破坏其蛋白质 [67] HPCD与nisin联用 枯草芽孢杆菌 HPCD(20 MPa+84~86 ℃)和nisin(200 IU/mL) 具协同杀灭芽孢作用,
导致高于2.5 logs的
芽孢失活HPCD破坏芽孢衣及皮层、增强内膜通透性,使得nisin进入芽孢,进一步破坏内膜 [64] -
[1] SETLOW P, CHRISTIE G. Bacterial spore mRNA-What's up with that?[J]. Frontiers in Microbiology,2020,11:596092. doi: 10.3389/fmicb.2020.596092
[2] MARTLBAUER E, GRANUM P E. Bacillus cereus toxins[J]. Toxins,2021,13(5):295−295. doi: 10.3390/toxins13050295
[3] PAREDES-SABJA D, SHEN A, SORG J A. Clostridium difficile spore biology: Sporulation, germination, and spore structural proteins[J]. Trends in Microbiology,2014,22(7):406−416. doi: 10.1016/j.tim.2014.04.003
[4] SWARGE B, NAFID C, VISCHER N, et al. Investigating synthesis of the MalS malic enzyme during Bacillus subtilis spore germination and outgrowth and the influence of spore maturation and sporulation conditions[J]. mSphere,2020,5(4):e00464−20.
[5] LOPEZ-GARRIDO J, OJKIC N, KHANNA K, et al. Chromosome translocation inflates Bacillus forespores and impacts cellular morphology[J]. Cell,2018,172(4):758−770. doi: 10.1016/j.cell.2018.01.027
[6] SHEN A, EDWARDS A N, SARKER M R, et al. Sporulation and germination in clostridial pathogens[J]. Microbiology Spectrum, 2019, 7(6): 10.
[7] GAUVRY E, MATHOT A-G, COUVERT O, et al. Differentiation of vegetative cells into spores: A kinetic model applied to Bacillus subtilis[J]. Applied and Environmental Microbiology,2019,85(10):e00322−19.
[8] SøGAARD-ANDERSEN L, MEARLS E B, JACKTER J, et al. Transcription and translation of the sigG gene is tuned for proper execution of the switch from early to late gene expression in the developing Bacillus subtilis spore[J]. PLOS Genetics,2018,14(4):e1007350. doi: 10.1371/journal.pgen.1007350
[9] WANG S T, SETLOW B, CONLON E M, et al. The forespore line of gene expression in Bacillus subtilis[J]. Journal of Molecular Biology,2006,358(1):16−37. doi: 10.1016/j.jmb.2006.01.059
[10] KEARNS D B, RAMÍREZ-GUADIANA F H, MEESKE A J, et al. A two-step transport pathway allows the mother cell to nurture the developing spore in Bacillus subtilis[J]. PLOS Genetics,2017,13(9):e1007015. doi: 10.1371/journal.pgen.1007015
[11] RILEY E P, TRINQUIER A, REILLY M L, et al. Spatiotemporally regulated proteolysis to dissect the role of vegetative proteins during Bacillus subtilis sporulation: Cell-specific requirement of σH and σA[J]. Molecular Microbiology,2018,108(1):45−62. doi: 10.1111/mmi.13916
[12] SAUJET L, PEREIRA F C, HENRIQUES A O, et al. The regulatory network controlling spore formation in Clostridium difficile[J]. FEMS Microbiology Letters,2014,358(1):1−10. doi: 10.1111/1574-6968.12540
[13] SWARGE B, ABHYANKAR W, JONKER M, et al. Integrative analysis of proteome and transcriptome dynamics during Bacillus subtilis spore revival[J]. Msphere,2020,5(4):e00463−20.
[14] WANG Y, DE BOER R, VISCHER N, et al. Visualization of germination proteins in putative Bacillus cereus germinosomes[J]. International Journal of Molecular Sciences, 2020, 21(15): 5198.
[15] GUPTA S, üSTOK F I, JOHNSON C L, et al. Investigating the functional hierarchy of Bacillus megaterium PV361 spore germinant receptors[J]. Journal of Bacteriology,2013,195(13):3045−3053. doi: 10.1128/JB.00325-13
[16] SHRESTHA R, SORG J A. Hierarchical recognition of amino acid co-germinants during Clostridioides difficile spore germination[J]. Anaerobe,2018,49:41−47. doi: 10.1016/j.anaerobe.2017.12.001
[17] RAO L, FEEHERRY F E, GHOSH S, et al. Effects of lowering water activity by various humectants on germination of spores of Bacillus species with different germinants[J]. Food Microbiology,2018,72:112−127. doi: 10.1016/j.fm.2017.11.012
[18] LIANG D, WANG X, WU X, et al. The effect of high pressure combined with moderate temperature and peptidoglycan fragments on spore inactivation[J]. Food Research International,2021,148:110615. doi: 10.1016/j.foodres.2021.110615
[19] 朱瑶迪, 张佳烨, 李苗云, 等. 不同肽聚糖对肉制品中产气荚膜梭菌芽孢萌发率影响及其定量预测[J]. 农业工程学报,2020,36(4):287−293. [ZHU Yaodi, ZHANG Jiaye, LI Miaoyun, et al. Effect of different peptidoglycan on Clostridium perfringens spores germination and quantitative prediction[J]. Transactions of the Chinese Society of Agricultural Engineering,2020,36(4):287−293. doi: 10.11975/j.issn.1002-6819.2020.04.034 ZHU Yaodi, ZHANG Jiaye, LI Miaoyun, et al. Effect of different peptidoglycan on Clostridium perfringens spores germination and quantitative prediction[J]. Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(4): 287-293. doi: 10.11975/j.issn.1002-6819.2020.04.034
[20] YAMAMOTO K. Food processing by high hydrostatic pressure[J]. Bioscience, Biotechnology, and Biochemistry,2017,81(4):672−679. doi: 10.1080/09168451.2017.1281723
[21] SONI A, OEY I, SILCOCK P, et al. Impact of temperature, nutrients, pH and cold storage on the germination, growth and resistance of Bacillus cereus spores in egg white[J]. Food Research International,2018,106:394−403. doi: 10.1016/j.foodres.2018.01.006
[22] 徐茜茜. 酸土脂环酸芽孢杆菌 (Alicyclobacillus acidoterrestris) 芽孢形成及低pH条件下芽孢萌发的蛋白组学研究[D]. 新乡: 河南科技学院, 2017 XU Xixi. Study on spore formation and proteomics of spore germination atlow pH in Alicyclobacillus acidoterrestris[D]. Xinxiang: Henan Institute of Science and Technology, 2017.
[23] SETLOW P. Spores of Bacillus subtilis: Their resistance to and killing by radiation, heat and chemicals[J]. Journal of Applied Microbiology,2006,101(3):514−525. doi: 10.1111/j.1365-2672.2005.02736.x
[24] ROZALI S N, MILANI E A, DEED R C, et al. Bacteria, mould and yeast spore inactivation studies by scanning electron microscope observations[J]. International Journal of Food Microbiology,2017,263:17−25. doi: 10.1016/j.ijfoodmicro.2017.10.008
[25] SCHOTTROFF F, PYATKOVSKYY T, REINEKE K, et al. Mechanisms of enhanced bacterial endospore inactivation during sterilization by ohmic heating[J]. Bioelectrochemistry,2019,130:107338. doi: 10.1016/j.bioelechem.2019.107338
[26] JUNEJA V K, OSORIA M, HWANG C A, et al. Thermal inactivation of Bacillus cereus spores during cooking of rice to ensure later safety of boudin[J]. Lwt,2020,122:108955. doi: 10.1016/j.lwt.2019.108955
[27] CONDÓN-ABANTO S, ARROYO C, áLVAREZ I, et al. Application of ultrasound in combination with heat and pressure for the inactivation of spore forming bacteria isolated from edible crab (Cancer pagurus)[J]. International Journal of Food Microbiology,2016,223:9−16. doi: 10.1016/j.ijfoodmicro.2016.02.001
[28] ANSARI J A, ISMAIL M, FARID M. Investigation of the use of ultrasonication followed by heat for spore inactivation[J]. Food and Bioproducts Processing,2017,104:32−39. doi: 10.1016/j.fbp.2017.04.005
[29] BUHR T L, MINTER Z A, KENNIHAN N L, et al. Combining spore germination and heat inactivation to decontaminate materials contaminated with Bacillus anthracis spores[J]. Journal of Applied Microbiology,2020,128(1):124−137. doi: 10.1111/jam.14474
[30] 李素, 张顺亮, 任双, 等. 芽孢诱导技术在中温香肠加工中的应用[J]. 肉类研究,2017,31(12):6−10. [LI Su, ZHANG Shunliang, REN Shuang, et al. Application of spore induction technology in the processing of medium temperature sausage[J]. Meat Research,2017,31(12):6−10. LI Su, ZHANG Shunliang, REN Shuang, et al. Application of spore induction technology in the processing of medium temperature sausage[J]. Meat Research, 2017, 31(12): 6-10.
[31] FAN L, ISMAIL B B, HOU F, et al. Thermosonication damages the inner membrane of Bacillus subtilis spores and impels their inactivation[J]. Food Research International,2019,125:108514. doi: 10.1016/j.foodres.2019.108514
[32] FAN L, ISMAIL B B, HOU F, et al. Thermosonication pretreatment enhances the killing of germinated Bacillus spores adhered to stainless steel surface[J]. Lwt,2021,136:110248. doi: 10.1016/j.lwt.2020.110248
[33] WANG L, XIA Q, LI Y. Label free-based proteomic analysis of proteins in Bacillus cereus spores regulated by high pressure processing and slightly acidic electrolyzed water treatment[J]. Food Control,2018,90:392−400. doi: 10.1016/j.foodcont.2018.03.015
[34] 孙静, 张津瑜, 胡小松, 等. 超高压导致芽孢亚致死损伤进而提高芽孢热敏感性[J]. 食品科技,2017(10):313−317. [SUN Jing, ZHANG Jinyu, HU Xiaosong, et al. Ultrahigh pressure processing enhances spore thermal sensitivity by causing sub-lethal damage to spores[J]. Food Science and Technology,2017(10):313−317. doi: 10.13684/j.cnki.spkj.2017.10.059 SUN Jing, ZHANG Jinyu, HU Xiaosong, et al. Ultrahigh pressure processing enhances spore thermal sensitivity by causing sub-lethal damage to spores[J]. Food Science and Technology, 2017, (10): 313-317. doi: 10.13684/j.cnki.spkj.2017.10.059
[35] LIAO X, MUHAMMAD A I, CHEN S, et al. Bacterial spore inactivation induced by cold plasma[J]. Critical Reviews in Food Science and Nutrition,2019,59(16):2562−2572. doi: 10.1080/10408398.2018.1460797
[36] LIAO X, BAI Y, MUHAMMAD A I, et al. The application of plasma-activated water combined with mild heat for the decontamination of Bacillus cereus spores in rice (Oryza sativa L. ssp. japonica)[J]. Journal of Physics D:Applied Physics,2019,53(6):064003.
[37] SILVA D R G, HADDAD G B S, DE MOURA A P, et al. Safe cured meat using gamma radiation: Effects on spores of Clostridium sporogenes and technological and sensorial characteristics of low nitrite cooked ham[J]. Lwt,2021,137:110392. doi: 10.1016/j.lwt.2020.110392
[38] KANG J W, HONG H N, KANG D H. Application of a krypton-chlorine excilamp to control Alicyclobacillus acidoterrestris spores in apple juice and identification of its sporicidal mechanism[J]. Applied and Environmental Microbiology,2020,86(11):e00159−20.
[39] TAYLOR W, CAMILLERI E, CRAFT D L, et al. DNA damage kills bacterial spores and cells exposed to 222-Nanometer UV radiation[J]. Applied and Environmental Microbiology,2020,86(8):e03039−19.
[40] TREMARIN A, BRANDãO T R S, SILVA C L M. Application of ultraviolet radiation and ultrasound treatments for Alicyclobacillus acidoterrestris spores inactivation in apple juice[J]. LWT-Food Science and Technology,2017,78:138−142. doi: 10.1016/j.lwt.2016.12.039
[41] CLAIR G, ESBELIN J, MALLEA S, et al. The spore coat is essential for Bacillus subtilis spore resistance to pulsed light, and pulsed light treatment eliminates some spore coat proteins[J]. International Journal of Food Microbiology,2020,323:108592. doi: 10.1016/j.ijfoodmicro.2020.108592
[42] SONI A, OEY I, SILCOCK P, et al. Effect of pulsed electric field with moderate heat (80 ℃) on inactivation, thermal resistance and differential gene expression in B. cereus spores[J]. Journal of Food Processing and Preservation,2020,44(7):e14503.
[43] LUONG T S V, MOIR C, CHANDRY P S, et al. Combined high pressure and heat treatment effectively disintegrates spore membranes and inactivates Alicyclobacillus acidoterrestris spores in acidic fruit juice beverage[J]. Innovative Food Science & Emerging Technologies,2020,66:102523.
[44] 董鹏. 高压均质对细菌营养体与芽孢的杀菌效果及机制研究[D]. 北京: 中国农业大学, 2016 DONG Peng. Inactivation mechanisms of vegetative microorganisms and bacterial spores by high pressure homogenization[D]. Beijing: China Agricultural University, 2016.
[45] 刘月. HPTS结合溶菌酶灭活枯草杆菌芽孢的作用研究[D]. 银川: 宁夏大学, 2022 LIU Yue. Study on the combined effects of HPTS and lysozyme on the inactivation of Bacillus subtilis spores[D]. Yinchuan: Ningxia University, 2022.
[46] RAO L, WANG Y, CHEN F, et al. High pressure CO2 reduces the wet heat resistance of Bacillus subtilis spores by perturbing the inner membrane[J]. Innovative Food Science & Emerging Technologies,2020,60:102291.
[47] EVELYN, SILVA F V M. Differences in the resistance of microbial spores to thermosonication, high pressure thermal processing and thermal treatment alone[J]. Journal of Food Engineering,2018,222:292−297. doi: 10.1016/j.jfoodeng.2017.11.037
[48] MOKASHI S, KANAAN J, CRAFT D L, et al. Killing of bacterial spores by dodecylamine and its effects on spore inner membrane properties[J]. Journal of Applied Microbiology,2020,129(6):1511−1522. doi: 10.1111/jam.14732
[49] DONG W, GREEN J, KORZA G, et al. Killing of spores of Bacillus species by cetyltrimethylammonium bromide[J]. Journal of Applied Microbiology,2019,126(5):1391−1401. doi: 10.1111/jam.14242
[50] HIROKADO R, NOMA S, SOH N, et al. Inactivation of Bacillus subtilis spores by carbonation with glycerin fatty acid esters[J]. Food Science and Technology Research,2018,24(3):455−463. doi: 10.3136/fstr.24.455
[51] VELUGOTI P R, KUMAR S, BOHRA L K, et al. Inhibition of germination and outgrowth of Clostridium perfringens spores by buffered calcium, potassium and sodium citrates in cured and non-cured injected pork during cooling[J]. Lwt,2020,123(C):109074.
[52] CAYEMITTE P E, GERLIANI N, RAYMOND P, et al. Study of the impacts of electro-activated solutions of calcium lactate, calcium ascorbate and their equimolar mixture combined with moderate heat treatments on the spores of Bacillus cereus ATCC 14579 under model conditions and in fresh salmon[J]. International Journal of Food Microbiology,2021,358:109285. doi: 10.1016/j.ijfoodmicro.2021.109285
[53] GHOSH S, JOSEPH G, KORZA G, et al. Effects of the microbicide ceragenin CSA-13 on and properties of Bacillus subtilis spores prepared on two very different media[J]. Journal of Applied Microbiology,2019,127(1):109−120. doi: 10.1111/jam.14300
[54] SUDHAUS N, NAGENGAST H, PINA-PÉREZ M C, et al. Effectiveness of a peracetic acid-based disinfectant against spores of Bacillus cereus under different environmental conditions[J]. Food Control,2014,39:1−7. doi: 10.1016/j.foodcont.2013.09.063
[55] 章中, 杨宏伟, 胡济美, 等. 化学物质辅助超高压处理对枯草杆菌芽孢的作用[J]. 中国食品学报,2015,15(5):47−53. [ZHANG Zhong, YANG Hongwei, HU Jimei, et al. Effect of high pressure processing assisted with chemicals on the spores of Bacillus subtilis[J]. Journal of Chinese Institute of Food Science and Technology,2015,15(5):47−53. doi: 10.16429/j.1009-7848.2015.05.007 ZHANG Zhong, YANG Hongwei, HU Jimei, et al. Effect of high pressure processing assisted with chemicals on the spores of Bacillus subtilis[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(05): 47-53. doi: 10.16429/j.1009-7848.2015.05.007
[56] SETLOW B, KORZA G, BLATT K M, et al. Mechanism of Bacillus subtilis spore inactivation by and resistance to supercritical CO2 plus peracetic acid[J]. Journal of Applied Microbiology,2016,120(1):57−69. doi: 10.1111/jam.12995
[57] DONG W, LI S, CAMILLERI E, et al. Accumulation and release of rare earth ions by spores of Bacillus species and the location of these ions in spores[J]. Applied and Environmental Microbiology,2019,85(17):e00956−19.
[58] DONG W, SETLOW P. Fluoride movement into and out of Bacillus spores and growing cells and effects of fluoride accumulation on spore properties[J]. Journal of Applied Microbiology,2019,126(2):503−515. doi: 10.1111/jam.14155
[59] LÜ R, MUHAMMAD A I, ZOU M, et al. Hurdle enhancement of acidic electrolyzed water antimicrobial efficacy on Bacillus cereus spores using ultrasonication[J]. Applied Microbiology and Biotechnology,2020,104(10):4505−4513. doi: 10.1007/s00253-020-10393-6
[60] FU Y, LIANG L, DENG S, et al. Novel spore lytic enzyme from a Bacillus phage leading to spore killing[J]. Enzyme and Microbial Technology,2020,142:109698. doi: 10.1016/j.enzmictec.2020.109698
[61] ZHAO S, HAN J, BIE X, et al. Purification and characterization of Plantaricin JLA-9: A novel bacteriocin against Bacillus spp. produced by Lactobacillus plantarum JLA-9 from Suan-Tsai, a traditional Chinese fermented cabbage[J]. Journal of Agricultural and Food Chemistry,2016,64(13):2754−64. doi: 10.1021/acs.jafc.5b05717
[62] CETIN-KARACA H, NEWMAN M C. Antimicrobial efficacy of phytochemicals against Bacillus cereus in reconstituted infant rice cereal[J]. Food Microbiology,2018,69:189−195. doi: 10.1016/j.fm.2017.08.011
[63] MODUGNO C, KMIHA S, SIMONIN H, et al. High pressure sensitization of heat-resistant and pathogenic foodborne spores to nisin[J]. Food Microbiol,2019,84:103244. doi: 10.1016/j.fm.2019.103244
[64] RAO L, WANG Y, CHEN F, et al. The synergistic effect of high pressure CO2 and nisin on inactivation of Bacillus subtilis spores in aqueous solutions[J]. Frontiers in Microbiology,2016,7:1507.
[65] CHO W I, CHUNG M S. Antimicrobial effect of a combination of herb extract and organic acid against Bacillus subtilis spores[J]. Food Science and Biotechnology,2017,26(5):1423−1428. doi: 10.1007/s10068-017-0164-5
[66] ZHANG C, YANG G, SHEN P, et al. Inactivation mechanism of slightly acidic electrolyzed water on Bacillus cereus spores[J]. Food Microbiology,2022,103:103951. doi: 10.1016/j.fm.2021.103951
[67] SHU Q, NIU Y, ZHAO W, et al. Antibacterial activity and mannosylerythritol lipids against vegetative cells and spores of Bacillus cereus[J]. Food Control,2019,106:106711. doi: 10.1016/j.foodcont.2019.106711
-
期刊类型引用(1)
1. 郭湘蕾,陈凌利,陈慧,于传龙,王文君. 预制菜生产过程关键加工技术研究进展. 食品科技. 2024(08): 64-71 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



