Optimization of the Extraction Process of Anthocyanins from Perilla Leaves and Their Antioxidant and Antibacterial Activities
-
摘要: 为了明确紫苏叶中花色苷的最佳提取工艺及其抗氧化和抑菌活性,本研究以新疆紫苏叶为原料,采用响应面法优化超声波辅助提取紫苏叶花色苷的最佳工艺条件,并采用液质联用技术对提取物中的花青素和花色苷进行了定性定量分析,同时研究了其抗氧化活性和抑菌活性。结果表明,紫苏叶中花色苷最优工艺条件为:料液比为1:20 g/mL、超声温度47 ℃、超声时间57 min、乙醇浓度62%,在此条件下花色苷提取量为7.18±0.32 mg/g DW。提取物主要由矢车菊素、飞燕草素3-O-葡萄糖苷和矢车菊素3-O-葡萄糖苷构成。花色苷提取物对DPPH和ABTS+自由基具有较强的清除活性,其IC50值分别为0.49和0.32 mg/mL。花色苷提取物对金黄色葡萄球菌的最底抑制浓度为160 mg/mL,对大肠杆菌无抑菌活性。本研究为新疆紫苏叶花色苷的提取及应用提供了理论依据。Abstract: In order to determine the optimal extraction process, and antioxidant and antibacterial activities of anthocyanins from Perilla friesians leaf, in this study, Perilla friesians leaf was used as raw material. Response surface method was used to optimize the optimal process conditions of ultrasonic-assisted extraction of anthocyanins from Perilla friesians leaf, and liquid mass combined technology was used to conduct qualitative and quantitative analysis of anthocyanins and anthocyanins in the extracts. The antioxidant activity and antibacterial activity of the extracts were studied. The results showed that the optimum conditions were as follows: The ratio of material to liquid was 1:20 g/mL, the ultrasonic temperature was 47 ℃, the ultrasonic time was 57 min, and ethanol concentration was 62%, and the maximum extraction rate was 7.18±0.32 mg/g DW under these conditions. The extract was mainly composed of cyanidin, delphinidin 3-O-glucoside, and cyanidin 3-O-glucoside. The extract showed significant scavenging activity on DPPH and ABTS+ free radicals, and the IC50 values were 0.49 and 0.32 mg/mL, respectively. The lowest inhibitory concentration against Staphylococcus aureus was 160 mg/mL. This study provides a theoretical basis for the extraction and application of anthocyanins from Perilla friesians leaf.
-
紫苏(Perilla frutescent(L.)Britt)系唇形科(Labiatae)一年生草本植物,又名桂荏[1],主要分布于我国新疆、甘肃、陕西、江苏等地区[2-3]。据《中国药典》记载:紫苏的籽、叶、梗皆可入药,具有化痰止咳、治疗风寒感冒、理气止痛以及安胎等功效[4]。以上功效归因于紫苏中含有的多种生物活性成分,如多酚类、氨基酸、花色苷和维生素等[3]。花色苷是紫苏叶中主要的生物活性成分之一[5-6],具有抗氧化[7-8]、抑菌[9-10]、抗肿瘤[11]、调节血糖[12],以及降血脂[13]等多种生理功能,在食品、药品及化妆品等领域具有广阔的应用前景。
研究发现,紫色紫苏叶中花色苷含量较大,而绿色紫苏叶的花色苷含量较少[14]。王月等[15]对河北紫苏中提取的花色苷进行了检测,发现其含量为715 mg/100 g DW。崔丽霞[16]对不同产地的新鲜紫苏叶进行了超声辅助萃取,其花色苷含量为1.88 mg CGE/g~6.44 mg CGE/g。茹巧美等[17]对红紫苏叶的花色苷进行活性研究,结果表明紫苏叶花色苷具有较好的清除DPPH、超氧阴离子、羟基等自由基的能力。超声辅助提取法是植物提取花色苷常见的方法之一[18-19],利用超声波的机械能破坏植物细胞壁,从而高效提取目标化合物,具有耗时短,效率高以及环保节能的特点[20]。
紫苏是新疆伊犁的一大特色经济作物,现已在昭苏县、察布查尔县及昭苏县及77兵团等地大面积推广,获得了较好的经济、社会及生态效益[21]。本研究以新疆地域的紫苏样本为研究对象,以酸化乙醇为提取溶剂,采用响应面法优化紫苏花色苷的超声波辅助提取工艺,并对其进行定性定量分析、抗氧化活性分析以及抗菌活性分析,旨在为新疆紫苏叶的精深加工提供理论依据。
1. 材料与方法
1.1 材料与仪器
紫苏叶 2020年采集于新疆伊犁昭苏县;金黄色葡萄球菌、大肠杆菌 四川师范大学生命科学学院微生物实验室提供;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、原花青素、飞燕草素、矢车菊素、锦葵色素和芍药色素标准品(均为色谱纯)、琼脂粉、牛肉粉、酸水解酪蛋白、可溶性淀粉 北京索莱宝生物科技有限公司;甲醇、乙酸、乙腈 色谱纯,美国Tedia公司;胰蛋白胨、氨苄青霉素钠 生工生物工程(上海)股份有限公司;酵母膏 赛默飞世尔科技(中国)有限公司;无水乙醇、氯化钾、氯化钠、无水乙酸钠、盐酸等试剂 分析纯,天津市致远化学试剂有限公司。
LE203/O2电子天平 梅特勒-托利多仪器(上海)有限公司;RE-3000A 325旋转蒸发仪 上海亚荣生化仪器厂;XS-04多功能粉碎机 上海兆申科技有限公司;BGZ-246电热鼓风干燥箱 博讯仪器;Lab-IC-80真空冷冻干燥机 北京博医康实验仪器有限公司;TGL-20B高速台式离心机 上海安亭科学仪器厂;JO-060S可调超声波清洗机 深圳市洁盟清洗设备有限公司;756型紫外可见分光光度计 上海箐华科技仪器有限公司;Synergy H1多功能酶标仪 美国博腾仪器有限公司;GI80DS 高压灭菌锅 厦门致微仪器有限公司;SW-CJ-1FD洁净工作台 苏州安泰空气技术有限公司;Thermo Vanquish UHPLC超高效液相色谱仪 美国Thermo Fisher Scientific公司;Q-Exactive HF高分辨质谱 美国Thermo Fisher Scientific公司;Zorbax Eclipse色谱柱 安捷伦科技有限公司。
1.2 实验方法
1.2.1 紫苏叶预处理
挑选出无病虫害的新鲜紫苏叶,清洗干净并切分进行冷冻干燥(−80 ℃、36 h),粉碎机粉碎过60目筛在−21 ℃密封保存备用。
1.2.2 紫苏花色苷提取工艺
紫苏叶预处理→超声辅助(功率360 W、40 kHz)酸化乙醇(1%盐酸调节溶剂pH为2.5)提取→离心(6000 r/min、10 min)→浓缩上清液(旋转蒸发,60 ℃、70 r/min)→冷冻干燥(−80 ℃、36 h)→提取物冻干粉(−21 ℃密封保存)。
1.2.3 单因素实验
1.2.3.1 超声温度对提取量的影响
称取5.00 g样品,固定料液比1:15 g/mL、乙醇浓度50%、提取时间45 min条件下,分别设置超声温度30、40、50、60、70 ℃、进行超声波辅助萃取。后续操作同1.2.2。
1.2.3.2 超声时间对提取量的影响
称取5.00 g样品,固定料液比1:15 g/mL、乙醇浓度50%,提取温度40 ℃的条件下,分别设置超声时间15、30、45、60、75 min,后续操作同1.2.2。
1.2.3.3 乙醇浓度对提取量的影响
称取5.00 g样品,固定料液比1:15 g/mL、提取时间45 min、提取温度40 ℃条件下,分别设置乙醇浓度50%、60%、70%、80%、90%,后续操作同1.2.2。
1.2.3.4 料液比对提取量的影响
称取5.00 g样品,固定乙醇浓度50%、提取时间45 min、提取温度40 ℃条件下,分别设置料液比1:10、1:15、1:20、1:25、1:30 g/mL,后续操作同1.2.2。
1.2.4 响应面试验
根据单因素实验结果,选择时间、温度和乙醇浓度为自变量,以花色苷提取量为响应值,采用Box-Benhnken(BBD)进行响应面试验设计,其因素水平与编码见表1。
表 1 响应面的因素水平Table 1. Factors and levels of response surface test水平 因素 A:超声温度(℃) B:超声时间(min) C:乙醇浓度(%) −1 40 45 50 0 50 60 60 1 60 75 70 1.2.5 花色苷提取量的测定
采用pH示差法测定花色苷含量,参照崔丽霞[16]并略加修改:取花色苷冻干粉10 mg溶于10 mL蒸馏水(1%盐酸调整pH为2.5)中,制备浓为1 mg/mL的样液,在96孔酶标板中加入30 μL样液后,分别加入pH1.0的氯化钾缓冲液、pH4.5的醋酸钠缓冲液270 μL,避光静置60 min。使用酶标仪分别在520 nm和700 nm处测定吸光度,以蒸馏水为对照。根据式(1)~式(2)计算花色苷提取量。
A=(A520−A700)pH1.0−(A520−A700)pH4.5 (1) 花色苷提取量(mg/gDW)=A×DF×MW×Vε×L×m (2) 式中:DF:样液稀释的倍数;MW:449.2(矢车菊-3-葡萄糖苷的分子量,mg/moL);V:溶液最终体积(mL);ε:26900(矢车菊-3-葡萄糖苷的摩尔消光系数,L/moL·cm);L:比色皿光路直径(cm);m:样品质量(g)。
1.2.6 花色苷的定性定量
采用液相色谱串联质谱技术(Liquid chromatography–mass spectrometry,LC-MS/MS)测定紫苏提取物中花色苷的含量。参照Xu等[22]的方法并略加修改:准确称取0.100 g花色苷样品冻干粉,溶解于10 mL提取液(甲醇:水:甲酸=15:4:1,v/v),40 kHz超声30 min,45 ℃减压浓缩后用甲醇-水溶液(80%,v/v)复溶,离心(12000 r/min,3 min)并吸取上清液,用0.22 μm微孔滤膜过滤,待测。
液相色谱条件:Zorbax Eclipse C18色谱柱(1.8 μm,2.1 mm×100 mm)。流动相A:超纯水(含0.1%甲酸),流动相B:乙腈。洗脱梯度:0.00 min,B相比例为5%,16.00 min增至70%,19.00 min增至100%,保持2 min,21 min降至5%并平衡2 min。流速:0.30 mL/min,柱温:30 ℃,进样量 2 μL。
质谱条件:电喷雾离子源温度500 ℃,正离子模式下质谱电压4500 V,帘气35 psi。根据标准品色谱及质谱信息,采用外标法定性定量。
1.2.7 抗氧化活性测定
1.2.7.1 DPPH自由基清除率
参照茹巧美等[17]的方法略作修改:取花色苷冻干粉10 mg溶于10 mL蒸馏水(1%盐酸调整pH为2.5)中,制备浓度为1 mg/mL的样品原液,在96孔板中分别加入0.015 mL不同浓度(0.25、0.50、0.75、1.00、1.25、1.50、1.75、2.00 mg/mL)的样液,然后加入0.285 mL DPPH-乙醇溶液(0.1 mol/L),混匀后于室温避光反应40 min,使用酶标仪在517 nm处测量吸光度,以VC为对照(按照上述样品浓度配制)。
DPPH自由基清除率(%)=(1−A1−A2A0)×100 (3) 式中:A0为不含样品的DPPH溶液的吸光值;A1为含有样品的DPPH溶液的吸光值;A2为无水乙醇替代DPPH溶液的吸光值。
1.2.7.2 ABTS+自由基清除率
参照王月等[15]的方法略作修改。取花色苷冻干粉10 mg溶于10 mL蒸馏水(1%盐酸调整pH为2.5)中,制备浓为1 mg/mL的样品原液,在96孔板中分别加入0.015 mL不同浓度(0.25、0.50、0.75、1.00、1.25、1.50、1.75、2.00 mg/mL)的样液与0.285 mL工作液(由适量的ABTS溶液和K2S2O8溶液混合制备)混合,室温避光反应40 min,使用酶标仪在734 nm处测量其吸光值,以VC为对照(按照上述样品浓度配制)。
ABTS+自由基清除率(%)=(1−A1−A2A0)×100 (4) 式中:A0为不含样品的ABTS溶液的吸光值;A1为含有样品的ABTS溶液的吸光值;A2为蒸馏水替代ABTS溶液的吸光值。
1.2.8 抑菌活性测定
以金黄色葡萄球菌、大肠杆菌为供试菌株,采用琼脂孔扩散法研究紫苏花色苷在LB-agar培养基上的抑菌作用及浓度效应。将活化后的菌株配制成1.0×108 CFU/mL的菌悬液,采用滤纸片法[9]测定质量浓度为20、40、80、160、320 mg/mL的花色苷水溶液对应各菌株的抑菌圈大小,采用二倍稀释法[13]测定花色苷对各菌株的最低抑菌浓度(MIC)。
1.3 数据处理
运用Design Expert.13软件分析回归方程和响应面优化分析,利用Origin 2018c绘图,采用SSPS 23.0进行数据分析。
2. 结果与分析
2.1 单因素实验
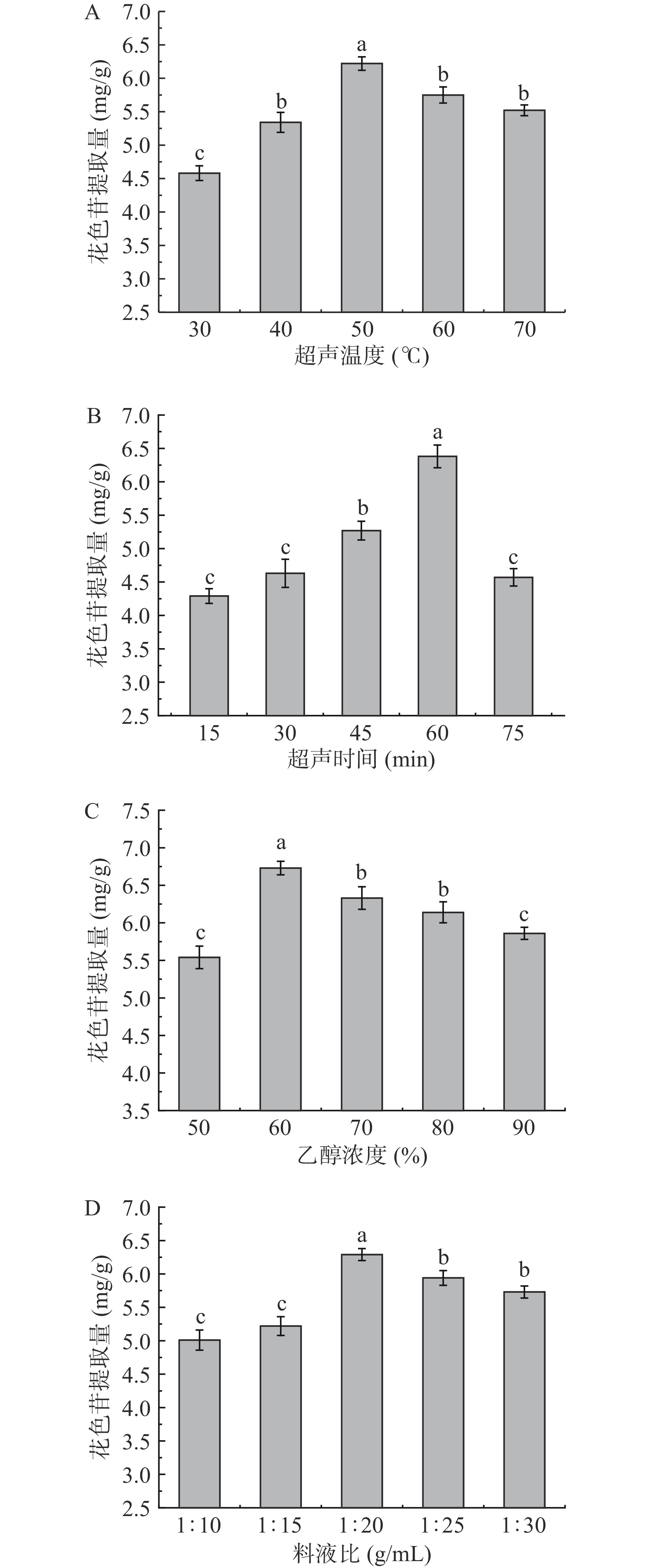
图1A为超声温度对紫苏叶花色苷提取量的影响。由图1A可知:当超声温度为50 ℃时,花色苷提取量最大值为6.24 mg/g DW;随着温度的继续升高,花色苷提取量逐渐降低,这是因为花色苷耐热性较差,在高温下易发生分解[11],导致花色苷提取量降低。因此选择40、50、60 ℃进行后续优化试验。
图1B为超声时间对紫苏叶花色苷提取量的影响。由图1B可知:超声时间为60 min时,花色苷提取量最高为6.38 mg/g DW。这是由于细胞壁被超声波破坏,易于花色苷的提取[19],而超声时间的延长会造成其结构被破坏[20]以及资源浪费。因此选择超声时间60 min为后续试验的中心点。
图1C为乙醇浓度对紫苏叶花色苷提取量的影响。由图1C可知:花色苷提取量随着乙醇浓度的升高呈现先上升后下降的趋势;当乙醇浓度为60%时,含量最大为6.73 mg/g DW。其原因是花色苷的极性与一定浓度的乙醇水溶液相近。当乙醇浓度较低时,其极性与花色苷接近,有利于花色苷的溶出[12]。而花色苷由花青素和糖基以糖苷键结合而成的,当乙醇浓度越高时,极性越弱,不利于花色苷糖苷的溶解,且醇溶性杂质以及脂类溶出,从而导致含量下降[23]。因此选择乙醇浓度为50%、60%、70%进行后续优化试验。
图1D为料液比对紫苏叶花色苷提取量的影响。由图1D可知:在一定的料液比下,紫苏叶粉与溶剂的接触面积随溶剂比例的增大而增大,而花色苷的含量也随之提高;在料液比例为1:20 g/mL时,提取量最高为6.29 mg/g DW。随着溶剂的不断增大,花色苷浓度被稀释导致提取量下降,这说明花色苷几乎已经完全从组织中溶出,且过量的萃取剂不仅会影响其超声作用还会使花色苷水解造成溶剂浪费。综合实验条件以及成本因素优选出1:20 g/mL的料液比进行试验。
2.2 响应面优化试验
2.2.1 设计与结果
响应面试验设计及结果见表2。
表 2 响应面试验设计及结果Table 2. Response surface test design and results实验号 A:超声温度 B:超声时间 C:乙醇浓度 Y:提取量(mg/g DW) 1 1 0 −1 4.97 2 0 0 0 6.99 3 0 0 0 6.85 4 0 0 0 7.01 5 −1 0 1 6.29 6 0 0 0 7.07 7 0 1 1 6.03 8 1 1 0 5.33 9 −1 1 0 6.45 10 −1 −1 0 6.59 11 1 0 1 6.16 12 0 −1 −1 5.74 13 0 1 −1 5.49 14 0 −1 1 6.55 15 1 −1 0 5.91 16 0 0 0 7.15 17 −1 0 −1 6.21 运用Design Expert软件对数据进行分析,可拟合得到多元二阶回归模型:
Y=7.01−0.40A−0.19B+0.33C−0.11AB+0.28AC−0.068BC−0.49A2−0.45B2−0.61C2 模型方差分析结果由表3可知:模型F=70.21,且P<0.0001,表明模型极显著;其中A、B、C、AC、A2、B2、C2为显著项(P<0.05);不同因素间显著性大小顺序为:提取温度(A)>乙醇浓度(C)>提取时间(B);交互项显著性大小为:AC>AB>BC;失拟项的F=0.6576,P=0.6195,说明失拟项不显著(P>0.05);模型确定系数R2=0.9890,表明该模型可解释98.90%的变化;Adj-R2=0.9750,Pre-R2=0.9750,回归方程的拟合程度和可行度较高,说明预测值与实验结果具有高度相关性。
表 3 方差分析结果Table 3. Results of ANOVA来源 平方和 自由度 均值 F值 P值 模型 6.6200 9 0.7356 70.21 < 0.0001 A-提取温度 1.2600 1 1.2600 119.88 < 0.0001 B-提取时间 0.2775 1 0.2775 26.49 0.0013 C-乙醇浓度 0.8581 1 0.8581 81.89 < 0.0001 AB 0.0484 1 0.0484 4.62 0.0687 AC 0.308 1 0.308 29.4 0.001 BC 0.0182 1 0.0182 1.74 0.2287 A² 1.0300 1 1.0300 98.26 < 0.0001 B² 0.8507 1 0.8507 81.19 < 0.0001 C² 1.5800 1 1.5800 150.51 < 0.0001 残差 0.0733 7 0.0105 失拟项 0.0242 3 0.0081 0.6576 0.6195 纯误差 0.0491 4 0.0123 总和 6.6900 16 R2 0.9890 信噪比 26.8477 C.V % 1.6300 注:Adj-R2=0.9750,Pre-R2=0.9750。 2.2.2 响应面图分析
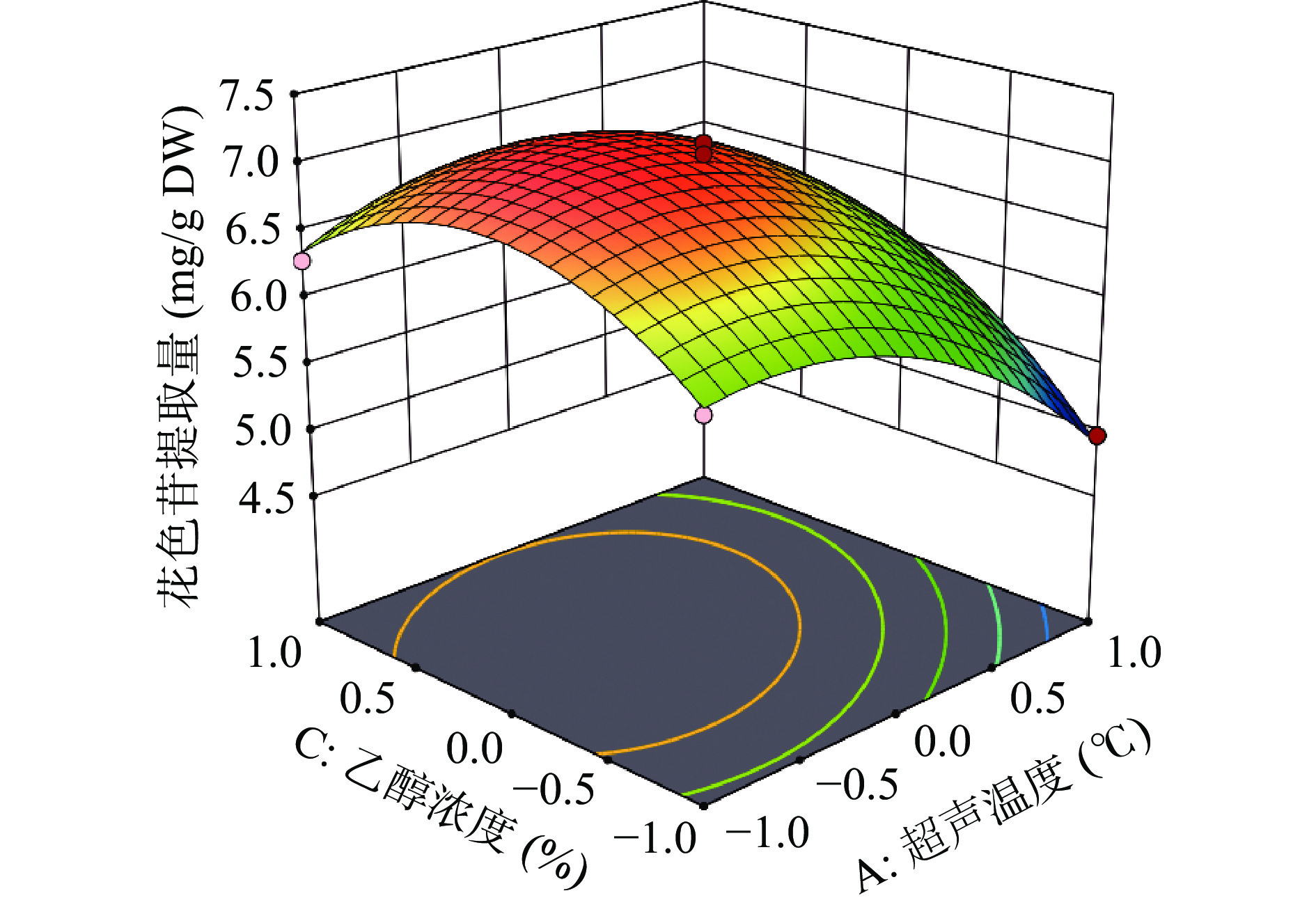
响应面法已广泛用于优化植物中多酚、多糖和蛋白质等物质的提取,它能更好地反映不同实验因素变量之间的相互作用对响应变量效应的影响。可根据三维曲线的斜率以及映射等高线的形状,从而判定两因子间的相互作用强度,当三维曲线的斜率越大时、且等高线形状呈椭圆,则说明这两个因子的相互作用显著[15-17]。
由图2所示,乙醇浓度和温度相互作用的等高线为椭圆形,且响应面图陡峭,表明二者之间有交互作用,综合方差分析结果表3可知,AC两者交互作用显著。
2.2.3 预测模型的验证
通过响应面优化得到紫苏花色苷最佳提取工艺参数为:超声温度46.78 ℃,超声时间57.27 min,乙醇浓度62.05%。此条件下紫苏花色苷提取量为7.13 mg/g。调整参数为:超声温度47 ℃,超声时间57 min,乙醇浓度为62%。在此条件下花色苷提取量为(7.18±0.32)mg/g,与理论值基本一致,由此说明该模型拟合效果良好,适用于紫苏花色苷的提取。
2.3 紫苏花色苷定性定量分析
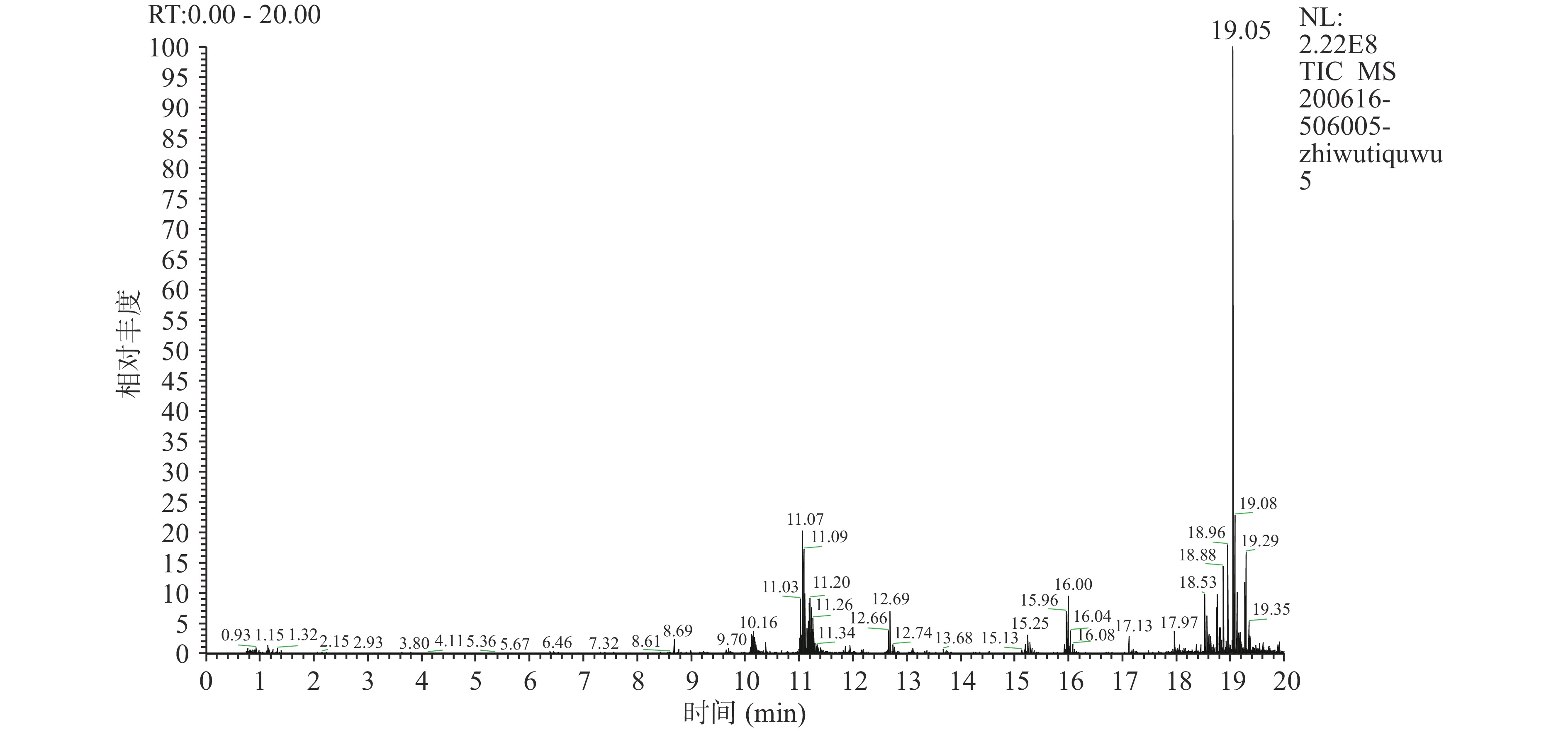
花色苷是由花青素和糖基以糖苷键结合而成的。不同文献报道的紫苏叶片中的花色苷成分存在差异,崔丽霞[16]从不同产地新鲜紫苏提取的花色苷主要成分为矢车菊素类型,与本文提取的新疆伊犁紫苏叶花色苷主要成分类型一致,但具体含量略有不同。除本文鉴定出的三种花色苷外,He等[24]还鉴定出丙二酰基顺式紫苏宁、顺式紫苏宁等7种不同种类的花色苷,这是因为花色苷成分与含量受到紫苏品种的影响[25]。本文在新疆伊犁紫苏花色苷中发现三种主要花青素(表4),包括矢车菊素、飞燕草素3-O-葡萄糖苷和矢车菊素3-O-葡萄糖苷。紫苏花色苷提取物花色苷总离子流图如图3所示,矢车菊素为主要花青素,含量为290.32 μg/g DW;其次为飞燕素3-O-葡萄糖苷,含量为118.83 μg/g DW,以及矢车菊素3-O-葡萄糖苷含量为34.58 μg/g DW。
表 4 紫苏叶花青素及花色苷含量Table 4. Anthocyanin content of anthocyanin extract花青素(花色苷) 含量(μg/g DW) 飞燕草素 ND 飞燕草素3-O-半乳糖苷 ND 飞燕草素3-O-葡萄糖苷 118.83±1.32 飞燕草素3-O-阿拉伯糖苷 ND 矢车菊素 290.32±1.14 矢车菊素3-O-半乳糖苷 ND 矢车菊素3-O-葡萄糖苷 34.58±0.98 矢车菊素3-O-阿拉伯糖苷 ND 芍药素 ND 芍药素3-O-葡萄糖苷 ND 芍药素3-O-阿拉伯糖苷 ND 锦葵素 ND 锦葵素3-O-葡萄糖苷 ND 锦葵素3-O-阿拉伯糖苷 ND 2.4 抗氧化活性分析
抗氧化主要是通过清除自由基、抑制氧化,从而达到维护身体健康的目的[26-27],DPPH和ABTS+自由基清除率是衡量天然食品中抗氧化能力常见的两种途径,可判断被测物质的抗氧化能力[7-8]。图4和图5分别为紫苏花色苷提取物对DPPH和ABTS+自由基的清除作用。由图4可知,新疆紫苏花色苷提取物对DPPH自由基的清除能力略低于VC,但当提取物浓度增加到1.5 mg/mL时,清除率超过80%(82.91%),表现出良好的抗氧化能力;由图5可知,当提取物浓度为1.5 mg/mL时,新疆紫苏花色苷提取物对ABTS+自由基清除率达到了98.41%,接近VC的清除能力。新疆紫苏花色苷提取物对DPPH与ABTS+自由基的IC50值分别为0.49和0.32 mg/mL,于海鑫[28]报道的新鲜紫苏叶花色苷浓度分别为0.30和0.05 mg/mL时DPPH和ABTS+自由基的清除率达到最大值,分别为40.4%和52.7%,在相近的浓度下新疆紫苏花色苷DPPH自由基清除率较强,但ABTS+自由基清除能力存在一定差异,这可能是紫苏产地以及预处理的方式(新鲜、干制)不同导致的[16,25]。上述研究结果均表明紫苏花色苷类物质具有良好的抗氧化活性。
2.5 抑菌活性
花色苷具有一定抑菌活性[29]。紫苏叶花色苷提取物对金黄色葡萄球菌和大肠杆菌生长的抑制效果如表5所示。当花色苷浓度分别为160和320 mg/mL时对金黄色葡萄球菌的抑菌圈直径分别为11.47和13.88 mm,表明紫苏叶花色苷提取物对金黄色葡萄球菌的生长有一定的抑制效果(花色苷对金黄色葡萄球菌的抑制作用如图6所示)。蔡宁晨[30]发现提取的紫苏叶花色苷对大肠杆菌、金黄色葡萄球菌均有一定的抑制作用,其中在相同花色苷浓度下对金黄色葡萄球菌的抑制作用强于对大肠杆菌的抑制作用。在本实验浓度范围内,紫苏花色苷对大肠杆菌的抑菌活性不明显,可能是在本实验浓度范围下的花色苷浓度对大肠杆菌起不到抑制的作用,这与Ivan等[10]报道结果相似,即当提取物的花色苷浓度较低时不对大肠杆菌起到抑制的作用。结果表明,花色苷只有在一定浓度下才会对金黄色葡萄球菌和大肠杆菌呈现出抑制作用。本实验结果对进一步研究新疆紫苏花色苷对大肠杆菌的抑制作用提供了理论依据。
表 5 花色苷提取物对两种致病菌的抑菌活性Table 5. Antibacterial activity of anthocyanin extracts against two pathogenic bacteria菌种 花色苷提取物浓度(mg/mL) 20 40 80 160 320 金黄色葡萄球菌
菌圈直径(mm)0 0 0 11.47±0.07 13.88±0.11 大肠杆菌菌圈直径(mm) 0 0 0 0 0 3. 结论
以新疆紫苏为原料,采用单因素和响应面法优化了紫苏叶花色苷的超声波辅助提取工艺,采用液质联用技术对紫苏花色苷单体化合物的种类和含量进行鉴定,并对其抗氧化活性、抗菌活性进行了分析。固定料液比为1:20 g/mL时紫苏叶花色苷的最佳提取工艺为:超声温度47 ℃,超声时间57 min,乙醇浓度62%。在此条件下花色苷提取量为7.18 mg/g DW。紫苏叶花色苷对DPPH和ABTS+自由基具有较强的清除能力,当提取物浓度为1.5 mg/mL时,对DPPH和ABTS+自由基清除率最高分别为82.91%和98.41%,其IC50值分别为0.49和0.32 mg/mL。紫苏叶花色苷主要由矢车菊素、飞燕草素3-O-葡萄糖苷和矢车菊素3-O-葡萄糖苷构成,其含量分别为290.32、118.83、34.58 μg/g DW。在花色苷抑菌实验的浓度范围内,对金黄色葡萄球菌的最低抑制浓度为160 mg/mL,对大肠杆菌无明显抑菌活性,有待提高花色苷浓度进一步研究其对大肠杆菌的抑制作用。本研究为新疆紫苏叶花色苷的提取及以及在功能性食品中的应用提供了理论依据。
-
表 1 响应面的因素水平
Table 1 Factors and levels of response surface test
水平 因素 A:超声温度(℃) B:超声时间(min) C:乙醇浓度(%) −1 40 45 50 0 50 60 60 1 60 75 70 表 2 响应面试验设计及结果
Table 2 Response surface test design and results
实验号 A:超声温度 B:超声时间 C:乙醇浓度 Y:提取量(mg/g DW) 1 1 0 −1 4.97 2 0 0 0 6.99 3 0 0 0 6.85 4 0 0 0 7.01 5 −1 0 1 6.29 6 0 0 0 7.07 7 0 1 1 6.03 8 1 1 0 5.33 9 −1 1 0 6.45 10 −1 −1 0 6.59 11 1 0 1 6.16 12 0 −1 −1 5.74 13 0 1 −1 5.49 14 0 −1 1 6.55 15 1 −1 0 5.91 16 0 0 0 7.15 17 −1 0 −1 6.21 表 3 方差分析结果
Table 3 Results of ANOVA
来源 平方和 自由度 均值 F值 P值 模型 6.6200 9 0.7356 70.21 < 0.0001 A-提取温度 1.2600 1 1.2600 119.88 < 0.0001 B-提取时间 0.2775 1 0.2775 26.49 0.0013 C-乙醇浓度 0.8581 1 0.8581 81.89 < 0.0001 AB 0.0484 1 0.0484 4.62 0.0687 AC 0.308 1 0.308 29.4 0.001 BC 0.0182 1 0.0182 1.74 0.2287 A² 1.0300 1 1.0300 98.26 < 0.0001 B² 0.8507 1 0.8507 81.19 < 0.0001 C² 1.5800 1 1.5800 150.51 < 0.0001 残差 0.0733 7 0.0105 失拟项 0.0242 3 0.0081 0.6576 0.6195 纯误差 0.0491 4 0.0123 总和 6.6900 16 R2 0.9890 信噪比 26.8477 C.V % 1.6300 注:Adj-R2=0.9750,Pre-R2=0.9750。 表 4 紫苏叶花青素及花色苷含量
Table 4 Anthocyanin content of anthocyanin extract
花青素(花色苷) 含量(μg/g DW) 飞燕草素 ND 飞燕草素3-O-半乳糖苷 ND 飞燕草素3-O-葡萄糖苷 118.83±1.32 飞燕草素3-O-阿拉伯糖苷 ND 矢车菊素 290.32±1.14 矢车菊素3-O-半乳糖苷 ND 矢车菊素3-O-葡萄糖苷 34.58±0.98 矢车菊素3-O-阿拉伯糖苷 ND 芍药素 ND 芍药素3-O-葡萄糖苷 ND 芍药素3-O-阿拉伯糖苷 ND 锦葵素 ND 锦葵素3-O-葡萄糖苷 ND 锦葵素3-O-阿拉伯糖苷 ND 表 5 花色苷提取物对两种致病菌的抑菌活性
Table 5 Antibacterial activity of anthocyanin extracts against two pathogenic bacteria
菌种 花色苷提取物浓度(mg/mL) 20 40 80 160 320 金黄色葡萄球菌
菌圈直径(mm)0 0 0 11.47±0.07 13.88±0.11 大肠杆菌菌圈直径(mm) 0 0 0 0 0 -
[1] 钱锦秀, 孟武威, 刘晖晖, 等. 经典名方中紫苏类药材的本草考证[J]. 中国实验方剂学杂志,2022,28(10):55−67. [QIAN J X, MENG W W, LIU H H, et al. Herbal textual research on Perilla medicinal materials in classic prescriptions[J]. Chinese Journal of Experimental Traditional Medical Formulae,2022,28(10):55−67. QIAN J X, MENG W W, LIU H H, et al. Herbal textual research on Perilla medicinal materials in classic prescriptions [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28 (10): 55-67.
[2] DHYANI A, CHOPRA R, GARG M. A review on nutritional Value, Functional properties and pharmacological application of Perilla (Perilla frutescens L.)[J]. Biomedical and Pharmacology Journal,2019,12(2):649−650. doi: 10.13005/bpj/1685
[3] 张婉萍, 陈婕, 王恒, 等. 紫苏叶的活性成分及生物活性研究进展[J/OL]. 食品与发酵工业: 1−10. [2022-10-28]. doi: 10.13995/j.cnki.11-1802/ts.033179. ZHANG W P, CHEN J, WANG H, et al. Research progress on active components and biological activities of Perilla leaves [J/OL]. Food and Fermentation Industries: 1−10 [2022-10-28]. doi: 10.13995/j.cnki.11-1802/ts.033179.
[4] 赵奕栋, 孙文豪, 陈天源, 等. 紫苏叶有效成分药理作用研究进展[J]. 江苏中医药,2022,54(8):79−82. [[ZHAO Y D, SUN W H, CHEN T Y, et al. Research progress on pharmacological effects of effective components of Perilla leaves[J]. Jiangsu Journal of Traditional Chinese Medicine,2022,54(8):79−82. [ZHAO Y D, SUN W H, CHEN T Y, et al. Research progress on pharmacological effects of effective components of Perilla leaves [J]. Jiangsu Journal of Traditional Chinese Medicine, 2022, 54(8): 79-82.
[5] ZHANG X, ZHAO Y Q, LI B, et al. Comparison of three extraction methods for anthocyanins from Perilla frutescens leaves[J]. Sustainable Chemistry and Pharmacy,2022,29(6):1−2.
[6] JUNH I, KIM B T, SONG G S, et al. Structural characterization of phenolic anti oxi dants from purple Perilla (Perilla frutescens var acuta) leaves[J]. Food Chemistry,2014,148(8):367−372.
[7] 章银良, 周文权, 郑坚强, 等. 超声波辅助萃取黑米中的花色苷及其抗氧化性的研究[J]. 郑州轻工业学院学报(自然科学版),2013,28(1):16−19, 29. [ZHANG Y L, ZHOU W Q, ZHENG J Q, et al. Ultrasonic assisted extraction of anthocyanins from black rice and its antioxidant activity[J]. Journal of Light Industry,2013,28(1):16−19, 29. ZHANG Y L, ZHOU W Q, ZHENG J Q, et al. Ultrasonic assisted extraction of anthocyanins from black rice and its antioxidant activity [J]. Journal of Light Industry, 2013, 28 (1): 16-19, 29.
[8] ZHAO X Q, YUAN Z H. Anthocyanins from pomegranate (Punica granatum L.) and their role in antioxidant capacities in vitro[J]. Chemistry & Biodiversity,2021,18(10):8.
[9] DENG H T, ZHU J Y, TONG Y Q, et al. Antibacterial characteristics and mechanisms of action of Aronia melanocarpa anthocyanins against Escherichia coli[J]. LWT,2021,150(5):1−4.
[10] IVAN S, NUR Ş S E, MARYAN K, et al. Antiproliferative and antimicrobial activity of anthocyanins from berry fruits after their isolation and freeze-drying[J]. Applied Sciences,2021,11(5):4−5.
[11] LIU Y X, ZHAO Y H, ZHUO Y, et al. Ultrasound-assisted extraction of anthocyanins from malus ‘Royalty’ fruits: Optimization, separation, and antitumor activity[J]. Molecules,2022,27(13):4299−4299. doi: 10.3390/molecules27134299
[12] 王自超. 黑果枸杞产地溯源及其花色苷降血糖机理[D]. 西安: 陕西师范大学, 2020: 57 WANG Z C. Tracing to the origin of wolfberry fruit and its mechanism of anthocyanin lowering blood glucose[D]. Xi'an: Shaanxi Normal University, 2020: 57.
[13] DANIELA D H B, ZHI C, RUTH P H, et al. Hypoglycemic and hypolipidemic effects of blueberry anthocyanins by AMPK activation: In vitro and in vivo studies[J]. Redox Biology,2021,46(8):102100.
[14] SAITO K, YAMAZAKI M. Biochemistry and molecular biology of the late-stage of bi osynthesis of anthocyanin: Lessons from Perilla, frutescens as a model plant[J]. New Phytologist,2002,155(9):9−23.
[15] 王月, 赵彦巧, 李建颖. 超声辅助提取紫苏叶花色苷及其抗氧化活性研究[J]. 食品研究与开发,2022,43(4):128−135. [WANG Y, ZHAO Y Q, LI J Y. Ultrasonic assisted extraction of anthocyanins from Perilla leaves and its antioxidant activity[J]. Food Research and Development,2022,43(4):128−135. WANG Y, ZHAO Y Q, LI J Y. Ultrasonic assisted extraction of anthocyanins from Perilla leaves and its antioxidant activity [J]. Food Research and Development, 2022, 43 (4): 128-135.
[16] 崔丽霞. 紫苏花色苷提取纯化及其微胶囊化研究[D]. 太原: 中北大学, 2018: 31−44 CUI L X. Study on extraction, purification and microencapsulation of Perilla anthocyanins[D]. Taiyuan: Central North University, 2018: 31−44.
[17] 茹巧美, 任国平, 胡琼. 聚乙二醇提取紫苏叶花色苷工艺优化及抗氧化活性[J]. 食品科技,2020,45(10):220−228. [RU Q M, REN G P, HU Q. Optimization of extraction process of anthocyanins from Perilla leaves by polyethylene glycol and its antioxidant activity[J]. Food Science and Technology,2020,45(10):220−228. RU Q M, REN G P, HU Q. Optimization of extraction process of anthocyanins from Perilla leaves by polyethylene glycol and its antioxidant activity [J]. Food Science and Technology, 2020, 45 (10): 220-228.
[18] LI X, ZHU F Y, ZENG Z W. Effects of different extraction methods on antioxidant properties of blueberry anthocyanins[J]. Open Chemistry,2021,19(1):138−148. doi: 10.1515/chem-2020-0052
[19] SHARMILA G, MUTHUKUMARAN C, SURIYA E, et al. Ultrasound aided extraction of yellow pigment from Tecoma castanifolia floral petals: Optimization by response surface method and evaluation of the antioxidant activity[J]. Industrial Crops & Products,2019,130(7):467−468.
[20] CHEMAT F, ROMBAUTN, SICAIRE A G, et al. Ultrasound assisted extraction of food and natural products. Mechanisms, techniques, combinations, protocols and applications. A review[J]. Ultrasonics-Sonochemistry,2017,34(6):540−560.
[21] 张振国, 赖刚刚, 郭丹丽, 等. 香紫苏机械化膜上点播栽培技术及应用推广[J]. 新疆农垦科技,2022,45(5):18−19. [ZHANG Z G, LAI G, GUO D L, et al. Mechanized film seeding cultivation technology and application promotion of Perilla frutescens[J]. Xinjiang Agricultural Reclamation Science and Technology,2022,45(5):18−19. ZHANG Z G, LAI G, GUO D L, et al. Mechanized film seeding cultivation technology and application promotion of Perilla frutescens [J]. Xinjiang Agricultural Reclamation Science and Technology, 2022, 45 (5): 18-19
[22] XU Y P, SIMON J E, FERRUZZI M G, et al. Quantification of anthocyanidins in the grapes and grape juice products with acid assisted hydrolysis using LC/MS[J]. Journal of Functional Foods,2012,4(4):710−717. doi: 10.1016/j.jff.2012.04.010
[23] 魏婷, 曾永明, 何伟, 等. 超声波辅助提取伊犁薰衣草花色苷工艺及其抗氧化活性研究[J]. 食品科技,2018,43(12):244−252. [WEI T, ZENG Y M, HE W, et al. Ultrasonic assisted extraction of anthocyanins from Lavender Ili and its antioxidant activity[J]. Food Science and Technology,2018,43(12):244−252. WEI T, ZENG Y M, HE W, et al. Ultrasonic assisted extraction of anthocyanins from Lavender Ili and its antioxidant activity [J]. Food Science and Technology, 2018, 43 (12): 244-252.
[24] HE Y K, YAO Y Y, CHANG Y N. Char acterization of anthocyanins in Perilla frutescens var. acuta extract by advanced “UPLC-ESI-IT-TOF-MS” method and their anticancer bioactivity[J]. Molecules,2015,20(5):9155−9169. doi: 10.3390/molecules20059155
[25] FUJIWARA Y, KONO M, ITO A, et al. Anthocyanins in Perilla plants and dried leaves[J]. Phytochemistry,2018,147(6):158−166.
[26] 刘小琳, 牛婷婷, 谢勇武, 等. 玫瑰茄中花色苷的双水相提取及其抗氧化活性[J]. 中国食品添加剂,2022,33(10):85−91. [[LIU X L, NIU T T, XIE Y W, et al. Aqueous two-phase extraction and antioxidant activity of anthocyanins from roselle[J]. China Food Additives,2022,33(10):85−91. [LIU X L, NIU T T, XIE Y W, et al. Aqueous two-phase extraction and antioxidant activity of anthocyanins from roselle [J]. China Food Additives, 2022, 33 (10): 85-91.
[27] 周新宇, 吕重宁, 秦汝兰. 刺玫果中花色苷提取工艺优化及抗氧化性分析[J]. 食品工业科技,2022,43(4):178−186. [ZHOU X Y, LU C N, QIN R L. Optimization of anthocyanin extraction process and antioxidant analysis in Rosa davurica[J]. Science and Technology of Food Industry,2022,43(4):178−186. ZHOU X Y, LU C N, QIN R L. Optimization of anthocyanin extraction process and antioxidant analysis in Rosa davurica[J]. Science and Technology of Food Industry, 2022, 43 (4): 178-186.
[28] 于海鑫, 张秀玲, 高诗涵, 等. 紫苏叶花色苷微波辅助提取工艺优化及其抗氧化活性[J]. 食品工业,2019,40(10):51−55. [YU H X, ZHANG X L, GAO S H, et al. Optimization of microwave assisted extraction process and antioxidant activity of anthocyanins from Perilla Leaves[J]. The Food Industry,2019,40(10):51−55. YU H X, ZHANG X L, GAO S H, et al. Optimization of microwave assisted extraction process and antioxidant activity of anthocyanins from Perilla Leaves [J]. The Food Industry, 2019, 40 (10): 51-55.
[29] 张卓睿, 崔金麒, 赵羚汐, 等. 桤叶唐棣花色苷分离纯化及抗氧化与抑菌活性[J]. 东北林业大学学报,2021,49(12):45−51. [ZHANG Z R, CUI J Q, ZHAO L X, et al. Purification and antioxidant and antibacterial activities of anthocyanins from Alnus cremastogyne[J]. Journal of Northeast Forestry University,2021,49(12):45−51. ZHANG Z R, CUI J Q, ZHAO L X, et al. Purification and antioxidant and antibacterial activities of anthocyanins from Alnus cremastogyne[J]. Journal of Northeast Forestry University, 2021, 49 (12): 45-51.
[30] 蔡宁晨. 紫苏叶花色苷的提取分析及其功能的研究[D]. 杭州: 浙江大学, 2013: 46−48 CAI N C. Extraction, analysis and function study of anthocyanins from Perilla leaves[D]. Hangzhou: Zhejiang University, 2013: 46−48.
-
期刊类型引用(1)
1. 史文锦,刘仁慧. 山药在糖尿病及其并发症治疗中的作用机制研究进展. 山东医药. 2025(01): 144-149 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:



 下载:
下载:



