Stability and Bioactivity of Polyphenols from Cabernet Sauvignon Grape Seeds in Vitro
-
摘要: 以酿酒后赤霞珠葡萄籽为原材料,提取、纯化葡萄籽多酚,研究葡萄籽多酚在不同pH、光照、温度、碳水化合物、稳定剂、氧化还原剂、防腐剂和金属离子等加工、贮藏条件下的稳定性,同时探讨其生物活性。结果表明:葡萄籽多酚在弱酸(pH4~6)、避光、低温(4 ℃)条件下稳定性最好,多酚保留率均在95%以上;高浓度(40%~50%)蔗糖和葡萄糖对多酚稳定性具有增强作用,不同浓度乳糖对多酚稳定性无显著影响(P˃0.05),而不同浓度淀粉均能显著降低多酚稳定性(P<0.05);与吐温-80相比,稳定剂硫代硫酸钠对多酚破坏程度更强;氧化剂与还原剂对多酚均有一定破坏作用,而还原剂对多酚的破坏作用明显强于氧化剂;在添加0.15%的苯甲酸钠、0.1%的山梨酸钾处理中,多酚保留率分别为87.95%、89.44%,防腐剂中山梨酸钾更利于多酚的稳定;金属离子中Al3+、Fe3+、Cu2+对多酚破坏程度最强,与第0 d相比,贮藏30 d后多酚保留率分别下降了66.11%、43.38%、82.15%;葡萄籽多酚具有较强的抗氧化能力和α-淀粉酶抑制能力,当其浓度为2.5 mg/mL时,α-淀粉酶抑制率可达97.97%。本研究结果可为葡萄籽多酚的进一步开发、利用提供理论依据。Abstract: With Cabernet Sauvignon grape seeds as raw materials, grape seed polyphenols were extracted and purified, the stability of grape seed polyphenols under different pH, light, temperature, carbohydrate, stabilizer, oxidant reducing agent, preservative and metal ion were studied during processing and storage conditions, and the biological activity in vitro was also discussed. The results showed that grape seed polyphenol was the best stability under the condition of low temperature (4 ℃), weak acid (pH4~6), avoiding light and low temperature (4 ℃), and the retention rate of grape seed polyphenols was above 95%. High concentration (40%~50%) of sucrose and glucose had enhanced effect on the stability of polyphenols, lactose concentration had no significant effects on the stability of polyphenols (P˃0.05), and different concentrations of starch could significantly reduce the stability of polyphenols (P<0.05). Compared with Tween-80, sodium thiosulfate, a stabilizer, was more destructive to polyphenols. Both oxidants and reducing agents had certain destructive effects on polyphenols, and the destructive effect of reducing agents on polyphenols was obviously stronger than oxidants. When 0.15% sodium benzoate and 0.1% potassium sorbate were added, the polyphenol retention rates were 87.95% and 89.44%, respectively. Potassium sorbate was more conducive to the stability of polyphenols. Among metal ions, Al3+, Fe3+ and Cu2+ had the strongest destruction degree to polyphenols, and the polyphenol retention rates decreased by 66.11%, 43.38% and 82.15% after 30 days of storage compared with the 0th day, respectively. Furthermore, grape seed polyphenols had strong antioxidant capacity and α-amylase inhibition ability. When the concentration was 2.5 mg/mL, the α-amylase inhibition rate could reach 97.97%. These results could provide theoretical basis for further development and utilization of grape seed polyphenols.
-
Keywords:
- Cabernet Sauvignon grape seed /
- polyphenols /
- stability /
- biological activity
-
植物多酚是广泛存在于植物根、皮、叶、果实中的次生代谢产物。据统计,植物中含有超过60000种结构多样的天然多酚,如类黄酮、酚酸、茋类等,这些天然多酚通过抑制氧化应激和清除自由基从而发挥对人体健康有益的作用,如预防或治疗炎症、糖尿病、肥胖、心血管疾病和癌症等[1-2]。目前,食品、化妆品、医药行业对于从天然植物中获得安全、高效且具有一定功能特性的天然多酚的需求正不断增加,关于多酚类物质的研究已然成为当下研究的热点之一[3-5]。
葡萄皮渣是葡萄酒酿造过程中产生的副产物,研究发现,葡萄皮渣中的葡萄籽中含有丰富的多酚类物质,如儿茶素、表儿茶素、没食子酸、原花青素及其聚合物等,是良好的酚类物质来源[6-8]。多酚类物质虽已被证实具有许多生物活性,但除自身结构影响外,其在加工和贮藏过程中易受光照、温度、pH、添加剂等不同条件的影响[9],发生氧化、降解或聚合,形成新物质使其性质改变从而导致生物活性降低,限制其进一步加工与应用。而多酚类物质对人体健康的影响实际上取决于其在食品加工过程中的稳定性,因此,为了准确评估多酚在食品加工行业真正的开发价值,就必须重视多酚在食品加工中的稳定性,这也正在成为当前生产领域的研究重点[10-13]。赤霞珠作为最受欢迎的酿酒品种之一,规模化的葡萄酒加工产业在带来经济效益的同时也带来了大量有待开发利用的葡萄籽副产物。因此,本文以酿酒后的赤霞珠葡萄籽为原材料,系统的考察pH、光照、温度、碳水化合物等不同加工、贮藏条件对葡萄籽多酚稳定性的影响,同时探讨葡萄籽多酚的生物活性(抗氧化、降血糖),旨在为有效开发利用赤霞珠葡萄籽资源提供更多参考依据,也为葡萄籽多酚相关产品在食品、医药等领域的开发、应用提供更多理论依据。
1. 材料与方法
1.1 材料与仪器
酿酒后赤霞珠葡萄籽脱脂粉 由实验室自制;福林酚试剂、AB-8大孔吸附树脂 北京索莱宝科技有限公司;无水碳酸钠、磷酸氢二钾、磷酸二氢钾、淀粉、蔗糖、乳糖、葡萄糖、氯化钠、氯化钾、氯化钙、氯化铁、氯化铝、氯化镁、硫酸铜、无水乙醇等试剂均为国产分析纯。
KQ-250DE数控超声清洗器 昆山市超声仪器有限公司;XMTD-400电热恒温水浴锅 北京市永光明医疗仪器有限公司;P4PC紫外可见分光光度计 上海美谱达仪器有限公司;3H16RI智能高速冷冻离心机 湖南赫西仪器装备有限公司;xianda-2000A旋转蒸发器 上海贤德实验仪器有限公司;Alpha 2-4 LSCplus冷冻干燥机 上海比朗仪器制造有限公司;HL-2S恒流泵、BS-100A自动部分收集器 上海沪西分析仪器厂有限公司。
1.2 实验方法
1.2.1 葡萄籽多酚样品的制备
按照范利君等[14]的方法制备葡萄籽多酚纯化物,在此条件下所制备的葡萄籽多酚纯度为80.35%。
1.2.2 多酚含量测定
葡萄籽多酚含量测定参照黄艳等[15]方法稍作修改。具体为:配制浓度为0.1 mg/mL没食子酸标准溶液,分别吸取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL上述没食子酸标准溶液于10 mL棕色容量瓶中,各加入蒸馏水10 mL、福林酚0.5 mL,混合均匀,室温下静置反应2 min后再加入15%碳酸钠溶液1.5 mL,用蒸馏水定容至刻度,摇匀,30 ℃水浴锅中避光反应30 min,在760 nm波长下测定吸光值,试验重复3次,得到标准曲线方程为:y=0.1317x−0.0029(R2=0.9992),按照标准曲线方法测定样品吸光值,并根据公式(1)计算样品多酚含量。
C=(A+0.0029)×N0.1317×1000 (1) 式中:C为样品中多酚含量(mg/mL);A为吸光值;N为稀释倍数。
1.2.3 葡萄籽多酚的稳定性研究
葡萄籽多酚稳定性测定相关样品处理参照张一格[16]方法并稍作修改。
1.2.3.1 pH对葡萄籽多酚稳定性的影响
分别配制pH为(2、3、4、5、6、7、8)的柠檬酸-磷酸氢二钠缓冲溶液,用不同pH值缓冲溶液溶解葡萄籽多酚样品,配制为一定浓度样品溶液,避光静置24 h后取样,按1.2.2中标准曲线方法操作,于760 nm波长下测定样品吸光值,根据公式(2)计算多酚保留率。
多酚保留率(%)=C1C0×100 (2) 式中:C1为处理后葡萄籽多酚含量(mg/mL);C0为处理前葡萄籽多酚含量(mg/mL)。
1.2.3.2 光照对葡萄籽多酚稳定性的影响
准确吸取三份2 mL葡萄籽多酚溶液,每份中各加入2 mL蒸馏水,分别置于室内避光、室内自然光、直射太阳光条件下静置5 h,每1 h取样,于760 nm波长下测定样品吸光值,计算多酚保留率。
1.2.3.3 温度对葡萄籽多酚稳定性的影响
准确吸取六份2 mL葡萄籽多酚溶液,每份中各加入2 mL蒸馏水,分别置于4、20、40、60、80、100 ℃条件下避光静置2 h后,于760 nm波长下测定样品吸光值,计算多酚保留率。
1.2.3.4 碳水化合物对葡萄籽多酚稳定性的影响
分别配制质量分数为10%、20%、30%、40%、50%的葡萄糖溶液、蔗糖溶液、乳糖溶液和淀粉溶液,吸取2 mL上述溶液并加入2 mL葡萄籽多酚溶液,混匀后,避光静置24 h后,于760 nm波长下测定样品吸光值,计算多酚保留率。
1.2.3.5 稳定剂对葡萄籽多酚稳定性的影响
准确吸取三份2 mL葡萄籽多酚溶液,分别加入2 mL 50 mg/mL Na2S2O3、2 mL吐温-80以及 2 mL蒸馏水,于室温条件下避光静置4 d,每1 d取样,于760 nm波长下测定样品吸光值,计算多酚保留率。
1.2.3.6 氧化剂对葡萄籽多酚稳定性的影响
准确吸取五份2 mL葡萄籽多酚溶液,分别加入2 mL 0、0.5%、1%、1.5%、2%的过氧化氢溶液和于室温条件下避光静置5 h,每1 h取样,于760 nm波长下测定样品吸光值,计算多酚保留率。
1.2.3.7 还原剂对葡萄籽多酚稳定性的影响
准确吸取五份2 mL葡萄籽多酚溶液,分别加入2 mL 0、0.5%、1%、1.5%、2%的亚硫酸钠溶液,于室温条件下避光静置5 h,每1 h取样,于760 nm波长下测定样品吸光值,计算多酚保留率。
1.2.3.8 防腐剂对葡萄籽多酚稳定性的影响
准确吸取五份2 mL葡萄籽多酚溶液,分别加入2 mL蒸馏水、0.05%、0.1%、0.15%、0.2%苯甲酸钠溶液和0.05%、0.1%、0.15%、0.2%山梨酸钾溶液,于室温条件下避光静置7 d后取样,于760 nm波长下测定样品吸光值,计算多酚保留率。
1.2.3.9 金属离子对葡萄籽多酚稳定性的影响
配制浓度均为50 mg/mL的氯化钠、氯化钾、氯化钙、氯化镁、氯化铝、氯化铁、硫酸铜溶液,吸取2 mL葡萄籽多酚溶液并加入2 mL上述金属离子溶液,室温条件下避光静置。分别在0、1、2、3、4、7、15、30 d取样,于760 nm波长下测定样品吸光值。
1.2.4 葡萄籽多酚的生物活性研究
1.2.4.1 葡萄籽多酚对DPPH自由基清除率的测定
参照王伟等[17]方法稍作修改。具体为:精密吸取1 mL不同浓度(10、20、30、40、50、60 μg/mL)的葡萄籽多酚溶液于棕色试管中,加入2 mL DPPH乙醇溶液(0.4 mmol/L,现用现配),摇匀后30 ℃避光静置反应30 min,517 nm波长处测定吸光值。Vc做阳性对照,根据公式(3)计算样品DPPH自由基清除率。
QD=(1−A1−A2A0)×100 (3) 式中:QD—DPPH自由基清除率(%);A1—样品+DPPH溶液;A2—样品+无水乙醇;A0—蒸馏水+DPPH溶液。
1.2.4.2 葡萄籽多酚对ABTS+自由基清除率的测定
参照Wang等[18]方法略作修改。具体为:在室温、避光条件下配制ABTS储备液。使用时用无水乙醇稀释储备液至在734 nm波长下吸光值为0.70±0.02(现用现配)。分别吸取0.1 mL不同浓度(50、100、200、300、400、500 μg/mL)样品溶液于试管中,再加入4.9 mL ABTS+工作液,室温下避光反应6 min后测定734 nm处的吸光值。VC做阳性对照,根据公式(4)计算样品ABTS+自由基清除率。
QA=(1−A1A2)×100 (4) 式中:QA—ABTS+自由基清除率(%);A1—样品+ABTS+稀释液;A2—蒸馏水+ABTS+工作液。
1.2.4.3 葡萄籽多酚还原力的测定
还原力的测定参照孙菡峥[19]的方法进行。具体为:吸取0.5 mL样品溶液,2.5 mL 1%(w/v)铁氰化钾溶液和2.5 mL pH=6.6磷酸缓冲溶液摇匀。50 ℃下反应20 min后加入2.5 mL 10%(w/v)的三氯乙酸溶液静置10 min。离心取2.5 mL上清液,再加入2.5 mL去离子水和0.5 mL 1%(w/v)FeCl3溶液,静置10 min后于700 nm处测量吸光值,Vc为阳性对照。
1.2.4.4 葡萄籽多酚抑制α-淀粉酶活性的测定
将葡萄籽多酚配制为不同浓度样品,参照罗丽平等[20]方法稍作修改,以阿卡波糖为阳性对照,按照表1所列方法进行试验,α-淀粉酶抑制率根据公式(5)计算。
表 1 α-淀粉酶活性抑制测定试验Table 1. Assay of α-amylase activity inhibition试剂 样品组(A2) 背景组(A1) 空白组(A0) α-淀粉酶溶液 0.5 0 0.5 磷酸盐缓冲液
(pH=6.8,0.1 mol/L)0.5 2 1 抑制剂 0.5 0.5 0 37 ℃水浴10 min 1%淀粉溶液 1 0 1 37 ℃水浴10 min DNS 2 2 2 沸水浴5 min后冷却至室温,于540 nm波长下测定吸光值 抑制率(%)=[1−(A2−A1)A0]×100 (5) 1.3 数据处理
以上实验均重复3次,实验结果采用平均值+标准差的形式表示,使用Excel 2019软件分析实验数据、IBM SPSS Statistics 19进行单因素方差分析(P<0.05),采用Origin 2021软件进行绘图。
2. 结果与分析
2.1 葡萄籽多酚的稳定性研究
2.1.1 pH对葡萄籽多酚稳定性的影响
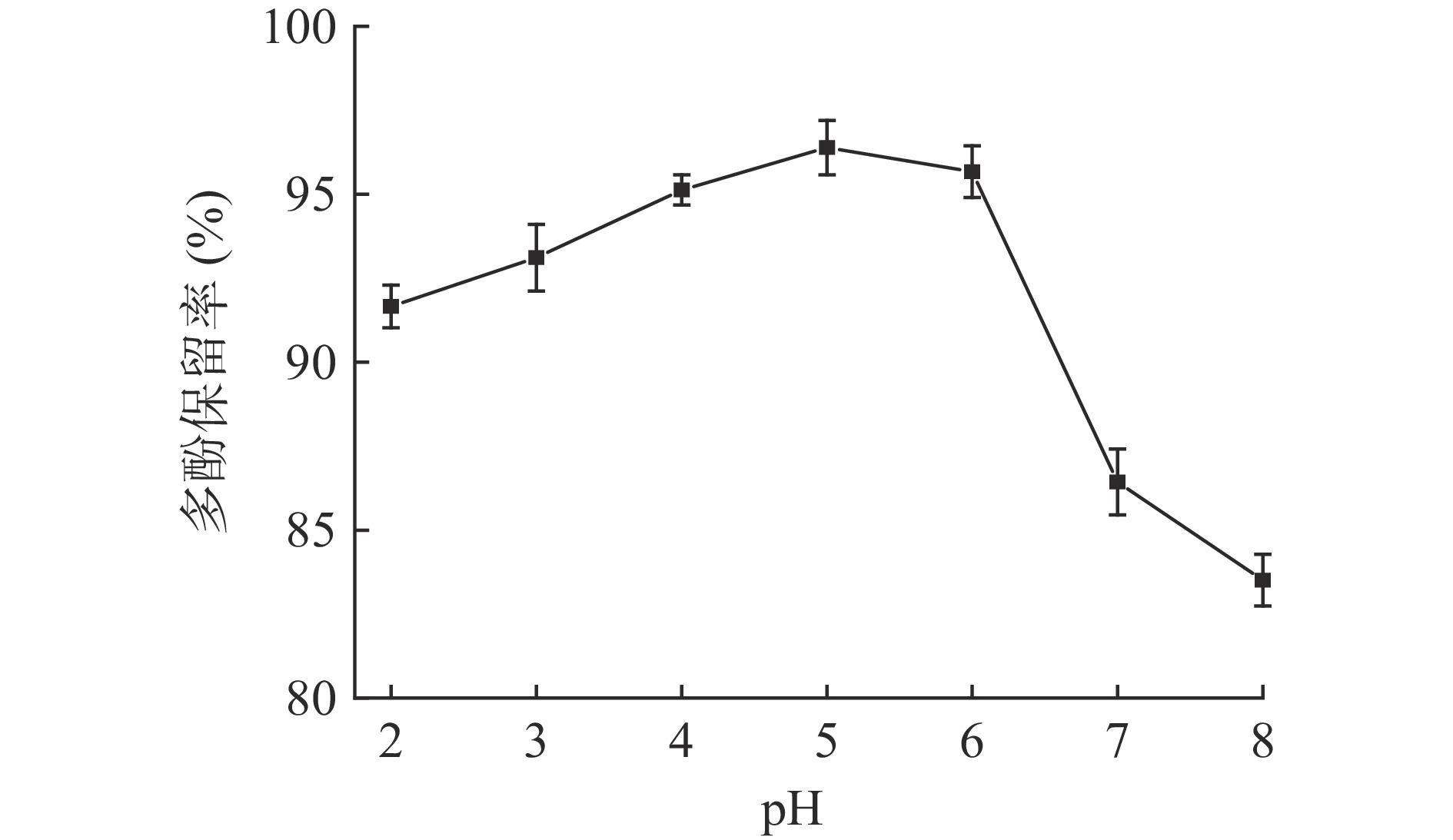
由图1可知,不同pH对葡萄籽多酚的稳定性均有一定影响。总体而言,葡萄籽多酚在酸性条件下稳定性较碱性条件更高。当pH为2~3条件下,葡萄籽多酚保留率均低于95%,但均高于90%,当pH为4~6条件下,多酚保留率呈先上升后下降趋势,在pH为5时有最大值96.39%,但在该pH范围内多酚保留率之间并无显著差异(P˃0.05);而在pH7、pH8条件下,葡萄籽多酚含量显著下降(P<0.05),多酚保留率分别下降了13.57%、16.49%。与碱性条件相比,葡萄籽多酚在酸性条件下降解速度较慢,出现这种现象可能是因为葡萄籽多酚结构中含有酚羟基,在碱性条件下结构易被破坏,生成其他物质,造成多酚含量下降[21]。以上结果说明,葡萄籽多酚在弱酸条件下稳定性更强。
2.1.2 光照对葡萄籽多酚稳定性的影响
由图2可知,光照强度对葡萄籽多酚保留率的变化具有显著影响(P<0.05),不论是在避光、室内散射光还是直射太阳光条件下,葡萄籽多酚保留率均随时间的延长逐渐下降,不同光照强度处理5 h后,葡萄籽多酚保留率分别下降至97.55%、92.70%、89.96%。由此可知,葡萄籽多酚对光敏感,直射太阳光照射下多酚稳定性最差,而在避光条件下最稳定。岳鑫等[9]研究红松种磷多酚光照稳定性,也发现多酚对光敏感,避光条件下更稳定,可能是因为多酚化合物中含有大量不饱和键,在光照条件下易发生自身氧化聚合,导致部分多酚降解。因此,在葡萄籽多酚的加工、贮藏过程中,应注意避光保存,避免直接暴露于室内强光的长时间照射。
2.1.3 温度对葡萄籽多酚稳定性的影响
某些食品在加工过程中可能会涉及到加热,而热处理会极大地促进多酚类物质(如槲皮素、芦丁等)的降解,使其生物活性下降[22]。由图3可知,温度对葡萄籽多酚稳定性的影响显著(P<0.05)。在6种不同温度条件下,随着温度的升高,多酚保留率逐渐下降。在4~40 ℃温度范围内,多酚保留率均在95%以上,且在4 ℃时最大(99.08%),而当温度高于40 ℃后,多酚保留率均低于95%,且在温度达到100 ℃时,多酚保留率已下降至86.33%,这一结果与林国荣等[23]所得葡萄多酚在温度为90 ℃时吸光度上升的结论略有出入,推测与不同葡萄品种所含的多酚种类和含量不同有关,同时经不同纯化条件纯化后所得的多酚种类也存在差异,因此,在经高温处理后,其多酚含量的变化趋势有可能存在不同[24]。以上实验结果说明葡萄籽多酚在高温条件下其结构易被破坏,从而导致稳定性降低,故葡萄籽多酚应于低温条件下进行保存。
2.1.4 碳水化合物对葡萄籽多酚稳定性的影响
由图4可知,不同碳水化合物对葡萄籽多酚稳定性均有一定影响。葡萄籽多酚溶液经葡萄糖和蔗糖处理24 h后,多酚保留率随其浓度的增加而上升,稳定性逐渐增强,说明高浓度(40%~50%)的葡萄糖和蔗糖对葡萄籽多酚稳定性均有一定的保护作用,而低浓度的葡萄糖和蔗糖添加量与高浓度相比对多酚的破环程度更大,这可能是因为溶液中水分活度降低,导致含氧量减少,抑制了多酚的降解速率,同时多酚中的部分花青素物质与糖类结合,使稳定性增强[25-26]。经不同浓度乳糖处理的葡萄籽多酚溶液多酚保留率无显著变化(P˃0.05),而经不同浓度淀粉处理后的多酚保留率与其他三种碳水化合物相比下降明显,且浓度越高,多酚保留率越低,这主要是因为多酚与淀粉之间可以通过范德华力、氢键、疏水作用等结合形成复合物,从而使多酚含量下降[27],而陈南等[28]研究发现,淀粉分子间交联所产生的物理空隙能够包裹和负载多种酚类物质,同时,淀粉与酚类物质之间会随淀粉添加量及植物多酚酚羟基数目的增加而形成更连续的氢键网络结构,从而强化淀粉-多酚复合物的稳定性,减少其在人体消化道的损害,从而提高多酚的生物可及性和生物利用度[28]。
2.1.5 稳定剂对葡萄籽多酚稳定性的影响
由图5可知,添加硫代硫酸钠、吐温-80、蒸馏水的葡萄籽多酚溶液在反应4 d内多酚保留率均呈下降趋势且不同处理组之间影响显著(P<0.05)。反应4 d结束后,经硫代硫酸钠、吐温-80处理后的葡萄籽多酚溶液中多酚保留率分别下降了13.78%、6.17%,对照组样品多酚保留率仅下降了2.69%,以上结果说明在加工过程中添加硫代硫酸钠和吐温-80对葡萄籽多酚的稳定性有一定影响,但硫代硫酸钠的破坏作用更强,与张一格[16]的研究结果一致,推测可能与两种物质不同的性质有关。在前人的研究中发现,吐温-80由于其具有较好的增溶效果可被用于多酚类物质的提取,适宜的质量浓度(20%)能得到较高多酚得率,而当其质量浓度过高时多酚得率反而下降,在本研究中经吐温-80处理后的多酚保留率有一定的下降,除多酚自身存在一定降解外,也可能与实验过程中吐温-80较高的质量浓度有关[29]。而硫代硫酸钠属于还原剂也属于金属盐,多酚与氧气、光照等氧化因素作用,会产生氧化产物与硫代硫酸钠反应,同时,多酚结构式中含有的邻苯二酚或邻苯三酚基团可以和金属离子配位,从而导致多酚含量下降[30]。
2.1.6 氧化剂对葡萄籽多酚稳定性的影响
H2O2在食品安全中的安全使用添加剂量是低于2%,所以在添加H2O2时其含量要控制在2%之内。由图6可知,在实验设计浓度范围内,氧化剂H2O2对葡萄籽多酚具有一定破坏作用。随着处理时间的增加,多酚保留率呈下降趋势,而在同一处理时间,多酚保留率又随氧化剂添加浓度的增加明显降低。经不同浓度氧化剂处理5 h后,各处理组多酚保留率分别下降了3.85%、4.92%、5.66%、6.14%、8.62%,与对照组(0%)相比,氧化剂添加浓度在1%范围内多酚保留率无明显差异(P˃0.05),而在1%~2%浓度范围内,多酚保留率差异显著(P<0.05),说明低浓度的氧化剂对葡萄籽多酚稳定性影响不大,葡萄籽多酚具有一定程度抗氧化能力。
2.1.7 还原剂对葡萄籽多酚稳定性的影响
由图7可知,还原剂亚硫酸钠对葡萄籽多酚具有较强的破坏作用。经还原剂亚硫酸钠处理后的葡萄籽多酚保留率随时间的延长均呈下降趋势,各处理组在反应5 h结束后,多酚保留率分别下降了3.85%、12.75%、22.86%、27.04%、32.86%,与对照组(0%)相比,各处理组多酚保留率随还原剂浓度的增大下降幅度增大,说明葡萄籽多酚耐还原能力较差。此外,通过对比氧化剂和还原剂在相同浓度处理后的多酚保留率,可以看出,在相同条件下,虽然氧化剂与还原剂对葡萄籽多酚均有破环作用,但还原剂对葡萄籽多酚的破坏作用明显强于氧化剂,这可能与亚硫酸钠既具有还原性又具有氧化性的化学性质有关[31],与林国荣等[23]研究结果一致。
2.1.8 防腐剂对葡萄籽多酚稳定性的影响
由图8可知,防腐剂对葡萄籽多酚稳定性影响显著。由于葡萄籽多酚本身不稳定,未做任何处理也会有一定程度降解。当葡萄籽多酚用不同浓度苯甲酸钠、山梨酸钾处理7 d后,多酚保留率随浓度的增加呈先下降再上升再下降的趋势。苯甲酸钠在浓度为0.15%时有最大多酚保留率为87.95%,山梨酸钾在浓度为0.1%时有最大多酚保留率为89.44%,说明防腐剂对葡萄籽多酚的稳定性有一定影响,但当选择适宜的浓度时,可以减小对多酚的破坏,提高葡萄籽多酚的稳定性,这可能是因为适宜浓度防腐剂可以抑制微生物的活性,减少微生物对多酚的利用,从而提高多酚稳定性[32]。此外,通过对比相同浓度下使用不同防腐剂处理后的多酚保留率,可以看出,苯甲酸钠对葡萄籽多酚的破坏程度更大,这可能与两种防腐剂不同的理化性质有关。
2.1.9 金属离子对葡萄籽多酚稳定性的影响
金属离子对葡萄籽多酚稳定性的影响如表2所示,贮藏30 d后,7种离子对葡萄籽多酚稳定性均有一定的影响。通过对比CK组在储存30 d后多酚溶液的吸光值下降率(17.60%),其中,Al3+、Fe3+、Cu2+对葡萄籽多酚稳定性存在显著影响(P<0.05),与第0 d相比,贮藏30 d以后,添加了Al3+、Fe3+、Cu2+的葡萄籽多酚溶液吸光值分别下降了66.11%、43.38%、82.15%,同时,由于这三种离子自身颜色的存在,使得多酚溶液颜色发生改变,且有明显沉淀产生,其中添加Fe3+的多酚溶液中产生沉淀最多,且多酚含量在Fe3+加入的同时就已经大量降低,说明Al3+、Fe3+、Cu2+三种离子对葡萄籽多酚的稳定性影响较大。而添加Na+、K+、Ca2+、Mg2+的多酚溶液吸光值分别下降了15.80%、9.47%、16.64%、2.28%,说明Na+、K+、Mg2+对葡萄籽多酚的稳定性具有一定保护作用,而Ca2+对多酚稳定性影响不大。前人研究表明,植物多酚结构中存在多个邻位酚羟基,可以作为一种多基配体与金属离子发生络合反应形成稳定的五元环螯合物,由于植物多酚配位基团多、络合能力强、络合物稳定,因此某些金属离子会与多酚络合后形成沉淀,同时某些高价金属离子如Cr6+、Fe3+等络合的同时也会将金属离子从高价态还原至低价态[33],而不同金属离子与多酚结合后会形成不同的螯合物,使其结构发生改变,从而影响多酚的稳定性[9]。因此,在葡萄籽多酚的加工、储存、使用过程中,应尽量避免与铝、铁、铜制容器或含有Al3+、Fe3+、Cu2+的容器接触。虽然在本研究中添加Al3+、Fe3+、Cu2+三种离子使多酚保留率下降,但目前已有研究发现,Al3+、Fe3+、Cu2+等过渡金属易与多酚分子组装形成金属-多酚网络(metal polyphenol network,MPN),通过调控这一过程可以形成不同形状和功能的薄膜或涂层从而应用于食品工业、污水净化和生物医药等领域[34],因此,关于金属离子对于多酚稳定性的影响应保持辩证的态度。
表 2 金属离子对葡萄籽多酚稳定性的影响Table 2. Influence of metal ions on stability of grape seed polyphenols离子 吸光值(Abs) 处理0 d 处理1 d 处理2 d 处理3 d 处理4 d 处理7 d 处理15 d 处理30 d CK 0.807+0.008c 0.806+0.005bc 0.806+0.003b 0.792+0.001c 0.789+0.005bc 0.781+0.007b 0.719+0.008c 0.665+0.008d Na+ 0.888+0.003a 0.855+0.010a 0.849+0.004a 0.836+0.007a 0.835+0.004a 0.785+0.008ab 0.749+0.005b 0.748+0.004c K+ 0.830+0.002b 0.816+0.010b 0.811+0.007b 0.802+0.002b 0.792+0.006b 0.794+0.004a 0.781+0.006a 0.752+0.004c Ca2+ 0.795+0.003c 0.803+0.003c 0.796+0.003c 0.756+0.008d 0.746+0.010d 0.721+0.003c 0.685+0.004d 0.670+0.003d Mg2+ 0.803+0.003c 0.805+0.002bc 0.791+0.009c 0.784+0.002c 0.780+0.007c 0.783+0.008b 0.782+0.005a 0.785+0.003b Al3+ 0.735+0.004e 0.733+0.006e 0.724+0.005d 0.652+0.006f 0.551+0.003g 0.388+0.004f 0.324+0.004e 0.249+0.001e Fe3+ 0.582+0.008f 0.581+0.003f 0.580+0.008f 0.489+0.004g 0.463+0.006e 0.432+0.011d 0.388+0.011a 0.329+0.008a Cu2+ 0.754+0.004d 0.752+0.005d 0.678+0.009e 0.677+0.003e 0.567+0.002f 0.447+0.003e 0.246+0.002f 0.135+0.002f 注:表中数据为平均值+标准误。不同小写字母代表差异显著(P<0.05)。 2.2 葡萄籽多酚的生物活性研究
2.2.1 葡萄籽多酚的抗氧化活性
由图9可知,在实验测定浓度范围内,葡萄籽多酚表现出较强的清除DPPH、ABTS+自由基的能力,且多酚浓度与清除自由基的能力呈正相关,当浓度在60 μg/mL时,葡萄籽多酚和VC对DPPH自由基的清除能力分别达到95.03%和96.44%,当浓度在500 μg/mL时,葡萄籽多酚和VC对ABTS+自由基的清除能力分别达到94.61%和96.40%,二者清除效果相当,说明当达到一定浓度时,葡萄籽多酚具有较强的DPPH、ABTS+自由基清除能力,同时,在相同浓度条件下,葡萄籽多酚的还原能力与VC接近,以上结果均说明经纯化后的葡萄籽多酚具有很强的抗氧化能力。
2.2.2 葡萄籽多酚对α-淀粉酶活性的抑制作用
由图10可知,在0.5~3.0 mg/mL浓度范围内,葡萄籽多酚和阳性对照阿卡波糖的α-淀粉酶抑制率均与样品浓度呈正相关,葡萄籽多酚在0.5~2.0 mg/mL浓度范围内其抑制率均低于同浓度下对照组阿卡波糖,但当其浓度大于2.0 mg/mL时,抑制率大于对照组,以上结果说明,当达到一定剂量时,葡萄籽多酚具有较强的抑制α-淀粉酶活性的能力。与郭雅婧等[35]的研究结果一致。
3. 讨论与结论
本试验研究了酿酒后赤霞珠葡萄籽中提取纯化得到的葡萄籽多酚的稳定性和体外生物活性,结果表明:葡萄籽多酚若需长期贮藏应置于避光、低温(4 ℃)环境中,在此条件下可最大程度保留其活性成分,这一结果与林国荣等[23]研究结果一致。不同的pH环境对葡萄籽多酚的稳定性影响显著,在本研究中,葡萄籽多酚在弱酸(pH4~6)条件下具有较好的稳定性且在pH为5时有最大多酚保留率,这一结果与岳鑫等[9]报道的红松种鳞多酚在pH<3条件下稳定性最好有所不同,这可能与两者所含不同的多酚种类有关。高浓度(40%~50%)的蔗糖和葡萄糖可以增强葡萄籽多酚的稳定性,且蔗糖优于葡萄糖,郑燕菲等[26]也在研究中发现高浓度的蔗糖更有利于单性木兰叶多酚的稳定,乳糖对葡萄籽多酚稳定性并无显著影响,而淀粉显著降低葡萄籽多酚的稳定性,这一结果与王红[36]所得淀粉溶液更易使燕麦麸皮多酚稳定性下降的结论一致。氧化剂和还原剂对葡萄籽多酚均有一定破坏作用,但1%浓度范围内的氧化剂对葡萄籽多酚稳定性并无显著影响,而还原剂对葡萄籽多酚的破坏作用更加明显,说明葡萄籽多酚耐还原性较差。此外,与吐温-80相比,稳定剂硫代硫酸钠更易使葡萄籽多酚稳定性下降,因此,在葡萄籽多酚的加工过程中应尽量避免硫代硫酸钠的添加。添加防腐剂会影响葡萄籽多酚的稳定性,当选择0.15%的苯甲酸钠和0.1%的山梨酸钾时多酚保留率最高,从整体来看,山梨酸钾比苯甲酸钠更利于多酚的稳定,此结果弥补了林国荣等[23]仅用苯甲酸钠单一防腐剂考察葡萄籽多酚稳定性的不足;不同金属离子对葡萄籽多酚稳定性存在不同影响,其中Na+、K+、Mg2+对葡萄籽多酚具有保护作用,可以降低多酚降解速率,Ca2+对多酚稳定性影响不大,而Al3+、Fe3+、Cu2+对葡萄籽多酚的破坏作用更明显,但关于Al3+、Fe3+、Cu2+等金属离子对多酚的稳定性的影响,应考虑其实际应用方向,而不能片面地认为其稳定性的降低即对其在加工利用中不利。生物活性研究表明,当达到一定质量浓度,葡萄籽多酚具有较强的抗氧化能力和抑制α-淀粉酶活性的能力,可作为今后降糖新药的研发,以减少降糖药长期服用对于人体肝肾的损伤,研究结果可为葡萄籽多酚的加工和保存以及进一步综合利用提供一定理论依据。
-
表 1 α-淀粉酶活性抑制测定试验
Table 1 Assay of α-amylase activity inhibition
试剂 样品组(A2) 背景组(A1) 空白组(A0) α-淀粉酶溶液 0.5 0 0.5 磷酸盐缓冲液
(pH=6.8,0.1 mol/L)0.5 2 1 抑制剂 0.5 0.5 0 37 ℃水浴10 min 1%淀粉溶液 1 0 1 37 ℃水浴10 min DNS 2 2 2 沸水浴5 min后冷却至室温,于540 nm波长下测定吸光值 表 2 金属离子对葡萄籽多酚稳定性的影响
Table 2 Influence of metal ions on stability of grape seed polyphenols
离子 吸光值(Abs) 处理0 d 处理1 d 处理2 d 处理3 d 处理4 d 处理7 d 处理15 d 处理30 d CK 0.807+0.008c 0.806+0.005bc 0.806+0.003b 0.792+0.001c 0.789+0.005bc 0.781+0.007b 0.719+0.008c 0.665+0.008d Na+ 0.888+0.003a 0.855+0.010a 0.849+0.004a 0.836+0.007a 0.835+0.004a 0.785+0.008ab 0.749+0.005b 0.748+0.004c K+ 0.830+0.002b 0.816+0.010b 0.811+0.007b 0.802+0.002b 0.792+0.006b 0.794+0.004a 0.781+0.006a 0.752+0.004c Ca2+ 0.795+0.003c 0.803+0.003c 0.796+0.003c 0.756+0.008d 0.746+0.010d 0.721+0.003c 0.685+0.004d 0.670+0.003d Mg2+ 0.803+0.003c 0.805+0.002bc 0.791+0.009c 0.784+0.002c 0.780+0.007c 0.783+0.008b 0.782+0.005a 0.785+0.003b Al3+ 0.735+0.004e 0.733+0.006e 0.724+0.005d 0.652+0.006f 0.551+0.003g 0.388+0.004f 0.324+0.004e 0.249+0.001e Fe3+ 0.582+0.008f 0.581+0.003f 0.580+0.008f 0.489+0.004g 0.463+0.006e 0.432+0.011d 0.388+0.011a 0.329+0.008a Cu2+ 0.754+0.004d 0.752+0.005d 0.678+0.009e 0.677+0.003e 0.567+0.002f 0.447+0.003e 0.246+0.002f 0.135+0.002f 注:表中数据为平均值+标准误。不同小写字母代表差异显著(P<0.05)。 -
[1] ZHANG X L, GUO Y S, WANG C H, et al. Phenolic compounds fromOriganum vulgare and their antioxidant and antiviral activities[J]. Food Chemistry,2014,152(2):300−306.
[2] XIAO J. Recent advances on the stability of dietary polyphenols[J]. eFood,2022,3(3):e21.
[3] AHMAD-QASEM M H, AHMAD-QASEM B H, BARRAJON-CATALAN E, et al. Drying and storage of olive leaf extracts. Influence on polyphenols stability[J]. Industrial Crops and Products,2016,79:232−239. doi: 10.1016/j.indcrop.2015.11.006
[4] 梁进欣, 白卫东, 杨娟, 等. 植物多酚的研究进展[J]. 农产品加工,2020(21):85−91. [LANG Jinxin, BAI Weidong, YANG Juan, et al. Research progress of plant polyphenols[J]. Processing of Agricultural Products,2020(21):85−91. LANG Jinxin, BAI Weidong, YANG Juan, et al. Research progress of plant polyphenols[J]. Processing of Agricultural Products, 2020(21): 85-91.
[5] SUN C, ZHAO C, GUVEN E C, et al. Dietary polyphenols as antidiabetic agents: Advances and opportunities[J]. Food Frontiers,2020,1(1):18−44. doi: 10.1002/fft2.15
[6] SIROHI R, TARAFDAR A, SINGH S, et al. Green processing and biotechnological potential of grape pomace: Current trends and opportunities for sustainable biorefinery[J]. Bioresource Technology,2020,314:123771. doi: 10.1016/j.biortech.2020.123771
[7] XIA E Q, DENG G F, GUO Y J, et al. Biological activities of polyphenols from grapes[J]. International Journal of Molecular Sciences,2010,11(2):622−646. doi: 10.3390/ijms11020622
[8] GUPTA M, DEY S, MARBANIANG D, et al. Grape seed extract: having a potential health benefits[J]. Journal of Food Science and Technology,2020,57(4):1205−1215. doi: 10.1007/s13197-019-04113-w
[9] 岳鑫, 包怡红. 加工条件对红松种鳞多酚稳定性的影响[J]. 东北林业大学学报,2019,47(11):100−104,112. [YUE Xin, BAO Yihong. Effect of processing conditions on the stability of polyphenols in Korean pine seed scales[J]. Journal of Northeast Forestry University,2019,47(11):100−104,112. YUE Xin, BAO Yihong. Effect of processing conditions on the stability of polyphenols in Korean pine seed scales[J]. Journal of Northeast Forestry University, 2019, 47(11): 100-104, 112.
[10] KATZ I H, NAGAR E E, OKUN Z, et al. The link between polyphenol structure, antioxidant capacity and shelf-life stability in the presence of fructose and ascorbic acid[J]. Molecules,2020,25(1):225. doi: 10.3390/molecules25010225
[11] CAO H, SAROGLU O, KARADAG A, et al. Available technologies on improving the stability of polyphenols in food processing[J]. Food Frontiers,2021,2(2):109−139. doi: 10.1002/fft2.65
[12] 符群, 吴小杰. 刺玫果不同醇提物对降糖酶活性影响及其加工稳定性[J]. 中南林业科技大学学报,2022,42(3):143−151. [FU Qun, WU Xiaojie. Effect of different ethanol extracts from Rosa davurica on the activity of glucose lowering enzyme and its processing stability[J]. Journal of Central South Forestry University,2022,42(3):143−151. doi: 10.14067/j.cnki.1673-923x.2022.03.015 FU Qun, WU Xiaojie. Effect of different ethanol extracts from Rosa davurica on the activity of glucose lowering enzyme and its processing stability[J]. Journal of Central South Forestry University, 2022, 42(3): 143-151. doi: 10.14067/j.cnki.1673-923x.2022.03.015
[13] SIDOR A, DROZDZYNSKA A, BRZOZOWSKA A, et al. The effect of plant additives on the stability of polyphenols in dried black chokeberry (Aronia melanocarpa) fruit[J]. Foods,2020,10(1):44. doi: 10.3390/foods10010044
[14] 范利君, 宋安康, 王志鹏, 等. 葡萄籽多酚提取物在体外模拟消化过程中抗氧化成分及抗氧化活性的变化[J]. 食品科技,2022,47(6):235−242. [FAN Lijun SONG Ankang, WAGN Zhipeng, et al. Changes of antioxidant components and antioxidant activity of grape seed polyphenol extract during simulated digestionin vitro[J]. Food Technology,2022,47(6):235−242. doi: 10.3969/j.issn.1005-9989.2022.6.spkj202206035 FAN Lijun SONG Ankang, WAGN Zhipeng, et al. Changes of antioxidant components and antioxidant activity of grape seed polyphenol extract during simulated digestion in vitro[J]. Food Technology, 2022, 47(6): 235-242. doi: 10.3969/j.issn.1005-9989.2022.6.spkj202206035
[15] 黄艳, 孙怡婷, 张见明, 等. 松毛菇多酚的提取及纯化工艺研究[J]. 食品研究与开发,2019,40(21):106−114. [HUANG Yan, SUN Yiting, ZHANG Jianming, et al. Study on extraction and purification of polyphenols from Tricholoma matsutake[J]. Food Research and Development,2019,40(21):106−114. HUANG Yan, SUN Yiting, ZHANG Jianming, et al. Study on Extraction and Purification of Polyphenols from Tricholoma matsutake[J]. Food Research and Development, 2019, 40(21): 106-114.
[16] 张一格. 核桃不同部位多酚的比较、消化特性及稳定性研究[D]. 合肥: 合肥工业大学, 2021 ZHANG Yige. Comparison, digestive characteristics and stability of polyphenols from different parts of walnut[D]. Hefei: Hefei University of Technology, 2021.
[17] 王伟, 布丽根·加冷别克, 胡晓东. 葡萄籽原花青素的提取工艺优化及其抗氧化活性研究[J]. 保鲜与加工,2020,20(6):101−108. [WANG Wei, BULIGENG·Jialengbieke, HU Xiaodong. Optimization of extraction process and antioxidant activity of grape seed proanthocyanidins[J]. Storage and Process,2020,20(6):101−108. WANG Wei, BULIGENG·Jialengbieke, HU Xiaodong. Optimization of extraction process and antioxidant activity of grape seed proanthocyanidins[J]. Storage and Process, 2020, 20(6): 101-108.
[18] WANG L, BEI Q, WU Y N, et al. Characterization of soluble and insoluble-bound polyphenols from Psidium guajava L. leaves co fermented with Monascus anka and Bacillus sp. and their bio-activities[J]. Journal of Functional Foods,2017,32:149−159. doi: 10.1016/j.jff.2017.02.029
[19] 孙菡峥. 龙眼核多酚的分离纯化及抗氧化性能的研究[D]. 无锡: 江南大学, 2019 SUN Hanzheng. Studies on the separation, purification and antioxidant activity of polyphenols from longan seeds[D]. Wuxi: Jiangnan University, 2019.
[20] 罗丽平, 李冰晶, 赵景芳, 等. 三种食用菌提取物体外抗氧化与降血糖活性研究[J]. 食品工业科技,2020,41(20):324−329. [LUO Liping, LI Bingjing, ZHAO Jingfang, et al. In vitro antioxidant and hypoglycemic activities of three edible fungi extracts[J]. Science and Technology of Food Industry,2020,41(20):324−329. LUO Liping, LI Bingjing, ZHAO Jingfang, et al. In vitro antioxidant and hypoglycemic activities of three edible fungi extracts[J]. Science and Technology of Food Industry, 2020, 41(20): 324-329.
[21] 颜征, 张海晖, 李亚群, 等. 莲子壳多酚的抗氧化活性和稳定性[J]. 中国食品学报,2019,19(12):89−95. [YAN Zheng, ZHANG Haihui, LI Yaqun, et al. Antioxidant activity and stability of lotus seed shell polyphenols[J]. Chinese Journal of Food,2019,19(12):89−95. YAN Zheng, ZHANG Haihui, LI Yaqun, et al. Antioxidant activity and stability of lotus seed shell polyphenols[J]. Chinese Journal of Food, 2019, 19(12): 89-95.
[22] ZHANG H, WANG M, XIAO J. Stability of polyphenols in food processing[J]. Advances in Food and Nutrition Research,2022,102:1−45.
[23] 林国荣, 杨丽洪. 加工条件对葡萄多酚稳定性影响的研究[J]. 食品科技,2019,44(11):267−272. [LING Guorong, YANG Lihong. Study on the influence of processing conditions on the stability of grape polyphenols[J]. Food Science and Technology,2019,44(11):267−272. LING Guorong, YANG Lihong. Study on the influence of processing conditions on the stability of grape polyphenols[J]. Food Science and Technology, 2019, 44(11): 267-272.
[24] 赵竞, 景浩. 不同品种葡萄皮、籽提取物多酚含量及抗氧化能力的比较研究[J]. 食品工业科技,2009,30(10):154−158. [ZHAO Jing, JING Hao. Comparative study on polyphenol content and antioxidant capacity of extracts from grape skin and seed of different varieties[J]. Science and Technology of Food Industry,2009,30(10):154−158. ZHAO Jing, JING Hao. Comparative study on polyphenol content and antioxidant capacity of extracts from grape skin and seed of different varieties[J]. Science and Technology of Food Industry, 2009, 30 (10): 154-158.
[25] 樊金玲, 武涛, 朱文学, 等. 蔗糖含量对牡丹花色苷贮藏稳定性和降解动力学的影响[J]. 食品研究与开发,2010,31(2):75−78. [FAN Jingling, WU Tao, ZHU Wenxue, et al. Effect of sucrose content on storage stability and degradation kinetics of peony anthocyanins[J]. Food Research and Development,2010,31(2):75−78. FAN Jingling, WU Tao, ZHU Wenxue, et al. Effect of sucrose content on storage stability and degradation kinetics of peony anthocyanins[J]. Food Research and Development, 2010, 31(2): 75-78.
[26] 郑燕菲, 许建本, 黄秋萍, 等. 单性木兰叶多酚的稳定性及抗氧化性研究[J]. 食品工业科技,2020,41(14):41−45,51−52. [ZHENG Yanfei, XU Janben, HUANG Qiuping, et al. Studies on the stability and antioxidation of polyphenols from leaves of Monoclonal magnolia[J]. Science and Technology of Food Industry,2020,41(14):41−45,51−52. ZHENG Yanfei, XU Janben, HUANG Qiuping, et al. Studies on the Stability and Antioxidation of Polyphenols from Leaves of Monoclonal Magnolia[J]. Science and Technology of Food Industry, 2020, 41(14): 41-45, 51-52.
[27] 肖遥, 曹悦, 任顺成, 等. 多酚与玉米淀粉相互作用研究[J]. 河南工业大学学报(自然科学版),2020,41(1):45−51. [XIAO Yao, CAO Yue, RENG Shuncheng, et al. Study on the interaction between polyphenols and corn starch[J]. Journal of Henan University of Technology (Natural Science Edition),2020,41(1):45−51. XIAO Yao, CAO Yue, RENG Shuncheng, et al. Study on the interaction between polyphenols and corn starch[J]. Journal of Henan University of Technology (Natural Science Edition), 2020, 41(1): 45-51.
[28] 陈南, 高浩祥, 何强, 等. 植物多酚与淀粉的分子相互作用研究进展[J]. 食品工业科技,2023,44(2):497−505. [CHEN Nan, GAO Haoxiang, HE Qiang, et al. Research progress in molecular interaction between plant polyphenols and starch[J]. Science and Technology of Food Industry,2023,44(2):497−505. CHEN Nan, GAO Haoxiang, HE Qiang, et al. Research progress in molecular interaction between plant polyphenols and starch[J]. Science and Technology of Food Industry, 2023, 44(2): 497-505.
[29] 陈琼, 吴菲菲, 李化强, 等. 超声吐温80提取杠板归多酚及其抗氧化活性研究[J]. 邵阳学院学报(自然科学版),2020,17(2):67−75. [CHEN Qiong, WU Feifei, LI Huaqiang, et al. Study on ultrasonic tween 80 extraction and antioxidant activity of polyphenol from Periploca arguta[J]. Journal of Shaoyang University (Natural Science Edition),2020,17(2):67−75. doi: 10.3969/j.issn.1672-7010.2020.02.010 CHEN Qiong, WU Feifei, LI Huaqiang, et al. Study on ultrasonic tween 80 extraction and antioxidant activity of polyphenol from periploca arguta[J]. Journal of Shaoyang University (Natural Science Edition), 2020, 17 (2): 67-75. doi: 10.3969/j.issn.1672-7010.2020.02.010
[30] 肖益蓉. 基于金属-多酚络合物复合纳滤膜的构筑及其在水处理中的应用[D]. 金华: 浙江师范大学, 2021 XIAO Yirong. Construction of composite nanofiltration membrane based on metal polyphenol complex and its application in water treatment[D]. Jinhua: Zhejiang Normal University, 2021.
[31] 唐霄, 孙杨赢, 潘道东, 等. 酶法优化菠萝皮多酚提取工艺及其稳定性研究[J]. 核农学报,2018,32(2):335−343. [TANG Xiao, SUN Yangying, PAN Daodong, et al. Optimization of polyphenol extraction from pineapple peel by enzymatic method and its stability[J]. Journal of Nuclear Agriculture,2018,32(2):335−343. doi: 10.11869/j.issn.100-8551.2018.02.0335 TANG Xiao, SUN Yangying, PAN Daodong, et al. Optimization of polyphenol extraction from pineapple peel by enzymatic method and its stability[J]. Journal of Nuclear Agriculture, 2018, 32 (2): 335-343. doi: 10.11869/j.issn.100-8551.2018.02.0335
[32] 高凝轩, 李斌, 杜姗姗, 等. 黑果腺肋花楸多酚稳定性的研究[J]. 食品科学,2016,37(23):20−24. [GAO Ningxuan, LI Bin, DU Shanshan, et al. Studies on the stability of polyphenol in Sorbus nigra[J]. Food Science,2016,37(23):20−24. GAO Ningxuan, LI Bin, DU Shanshan, et al. Studies on the Stability of Polyphenol in Sorbus nigra[J]. Food Science, 2016, 37(23): 20-24.
[33] 张力平, 孙长霞, 李俊清, 等. 植物多酚的研究现状及发展前景[J]. 林业科学,2005(6):160−165. [ZHAGN Lipin, SUN Changxia, LI Junqing, et al. Research status and development prospects of plant polyphenols[J]. Forestry Science,2005(6):160−165. doi: 10.11707/j.1001-7488.20050627 ZHAGN Lipin, SUN Changxia, LI Junqing, et al. Research status and development prospects of plant polyphenols[J]. Forestry Science, 2005(6): 160-165. doi: 10.11707/j.1001-7488.20050627
[34] 焦婷, 王稳航, 程芸, 等. 金属-多酚网络的组装、功能特性及其在食品领域中的应用研究进展[J]. 食品科学,2022,43(1):232−239. [JIAO Tin, WANG Wenhang, CHENG Yun, et al. Research progress in the assembly, functional properties and application of metal polyphenol networks in food field[J]. Food Science,2022,43(1):232−239. doi: 10.7506/spkx1002-6630-20200814-182 JIAO Tin, WANG Wenhang, CHENG Yun, et al. Research progress in the assembly, functional properties and application of metal polyphenol networks in food field[J]. Food Science, 2022, 43 (1): 232-239. doi: 10.7506/spkx1002-6630-20200814-182
[35] 郭雅靖, 颜梦婷, 林圣楠, 等. 几种原花青素的降血糖作用及与常见食品原料的结合研究[J]. 食品科学,2017,38(19):156−163. [GUO Yajing, YAN Mengtin, LIN Shengnan, et al. Study on hypoglycemic effect of several proanthocyanidins and their combination with common food materials[J]. Food Science,2017,38(19):156−163. doi: 10.7506/spkx1002-6630-201719025 GUO Yajing, YAN Mengtin, LIN Shengnan, et al. Study on hypoglycemic effect of several proanthocyanidins and their combination with common food materials[J]. Food Science, 2017, 38 (19): 156-163. doi: 10.7506/spkx1002-6630-201719025
[36] 王红. 燕麦麸皮多酚类物质的提取、抗氧化性及稳定性研究[D]. 哈尔滨: 哈尔滨商业大学, 2013 WANG Hong. Extraction, antioxidant activity and stability of polyphenols from oat bran[D]. Harbin: Harbin University of Commerce, 2013.
-
期刊类型引用(4)
1. 王明洁. 不同叶幕结构对威代尔葡萄多酚及抗氧化性的影响. 中国果树. 2024(03): 88-92 .  百度学术
百度学术
2. 卢千山,童舟,赵海英,常雅宁,周英骏. 紫馚生菜多酚的抗氧化、抑菌活性与稳定性研究. 中国食品添加剂. 2024(05): 150-159 .  百度学术
百度学术
3. 胡童霞,张楠,朱鑫麗,曾彬,吴帆,李红亮. 荞麦蜂花粉多酚对α-淀粉酶的抑制作用. 天然产物研究与开发. 2024(06): 930-937 .  百度学术
百度学术
4. 严欣,方一泓,刘元钰,卢玉栋. 葡萄籽多酚提取工艺研究及其功效评价. 云南化工. 2024(07): 144-147 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:









 下载:
下载:



