Preparation and Stability of Nanostructured Lipid Carriers of Phytosterols with Walnut Oil
-
摘要: 本研究通过高压均质法采用核桃油为液体脂质制备用于封装、保护植物甾醇(Phytosterol,PS)的纳米结构脂质载体(Nanostructured lipid carriers,NLC)。以平均粒径、多分散指数、Zeta电位及包封率等为主要评价指标,对制备工艺参数及配方进行优化,同时对优化后的PS-NLC进行形貌观察及稳定性研究。通过正交试验确定制备PS-NLC的最佳比例为总脂质浓度10%,硬脂酸和核桃油的比例为2:3,大豆卵磷脂浓度为1.2%。制备得到的PS-NLC外观呈球形,粒径较小且分布均匀。PS-NLC的稳定性结果表明:PS-NLC在4 ℃下储藏28 d稳定性良好;在使用时可以在5~100倍之间进行稀释,具有良好的稀释稳定性;添加2%的蔗糖对PS-NLC的冻干保护效果最佳。本文利用核桃油作为NLC的壁材为植物甾醇提供了一个合适的脂质运载系统,可为食品工业构建PS-NLC提供技术支持。Abstract: Nanostructured lipid carriers (NLC) for the encapsulation and protection of phytosterol (PS) were prepared using walnut oil as liquid lipid by high-pressure homogenization method. The average particle size, polydispersity index, Zeta potential and encapsulation efficiency were used as the main evaluation indexes to optimize the preparation process parameters and formulations, and the morphology and stability of the optimized PS-NLC were investigated. The optimal ratio for the preparation of PS-NLC was determined by orthogonal tests as 10% of total lipid concentration, 2:3 of stearic acid and walnut oil, and 1.2% of soy lecithin. The prepared PS-NLC had a spherical appearance, small particle size and uniform distribution. The stability results of PS-NLC showed that PS-NLC was stable in storage at 4 ℃ for 28 days. It was diluted 5~100 times with good dilution stability, when used. And the addition of 2% sucrose had the best effect on the lyophilization protection of PS-NLC. Walnut oil was used as the wall material of NLC to provide a suitable lipid delivery system for phytosterols, which could provide technical support for the construction of PS-NLC in food industry.
-
Keywords:
- phytosterol /
- nanostructured lipid carriers /
- walnut oil /
- soy lecithin /
- stearic acid
-
植物甾醇(Phytosterol,PS)是一种三萜类化合物,广泛存在于自然界植物内的微量活性成分,具有类似于胆固醇的化学结构,被人们认为是治疗以及预防冠心病、动脉粥样硬化的最佳天然物质。自从1953年以来,人们就发现饮食中含有的植物甾醇可以降低人体血清里的胆固醇水平[1]。一般认为,每天摄入2~3 g任何类型的PS将使血清总胆固醇和低密度脂蛋白分别减少约10%和15%[2-3]。虽然PS广泛存在于富含植物物质的饮食中,但从正常饮食中获得的160~430 mg/d的PS几乎不能满足人们的正常需求[4-5]。因此,PS已成为食品补充剂和食品配方的重要组成部分。然而,植物甾醇因为疏水碳链使其水溶性差,而其在油脂中的溶解度也很低,且植物甾醇的熔点很高,在常温下主要以结晶态存在,导致其在生物体内溶解性差、生物利用率低,在食品工业应用上存在困难[6]。研究发现,构建合适的纳米递送载体可有效改善PS稳定性并解决其生物利用率低的问题[7]。
纳米结构脂质载体(Nanostructured lipid carriers,NLC)是在固体脂质纳米颗粒(Solid lipid nanoparticle,SLN)的基础上发展起来的新型纳米脂质载药系统[8]。NLC具有独特的脂质性质,其脂质基质由液体脂质和固体脂质混合而成[9]。由于固液脂质的特性差异较大,NLC在冷却重结晶的过程中,混合的脂质基质不像单一的固态脂质一样形成排列有序的紧密结构,反而会形成大量非完美晶体即缺陷型晶体,这种缺陷型晶体排列有序度降低,为生物活性物质提供了更大的包埋空间以及更高的溶解性[10-11],从而提高生物活性物质的包封率和运载量,减少生物活性成分在储存期间的泄露,延长其作用时间。
核桃油富含不饱和脂肪酸,主要是亚油酸、亚麻酸和油酸,总含量超过90%[12],其中亚麻酸和亚油酸为人体必需脂肪酸,因此赋予了核桃油在预防心血管疾病[13]、抗氧化[14]和抗炎[15]等方面的重要功能。然而,目前关于核桃油的研究主要集中在成分分析和提取工艺上,利用核桃油制备NLC的研究尚未报道。因此,基于核桃油不溶于水、气味独特且富含不饱和脂肪酸等特性,核桃油可以作为NLC的壁材来生产具有新功能的递送系统,有望成为热门且极具研究潜力的领域。
为扩大植物甾醇在食品中的应用、提高植物甾醇的稳定性并解决生物利用率低等问题,本文拟采用高压均质法,以核桃油为液体脂质制备负载植物甾醇的纳米结构脂质载体。先通过单因素实验以平均粒径、多分散指数(Polymer dispersity index,PDI)、Zeta电位及包封率等指标确定制备工艺参数和配方主要组成后,再利用正交试验的方法得到制备PS-NLC的最佳方法比例。对优化后的PS-NLC进行形貌观察及稳定性研究,以期在拓展和促进PS在食品领域内应用的同时提供理论支持和技术指导。
1. 材料与方法
1.1 材料与仪器
植物甾醇(纯度>95%)、硬脂酸(纯度>98%)、单硬脂酸甘油酯、山嵛酸甘油酯、棕榈酸、大豆卵磷脂(Soy lecithin,SL,纯度>98%)、吐温60、吐温80、乳清分离蛋白(Whey protein isolate,WPI) 上海源叶生物科技有限公司;核桃油 购自中国哈尔滨超市;以上试剂均为分析纯试剂。
AVP-2000型高压均质机 英国Stansted Fluid Power公司;T18 Basic型高速分散机/匀浆机 德国IKA公司;Zetasizer Nano90型粒度及电位分析仪 英国马尔文仪器有限公司;DK-98-1型电热恒温水浴锅 余姚市东方电工仪器厂;85-2型磁力搅拌器 江苏省金坛市荣华仪器制造有限公司;UV-6100紫外-可见分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 NLC的制备
采用高压均质法制备负载PS的NLC[10]。根据预实验的结果,确定PS占总脂质含量的5%(w/w)左右。将固体脂质和核桃油按一定比例混合并升温至特定均质温度(高于固体脂质熔点的5 ℃),加入一定量的PS,搅拌混匀形成油相;将同温度的去离子水和一定量的表面活性剂混匀后边搅拌边加入到油相中形成混合液。将混合液在13000 r/min下剪切处理2 min后,利用高压均质机在一定压力下均质处理后迅速冷却至室温即得到PS-NLC。
将获得的PS-NLC在4 ℃下储存24 h,用于脂质部分结晶和获得含有NLC的分散体,随后在25 ℃下储存24 h,用于晶体稳定。
1.2.2 高压均质法制备NLC工艺条件优化
1.2.2.1 均质压力的选择
分别选取均质压力为300、400、500、600、700 bar,固定均质次数3次,选择硬脂酸为固体脂质(与核桃油的比例为3:1)、吐温80为表面活性剂(1.0 g/100 mL),按照1.2.1所述方法制备PS-NLC。测定其粒径、PDI。每个条件下的样品分别处理分析三次,取平均值。
1.2.2.2 均质次数的选择
分别选取均质次数为1、2、3、4、5次,固定均质压力为500 bar,选择硬脂酸为固体脂质(与核桃油的比例为3:1)、吐温80为表面活性剂(1.0 g/100 mL),按照1.2.1所述方法制备PS-NLC。测定其粒径、PDI。每个条件下的样品分别处理分析三次,取平均值。
1.2.3 PS-NLC的配方优化
1.2.3.1 固体脂质的筛选
将不同熔点的固体脂质(单硬脂酸甘油酯、山嵛酸甘油酯、硬脂酸、棕榈酸)分别与核桃油构成固液脂(3:1),选择吐温80作为表面活性剂(1.0 g/100 mL),在均质压力为500 bar、均质3次的条件下制备PS-NLC样品,测定平均粒径、PDI及包封率。
1.2.3.2 表面活性剂的筛选
根据固态脂质筛选的实验结果,分别选择SL、吐温60、吐温80、WPI作为表面活性剂制备PS-NLC。通过比较不同的表面活性剂制备的PS-NLC在4 ℃下贮藏7 d的粒径和Zeta电位变化,筛选出最适宜的表面活性剂。
1.2.3.3 正交试验优化
根据上述单因素实验结果,并且在前期预实验的基础上,选定PS-NLC中的固液脂质量比、总脂质浓度(w/v)、表面活性剂浓度(w/v)为考察因素,以包封率作为评价指标,设计L9(34)正交试验,确定PS-NLC的最佳制备工艺条件,并进行验证实验。正交试验设计因素水平表见表1。
表 1 正交试验因素水平设计Table 1. Orthogonal assay factors and levels水平 因素 A总脂质浓度(%) B固液脂质量比 C表面活性剂浓度(%) 1 7.5 4:1 1.2 2 10 3:2 1.4 3 12.5 2:3 1.6 1.2.4 粒径、PDI、及Zeta电位的测定
采用Nano-ZS90粒度电位计测量NLC的粒径、PDI和Zeta电位,并将溶液浓度保持在0.01%(v/v)。
1.2.5 包封率测定
取10 mL新制备的PS-NLC,加入10 mL正己烷,并立即使用涡流混合器涡旋振荡5 min,然后让溶液静置1~2 min,以此来溶解未包封的PS。收集上部己烷,用氮气吹干。残留物用无水乙醇重新溶解,PS含量测定根据Zhou等[5]描述的方法进行。向重新溶解的残留物溶液中加入硫磷铁显色剂,反应15 min后,用紫外-可见分光光度计测定混合物在520 nm下的吸光度,根据纯化PS建立的标准曲线(R2>0.99)计算PS含量。包封率的计算公式如下:
包封率(%)=植物甾醇总量−游离植物甾醇植物甾醇总量×100 1.2.6 微观结构
采用透射电镜(TEM)对NLC的形貌进行观察。取NLC用蒸馏水稀释100倍后滴加在铜网上,用1%(w/v)磷钨酸进行负染色,置于室温下干燥后用透射电镜观察其形貌并拍照。
1.2.7 NLC的稳定性研究
1.2.7.1 储藏稳定性
将在最优条件下制备得到的PS-NLC放置在4 ℃储藏28 d,然后分别测量其粒径、PDI及Zeta电位。具体测试操作同1.2.4。
1.2.7.2 稀释稳定性
将在最优条件下制备的PS-NLC分别稀释5、10、20、50、100倍,再按照1.2.4的方法测定样品的粒径和PDI来进行稀释稳定性的评价。
1.2.7.3 冻干稳定性
取PS-NLC混悬液20 mL,分别加入浓度为0%、2%、5%、10%(w/w)的蔗糖[16-17],将样品放入−20 ℃的冰箱预冻12 h后放入冻干机进行冻干24 h后即得冻干样品。取0.1 g冻干后的样品与10 mL去离子水混合,经搅拌涡旋后,测量其粒径和PDI。
1.3 数据处理
每个实验重复3次,结果表示为平均数±标准差。图表制作采用Origin Pro 8.5软件,使用SPSS 23.0进行ANOVA差异显著性分析和方差分析(P<0.05为显著性差异)。
2. 结果与分析
2.1 高压均质的压力及次数对PS-NLC的影响
高压均质的压力和循环次数对PS-NLC的粒径和PDI影响如图1所示。PS-NLC的粒径在高压均质过程中因高速剪切、冲击和空腔效应而逐渐减小[18-19],在压力为500 bar时粒径和PDI均达到最小值,即粒径为325.83 nm,PDI为0.189(图1A)。当压力超过500 bar时,PS-NLC的粒径随压力的增加而增加,可能是由于颗粒间碰撞的速度加快,导致颗粒之间发生团聚,同时压力过高会导致在均质过程中温度的升高,影响表面活性剂的乳化效果,同样导致粒径的增加[20]。此外,均质压力过高或过低均会导致粒径分布不均匀,PDI增大。因此,均质压力为500 bar时制备的PS-NLC最合适。同理,PS-NLC的粒径和PDI随均质循环次数的增加也呈现先减小后增加的趋势,在循环次数为3次时PS-NLC的粒径和PDI达到最小值,此时PS-NLC具备最好的稳定性和分散性。此外,循环次数增加对仪器的损耗越大,不利于设备维护,故综合考虑后选取的循环次数为3次(图1B)。
2.2 PS-NLC的配方优化
2.2.1 固体脂质的选择
采用四种不同熔点的固体脂质制备的 PS-NLC 的粒径、PDI 和包封率如表 2所示。NLC的粒径越小,布朗运动越迅速,抵消重力的沉降性越有效,从而使体系具有更好的稳定性[21]。PDI是体现体系稳定性的又一重要指标,PDI越小表明粒径分布越窄,纳米颗粒的粒径越均一;PDI越大表示纳米颗粒的粒径分布范围宽,纳米颗粒分布不均一,颗粒间容易发生相互碰撞造成聚集团聚,体系的稳定性越差[22]。由表2可知,采用硬脂酸为固体脂质制备的PS-NLC的包封率高达91.09%,粒径和PDI分别为302.90 nm和0.238,故综合考虑最佳的固体脂质为硬脂酸。
表 2 四种不同固体脂制备的PS-NLC的粒径、PDI及包封率Table 2. Particle size, PDI and encapsulation ratio of PS-NLC prepared from four different solid lipids固体脂质 粒径(nm) PDI 包封率(%) 棕榈酸 525.43±4.631b 0.357±0.013b 77.10±0.116d 硬脂酸 302.90±0.794d 0.238±0.011c 91.09±0.115b 山嵛酸甘油酯 740.90±7.503a 0.206±0.007d 85.63±0.364c 单硬脂酸甘油酯 344.47±4.801c 0.592±0.021a 92.29±0.236a 注:每一列上标字母不同表示均值差异显著(P<0.05),字母相同表示均值差异不显著(P>0.05);表4同。 2.2.2 表面活性剂的选择
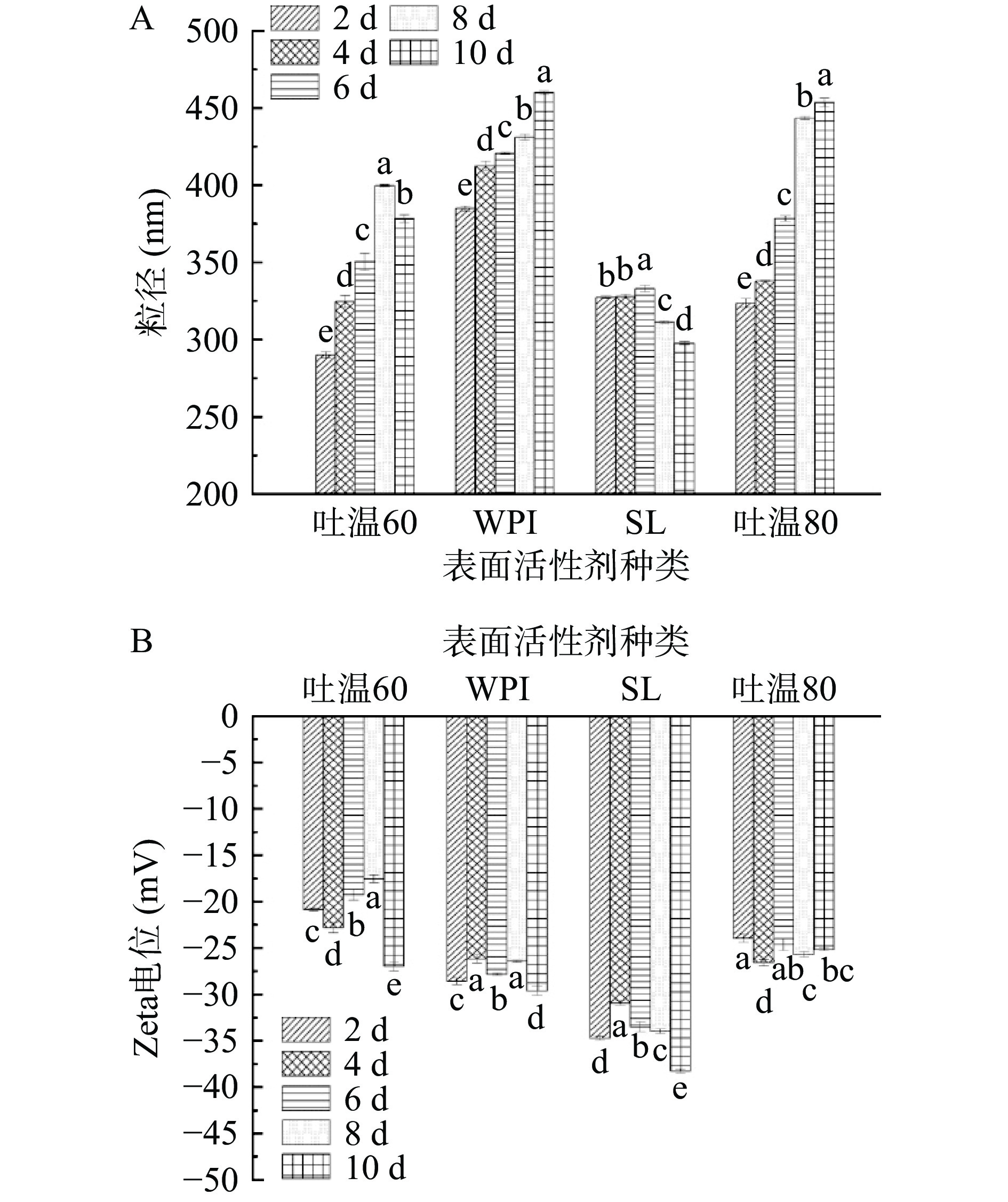
在NLC制备过程中,表面活性剂能够迅速吸附到液滴表面,并在高压均质过程中降低界面张力,从而降低颗粒的大小并提高体系的稳定性[23-24]。因此,选择合适的表面活性剂对于制备NLC来说是至关重要的。图2A可知,吐温60、SL、吐温80制备的PS-NLC在贮藏初期时粒径较小(<350 nm),粒径越小越有利于维持体系的稳定。但随着储藏时间增加,吐温60、WPI和吐温80制备的PS-NLC发生很大变化,粒径均呈现增大趋势,其中WPI和吐温80制备的PS-NLC在储藏10 d后粒径增大至450 nm左右,颗粒间发生凝聚,表明WPI和吐温80不利于减小体系的颗粒粒径和增强体系稳定性。而以SL为表面活性剂制备的PS-NLC在贮藏过程中粒径变化不大,均保持在350 nm以下,说明此时的PS-NLC的液滴碰撞速率和频率相对较低,稳定性良好。Zeta电位是颗粒表面电荷的间接量度,当Zeta电位的绝对值≥30 mV时的胶体系统被认为是物理稳定的[25-26]。由图2B可知,不同表面活性剂制备的PS-NLC在储藏期间电位值大小无明显变化,其中SL制备的PS-NLC的Zeta电位绝对值在储藏期间均大于30 mV,电位始终呈高电负性,物理稳定性最好。因此综合考虑最佳的表面活性剂为SL。
2.2.3 正交试验优化
基于前期预实验,选择对PS-NLC影响较大的三个因素,即总脂质浓度、固液脂质量比及表面活性剂浓度进行正交试验优化。其中A总脂质浓度(7.5%,10%,12.5%)、B固液脂质比例(4:1,3:2,2:3)、C表面活性剂浓度(1.2%,1.4%,1.6%),以包封率为评价指标进行统计分析。正交试验分析结果见表3。
表 3 L9(34)正交试验设计及结果Table 3. L9(34) orthogonal experiment design and results试验号 总脂质浓度(%) 固液脂质量比 表面活性剂浓度(%) 包封率(%) 1 7.5 4:1 1.2 85.85 2 7.5 3:2 1.4 88.68 3 7.5 2:3 1.6 84.58 4 10 4:1 1.4 87.24 5 10 3:2 1.6 86.43 6 10 2:3 1.2 93.97 7 12.5 4:1 1.6 84.39 8 12.5 3:2 1.2 91.77 9 12.5 2:3 1.4 90.88 K1 86.370 85.827 90.530 − K2 89.213 88.960 88.933 − K3 89.013 89.810 85.133 − R 2.843 3.983 5.937 − 由表3的极差(R)分析可知,表面活性剂浓度对PS-NLC的包封率影响最大,三因素影响大小顺序为表面活性剂浓度>固液脂质量比>总脂质浓度。PS-NLC的最佳制备条件为A2B3C1,即总脂质浓度10%(m/v),硬脂酸:核桃油=2:3,SL浓度为1.2%(m/v)。采用此工艺条件平行制备3组PS-NLC,测得制备的PS-NLC的粒径、PDI、Zeta电位及包封率分别为298.32±1.346 nm、0.232±0.005、−35.83±0.046 mV和92.89%±0.232%。证明该方法得到的PS-NLC粒度分布均匀,重现性好。
2.3 PS-NLC的微观形貌
采用最佳工艺条件和配方组成制备PS-NLC并对其进行形貌观察。一般来说,固体脂质容易形成细长的晶体,这种晶体形态使NLC形成非球形的表面[27]。从图3可以看出,PS-NLC外观形状大部分为较规则的球形,这说明PS-NLC中的脂质结晶是以缺陷晶体的形式存在的。此外,TEM观察到PS-NLC的表面相对光滑,没有发现明显的颗粒间聚集现象,这也使得表面活性剂可以更快速地在NLC表面发生移动,从而更好地发挥乳化作用,使体系具有较好的稳定性和分散性[28-29]。TEM显示PS-NLC的粒径大小与纳米粒度分析仪测定的结果基本一致,大部分都小于300 nm,但仍有部分颗粒的粒径大于300 nm,这可能与体系中含较高含量的核桃油有一定关系,核桃油是液态油脂,有可能降低NLC的坚固程度,导致颗粒比较脆弱,在样品预处理及拍摄过程中容易出现某些颗粒熔化扩散现象[30]。另外,成分复杂的胶体分散体系,也不可能使体系中的颗粒形成完全相同的结构并具有完全相同的粒径。样品预处理上和检测原理上的差异,也可能会导致两种表征手段在结果上出现轻微差异。TEM是在干燥后直接观察颗粒形貌,而纳米粒度分析仪不需要干燥直接检测载体的光散射信号[31]。
2.4 PS-NLC的稳定性研究
为考察PS-NLC在食品及功能性产品应用中的稳定性,通过储藏稳定性、稀释稳定性及冻干稳定性等指标评价PS-NLC在存储、运输以及使用过程中的稳定性。
2.4.1 储藏稳定性
表4显示出在4 ℃下储存28 d的PS-NLC的粒径、PDI和电位变化。PS-NLC的初始粒径、PDI和Zeta电位分别为313.23 nm、0.248、−35.23 mV。与初始粒径相比,在4 ℃下储存28 d后,粒径增加速率比较小,粒径均小于350 nm。PDI从最初的0.248增加至0.288,PDI的增加可能是由于在存储过程中NLC颗粒间发生相互碰撞、聚合[32],PDI虽然上升但在可接受范围内,并且在储存期间PS-NLC没有发生絮凝、聚集、分层、颜色变化等不稳定现象。此外,PS-NLC在4 ℃储藏28 d后,Zeta电位的绝对值均超过30.00 mV,表明PS-NLC中的粒子可通过静电斥力相互分散抑制液滴絮凝,具有良好的稳定性[33]。综上,采用最佳工艺条件和配方组成制备的PS-NLC在储存期间具有很高的稳定性。
表 4 4 ℃下储存28 d的PS-NLC的粒径、PDI和Zeta电位Table 4. Particle size, PDI and Zeta potential of PS-NLC stored at 4 ℃ for 28 days储藏时间(d) 粒径(nm) PDI Zeta电位(mV) 0 313.23±0.666d 0.248±0.003d −35.23±0.057b 7 339.80±1.646a 0.253±0.005c −34.67±0.208a 14 322.63±2.843c 0.236±0.003e −35.30±0.361b 21 319.73±1.193c 0.267±0.003b −35.83±0.208c 28 327.93±2.409b 0.288±0.005a −36.10±0.264c 2.4.2 稀释稳定性
NLC在实际应用中一般需要进行一定比例的稀释才能添加到最终的产品中,因此这就需要NLC在不同比例的稀释过程中依然保持体系的稳定。如图4A所示,PS-NLC在经过不同倍数的稀释后其平均粒径没有发生明显变化,皆保持在350 nm以下。PDI随稀释倍数增加呈现轻微上升趋势,但均在0.3~0.4之间,表明所制备的PS-NLC具有良好的稀释稳定性,在使用时可以对其进行一定比例的稀释,但稀释倍数不宜超过100倍。
2.4.3 冻干稳定性
NLC在长期储藏过程中容易发生絮凝、分层及奥斯瓦尔德熟化,导致粒径增大,稳定性降低,不利于运输和储存[34]。冷冻干燥是一种能够提高NLC理化稳定性的有效方法。但是NLC是一种纳米分散体系,如果直接进行冷冻干燥,纳米颗粒可能会因为冰晶的产生和生长而发生破乳现象,造成颗粒间聚集融合,不利于快速复溶及后期的使用[29,35]。因此,本实验采用最常用的蔗糖作为PS-NLC的冻干保护剂,并研究了不同蔗糖浓度添加量对PS-NLC的影响。PS-NLC在冻干前的平均粒径为272.16 nm,PDI为0.254。图4B显示,未添加任何蔗糖的样品冷冻干燥后,粒径超过500 nm,PDI>0.4,表明未添加冻干保护剂的PS-NLC在冻干后发生了一定程度的聚集,均一稳定性差。添加蔗糖后的PS-NLC粒径增幅较小,表明蔗糖作为冻干保护剂对PS-NLC起到了保护作用。此外,PS-NLC的粒径随蔗糖浓度的增大呈现略微增大趋势,可能与冻干保护剂、溶剂、颗粒以及冻干保护剂的结晶行为之间的特定相互作用有关[17],但是粒径均小于350 nm,且PDI小于0.3。因此,通过比较所选蔗糖浓度,添加2%的蔗糖浓度的PS-NLC冻干后的平均粒径和PDI与初始值相差最小,对PS-NLC的冻干保护效果最佳。
3. 结论
本文采用高压均质法以核桃油为液态脂质制备负载PS的NLC,并对其制备工艺和配方进行优化。确定均质条件为均质压力500 bar,循环次数3次。在此均质条件下,通过粒径、Zeta电位、包封率等指标筛选出最佳固体脂质为硬脂酸,最佳表面活性剂为SL。最后通过正交试验优化得到制备PS-NLC的最佳条件为总脂质浓度10%,固液脂质比为2:3,表面活性剂浓度为1.2%。按优化配方制备PS-NLC,其粒径、PDI、Zeta电位及包封率分别为298.32±1.346 nm、0.232±0.005、−35.83±0.046 mV和92.89±0.232%。TEM观察到PS-NLC的外观形状大部分为较规则的球形,表面光滑,粒径大小与粒度分析仪测定结果基本一致,大部分都小于300 nm。物理稳定性试验结果表明PS-NLC具有良好的储藏稳定性和稀释稳定性, 并且添加冻干保护剂可以提高PS-NLC的冻干稳定性,2%的蔗糖的冻干保护效果最佳,外观上近似粉末状,比较均匀,而且水分散性好。这项基础研究的结果可用于进一步发展PS在功能性食品中的研究领域,并为功能性食品中添加PS提供宝贵信息。未来,我们将使用这种NLC来封装疏水性生物活性物质,并探索它们对营养物质的保护和运输作用。
-
表 1 正交试验因素水平设计
Table 1 Orthogonal assay factors and levels
水平 因素 A总脂质浓度(%) B固液脂质量比 C表面活性剂浓度(%) 1 7.5 4:1 1.2 2 10 3:2 1.4 3 12.5 2:3 1.6 表 2 四种不同固体脂制备的PS-NLC的粒径、PDI及包封率
Table 2 Particle size, PDI and encapsulation ratio of PS-NLC prepared from four different solid lipids
固体脂质 粒径(nm) PDI 包封率(%) 棕榈酸 525.43±4.631b 0.357±0.013b 77.10±0.116d 硬脂酸 302.90±0.794d 0.238±0.011c 91.09±0.115b 山嵛酸甘油酯 740.90±7.503a 0.206±0.007d 85.63±0.364c 单硬脂酸甘油酯 344.47±4.801c 0.592±0.021a 92.29±0.236a 注:每一列上标字母不同表示均值差异显著(P<0.05),字母相同表示均值差异不显著(P>0.05);表4同。 表 3 L9(34)正交试验设计及结果
Table 3 L9(34) orthogonal experiment design and results
试验号 总脂质浓度(%) 固液脂质量比 表面活性剂浓度(%) 包封率(%) 1 7.5 4:1 1.2 85.85 2 7.5 3:2 1.4 88.68 3 7.5 2:3 1.6 84.58 4 10 4:1 1.4 87.24 5 10 3:2 1.6 86.43 6 10 2:3 1.2 93.97 7 12.5 4:1 1.6 84.39 8 12.5 3:2 1.2 91.77 9 12.5 2:3 1.4 90.88 K1 86.370 85.827 90.530 − K2 89.213 88.960 88.933 − K3 89.013 89.810 85.133 − R 2.843 3.983 5.937 − 表 4 4 ℃下储存28 d的PS-NLC的粒径、PDI和Zeta电位
Table 4 Particle size, PDI and Zeta potential of PS-NLC stored at 4 ℃ for 28 days
储藏时间(d) 粒径(nm) PDI Zeta电位(mV) 0 313.23±0.666d 0.248±0.003d −35.23±0.057b 7 339.80±1.646a 0.253±0.005c −34.67±0.208a 14 322.63±2.843c 0.236±0.003e −35.30±0.361b 21 319.73±1.193c 0.267±0.003b −35.83±0.208c 28 327.93±2.409b 0.288±0.005a −36.10±0.264c -
[1] LAURA C B, ESCOLA-GIL J C, BLANCO-VACA F. New insights into the molecular actions of plant sterols and stanols in cholesterol metabolism[J]. Atherosclerosis,2009,203(1):18−31. doi: 10.1016/j.atherosclerosis.2008.06.026
[2] MAKHMUDOVA U, SCHULZE P C, LUTJOHANN D, et al. Phytosterols and cardiovascular disease[J]. Current Atherosclerosis Reports,2021,23(11):68. doi: 10.1007/s11883-021-00964-x
[3] RIDEOUT T C, CHAN Y M, HARDING S V, et al. Low and moderate-fat plant sterol fortified soymilk in modulation of plasma lipids and cholesterol kinetics in subjects with normal to high cholesterol concentrations: Report on two randomized crossover studies[J]. Lipids in Health and Disease,2009,8:45. doi: 10.1186/1476-511X-8-45
[4] UBEYITOGULLARI A, CIFTCI O N. In vitro bioaccessibility of novel low-crystallinity phytosterol nanoparticles in non-fat and regular-fat foods[J]. Food Research International,2019,123:27−35. doi: 10.1016/j.foodres.2019.04.014
[5] ZHOU S J, HAN L, LU K Y, et al. Whey protein isolate-phytosterols nanoparticles: Preparation, characterization, and stabilized food-grade pickering emulsions[J]. Food Chemistry,2022,384:132486. doi: 10.1016/j.foodchem.2022.132486
[6] CAO W J, OU S Y, LIN W F, et al. Food protein-based phytosterol nanoparticles: Fabrication and characterization[J]. Food Function,2016,7(9):3973−3780. doi: 10.1039/C6FO00861E
[7] ZHONG Q X, ZHANG L H. Nanoparticles fabricated from bulk solid lipids: Preparation, properties, and potential food applications[J]. Advances in Colloid and Interface Science,2019,273:102033. doi: 10.1016/j.cis.2019.102033
[8] SALVI V R, PAWAR P. Nanostructured lipid carriers (NLC) system: A novel drug targeting carrier[J]. Journal of Drug Delivery Science and Technology,2019,51:255−267. doi: 10.1016/j.jddst.2019.02.017
[9] GABA B, FAZIL M, KHAN S, et al. Nanostructured lipid carrier system for topical delivery of terbinafine hydrochloride[J]. Bulletin of Faculty of Pharmacy, Cairo University,2015,53(2):147−159. doi: 10.1016/j.bfopcu.2015.10.001
[10] 朱子昊, 卢晓明. 纳米结构脂质载体的制备、表征及其在食品领域的研究进展[J]. 中国食品学报,2021,21(12):311−322. [ZHU Z H, LU X M. A Preparation and characterization of nanostructured lipid carriers and their research progress in food[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(12):311−322. doi: 10.16429/j.1009-7848.2021.12.034 [11] CHAMUNDEESWARI M, JESLIN J, VERMA M L. Nanocarriers for drug delivery applications[J]. Environmental Chemistry Letters,2018,17(2):849−865.
[12] KERGOMARD J, PABOEUF G, BAROUH N, et al. Stability to oxidation and interfacial behavior at the air/water interface of minimally-processed versus processed walnut oil-bodies[J]. Food Chemistry,2021,360:129880. doi: 10.1016/j.foodchem.2021.129880
[13] ZHOU D, PAN Y, YE J, et al. Preparation of walnut oil microcapsules employing soybean protein isolate and maltodextrin with enhanced oxidation stability of walnut oil[J]. LWT-Food Science and Technology,2017,83:292−297. doi: 10.1016/j.lwt.2017.05.029
[14] GAO P, LIU R J, JIN Q Z, et al. Effects of processing methods on the chemical composition and antioxidant capacity of walnut (Juglans regia L.) oil[J]. LWT-Food Science and Technology,2021,135:109958. doi: 10.1016/j.lwt.2020.109958
[15] YU Y J, WANG T, GONG Y H, et al. Effect of ultrasound on the structural characteristics and oxidative stability of walnut oil oleogel coated with soy protein isolate-phosphatidylserine[J]. Ultrasonics Sonochemistry,2022,83:105945. doi: 10.1016/j.ultsonch.2022.105945
[16] 李飞. 具有美白护肤潜力的川芎挥发油纳米结构脂质载体的制备[D]. 成都: 西华大学, 2022 LI Fei. Preparation of Chuanxiong Rhizoma volatile oil nanostructured lipid carriers with skin-whitening potential[D]. Chengdu: Xihua University, 2022.
[17] VARSHOSAZ J, ESKANDARI S, TABBAKHIAN M. Freeze-drying of nanostructure lipid carriers by different carbohydrate polymers used as cryoprotectants[J]. Carbohydrate Polymers,2012,88(4):1157−1163. doi: 10.1016/j.carbpol.2012.01.051
[18] LIU X L, CHEN L Q, KANG Y N, et al. Cinnamon essential oil nanoemulsions by high-pressure homogenization: Formulation, stability, and antimicrobial activity[J]. LWT-Food Science and Technology,2021,147:111660. doi: 10.1016/j.lwt.2021.111660
[19] JAFARI S M, HE Y H, BHANDARI B. Optimization of nano-emulsions production by microfluidization[J]. European Food Research and Technology,2006,225(5-6):733−741.
[20] ZHAO Y, REN Y, ZHANG R C, et al. Preparation of hydrogenated soybean oil of high oleic oil with supported catalysts[J]. Food Bioscience,2018,22:91−98. doi: 10.1016/j.fbio.2018.01.010
[21] AKHOOND ZARDINI A, MOHEBBI M, FARHOOSH R, et al. Production and characterization of nanostructured lipid carriers and solid lipid nanoparticles containing lycopene for food fortification[J]. Journal of Food Science and Technology,2018,55(1):287−298. doi: 10.1007/s13197-017-2937-5
[22] PIMENTEL-MORAL S, TEIXEIRA M C, FERNANDES A R, et al. Polyphenols-enriched Hibiscus sabdariffa extract-loaded nanostructured lipid carriers (NLC): Optimization by multi-response surface methodology[J]. Journal of Drug Delivery Science and Technology,2019,49:660−667. doi: 10.1016/j.jddst.2018.12.023
[23] SCHREINER T B, SANTAMARIA-ECHART A, RIBEIRO A, et al. Formulation and optimization of nanoemulsions using the natural surfactant saponin from Quillaja bark[J]. Molecules,2020,25(7):1538. doi: 10.3390/molecules25071538
[24] HE W, LU Y, QI J P, et al. Food proteins as novel nanosuspension stabilizers for poorly water-soluble drugs[J]. International Journal of Pharmaceutics,2013,441(1-2):269−278. doi: 10.1016/j.ijpharm.2012.11.033
[25] HYUN J E, YI H Y, HONG G P, et al. Digestion stability of curcumin-loaded nanostructured lipid carrier[J]. LWT-Food Science and Technology,2022,162:113474. doi: 10.1016/j.lwt.2022.113474
[26] BASHIRI S, GHANBARZADEH B, AYASEH A, et al. Preparation and characterization of chitosan-coated nanostructured lipid carriers (CH-NLC) containing cinnamon essential oil for enriching milk and anti-oxidant activity[J]. LWT-Food Science and Technology,2020,119:108836. doi: 10.1016/j.lwt.2019.108836
[27] LACATUSU I, BADEA N, STAN R, et al. Novel bio-active lipid nanocarriers for the stabilization and sustained release of sitosterol[J]. Nanotechnology,2012,23(45):455702. doi: 10.1088/0957-4484/23/45/455702
[28] SHEVALKAR G, VAVIA P. Solidified nanostructured lipid carrier (S-NLC) for enhancing the oral bioavailability of ezetimibe[J]. Journal of Drug Delivery Science and Technology,2019,53:101211. doi: 10.1016/j.jddst.2019.101211
[29] LIN Y W, YIN W T, LIU G Q. Development and characterisation of a novel krill oil nanostructured lipid carrier based on 1, 3-glycerol distearate[J]. International Journal of Food Science & Technology,2020,55(11):3493−3502.
[30] GENOVESE D B, LOZANO J E, RAO M A. The rheology of colloidal and noncolloidal food dispersions[J]. Journal of Food Science,2007,72(2):11−20. doi: 10.1111/j.1750-3841.2006.00253.x
[31] BOYD R D, PICHAIMUTHU S K, CUENAT A. New approach to inter-technique comparisons for nanoparticle size measurements; using atomic force microscopy, nanoparticle tracking analysis and dynamic light scattering[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,2011,387(1-3):35−42.
[32] SANTOS V D S, BRAZ B B, SILVA A A, et al. Nanostructured lipid carriers loaded with free phytosterols for food applications[J]. Food Chemistry,2019,298:125053. doi: 10.1016/j.foodchem.2019.125053
[33] AZIZI M, KIERULF A, CONNIE LEE M, et al. Improvement of physicochemical properties of encapsulated echium oil using nanostructured lipid carriers[J]. Food Chemistry,2018,246:448−456. doi: 10.1016/j.foodchem.2017.12.009
[34] TAMJIDI F, SHAHEDI M, VARSHOSAZ J, et al. Stability of astaxanthin-loaded nanostructured lipid carriers in beverage systems[J]. Journal of the Science of Food and Agriculture,2018,98(2):511−518. doi: 10.1002/jsfa.8488
[35] CUI Z R, HSU C H, MUMPER R J. Physical characterization and macrophage cell uptake of mannan-coated nanoparticles[J]. Drug Development and Industrial Pharmacy,2003,29(6):689−700. doi: 10.1081/DDC-120021318
-
期刊类型引用(2)
1. 林文捷,赵明岩,陈浩克,方宇涵,张凯翔. 基于冷链物流的鲜鸡蛋抗压特性试验及参数优化. 农业工程学报. 2024(17): 305-313 .  百度学术
百度学术
2. 谭雅兰,杨毅,谢艾伶,戴妍,常海军. 不同包装形式对市售壳蛋新鲜度的影响. 食品工业科技. 2023(21): 373-378 .  本站查看
本站查看
其他类型引用(0)





 下载:
下载:




 下载:
下载:



