Design, Expression and Evaluation of Bacteriostatic Activity of Hybrid Antimicrobial Peptide NK-LPd
-
摘要: 目的:了解杂合抗菌肽NK-LPd的抑菌活性,探讨进一步开发潜力。方法:用两个甘氨酸作接头连接NK-lysin和Piscidin的活性片段,生物信息学技术预测杂合抗菌肽的理化性质和功能结构,根据毕赤酵母(Pichia pastoris)的密码子偏好性优化杂合抗菌肽NK-LPd基因序列,重叠延伸聚合酶链式反应(gene splicing by overlap extension polymerase chain reaction,SOE-PCR)扩增基因并与分泌型表达载体pPIC9K连接,通过化学法将其转化至毕赤酵母KM71感受态细胞中,经0.5%甲醇诱导表达和亲和纯化后获得杂合抗菌肽NK-LPd,评价其抗菌活性。结果:成功构建了KM71/pPIC9K-NK-LPd,经诱导表达5 d后上清液中获得了相对分子质量约6 kDa的表达产物,与预期大小相符;抗菌活性实验表明,NK-LPd对革兰氏阴性菌和革兰氏阳性菌均具有较强的抑菌活性,与母体肽相比,杂合抗菌肽NK-LPd的抑菌活性显著增强。结论:设计并在毕赤酵母KM71中分泌表达了杂合抗菌肽NK-LPd,其抑菌活性优于母体肽。本研究可为新型杂合抗菌肽的设计和生产提供技术参考。Abstract: Objective: To reveal the bacteriostatic activity of hybrid antimicrobial peptide NK-LPd, and discuss its further exploitation potential. Methods: Two glycines were utilized as the linker to connect the active fragments of NK-lysin and Piscidin, and the physicochemical properties and functional structures of the hybrid antimicrobial peptides were predicted by bioinformatics. The hybrid antimicrobial peptide NK-LPd gene was optimized according to Pichia pastoris codon preference principle. The optimized gene was amplified by gene splicing via overlap extension polymerase chain reaction (gene splicing by overlap extension polymerase chain reaction, SOE-PCR) and inserted into the secretory expression vector pPIC9K. The recombinant plasmid was chemically transformed into P. pastoris KM71 competent cells. The recombinant expression was induced by 0.5% methanol as the inducer, which products were purified by affinity purification and its activity was evaluated. Results: KM71/pPIC9K-NK-LPd was successfully constructed. After expression for 5 days, an expression product with a relative molecular mass of about 6 kDa was obtained in the supernatant, which was in line with the expected size. Bacteriostatic activity experiments showed that NK-LPd had strong bacteriostatic activity against Gram-negative and Gram-positive bacteria. Compared with the parent peptides, the bacteriostatic activity of NK-LPd was significantly enhanced. Conclusion: The hybrid antimicrobial peptide NK-LPd was designed and expressed in P. pastoris KM71, and its bacteriostatic activity was superior to that of the parent peptides. This study could provide technical reference for the design and production of novel hybrid antimicrobial peptides.
-
Keywords:
- hybrid peptide /
- NK-LPd /
- design /
- expression /
- evaluation of bacteriostatic activity
-
抗菌肽(Antimicrobial peptides,AMPs)是一类广泛存在于自然界中的多肽,是生物体先天免疫系统的重要组成部分,对细菌、真菌、寄生虫和病毒具有广泛的抑制作用[1]。由于超级耐药菌的出现以及对抗生素的过度使用促进了AMPs研究发展,其在医药、食品、畜牧、农业和水产养殖等领域具有良好的应用前景[2]。AMPs通过与细菌细胞膜相互作用,导致细胞膜损伤和细菌死亡,或是与细胞内蛋白质、核酸等物质相互作用使细菌死亡[3]。
Piscidin是一类最常见的抗菌肽,具有广谱抗菌、抗真菌和抗病毒活性,但Piscidin家族抗菌肽分子质量较小且容易降解,导致表达产量低,成为其生产应用的主要瓶颈[4]。抗菌肽NK-lysin是一类由细胞毒性T淋巴细胞和自然杀伤细胞产生的具有多功能的抗菌肽,其成熟肽具有六个保守的半胱氨酸以及一个Saposin B结构域[5],而NK-lysin含有74~78个氨基酸残基,难以通过化学法或生物法合成,研究证实NK-lysin的短截肽也具有抗菌活性,甚至较母体肽的抗菌活性更强[6]。杂合抗菌肽是通过将两个或多个抗菌肽的部分序列重新组合形成一个新的杂合肽[7]。本研究采用杂合的方式,基于抗菌活性和结构之间的关系对银鲫(Carassius gibelio)的NK-lysin和Piscidin进行优化改造,改善两亲性和疏水性以提高其对细菌的选择性和抗菌活性。应用生物信息学等方法获得NK-lysin和Piscidin的保守片段,采用甘氨酸接头连接得到杂合抗菌肽,利用重叠延伸聚合酶链式反应(gene splicing by overlap extension polymerase chain reaction,SOE-PCR)技术合成杂合肽基因NK-LPd,在毕赤酵母KM71中表达,评价其抗菌活性,以期获得一种具有更高抗菌活性和更广抗菌谱的杂合抗菌肽,为制备新型抗菌药物、饲料添加剂或免疫增强剂提供理论基础和技术支持。
1. 材料和方法
1.1 材料与仪器
银鲫(Carassius gibelio) 购自大学城菜市场,饲养于本实验室养鱼箱;毕赤酵母菌株KM71 购自上海瑞楚生物;表达载体pPIC9K 由重庆擎科生物提供;大肠杆菌(Escherichia coli,ATCC 25923)、金黄葡萄球菌(Staphylococcus aureus,ATCC 25923)、沙门氏菌(Salmonella enterica,ATCC 12022)、铜绿假单胞菌(Pseudomonas aeruginosa,ATCC 27853)、嗜水气单胞菌(Aeromonas hydrophila,ATCC 7966) 由本实验室保存;柱式质粒提取试剂盒、DNA凝胶回收试剂盒、酵母RNA提取试剂盒、DNA Marker A(25~500 bp) 均购自生工生物工程有限股份公司;限制性内切酶EcoR I、Not I、Sac I-HF 购自New England Business Services公司;DL2000 DNA Marker、DNA连接试剂盒 购自TaKaRa公司;低分子量预染蛋白Marker 购自Thermo Scientific公司;其他试剂 均为国产分析纯。
A200型PCR扩增仪 杭州朗基科学仪器有限公司;6132型紫外可见分光光度计 德国Eppendorf公司;蛋白质电泳系统 伯乐Bio-Rad;1100/26M凝胶成像系统 Quantum ST4;ZQTY-70N型恒温振荡培养箱 上海知楚仪器有限公司;LC5090高效液相色谱系统 浙江福立分析仪器股份有限公司。
1.2 实验方法
1.2.1 杂合肽的设计
取银鲫(Carassius gibelio)的NK-lysin氨基酸序列(XP_052436046.1)与NKL-24[8]氨基酸序列进行比对,获得同源部分,从NCBI数据库中收集Piscidin家族的氨基酸序列进行序列比对,获得保守序列,再用两个甘氨酸(GG)作接头将两个片段连接得杂合肽序列。
1.2.2 生物信息学分析
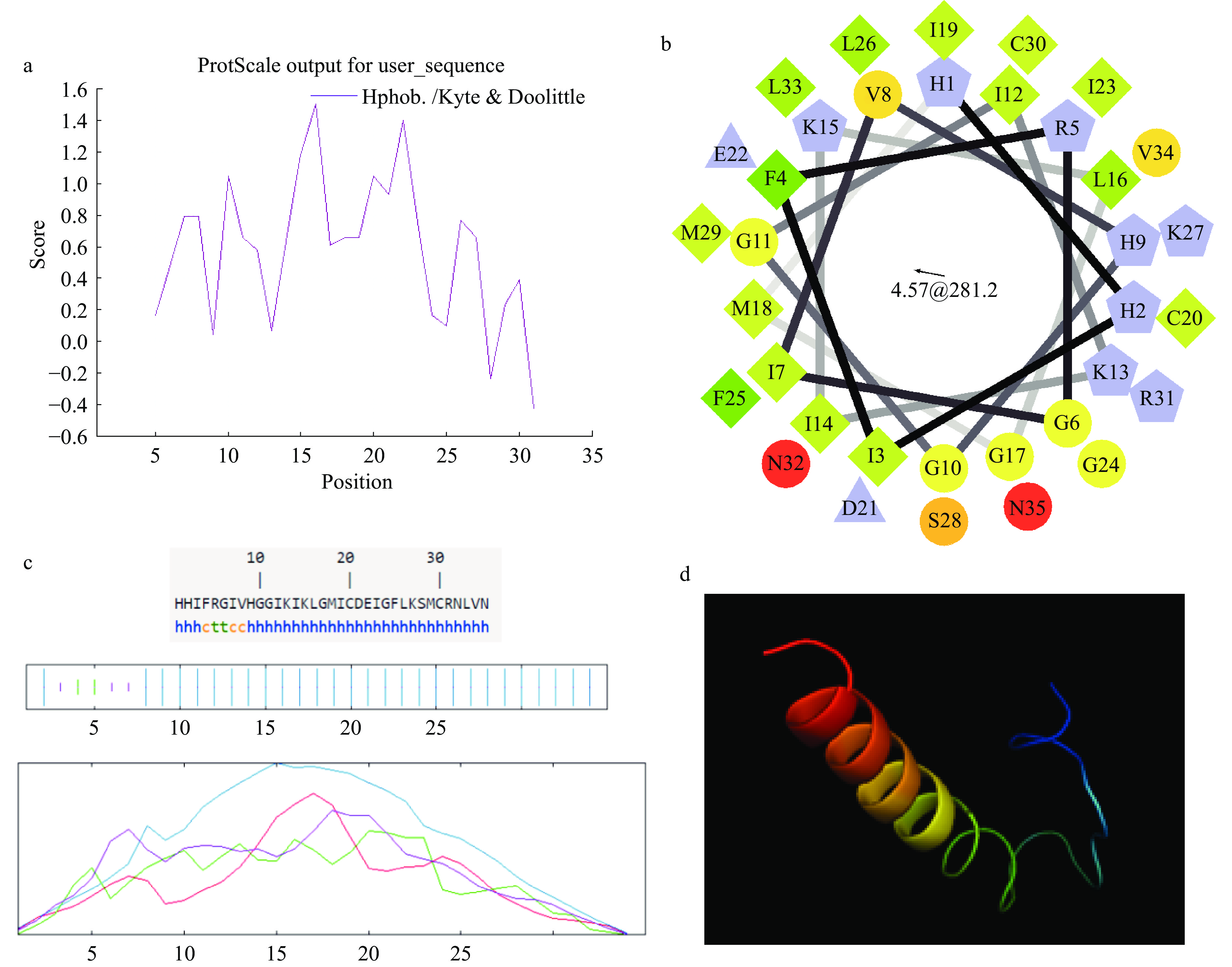
利用Expasy中的在线服务器Prot Param分析杂合抗菌肽NK-LPd的理化性质,Prot Scale预测杂合肽NK-LPd的亲水、疏水性,Helical Wheel Projections绘制杂合肽NK-LPd的三维螺旋轮图,在线服务器SOPM Secondary Structure Prediction预测杂合肽NK-LPd的二级结构,I-TASSER[9]预测NK-LPd的三级结构。
1.2.3 目的基因片段的合成
为了使表达后的抗菌肽具有天然的N端,在杂合肽序列N端加上Kex2蛋白酶裂解位点,在C端加上6×His标签便于后续纯化。参照毕赤酵母偏好性密码子翻译得到优化后的核苷酸序列,在杂合抗菌肽核苷酸序列的5'端加上EcoR Ⅰ酶切位点,在3'端加上终止密码子(TAA)和Not Ⅰ酶切位点。根据其序列设计4条引物NL 1、NL 2和NL 3、NL 4(表1)两两互为模板,采用SOE-PCR(两次PCR,第一次PCR的产物作为第二次PCR的模板)的方法合成目的基因。引物由生工生物工程(上海)股份有限公司合成。
表 1 SOE-PCR使用的引物序列Table 1. The sequences of primers used in SOE-PCR引物名称 序列 Tm值(℃) NL-1 CGGAATTCAAAAGACACCACATCTTCAGAGGTATCGTTCACGGTGGTATC 69 NL-2 CCGATCTCGTCACAGATCATACCCAACTTGATCTTGATACCACCGTGAACGATACC 71 NL-3 GGGTATGATCTGTGACGAGATCGGTTTCTTGAAGTCCATGTGTAGAAACTTGG 70 NL-4 ATTCGCGGCCGCTTAGTGGTGGTGGTGGTGGTGGTTAACCAAGTTTCTACACATGGAC 75 1.2.4 pPIC9K-NK-LPd表达载体的构建
将获得的PCR产物和质粒pPIC9K DNA分别用限制性内切酶EcoR I和Not I进行双酶切,利用DNA凝胶回收试剂盒回收相应目的片段然后用T4 DNA连接酶连接,得到重组质粒pPIC9K-NK-LPd,用重组的质粒转化大肠杆菌感受态细胞DH5α,用含Amp的LB平板筛选获得阳性克隆。将阳性克隆送测序鉴定。
1.2.5 毕赤酵母KM71的转化及筛选
用含有氨苄青霉素LB培养液过夜培养,提取质粒,Sac I-HF酶切线性化后转化入毕赤酵母KM71。用不含组氨酸的MD平板筛选后,加1 mL无菌水重悬转化子,将菌液依次涂布于G418浓度为1.0、2.0、3.0 mg/mL的YPD平板上筛选高拷贝酵母转化子。使用载体的引物5'AOX和3'AOX,PCR检测获得阳性重组菌株KM71/pPIC9K-NK-LPd,空载体转化的酵母菌株作为阴性对照。
1.2.6 酵母菌的RT-PCR
取重组酵母菌液,用酵母菌RNA提取试剂盒提取重组酵母RNA,由反转录为cDNA第1条链,以此为模板,用特异性引物NL 1和3'AOX进行RT-PCR扩增。反应条件:预变性94 ℃ 3 min,变性94 ℃ 30 s,退火60 ℃ 30 s,延伸72 ℃ 30 s,循环数35,4 ℃ ∞[10]。
1.2.7 重组酵母的诱导表达
挑取筛选获得的高拷贝酵母转化子,接种于YPD培养基中培养过夜。取1 mL菌液接种于100 mL BMGY培养基中,振荡培养至OD600=2~6,离心,收集菌体,弃上清,用灭菌水清洗菌体沉淀,离心,弃上清。用20 mL BMMY培养液重悬菌体沉淀,转入锥形瓶振荡培养,用100%甲醇诱导表达,每隔24 h加一次甲醇至终浓度仍为0.5%,诱导表达5 d后,12000 r/min,10 min离心收集上清,使用TCA法浓缩蛋白,用于Tricine-SDS-PAGE检测。
1.2.8 重组杂合肽的纯化
将上清液与等体积Binding Buffer(5 mmol/L咪唑)混合后上柱,使用15倍柱体积的Binding Buffer冲洗层析柱,洗去杂蛋白,然后使用Eluent Buffer(25 mmol/L咪唑)冲洗层析柱,直至收集的洗脱液在280 nm处的吸光度接近基线,收集洗脱液,将纯化后的蛋白进行HPLC鉴定。
1.2.9 HPLC条件
本实验采用液相色谱柱为C18柱(4.6×250 mm×5 μm),Pump A:含0.1%三氟乙酸的水,Pump B:含0.1%三氟乙酸的乙腈,流速控制为1 mL/min,保持色谱柱温度为32 ℃,进样量:40 μL,波长:214 nm[11]。
1.2.10 重组杂合肽的抗菌活性评价
采用琼脂糖扩散法初步测定重组表达产物的抗菌活性及抗菌谱[12]。选择大肠杆菌、金黄葡萄球菌、沙门氏菌、铜绿假单胞菌和嗜水气单胞菌作为供试菌。用液体培养基将菌稀释至1×106 CFU/mL,按照1%的比例接种至固体培养基中,混匀后倾注平板。待平板冷却后,用灭菌的打孔器打孔,向孔中加入100 μL纯化后的抗菌肽溶液,37 ℃培养过夜后,用游标卡尺测量抑菌圈直径,以直径表示抑菌圈的大小。实验重复三次,取平均值。
1.3 数据处理
全部数据用Excel 2019计算平均值和标准偏差,使用Origin 9.0软件作图。所有实验检测均重复3次。
2. 结果与分析
2.1 杂合抗菌肽的设计
NK-lysin序列比对结果如图1所示,获得同源部分:IKIKLGMICDEIGFLKSMCRNLVN。再从NCBI数据库中收集Piscidin家族的氨基酸序列进行序列比对,Piscidin序列比对结果如图2,获得保守序列:HHIFRGIVH。再采用两个甘氨酸接头(GG,以方框表示)将两个片段连接得到杂合肽序列:HHIFRGIVHGGIKIKLGMICDEIGFLKSMCRNLVN。
2.2 杂合抗菌肽NK-LPd的生物信息学分析
杂合抗菌肽的理化性质如表2所示,预期分子量为3950.80 Da,理论等电点为9.39,理化性质较稳定。由螺旋轮图3b和疏水性图3a可知,杂合肽NK-LPd包含13个亲水性氨基酸残基;11个疏水性氨基酸;2个带负电荷氨基酸残基;16个正电荷的氨基酸残基。NK-LPd的亲水性氨基酸和疏水性氨基酸大体分别位于螺旋轮的两侧,能形成明显的疏水界面和亲水界面,使其具有两亲性,且疏水性为54%。杂合肽NK-LPd二级结构主要含有α螺旋结构,占整体结构的85.71%。
表 2 杂合抗菌肽NK-LPd理化性质分析Table 2. Analysis of physicochemical properties of hybride antimicrobial peptide NK-LPd名称 分子量(Da) 等电点 电荷数 脂肪系数 总水平疏水性 不稳定指数 半衰期 NK-LPd 3950.80 9.39 负氨基酸残基数:2
正氨基酸残基数:5116.86 0.403 15.53 3.5 h(哺乳动物网织红细胞半衰期)
10 min(酵母半衰期)
>10 h(大肠杆菌半衰期)2.3 杂合抗菌肽NK-LPd的基因合成
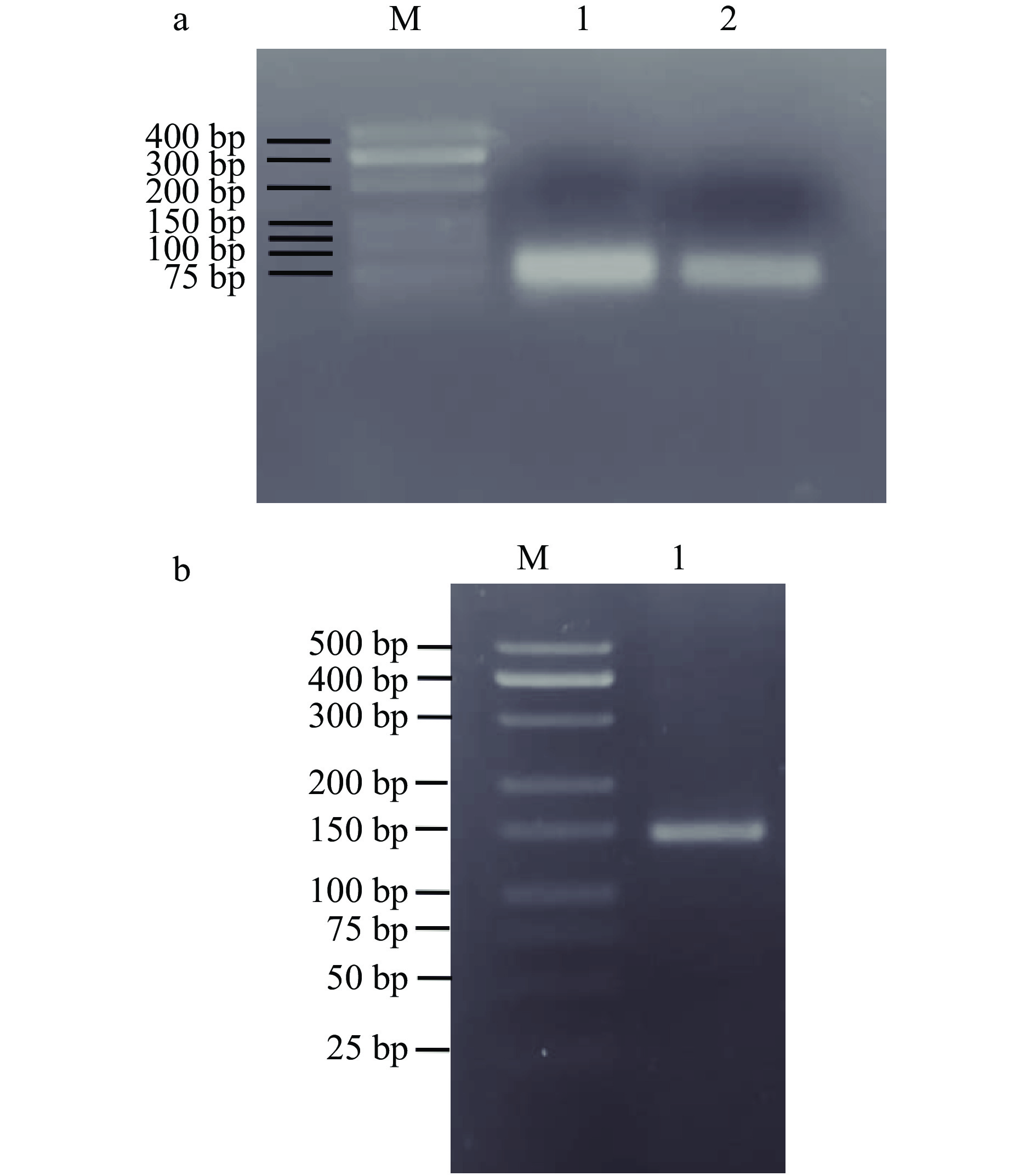
通过SOE-PCR的方法,设计4条引物经过两次PCR合成杂合抗菌肽的NK-LPd的目的基因。第一次PCR分别使用引物NL 1、NL 2和NL 3、NL 4两两互为模板进行扩增得到延伸液1和延伸液2。经3.0%琼脂糖凝胶电泳检测,如图4a所示,分别在85和91 bp处出现明显的条带,与预期大小符合。以第一次PCR获得的产物作为模板进行第二次PCR,得到相应的目的基因,经3.0%琼脂糖凝胶电泳检测如图4b,得到单一条带大小为152 bp,与目标条带大小相符,证明成功扩增得到目的基因。
2.4 重组质粒的构建
从氨苄抗性平板上挑取10个长势较好单菌落作为模板,分别以NL 1和NL 2为引物进行菌落PCR,经过1.0%琼脂糖凝胶电泳检测在152 bp处出现单一目标条带,与理论值相符,证明挑取的单克隆均为阳性克隆。将阳性克隆送擎科生物公司测序验证,证明基因片段NK-LPd成功连接至pPIC9K表达载体的多克隆位点,并且核苷酸序列未发生碱基突变,与预先设计的序列相同。
2.5 毕赤酵母的转化及筛选
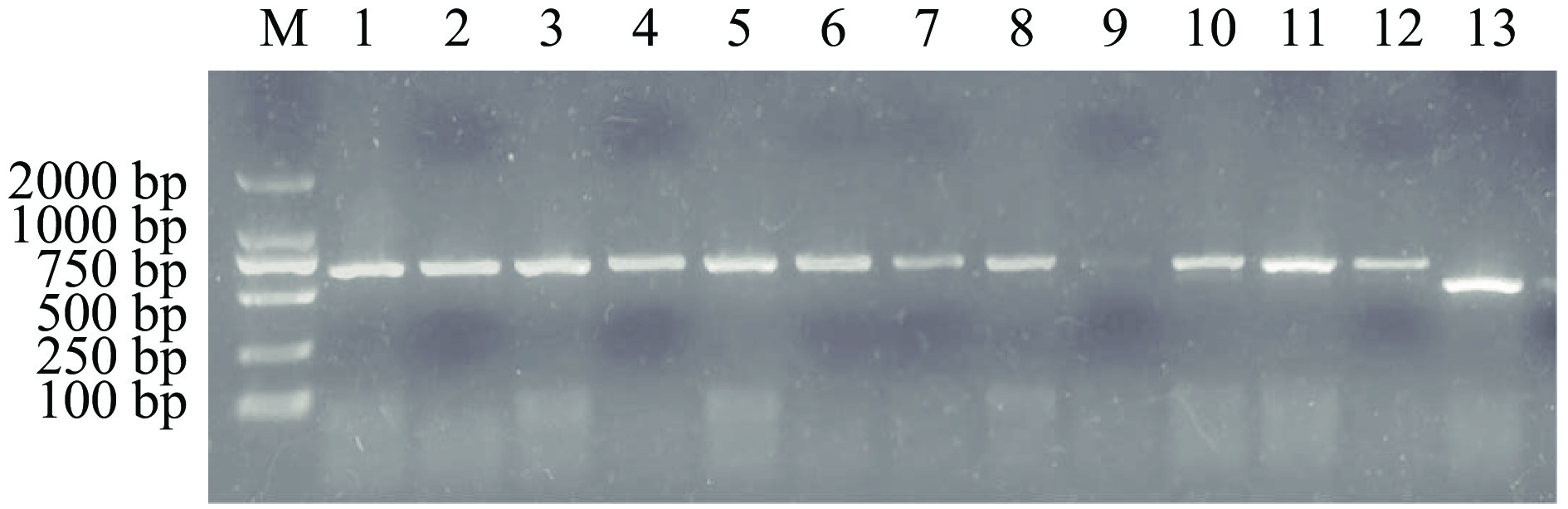
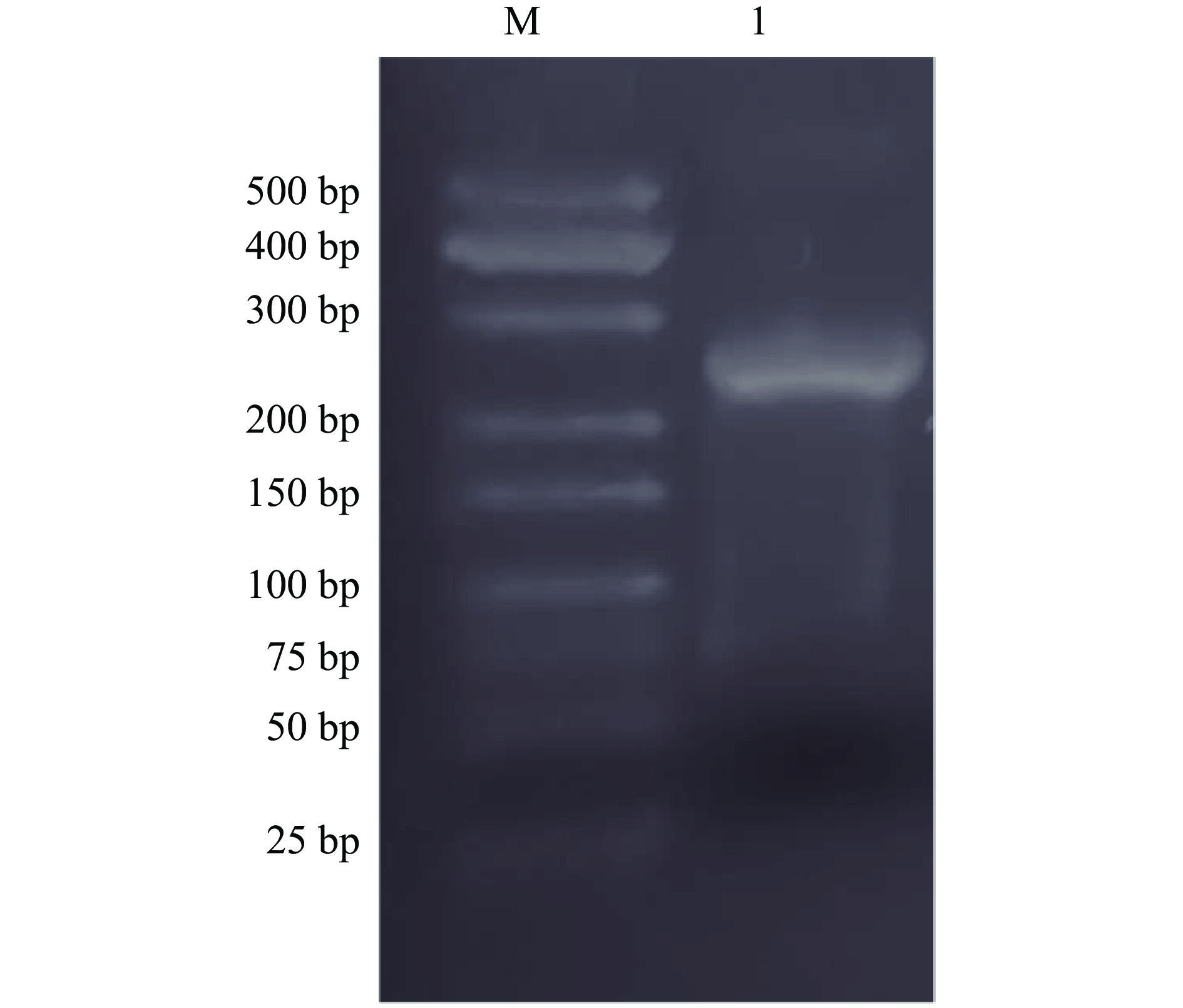
线性化的pPIC9K-NK-LPd通过原生质法转入毕赤酵母KM71感受态细胞中,全部涂布至MD培养基(His+缺陷型),4 d后长出转化子。重悬转化子,将菌液依次涂布于G418浓度为1.0、2.0、3.0 mg/mL的YPD平板上筛选高拷贝酵母转化子。以3' AOX和5' AOX为引物进行酵母菌PCR,1%琼脂糖电泳检测结果如图5,除9号泳道外,其余阳性克隆扩增得到一条大小620 bp的清晰条带,空载体没有插入目标基因,得到条带大小为494 bp。将阳性菌株提取总RNA,通过RT-PCR验证目的基因的表达(图6)。结果表明,重组表达质粒pPIC9K-NK-LPd已经成功转入酵母KM71,并能够稳定表达。
2.6 NK-LPd重组蛋白在毕赤酵母的表达及纯化
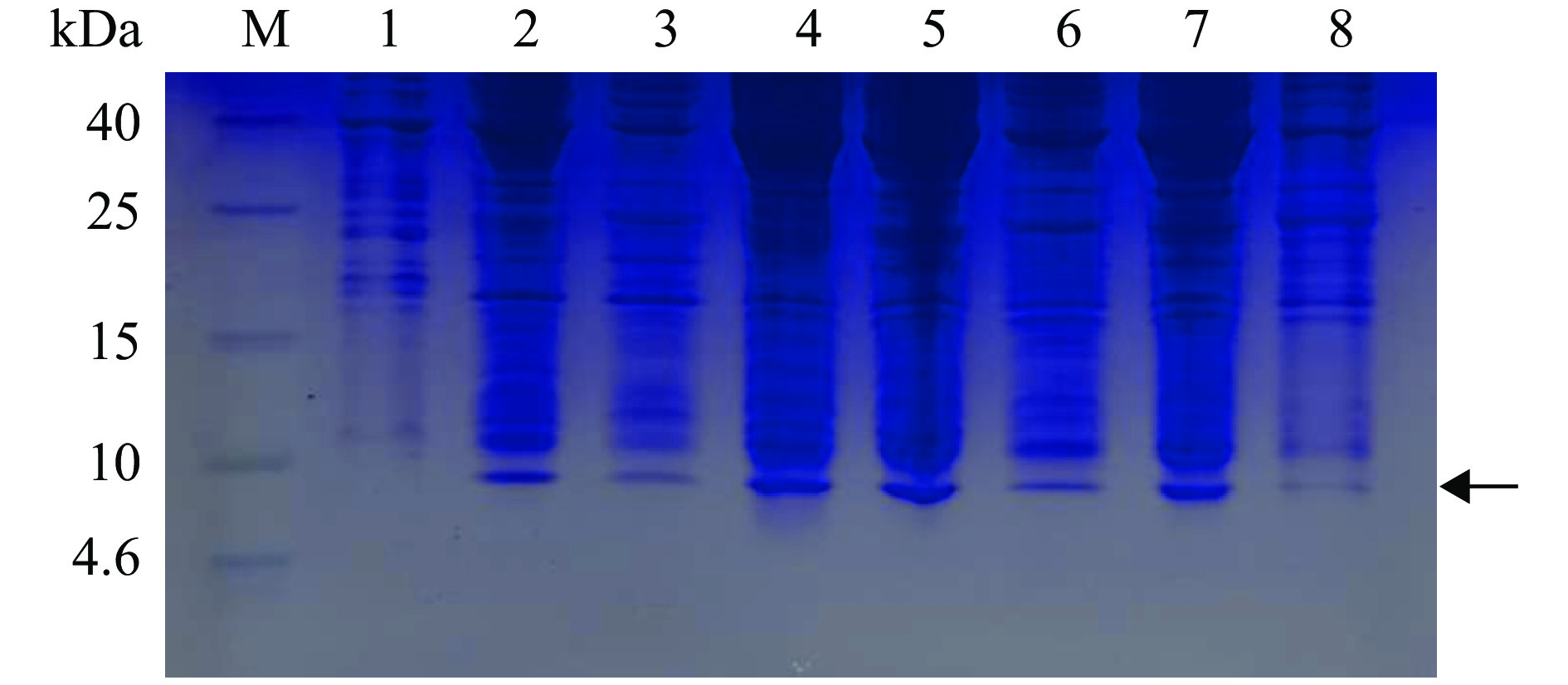
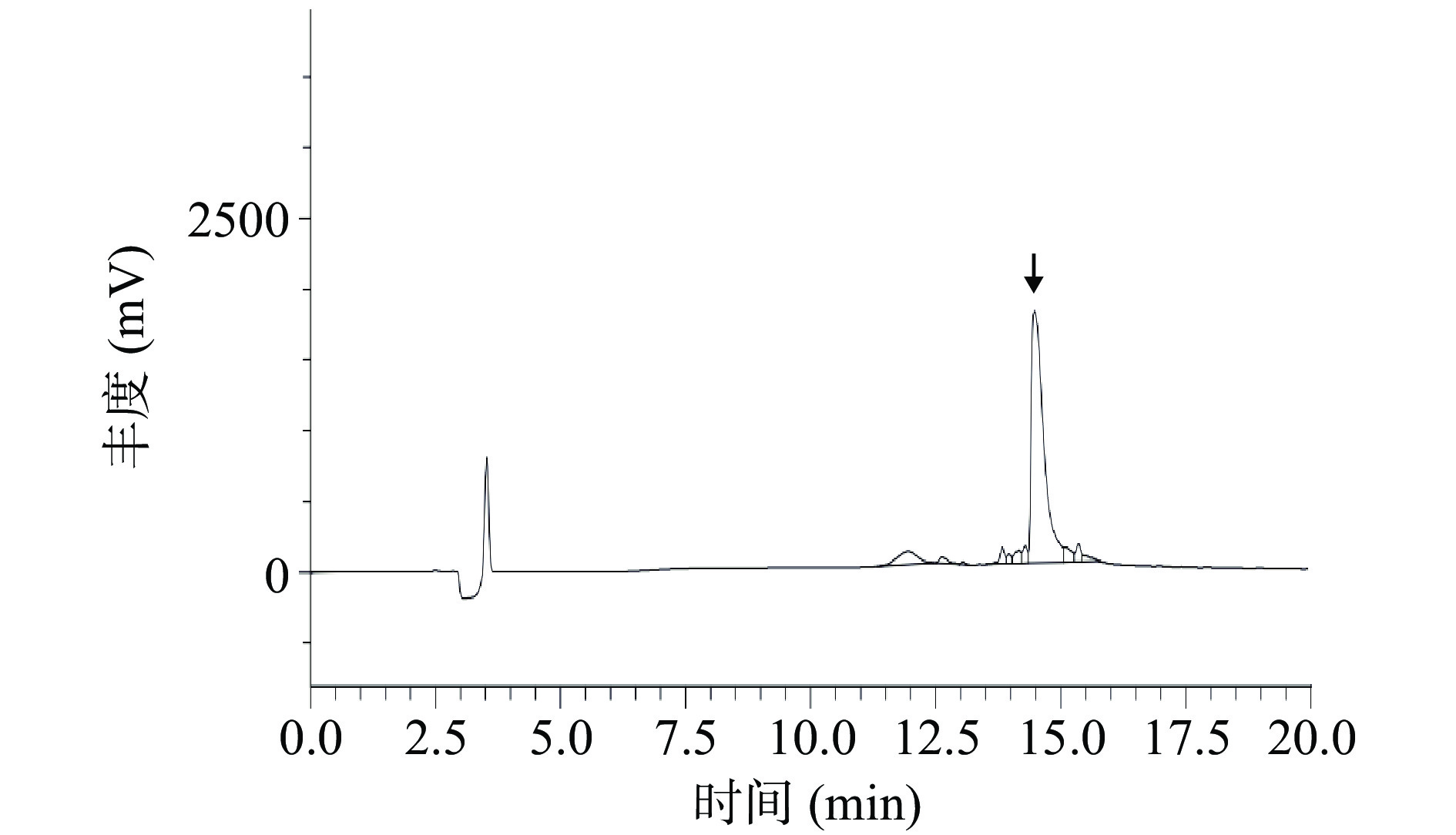
选取阳性酵母转化子,在0.5%甲醇浓度的条件下进行诱导表达5 d后,离心收集培养上清经TCA法浓缩之后进行Tricine-SDS-PAGE分析,如图7所示。酵母转化子的培养上清在4.6~10 kDa处有一个较明显的条带(黑色箭头所示),而空载体阴性对照的培养上清则无此条带,说明重组肽NK-LPd在酵母中成功表达。HPLC结果如图8,NK-LPd的保留时间为14.469 min,纯度75.7%。
2.7 重组NK-LPd的抑菌活性评价
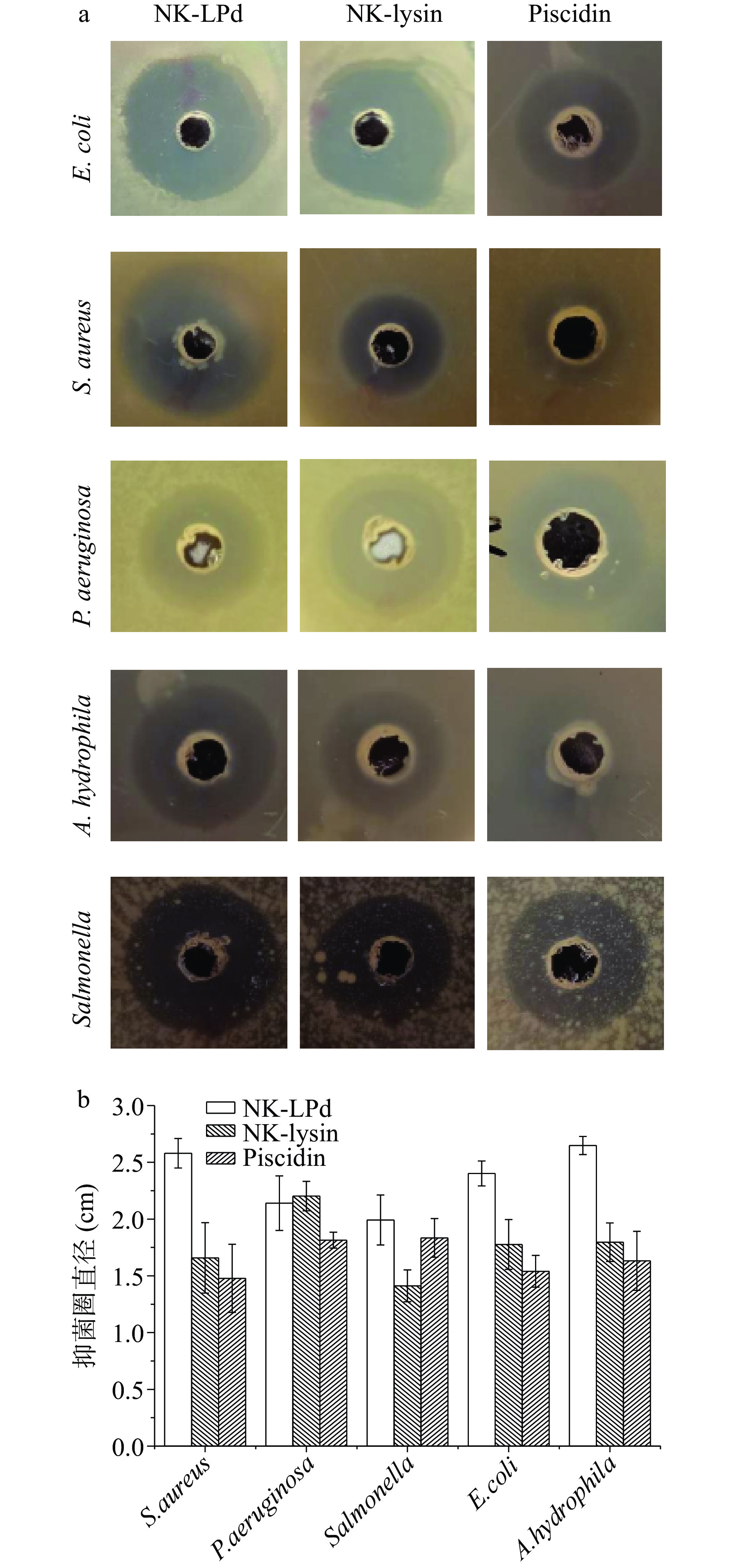
重组NK-LPd对大肠杆菌、金黄葡萄球菌、沙门氏菌、铜绿假单胞菌和嗜水气单胞菌的抑菌圈直径如图9。结果表明杂合肽NK-LPd对大肠杆菌(2.402±0.11 cm)、金黄葡萄球菌(2.580±0.13 cm)、沙门氏菌(1.992±0.22 cm)、铜绿假单胞菌(2.140±0.24 cm)和嗜水气单胞菌(2.648±0.08 cm)均显示出良好的抑菌性。并且与母体肽相比,杂合肽NK-LPd对铜绿假单胞菌的抑菌活性介于NK-lysin(2.202±0.13 cm)和Piscidin(1.814±0.07 cm)之间,但对大肠杆菌、金黄葡萄球菌、沙门氏菌和嗜水气单胞菌的抑菌活性增强,尤其NK-LPd对嗜水气单胞菌的抑菌活性为Piscidin的两倍。因此,可以证明重组NK-LPd肽对革兰氏阴性菌和革兰氏阳性菌均有明显的抑制作用,与母体肽相比抗菌活性增加。
3. 讨论
目前对于病原菌的治疗主要依靠抗生素,但抗生素的作用靶点单一导致大量的耐药菌的出现,已经成为临床感染管理的主要挑战[13]。抗菌肽在对抗各种病原微生物方面表现出显著的效果和优势,被认为是替代抗生素的理想候选者[14]。迄今为止,抗菌肽数据库(APD)已经储存了3000多种AMP,包括抗菌、抗病毒、抗寄生虫等[15]。虽然已经有少数抗菌肽进入了临床阶段[16],但天然的AMP存在溶血活性和细胞毒性等问题使其在实际生产应用中受到了严重限制。因此,需要对天然抗菌肽进行适当的改造使其更适合于应用。
将不同的抗菌肽连接得到杂合抗菌肽是目前抗菌肽分子改造的主要手段之一。Al等[17]利用LL-37和BMAP-27的序列开发了一个新的杂合肽B1,具有选择性,细胞毒性降低并且对哺乳动物的溶血作用降低,抗菌活性和联合用药后毒性显著改善。对天然抗菌肽开展分子改造主要从AMP结构与功能的关系出发,AMP的抗菌活性受到多种结构参数的影响[18],如净电荷、两亲性、疏水性和结构倾向等。所有的参数都是相互关联的,因此在设计杂合肽的时候要考虑结构的改变对其功能的影响。AMP的电荷数量与抗菌活性并不是单纯的线性相关,只有在一定的范围内才能提高抗菌活性,通常认为杂合肽的电荷在+3~+8之间较为合适[19]。疏水性决定着抗菌肽插入磷脂双分子层的程度,通常在50%左右[20]。抗菌肽的两亲性使其具有独特的杀菌机制,亲水区域可以与细胞膜的磷脂分子的头部结合,而疏水区域与磷脂分子尾部相互作用。但完美的两亲性会降低AMP的选择性,导致抗菌活性与细胞毒性同时增加[21]。本研究中,对设计的杂合肽NK-LPd进行生物信息学分析发现,NK-LPd的净电荷为4.5,疏水性为54%,绘制的螺旋轮图谱的亲水性氨基酸和疏水性氨基酸大体分别位于螺旋轮的两侧,不是完美的两亲性,但能形成明显的疏水界面和亲水界面。结构预测发现NK-LPd主要含有α螺旋结构,占整体结构的85.71%,通过APD预测有成为新型抗菌肽的可能。
本研究选择的母体肽Pisicidn和NK-lysin具有不同的抗菌作用机制,Piscidin通过环形孔机制破坏细菌细胞膜,α-螺旋体插入膜的脂质之间,导致细胞破裂死亡[22]。而NK-lysin进入目标微生物的细胞质后与微生物核酸相互作用并导致细胞死亡[23]。Shan等[8]发现斑马鱼NK-lysin的24个残基的截短肽,通过膜活性的细胞杀伤机制对副溶血性弧菌具有强大的抗菌作用并且可以提高非特异性免疫参数。鉴于NK-lysin和Piscidin具有不同的抗菌机制,为了获得抗菌活性更强,抗菌谱更广的抗菌肽,本研究基于杂合抗菌肽的设计思想,将银鲫NK-lysin和NK-lysin的短截肽NKL-24通过NCBI网站进行Blastn比对发现NK-lysin的71~94氨基酸(IKIKLGMICDEIGFLKSMCRNLVN)具有70%相似度,将Piscidin家族的氨基酸序列进行比对发现HHIFRGIVH序列保守。为了使连接的片段具有正确的构象和生物学活性,选择合适的连接肽进行连接。但目前对于连接肽的研究较少,并没有明确的统一标准。连接肽中常用的氨基酸包括甘氨酸(Gly)、脯氨酸(Pro)、丙氨酸(Ala)等[24],Gly分子质量较小并且无侧链基团,作为连接肽柔软易弯折,不会影响连接肽的空间结构[25]。陈香君等[26]截取LL-37和HNP-1的活性作用片段KEKIGKEF和RIPACIA,经“-甘氨酸(Gly,G)甘氨酸(Gly,G)-”两两拼接,设计合成新型LL-37杂合肽能够显著抑制乳腺癌MCF-7细胞的增殖、周期进展并促使其凋亡。Tonk等[27]测试了将CopA3和Hp1090与两个(InSco2)或六个(InSco6)甘氨酸残基的接头连接而产生的两种杂合肽的抗菌活性,发现杂合肽InSco2显示出比亲本AMP或InSco6更有效的杀菌活性。基于上述的研究报道,本研究选择两个Gly作连接肽将两个片段连接构建杂合抗菌肽,期望得到更高活性的杂合抗菌肽。
由于抗菌肽本身具有抗菌作用,采用大肠杆菌表达系统会抑制其进一步表达。有研究表明,用毕赤酵母表达系统表达的抗菌肽的抗菌活性比大肠杆菌表达系统的产物抗菌活性强[28]。薛剑锋[29]分别用大肠杆菌和毕赤酵母表达了对虾素Chp3、Chp5,原核表达的重组蛋白抑菌活性不高,而用毕赤酵母表达的重组蛋白的抑菌活性与从凡纳对虾和大西洋白对虾发现的天然对虾素对革兰氏阳性菌、革兰氏阴性菌和真菌的抑菌活性相似。这是因为毕赤酵母是真核表达系统,能够将翻译后的蛋白进行修饰加工,如添加二硫键等。由于母体肽NK-lysin的成熟肽具有6个保守的半胱氨酸,能够形成3个二硫键,对其结构的稳定具有关键性的作用,这种结构与其抗菌活性密切相关[30]。为了使重组杂合肽具有正确的结构功能,本研究采用毕赤酵母表达系统中的真核表达载体pPIC9K,利用甲醇调控启动子AOX 1使目标蛋白大量表达,将杂合抗菌肽NK-LPd的序列克隆在α-factor序列后实现目的蛋白的分泌表达。
经过设计后杂合抗菌肽NK-LPd的空间结构、两亲性和疏水性等都发生了巨大的变化,本研究将杂合抗菌肽与杂合前的两种抗菌肽通过抑菌圈法进行抑菌活性比对。母体肽均由本实验室前期通过相同的方法进行毕赤酵母诱导表达获得。实验发现,杂合抗菌肽的抑菌活性显著增加,对革兰氏阴性菌和革兰氏阳性菌均有明显的抑制作用。这可能是由于两种抗菌肽的作用方式不同,位于N端的Piscidin通过环型孔作用方式破坏细菌的细胞膜,进入细胞后NK-lysin与胞内目标成分结合加速了细胞的死亡。下一步我们将对其作用机制进行进一步分析验证。
4. 结论
本研究将Piscidin和NK-lysin的活性片段融合拼接成杂合抗菌肽,通过毕赤酵母KM71分泌表达获得重组杂合肽,纯化的杂合肽NK-LPd对革兰氏阳性菌和革兰氏阴性菌均有明显的抑制作用。本研究设计了一种新型具有生物学活性的杂合肽NK-LPd,能够代替抗生素在动物性食品中的使用,提高食品的安全性,在食品防护和动物饲料添加剂方面具有很好的应用前景。
-
表 1 SOE-PCR使用的引物序列
Table 1 The sequences of primers used in SOE-PCR
引物名称 序列 Tm值(℃) NL-1 CGGAATTCAAAAGACACCACATCTTCAGAGGTATCGTTCACGGTGGTATC 69 NL-2 CCGATCTCGTCACAGATCATACCCAACTTGATCTTGATACCACCGTGAACGATACC 71 NL-3 GGGTATGATCTGTGACGAGATCGGTTTCTTGAAGTCCATGTGTAGAAACTTGG 70 NL-4 ATTCGCGGCCGCTTAGTGGTGGTGGTGGTGGTGGTTAACCAAGTTTCTACACATGGAC 75 表 2 杂合抗菌肽NK-LPd理化性质分析
Table 2 Analysis of physicochemical properties of hybride antimicrobial peptide NK-LPd
名称 分子量(Da) 等电点 电荷数 脂肪系数 总水平疏水性 不稳定指数 半衰期 NK-LPd 3950.80 9.39 负氨基酸残基数:2
正氨基酸残基数:5116.86 0.403 15.53 3.5 h(哺乳动物网织红细胞半衰期)
10 min(酵母半衰期)
>10 h(大肠杆菌半衰期) -
[1] SINHA R, SHUKLA P. Antimicrobial peptides: Recent insights on biotechnological interventions and future perspectives[J]. Protein and Peptide Letters,2019,26(2):79−87. doi: 10.2174/0929866525666181026160852
[2] GIANNAMARIA A, GABRIELE C. Antimicrobial peptides (AMPs): A patent review (2015-2020)[J]. Expert Opinion on Therapeutic Patents,2020,30(12):931−947. doi: 10.1080/13543776.2020.1851679
[3] LEI J, SUN L C, HUANG S Y, et al. The antimicrobial peptides and their potential clinical applications[J]. American Journal of Translational Research,2019,11(7):3919−3931.
[4] RAJU S V, SARKAR P, KUMAR P, et al. Piscidin, fish antimicrobial peptide: Structure, classification, properties, mechanism, gene regulation and therapeutical importance[J]. International Journal of Peptide Research and Therapeutics,2021,27:91−107. doi: 10.1007/s10989-020-10068-w
[5] ZHU R, WU Y S, LIU X X, et al. Membrane disruptive antimicrobial potential of NK-lysin from yellow catfish (Pelteobagrus fulvidraco)[J]. Fish and Shellfish Immunology,2019,97:571−580.
[6] ZHANG M, LI M F, SUN L. NKLP27: A teleost NK-lysin peptide that modulates immune response, induces degradation of bacterial DNA, and inhibits bacterial and viral infection[J]. PLoS One,2014,9(9):e106543. doi: 10.1371/journal.pone.0106543
[7] 刘明辉, 张尚志, 马艳, 等. 抗菌肽及其分子改造研究进展[J]. 安徽农业科学,2016,44(16):147−150. [LIU M H, ZHANG S Z, MA Y, et al. Research progress of antibacterial peptides and their molecular modification[J]. Journal of Anhui Agricultural Sciences,2016,44(16):147−150. LIU M. H. , ZHANG S. Z. , MA Y. , et al. Research progress of antibacterial peptides and their molecular modification[J]. Journal of Anhui Agricultural Sciences, 2016, 44(16), 147-150.
[8] SHAN Z G, YANG Y P, GUAN N, et al. NKL-24: A novel antimicrobial peptide derived from zebrafish NK-lysin that inhibits bacterial growth and enhances resistance against Vibrio parahaemolyticus infection inYesso scallop, Patinopecten yessoensis[J]. Fish and Shellfish Immunology,2020,106:431−440. doi: 10.1016/j.fsi.2020.08.020
[9] ZHENG W, ZHANG C, LI Y, et al. Folding non-homologous proteins by coupling deep-learning contact maps with I-TASSER assembly simulations[J]. Cell Rep Methods,2021,26,1(3):100014.
[10] 王莲哲, 江宏浩, 唐宜飞, 等. 新型抗菌肽 Temporin-SHf 在毕赤酵母中的表达及诱导条件优化[J]. 食品与发酵工业,2020,46(14):98−102. [WANG L Z, JIANG H H, TANG Y F, et al. Expression of novel antibacterial peptide Temporin-SHf in Pichia pastoris and optimization of induction conditions[J]. Food and Fermentation Industries,2020,46(14):98−102. WANG L Z, JIANG H H, TANG Y F, et al. Expression of novel antibacterial peptide Temporin-SHf in Pichia pastoris and optimization of induction conditions[J]. Food and Fermentation Industries, 2020, 46(14): 98-102.
[11] 何妍之. 液相色谱技术在饲料中抗菌肽分离纯化和含量测定的应用研究[J]. 中国饲料,2021(22):63−68. [HE Y Z. Application of liquid chromatographic techniques for the separation and purification of antimicrobial peptides in feed and determination of their content[J]. China Feed,2021(22):63−68. HE Y. Z. Application of liquid chromatographic techniques for the separation and purification of antimicrobial peptides in feed and determination of their content[J]. China Feed, 2021(22): 63-68.
[12] 谭才邓, 朱美娟, 杜淑霞, 等. 抑菌试验中抑菌圈法的比较研究[J]. 食品工业,2016,37(11):122−125. [TAN C D, ZHU M J, DU S X, et al. Comparative study of the inhibition circle method in the inhibition test[J]. The Food Industry,2016,37(11):122−125. TAN C D, ZHU M J, DU S X. , et al. Comparative study of the inhibition circle method in the inhibition test[J]. The Food Industry, 2016, 37(11): 122-125.
[13] SEO M D, WON H S, KIM J H, et al. Antimicrobial peptides for therapeutic applications: A review[J]. Molecules,2012,17(10):12276−12286. doi: 10.3390/molecules171012276
[14] RAJESHWARI S, PRATYOOSH S. Antimicrobial Peptides: recent insights on biotechnological interventions and future perspectives[J]. Protein & Peptide Letters,2019,26(2):79−87.
[15] GUANGSHUN W, XIA L, ZHE W. APD3: the antimicrobial peptide database as a tool for research and education[J]. Nucleic Acids Research, 2016: D1087−D1093.
[16] DATTA S, ROY A. Antimicrobial peptides as potential therapeutic agents: a review[J]. International Journal of Peptide Research and Therapeutics,2021,27:555−577. doi: 10.1007/s10989-020-10110-x
[17] AL TALL Y, ABUALHAIJAA A, ALSAGGAR M, et al. Design and characterization of a new hybrid peptide from LL-37 and BMAP-27[J]. Infect Drug Resist,2019,30(12):1035−1045.
[18] TAN P, FU H Y, MA X. Design, optimization, and nanotechnology of antimicrobial peptides: From exploration to applications[J]. Nano Today,2021,4(44):101229.
[19] 武如娟, 张日俊. 杂合抗菌肽设计及生物学活性的研究进展[J]. 中国生物工程杂志,2013,33(9):94−100. [WU R J, ZHANG R J. The progress of hybrid peptides on design and biological activity[J]. China Biotechnology,2013,33(9):94−100. WU R. J. , ZHANG R. J. , The progress of hybrid peptides on design and biological activity[J]. China Biotechnology, 2013, 33(9): 94-100.
[20] GHOSH C, HALDAR D J. Membrane-active small molecules: Designs inspired by antimicrobial peptides[J]. Chem Med Chem,2015,10(10):1606−1624. doi: 10.1002/cmdc.201500299
[21] 孙长峰, 仲伟霞, 王洪法, 等. 抗菌肽作用机制及改造策略研究进展[J]. 中国病原微生物杂志,2013,8(7):659−663. [SUN C F, ZHONG W X, WANG H F, et al. Research progress on the mechanism of action and modification strategy of antimicrobial peptides[J]. Journal of Pathogen Biology,2013,8(7):659−663. SUN C F, ZHONG W X, WANG H F, et al. Research progress on the mechanism of action and modification strategy of antimicrobial peptides[J]. Journal of Pathogen Biology, 2013, 8(7): 659-663.
[22] CHEN R, MAO Y, WANG J, et al. Molecular mechanisms of an antimicrobial peptide piscidin (Lc-pis) in a parasitic protozoan, Cryptocaryon irritans[J]. BMC Genomics,2018,19(1):192.
[23] HUANG Y, ZHENG Q, NIU J, et al. NK-lysin from Oreochromis niloticus improves antimicrobial defence against bacterial pathogens[J]. Fish Shellfish Immunol,2018,72:259−265. doi: 10.1016/j.fsi.2017.11.002
[24] 于健, Sarra Setrerrahmane, 徐寒梅. 连接肽在融合蛋白设计中的选择及应用[J]. 药物生物技术,2016,23(3):260−263. [YU J, SETRERRAHMANE S, XU H M. Selection and application of linker peptides in fusion protein design[J]. Chinese Journal of Pharmaceutical Biotechnology,2016,23(3):260−263. YU J, SETRERRAHMANE S, XU H M. Selection and application of linker peptides in fusion protein design[J]. Chinese Journal of Pharmaceutical Biotechnology, 2016, 23(3): 260-263.
[25] 李剑芳, 王春娟, 邬敏辰. 连接肽的设计及在融合蛋白中的应用[J]. 食品与生物技术学报,2016,34(11):1121−1127. [LI J F, WANG C J, WU M C. Design of linker peptides and its application in fusion protein[J]. Journal of Food science and Biotechnology,2016,34(11):1121−1127. LI J F, WANG C J, WU M C. Design of linker peptides and its application in fusion protein[J]. Journal of Food science and Biotechnology, 2016, 34(11), 1121-1127.
[26] 陈香君, 李黎, 何树梅, 等. 新型LL-37杂合肽对乳腺癌MCF-7细胞的抗肿瘤活性的研究[J]. 中国肿瘤生物治疗杂志,2020,27(6):609−614. [CHEN X J, LI L, HE S M, et al. Antitumor activity of a novel LL-37 hybrid peptide against breast cancer MCF-7 cells[J]. Chinese Journal of Cancer Biotherapy,2020,27(6):609−614. CHEN X J, LI L, HE S M. ZHANG M. Antitumor activity of a novel LL-37 hybrid peptide against breast cancer MCF-7 cells[J]. Chinese Journal of Cancer Biotherapy, 2020, 27(6): 609-614.
[27] TONK M, VALDÉS, J J, CABEZAS-CRUZ A. et al. Potent activity of hybrid arthropod antimicrobial peptides linked by glycine spacers[J]. International Journal of Molecular Sciences,2021,22(16):8919. doi: 10.3390/ijms22168919
[28] 杨平, 袁奕豪, 杨晓莉, 等. 抗菌肽高效表达及生产优化研究进展[J]. 生物技术通报,2016,32(3):24−30. [YANG P, YUAN Y H, YANG X L, et al. Research progress of efficient expression and optimization of production of antibacterial peptide[J]. Biotechnology Bulletin,2016,32(3):24−30. YANG P, YUAN Y H, YANG X L, et al. Research progress of efficient expression and optimization of production of antibacterial peptide[J]. Biotechnology Bulletin, 2016, 32(3): 24-30.
[29] 薛剑峰. 对虾素CHP3和CHP5的原核与真核重组表达及性质研究[D]. 济南: 山东大学, 2005. XUE Jianfeng. Recombinant expression and characterization of CHP3 andCHP5, two kinds of antimicrobial peptides from Chinese shrimp (Fenneropenaeus chinensis) [D]. Jinan: Shandong University, 2005.
[30] CHEN R Y, CHEN J, LIU Z M, et al. Barbel steed (Hemibarbus labeo) NK-lysin protects against Aeromonas hydrophila infection via immunomodulatory activity[J]. Developmental and Comparative Immunology,2021,122:104114. doi: 10.1016/j.dci.2021.104114





 下载:
下载:


 下载:
下载:



