Preparation of Modified Starch-Based Silver Carp Oil Pickering Emulsion and Its Physicochemical Properties
-
摘要: 为提高鲢鱼鱼糜加工副产物-鲢鱼脂肪的利用率,以六种改性淀粉为固体颗粒、鲢鱼油为油相制备皮克林乳液,考察了淀粉种类、淀粉添加量(1%、2%、3%、4%、5%,w/w)、油水比(0.1、0.2、0.3、0.4、0.5、0.6,w/w)和离子强度(氯化钠浓度:0、0.1、0.2、0.3、0.4、0.5 mol/L)对乳液的理化特性(粒径、Zeta电位、乳化特性、稳定性、流变特性、微观结构)的影响。结果表明,六种改性淀粉中,辛烯基琥珀酸玉米淀粉颗粒粒径最小(146.73 nm),接触角最大(71.5°),制备的皮克林乳液最稳定。油水比和淀粉添加量显著影响了乳液的理化特性,较高的油水比(0.5~0.6)和淀粉添加量(4%~5%)使乳液表现出凝胶特性,适量(0.3~0.5 mol/L)氯化钠的添加可促进乳液微絮凝,增强乳液稳定性。乳液CLSM观察微观结构发现,乳液液滴的粒径随淀粉添加量的增加而减小,在2%~5%淀粉添加量下可观察到油滴被淀粉颗粒完全包裹,形成了致密的界面膜。油水比、淀粉添加量和氯化钠浓度分别为0.5、4%和0.4 mol/L时,乳液性能较佳。本研究可为功能性乳液配料的制备及其在功能性食品方面的应用提供参考。Abstract: In order to improve the utilization rate of silver carp fat, a by-product of silver carp surimi processing, the modified starch-based Pickering emulsion was prepared with six modified starches as solid particles and silver carp oil as oil phase. The effects of starch type, starch amount (1%, 2%, 3%, 4%, 5%, w/w), oil-to-water ratio (0.1, 0.2, 0.3, 0.4, 0.5, 0.6, w/w) and ionic strength (NaCl concentration: 0, 0.1, 0.2, 0.3, 0.4, 0.5 mol/L) on the emulsion physicochemical properties (including particle size, Zeta potential, emulsifying properties, stability, rheological properties, and microstructure) were investigated. The results showed that, among the six modified starches, the octenyl succinic anhydride modified corn starch had the smallest particle size (146.73 nm) and the largest contact angle (71.5°), and its Pickering emulsion had the best stability. The oil-water ratio and starch amount significantly affected the physiochemical properties of the prepared emulsion, and the emulsion had gel properties at the higher level of oil-water ratio (0.5~0.6) and starch amount (4%~5%). The addition of an appropriate amount (0.3~0.5 mol/L) of sodium chloride could promote the micro-flocculation of the emulsion and enhance the stability of the emulsion. The emulsion microstructure observed by confocal laser microscopic (CLSM) revealed that the particle size of the emulsion droplets decreased with the increase of starch amount, and the oil droplets were completely wrapped by modified starch particles and formed a dense interfacial film at the addition of 2%~5% starch. In conclusion, the better performance of Pickering emulsion was achieved at the oil-water ratio 0.5, starch amount 4% and sodium chloride concentration 0.4 mol/L, respectively. The study provides a reference for the preparation of fish oil Pickering emulsion and improves its application in functional food.
-
Keywords:
- modified starch /
- silver carp oil /
- Pickering emulsion /
- emulsion properties /
- microstructure
-
皮克林乳液(Pickering emulsion)是由具有两亲性的固体颗粒稳定的乳液,与传统乳液相比,皮克林乳液具有高度的稳定性、生物相容性、无表面活性剂、固体颗粒用量少、可通过对固体颗粒表面性质进行修饰来调整乳化效果等优点[1],因此,皮克林乳液得以在食品,化妆品,医药等领域广泛应用,是当下的研究热点,学者们也一直在寻找拓展皮克林乳液应用的方法。通常来说,从制备皮克林乳液的材料方面寻求改变是一个好的办法,即固体颗粒和油相。
近年来,皮克林乳液的研究逐渐由应用无机粒子发展到应用有机粒子,而食品级粒子的应用赋予了Pickering乳液更广阔的前景[2-3]。在众多食品级粒子中,淀粉颗粒有着原料丰富、种类多样、成本低廉的优势,并且生物相容性好,具有无毒无害无致敏性等优点[4]。然而,由于天然淀粉颗粒的粒径相对较大且表面羟基较多,导致其亲水性较强而疏水性较差,通常对天然淀粉进行改性使其成为稳定皮克林乳液的理想固体颗粒。Li等[5]以辛烯基琥珀酸酐(OSA,octenyl succinate anhydride)将天然藜麦淀粉改性,发现OSA显著增加了其疏水性;与天然藜麦淀粉相比,OSA改性淀粉乳液的乳化体积增加,粒径减小,稳定性提高。Yu等[6]同样以OSA制备了具有不同取代度的芋头淀粉,发现改性后芋头淀粉的接触角从25.4°显著增加至70.1°,其制备的乳液稳定性也显著提高。由此可见,以改性淀粉颗粒制备的皮克林乳液具有成本低廉、种类多样、生物相容性好和稳定性高等独特优势。
从油相方面拓展皮克林乳液的应用同样是一个可行的方向。Mei等[7]以油棕空果串纳米晶纤维素制备具有增强稳定性和抗氧化潜力的黑孜然油Pickering纳米乳液,其中黑孜然油具有抗自由基、抗菌、抗病毒、抗氧化、抗炎、抗焦虑和抗高血压等药理作用[8]。Li等[9]以十八烷基胺化羧甲基凝胶多糖提高丁香精油Pickering乳液的乳化性能和生物利用度,其中丁香精油含有丁香酚、石竹烯等多种活性成分,其具有抗氧化、抗菌、抗炎等生物活性[10]。通过这些研究发现,他们采用的油相均对人体有生理活性,且制备成皮克林乳液后对其本身的理化性质有所提高,这既扩展了油在皮克林乳液上的应用,也赋予了皮克林乳液功能特性,拓展了皮克林乳液在食品、化妆品和医疗方面的应用。鱼油富含二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)多种omega-3系多不饱和脂肪酸(omega-3PUFA),具有保护心脏、抑制癌症、促进大脑和视觉功能、抗糖尿病和抗炎等功能活性[11]。将鱼油制成皮克林乳液,使其以被固体颗粒包埋的小液滴形式存在,不仅可以提高其稳定性、防止氧化,而且可以拓展其应用范围,引起研究者的广泛关注。Hosseini等[12]以含有丁香精油的壳聚糖-硬脂酸纳米凝胶作为固体颗粒,鱼油为油相,制备了皮克林乳液,并将其用于生产富含鱼油的蛋黄酱。Ren等[13]以茶叶水溶性蛋白和κ-卡拉胶复合物为稳定剂制备了鱼油皮克林乳液,Ding等[14]、Yang等[15]以明胶为稳定剂制备了鱼油皮克林乳液,但以改性淀粉颗粒为稳定剂制备鱼油皮克林乳液的研究尚鲜见报道。
鲢鱼脂肪是鲢鱼鱼糜生产加工中的副产物,然其本身富含omega-3PUFA,具有良好的高值化利用潜力。为了提高其利用率,本文以六种市售改性淀粉作为固体颗粒,以鲢鱼油(由鲢鱼脂肪提纯制备)为油相制备皮克林乳液,探究了淀粉种类、淀粉添加量、油水比和离子强度对改性淀粉基鲢鱼油皮克林乳液特性的影响。本研究可为拓展皮克林乳液的应用和开发食品级皮克林乳液提供一些思路,为淀粉基鱼油皮克林乳液的构建提供一些参考。
1. 材料与方法
1.1 材料与仪器
鲢鱼脂肪 辽宁安井食品有限公司;辛烯基琥珀酸玉米淀粉钠(食品级,纯度99%)、辛烯基琥珀酸木薯淀粉钠(食品级,纯度99%)、交联木薯淀粉(食品级,纯度99%)、醋酸酯木薯淀粉(食品级,纯度99%)、羟丙基木薯淀粉(食品级,纯度99%)、羟丙基磷酸酯玉米淀粉(食品级,纯度99%) 永顺食品配料有限公司;氯化钠(分析纯) 悦成办公专营店;十二烷基硫酸钠(分析纯) 北京索莱宝科技有限公司;尼罗红、尼罗蓝(分析纯) 上海阿拉丁生化科技有限公司;异丙醇(分析纯) 上海麦克林生化有限公司。
HH-4数显恒温水浴锅 常州国华电器有限公司;XHF-DY型高速分散器 宁波新芝生物科技有限公司;AH-BASIC型高压均质机 安拓思纳米技术(苏州)有限公司;OCA 25型视频光学接触角测量仪 德国数据物理仪器有限公司;90Plus Zeta粒度及Zeta电位分析仪 美国布鲁克海文仪器公司;UV-2550型紫外可见光分光光度计 岛津仪器(苏州)有限公司;Leica SP8型激光共聚焦 德国徕卡公司;Lab expert型多重光散射仪 北京朗迪森科技有限公司;Discovery HR-1型流变仪 美国TA仪器有限公司。
1.2 实验方法
1.2.1 淀粉颗粒接触角的测定
参考李小敏[16]的方法,将粉末状样品用压片机压成直径13 mm、厚度为2 mm的平整圆片,把圆片放入样品池,控制高精度注射器,将一滴去离子水(5 μL)滴加在片剂的表面,平衡30 s后,采用高速摄像机对液滴的形态进行拍摄,以软件程序对成像液滴的轮廓进行模拟,得到三相接触角。
1.2.2 鲢鱼油的制备
以辽宁安井食品有限公司提供的鲢鱼脂肪为提取原料,将其置于70 ℃水浴锅中融化,然后将此液态混合物在7000 r/min条件下离心15 min,取上清夜并再次以同样的离心条件离心,取上清夜,−20 ℃储藏。
1.2.3 皮克林乳液的制备
称取一定质量的六种改性淀粉(1.1中六种淀粉),用蒸馏水配制成淀粉溶液(将淀粉与蒸馏水于50 ℃水浴,使淀粉充分溶于蒸馏水中),称取一定质量的鲢鱼油,将鲢鱼油添加进淀粉颗粒分散液中,用高速均质机15000 r/min处理4 min,然后用高压均质机均质,均质压力(50 MPa),均质循环次数为8次,可得皮克林乳液。然后以效果最佳的改性淀粉作为固体颗粒,分别研究淀粉添加量(1%、2%、3%、4%、5%,w/w)、油水比(0.1、0.2、0.3、0.4、0.5、0.6,w/w)和离子强度(氯化钠浓度:0、0.1、0.2、0.3、0.4、0.5 mol/L)对乳液的理化特性的影响。其中,固定变量为:淀粉添加量为3%,氯化钠浓度为0 mol/L,油水比为0.5。
1.2.4 皮克林乳液的乳化体积
皮克林乳液制成后以25 mL透明玻璃瓶盛放并密封,于4 ℃环境放置一月,观察其乳化体积的变化。测定乳化体积的公式如下所示:
乳化体积(%)=VeVt×100 (1) 式中:Ve为乳液乳化层体积;Vt为乳液总体积。
1.2.5 粒径和电位
采用90 Plus Zeta粒度及Zeta电位分析仪测定乳液的粒径和电位,测量时将乳液稀释1000倍。
1.2.6 乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI)
参考王标[17]的方法并稍作修改,取乳液40 μL加入10 mL 0.1%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS),振荡搅拌均匀后,以0.1% SDS溶液为空白,于500 nm波长处测定其吸光度(A500 nm)。于0 h测定的吸光度计算乳液乳化活性,隔6 h后同样的方法测定乳液的吸光度。测定乳化活性(EAI)和乳化稳定性(ESI)的公式如下所示:
EAI(m2/g)=2.303×2×A500\;nm×稀释倍数C×(1−φ)×104 (2) ESI(%)=AtA0×100 (3) 式中:EAI为单位质量淀粉的乳化表面积,m2/g;A500 nm是样品在500 nm下的吸光度;C为样品溶解液中淀粉质量浓度,g/mL;φ为油相所占的质量分数;稀释倍数为250倍;A0是0 h时乳液的吸光度;At是6 h后乳液的吸光度。
1.2.7 多重光散射分析
参照赵玲玲[18]的方法,通过多重光散射仪研究乳液稳定性。将20 mL制备乳液样品放入样品瓶中并装入散射仪中,两个检测器在25 ℃下采用多次扫描模式对乳液进行1 h连续检测,每25 s扫描一次。收集透射光和背散射光强度随时间的变化数据。检测得到的图形反映样品体积浓度和颗粒粒径随时间的变化规律,从而表征样品的稳定性,然后通过Turbiscan软件输出为ΔBS曲线。利用Turbiscan软件对稳定性数据进行分析,计算出样品中油滴的迁移率和稳定性动力学指数(turbiscan stability index,TSI)。
1.2.8 流变特性
采用马尔文流变仪对样品进行表观粘度测试,取平板探头(直径40 mm),将制备好的乳化液2 mL滴加在双侧隔板中,测定乳液在25 ℃恒定温度下的流变特性。测试软件选取TRIOS,在相同剪切速率(0.01~100 s−1)条件下进行流动扫描实验,测定其粘度值;频率变化范围为0.01~10 Hz,间距为1.0 mm,振幅为0.05%,进行频率扫描实验,测定其储能模量和损耗模量。每个样品重复三次,取平均值。
1.2.9 乳液微观结构分析
为确定淀粉颗粒在乳液界面的分布,采用激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)进行观测。观测前,将尼罗红(1 mg/mL,溶于异丙醇)和尼罗蓝(1 mg/mL,溶于异丙醇)1:1混合制成染色剂。取混合染色剂对样品进行染色。将染色后的样品置于凹槽的激光共聚焦显微镜的载玻片上,其中488 nm处为尼罗红的激发波长,633 nm处为尼罗蓝的激发波长。
1.3 数据处理
所有实验均重复3次,实验结果表示为平均值±标准偏差。实验数据采用Origin 201932b绘图,采用SPSS 26.0统计软件进行单因素ANOVA判断(邓肯检验),P<0.05表示具有显著性差异。
2. 结果与分析
2.1 不同淀粉颗粒的筛选
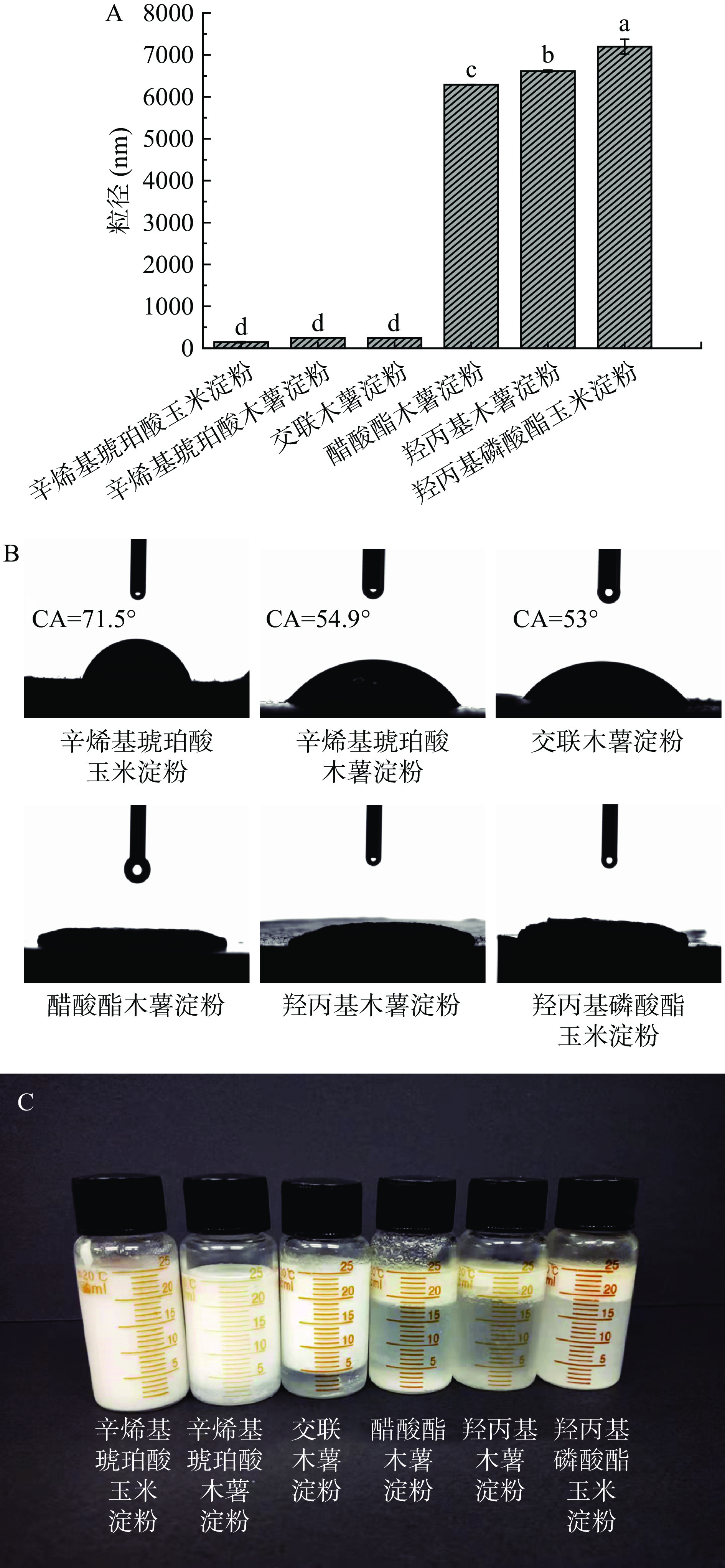
在本实验中,以改性淀粉制备的乳液液滴可在水相中快速分散,根据乳液在水相或油相中的分散行为判断其为水包油乳液。乳液类型鉴定完毕后,测定了六种改性淀粉的粒径和三相接触角,并将乳液在4 ℃条件下储藏30 d,以筛选不同改性淀粉所制备乳液的优劣。如图1A所示,辛烯基琥珀酸玉米淀粉、辛烯基琥珀酸木薯淀粉和交联木薯淀粉的粒径显著低于醋酸酯木薯淀粉、羟丙基木薯淀粉、羟丙基磷酸酯玉米淀粉(P<0.05),并且前三种淀粉的接触角也明显高于后三种淀粉(后三种改性淀粉亲水性极强,水滴轻易便溶入淀粉圆片,故接触角未测出,图1B)。如图1C所示,由辛烯基琥珀酸玉米淀粉稳定的皮克林乳液乳化体积仍然为100%,辛烯基琥珀酸木薯淀粉和交联木薯淀粉的乳化体积分别为88%和82%,醋酸酯木薯淀粉、羟丙基木薯淀粉、羟丙基磷酸酯玉米淀粉的乳化体积显著低于前三种改性淀粉,分别为28%、22%和24%。Li等[19]以大米、糯玉米、小麦和马铃薯4种天然淀粉颗粒制备液体石蜡皮克林乳液,发现大米淀粉稳定的乳液乳化体积最大,因为大米淀粉的粒径最小。研究表明,颗粒粒径越小,所稳定的乳液液滴粒径也越小,皮克林乳液越稳定;此外,固体颗粒的接触角越接近90°,所制备的乳液也越稳定[20]。辛烯基琥珀酸玉米淀粉粒径最小(为146.73 nm),接触角(θ)最大(为71.5°),且制备的鱼油储藏30 d后最稳定。因此,后续试验选用辛烯基琥珀酸玉米淀粉制备鲢鱼油皮克林乳液。
2.2 粒径和电位
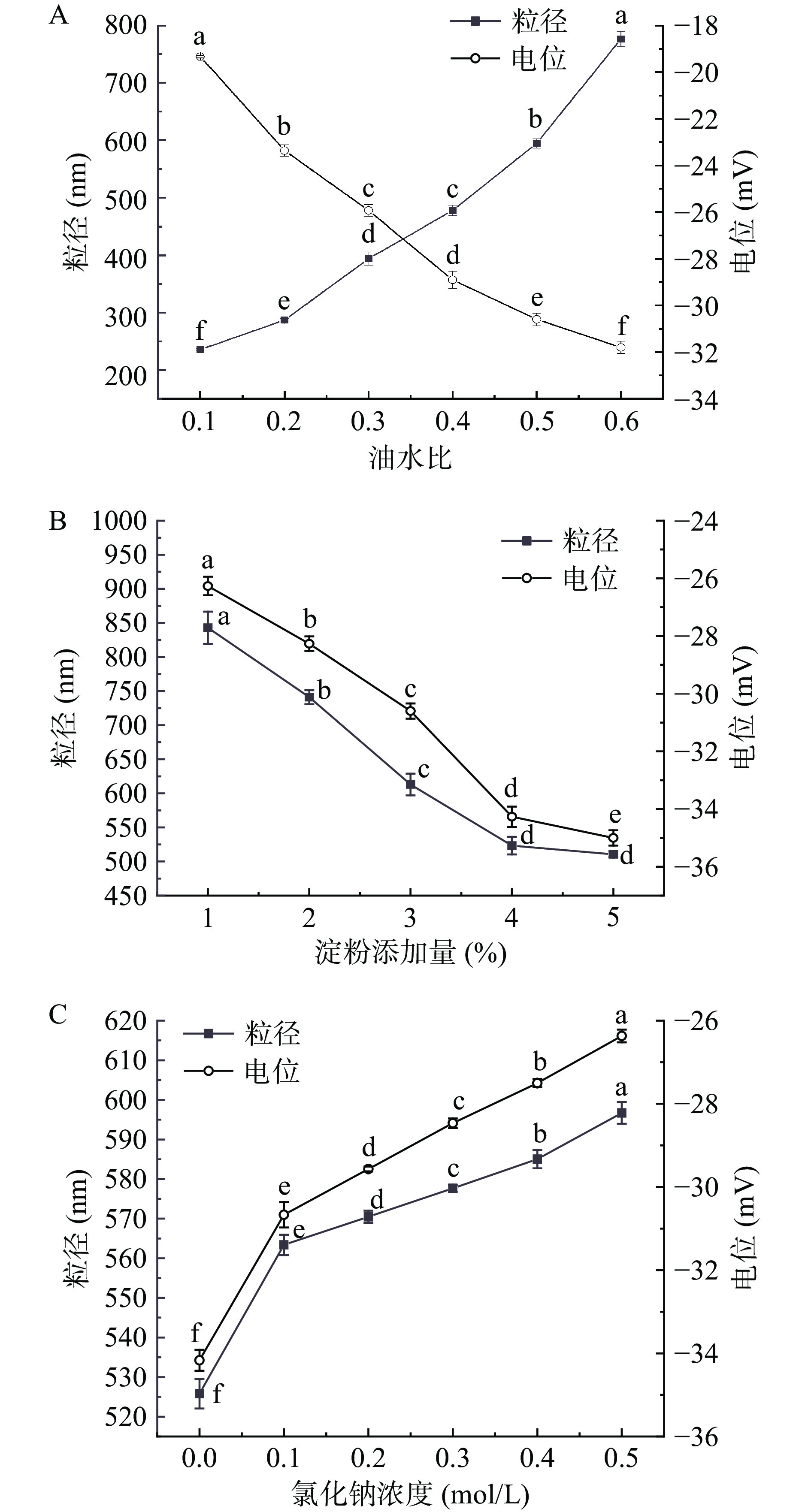
油水比、淀粉添加量和氯化钠浓度均可影响乳液的粒径和电位,从而影响乳液的稳定性。如图2A和图2B所示,乳液的粒径随着油水比的增加逐渐增大,随着淀粉添加量的增加逐渐降低。乳液粒径的变化与油滴单位界面膜上的淀粉浓度有关。随着油相增多,乳液单位界面膜上淀粉颗粒浓度降低,体系在经过高速剪切和高压均质时通过减小比表面积来完成乳化[21],于是呈现出粒径增大的趋势。而随着淀粉添加量的不断增大,单位界面膜上的淀粉颗粒浓度不断增加,粒径不断减小,并在4%的添加量下趋于饱和,且当添加量达5%时没有显著差异(P>0.05)。因此,4%为淀粉的最佳添加量,这与李小敏[16]的研究结果相似。由图2A和图2B可知,乳液的Zeta电位随油水比和淀粉添加量的增大而逐渐降低。由于辛烯基琥珀酸淀粉为阴离子型生物大分子乳化剂,其在水中可以解离出羧酸基负离子。因此,乳液的Zeta电位随水中淀粉浓度的增大而减小。
如图2C所示,随着氯化钠的添加,乳液的粒径和Zeta电位逐渐增大。这是因为氯化钠在乳液中可解离为钠离子和氯离子,减少了乳液液滴之间的静电排斥[22],导致乳液的Zeta电位逐渐增大,同时也使乳液液滴发生微絮凝,导致乳液粒径随之增大。此外,当氯化钠浓度为0.1 mol/L时,乳液的粒径和Zeta电位均有显著的增加,这可能与乳液中离子环境的突变有关。王然[2]研究中发现,随着氯化钾浓度的增加,辛烯基琥珀酸纳米淀粉酯颗粒稳定的皮克林乳液粒径不断增加,当KCl浓度为50 mmol/L时,乳液发生分层现象,这是因为氯化钾的添加显著增大了乳液的Zeta电位(0 mmol/L时乳液Zeta电位在−27 mV左右,50 mmol/L时乳液的Zeta电位在−7 mV左右),颗粒之间的静电斥力显著降低,导致乳液之间发生严重的絮凝,使乳液失去稳定性。
2.3 乳化特性
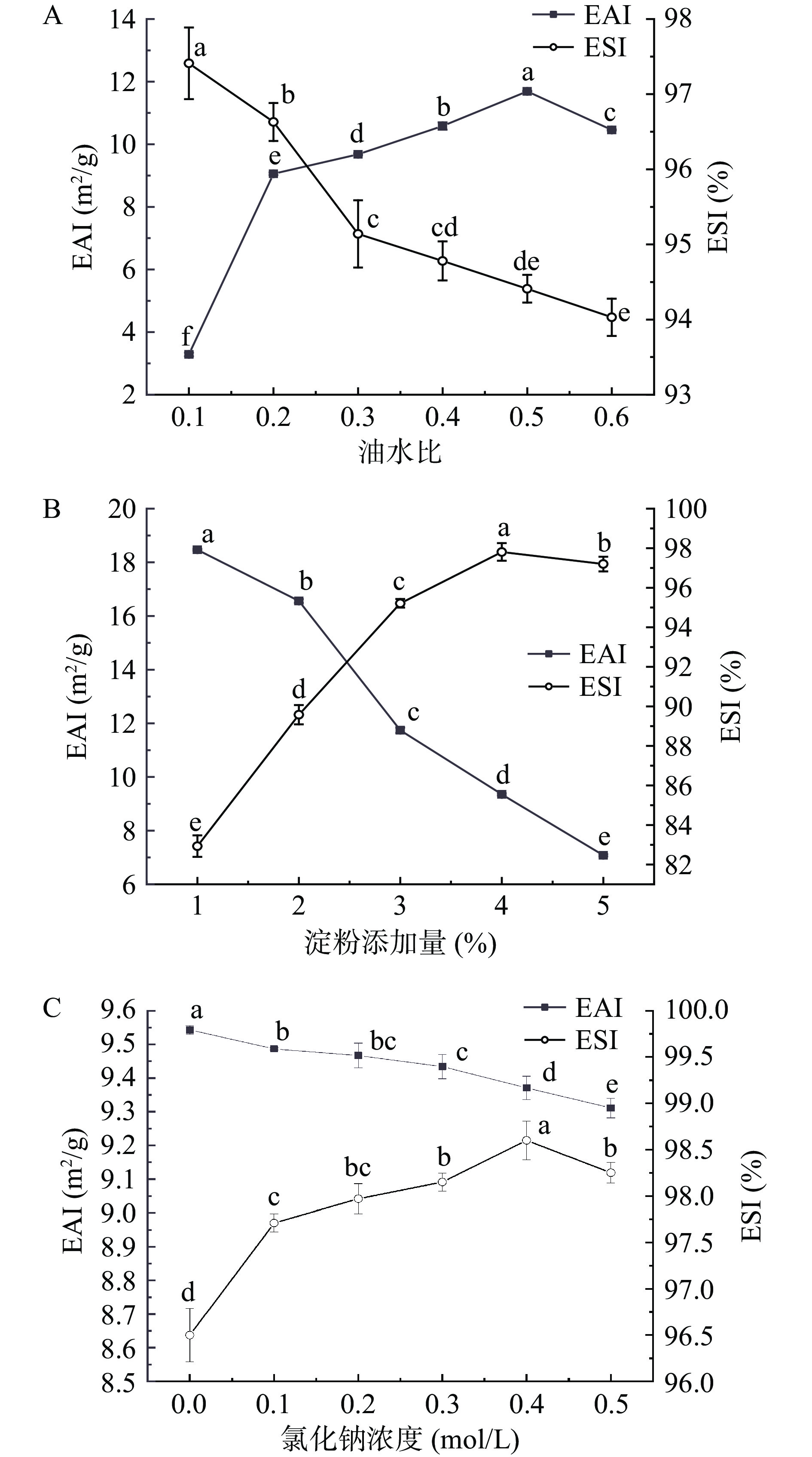
乳液的乳化活性(EAI)和乳化稳定性(ESI)的增加有助于乳液的形成和稳定。研究表明,乳液的乳化活性与油水比成正比,与乳液粒径和淀粉添加量成反比[23-24]。如图3A所示,乳液乳化活性随着油水比的增大而增加,在油水比为0.5时达到最高点,乳液稳定性则随着油水比的增加不断降低。这是因为随着油水比的增加,油滴的比表面积增大,淀粉颗粒之间的竞争吸附降低,淀粉颗粒可更快地吸附在油水界面上,增强乳液的乳化活性[23]。然而,油水比的增加同样使得乳液的粒径增大,乳液的乳化活性在油水比为0.5时达到最高,乳液的乳化稳定性不断降低。图3B显示了不同淀粉添加量下乳液乳化特性的变化。随着淀粉添加量的增加,乳液的乳化活性不断下降,乳化稳定性不断升高,在4%的添加量时达到最高。这是因为淀粉颗粒之间存在着分子间或分子内作用力,淀粉添加量的增加使这些作用力得到增强,从而减少了淀粉颗粒吸附于油滴的机会,降低了乳液乳化活性。然而淀粉添加量的增加也使得淀粉颗粒充分包裹了油滴,避免了乳液液滴之间的聚集和絮凝,减小了乳液的粒径,从而增强乳液的稳定性。淀粉添加量超过4%时乳化稳定性有略微的下降,可能是因为过量淀粉颗粒分子间或分子内的力对乳液的乳化稳定性有一定程度的破坏[23]。如图3C所示,氯化钠的添加降低了乳液的乳化活性,增强了乳液的乳化稳定性,NaCl添加量在0.4 mol/L时,乳液的乳化稳定性达到峰值。这是因为氯化钠的添加促进了乳液的微絮凝,增加了乳液的粒径,导致乳液的乳化活性减小,乳化稳定性增大。
2.4 乳液稳定性
乳液的视觉外观图可定性反映乳液的稳定性,乳液背散射光谱图和稳定性动力学指数(TSI)可定量反映乳液的稳定性。由图4可知,油水比0.1~0.4的乳液乳化体积均为100%,油水比0.5~0.6的乳液不仅乳化体积为100%且形成了乳液凝胶,倒立而不变形(图4A);淀粉添加量1%的乳液乳化体积为68%,添加量2%~5%的乳液乳化体积为100%且形成乳液凝胶(图4B);添加0~0.5 mol/L的氯化钠,乳液均形成乳液凝胶(图4C)。观察乳液的视觉外观图可知,在淀粉添加量(1%)不足的情况下,乳液液滴之间会聚集絮凝,最终分层;在较高的油水比、淀粉添加量及一定浓度氯化钠存在条件下制备的乳液稳定性极强且可形成凝胶状。
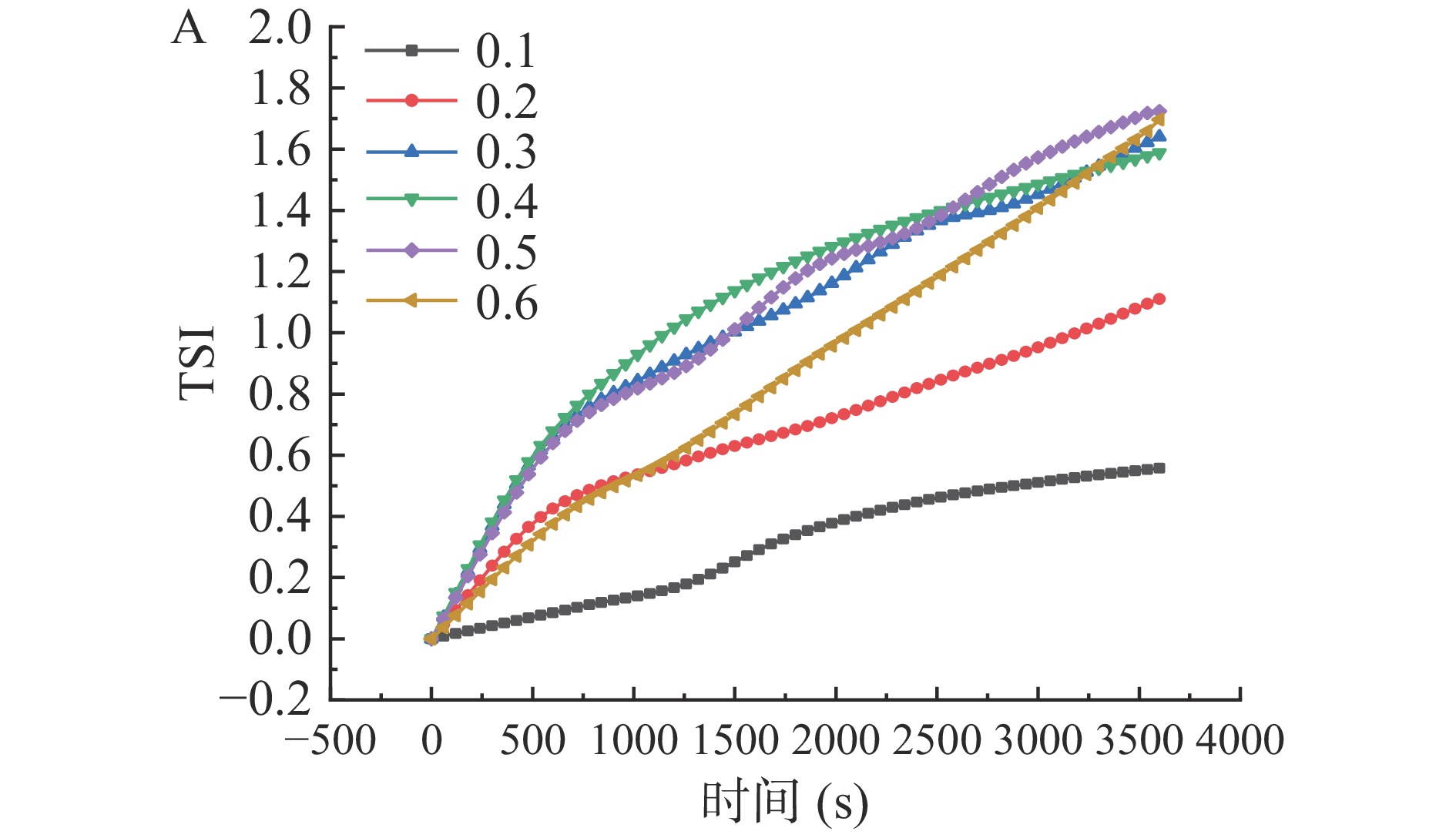
图5反映了1 h内不同油水比、淀粉添加量和氯化钠浓度对乳液稳定性的影响,其中A1~A6分别代表油水比0.1~0.6,B1~B5分别代表淀粉添加量1%~5%,C1~C6分别代表氯化钠浓度0~0.5 mol/L。图中纵坐标为背散射光变化值,背散射光强的变化随着乳液液滴的粒径和浓度变化,背散射光谱上下峰突出强度越小,乳液越稳定;横坐标为高度,其自左向右对应于样品瓶顶部至样品瓶底部。图6是对应于图5中不同油水比、淀粉添加量和氯化钠浓度的乳液TSI图,TSI值越小、斜率越小,表明乳液越稳定[25]。如图5中A1~A6所示,随着油水比的不断增加,样品瓶底部的背散射光强不断增大,下凸峰不断向下延伸,而在0.6的油水比时,从样品瓶顶部到底部,整体呈现向下的峰,这说明0.6的乳液液滴从顶部往底部整体性迁移。观察与之对应的图6A可知,随着油水比的增加,乳液TSI值也不断增大,乳液稳定性不断降低。观察图5B1发现样品瓶顶部的背散射光强随着时间不断增大,这表明乳液液滴随着时间推移在往样品瓶顶部聚集,这是因为1%的淀粉添加量不足以完全稳定乳液,随着时间的推长其稳定性逐渐降低,与之对应的是图6B中1%乳液的TSI值为6.49,远高于其他淀粉添加量下乳液的TSI值。此外,观察图5中B1~B5发现,随着淀粉添加量的增加,样品瓶底部的背散射光强不断减小,下凸峰不断向上缩减,与之对应的图6B中乳液的TSI随着淀粉添加量的增加而不断减小,其中4%乳液的TSI值最低为0.78,这表明淀粉的添加有助于乳液的稳定,然而过量淀粉的添加可能对乳液的稳定性产生不利的影响。如图5中C1~C6所示,随着氯化钠浓度的增加,背散射光强有略微的减小,与之对应的图6C中乳液的TSI值也有略微的减小,其中,0.4 mol/L乳液的TSI值最低为0.47。这是因为适量电解质的添加能够促进固体颗粒吸附在液滴表面,使乳液形成凝胶状态,在这种状态下,乳液的粘度更高,稳定性也更强。在赵玲玲[18]的研究中,盐离子浓度为0.1 mol/L 时,大豆种皮多糖乳液的TSI值最小,与本文的结果相似,而适宜的氯化钠添加量不同则可能与制备乳液的材料与条件等多种因素有关。
2.5 流变特性
界面流变学是揭示乳液体系中液滴-液滴、液滴-颗粒或颗粒-颗粒相互作用的关键技术。监测乳液样品流变性质的变化,如粘度、储能模量(G')和损耗模量(G''),有利于表征乳液稳定性和液滴-液滴相互作用[26]。观察图7中乳液的粘度变化发现,所有组的粘度都随着剪切速率的增加而逐渐降低,这是一种剪切变稀的流变行为,表明制备的乳液属于非牛顿流体。当剪切速率为0.01 s−1时,随着油水比从0.1增加至0.6,乳液的粘度也从1.14 Pa·s明显增加至78.08 Pa·s,(图7A);随着淀粉添加量从1%增加至5%,乳液的粘度从1.01 Pa·s明显增加至63.95 Pa·s(图7B);随着氯化钠浓度从0 mol/L增加至0.5 mol/L,乳液的粘度略有提高,从50.94 Pa·s增加至74.68 Pa·s(图7C)。这是因为随着油水比的增加,乳液液滴之间的接触面积也在增大,而淀粉添加量的增加不仅导致液滴之间的分离距离减小,增强了液滴之间的相互作用,还导致了液滴的粒径减小,增加了单位液滴与液滴之间相互作用的数量[27];适量氯化钠的添加则可适当降低乳液液滴之间的静电斥力,有利于乳液凝胶网络的形成。因此,油水比、淀粉添加量和氯化钠的增加都可促进淀粉基皮克林乳液形成聚集体和网络结构,有助于抵抗剪切,使乳液具有更高的粘度。
图8和图9分别显示了不同油水比、淀粉添加量、氯化钠浓度下乳液的储能模量和损耗模量。图8和图9可知,乳液的储能模量和损耗模量均随着油水比和淀粉添加量的增加而增大,当油水比为0.5~0.6和淀粉添加量为2%~5%时,乳液的储能模量均高于损耗能量,其中淀粉添加量2%,油水比0.5的乳液在0.01~10 Hz的储能模量为1.23~13.81 Pa,损耗模量为0.55~2.54 Pa。乳液的储能模量和损耗模量随着氯化钠浓度的增加而略有降低,当氯化钠浓度为0~0.5 mol/L时,乳液的储能模量均高于损耗模量。油水比和淀粉添加量的增加有利于乳液油滴周围形成凝胶网络,这也是较高的油水比和淀粉添加量下乳液的储能模量均高于损耗模量的原因;而氯化钠的添加略微地降低了乳液的储能模量和损耗模量,这可能与其改变了乳液中的离子环境有关。观察图8和图9中储能模量高于损耗模量的乳液发现其可与乳液的外观图相对应,这表明储能模量高于损耗模量的乳液具有弹性和凝胶固体状性质。Li等[5]以取代度为0.028的辛烯基琥珀酸改性藜麦淀粉,在4%的淀粉浓度下,油相体积为50%~70%时,乳液的储能模量均高于损耗模量,形成了倒立的乳液凝胶,这与本文的结果类似。值得一提的是,氯化钠对乳液的粘度有略微的提高,对乳液的储能模量和损耗模量则有略微的降低,由此可知,氯化钠的添加对淀粉基皮克林乳液的流变特性并无显著影响,这与Zhu等[28]的研究结果一致。然而,Liu等[29]以鱼糜颗粒稳定的皮克林乳液中,氯化钠的浓度显著影响了乳液的流变特性,这是因为水相中的离子强度影响了鱼糜蛋白的溶解度,改变氯化钠的浓度会影响其自聚集行为,进而影响水包油乳液体系的流变特性。通过对比这些研究发现,对于非盐溶性蛋白而言,氯化钠对以其为固体颗粒稳定的乳液的流变特性无显著性影响。
2.6 微观结构
为了进一步了解改性淀粉稳定的鲢鱼油Pickering乳液的形成及其在油滴表面的分布行为,以油水比为0.5时不同淀粉添加量制备的乳液为例,采用CLSM对其微观结构进行了观察。如图10所示,绿色球体为油滴,红色颗粒为淀粉颗粒。淀粉添加量为1%时可观察到有许多淀粉颗粒吸附于油滴上,在2%的浓度下可观察到淀粉颗粒吸附于油滴上,直至油滴被淀粉颗粒完全包裹,形成了致密的界面膜结构。这种结构能够起到一个物理屏障的作用,避免油滴之间的直接接触,抑制液滴的絮凝、聚集、奥氏熟化以及脂肪氧化等现象的发生[16,30]。随着淀粉添加量的增加,吸附于油滴上的淀粉颗粒含量显著增加,形成界面膜结构的油滴也逐渐增多,液滴的粒径也逐渐减小,这与图2B的结果一致。Dai等[31]以玉米醇溶蛋白/阿拉伯树胶复合胶体纳米粒子稳定皮克林乳液,其CLSM图显示,固体颗粒在球形油滴表面形成了一层致密而厚的界面层,对皮克林乳状液的聚结形成了有效的屏障。Zhu等[30]以辛烯基琥珀酸籼米淀粉制备皮克林乳液,CLSM观察结果表明,3%~4%辛烯基琥珀酸淀粉制备的乳液其油滴周围被大量淀粉颗粒包裹,在油滴表面形成界面膜,形成了三维网络结构,从而提高乳液的稳定性,这与本文的结果相似。综上所述,淀粉添加量的增加,显著减小了乳液的粒径(从 1% 时的 842.91 nm 减小至 5% 的 510.52 nm),并包埋了油滴,在油滴表面形成了致密的界面膜结构,显著提高了乳液的稳定性。
3. 结论
从六种改性淀粉中筛选出辛烯基琥珀酸玉米淀粉作为最佳的固体颗粒,以鲢鱼油为油相制备了改性淀粉基鲢鱼油皮克林乳液。随着油水比的增加,乳液粒径增加和Zeta电位下降、乳化活性增加但稳定性下降;随着淀粉添加量的增加,粒径和Zeta电位下降、乳化活性下降但稳定性提高;随着氯化钠浓度的增加,乳液粒径增加和Zeta电位升高。在较高的油水比与淀粉颗粒浓度下,皮克林乳液表现出凝胶状行为。微观结构观察结果发现淀粉颗粒完全包裹油滴,在其表面形成了致密的界面膜,形成了有效的屏障。综上可知,油水比、淀粉添加量和氯化钠浓度分别为0.5、4%和0.4 mol/L时,制备的皮克林乳液具有良好的理化特性和稳定性。本研究可为开发新型淀粉基鱼油皮克林乳液提供一定的参考,为拓展皮克林乳液的应用提供一些思路,未来或可将皮克林乳液添加于鱼糜制品中以增强鱼糜制品的营养特性。
-
-
[1] TAN Y, XU K, LIU C, et al. Fabrication of starch-based nanospheres to stabilize pickering emulsion[J]. Carbohydrate Polymers,2012,88(4):1358−1363. doi: 10.1016/j.carbpol.2012.02.018
[2] 王然. 辛烯基琥珀酸纳米淀粉酯颗粒的制备及其食品级Pickering乳液的特性[J]. 食品科学,2019,40(20):94−99. [WANG Ran. Preparation of octenylsuccinate nano-starch ester particles and their properties of food-grade Pickering emulsion[J]. Food Science,2019,40(20):94−99. doi: 10.7506/spkx1002-6630-20190316-204 [3] XIA T, XUE C, WEI Z H. Physicochemical characteristics, applications and research trends of edible Pickering emulsions[J]. Trends in Food Science & Technology,2021,107:1−15.
[4] LUZ A, MARIA L H, MARIA L F. Synthesis and characterization of octenyl succinic anhydride modified starches for food applications. A review of recent literature[J]. Food Hydrocolloids,2018,80:97−110. doi: 10.1016/j.foodhyd.2018.01.032
[5] LI S, ZHANG B, TAN C P, et al. Octenylsuccinate quinoa starch granule-stabilized Pickering emulsion gels: Preparation, microstructure and gelling mechanism[J]. Food Hydrocolloids,2019,91:40−47. doi: 10.1016/j.foodhyd.2019.01.001
[6] YU Z Y, JIANG S W, ZHENG Z, et al. Preparation and properties of OSA-modified taro starches and their application for stabilizing Pickering emulsions[J]. International Journal of Biological Macromolecules,2019,137:277−285. doi: 10.1016/j.ijbiomac.2019.06.230
[7] FOO M L, OOI C W, TAN K W, et al. Preparation of black cumin seed oil Pickering nanoemulsion with enhanced stability and antioxidant potential using nanocrystalline cellulose from oil palm empty fruit bunch[J]. Chemosphere,2021,287:132108.
[8] YIMER E. M., TUEM K B, KARIM A et al. Nigella sativa L. (black cumin): A promising natural remedy for wide range of illnesses[J]. Evidence-Based Complementary and Alternative Medicine,2019,2019:1−16.
[9] LI H, WU C C, YIN Z W, et al. Emulsifying properties and bioavailability of clove essential oil Pickering emulsions stabilized by octadecylaminated carboxymethyl curdlan[J]. International Journal of Biological Macromolecules,2022,216:629−642. doi: 10.1016/j.ijbiomac.2022.07.029
[10] YU H P, HANG G T, MA Y Q, et al. Cellulose nanocrystals based clove oil Pickering emulsion for enhanced antibacterial activity[J]. International Journal of Biological Macromolecules,2021,170:24−32. doi: 10.1016/j.ijbiomac.2020.12.027
[11] FEREIDOON S, PRIYATHARINI A. Omega-3 polyunsaturated fatty acids and their health benefits[J]. Annual Review of Food Science and Technology,2018,9(1):345−381. doi: 10.1146/annurev-food-111317-095850
[12] HOSSEINI R S, RAJAEI A. Potential Pickering emulsion stabilized with chitosan-stearic acid nanogels incorporating clove essential oil to produce fish-oil-enriched mayonnaise[J]. Carbohydrate Polymers,2020,241(2):116340.
[13] REN Z Y, LI Z M, CHEN Z Z, et al. Characteristics and application of fish oil-in-water pickering emulsions structured with tea water-insoluble proteins/κ-carrageenan complexes[J]. Food Hydrocolloids,2021,114:106562. doi: 10.1016/j.foodhyd.2020.106562
[14] DING M Z, ZHANG T, ZHANG H, et al. Gelatin molecular structures affect behaviors of fish oil-loaded traditional and Pickering emulsions[J]. Food Chemistry,2020,309:125642. doi: 10.1016/j.foodchem.2019.125642
[15] YANG M Y, YANG L L, XU J M, et al. Comparison of silver carp fin gelatins extracted by three types of methods: Molecular characteristics, structure, function, and pickering emulsion stabilization[J]. Food Chemistry,2022,368:130818. doi: 10.1016/j.foodchem.2021.130818
[16] 李小敏. 淀粉基复合胶体颗粒皮克林乳液的构建与应用[D]. 合肥: 合肥工业大学, 2020 LI Xiaomin. Construction and application of starch-based composite colloidal particle Pickering emulsion[D]. Hefei: Hefei University of Technology, 2020.
[17] 王标. 鲶鱼鱼糜在不同低温贮藏下的品质及其蛋白质理化特性的研究[D]. 太原: 山西农业大学, 2019 WANG Biao. Study on the quality of catfish surimi and its protein physicochemical properties under different low temperature storage[D]. Taiyuan: Shanxi Agricultural University, 2019.
[18] 赵玲玲. pH、Na+及萃取剂对大豆种皮多糖乳化性影响研究[D]. 锦州: 渤海大学, 2019 ZHAO Lingling. Effects of pH, Na+ and extractant on the emulsification of soybean seed coat polysaccharide[D]. Jinzhou: Bohai University, 2019.
[19] LI C, LI Y X, SUN P D, et al. Pickering emulsions stabilized by native starch granules[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2013,431(33):142−149.
[20] 曾海燕. 壳聚糖纳米粒子的制备及其稳定皮克林乳液的研究[D]. 无锡: 江南大学, 2015 ZENG Haiyan. Preparation of chitosan nanoparticles and their stabilization of Pickering emulsion[D]. Wuxi: Jiangnan University, 2015.
[21] YAN C, MCCLEMENTS D J, ZOU L Q, et al. A stable high internal phase emulsion fabricated with OSA-modified starch: An improvement in β-carotene stability and bioaccessibility[J]. Food & Function,2019,10(9):5446−5460.
[22] BURGOS D C, WANDERSLEBEN T, OLIVOS M, et al. Food-grade Pickering stabilizers obtained from a protein-rich lupin cultivar (AluProt-CGNA®): Chemical characterization and emulsifying properties[J]. Food Hydrocolloids,2019,87:847−857. doi: 10.1016/j.foodhyd.2018.09.018
[23] 李星科. 壳聚糖的增稠、乳化性质及机制研究[D]. 无锡: 江南大学, 2011 LI Xingke. Study on the thickening and emulsifying properties and mechanism of chitosan [D]. Wuxi: Jiangnan University, 2011.
[24] STELLE K S. Lectures on supergravity p-branes[J]. Fortschritte Der Physik Progress of Physics,1997,50(10-11):1126−1172.
[25] JI Y, KANG W, MENG L, et al. Study of the solution behavior of β-cyclodextrin amphiphilic polymer inclusion complex and the stability of its O/W emulsion[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2014,453:117−124.
[26] ZHU Y Q, CHEN X, JULIAN D, et al. Pickering-stabilized emulsion gels fabricated from wheat protein nanoparticles: Effect of pH, NaCl and oil content[J]. Journal of Dispersion Science and Technology,2018,39(6):826−835. doi: 10.1080/01932691.2017.1398660
[27] FAN Z. Starch based Pickering emulsions: Fabrication, properties, and applications[J]. Trends in Food Science & Technology,2019,85:129−137.
[28] ZHU X F, ZHENG J, LIU F, et al. Freeze-thaw stability of Pickering emulsions stabilized by soy protein nanoparticles. Influence of ionic strength before or after emulsification[J]. Food Hydrocolloids,2018,74:37−45. doi: 10.1016/j.foodhyd.2017.07.017
[29] LIU C K, FAN L X, YANG Y Y, et al. Characterization of surimi particles stabilized novel Pickering emulsions: Effect of particles concentration, pH and NaCl levels[J]. Food Hydrocolloids,2021,117(23):106731.
[30] ZHU W, ZHENG F, SONG X, et al. Influence of formulation parameters on lipid oxidative stability of Pickering emulsion stabilized by hydrophobically modified starch particles[J]. Carbohydrate Polymers,2020,246:116649. doi: 10.1016/j.carbpol.2020.116649
[31] DAI L, SUN C A, WEI Y, et al. Characterization of Pickering emulsion gels stabilized by zein/gum arabic complex colloidal nanoparticles[J]. Food Hydrocolloids,2018,74:239−248. doi: 10.1016/j.foodhyd.2017.07.040
-
期刊类型引用(1)
1. 朱伟,程志翔,付昕媛. 磷酸酯双淀粉国内外标准比对研究. 实验室检测. 2024(02): 114-118 .  百度学术
百度学术
其他类型引用(4)








 下载:
下载:








 下载:
下载:



