Effect of Co-fermentation Technology with Lactic Acid Bacteria on the Quality of Cloudy Juice of Different Varieties of Red Jujube
-
摘要: 为提高红枣的营养价值及深加工利用潜力,以‘和田大枣’、‘延川狗头枣’、‘交城骏枣’、‘赞皇大枣’及‘宁阳大枣’五个代表性红枣品种为研究材料,利用嗜酸乳杆菌、植物乳杆菌及发酵乳杆菌的混合菌株进行乳酸发酵,探究混合菌株发酵对不同品种红枣浊汁品质的影响。结果表明:五个品种红枣汁皆是混合菌株发酵的良好基质,发酵结束活菌数皆超过6 lg CFU/mL。混合菌株发酵促进了酚类物质的转化,提高了咖啡酸、原儿茶酸及芦丁含量,发酵结束后含量分别达到了0.67~1.13、8.05~10.77及2.17~3.12 mg/mL。发酵后红枣汁抗氧化能力明显提高,DPPH自由基清除能力提高了38.2%~45.2%;FRAP铁力还原力提高了20.3%~60.6%。‘和田大枣’及‘赞皇大枣’枣汁中含有更高的总酚、葡萄糖、果糖及苹果酸,促进了乳酸菌的生长,其发酵汁具有较高的活菌数,分别达到了11.2及10.4 lg CFU/mL。此外两者发酵汁还具有较高的抗氧化能力及感官品质。研究结果可为红枣优良品种的筛选及应用提供理论指导。Abstract: With a view to improving the nutritional value and the potential for deep processing of jujube, five representative varieties of jujube were selected as research materials, namely 'Hetian jujube', 'Yanchuan Goutou jujube', 'Jiaocheng jujube', 'Zanhuang jujube' and 'Ningyang jujube'. Subsequently, to explore the impact of the mixed strains fermentation on the cloudy juice quality of the various varieties of jujube, fermentation with lactic acid was carried out with the mixed strains of Lactobacillus acidophilus, Lactobacillus plantarum, and Lactobacillus fermentus. The results indicated that the juice of five jujube cultivars was a good substrate for the fermentation of mixed strains, while the number of viable bacteria at the end of fermentation was more than 6 lg CFU/mL. The fermentation of mixed strains induced the transformation of the phenolic substances and enhanced the contents of caffeic acid, protocatechuic acid, and rutin, which reached 0.67~1.13, 8.05~10.77 and 2.17~3.12 mg/mL, respectively. The antioxidant capacity of the fermented jujube juice was significantly increased, and the DPPH was increased by 38.2%~45.2%, FRAP was increased by 20.3%~60.6%. The juice of 'Hetian jujube' and 'Zanhuang jujube' were found to have higher total phenols, glucose, fructose, and malic acid, which promoted the growth of lactic acid bacteria, while their fermented juice had higher viable bacteria count, which reached 11.2 and 10.4 lg CFU/mL, respectively. Moreover, the fermented jujube juice of 'Hotan jujube' and 'Zanghuang jujube' displayed higher antioxidant capacity and sensory quality. Additionally, the fermented juices of 'Hetian jujube' and 'Zanhuang jujube' also had higher antioxidant capacity and sensory quality. The results could provide theoretical guidance for the selection and application of the fine varieties of jujube.
-
红枣又名大枣、枣子,是鼠李科枣属植物,在我国栽培历史悠久,相关文献考证早在五千年前我国先民便有种植红枣的历史,红枣自古就被列为“五果”之一,是我国重要的经济果品[1]。相关研究表明早在2018年中国红枣产量就超过了15万吨,其种植面积及产量均位居世界第一[2],在世界红枣贸易中占据绝对地位。红枣贮藏期较短、贮藏稳定性较差,这些缺点对红枣的深加工利用造成阻碍[3]。目前为了解决红枣易腐特性,枣农及红枣加工业一般采用干制方式进行保存红枣,并且我国目前红枣的主要消费方式也是以干枣为主[4]。干枣富含各种活性成分如多糖、三萜酸、酚类和环核苷酸,具有广泛的生物功能活性,如抗氧化、抗炎和抗肿瘤以及保肝功能[5]。基于红枣重要的经济及营养价值,世界各国将其作为保健功能食品进行加工销售。因此,不断探索优良的干枣加工技术,丰富产品种类,对提高红枣的经济效益及保健效益具有重要意义。
乳酸菌(LAB)发酵可以提高各种食物的营养价值和可消化性,相关研究表明LAB能够产生淀粉酶、肽酶、蛋白酶、脱氢酶、脱羧酶及β-葡萄糖苷酶等活性酶,能够将初级底物转化为具有生物功能的活性物质[6]。Szutowska[7]研究表明益生菌产品可以降低血清中胆固醇水平,并且改善胃肠功能,增强人体免疫系统。目前乳制品是LAB发酵最常用和最成熟的基质,如制作酸奶和奶酪。然而随着乳糖不耐受、高胆固醇、乳蛋白过敏以及素食消费者的日益增加,单纯乳制品发酵难以满足消费需求[8]。大量研究表明水果中富含糖、矿物质、维生素、膳食纤维、酚类物质及抗坏血酸,可以促进乳酸菌菌株的生长[9]。Kwaw等[10]研究表明益生菌发酵果蔬汁可以丰富其风味、延长保质期,并且较发酵前产生了更多的活性成分。因此随着消费者对功能性食品的需求增加,丰富益生菌水果产品十分必要。
混浊红枣汁是一个复杂食物体系,含有果胶及蛋白等大分子胶体,与清汁相比,红枣浊汁含有更丰富的膳食纤维,口感更柔和,风味更浓,营养价值更高[11]。目前针对红枣乳酸菌发酵研究多集中于探究单一红枣品种清汁与单一发酵菌株的发酵过程,较少文献探究混合菌株发酵对不同品种红枣浊汁发酵特性及品质,特别是酚类物质含量及抗氧化能力的变化。因此本研究利用混合菌株对不同品种红枣进行乳酸发酵,探究混合菌株发酵对不同品种红枣浊汁品质的影响,为更好的选择优良品种,提高红枣深加工潜力提供理论支持。
1. 材料与方法
1.1 材料与仪器
红枣样品 本研究选取五个红枣代表性品种的完整干红枣:‘和田大枣’(HTZ)购自新疆和田、‘延川狗头枣’(GTZ)购自陕西延川、‘交城骏枣’(JCZ)购自山西交城、‘赞皇大枣’(ZHZ)购自河北赞皇及‘宁阳大枣’(NYZ)购自山东宁阳。所有干枣均由2021年全红成熟期红枣干制而成;MRS培养基 北京陆桥科技有限公司;氢氧化钠、碳酸钠、葡萄糖、福林酚试剂、亚铁氰化钾、乙腈、2,2-二苯基-1-吡啶并肼基(DPPH)及磷酸均为分析纯(纯度>97%) 四川西龙化学有限公司;没食子酸、原儿茶酸、绿原酸、咖啡酸、阿魏酸、表儿茶素、芦丁、槲皮素、酒石酸、苹果酸、乳酸、柠檬酸、葡萄糖、蔗糖、果糖及水溶性维生素E(Trolox)均为色谱纯(纯度>99.8%) 上海源叶生物技术有限公司;植物乳杆菌CICC20765(LP-20765)、嗜酸乳杆菌CICC22162(LA-22162)及发酵乳杆菌CICC22549(LF-22549) 中国工业菌种保藏中心。
CR-400型色差计 日本柯尼卡美能达有限公司;UV-mini1120型紫外-可见分光光度计 日本岛津公司;FE-28型pH计 上海梅特勒托利多科技(中国)有限公司;RA-600型可溶性固形物测定仪 上海可睦电子股份有限公司;LC-20A型高效液相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 枣汁制备及菌种接种发酵
干枣枣汁的制备参考Li等[2]的研究方法,干枣利用纯净水洗净后去核添加25%(w/v)的纯净水置于50 ℃条件下进行充分浸泡4 h,期间不断搅拌使果渣中营养成分充分溶于水中,浸泡结束后利用80目灭菌棉布进行过滤。发酵接种前,浑浊果汁在80 ℃下巴氏灭菌10 min,冷却到室温后接种。
菌种活化及接种参考Peng等[12]研究方法,将置于甘油管低温保存的LP-20765、LA-22162及LF-22549活化后,单独的培养物以1:1:1的比例接种到100 mL枣汁中,接种量为0.5%(v/v)并在37 ℃下培养36 h。未接种的对照组果汁在相同条件下培养,所有发酵组一式三份。
1.2.2 可溶性固形物、pH、总糖、总酸、总酚、浊度及色泽测定
果汁可溶性固形物、pH、总糖、总酸、总酚及浊度测定测定参考Li等[2]研究方法:果汁可溶性固形物含量测定使用手持型可溶性固形物测定仪进行测定;果汁pH利用pH计进行测定;果汁总糖含量测定采用3,5-二硝基水杨酸法;总酸含量利用滴定法进行测定;果汁总酚含量利用福林酚比色法进行测定;果汁浊度利用酶标仪进行测定;果汁色泽利用标准LAB色差计进行测定。
1.2.3 有机酸及可溶性糖含量测定
利用高效液相色谱法测定果汁有机酸及可溶性糖含量,样品制备:果汁离心(6000×g,10 min)后取上清液过0.45 µm PES亲水性滤膜注射至样品瓶中。液相条件参考Luciano等[13]的方法。有机酸色谱条件:利用Terra MS C18柱(250×4.6 mm,5μm)分离有机酸,进样量为10 μL,柱温为30 ℃,使用二极管阵列检测器在210 nm处测量吸光度,洗脱液流速为0.7 mL/min,流动相A为去离子水,流动相B为0.01 mol/L(NH4)3PO4,洗脱梯度为0~8 min,60%A;8~15 min,100%A。
可溶性糖色谱条件:利用Supelco柱(Supelcogel TMC-610H柱,30 cm×7.8 mm分离可溶性糖,进样量为10 μL,柱温保持在80 ℃,检测器为示差折光检测器,采用等浓度洗脱分离可溶性糖,洗脱流速为0.6 mL/min,洗脱缓冲液为85%乙腈水溶液。糖和有机酸的标准物通过峰保留时间进行确定,并通过峰面积进行量化。利用具有良好线性关系(R2>0.997)的校准曲线来定量糖和有机酸。
1.2.4 活菌数量测定
发酵过程中的活菌数通过用无菌生理盐水连续稀释至106~1010倍来确定[2]。将0.1 mL稀释液接种于MRS琼脂培养基上,后将平板在37 ℃下培养36 h后计数。乳酸菌活菌数记录为log CFU/mL。
1.2.5 单体酚类物质含量测定
利用高效液相色谱法测定果汁中单体酚类物质含量,果汁上样前处理方式与可溶性糖及有机酸方法一致。色谱条件:流动相A为1%(v/v)甲酸溶液,流动相B为乙腈。洗脱步骤:0~5 min,5%B;5~25 min,12% B;25~40 min,30%B;40~50 min,45%B;50~60 min,5%B。洗脱温度为30 ℃,流动相速率为1 mL/min,洗脱柱型号为C18柱(4.6 mm×250 mm),酚酸类物质检测波长为260 nm,黄酮物质检测波长为320 nm,果汁样品通过峰保留时间并使用外标法对结果进行定量分析。
1.2.6 抗氧化能力测定
以果汁DPPH自由基清除率及铁离子还原能力(Ferric ion reducing antioxidant power,FRAP)来衡量果汁抗氧化能力,具体测定步骤参考Li等[2]DPPH自由基清除率结果表示为DPPH自由基抑制的百分比(%),具体测定步骤为:1 mL样品加入2 mL DPPH甲醇溶液(45 mg/L)中。将混合物在黑暗中孵育30 min后,用紫外分光光度计在517 nm处测量吸光度。结果以DPPH自由基抑制百分比表示,见公式(1)。
(1) 式中:Ai为样品+DPPH溶液吸光度;Aj为样品+甲醇溶液吸光度;Ac为甲醇+DPPH溶液吸光度。
FRAP铁离子还原力具体测定步骤为:将1 L乙酸盐缓冲溶液(0.3 mol/L,pH3.6)、100 mL 2,3,5-氯化三苯基四氮唑和100 mL三氯化铁(0.02 mol/L)混合,并在37 ℃放置30 min以获得反应试剂,随后将0.2 mL样品和6 mL反应试剂混合,在37 ℃下反应30 min。利用紫外分光光度计在593 nm处读取吸光度,结果以Trolox当量表示(mmoL Trolox/L)。
1.2.7 感官评定
发酵果汁感官评定参考Peng等[12]的研究方法,感官评价小组由20名受过训练的从事果蔬加工科研人员组成(10名女性及10名男性)。将20 mL样品倒入玻璃杯中,随机品尝。在测试过程中,提供淡盐水进行漱口。消费者接受度测试打分使用9分量表:1、强烈不喜欢;2、非常不喜欢;3、适度不喜欢;4、稍微不喜欢;5、既不喜欢也不反感;6、略喜欢;7、适度喜欢;8、很喜欢;9、强烈的喜欢,对发酵果汁酸度、口感、香味、颜色、质地及总体接受度进行打分。
1.3 数据处理
数据结果以三个独立实验的平均值±标准差表示。使用SPSS20.0进行数据分析。利用邓肯氏检验分析,P<0.05表示差异有统计学意义。所得数据之间的相关性采用标准皮尔逊相关性分析。
2. 结果与分析
2.1 不同品种红枣汁理化指标分析
不同品种红枣汁理化性质如表1所示,品种对红枣汁pH、可溶性固形物、总糖、总酸、总酚、浊度、L*值、a*值及b*值具有明显影响。不同品种红枣汁pH处于4.53~5.66之间,和田大枣枣汁的pH最高,交城骏枣枣汁pH最低。研究表明发酵初期果汁pH影响其发酵特性,低pH发酵果汁会抑制乳酸菌生长[14],因此合适的pH对果汁发酵至关重要。五个品种可溶性固形物含量范围为11.1~15.57 °Brix之间,这也与Kou等[15]的研究结果一致,可溶性固形物主要由糖、酸、维生素、矿物质等组成,可为乳酸菌生长提供良好的碳源。五个品种红枣汁总酸含量范围为0.45~0.66 g/100 mL之间,赞皇大枣枣汁的总酸含量最高,和田大枣枣汁总酸含量最低。
表 1 不同品种红枣汁理化性质Table 1. Physicochemical properties of red jujube juice of different varieties品种 pH 可溶性固形物(°Brix) 总糖(g/100 mL) 总酸(g/100 mL) 总酚(g/L) 浊度 L* a* b* HTZ 5.66±0.04a 15.57±0.11a 11.67±0.14a 0.45±0.07c 2.67±0.04a 3.87±0.14a 41.88±0.47d 19.25±0.33a 51.67±0.63a GTZ 4.58±0.02c 12.14±0.03c 9.85±0.12c 0.55±0.08b 1.75±0.13d 2.85±0.11c 53.76±0.53b 17.55±0.23b 50.75±0.37a JCZ 4.53±0.14c 11.10±0.06d 8.18±0.07d 0.48±0.04c 1.88±0.07d 2.55±0.07d 55.67±0.34a 13.68±0.24d 38.18±0.39c ZHZ 5.12±0.02b 14.13±0.13b 10.75±0.03b 0.66±0.08a 2.55±0.13b 3.75±0.02a 42.85±0.52d 19.85±0.22a 39.85±0.52c NYZ 5.24±0.05b 12.10±0.03c 9.88±0.09c 0.55±0.02b 2.10±0.09c 2.87±0.07c 49.85±0.28c 16.87±0.09c 48.82±0.59b 注:同列肩标不同字母表示其具有显著性差异(P<0.05)。 相关研究表明红枣品种对其总酚含量具有显著影响[16],不同品种红枣汁总酚含量范围为1.75~2.67 g/L,和田大枣枣汁总酚含量最高,狗头枣枣汁总酚含量最低。相关研究表明酚类化合物参与果汁发酵,为发酵果汁提供香气来源,能够防止微生物腐败,并且控制发酵速率[17]。此外,它们还通过与蛋白质的相互作用进而控制胶体的稳定性。因此,适宜的酚类物质含量对果汁发酵过程感官品质的形成至关重要。浊度及色泽是发酵果汁的基本质量标准,不同红枣品种的浊度、L*值、a*值及b*值差异显著。其中和田大枣枣汁的浊度最高达到了3.87,交城骏枣枣汁的浊度最低为2.55。Tian等[18]研究表明浊度是果汁的稳定性指标,浊度越大果汁稳定性越好,因此和田大枣枣汁可能具有最高的果汁稳定性。
不同品种枣汁亮度值L*变化范围为41.88~55.67,红色值a*值变化范围为13.68~19.85,黄色值b*值变化范围为38.18~51.67。和田大枣枣汁具有较低的L*值及较高的b*值,这也通常表明其褐变程度较高。红枣果汁美拉德反应的进行通常伴随着浓郁枣风味的产生,因此和田大枣枣汁可能具有更为浓郁的枣香味。此外Ye等[17]研究表明果汁总酚含量与其褐变程度呈正相关关系,本研究在和田大枣枣汁中也得到了类似结论。综上品种对红枣汁理化性质具有明显影响,研究结果可为发酵产业筛选良好品种提供理论支持。
2.2 枣汁发酵前后可溶性糖含量分析
不同品种红枣汁发酵前后可溶性糖含量如表2所示,葡萄糖及果糖是红枣中最主要的可溶性糖,这也与牛林茹等[19]研究结果一致。不同品种红枣汁果糖及葡萄糖含量差异显著,其中果糖含量范围为41.58~65.66 mg/mL,葡萄糖含量范围为30.52~44.45 mg/mL,和田大枣枣汁中具有最高含量的果糖及葡萄糖,狗头枣的果糖及葡萄糖的含量最低。不同品种红枣汁发酵后其果糖及葡萄糖含量显著下降(P<0.05),其中果糖含量下降最为明显达到了15.3%~30.6%,葡萄糖含量下降了12.9%~16.9%,蔗糖含量变化较小。因此对于混合乳酸发酵红枣汁而言,果糖是微生物消耗最多的糖类物质,其次是葡萄糖。Pereira等[20]研究结果也证实了这一点。此外Hashemi等[21]在石榴汁的乳酸发酵研究中也得到了类似的结论,即果糖是乳酸菌代谢的主要糖类。此外研究中还观察到蔗糖含量略有降低,产生这一现象的主要原因可能为发酵过程产生的乳酸导致果汁pH的降低,这导致了蔗糖的轻微水解[12]。
表 2 不同品种红枣汁发酵前后可溶性糖含量变化(mg/mL)Table 2. Changes of soluble sugar content in different red jujube juice before and after fermentation (mg/mL)品种 果糖 葡萄糖 蔗糖 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 HTZ 65.66±0.54Aa 45.57±0.31Bb 44.45±0.37Aa 37.67±0.24Ba 1.67±0.04Ab 1.43±0.04Bb GTZ 41.58±0.62Ad 34.14±0.43Bc 30.52±0.48Ad 25.55±0.23Be 1.85±0.02Aa 1.35±0.02Bb JCZ 54.53±0.34Ac 46.10±0.36Bb 33.48±0.34Ac 27.88±0.17Bd 1.82±0.07Aa 1.80±0.03Aa ZHZ 60.12±0.42Ab 48.13±0.43Ba 40.63±0.38Ab 33.76±0.23Bb 0.86±0.03Ac 0.53±0.03Bd NYZ 53.24±0.35Ac 45.10±0.23Bb 34.55±0.42Ac 30.10±0.19Bc 0.88±0.08Ac 0.85±0.05Ac 注:表中小写字母代表不同品种枣汁之间存在显著性差异(P<0.05);不同大写字母表示同一品种发酵前后具有显著性差异(P<0.05);表3~表4、图1~图2同。 2.3 枣汁发酵前后有机酸含量分析
有机酸影响着果汁的口感、风味、色泽、稳定性及耐储性。不同品种红枣汁发酵前后有机酸含量变化如表3所示,共检测了红枣中的四种有机酸,其中苹果酸及酒石酸是红枣汁中最主要的有机酸,这与Li等[2]的研究结果一致。不同品种红枣汁中酒石酸含量范围为2.64~3.88 mg/mL,苹果酸含量范围为1.38~1.66 mg/mL,其中和田大枣枣汁酒石酸含量最高,赞皇大枣苹果酸含量最高。不同品种枣汁经混合乳酸菌发酵后其酒石酸、苹果酸及柠檬酸含量均有所下降,其中苹果酸含量下降最为明显(下降了27.7%~53.3%)。这与Chen等[22]的研究结果一致,即经乳酸菌发酵后果汁的苹果酸浓度显著降低,苹果酸是乳酸菌代谢的主要碳源。此外不同品种枣汁经发酵后其乳酸含量显著提高,主要原因为乳酸菌代谢促进了乳酸形成。和田大枣枣汁经发酵后其乳酸含量升高最为明显(升高了1.7 mg/mL),这也表明和田大枣枣汁能够更好的促进混合益生菌进行苹果酸-乳酸转化,能够减弱枣汁的酸度,使其更加柔和。此外发酵后枣汁酒石酸含量显著降低,这是由于乳酸菌代谢产生的酒石酸脱水酶,该酶可以将酒石酸转化为乳酸[2]。红枣汁经发酵后柠檬酸的含量也产生了明显的下降趋势,主要原因为柠檬酸被乳酸菌分解产生如双乙酰、乳酸等物质[23]。
表 3 不同品种红枣汁发酵前后有机酸含量变化(mg/mL)Table 3. Changes of organic acid content in different red jujube juice before and after fermentation (mg/mL)品种 柠檬酸 苹果酸 酒石酸 乳酸 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 HTZ 0.66±0.02Ac 0.37±0.11Bc 1.65±0.07Aa 0.77±0.04Bc 3.88±0.07Aa 3.25±0.03Bc 0.75±0.02Bb 2.45±0.03Aa GTZ 0.58±0.02Ad 0.34±0.03Bc 1.55±0.08Ab 1.12±0.03Ba 3.83±0.05Aa 3.72±0.03Ba 0.43±0.02Bc 1.85±0.02Ac JCZ 0.87±0.04Aa 0.60±0.06Ba 1.48±0.04Ac 1.05±0.03Bb 2.64±0.04Ac 2.18±0.04Be 0.83±0.03Ba 1.48±0.04Ae ZHZ 0.83±0.03Aa 0.43±0.13Bc 1.66±0.08Aa 1.19±0.03Ba 3.71±0.03Ab 2.35±0.03Bd 0.82±0.03Ba 1.98±0.03Ab NYZ 0.74±0.03Ab 0.60±0.03Ba 1.38±0.02Ad 0.91±0.09Ba 3.84±0.08Aa 3.17±0.03Bb 0.46±0.03Bc 1.67±0.03Ad 2.4 枣汁发酵后微生物数量分析
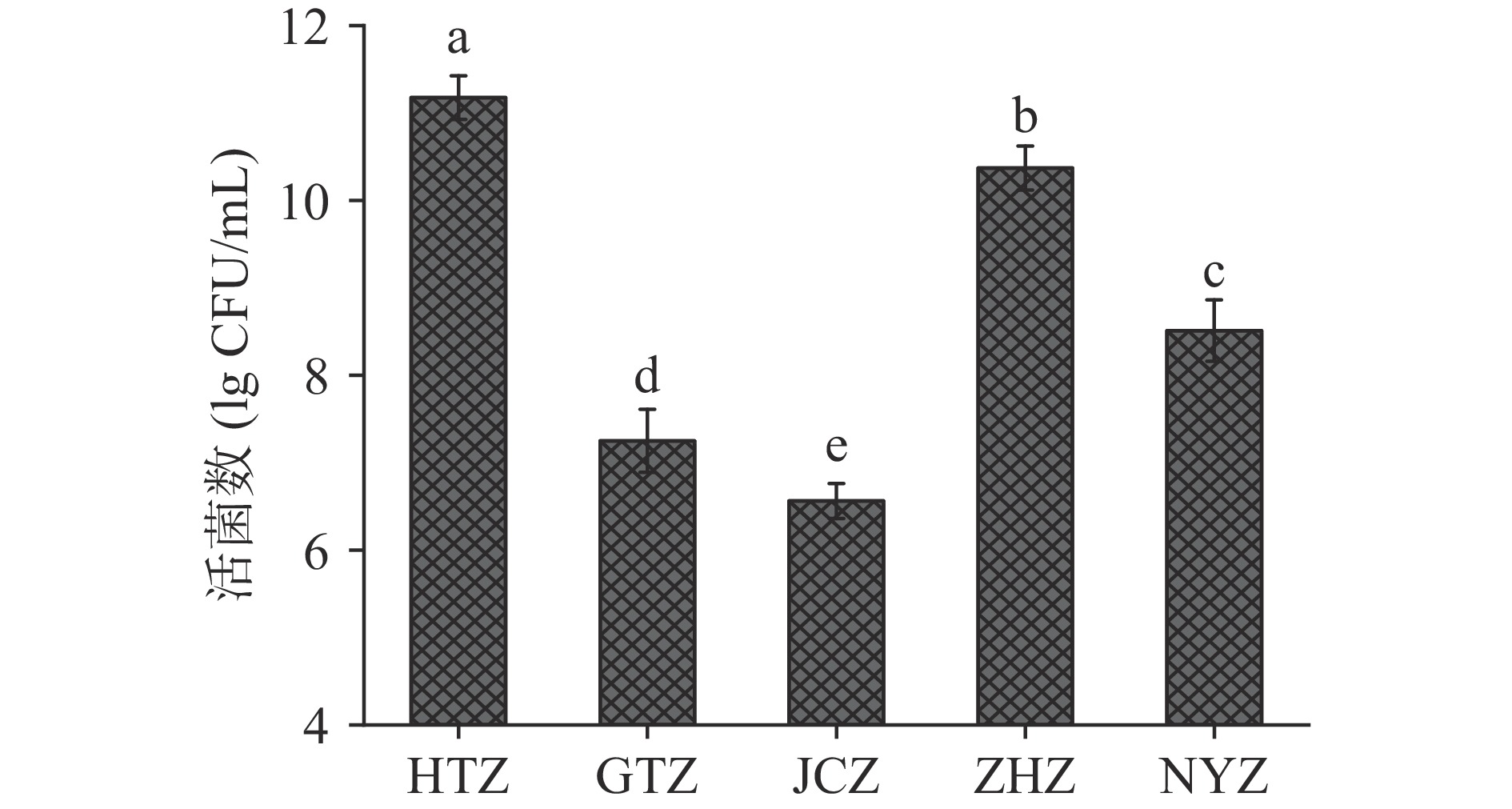
益生菌的生长对发酵至关重要,其生存能力与有机产品的质量及稳定性相关。不同品种红枣汁发酵结束后的活菌数如图1所示,并且各个品种发酵汁活菌数量具有显著性差异(P<0.05)。所有红枣品种的发酵汁中活菌数均高于1×106 CFU/mL,这表明红枣汁促进了益生菌的生长和代谢。其中和田大枣及赞皇大枣枣汁的活菌数量较高,活菌数量分别达到了11.2及10.4 lg CFU/mL),可能的原因为其可溶性糖类物质能够被很好的利用,此外也表明这两个品种有利于乳酸菌的生长。Li等[2]针对红枣的乳酸发酵微生物生长的研究也得到了类似的结果,即红枣汁是乳酸菌良好的生长基质。
2.5 枣汁发酵前后酚类物质含量分析
果汁中丰富的酚类物质不仅能够给予果汁良好的贮性,并且能够为人体提供良好的功能活性物质。不同品种枣汁发酵后酚类物质变化如表4所示,共检测了八种酚类物质,其中五种酚酸类物质(没食子酸、原儿茶酸、绿原酸、咖啡酸及阿魏酸)、三种黄酮类物质(表儿茶素、芦丁及槲皮素)。不同品种枣汁酚类物质含量差距较大,其中没食子酸、原儿茶酸及绿原酸是红枣汁中最主要的酚酸,芦丁是枣汁中最主要的类黄酮,这也与Li等[2]的研究结果一致。其中和田大枣及赞皇大枣枣汁中含有最高含量的没食子酸,分别达到了26.67及23.81 mg/L;和田大枣及宁阳大枣枣汁中含有最高含量的原儿茶酸,其含量分别达到了8.65及8.28 mg/L;赞皇大枣及狗头枣枣汁中含有最高含量的绿原酸,其含量分别达到了4.96及4.82 mg/L;赞皇大枣及和田大枣枣汁中含有最高含量的芦丁,其含量分别达到了2.29及2.19 mg/L。
表 4 不同品种红枣汁发酵前后酚类物质含量变化(mg/L)Table 4. Changes of phenolics content in different red jujube juice before and after fermentation (mg/L)品种 没食子酸 原儿茶酸 绿原酸 咖啡酸 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 HTZ 26.67±0.42Aa 20.37±0.11Ba 8.65±0.17Ba 10.77±0.08Aa 4.25±0.09Ab 3.55±0.19Ba 0.25±0.02Bb 1.05±0.04Ab GTZ 18.55±0.33Ad 16.33±0.21Bc 6.55±0.13Bd 8.12±0.14Ac 4.82±0.09Aa 3.16±0.19Bb 0.10±0.02Bc 1.13±0.06Aa JCZ 18.84±0.15Ad 15.61±0.09Bd 6.48±0.21Bd 8.05±0.12Ac 2.88±0.08Ad 2.11±0.11Bc 0.16±0.03Bc 0.88±0.05Ac ZHZ 23.81±0.23Ab 18.44±0.23Bb 7.66±0.12Bc 9.19±0.13Ab 4.96±0.13Aa 3.12±0.07Bb 0.18±0.02Bc 0.67±0.03Ad NYZ 20.72±0.19Ac 15.62±0.14Bd 8.28±0.16Bb 8.88±0.11Ab 3.84±0.09Ac 3.10±0.08Bb 0.33±0.01Ba 1.03±0.03Ab 品种 阿魏酸 表儿茶素 芦丁 槲皮素 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 HTZ 0.56±0.02Ab 0.55±0.01Ab 0.64±0.07Bb 0.72±0.04Ab 2.19±0.05Ba 3.12±0.03Aa 0.12±0.02Bb 0.40±0.02Aa GTZ 0.32±0.02Bc 0.42±0.02Ac 0.55±0.08Ab 0.55±0.03Ac 1.88±0.05Bc 2.44±0.08Ab 0.16±0.01Ba 0.22±0.01Ab JCZ 0.46±0.04Bb 0.53±0.03Ab 1.03±0.04Aa 0.62±0.03Bc 2.05±0.03Bb 2.24±0.06Ac 0.22±0.02Ba 0.48±0.02Aa ZHZ 0.75±0.03Aa 0.77±0.04Aa 1.12±0.08Aa 1.12±0.03Aa 2.29±0.05Ba 2.55±0.05Ab 0.18±0.01Aa 0.17±0.02Ab NYZ 0.49±0.03Ab 0.48±0.02Ac 0.33±0.02Bc 0.56±0.09Ac 1.79±0.04Bc 2.17±0.04Ac 0.19±0.02Aa 0.16±0.01Ab 乳酸发酵对不同品种红枣汁主要酚类物质含量具有明显影响,不同品种枣汁经发酵后其没食子酸及绿原酸含量呈现下降趋势,其原儿茶酸、咖啡酸及芦丁含量呈现升高趋势。Li等[2]研究结果表明,添加干酪乳杆菌的红枣汁发酵后芦丁含量明显提升;添加瑞士乳杆菌的红枣汁发酵后咖啡酸含量显著提升。本研究结果也表明了复合乳酸菌发酵红枣汁能够集合单一菌种发酵的优势。此外Filannino等[24]研究结果表明乳酸菌代谢产生的肉桂酰酯酶能够将绿原酸转化为咖啡酸,这可能是发酵过程绿原酸含量下降,咖啡酸含量升高的主要原因。相关研究表明乳酸菌菌株多样性能够使它们在不同环境下产生特定的代谢途径[25],这种途径造成了酚类物质的代谢及生成,这也是复合菌株发酵具有优势的主要原因[26]。此外和田大枣发酵后具有最高的没食子酸、原儿茶酸、绿原酸及芦丁含量,这表明其可能具有更高的抗氧化能力,具有更高的生物活性功能。综上,复合乳酸菌促进了枣汁中酚类物质的转化,这可能增强了其特定的某种活性功效。
2.6 枣汁发酵前后抗氧化能力及相关性分析
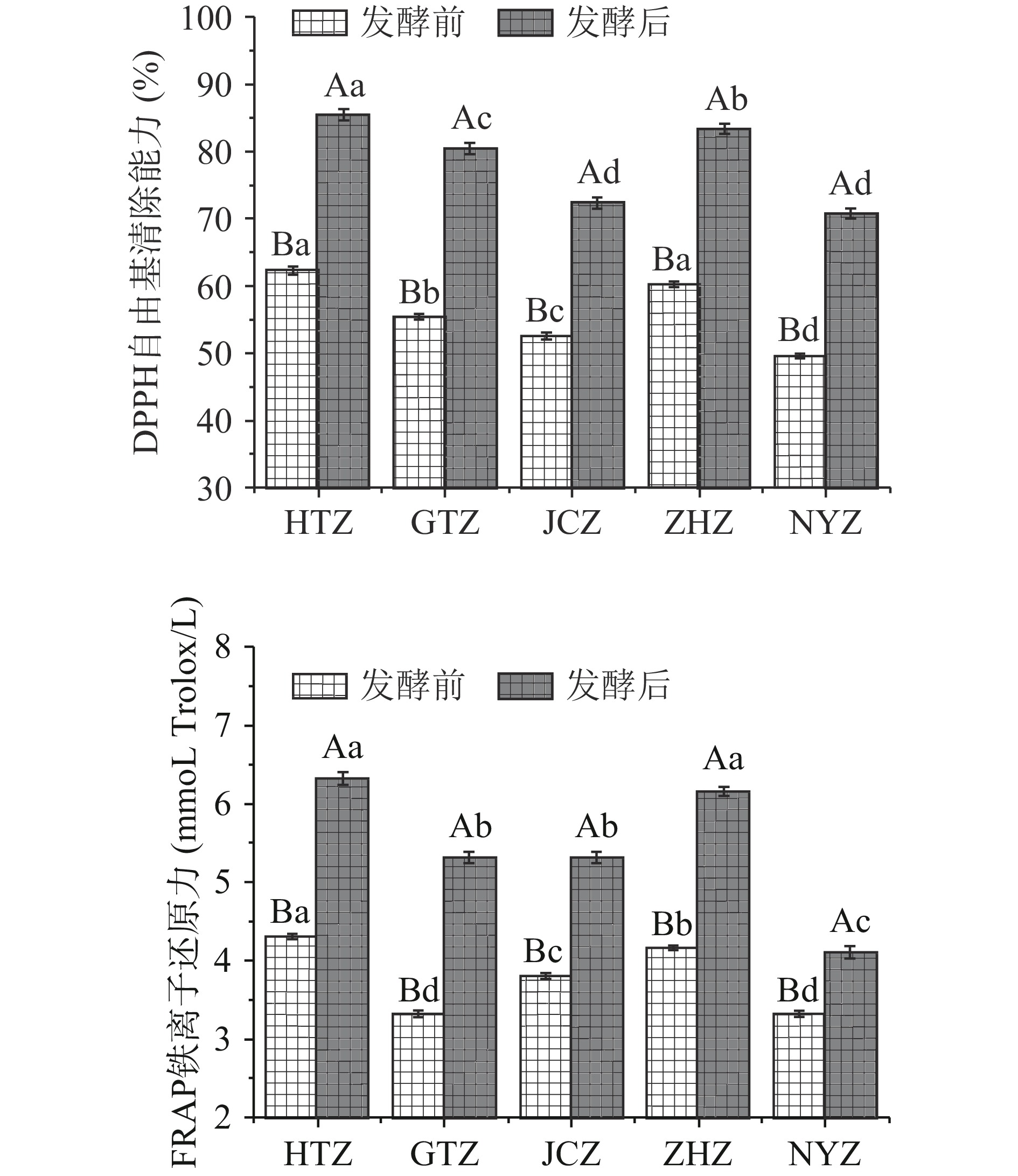
不同品种红枣汁发酵前后抗氧化能力的变化如图2所示,未发酵前和田大枣及赞皇大枣枣汁具有最高的DPPH自由基清除能力(分别为62.3%及60.2%)及最高的FRAP铁离子还原力(分别为4.3及4.15 mmol Trolox/L)。不同品种枣汁经发酵后其DPPH自由基清除能力及FRAP铁离子还原力显著增强(DPPH自由基清除能力增强了38.2%~45.2%;FRAP铁力还原力增强了20.3%~60.6%)。不同品种抗氧化能力提高程度具有明显差异,这与微生物代谢产生的抗氧化物质密切相关,即不同基质下微生物代谢各异[27]。相关研究表明乳酸菌发酵产物抗氧化能力的变化与发酵物酚类物质变化密切相关[28]。枣汁发酵后显示出高抗氧化活性可能由其酚类物质变化有关,酚类物质可以为高活性自由基提供氢原子,从而阻止自由基反应[29]。
枣汁酚类物质及抗氧化能力相关性分析如表5所示,DPPH自由基清除能力及铁离子还原力与咖啡酸及芦丁含量呈现极显著正相关(P<0.01);与绿原酸含量呈现显著负相关(P<0.05)。此外芦丁及咖啡酸含量与绿原酸含量呈现显著负相关(P<0.05)。这也证明了乳酸菌促进了枣汁中酚类物质的转化,提高了其抗氧化能力。
表 5 酚类物质及抗氧化能力相关性分析Table 5. Correlation coefficients of phenolic profiles and antioxidant activities指标 没食子酸 原儿茶酸 绿原酸 咖啡酸 阿魏酸 表儿茶素 芦丁 槲皮素 DPPH FRAP 没食子酸 1 原儿茶酸 −0.135 1 绿原酸 0.882** −0.192 1 咖啡酸 0.125 −0.276 −0.807* 1 阿魏酸 −0.325 0.101 −0.404* 0.368 1 表儿茶素 0.887** −0.320 0.921** 0.489 0.456 1 芦丁 −0.425* −0.02 −0.636* 0.226 0.432 0.456 1 槲皮素 −0.559* 0.245 0.256 −0.546* 0.558* 0.505* 0.455 1 DPPH −0.228 0.681* −0.435* 0.850** 0.186 −0.125 0.756** −0.505* 1 FRAP −0.389 0.553* −0.541* 0.854** 0.135 −0.265 0.805** −0.515* 0.889** 1 注:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)。 2.7 发酵后枣汁感官评定
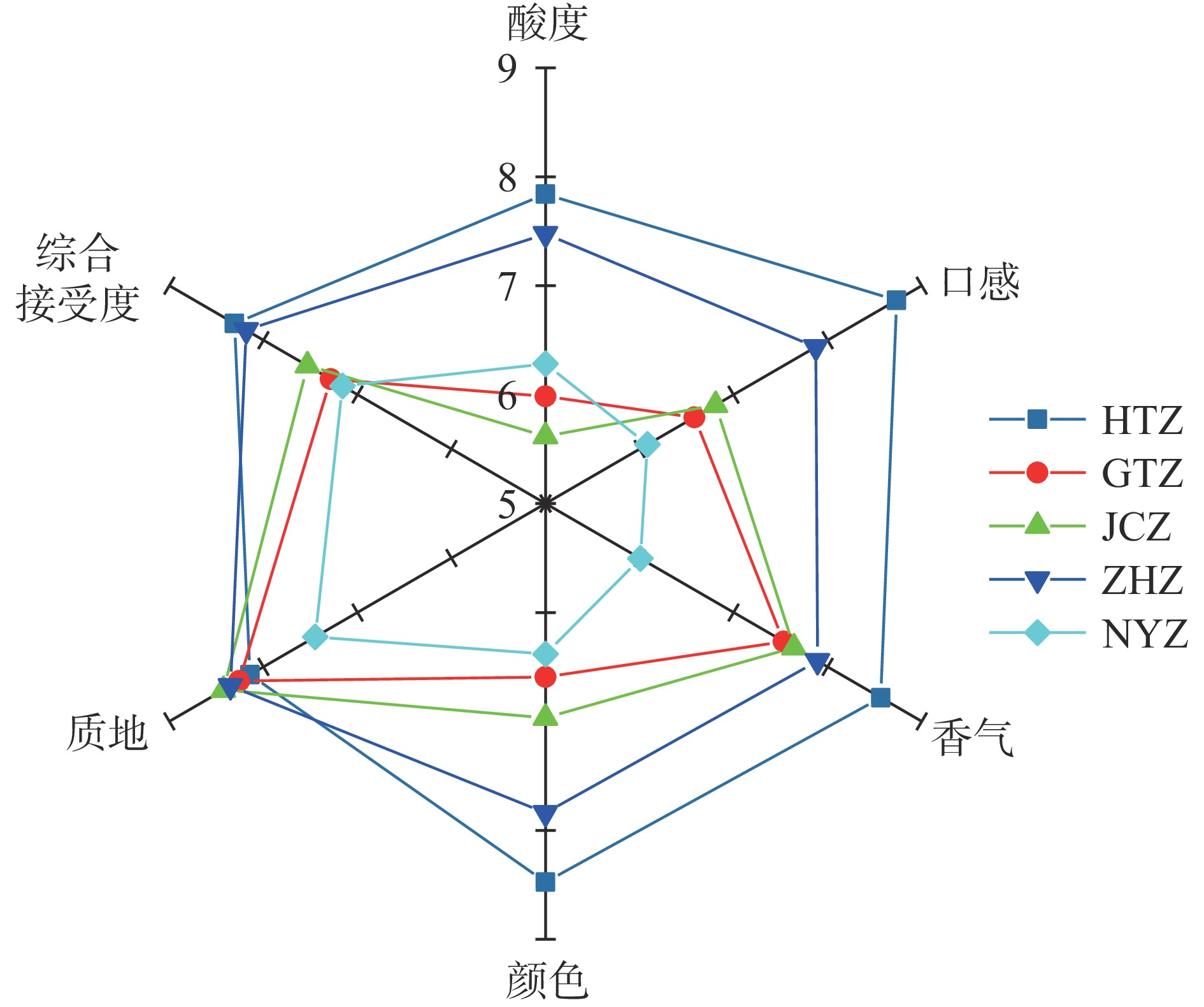
发酵后不同品种红枣汁的酸度、口感、香气、颜色、质地及综合接受度评分结果如图3所示,五个品种红枣发酵汁的综合接受度评分均大于6分,这表明混合乳酸发酵红枣汁感官品质较好,此外和田大枣发酵汁的酸度及口感得分最高,主要原因可能为其含有更高含量的可溶性糖及乳酸,其糖酸比更适宜。此外和田大枣还具有较高的香气及颜色评分,产生这一现象的主要原因可能为和田大枣含有更高含量的还原糖,更易发生美拉德反应,产生了浓郁的枣香味[30],基于此和田大枣枣汁最高的综合接受度评分。此外赞皇大枣发酵汁由于其香气、色泽、口感及酸度较为平衡,其综合接受度得分仅次于和田大枣发酵汁。综上,和田大枣及赞皇大枣发酵汁感官品质较好,综合接受度较高,是适宜乳酸发酵的良好品种。
3. 结论
本研究以混合菌株发酵五个品种红枣汁,探究了其理化性质、活菌数及感官品质,研究结果表明:五个品种枣汁都是混合菌株发酵的良好基质,发酵结束其活菌数都超过了6 lg CFU/mL,并且感官评定综合接受度评分皆大于6分。此外发酵过程中葡萄糖、果糖及苹果酸是混合菌株生长的主要碳源。乳酸发酵促进了酚类物质的转化,其咖啡酸、原儿茶酸及芦丁含量较发酵前显著升高。此外乳酸发酵增强了红枣汁的抗氧化能力。和田大枣及赞皇大枣枣汁经发酵后具有最高的活菌数量,分别达到了11.2及10.4 lg CFU/mL,并且其没食子酸、原儿茶酸、绿原酸及芦丁含量较高,具有较强的抗氧化能力,其DPPH自由基清除能力分别达到了62.3%及60.2%;FRAP铁离子还原力分别达到了4.3及4.15 mmol Trolox/L。此外这两种发酵枣汁还具有较高的综合接受度评分,其感官品质较优。因此和田大枣及赞皇大枣可能是乳酸发酵较为合适的红枣品种,这有助于提高红枣乳酸发酵产品品质,提高其附加值。此外由于我国红枣产区及品种众多,研究只针对我国五大产区的五种代表性红枣品种进行研究,因此后续更为全面的了解各产区红枣品种的乳酸发酵特性对十分必要。本文研究结果为提高红枣汁营养价值,筛选优良红枣加工品种提供理论依据。
-
表 1 不同品种红枣汁理化性质
Table 1 Physicochemical properties of red jujube juice of different varieties
品种 pH 可溶性固形物(°Brix) 总糖(g/100 mL) 总酸(g/100 mL) 总酚(g/L) 浊度 L* a* b* HTZ 5.66±0.04a 15.57±0.11a 11.67±0.14a 0.45±0.07c 2.67±0.04a 3.87±0.14a 41.88±0.47d 19.25±0.33a 51.67±0.63a GTZ 4.58±0.02c 12.14±0.03c 9.85±0.12c 0.55±0.08b 1.75±0.13d 2.85±0.11c 53.76±0.53b 17.55±0.23b 50.75±0.37a JCZ 4.53±0.14c 11.10±0.06d 8.18±0.07d 0.48±0.04c 1.88±0.07d 2.55±0.07d 55.67±0.34a 13.68±0.24d 38.18±0.39c ZHZ 5.12±0.02b 14.13±0.13b 10.75±0.03b 0.66±0.08a 2.55±0.13b 3.75±0.02a 42.85±0.52d 19.85±0.22a 39.85±0.52c NYZ 5.24±0.05b 12.10±0.03c 9.88±0.09c 0.55±0.02b 2.10±0.09c 2.87±0.07c 49.85±0.28c 16.87±0.09c 48.82±0.59b 注:同列肩标不同字母表示其具有显著性差异(P<0.05)。 表 2 不同品种红枣汁发酵前后可溶性糖含量变化(mg/mL)
Table 2 Changes of soluble sugar content in different red jujube juice before and after fermentation (mg/mL)
品种 果糖 葡萄糖 蔗糖 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 HTZ 65.66±0.54Aa 45.57±0.31Bb 44.45±0.37Aa 37.67±0.24Ba 1.67±0.04Ab 1.43±0.04Bb GTZ 41.58±0.62Ad 34.14±0.43Bc 30.52±0.48Ad 25.55±0.23Be 1.85±0.02Aa 1.35±0.02Bb JCZ 54.53±0.34Ac 46.10±0.36Bb 33.48±0.34Ac 27.88±0.17Bd 1.82±0.07Aa 1.80±0.03Aa ZHZ 60.12±0.42Ab 48.13±0.43Ba 40.63±0.38Ab 33.76±0.23Bb 0.86±0.03Ac 0.53±0.03Bd NYZ 53.24±0.35Ac 45.10±0.23Bb 34.55±0.42Ac 30.10±0.19Bc 0.88±0.08Ac 0.85±0.05Ac 注:表中小写字母代表不同品种枣汁之间存在显著性差异(P<0.05);不同大写字母表示同一品种发酵前后具有显著性差异(P<0.05);表3~表4、图1~图2同。 表 3 不同品种红枣汁发酵前后有机酸含量变化(mg/mL)
Table 3 Changes of organic acid content in different red jujube juice before and after fermentation (mg/mL)
品种 柠檬酸 苹果酸 酒石酸 乳酸 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 HTZ 0.66±0.02Ac 0.37±0.11Bc 1.65±0.07Aa 0.77±0.04Bc 3.88±0.07Aa 3.25±0.03Bc 0.75±0.02Bb 2.45±0.03Aa GTZ 0.58±0.02Ad 0.34±0.03Bc 1.55±0.08Ab 1.12±0.03Ba 3.83±0.05Aa 3.72±0.03Ba 0.43±0.02Bc 1.85±0.02Ac JCZ 0.87±0.04Aa 0.60±0.06Ba 1.48±0.04Ac 1.05±0.03Bb 2.64±0.04Ac 2.18±0.04Be 0.83±0.03Ba 1.48±0.04Ae ZHZ 0.83±0.03Aa 0.43±0.13Bc 1.66±0.08Aa 1.19±0.03Ba 3.71±0.03Ab 2.35±0.03Bd 0.82±0.03Ba 1.98±0.03Ab NYZ 0.74±0.03Ab 0.60±0.03Ba 1.38±0.02Ad 0.91±0.09Ba 3.84±0.08Aa 3.17±0.03Bb 0.46±0.03Bc 1.67±0.03Ad 表 4 不同品种红枣汁发酵前后酚类物质含量变化(mg/L)
Table 4 Changes of phenolics content in different red jujube juice before and after fermentation (mg/L)
品种 没食子酸 原儿茶酸 绿原酸 咖啡酸 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 HTZ 26.67±0.42Aa 20.37±0.11Ba 8.65±0.17Ba 10.77±0.08Aa 4.25±0.09Ab 3.55±0.19Ba 0.25±0.02Bb 1.05±0.04Ab GTZ 18.55±0.33Ad 16.33±0.21Bc 6.55±0.13Bd 8.12±0.14Ac 4.82±0.09Aa 3.16±0.19Bb 0.10±0.02Bc 1.13±0.06Aa JCZ 18.84±0.15Ad 15.61±0.09Bd 6.48±0.21Bd 8.05±0.12Ac 2.88±0.08Ad 2.11±0.11Bc 0.16±0.03Bc 0.88±0.05Ac ZHZ 23.81±0.23Ab 18.44±0.23Bb 7.66±0.12Bc 9.19±0.13Ab 4.96±0.13Aa 3.12±0.07Bb 0.18±0.02Bc 0.67±0.03Ad NYZ 20.72±0.19Ac 15.62±0.14Bd 8.28±0.16Bb 8.88±0.11Ab 3.84±0.09Ac 3.10±0.08Bb 0.33±0.01Ba 1.03±0.03Ab 品种 阿魏酸 表儿茶素 芦丁 槲皮素 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 发酵前 发酵后 HTZ 0.56±0.02Ab 0.55±0.01Ab 0.64±0.07Bb 0.72±0.04Ab 2.19±0.05Ba 3.12±0.03Aa 0.12±0.02Bb 0.40±0.02Aa GTZ 0.32±0.02Bc 0.42±0.02Ac 0.55±0.08Ab 0.55±0.03Ac 1.88±0.05Bc 2.44±0.08Ab 0.16±0.01Ba 0.22±0.01Ab JCZ 0.46±0.04Bb 0.53±0.03Ab 1.03±0.04Aa 0.62±0.03Bc 2.05±0.03Bb 2.24±0.06Ac 0.22±0.02Ba 0.48±0.02Aa ZHZ 0.75±0.03Aa 0.77±0.04Aa 1.12±0.08Aa 1.12±0.03Aa 2.29±0.05Ba 2.55±0.05Ab 0.18±0.01Aa 0.17±0.02Ab NYZ 0.49±0.03Ab 0.48±0.02Ac 0.33±0.02Bc 0.56±0.09Ac 1.79±0.04Bc 2.17±0.04Ac 0.19±0.02Aa 0.16±0.01Ab 表 5 酚类物质及抗氧化能力相关性分析
Table 5 Correlation coefficients of phenolic profiles and antioxidant activities
指标 没食子酸 原儿茶酸 绿原酸 咖啡酸 阿魏酸 表儿茶素 芦丁 槲皮素 DPPH FRAP 没食子酸 1 原儿茶酸 −0.135 1 绿原酸 0.882** −0.192 1 咖啡酸 0.125 −0.276 −0.807* 1 阿魏酸 −0.325 0.101 −0.404* 0.368 1 表儿茶素 0.887** −0.320 0.921** 0.489 0.456 1 芦丁 −0.425* −0.02 −0.636* 0.226 0.432 0.456 1 槲皮素 −0.559* 0.245 0.256 −0.546* 0.558* 0.505* 0.455 1 DPPH −0.228 0.681* −0.435* 0.850** 0.186 −0.125 0.756** −0.505* 1 FRAP −0.389 0.553* −0.541* 0.854** 0.135 −0.265 0.805** −0.515* 0.889** 1 注:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)。 -
[1] 齐习超, 吴现华, 刘静, 等. 红枣酒发酵工艺、品质影响及香气成分研究进展[J]. 中国酿造,2022,41(2):19−22. [QI X C, WU X H, LIU J, et al. Research progress on fermentation technology, quality influence and aroma components of jujube wine[J]. China Brewing,2022,41(2):19−22. QI X C, WU X H, LIU J, et al. Research progress on fermentation technology, quality influence and aroma components of jujube wine[J]. China Brewing, 2022, 41(2): 19-22.
[2] LI T, JIANG T, LIU N, et al. Biotransformation of phenolic profiles and improvement of antioxidant capacities in jujube juice by select lactic acid bacteria[J]. Food Chemistry,2020,339:127859.
[3] 王庆卫, 刘启玲, 崔胜文. 不同干燥方式对红枣营养品质及抗氧化活性的影响[J]. 食品工业,2020,41(12):218−222. [WANG Q W, LIU Q L, CUI S W. The effect of different drying methods on the nutritional quality and antioxidant activity of jujube[J]. Food Industry,2020,41(12):218−222. WANG Q W, LIU Q L, CUI S W. The effect of different drying methods on the nutritional quality and antioxidant activity of jujube[J]. Food Industry, 2020, 41(12): 218-222.
[4] SHI Q, HAN G, LIU Y, et al. Nutrient composition and quality traits of dried jujube fruits in seven producing areas based on metabolomics analysis[J]. Food Chemistry,2022,385:132627. doi: 10.1016/j.foodchem.2022.132627
[5] SHI Q, LI X, ZHU D, et al. Comprehensive analysis of antibacterial and anti-hepatoma activity of metabolites from jujube fruit[J]. Food Bioscience,2022,47:101511. doi: 10.1016/j.fbio.2021.101511
[6] HUR S J, LEE S Y, KIM Y, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chemistry,2014,160:346−356. doi: 10.1016/j.foodchem.2014.03.112
[7] SZUTOWSKA J. Functional properties of lactic acid bacteria in fermented fruit and vegetable juices: A systematic literature review[J]. European Food Research and Technology,2020,246:357−372. doi: 10.1007/s00217-019-03425-7
[8] CHINTHA P, SARKAR D, PECOTA K, et al. Improving phenolic bioactive-linked functional qualities of sweet potatoes using beneficial lactic acid bacteria-based biotransformation strategy[J]. Scientia Horticulturae,2021,7(10):367. doi: 10.3390/horticulturae7100367
[9] WANG K, QI J, JIN Y, et al. Influence of fruit maturity and lactic fermentation on physicochemical properties, phenolics, volatiles, and sensory of mulberry juice[J]. Food Bioscience,2022,48:101782. doi: 10.1016/j.fbio.2022.101782
[10] KWAW E, MA Y, TCHABO W, et al. Impact of ultrasonication and pulsed light treatments on phenolics concentration and antioxidant activities of lactic-acid-fermented mulberry juice[J]. Food Science and Technology,2018,92:61−66.
[11] ZHANG L, ZHA M, LI S, et al. Investigation on the effect of thermal sterilization versus non-thermal sterilization on the quality parameters of jujube juice fermented by Lactobacillus plantarum[J]. Journal of Food Science and Technology,2022,59:3765−3774. doi: 10.1007/s13197-022-05358-8
[12] PENG W, MENG D, YUE T, et al. Effect of the apple cultivar on cloudy apple juice fermented by a mixture of Lactobacillus acidophilus, Lactobacillus plantarum, and Lactobacillus fermentum[J]. Food Chemistry,2021,340:127922. doi: 10.1016/j.foodchem.2020.127922
[13] LUCIANO W A, MATTE T C, PORTELA I A, et al. Effects of Lactobacillus acidophilus LA-3 on physicochemical and sensory parameters of açaí and mango based smoothies and its survival following simulated gastrointestinal conditions[J]. Food Research International,2018,114:159−168. doi: 10.1016/j.foodres.2018.08.005
[14] DIMITROVSKI D, VELICKOVA E, LANGERHOLC T, et al. Apple juice as a medium for fermentation by the probiotic Lactobacillus plantarum PCS 26 strain[J]. Annals of Microbiology,2015,65(4):2161−2170. doi: 10.1007/s13213-015-1056-7
[15] KOU X, CHEN Q, LI X, et al. Quantitative assessment of bioactive compounds and the antioxidant activity of 15 jujube cultivars[J]. Food Chemistry,2015,173:1037−1044. doi: 10.1016/j.foodchem.2014.10.110
[16] SONG Y, CHEN C, WANG F, et al. Physicochemical properties and antioxidant activities of jujubes (Ziziphus jujuba Mill.): Effect of blackening process on different cultivars[J]. International Journal of Food Properties,2022,25(1):1576−1590. doi: 10.1080/10942912.2022.2093361
[17] YE M, YUE T, YUAN Y. Changes in the profile of volatile compounds and amino acids during cider fermentation using dessert variety of apples[J]. European Food Research and Technology,2014,239(1):67−77. doi: 10.1007/s00217-014-2204-1
[18] TIAN You, SUN Lijun, YANG Yali, et al. Changes in the physicochemical properties, aromas and polyphenols of not from concentrate (NFC) apple juice during production[J]. CyTA-Journal of Food,2018,16(1):755−764. doi: 10.1080/19476337.2018.1471102
[19] 牛林茹, 李涛, 冯俊敏, 等. 7种大品类红枣中可溶性糖含量及组成成分分析[J]. 山西农业科学,2015,43(1):4. [NIU L R, LI T, FENG J M, et al. The analysis of soluble sugar content and composition of 7 major categories kinds of Jujube[J]. Journal of Shanxi Agricultural Sciences,2015,43(1):4. NIU L R, LI T, FENG J M, et al. The analysis of soluble sugar content and composition of 7 major categories kinds of Jujube[J]. Journal of Shanxi Agricultural Sciences, 2015, 43(1): 4.
[20] PEREIRA A L F, FEITOSA W S C, ABREU V K G, et al. Impact of fermentation conditions on the quality and sensory properties of a probiotic cupuassu (Theobroma grandiflorum) beverage[J]. Food Research International,2017,100(1):603−611.
[21] HASHEMI S M B, MOUSAVI KHANEGHAH A, BARBA F J, et al. Fermented sweet lemon juice (Citrus limetta) using Lactobacillus plantarum LS5: Chemical composition, antioxidant and antibacterial activities[J]. Journal of Functional Foods,2017,38:409−414. doi: 10.1016/j.jff.2017.09.040
[22] CHEN C, LU Y, YU H, et al. Influence of 4 lactic acid bacteria on the flavor profile of fermented apple juice[J]. Food Bioscience,2019,27:30−36. doi: 10.1016/j.fbio.2018.11.006
[23] WANG Y, TAO Y, ZHANG X, et al. Metabolic profile of ginkgo kernel juice fermented with lactic aicd bacteria: A potential way to degrade ginkgolic acids and enrich terpene lactones and phenolics[J]. Process Biochemistry,2019,76:25−33. doi: 10.1016/j.procbio.2018.11.006
[24] FILANNINO P, DI CAGNO R, GOBBETTI M. Metabolic and functional paths of lactic acid bacteria in plant foods: Get out of the labyrinth[J]. Current Opinion in Biotechnology,2018,49:64−72. doi: 10.1016/j.copbio.2017.07.016
[25] RICCI A, CIRLINI M, MAOLONI A, et al. Use of dairy and plant-derived Lactobacilli as starters for cherry juice fermentation[J]. Nutrients,2019,11(2):213. doi: 10.3390/nu11020213
[26] LI Z, TENG J, LYU Y, et al. Enhanced antioxidant activity for apple juice fermented with Lactobacillus plantarum ATCC14917[J]. Molecules,2018,24(1):51. doi: 10.3390/molecules24010051
[27] WU C, LI T, QI J, et al. Effects of lactic acid fermentation-based biotransformation on phenolic profiles, antioxidant capacity and flavor volatiles of apple juice[J]. LWT,2020,122:109064. doi: 10.1016/j.lwt.2020.109064
[28] DE SOUZA E L, DE ALBUQUERQUE T M R, DOS SANTOS A S, et al. Potential interactions among phenolic compounds and probiotics for mutual boosting of their health-promoting properties and food functionalities-A review[J]. Critical Reviews in Food Science and Nutrition,2019,59(10):1645−1659. doi: 10.1080/10408398.2018.1425285
[29] VERON H E, CANO P G, FABERSANI E, et al. Cactus pear (Opuntia ficus-indica) juice fermented with autochthonous Lactobacillus plantarum S-811[J]. Food & Function,2019,10(2):1085−1097.
[30] MARKKINEN N, LAAKSONEN O, NAHKU R, et al. Impact of lactic acid fermentation on acids, sugars, and phenolic compounds in black chokeberry and sea buckthorn juices[J]. Food Chemistry,2019,286:204−215. doi: 10.1016/j.foodchem.2019.01.189
-
期刊类型引用(1)
1. 杜晓仪,杨继国,徐玉娟,吴继军,余元善,邹波,彭健,李璐. 不同益生菌对三华李发酵果汁品质及其体外消化特性的影响. 食品工业科技. 2024(02): 143-151 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:
 下载:
下载:



