Structural Characterization of Mango Core-shell Cellulose Nanofibers and Properties Analysis of Stable Pickering Emulsion
-
摘要: 在本研究中,以芒果核壳为原料,经过次氯酸漂白、碱化处理、TEMPO氧化和高压均质处理后,成功制备了丝状的芒果核壳纤维素纳米纤维(CNFs),并考察了pH和离子强度对乳液稳定性的影响。结果表明,由TEMPO氧化和高压均质法制备的芒果核壳CNFs保持了纤维素的基本结构,部分羟基被氧化成羧基,纤维素晶型为I型纤维素,结晶度降低至57%,对温度更加敏感,但仍保持较高的热稳定性。芒果核壳CNFs稳定的Pickering乳液的粒径随着pH升高而显著减小,在pH11的条件下粒径最小,为469.5 nm,粒径分布也更均匀,30 d的CI为58.8%,表现出较好的稳定性。离子强度对芒果核壳CNFs Pickering乳液的稳定性有较大影响,在50~100 mmol/L的离子强度条件下,由于大量带正电的钠离子会聚集在CNFs表面并中和其表面的负电荷,使得液滴间的静电斥力减弱,液滴更易聚集,不利于乳液的稳定。综上,芒果核壳CNFs可以作为优异的固体颗粒应用于Pickering乳液,为芒果核的高价值利用提供了新的思路。
-
关键词:
- 芒果核壳 /
- 纤维素纳米纤维 /
- 结构表征 /
- Pickering乳液 /
- 环境稳定性
Abstract: In this study, mango core-shell cellulose nanofibers (CNFs) were prepared successfully after hypochlorite bleaching, alkalization TEMPO oxidation and high pressure homogenization. The effects of pH and ionic strength on emulsion stability were also investigated. The results showed that the mango core-shell CNFs prepared by TEMPO oxidation and high pressure homogenization method maintained the basic structure of cellulose, and some hydroxyl groups were oxidized to carboxyl group. The cellulose crystallinity was reduced to 57%, which was more sensitive to temperature, but still maintained high thermal stability. The particle size of Pickering emulsion stabilized by mango core-shell CNFs decreased significantly with the increase of pH. The smallest particle size was 469.5 nm at pH11, and the particle size distribution was more uniform. The 30 day CI was 58.8%, showing good stability. The ionic strength had a great influence on the stability of mango core-shell CNFs Pickering emulsion. Under the ionic strength of 50~100 mmol/L, a large number of positively charged sodium ions aggregated on the surface of CNFs and neutralize the negative charge on the surface, which weakened the electrostatic repulsion between droplets and makes droplets more likely to aggregate, which was not conductive to the stability of the emulsion. In summary, the mango core-shell CNFs could be used as excellent solid particles in Pickering emulsion, which would provide a new for the high value utilization of mango core-shell. -
Pickering乳液是以固体颗粒代替传统的表面活性剂作稳定剂的乳液[1],因其高物理稳定性受到国内外的广泛关注。目前用于稳定Pickering乳液的固体颗粒主要是一些无机颗粒或生物质来源的颗粒,如:淀粉、蛋白质、壳聚糖和纤维素等[2]。纤维素因其来源广泛、具备良好的热稳定性和易于改性等优点而成为优异的固体颗粒来源[3]。影响Pickering乳液稳定性的因素有很多,主要包括固体颗粒的湿润性、颗粒浓度、电位和粒径大小等,其中的关键因素是固体颗粒的湿润性[4]。由于天然的纤维素含有大量羟基,导致其湿润性较差,通常被认为无法稳定Pickering乳液,通过一定的物理和化学法处理,如:酸水解、高压均质法、酶解法或它们的组合法等,可以获得湿润性更好的纳米纤维素。在此过程中纤维素除了尺寸发生变化,也会形成具有两亲性的分子链,有助于吸附到油水界面形成稳定的Pickering乳液[5]。大量的研究也证实,纤维素的原始来源、提取方法和预处理过程的不同可以调节所获得的纳米纤维素性质[6]。
纳米纤维素主要分为三类:纳米纤维素晶(CNCs)、纤维素纳米纤维(CNFs)和细菌纳米纤维素(BNC)[7]。CNFs一般可通过高压均质、球磨、高速剪切等机械法制备,为了节约能源和避免机器的堵塞需要对原料进行预处理。常用的TEMPO氧化法可以将纤维素C6伯羟基区域选择性氧化为羧基,增强其两亲性,有利于形成稳定性更好的乳液[8],因此通过TEMPO氧化和高压均质法制备的CNFs作为乳化剂在稳定Pickering和各种食物脂肪中具备很大潜力[9]。
近年来,由于对可持续的“清洁标签”食品需求的不断增加,各种低附加值的生物资源已经被用于纳米纤维素的生产,如:甘蔗渣[10]、菠萝皮[11]、香蕉皮[12]等。来源于植物或其他食品加工副产物的天然纤维素比其他来源的纤维素具有更高的安全性,更容易运用于食品工业,因此开发这些资源已成为一项很有潜力的经济战略[13]。然而大多数提取出来的纳米纤维素虽然可以稳定Pickering乳液,但其贮藏稳定性较差,往往需要进行复杂的化学改性才能获得性能更优异的纳米纤维素,限制了其在食品领域的进一步应用[14],因此,采用更加绿色的提取方法,从新的植物原料中提取性能更加优异的纳米纤维素成为新的研究方向[15]。
芒果是我国四大热带水果之一,因其色泽诱人、口感宜人、含有较高浓度的类胡萝卜素、抗坏血酸和植物化学物质而受到广大消费者的喜爱[16]。由于消费者对芒果需求量的逐年增加,我国的芒果产量也保持高速发展,在2020年达到了330.6万吨。芒果核约占芒果总量的20%[17],常常被直接丢弃、作为燃料或者掩埋处理,不仅浪费资源,还造成了一定的环境污染问题,因此将其加工利用起来具有重要意义。
目前对于芒果核的研究主要集中于从核仁中提取优质植物油,而芒果核壳则是被丢弃或掩埋。芒果核壳约占芒果核的30%~35%,其中纤维素的含量约为39%,是提取纳米纤维素的良好来源[18]。但是,对于从芒果核壳中提取纳米纤维素用于稳定Pickering乳液的应用研究还鲜有报道,因此本研究通过较为绿色的TEMPO氧化法,从芒果核壳中提取制备CNFs,用于稳定Pickering乳液,考察pH和离子强度对其稳定性能的影响,探讨芒果核壳CNFs在Pickering乳液中应用的潜能,同时对芒果核壳的加工利用提供一定的理论指导。
1. 材料与方法
1.1 材料与仪器
小台芒 购自本地超市(湛江);大豆油(食品级) 益海(广州)粮油工业有限公司;TEMPO、溴化钠、次氯酸钠 上海阿拉丁生化科技股份有限公司;氢氧化钠、乙酸、无水乙醇、亚氯酸钠 中国上海麦克林生化科技有限公司;上述试剂均为分析纯。
ATS/AMF-5型微射流高压均质机 安托思纳米技术(苏州)有限公司;Zetasizer Pro纳米粒度分析仪、ZETA电位分析仪 英国马尔文仪器有限公司;T18高速剪切机 美国IKA公司;Thermo Nicolet iN10傅里叶红外光谱仪(FTIR) 美国赛默飞公司;PHS-2F上海雷磁pH计 上海仪电科学仪器股份有限公司;D2 PHASER X-ray衍射仪 德国布鲁克AXS有限公司;JEM-1000透射电镜 日本电子株式会社;Leica DMI600B倒置显微镜 德国Leica公司。
1.2 实验方法
1.2.1 芒果核壳纤维素和纳米纤维素(CNFs)的制备
1.2.1.1 芒果核壳纤维素的提取
参考沈小倩等[19]的方法并稍做修改。将新鲜的芒果去除果肉和核仁,留下芒果核壳。将芒果核壳粉碎后,与无水乙醇按照料液比1:10进行混合,水浴加热4 h后在滤网中过滤洗涤,再与7.5% 的亚氯酸钠溶液按照料液比1:12(w/v)的比例混合后在70 ℃ 水浴锅中反应2 h,洗涤后过夜烘干,再与2% 的氢氧化钠混合,100 ℃ 水浴加热4 h,最后在滤网中用大量去离子水洗涤后收集滤渣,烘干粉碎置于干燥皿中保存。
1.2.1.2 芒果核壳CNFs的制备
参考Juan等[20]的方法并稍作修改。芒果核壳CNFs采用TEMPO氧化预处理和高压均质的方法。称取8 g经过预处理的芒果核壳纤维素于三口烧瓶中,添加去离子水调节浆浓为2.5%,添加0.128 g TEMPO和0.8 g NaBr,磁力搅拌混合均匀后使用胶头滴管将80 ml NaClO溶液缓慢加入三口烧瓶中,反应过程中滴加0.5 mol/L的氢氧化钠溶液使反应体系的pH维持在10.3,直到溶液的pH在5 min内没有下降,向三口烧瓶中添加稍过量的甲醇(5 mL)终止反应。之后用大量去离子水常温离心(12000 r/min,5 min),待出现淡蓝色悬浮液后,进行收集,该淡蓝色悬浮液即为CNFs悬浮液,然后使用高压均质机均质5次后透析至中性,冻干备用。
1.2.2 芒果核壳纤维素和CNFs 的结构表征和性质分析
1.2.2.1 芒果核壳CNFs形态观察
参考Rohaizu等[21]的方法。芒果核壳CNFs的形态结构采用透射电镜(TEM)进行观察。TEM样品的制备:首先将芒果核壳CNFs悬浮液超声分散,浓度为0.01 wt%,使用移液枪吸取20 μL稀释后的样品于洁净的碳膜覆盖的电子显微镜栅格上(300目),静置2 min。然后吸取2 μL的醋酸铀(浓度为1 wt%)染色剂对芒果核壳CNFs进行染色,然后使用TEM进行观察,操作电压为200 kV。
1.2.2.2 傅里叶红外(FTIR)和X射线衍射(X-ray)分析
参考Le等[22]的方法。FTIR的制样是将干燥的芒果核壳纤维素和芒果核壳CNFs粉末和溴化钾进行压片。FTIR的扫描波长范围为4000~400 cm−1,分辨率为4 cm−1;X-ray的测试条件:扫描速度为5°/min,扫描范围为10°~60°,Cu Ka辐射(λ=1.5418 Å)。电压为40 kV,电流为40 mA。使用公式(1)计算结晶度指数 (CrI)。
$$结晶度({\rm{CrI}})=({\rm{I}}_{002}-{\rm{I}}_{{\rm{am}}})\times 100/{\rm{I}}_{022} $$ (1) 1.2.2.3 颗粒的粒径和电位分析
参考 Wu等[23]的方法。芒果核壳CNFs悬浮液稀释10倍,在仪器平衡30 s后,测量粒径和电位,结果报告为3次测量的平均值。该方法为芒果核壳CNFs纳米颗粒尺寸的计算提供了间接信息,颗粒的粒径都是假设为球形的基础上进行测量。
1.2.2.4 热重分析(TGA)
参考Nystrom等[24]的方法。称取约10 mg芒果核壳纤维素和CNFs样品置于氧化铝坩埚中,以10 ℃/min的加热速率从室温加热到550 ℃,氮气的流动速率设置为50 mL/min。
1.2.3 Pickering乳液的制备和性质分析
1.2.3.1 Pickering乳液的制备
Pickering乳液的制备参考Chen等[25]的方法并稍作修改。首先将芒果核壳CNFs溶于去离子水调节浆浓为0.4 wt%,然后分别调节pH(5~11)和离子强度(10~100 mmol/L)后按油相占体系比例的30%,水相占体系比例的70% 进行混合,然后使用高速剪切机以12000 r/min的速率处理2 min,随后使用微射流高压均质机在30 MPa的压力下处理3次,得到芒果核壳CNFs稳定的Pickering乳液。
1.2.3.2 乳液的粒径和电位测试
参考Li等[26]的方法。测试前将Zetasizer Pro纳米粒度仪及ZETA电位分析仪预热30 min,乳液的样品用去离子水稀释至合适的倍数分别置于马尔文塑料样品池和马尔文电位样品池中,根据所使用的油相的折射率进行设置,每个样品测试3次。
1.2.3.3 乳液的微观结构观察
参考 Li等[27]的方法,使用Leica DMI6000B 倒置显微镜对乳液的微观结构进行观察。乳液使用超纯水稀释至适宜倍数后,使用移液枪吸取10 μL的样品滴于载玻片上,盖上盖玻片后调整焦距和观察倍数拍摄乳液的微观结构图片。
1.2.3.4 乳析指数测定
参考Huang等[28]的方法,将制备好的乳液分别转移到单独的10 mL的样品瓶中,每个pH和离子强度条件下分装3瓶。根据公式(2)分别在1、3、5、7和14 d记录乳液层高度评估乳液的乳析指数(CI)。
$$ {\rm{CI}}({\text{%}})={\rm{Hs}}/{\rm{Ht}}\times100 $$ (2) 式中,Hs是乳液下层清液的高度(cm),Ht是乳液的总高度(cm)。
1.3 数据处理
各组实验数据重复3次,实验数据以平均值的形式表示,数据采用统计学分析软件SPSS18.0进行差异显著性分析(P<0.05),并使用Origin 2021软件作图。
2. 结果与分析
2.1 芒果核壳纤维素和CNFs的结构表征及其性质分析
2.1.1 芒果核壳CNFs的TEM表征和性质分析
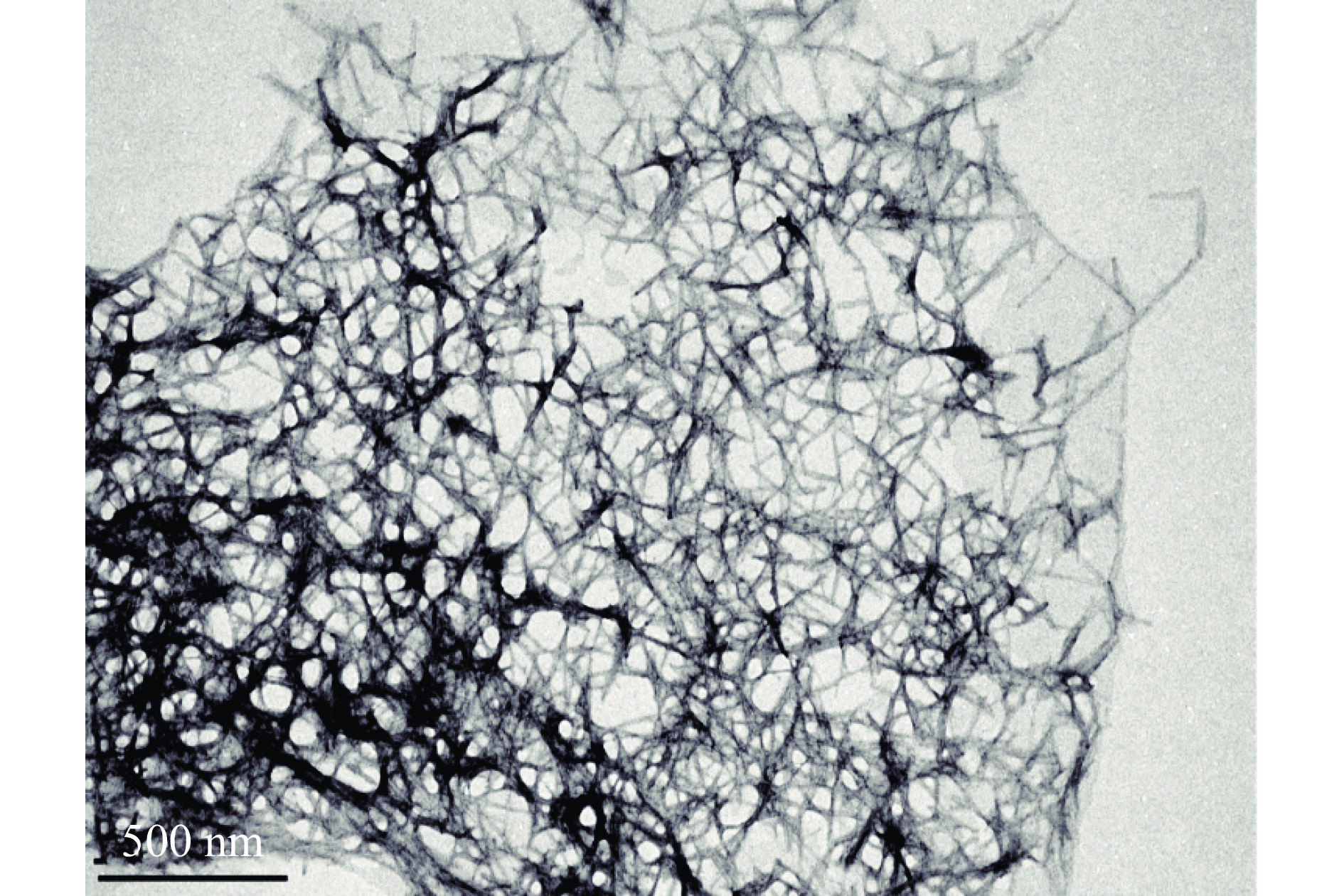
芒果核壳CNFs的形貌表征如图1所示,呈细长的纤维状,获得的丝状CNFs相互缠绕,形成网状结构。从图中可以明显看到CNFs有明显的絮凝,不能清晰地看到单根分散的CNFs。发生这种现象可能是在样品制备过程中醋酸铀染色的影响,干燥后的样品在醋酸铀的影响下发生了不同程度的絮凝。李霞[29]在棕榈空果串CNFs的TEM表征中也发现了类似的现象。
2.1.2 芒果核壳纤维素和CNFs的FTIR表征和性质分析
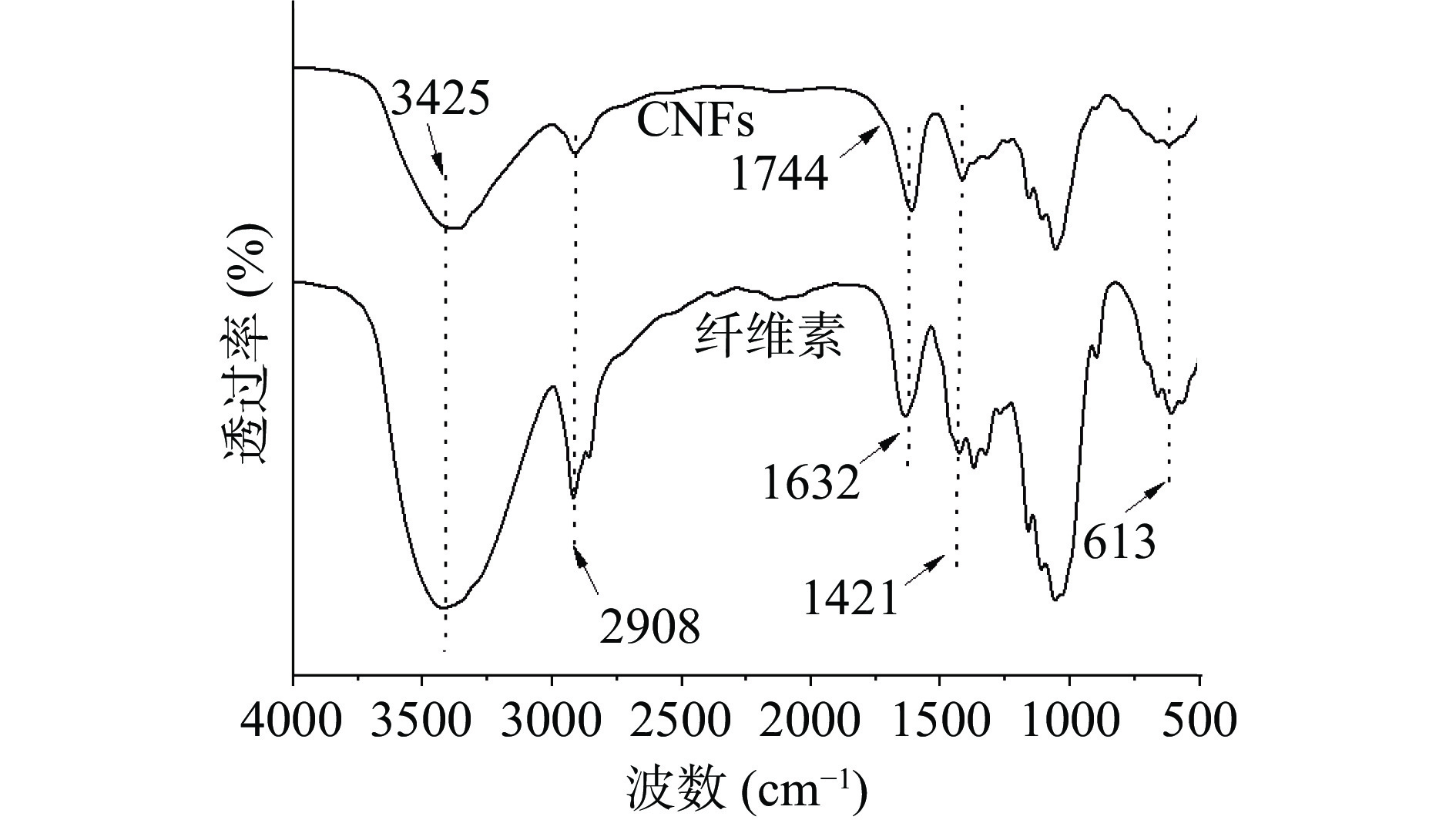
芒果核壳纤维素和CNFs的FTIR图谱如图2所示。由于O-H的伸缩振动在 3425 cm−1处存在峰,而CNFs的峰强度和纤维素相比明显减少,这是因为TEMPO氧化法在制备过程中将纤维素C6伯羟基区域选择性氧化为羧基,使其羟基含量下降[26];2900~2800 cm−1处的峰值是C-H的伸缩振动[27]。从CNFs的FT-IR光谱中发现,在1744 cm−1处出现了一个小小的吸收峰,表明羟基被成功的氧化成羧基,Wu等[23]在使用TEMPO氧化法和高压均质法制备豆渣CNFs的FTIR图谱表征中,也在此波长范围发现了吸收峰。在1632 cm−1处的吸收峰是C=C的伸缩,此处的吸收峰与水的结合能力有关,显然芒果核壳纤维素和CNFs都具备此吸收峰,说明他们与水的结合能力较强[30];1421 cm−1处的吸收峰是因为 C-O-C 的伸缩模式;在613 cm−1处向外弯曲的吸收峰则是纤维素的特征峰[31]。FTIR结果表明TEMPO氧化法并没有改变芒果核壳纳米纤维素的基本结构。
2.1.3 芒果核壳纤维素和CNFs XRD结构表征和性质分析
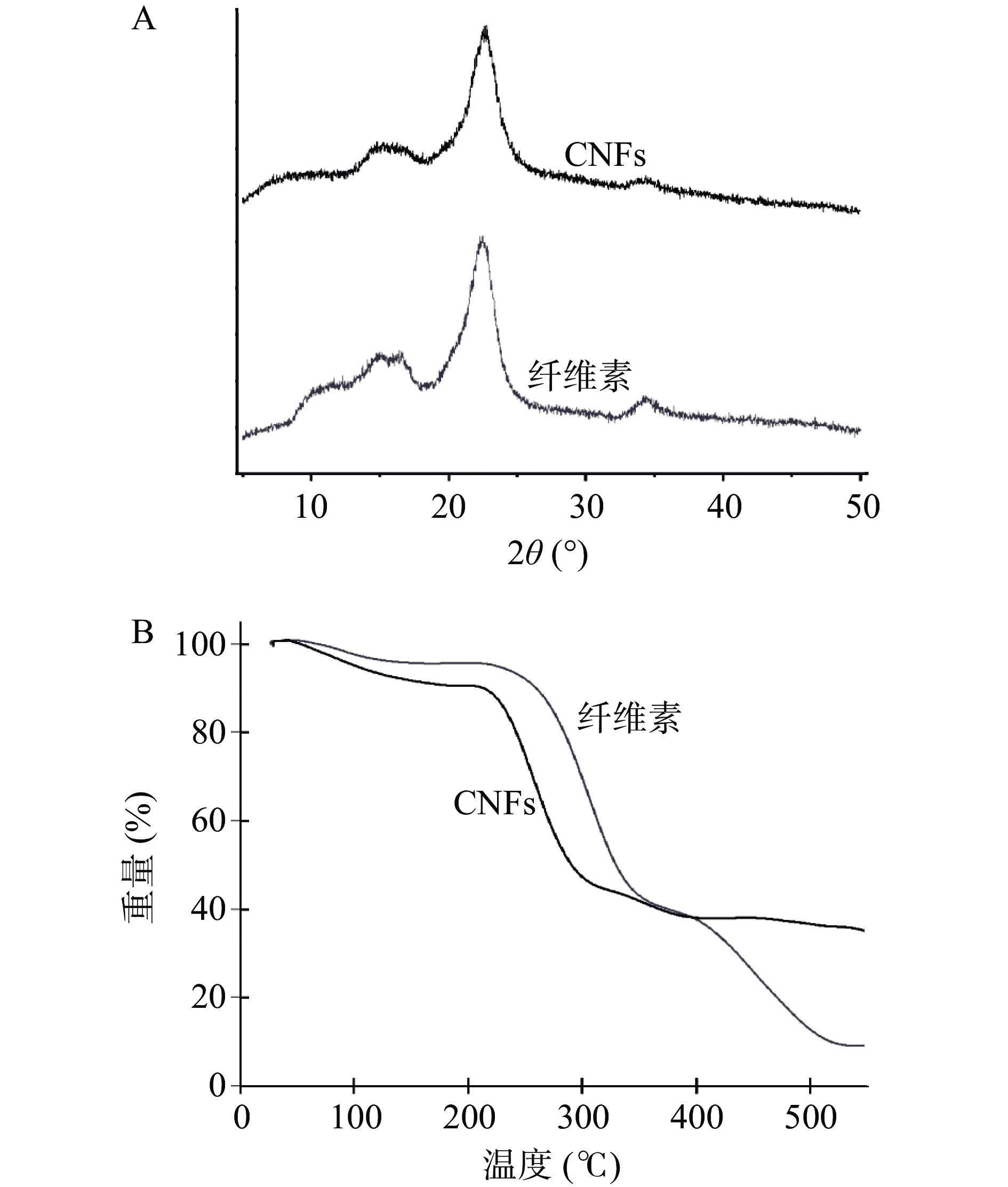
芒果核壳纤维素和CNFs的XRD衍射图谱如图3A所示。通过XRD可以进一步的观察到它们之间的结晶度差异,在2θ=14.8°、16.4°、22.6°和34.5°处有主强度峰,表明它们都属于Ⅰ型纤维素。经过计算,纤维素和CNFs的结晶度分别为62% 和57%,从图也可以看到CNFs的衍射峰强度是低于芒果核壳纤维素,这是由于TEMPO氧化过程的选择性所致,无定形葡萄糖单醛酸单元的形成主要发生在纤维素的结晶区域表面,同时高压均质也会破坏一定的结晶区域使其结晶度有所降低[32]。
2.1.4 芒果核壳纤维素和CNFs TGA 分析
芒果核壳纤维素和CNFs的TGA曲线如图3B所示。芒果核壳纤维素和CNFs的热降解过程主要在以下几个温度区间。在温度为27~215 ℃的区间内,芒果核壳纤维素和CNFs的质量损失分别为5%和10%,主要是由于样品中的水分蒸发,导致样品质量下降,发生这种现象的原因可能是由于芒果核壳纤维素采用烘箱烘干,而CNFs采用的是冷冻干燥,两种不同的方法导致初始含水量有一定的差距。第二个温度区间为215~400 ℃,此过程中芒果核壳纤维素和CNFs发生了一定程度的热降解,葡萄糖分子链在高温下解聚脱水和分解,最终形成碳化物,从图中可以看出经过TEMPO氧化处理的CNFs相较于芒果核壳纤维素对温度更为敏感,这可能与其结晶度的降低有关[33]。第三个温度区间为>400 ℃时,此温度条件下发生的变化归因于碳质层的形成,碳质层的存在可以延缓有机质的热分解,而碳质层的形成和羧基含量有关,CNFs由于TEMPO氧化使得羧基含量增加,因此芒果核壳纤维素的最终失重要大于CNFs[34]。
2.1.5 芒果核壳CNFs悬浮液粒径电位分析
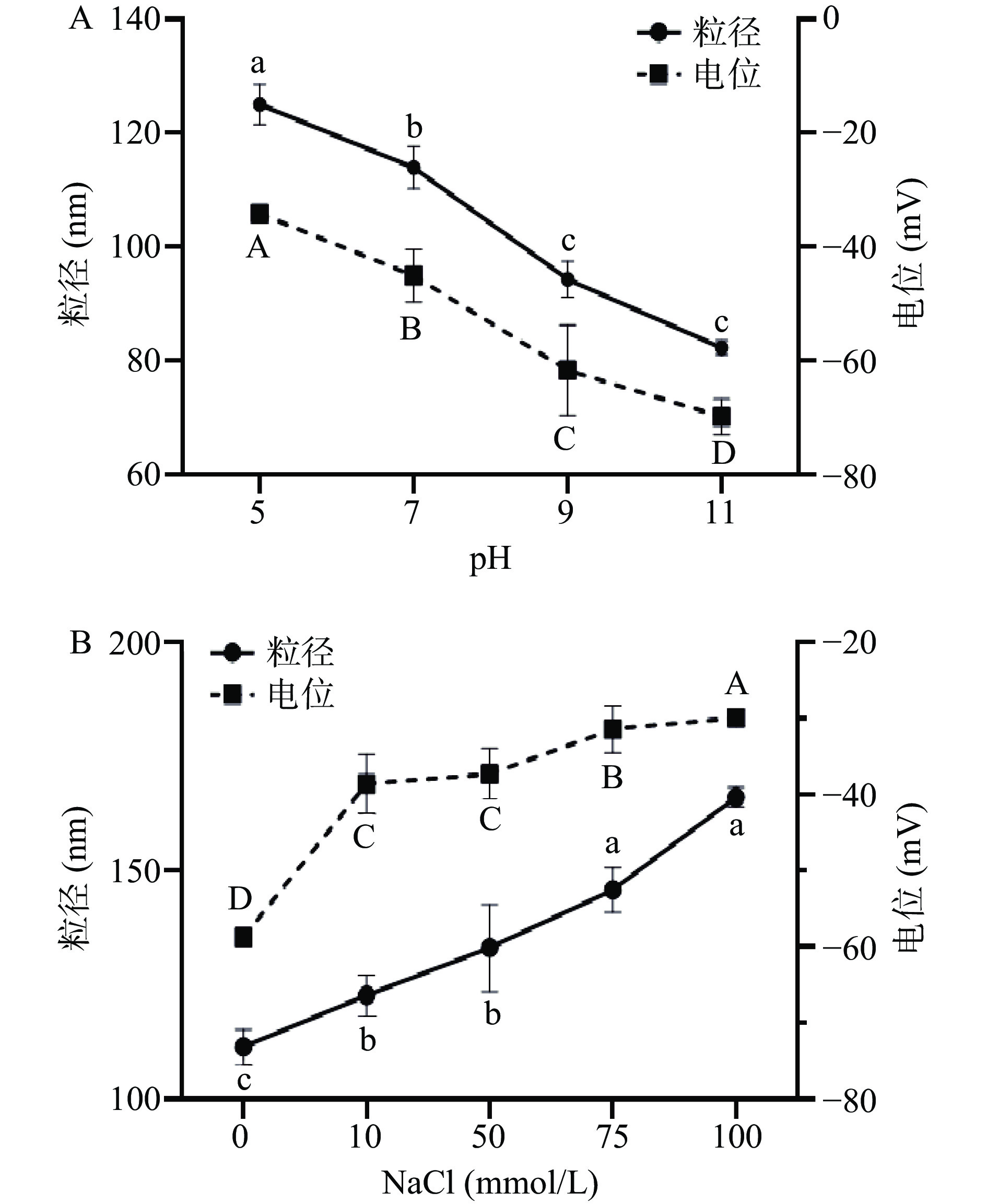
芒果核壳CNFs悬浮液的粒径和Zeta电位随着pH(5~11)变化如图4A所示,随着pH的增大,悬浮液的粒径从125.02 nm逐渐减小到82.24 nm,呈现显著减小的趋势(P<0.05)。Zeta电位的绝对值则是在pH5~9的条件下从34.2 mV逐渐增加到61.67 mV,呈现显著增加的趋势(P<0.05),而从pH9~11电位的绝对值虽然也在增大,但是不具有显著差异性。发生这种现象可能因为羧基的去质子化(COOH→COO–+H+),当pH从9增加到11时去质子化的效果影响逐渐减弱,因此电位变化不明显。而电位绝对值的逐渐增大,使得CNFs之间的排斥逐渐增强,颗粒之间不容易聚集,因此粒径逐渐减小[35]。
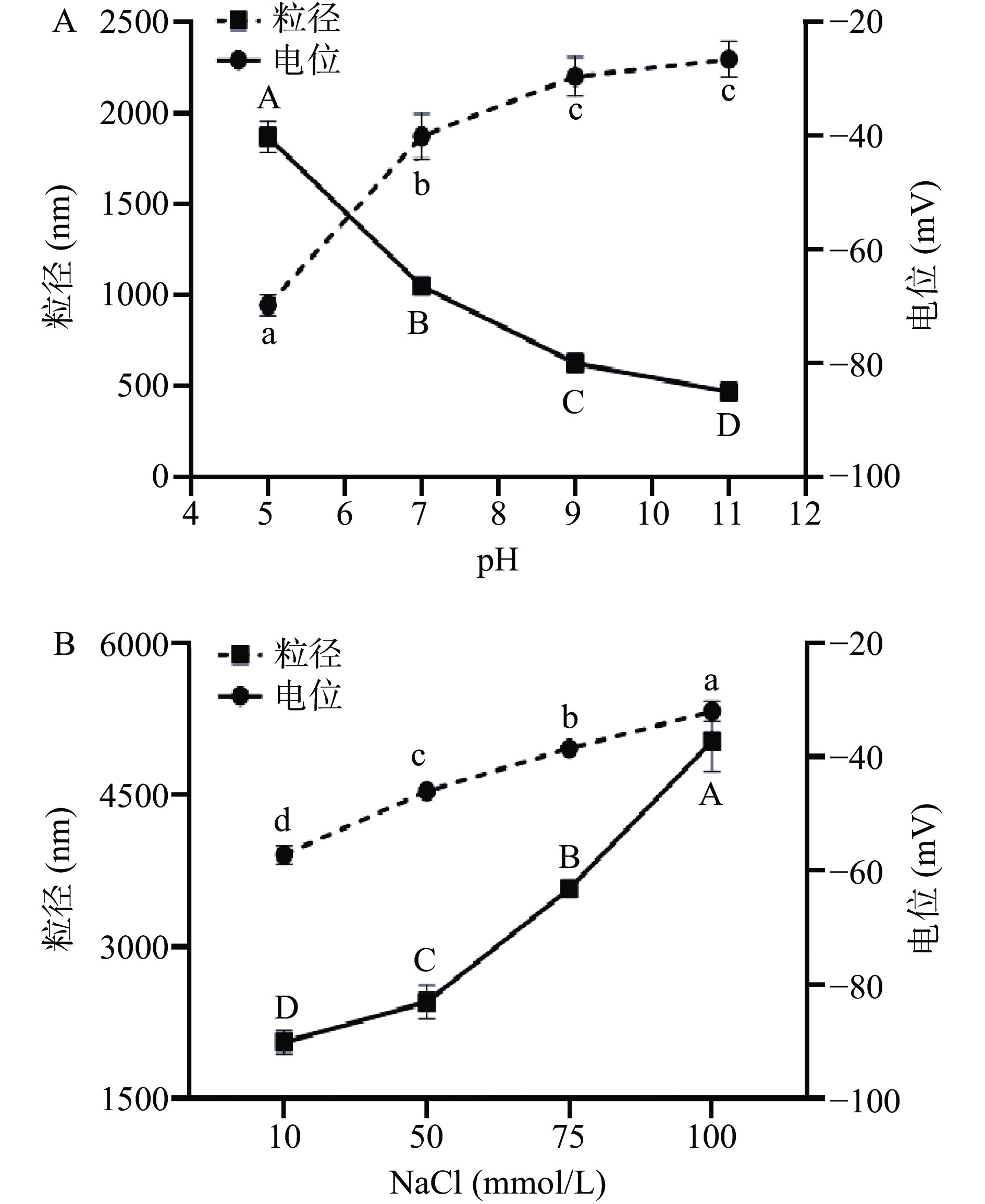
![]() 图 4 CNFs在不同pH条件下粒径电位的变化和CNFs在不同离子强度条件下粒径电位的变化注:A为在pH5~11条件下CNFs颗粒的粒径和电位;B为在离子强度0~100 mmol/L条件下CNFs颗粒的粒径和电位;同一指标相同类型的不同字母表示样本间的显著性差异(P<0.05)。Figure 4. Changes in particle size potential of CNFs at different pH conditions and Changes in particle size potential of CNFs under different ionic strength conditions
图 4 CNFs在不同pH条件下粒径电位的变化和CNFs在不同离子强度条件下粒径电位的变化注:A为在pH5~11条件下CNFs颗粒的粒径和电位;B为在离子强度0~100 mmol/L条件下CNFs颗粒的粒径和电位;同一指标相同类型的不同字母表示样本间的显著性差异(P<0.05)。Figure 4. Changes in particle size potential of CNFs at different pH conditions and Changes in particle size potential of CNFs under different ionic strength conditions芒果核壳CNFs悬浮液的粒径和Zeta电位随着离子强度(0~100 mmol/L)变化如图4B所示,随着离子浓度的增大,悬浮液的粒径由111.40 nm增加到166.17 nm;而电位的绝对值则是从58.73 mV降低到29.93 mV。这是因为盐的添加导致CNFs表面带负电荷的基团与钠离子发生了静电吸附作用[36],使得Zeta电位的绝对值降低,颗粒之间的静电排斥力减弱,从而引起颗粒的絮凝,导致粒径的增大。
综上可知,经过次氯酸漂白、碱化处理、TEMPO氧化和高压均质处理,成功以芒果核壳为原料制备了丝状的芒果核壳CNFs,其悬浮液在不同的pH和离子强度条件下也具备较小的粒径和较高的电位,有利于Pickering乳液的稳定。FTIR图谱表明芒果核壳CNFs保持了纤维素的基本结构,同时其部分羟基被氧化成羧基,增强了芒果核壳CNFs的两亲性,使其稳定Pickering乳液的能力增强。而XRD和TGA图谱则阐释了,经过TEMPO氧化和高压均质处理后获得的芒果核壳CNFs为 Ⅰ 型纤维素,属于稳定Pickering乳液性能较优的纤维素晶型,同时其结晶度略有降低,导致其热稳定性有所下降,但仍保持较好的热稳定性,使其可以在不同温度的Pickering乳液中得以应用。因此,理论上由芒果核壳制备的芒果核壳CNFs具备优异的稳定Pickering乳液固体颗粒性质,但对其稳定性能的认识还不清楚,所以接下来通过考察pH和离子强度对Pickering乳液稳定性的影响,从粒径、电位和乳析指数等多个指标来进一步评估芒果核壳CNFs是否具备优异的稳定Pickering乳液固体颗粒性质。
2.2 芒果核壳CNFs稳定的Pickering乳液的特性
2.2.1 粒径和电位分析
在pH5~11条件下,芒果核壳CNFs乳液粒径和电位变化如图5A所示。乳液的粒径显著减小(P<0.05),从1867 nm减小到469.5 nm。Zeta电位的绝对值逐渐减小,从69.76 mV降低到19.38 mV。在pH5~9之间显著增大(P<0.05),pH9~11则没有显著性。这些结果表明低pH条件有利于增加CNFs Pickering乳液的表面负电荷。 WINUPRASITH等[37]在使用TEMPO氧化法制备裙带菜纳米纤维素稳定的Pickering乳液中也发现了相同的现象,也说明在pH为11的时候电荷密度较高,将会防止乳液的聚集,有助于乳液体系的稳定。这与前面悬浮液电位变化趋势完全相反,说明乳液是个较为复杂的体系,由于提取纳米纤维素材料不同,悬浮液电位趋势的变化并不一定适用于乳液的变化趋势。
在离子强度为0~100 mmol/L条件下,芒果核壳CNFs稳定的乳液粒径和电位的变化如图5B所示。乳液的粒径从2056.33 nm增加到5030.67 nm,呈现显著增大的趋势(P<0.05);乳液电位的绝对值则是从57.19 mV减小到31.96 mV,呈现显著减小的趋势(P<0.05)。这是因为钠在电解质中带正电,会聚集在CNFs的周围并中和表面的负电荷,导致液滴之间的电荷排斥减少,从而使得液滴的聚集和尺寸的增加[38],因此离子强度的增加不利于乳液的稳定。
2.2.2 乳液的形态观察
图6A是乳液在pH5~11条件下的微观结构。随着pH的增大,乳液液滴的尺寸逐渐减小。在pH5时,液滴较为不均一,有一定的聚集现象,说明此pH条件下,乳液的稳定性较差。虽然电位的降低使得液滴间的静电排斥降低,乳液更容易聚集,但是从图中可以看出乳液液滴较好地分散,并没有明显的聚集行为,说明在pH7到pH11的条件下,CNFs缠绕成丝的网状结构可以有效的阻止乳液液滴聚集,也说明虽然乳液液滴的电位较低,但其静电斥力总是需要满足乳液液滴的均匀分散,阻止乳液液滴聚集和聚结,使乳液尽可能的具备较好的稳定性。
图6B是在离子强度0~100 mmol/L条件下乳液的微观结构。在10、50和75 mmol/L条件下,乳液液滴粒径相对较小,分布较为均匀,而在100 mmol/L条件下,乳液液滴的粒径发生较为明显的增大和聚集现象。总的来看,离子强度增大,使得乳液液滴的粒径逐渐增大,这是因为离子强度的增加会一定程度上增强静电屏蔽作用,导致颗粒之间的静电斥力减弱,从而引起乳液液滴聚集和尺寸的增大,使得乳液的稳定性下降,更容易破乳。
2.2.3 乳液的乳析指数分析
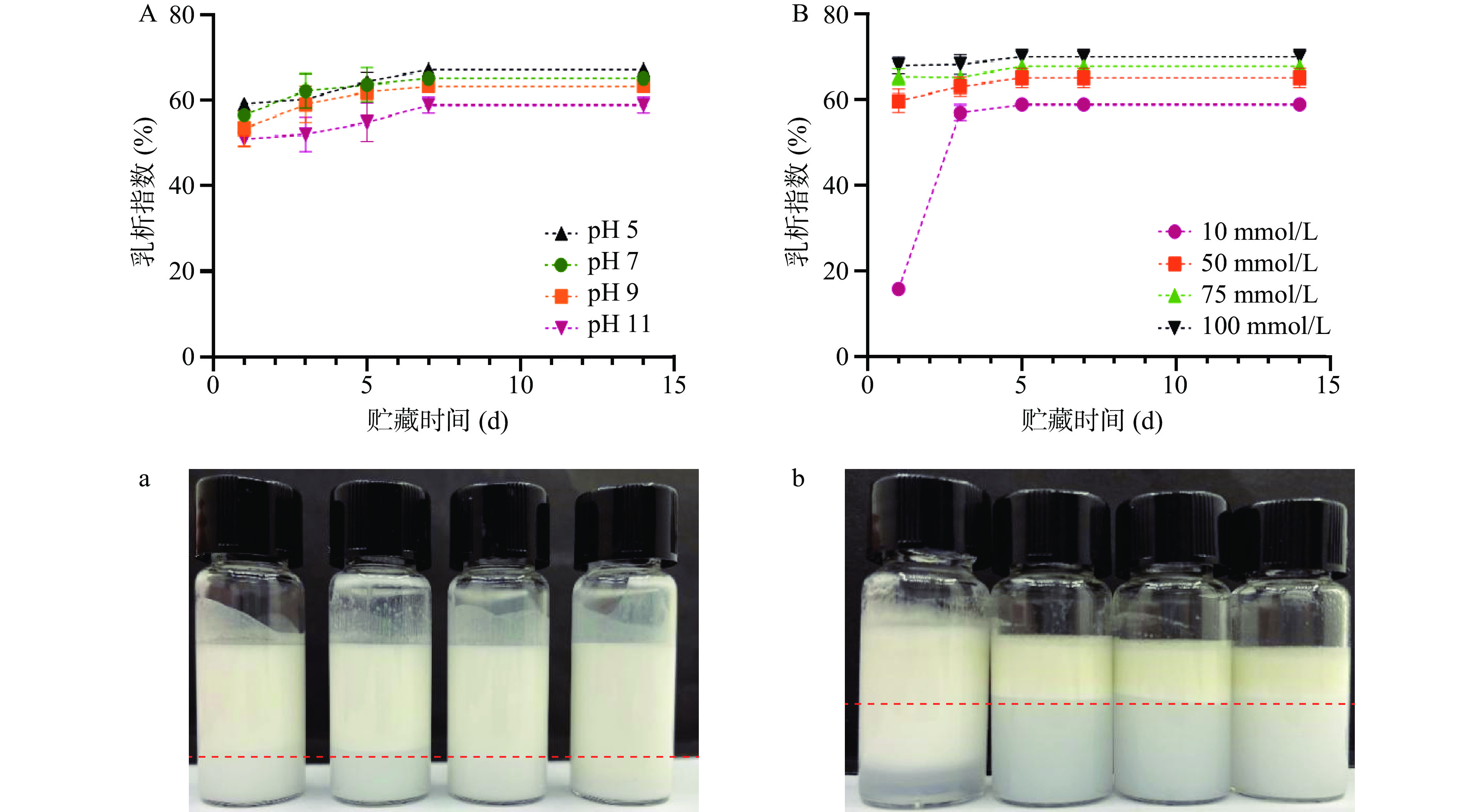
芒果核壳CNFs稳定的乳液在pH5~11条件下的CI值和乳液的外观形态如图7A、图7a所示,随着pH的增大,乳液的乳析指数和分层速度都逐渐减小,在第7 d达到最大值。在pH11时乳液的乳析指数要优于其他pH条件,说明由芒果核壳制备的CNFs在碱性条件下具备较为优异的稳定性。出现这种现象的原因可能是因为随着pH的增大,乳液的液滴尺寸显著降低,在油水界面排列更加紧密,使得界面膜的致密性增加,阻止液滴之间的聚集,使得乳液更加稳定。翟希川等[39]也在不同pH条件下细菌纳米纤维素稳定性的研究中发现了类似的现象。
芒果核壳CNFs稳定的乳液,在离子强度0~100 mmol/L条件下乳液的CI值和乳液的外观形态如图7B、图7b所示,随着离子强度的增大,乳液的乳析指数逐渐增大。离子强度为10 mmol/L时,乳液分层速度最慢,在第5 d达到顶峰,而在离子强度为50、75、100 mmol/L时,乳液的分层速度都较快,在第1 d时就几乎接近顶峰,说明离子强度的增大对芒果核壳CNFs稳定的Pickering乳液具有较大影响。Ni等[6]在研究银杏壳纳米纤维素在Pickering乳液的应用中也发现了类似的现象。
3. 结论
本文研究了以芒果核壳CNFs作为Pickering乳液稳定剂的性能,探究了其在pH5~11和离子强度0~100 mmol/L条件下对乳液的形成和稳定性的影响。结果表明,通过TEMPO氧化和高压均质法制备的芒果核壳CNFs仍旧保持着Ⅰ型纤维素构型,结晶度由 62% 降低至57% ,对温度更加敏感。CNFs稳定的Pickering乳液在pH11和离子强度为10 mmol/L的条件下展现出良好的稳定性能,具有较低的乳析指数、较小的粒径和适宜的Zeta电位绝对值,同时也具备良好的微观结构。这些实验结果揭示了芒果核壳纳米纤维素在不同pH和离子强度条件下的乳化性能,同时TEMPO氧化和高压均质法制备的CNFs相较浓硫酸水解法更为绿色环保,其废液也能回收利用,因此以芒果核壳为原料提取制备的CNFs可以作为Pickering乳液优异的固体颗粒来源。
-
图 4 CNFs在不同pH条件下粒径电位的变化和CNFs在不同离子强度条件下粒径电位的变化
注:A为在pH5~11条件下CNFs颗粒的粒径和电位;B为在离子强度0~100 mmol/L条件下CNFs颗粒的粒径和电位;同一指标相同类型的不同字母表示样本间的显著性差异(P<0.05)。
Figure 4. Changes in particle size potential of CNFs at different pH conditions and Changes in particle size potential of CNFs under different ionic strength conditions
-
[1] LI Q, WU Y L, FANG R X, et al. Application of nanocellulose as particle stabilizer in food pickering emulsion: Scope, merits and challenges[J]. Trends in Food Science & Technology,2021,110(1):573−583.
[2] BEI W, SAIN M. Dispersion of soybean stock-based nanofiber in a plastic-matrix[J]. Polymer International,2010,56(4):538−546.
[3] ANGKURATIPAKORN T, CHUNG C, KOO C, et al. Development of food-grade Pickering oil-in-water emulsions: Tailoring functionality using mixtures of cellulose nanocrystals and lauric arginate[J]. Food Chemistry,2022,327:127039.
[4] PAUNOV V N, CAYRE O J, NOBLE P F, et al. Emulsions stabilized by food colloid particles: Role of particle adsorption and wettability at the liquid interface[J]. Journal of Colloid and Interface Science,2007,312(2):381−389. doi: 10.1016/j.jcis.2007.03.031
[5] HUANG S T, LIU X H, CHANG C Y, et al. Recent developments and prospective food-related application of cellulose nanocrystals: a review[J]. Cellulose,2020,27(6):2991−3011. doi: 10.1007/s10570-020-02984-3
[6] NI Y, LI Y N, FAN L P. Production of nanocellulose with different length from ginkgo seed shells and applications for oil in water Pickering emulsions[J]. International Journal of Biological Macromolecules,2020,149:617−626. doi: 10.1016/j.ijbiomac.2020.01.263
[7] XIAO J, LI Y Q, HUANG Q R, et al. Recent advances on food-grade particles stabilized Pickering emulsions: Fabrication, characterization and research trends[J]. Food Science & Technology,2016,55:48−60.
[8] GOMEZ H C, SERPA A VELASQUEZ C J, et al. Vegetable nanocellulose in food science: A review[J]. Food Hydrocolloids,2016,57:178−186. doi: 10.1016/j.foodhyd.2016.01.023
[9] WU Y L, ZHANG X Z, QIU D, et al. Effect of surface charge density of bacterial cellulose nanofibrils on the rheology of O/W Pickering emulsions[J]. Food Hydrocolloids,2021,120:106944. doi: 10.1016/j.foodhyd.2021.106944
[10] LI J H, WEI X Y, WANG Q H, et al. Homogeneous isolation nanocellulose from bagasse by high pressure homogenization[J]. Carbohydrate Polymers,2012,90(4):1609−1613. doi: 10.1016/j.carbpol.2012.07.038
[11] DAI H J, ZHANG H, MA L, Green pH/magnetic sensitive hydrogels based on pineapple peel cellulose and polyvinyl alcohol: Synthesis, characterization and naringin prolonged release[J]. Carbohydrate Polymers, 2019, 209: 51−61.
[12] COSTA A L R, GOMES A, TIBOLLA H, Cellulose nanofibers from banana peels as a Pickering emulsifier: High-energy emulsification processes[J]. Carbohydrate Polymers, 2019, 209: 51−61.
[13] JIANG F, KONDO T, HSIEH Y L. Rice straw cellulose nanofibrils via aqueous counter collision and differential centrifugation and their self assembled structures[J]. ACS Sustainable Chemistry & Engineering,2016,4(3):1697−1706.
[14] LEI W Q, FANG C Q, ZHOU X, et al. Cellulose nanocrystals obtained from office waste paper and their potential application in PET packing materials[J]. Carbohydrate Polymers,2018,181:376−385. doi: 10.1016/j.carbpol.2017.10.059
[15] LINKE C, DRUSCH S. Pickering emulsions in foods-opportunities and limitations[J]. Critical Reviews in Food Science and Nutrition,2018,58(12):1971−1985. doi: 10.1080/10408398.2017.1290578
[16] NADEEM M, IMRAN M, KHALIQUE A. Promising features of mango (Mangifera indica L.) kernel oil: A review[J]. Springer Link,2016,53(5):2185−2196.
[17] FUJISAWA S, TOGAWA E, KORODA K. Nanocellulose-stabilized pickering emulsions and their applications[J]. Science and Technology of Advanced Materials,2017,18(1):959−971. doi: 10.1080/14686996.2017.1401423
[18] GALANAKIS C M, Valorization of fruit processing by-products[M]. London: Academic Press, 2020: 167−181.
[19] 沈小倩, 张梦, 周伟, 等. pH和离子强度对甘蔗渣纳米纤维素Pickering乳液稳定性的影响[J]. 食品工业科技,2022,43(6):102−108. [SHEN X Q, ZHANG M, ZHOU W, et al. Effect of pH and ionic strength on the pickering emulsion stability of bagasse nanocellulose[J]. Science and Technology of Food Industry,2022,43(6):102−108. SHEN X Q, ZHANG M, ZHOU W, et al. Effect of pH and ionic strength on the pickering emulsion stability of bagasse nanocellulose[J]. Science and Technology of Food Industry, 2022, 43(6): 102-108.
[20] JUAN L T, LIN S H, WONG C W, et al. Functionalized cellulose nanofibers as crosslinkers to produce chitosan self-healing hydrogel and shape memory cryogel[J]. ACS Applied Materials & Interfaces,2022,14(32):36353−36365.
[21] ROHAIZU R, WANROSLI W D. Sono-assisted TEMPO oxidation of oil palm lignocellulosic biomass for isolation of nanocrystalline cellulose[J]. Ultrasonics Sonochemistry,2017,34:631−639. doi: 10.1016/j.ultsonch.2016.06.040
[22] LE H D, LOVEDAY S M, SINGH H, et al. Pickering emulsions stabilised by hydrophobically modified cellulose nanocrystals: Responsiveness to pH and ionic strength[J]. Food Hydrocolloids. 2020, 99: 105344.
[23] WU J L. ZHU W, SHI X D, et al. Acid-free preparation and characterization of kelp (Laminaria japonica) nanocelluloses and their application in Pickering emulsions[J]. Carbohydrate Polymers,2020,236:115999. doi: 10.1016/j.carbpol.2020.115999
[24] NYSTROM G, Mihranyan A, RAZAQ A, et al. Nanocellulose polypyrrole composite based on microfibrillated cellulose from wood[J]. The Journal of Physical Chemistry B,2010,114(12):4178−182.
[25] CHEN Y, ZHANG H, FENG X, et al. Lignocellulose nanocrystals from pineapple peel: Preparation, characterization and application as efficient Pickering emulsion stabilizers[J]. Food Research International,2021,150:110738. doi: 10.1016/j.foodres.2021.110738
[26] LI X, KUANG Y S, JIANG Y F, et al. In vitro gastrointestinal digestibility of corn oil-in-water Pickering emulsions stabilized by three types of nanocellulose[J]. Carbohydrate Polymers,2022,277:118835. doi: 10.1016/j.carbpol.2021.118835
[27] LI Q, XIE B, WANG Y X, et al. Cellulose nanofibrils from miscanthus floridulus straw as green particle emulsifier for O/W Pickering emulsion[J]. Food Hydrocolloids,2019,97:105214. doi: 10.1016/j.foodhyd.2019.105214
[28] HUANG Z L, HUANG X B. Fabrication and stability of Pickering emulsions using moringa seed residue protein: Effect of pH and ionic strength[J]. International Journal of Food Science and Technology, 2021, 56: 3484−3494.
[29] 李霞. 不同结构纳米纤维素稳定Pickering乳液的作用机制与应用研究[D]. 广州: 华南理工大学, 2019 LI X. Study of mechanism and application of Pickering emulsions stabilized by nano-cellulose with various structure[D]. Guangzhou: South China University of Technology, 2019.
[30] WU C L, MCCLEMENTS D J, HE M, et al. Okara nanocellulose fabricated using combined chemical and mechanical treatments: Structure and properties[J]. Journal of Molecular Liquids,2021,335:116231. doi: 10.1016/j.molliq.2021.116231
[31] ZHANG H, CHEN Y, WANG S, et al. Extraction and comparison of cellulose nanocrystal from lemon (Citrus limon) seed using sulfuric acid hydrolysis and oxidation methods[J]. Carbohydrate Polymers,2020,238:116180. doi: 10.1016/j.carbpol.2020.116180
[32] DAI H J, HUANG Y, HUANG H H. Eco-friendly polyvinyl alcohol/carboxymethyl cellulose hydrogels reinforced with graphene oxide and bentonite for enhanced adsorption of methylene blue[J]. Carbohydrate Polymers,2018,185:1−11. doi: 10.1016/j.carbpol.2017.12.073
[33] LI X, LI J, KUANG Y. Stabilization of Pickering emulsions with cellulose nanofibers derived from oil palm fruit bunch[J]. Cellulose,2019,27(2):839−851.
[34] MA Q Y, PANG K, WANG K et al. Ultrafine and carboxylated β-chitin nanofibers prepared from squid pen and its transparent hydrogels[J]. Carbohydrate Polymers,2019,211:118−123. doi: 10.1016/j.carbpol.2019.02.001
[35] LI X, LI J, GONG J, et al. Cellulose nanocrystals(CNCs) with different crystalline allomorpHfor oil in water Pickering emulsions[J]. Carbohydrate Polymers,2018,183:303−310. doi: 10.1016/j.carbpol.2017.12.085
[36] LIU Y F, WANG H S, YU G, A novel approach for the preparation of nanocrystalline cellulose by using phosphotungstic acid[J]. Carbohydrate Polymers, 2014, 110: 415−422.
[37] WINUPRASITH T, KHOMEUN P, MITBUMRUNG W, et al. Encapsulation of vitamin D3 in Pickering emulsions stabilized by nanofibrillated mangosteen cellulose: Effect of environmental stresses[J]. Food Hydrocolloids,2018,84(11):153−164.
[38] QI J R, SONG L W, ZENG W Q, et al. Citrus fiber for the stabilization of O/W emulsion through combination of Pickering effect and fiber-based network[J]. Food Chemistry,2021,343:128523. doi: 10.1016/j.foodchem.2020.128523
[39] 翟希川. 细菌纤维素纳米纤维的制备及其稳定的Pickering乳液的特性研究[D]. 西安: 陕西师范大学, 2019 ZHAI X C. Preparation of bacterial cellulose nanofibers and characterization of their stable Pickering emulsion[D]. Xi’an: Shaanxi Normal University, 2019.
-
期刊类型引用(2)
1. 刘茜. 带鱼多肽美拉德反应前后性质研究和结构表征分析. 中国食品工业. 2024(01): 120-122 .  百度学术
百度学术
2. 陈素艳,卢妍,吴光斌,陈发河. 黄秋葵酒渣纳米纤维素的制备工艺及表征分析. 食品研究与开发. 2024(17): 113-120 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:

 下载:
下载:



