Optimization of Oligosaccharide Preparation Process and Physiological Activity Analysis of Konjac Crude Powder
-
摘要: 本文利用地衣芽孢杆菌(Bacillus licheniformis)水解魔芋粗粉制备低聚糖,通过单因素实验确定魔芋粗粉浓度、菌株接种量、水解温度、水解时间4个因素对魔芋粗粉水解率的影响,在此基础上利用响应面优化水解条件。利用粘度计、薄层层析(TLC)分析水解产物特性,以·OH、·O2−和DPPH·清除能力为指标评价魔芋粗粉低聚糖抗氧化活性,以体外发酵试验探究魔芋粗粉低聚糖益生元活性。结果表明,水解最佳工艺参数为魔芋粗粉浓度20 g/L、接菌量1×107 CFU/g、水解温度43.6 ℃、水解时间10.2 h,此时,魔芋粗粉水解率为39.06%±0.12%,魔芋葡甘低聚糖(Konjac glucomannan oligosacchrrides,KGOS)产率为66.72%。随着水解时间延长,溶液粘度由2430.33 mPa·s下降到18.06 mPa·s。魔芋粗粉浓度10 mg/mL时,·OH、·O2−和DPPH·清除率分别为61.47%、34.60%和81.43%。KGOS、葡萄糖和魔芋粗粉对植物乳杆菌、短乳杆菌和干酪乳杆菌体外增殖作用OD600分别为0.775、1.371、0.236,0.791、1.339、0.224和0.916、1.336、0.243。该结果为魔芋粗粉低聚糖开发利用提供了依据。Abstract: In this paper, konjac powde were hydrolyzed by Bacillus licheniformis to prepare oligosaccharides. The effects of concentration of konjac powder, inoculum amount of strain, bacteriolysis temperature and hydrolysis time on hydrolysis rate of konjac powder were determined by single factor tests. The antioxidant activity of konjac powder oligosaccharides was evaluated with the scavenging ability of ·OH, ·O2−· and DPPH· as indexes. The prebiotic activity of konjac powder oligosaccharides was investigated by in vitro fermentation test. The results showed that the optimal hydrolysis process parameters was as follows: concentration of konjac powder 20 g/L, inoculation capacity 1×107 CFU/g, hydrolysis temperature 43.6 ℃, hydrolysis time 10.2 h. Under the optimal conditions, the hydrolysis rate of konjac powder was 39.06%±0.12%, and the yield of KGOS was 66.72%. With the prolongation of hydrolysis time, the viscosity of solution decreased from 2430.33 mPa·s to 18.06 mPa·s. When the concentration of konjac powder was 10 mg/mL, the clearance rates of ·OH, ·O2− and DPPH· were 61.47%, 34.60% and 81.43%, respectively. The OD600 of KGOS, glucose and konjac powder on the proliferation of Lactobacillus plantarum, Lactobacillus brevity and Lactobacillus casei in vitro were 0.775, 1.371, 0.236, 0.791, 1.339, 0.224 and 0.916, 1.336, 0.243, respectively. The results provide a theoretical basis for the further processing and utilization of oligosaccharides in konjac powder.
-
魔芋是天南星科(Araceae)魔芋属(Amorphophallus)多年生草本植物,具有低热量、低脂肪、高膳食纤维的营养特性。中国有着丰富的魔芋资源,现代魔芋深加工主要生产魔芋粗粉、魔芋葡甘聚糖、魔芋葡甘低聚糖三类产品。魔芋经过干制、初步粉碎制得的粉末称为魔芋粗粉[1],每100 kg鲜魔芋一般可制得粗粉20~30 kg。魔芋粗粉主要含有50%~60%的魔芋葡甘露聚糖(Konjac glucomannan,KGM)、20%~30%淀粉、5%~10%粗蛋白、2%~5%粗纤维等营养物质。KGM是一种高分子可溶性膳食纤维,羟基含量丰富,具有很强的溶胀性和凝胶性能,通常难以被胃肠道消化和利用,这导致其生物活性功能大大降低[2-3]。研究发现,将KGM制成低分子魔芋葡甘低聚糖(Konjac glucomannan oligosaccharides,KGOS)[4],其溶解性、流动性和口感大大改善,更易被机体吸收利用,还具有抑制淀粉老化、清除自由基、促进肠道益生菌增殖等多重作用[5-6]。
KGM属于半纤维素,而纤维素是结构物质不能作为能源物质,因此在KGM被分解为寡糖前,无法直接作为碳源为微生物的生长提供营养。当前KGM主要通过物理和化学等方法改性,均存在产物分子质量范围难掌控、副产物多和寡糖得率低等问题[7]。研究发现部分特异性微生物生长及代谢产物分解KGM,也同时分解其中的淀粉及蛋白质,且作用条件温和、寡糖产率高、成本低廉,能有效提高魔芋粗粉利用率[8]。因此,采用特异性菌株分解KGM是高效、快速制备葡甘寡糖的有效途径之一。
地衣芽孢杆菌(Bacillus licheniformis)是一种在土壤中广泛存在的革兰氏阳性嗜热腐生菌[9]。该菌可促使机体产生抗菌活性物质,调整体内菌群失调,同时杀灭致病菌,达到治疗目的。长期以来,该菌在发酵工业方面的应用广泛,常被用于生产碱性蛋白酶、淀粉酶、表面活性剂的生产原料,并且对人体和环境无毒害作用[10]。据Xan等[11]研究显示,芽孢杆菌代谢产物含有葡聚糖酶,因此具有水解KGM的能力,利用水解物进行生长代谢,因此魔芋粗粉可直接作为地衣芽孢杆菌培养基的营养来源。
本论文利用地衣芽孢杆菌水解魔芋粗粉,研究其水解特性和主要产物及其功能性,旨在将魔芋粗粉通过生物水解作用,制成完全可溶的液态功能食品材料,以期提升魔芋的加工利用率和食用价值。
1. 材料与方法
1.1 材料与仪器
鲜魔芋 使用产自陕西省岚皋县花魔芋;地衣芽孢杆菌(Bacillus licheniformis,CGMCC 1.8791)、植物乳杆菌(Lactobacillus plantarum,CGMCC 1.12974)、短乳杆菌(Lactobacillus brevis,CGMCC 1.2028)、干酪乳杆菌(Lactobacillus casei,CGMCC 1.580) 均购于中国普通微生物菌种保藏管理中心;胰蛋白胨 北京拜尔迪生物技术有限公司;酵母提取物 北京奥博星生物技术有限责任公司;氯化钠、正丁醇、冰乙酸、氢氧化钠、无水乙醇 天津市天力化学试剂有限公司;3,5-二硝基水杨酸 天津市大茂化学试剂厂;苯胺 上海麦克林生化科技有限公司;β-甘露聚糖酶(10000 U/g) 上海源叶生物科技有限公司;其他试剂 均为国产分析纯。
Autoflex Speed 基质辅助激光解吸电离飞行时间质谱、AVANCE NEO600M 核磁共振波(600 Hz) 德国布鲁克公司;Multiskan Go型酶标仪 美国Thermo Electron公司;RVDV-Ⅱ+Pro型粘度计 美国博利飞公司;LDZX-30KBS型立式压力蒸汽灭菌锅 上海申安医疗器械厂;SHP-200B型摇床 上海世平实验设备有限公司。
1.2 实验方法
1.2.1 魔芋粉制备
魔芋粗粉制备方法为[12-13]:将魔芋洗净、去皮、切片、热风烘干、粉碎,过80目筛(取筛下物),获得魔芋粗粉(不经漂白处理),置于干燥器中常温保存。
1.2.2 魔芋粗粉基础指标测定
水分:参照GB 5009.3-2016方法[14];KGM:参照GB/T 18104-2000方法[15];粗纤维:参照GB/T 5009.10-2003方法[16];蛋白质:参照GB 5009.5-2016方法[17];粗脂肪:参照GB 5009.6-2016方法[18];灰分:参照GB 5009.4-2016方法[19];pH:参照GB 5009.237-2016方法[20];淀粉:参照GB 5009.4-2016方法[17]。
1.2.3 地衣芽孢杆菌活化
将地衣芽孢杆菌接种于LB固态培养基,培养箱40 ℃恒温培养至有明显褶皱及不规则边缘的白色菌落,获得活化菌株。
1.2.4 菌悬液的制备
将活化的地衣芽孢杆菌接种到含有50 mL LB液体培养基,在40 ℃、180 r/min的条件培养22 h,将1 mL培养物转移到50 mL LB液体培养基,用于制备种子液。将种子液4000 r/min离心10 min,弃上清液,0.9%无菌生理盐水(w/v)洗涤两次,添加无菌生理盐水制备细菌悬浮液,调整浓度为108 CFU/g。
1.2.5 指标测定
1.2.5.1 还原糖和总糖含量测定
采用3,5-二硝基水杨酸比色法测定反应混合物中的还原糖浓度和总糖浓度,参考Chen[21]的方法并略做修改。
还原糖的测定:移取1.0 mL稀释过的魔芋粗粉水解液或魔芋粗粉溶液于25 mL具塞试管中,加入1 mL蒸馏水,再在每个具塞试管中加入1.5 mL DNS显色液,摇匀后置于沸水浴中5 min,立即冷却,用蒸馏水定容至刻度,于540 nm处测定吸光度。利用测得的标准曲线,计算溶液中还原糖含量,以葡萄糖标准溶液浓度为横坐标,吸光度为纵坐标,建立回归方程为:y= 0.4131x+0.0057,决定系数R2= 0.9982。
总糖的测定:移取1.0 mL稀释过的魔芋粗粉水解液或魔芋粗粉溶液于25 mL具塞试管中,准确加入3 mol/L硫酸0.5 mL,摇匀后在沸水浴中具塞密封水解1.5 h,取出,冷却。准确加入6 mol/L氢氧化钠0.5 mL,摇匀;再在每个具塞试管中加入1.5 mL DNS显色液,摇匀后置于沸水浴中5 min,立即冷却,用蒸馏水定容至刻度,于540 nm处测定吸光度。利用测得的标准曲线,计算溶液中总糖含量。
总糖含量(mg/mL)=θT (1) 式中:θ为换算系数,θ=0.9;T为待测溶液用DNS法测定在标准曲线所得的值。
1.2.5.2 水解率和低聚糖产率测定
通过测定水解前KGM溶液中总糖含量与水解前、后溶液中还原糖含量,得到水解率[22],即公式(2)。
水解率(%)=菌解液中还原糖含量−初始还原糖含量初始总糖含量×100 (2) 通过测定水解前KGM溶液中总糖含量与水解后溶液中总糖含量,得到低聚糖产率,即公式(3)。
低聚糖产率(%)=初始总糖含量−水解后的总糖含量初始总糖含量×100 (3) 1.2.6 魔芋粗粉水解工艺单因素实验
以水解率为评价指标,研究各因素对魔芋粗粉水解的过程的影响,固定底物浓度20 g/L,接菌量1×107 CFU/g,水解温度43 ℃,水解时间12 h进行试验。考察不同因素水平分别设定为底物浓度(10、20、30、40、50 g/L)、接菌量(1×105、1×106、1×107、1×108、1×109 CFU/g)、水解温度(37、40、43、46、49 ℃)和水解时间(0、2、4、6、8、10、12、14 h)对水解率的影响,各组试验均重复3次。
1.2.7 响应曲面(RSM)试验设计
根据Box-Behnken试验设计原理,以单因素实验结果为基础,选取对魔芋粗粉水解影响较大的接菌量(A)、水解温度(B)和水解时间(C)3个实验因素,以水解率为响应值进行三因素三水平的Box-Behnken响应面试验,优化水解魔芋粗粉获取KGOS的水解条件,因素水平编码表见表1。
表 1 响应面试验因素水平设计Table 1. Response surface test factor level design水平 因素 A接菌量(CFU/g) B水解温度(℃) C水解时间(h) −1 1×106 40 8 0 1×107 43 10 1 1×108 46 12 1.2.8 水解时间对粘度的影响
粘度越大表示溶液内分子量越大,因此粘度能直观地表现魔芋粗粉溶液内KGM分解效果;在生产加工过程中,常以粘度表示KGM含量[23]。本试验选用粘度作为KGM分解效果的一项指标。魔芋粗粉浓度为20 g/L、接菌量为1×107 CFU/g、水解温度43 ℃,设定水解时间分别为0、2、4、6、8、10 h,测定水解时间对魔芋粗粉溶液粘度的影响[24]。
1.2.9 水解产物的薄层层析(TLC)
在尺寸为20×20 cm的硅胶玻璃板上对纯化后的KGM水解产物进行TLC分析,参考张敏[25]的方法并略做修改。取水解时间分别为0、2、4、6、8、10 h低聚糖溶液和经β-甘露聚糖酶酶解4 h低聚糖溶液作为样品液,用移液枪分别吸取各样品液,在距离玻璃板2.5 cm,间距1.5 cm分别点样,点样直径小于0.5 cm。使用比例为4:3:4(v:v:v)的正丁醇:水:冰醋酸溶液作为展开剂。将1 g二苯胺、1 g苯胺和50 mL三氯乙酸溶解于50 mL丙酮以制备显色剂。样品经展开剂充分展开且晾干,将显色剂均匀喷洒在硅胶玻璃板上,于105 ℃下加热15~20 min,观察斑点并进行拍照记录。以浓度为10 mg/mL的甘露糖、葡萄糖、麦芽糖和甘露糖三糖为标准溶液。甘露糖和葡萄糖标准溶液(10 mg/mL)点样量为1.5 μL,麦芽糖和甘露糖三糖标准溶液(10 mg/mL)点样量为3 μL,所有样品在TLC硅胶板上的点样量为25 μL。
1.2.10 魔芋粗粉水解液低聚糖的生理活性分析
1.2.10.1 OH自由基清除率测定
取最优工艺条件下魔芋粗粉水解液1 mL,分别加入1 mL 8 mmol/L FeSO4溶液,1 mL 8 mmol/L 水杨酸-乙醇溶液和1 mL 8 mmol/L H2O2溶液,摇匀于37 ℃放置40 min,510 nm处测定其吸光值Ai。对照组用蒸馏水代替样液,测得吸光值A0[26]。空白组用蒸馏水代替FeSO4溶液,测得吸光值Aj,VC作为阳性对照。OH自由基清除率计算方法如公式(4)。
OH自由基清除率(%)=(1−Ai−AjA0)×100 (4) 1.2.10.2 O2−自由基清除率测定
取魔芋粗粉水解液0.25 mL于2.25 mL 50 mmol/L Tris-HCl缓冲溶液(pH=8.2),混合均匀,25 ℃放置10 min,加入15 μL 30 mmo1/L邻苯三酚溶液,快速混匀于320 nm处测定吸光度,5 min内每隔30 s测定一次吸光度,求得样品溶液在320 nm处的邻苯三酚自氧化速率Ai。用0.25 mL蒸馏水代替样液,于320 nm处测得邻苯三酚自氧化速率A0[27],VC作为阳性对照。O2−自由基清除率计算方法如公式(5)。
O2−自由基清除率(%)=A0−AiA0×100 (5) 1.2.10.3 DPPH自由基清除率的测定
取魔芋粗粉水解液100 μL,加100 μL 0.2 mmol/L DPPH溶液,混匀后避光反应30 min,在517 nm处测得吸光值A0;将100 μL各样品液加入到100 μL 95%乙醇,测得吸光值为Ai;将100 μL DPPH加入到100 μL 95%乙醇,测得吸光值为Aj[28],VC作为阳性对照。DPPH自由基清除率计算方法如公式(6)。
DPPH自由基清除率(%)=(1−A0−AiAj)×100 (6) 1.2.10.4 魔芋低聚糖的益生功能评价
使用3株益生菌植物乳杆菌(Lactobacillus plantarum)、短乳杆菌(Lactobacillus brevis)和干酪乳杆菌(Lactobacillus casei)测定KGOS的益生元活性。菌株在MRS培养基中37 ℃活化12 h,以制备种子溶液。最优工艺下得到的魔芋粗粉水解液冷冻干燥48 h,制备KGOS冻干物,4 ℃储藏,备用。
3株益生菌分别在最终浓度为1%(w/v)的KGOS、1%(w/v)的魔芋粗粉(阳性对照)和1%(w/v)的葡萄糖(阳性对照)作为唯一碳源的MRS培养基培养。发酵培养基在121 ℃高压灭菌20 min,并在4 ℃放置过夜补充水分,每10 mL培养基中注入200 μL菌液,菌株置于37 ℃静置培养,控制初始变量相同,在24 h测定OD600值和pH。
1.3 数据处理
所有试验均重复3次,采用Excel软件统计实验数据,利用SPSS 22.0和Design-Expert 8.0.6软件对数据进行处理和差异显著性分析。
2. 结果与分析
2.1 魔芋粗粉成分分析
魔芋粗粉主要指标测定结果如表2。
表 2 魔芋粗粉指标测定结果Table 2. Determination results of indicators of konjac crude powder指标 结果 指标 结果 总糖(g/100 g) 71.82±1.37 水分(g/100 g) 10.51±0.53 KGM(g/100 g) 58.62±1.18 灰分(g/100 g) 3.49±0.31 还原糖(g/100 g) 1.18±0.09 pH 7.02±0.01 粗纤维(g/100 g) 2.13±0.11 粗蛋白(g/100 g) 7.35±0.63 粗脂肪(g/100 g) 0.26±0.02 淀粉(g/100 g) 13.96±0.21 由表2可得,魔芋粗粉中总糖含量>70%,其中KGM含量>50%,表明粗粉中含有大量的高分子可溶性多糖。
根据魔芋粗粉指标测定结果,可以得到魔芋粗粉含有基础营养物质,其中糖类含量丰富。总体看,魔芋粗粉可为地衣芽孢杆菌生长提供营养,同时KGM会被代谢产物水解为低聚糖。
2.2 单因素实验结果
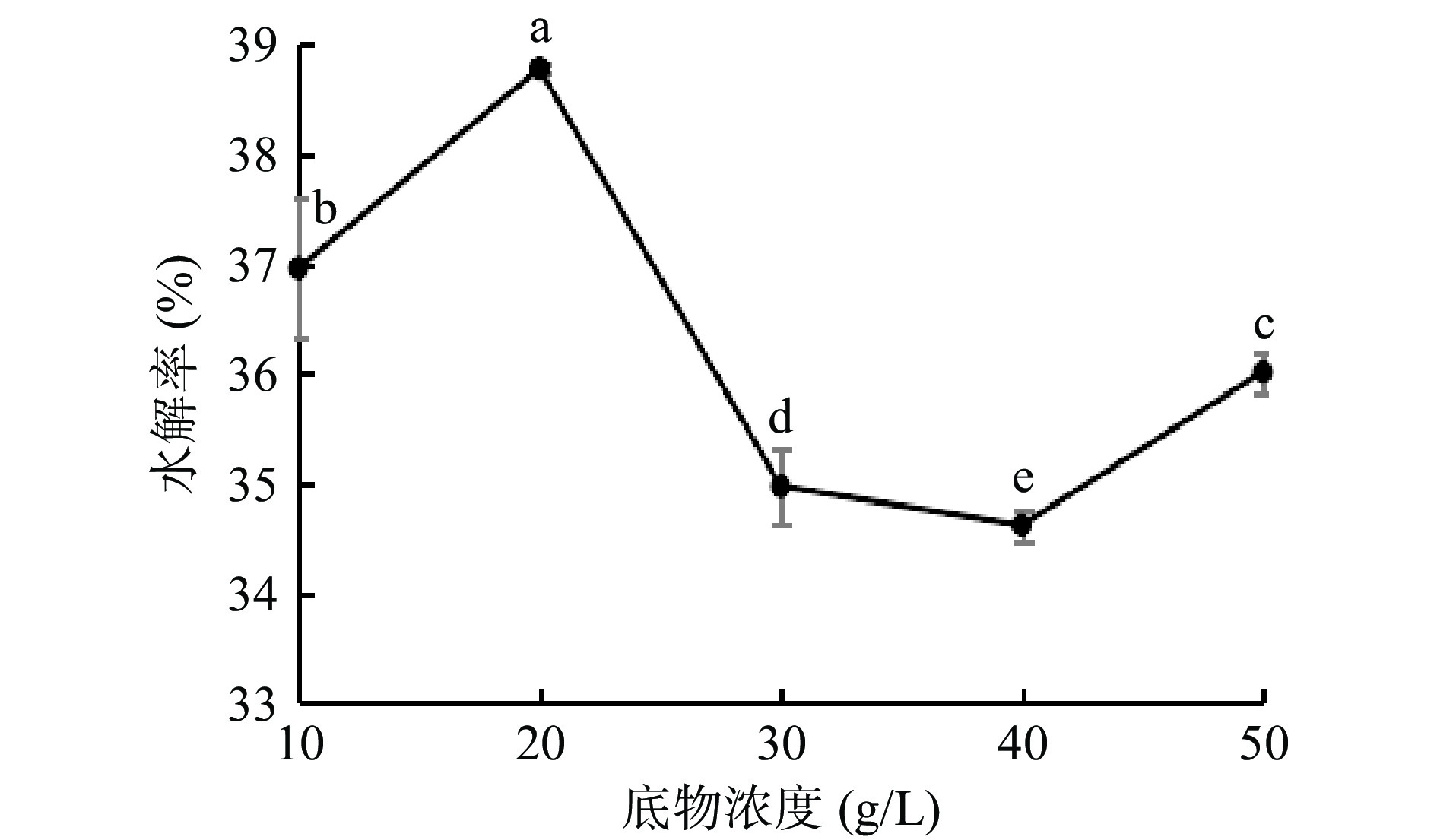
2.2.1 底物浓度对水解率的影响
底物浓度对水解率的影响如图1所示,魔芋粗粉水解率随底物浓度增大先升高后降低。当底物浓度在10~20 g/L,水解率随底物浓度增大而升高;底物浓度为20 g/L水解度达到最高值38.77%(P<0.05)。当底物浓度由20 g/L增加至40 g/L时,水解率随底物浓度的增大而降低。这是由于随着底物浓度升高,酶与底物结合几率增加,魔芋粗粉水解率升高;而当底物浓度继续增大时,魔芋粗粉无法充分溶胀,溶液粘度大幅增加,阻碍了酶分子与糖分子的结合[29],导致魔芋粗粉降解速率缓慢,水解速率降低,低聚糖产量减少。本试验选择20 g/L作为水解反应的最佳底物浓度。
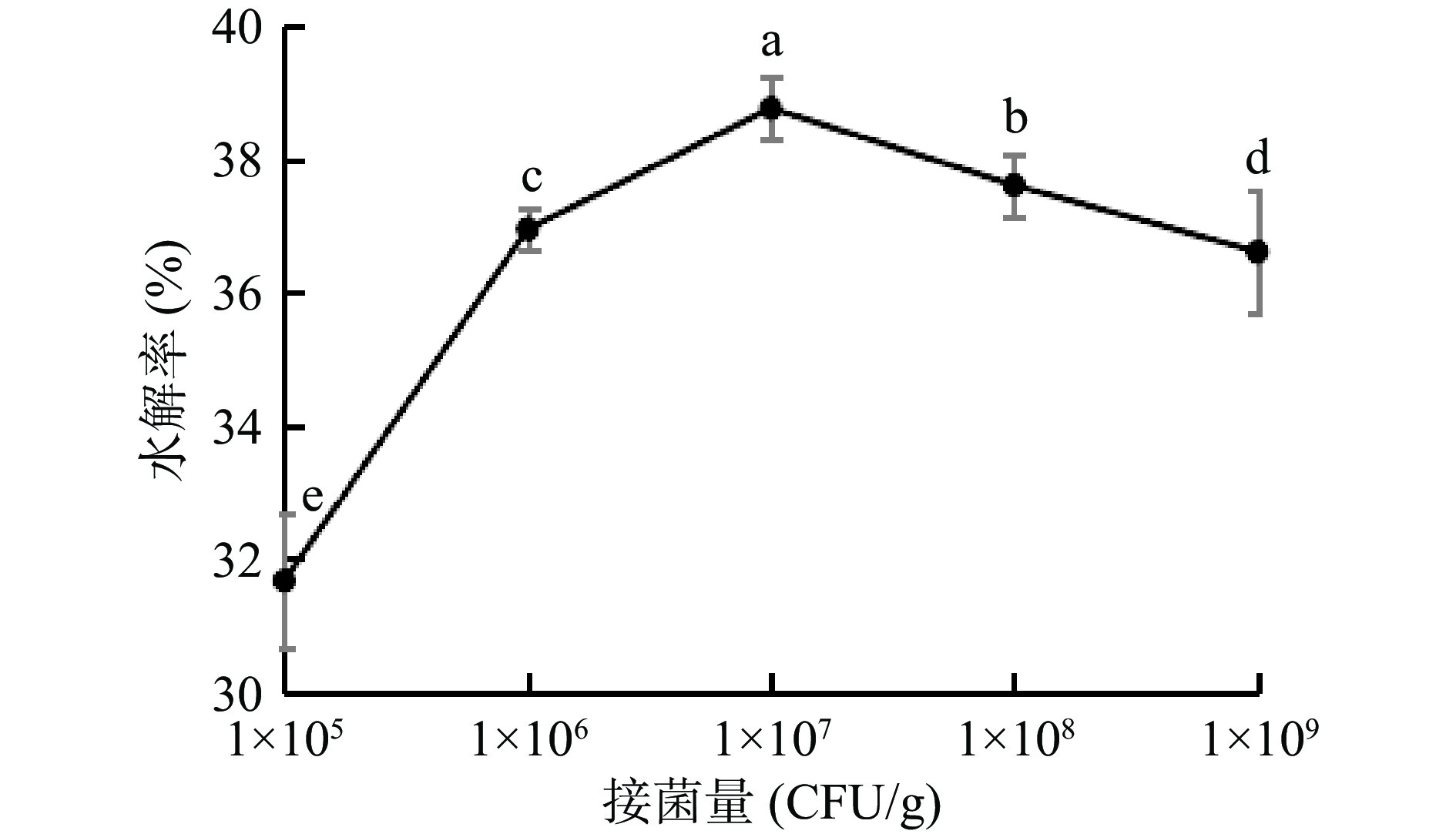
2.2.2 接菌量对水解率的影响
接菌量对水解率的影响如图2所示,魔芋粗粉水解率随接菌量的增加呈先上升后下降的趋势。当接菌量由1×105 CFU/g上升至1×107 CFU/g时,水解率随接菌量的增加而升高;当接菌量1×107 CFU/g,发现此时水解度显著高于其他样品组(P<0.05)。而接菌量由1×107 CFU/g增加至1×109 CFU/g时,水解率随底物浓度的增加而降低。这可能是由于接菌量的增加,菌株大量繁殖,产酶量增多,酶促反应速率加快[30],对魔芋粗粉的降解速率加快,水解率升高;但当接菌量继续增加,菌株对糖的消耗速率高于酶对糖的降解速率,导致水解率下降[31]。本试验选择1×107 CFU/g作为水解反应的最佳接菌量。
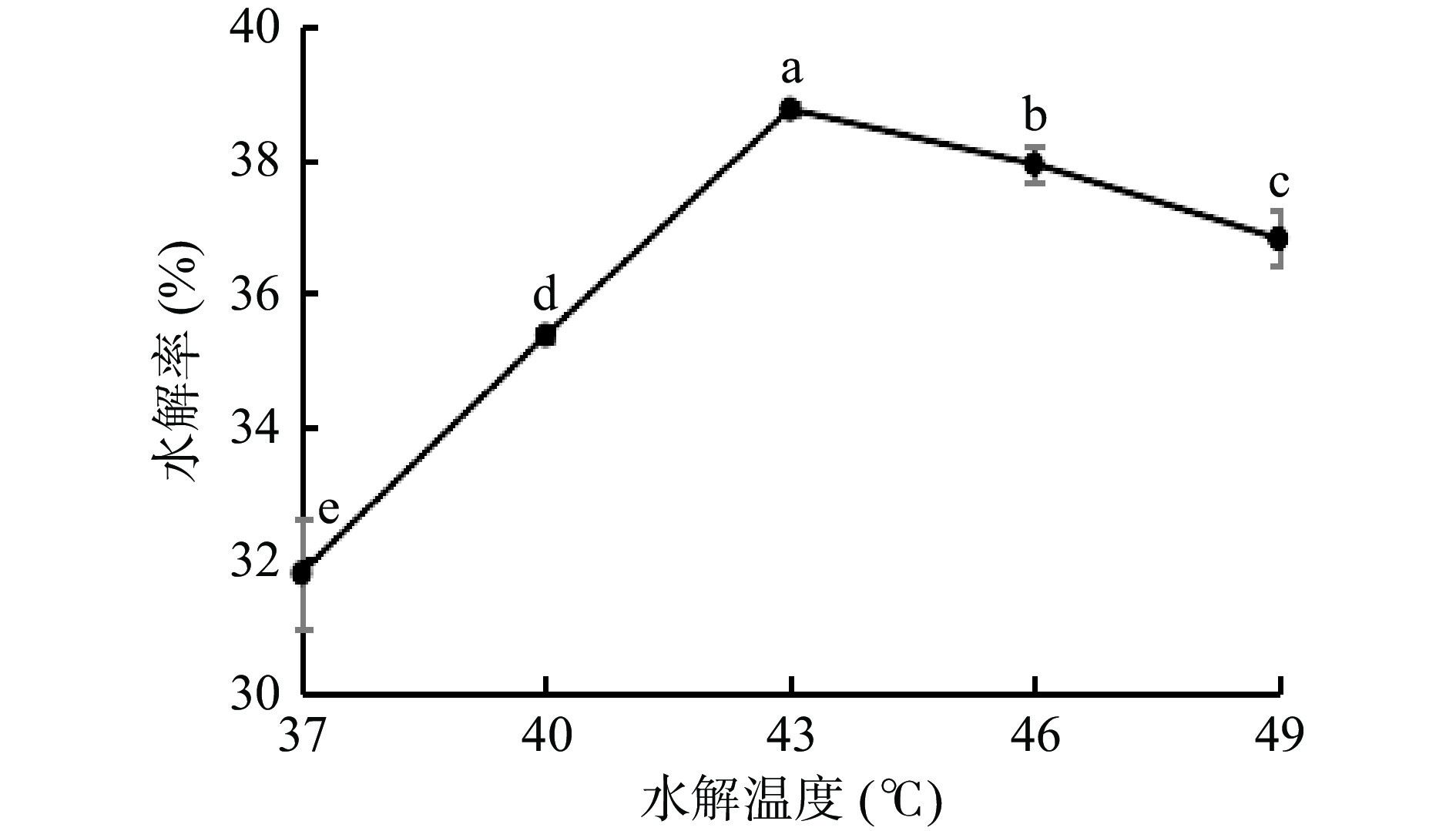
2.2.3 水解温度对水解率的影响
水解温度对水解率的影响如图3所示,魔芋粗粉水解率随水解温度增加呈先上升后下降的趋势。当水解温度由37 ℃增高至43 ℃时,水解率随温度增加而升高;当温度为43 ℃时水解度达最高值38.77%,相比于其他水解温度有显著性差异(P<0.05)。当水解温度由43 ℃增加至49 ℃,水解率随温度增加而降低。这是由于在37~43 ℃内,菌株所产生的酶并未处在最适温度下,其酶活不高。高温会增加葡甘露低聚糖的溶解度,降低了黏度,有利于底物与酶的结合。但随着温度继续升高,会促使酶的变性,使酶的活力下降,从而使葡甘露低聚糖得率的降低。本试验选择43 ℃作为水解反应的最佳水解温度。
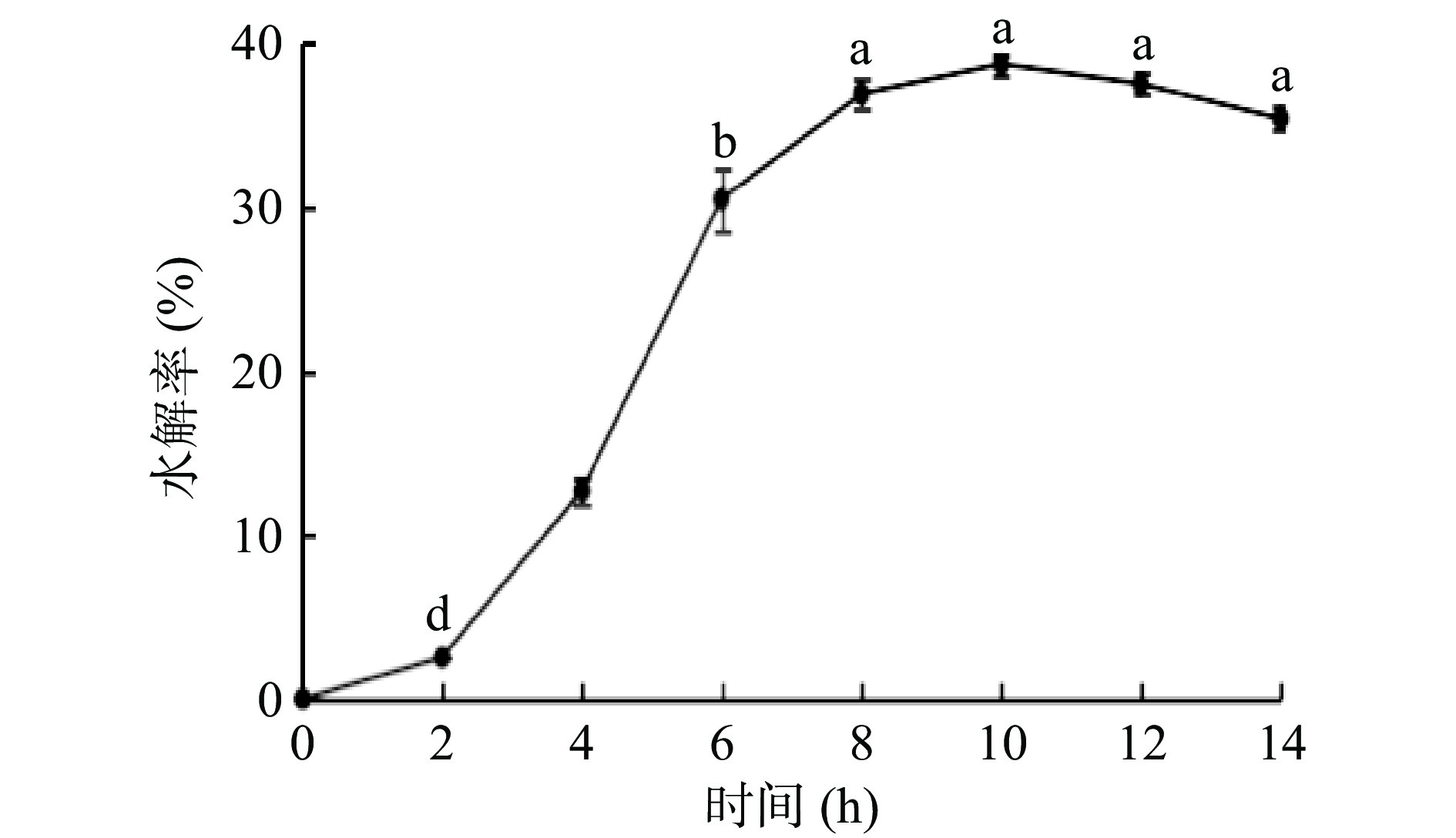
2.2.4 水解时间对水解率的影响
水解时间对水解率的影响如图4所示,水解率随水解时间的延长呈先上升后下降的趋势。当水解时间在0~10 h时,水解率呈逐渐上升趋势。在0~2 h水解率上升较慢,是由于前期菌株产酶量较低;在2~8 h内水解率大幅度上升,是由于菌株大量繁殖,产酶量增多,水解率迅速上升;在8~10 h内水解率缓慢上升,是由于菌株大量繁殖,对底物消耗量增加,酶解效率降低,水解率上升缓慢。在水解时间为10 h时,KGM的水解率达到最大,为38.77%(P<0.05)。当水解时间在10~14 h时,水解率逐渐降低,本试验选择10 h作为水解反应的最佳反应时间。
2.3 响应面试验
结合生产实际,降低成本,选择底物浓度为20 g/L,以接菌量、水解时间和水解温度为响应面变量,以水解率为响应值,应用Box-Behnken对地衣芽孢杆菌水解魔芋粗粉工艺进行优化,结果见表3和表4。
表 3 响应面试验设计与结果Table 3. Experimental design and results of response surface test实验号 A 接菌量 B水解温度 C 水解时间 Y 水解率(%) 1 −1 0 −1 34.59 2 0 1 −1 37.03 3 0 0 0 39.74 4 1 1 0 34.91 5 1 0 1 35.85 6 −1 1 0 35.75 7 −1 −1 0 32.69 8 −1 0 1 36.56 9 0 0 0 38.66 10 0 0 0 39.04 11 0 −1 1 35.26 12 0 1 1 36.45 13 0 −1 −1 33.79 14 0 0 0 38.89 15 1 −1 0 34.24 16 0 0 0 39.37 17 1 0 −1 36.15 表 4 响应面试验方差分析Table 4. Analysis of variance of response surface test变异来源 平方和 自由度 均方 F值 P值 模型 70.65 9 7.85 64.22 < 0.0001 A 接菌量 0.30 1 0.30 2.49 0.1587 B 水解温度 8.32 1 8.32 68.10 < 0.0001 C 水解时间 0.82 1 0.82 6.70 0.0360 AB 1.43 1 1.43 11.68 0.0112 AC 1.29 1 1.29 10.54 0.0141 BC 1.05 1 1.05 8.60 0.0220 A2 22.15 1 22.15 181.25 < 0.0001 B2 25.25 1 25.25 206.58 < 0.0001 C2 4.72 1 4.72 38.62 0.0004 残差 0.86 7 0.12 失拟项 0.14 3 0.047 0.26 0.8511 纯误差 0.72 4 0.18 总和 71.50 16 R2=0.9880,R2Adj=0.9727 如表4所示,对表中数据进行多元二次回归拟合,得到回归方程为 Y = 39.14+0.19A+1.02B+0.32C−0.60AB−0.57AC−0.51BC−2.29A2−2.45B2−1.06C2。
由表4可以看出,该模型方程极显著(P<0.0001),各因素中一次项B和二次项A2、B2模型影响极显著(P<0.0001),一次项C,交互项AB、AC、BC,和二次项C2模型影响显著(P<0.05)。由F值可知,三个因素对地衣芽孢杆菌水解魔芋粗粉影响大小次序为B>C>A。失拟项P=0.8511>0.05,表明该模型相对于绝对误差不显著;R2=0.9880,表明有98.80%的Y值变化是因为所选择的因素,说明回归方程数据拟合度高,试验误差小,可以利用该回归方程确定水解魔芋粗粉的最优条件为:接菌量为1×107 CFU/g、水解温度为43.59 ℃、水解时间为10.20 h。
为验证结果可靠性,对最佳水解条件进行实际调整,在接菌量为1×107 CFU/g、水解温度为43.6 ℃、水解时间为10.2 h的条件下进行试验,测得水解率为39.06%,比理论值39.25%仅低0.48%。董振香等[4]研究发现通过酶解KGM的水解率可达到43.56%,但酶解专一性高,对魔芋粗粉的水解不具有广泛性。同时菌解魔芋粗粉的研究尚未见报道。该模型能够较好预测实际水解率,经响应面优化得到水解魔芋粗粉的最佳参数准确可靠,并以此最佳参数为后续试验条件。
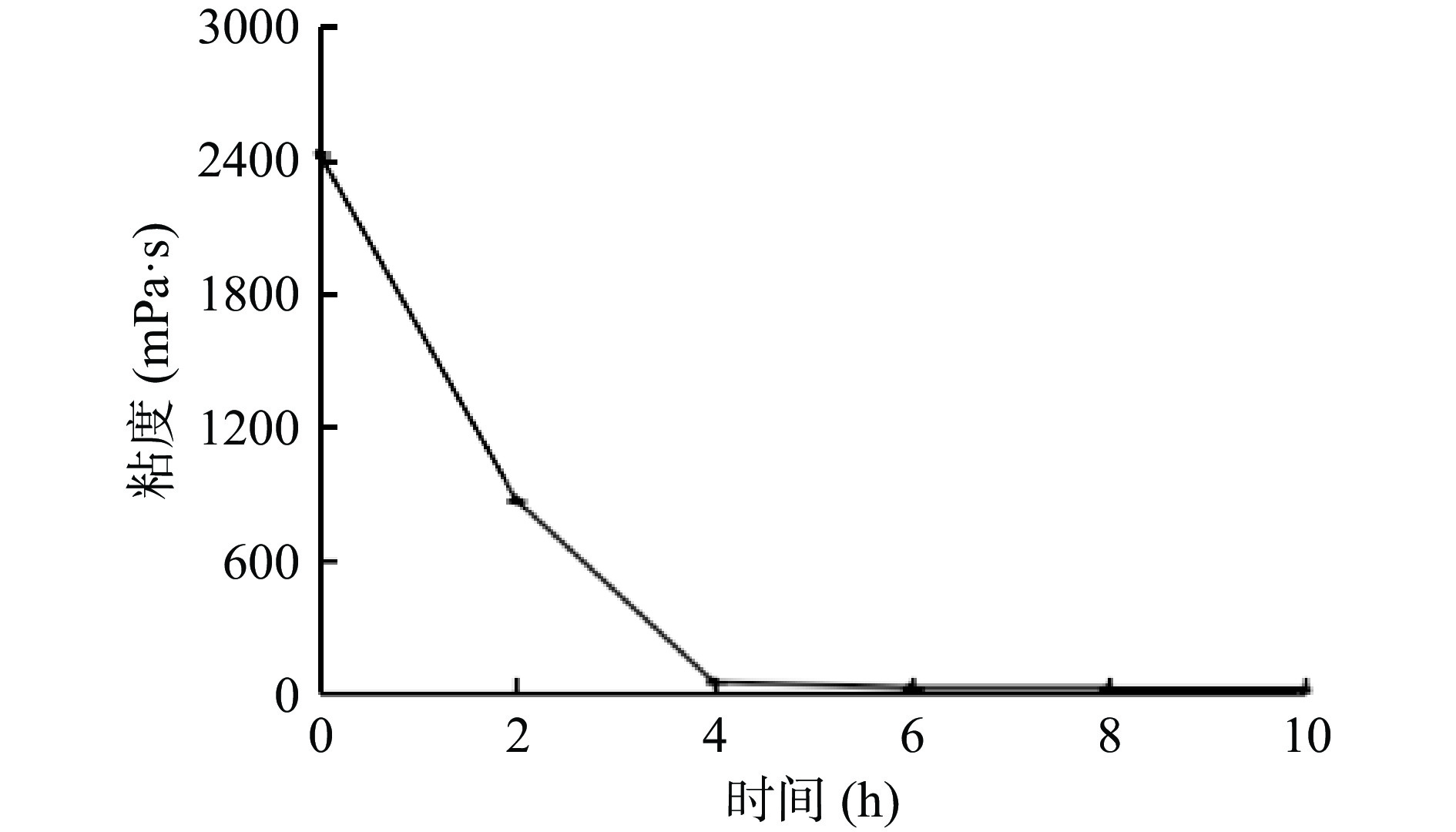
2.4 水解时间对魔芋粗粉溶液粘度的影响
水解时间对粘度的影响如图5所示,据郑梅霞等[32]研究表明KGM溶胶具有剪切稀化现象,因此在试验过程中多以3组以上平行试验验证。
随水解时间的延长,粘度呈现出先迅速下降后趋于稳定的趋势。在0~4 h内,粘度降低速率最快;在4 h时,溶液粘度由初始粘度2430.33 mPa·s下降至50.16 mPa·s,水解率为2.73%;在4~10 h时,粘度降低速率较慢,并逐渐趋于平稳;在10 h时,溶液粘度为18.06 mPa·s,水解率为38.77%。粘度变化证明了魔芋粗粉水解液中大分子物质能被地衣芽孢杆菌分解,同时便于试剂生产中对魔芋的开发利用。
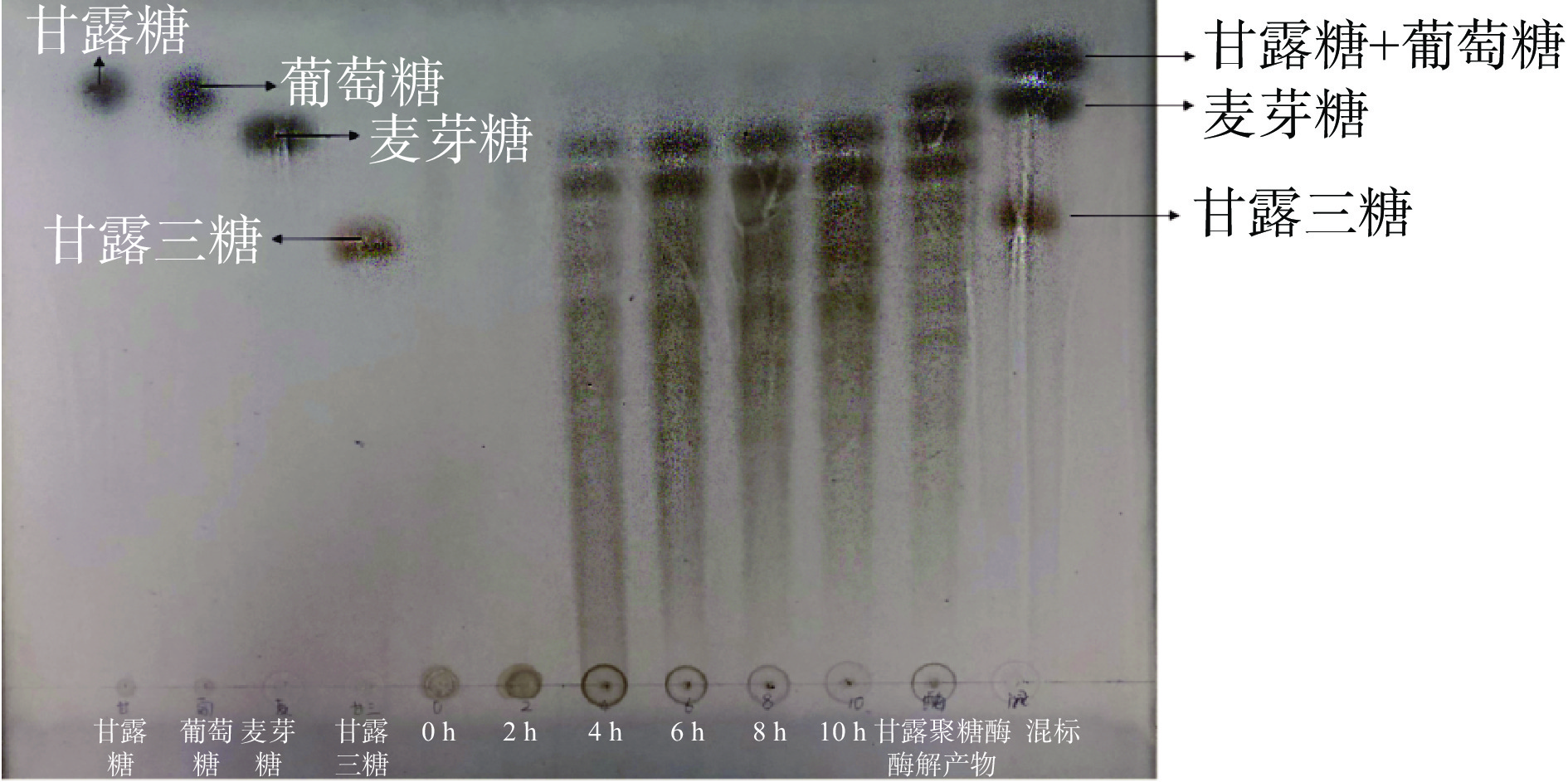
2.5 魔芋粗粉水解产物的TLC分析
利用地衣芽孢杆菌对魔芋粗粉进行水解,水解产物的TLC分析如图6所示。
如图6所示,从显色情况看,水解时间在0~2 h,魔芋粗粉含有少量单糖与二糖;水解时间2~4 h,魔芋粗粉被水解为小分子糖,其中单糖与二糖逐被菌株利用,水解时间4~10 h,随时间的延长,当水解时间达到10 h,魔芋粗粉糖类被水解为低聚糖,其中大部分由二糖以上不同分子量的低聚糖组成[33-34]。图中存在的少量拖尾现象是由于部分多糖未水解和魔芋粗粉溶液中其他大分子物质未被展开,经β-甘露聚糖酶处理后,KGM被分解为一些在二糖和三糖之间的低聚糖产物,未发现产生单糖。因此,地衣芽孢杆菌可将魔芋粗粉水解为低聚糖。
2.6 魔芋粗粉水解产物的体外抗氧化活性研究
2.6.1 魔芋粗粉水解产物对OH自由基的清除率
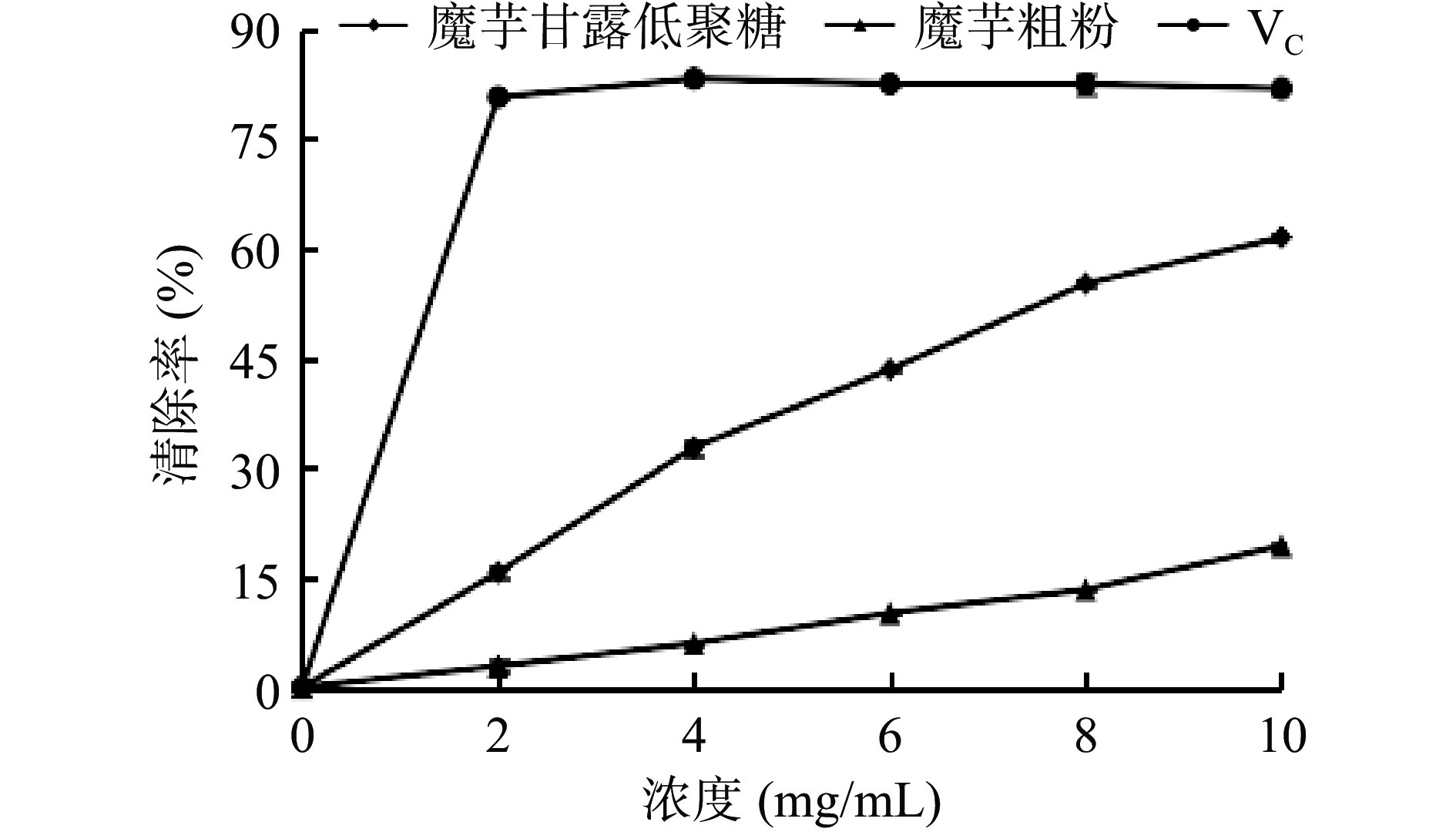
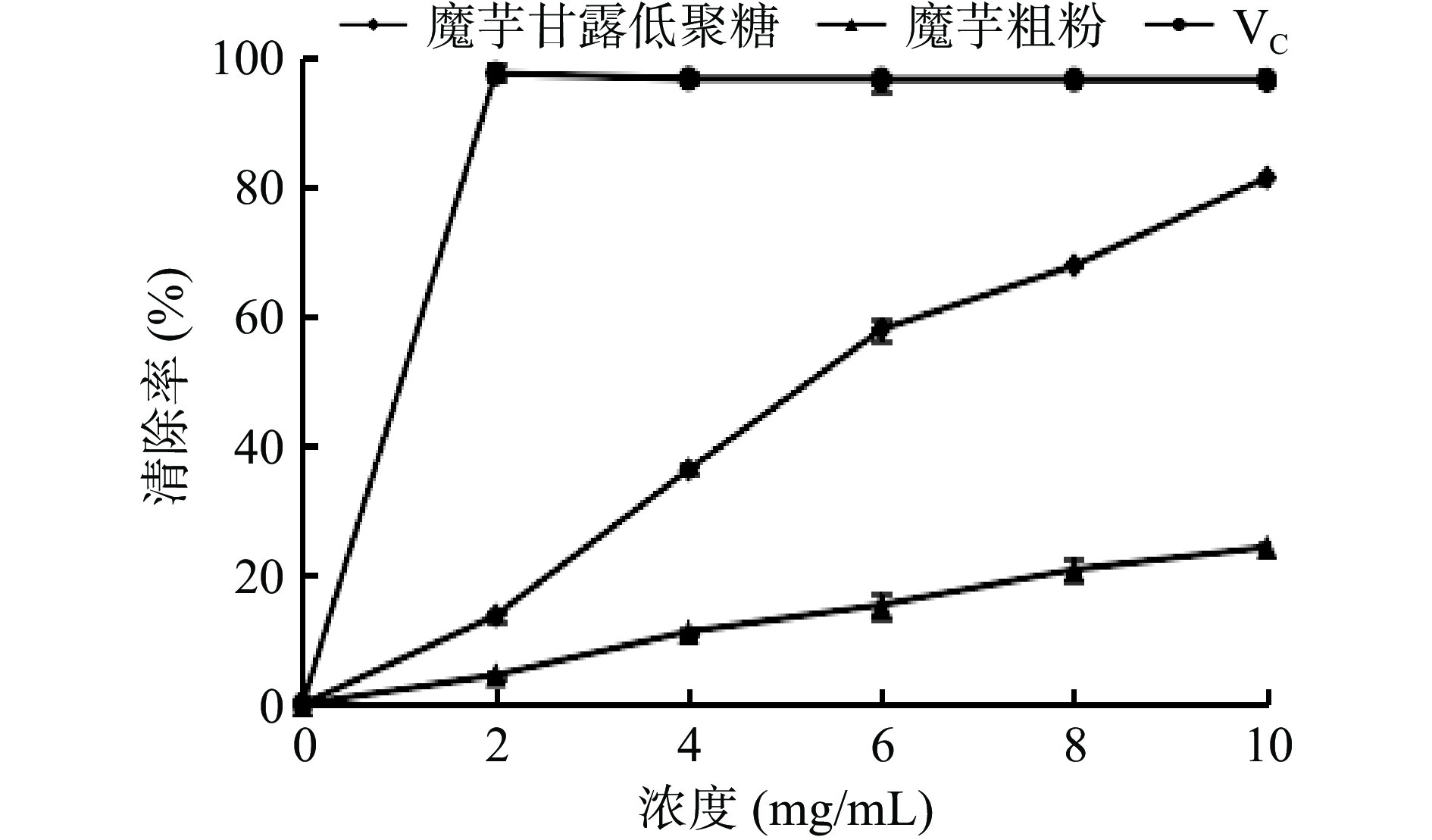
研究不同浓度的魔芋粗粉水解产物对OH自由基的清除率,结果如图7所示。
在所选浓度范围内,随着魔芋粗粉、魔芋粗粉水解产物浓度的增加,对OH自由基的清除率均逐渐增强,并且魔芋粗粉水解产物对OH自由基的清除率明显优于同浓度的魔芋粗粉溶液。当魔芋粗粉水解产物浓度为10 mg/mL时,对OH自由基的清除率达到最大,为61.47%。KGOS有显著的羟基自由基清除能力。试验表明由地衣芽孢杆菌水解魔芋粗粉制得KGOS对OH自由基的抗氧化能力显著。结合现有研究,这可能与低聚糖的糖醛酸含量、分子量大小和分支结构的差异有关,具体作用机理有待于进一步研究[35]。
2.6.2 魔芋粗粉水解产物对O2−自由基的清除率
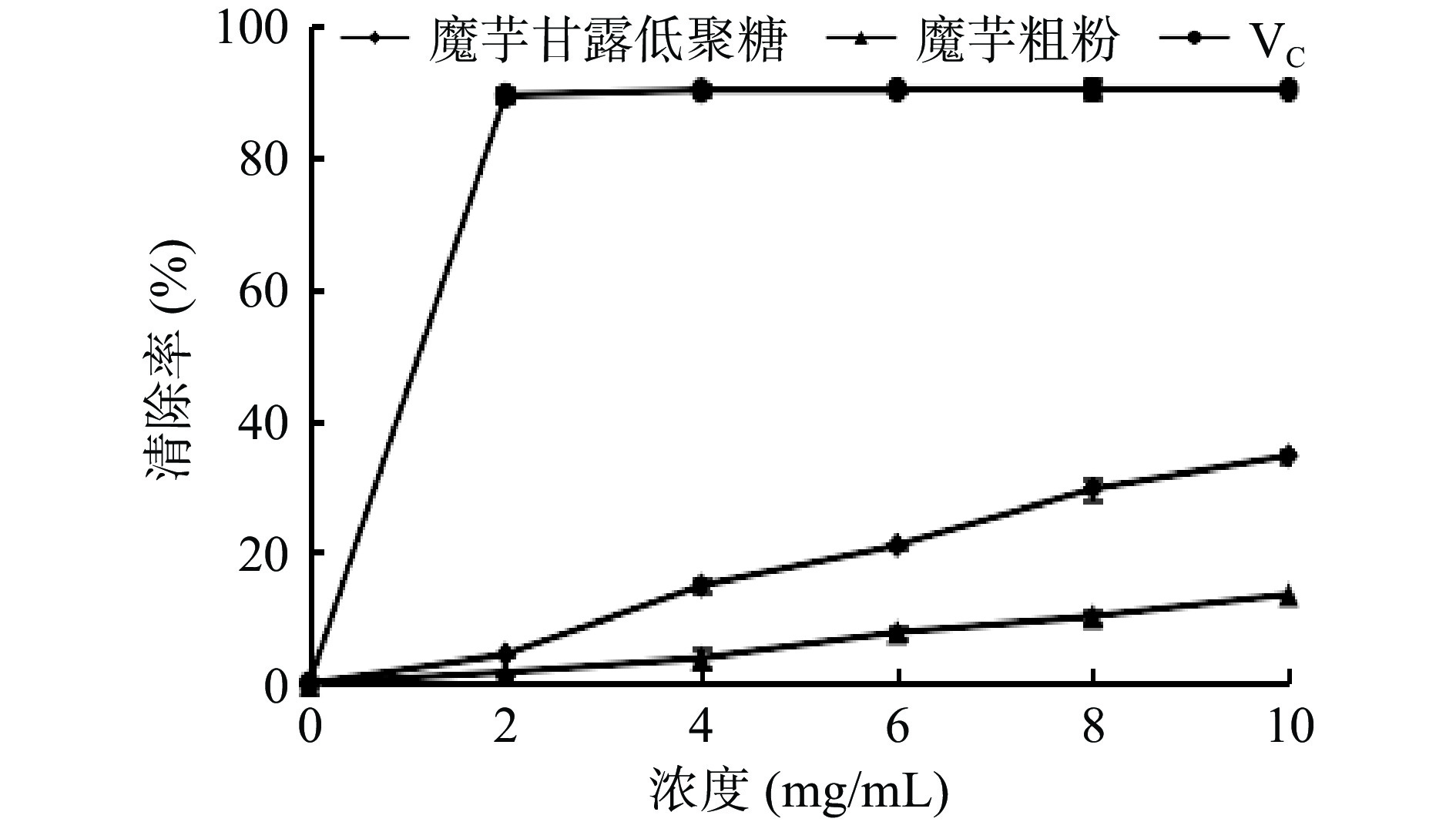
不同浓度的魔芋粗粉水解产物对O2−自由基的清除率如图8所示。
在所选浓度范围内,随魔芋粗粉、魔芋粗粉水解产物浓度的增加,对O2−自由基的清除率均逐渐增强,并且魔芋粗粉水解产物对O2−自由基的清除率明显优于同浓度的魔芋粗粉溶液。当魔芋粗粉水解产物的浓度为10 mg/mL时,对O2−自由基的清除率达到最大,为34.60%;同KGOS溶液对OH自由基的清除作用相比,魔芋粗粉水解产物对O2−自由基的清除能力较弱,这是由于两种自由基的结构不同,从而造成差异[36]。
2.6.3 魔芋粗粉水解产物对DPPH自由基的清除率
不同浓度的魔芋粗粉水解产物对DPPH自由基的清除率如图9所示。
在所选浓度范围内,随魔芋粗粉、魔芋粗粉水解产物浓度的增加,对DPPH自由基的清除率均逐渐增强,并且魔芋粗粉水解产物对DPPH自由基的清除率明显优于同浓度的魔芋粗粉溶液。当魔芋粗粉水解产物的浓度为10 mg/mL时,对DPPH自由基的清除率达到最大,为81.43%。试验发现KGOS对于DPPH自由基具有一定的清除作用,且随着水解率的上升,多糖及其衍生物的抗氧化活性将增强。
2.7 水解魔芋粗粉促进益生菌增殖作用
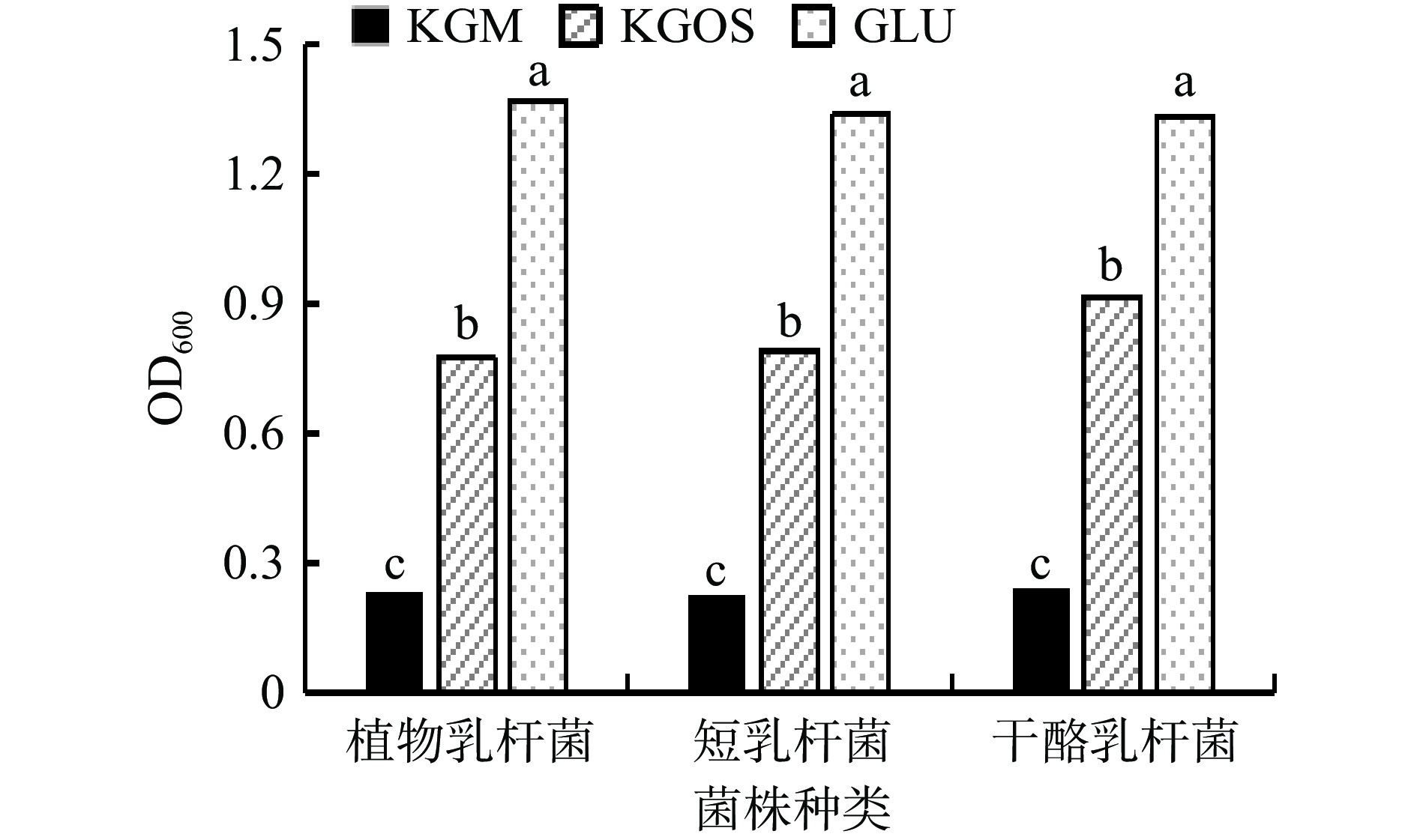
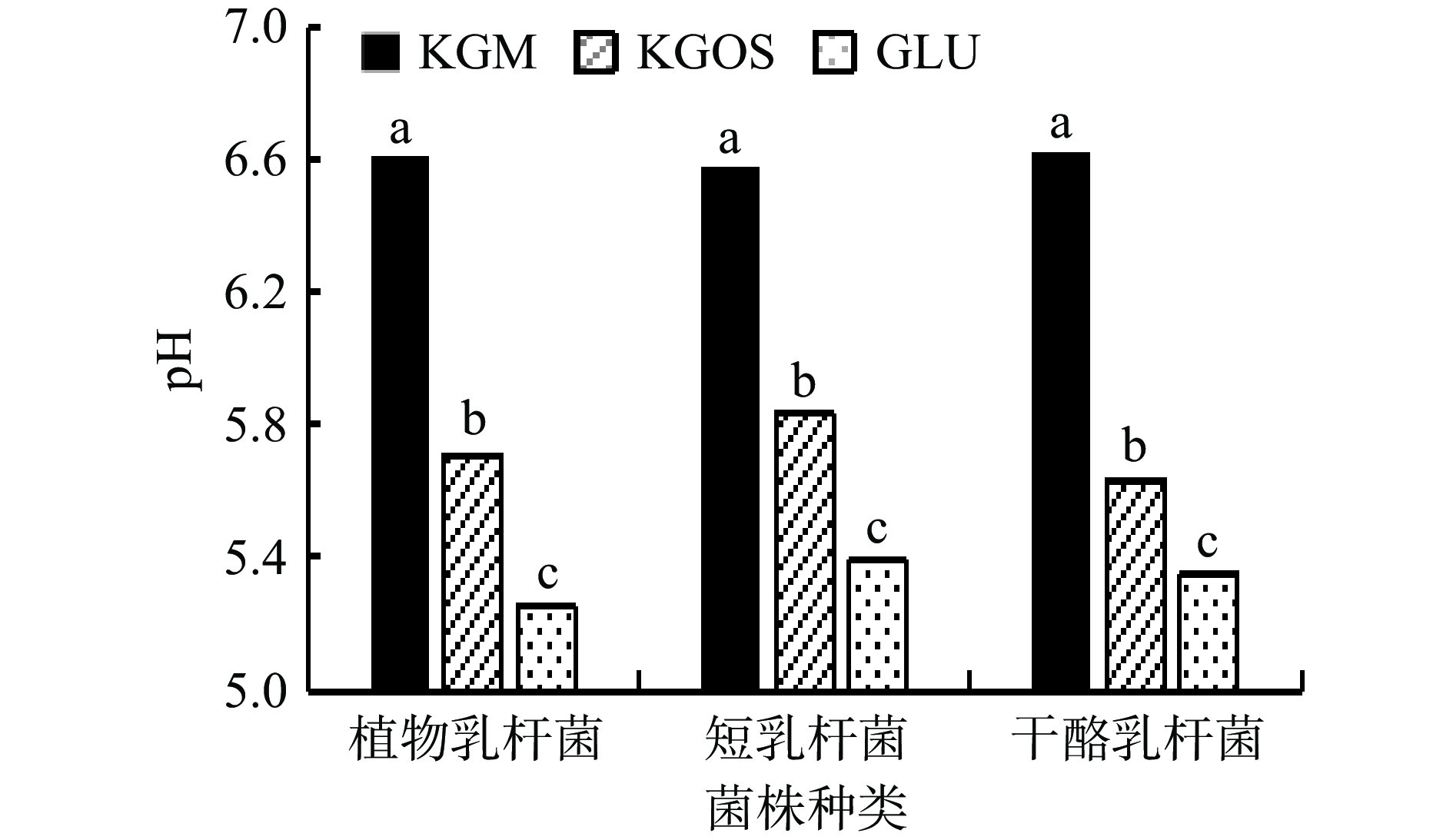
从对益生菌的影响来看,乳酸菌属作为公认的有益菌群,可以通过减少致病菌和提高免疫力来改善肠道微环境。但是由于胃酸的影响,使得摄入的乳酸菌活菌无法充分发挥功效,而低聚糖可以促进乳酸菌增殖。通过试验研究KGOS对于不同乳酸菌的增殖作用,同时比较KGOS与魔芋粗粉和葡萄糖对乳酸菌的增殖效果,结果如图10、图11所示。
乳酸菌在魔芋粗粉(A)、葡萄糖(B)、KGOS(C)三种碳源中培养24 h后,乳酸菌菌株浓度均为B>C>A,代谢产物pH均为A>C>B,可以得到KGOS对于三种乳酸菌的增殖效果介于魔芋粗粉和葡萄糖之间,表明KGOS对乳酸菌的生长具有一定的促进作用,且在相同条件下,促进乳酸菌产酸效果优于魔芋粗粉。葡萄糖属单糖,作为直接碳源时能迅速被菌株利用,菌株生长效果最好;KGOS多由小分子寡糖组成,菌株需分解其为单糖后方可利用;魔芋粗粉多为KGM,菌株不含特异性水解酶,无法分解获得单糖,只能利用其中少量的淀粉,因此菌株生长效果最差。根据机体消化代谢途径分析,KGOS较于KGM有更加广泛的益生元活性[37]。在研究中,KGOS对乳酸菌的体外增殖作用是可重复的,这表明由地衣芽孢杆菌水解魔芋粗粉产生的KGOS与乳酸菌体外增殖存在联系。
3. 结论
魔芋水解液与魔芋原浆经高温处理后,魔芋水解液中的生物碱含量显著低于魔芋原浆,因此热风烘干与菌解能脱除魔芋中的生物碱,同时菌解没有对魔芋主要成分造成不利影响,对于魔芋的开发利用具有积极影响[38]。
本研究利用地衣芽孢杆菌水解魔芋粗粉,通过薄层层析、抗氧化及体外发酵试验对所得KGOS进行结构分析和生理活性研究。研究得到的水解魔芋粗粉最优条件为:魔芋粗粉20 g/L,接菌量1×107 CFU/g,水解温度43.6 ℃,水解时间10.2 h,水解率可达39.06%,KGOS产率为66.72%。同时,溶液粘度下降至18.06 mPa·s。随着KGOS浓度的增加,魔芋粗粉水解产物对OH、O2−和DPPH自由基的清除能力均提高,并对3种乳酸菌具有一定的增殖作用。本研究为拓宽魔芋的应用范围提供了科学依据,为KGOS的一体化生产提供理论依据,也为魔芋葡甘低聚糖在食品领域的研究和开发提供理论支持和生产指导。
-
表 1 响应面试验因素水平设计
Table 1 Response surface test factor level design
水平 因素 A接菌量(CFU/g) B水解温度(℃) C水解时间(h) −1 1×106 40 8 0 1×107 43 10 1 1×108 46 12 表 2 魔芋粗粉指标测定结果
Table 2 Determination results of indicators of konjac crude powder
指标 结果 指标 结果 总糖(g/100 g) 71.82±1.37 水分(g/100 g) 10.51±0.53 KGM(g/100 g) 58.62±1.18 灰分(g/100 g) 3.49±0.31 还原糖(g/100 g) 1.18±0.09 pH 7.02±0.01 粗纤维(g/100 g) 2.13±0.11 粗蛋白(g/100 g) 7.35±0.63 粗脂肪(g/100 g) 0.26±0.02 淀粉(g/100 g) 13.96±0.21 表 3 响应面试验设计与结果
Table 3 Experimental design and results of response surface test
实验号 A 接菌量 B水解温度 C 水解时间 Y 水解率(%) 1 −1 0 −1 34.59 2 0 1 −1 37.03 3 0 0 0 39.74 4 1 1 0 34.91 5 1 0 1 35.85 6 −1 1 0 35.75 7 −1 −1 0 32.69 8 −1 0 1 36.56 9 0 0 0 38.66 10 0 0 0 39.04 11 0 −1 1 35.26 12 0 1 1 36.45 13 0 −1 −1 33.79 14 0 0 0 38.89 15 1 −1 0 34.24 16 0 0 0 39.37 17 1 0 −1 36.15 表 4 响应面试验方差分析
Table 4 Analysis of variance of response surface test
变异来源 平方和 自由度 均方 F值 P值 模型 70.65 9 7.85 64.22 < 0.0001 A 接菌量 0.30 1 0.30 2.49 0.1587 B 水解温度 8.32 1 8.32 68.10 < 0.0001 C 水解时间 0.82 1 0.82 6.70 0.0360 AB 1.43 1 1.43 11.68 0.0112 AC 1.29 1 1.29 10.54 0.0141 BC 1.05 1 1.05 8.60 0.0220 A2 22.15 1 22.15 181.25 < 0.0001 B2 25.25 1 25.25 206.58 < 0.0001 C2 4.72 1 4.72 38.62 0.0004 残差 0.86 7 0.12 失拟项 0.14 3 0.047 0.26 0.8511 纯误差 0.72 4 0.18 总和 71.50 16 R2=0.9880,R2Adj=0.9727 -
[1] 杨大伟, 卢智锋. 乙醇脱除魔芋粗粉三甲胺异味的效果研究[J]. 湖北民族学院学报(自然科学版),2014,32(1):1−4. [YANG Dawei, LU Zhifeng. Effect of ethanol on removing trimethlamine from konjac powder[J]. Journal of Hubei Minzu University (Natural Science Edition),2014,32(1):1−4. YANG Dawei, LU Zhifeng. Effect of ethanol on removing trimethlamine from konjac powder[J]. Journal of Hubei Minzu University (Natural Science Edition), 2014, 32(1): 1-4.
[2] LI Y, DENG R, CHEN N, et al. Review of konjac glucomannan: Isolation, structure, chain conformation and bioactivities[J]. Journal of Single Molecule Research,2013,1(1):7. doi: 10.12966/jsmr.07.03.2013
[3] NISHINARI K, WILLIAMS P A, PHILLIPS G O. Review of the physico-chemical characteristics and properties of konjac mannan[J]. Food Hydrocolloids,1992,6(2):199−222. doi: 10.1016/S0268-005X(09)80360-3
[4] 董振香, 顾秋亚, 李丹晨, 等. 不同分子质量魔芋甘露聚糖的制备及功效活性分析[J]. 食品与发酵工业,2020,46(8):48−53. [DONG Zhenxiang, GU Qiuya, LI Danchen, et al. Preparation and active component analysis of Konjac mannans with different molecular weights[J]. Food and Fermention Industries,2020,46(8):48−53. DONG Zhenxiang, GU Qiuya, LI Danchen, et al. Preparation and active component analysis of Konjac mannans with different molecular weights[J]. Food and Fermention Industries, 2020, 46(8): 48-53.
[5] 仝泽方, 李利军, 卢美欢, 等. 葡甘聚糖酶制备魔芋葡甘露低聚糖的工艺研究[J]. 中国调味品,2021,46(7):167−170. [TONG Zefang, LI Lijun, LU Meihuan, et al. Study on preparation process of konjac glucomannan oligosaccharide by glucomannase[J]. China Condiment,2021,46(7):167−170. TONG Zefang, LI Lijun, LU Meihuan, et al. Study on preparation process of konjac glucomannan oligosaccharide by glucomannase[J]. China Condiment, 2021, 46(7): 167-170.
[6] 周旻昱. 魔芋葡甘露低聚糖酶法制备及对肉鸡生理活性的研究[D]. 南京: 南京林业大学 ZHOU Wenyu. Study on the enzymatic hydrolysis of glucomannan from konjac and its probiotic activity in broilers[D]. Nanjing: Nanjing Forestry University, 2022.
[7] YIN Junyi, MA Luyao, XIE Mingyong, et al. Molecular properties and gut health benefits of enzyme-hydrolyzed konjac glucomannans[J]. Carbohydrate Polymers,2020,237:116117.
[8] 张晓. 食药用菌生物降解魔芋葡甘聚糖技术研究[D]. 武汉: 华中科技大学, 2015 ZHANG Xiao. Study on biodegradation of konjac glucomannan by edible and medicinal bacteria[D]. Wuhan: Huazhong University of Science and Technology. 2015
[9] 张盼文, 李浩, 徐钰红, 等. 一株来源于豆豉的地衣芽孢杆菌全基因组学及其风味物质形成分析[J]. 食品与发酵工业,2022,48(19):36−44. [ZHANG Panwen, LI Hao, XU Yuhong, et al. Whole genome and flavor formation analysiss of a Bacillus licheniformis strain from Douchi[J]. Food and Fermentation Industries,2022,48(19):36−44. ZHANG Panwen, LI Hao, XU Yuhong, et al. Whole genome and flavor formation analysiss of a Bacillus licheniformis strain from Douchi[J]. Food and Fermentation Industries, 2022, 48(19): 36-44.
[10] 李娅楠. 乳杆菌与地衣芽孢杆菌复合微贮对稻草营养价值影响及机理研究[D]. 银川: 宁夏大学, 2022 LI Yanan. Effect and mechanism research of compound silage of Lactobacillus and Bacillus licheniformis on nutritional value of rice straw[D]. Yinchuan: Ningxia University, 2022.
[11] WAN Xin, WEI Lusha, ZHANG Wei, et al. Production, characterization, and prebiotic activity of oligosaccharides from konjac glucomannan by Bacillus amyloliquefaciens WX-1[S]. Journal of Functional Foods, 2022, 88: 104872.
[12] 张百忍, 王显安, 张宝善. 魔芋[M]. 西安: 陕西出版传媒集团, 三秦出版社, 2014: 127−144 ZHANG Bairen, WANG Xian’an, ZHANG Baoshan. Konjac [M]. Xi'an: Shaanxi Publishing Media Group, Sanqin Publishing House, 2014: 127−144
[13] 刘佩瑛. 魔芋学[M]北京: 中国农业出版社, 2004: 285−295 LIU Peiying. Konjac[M] Beijing: China Agricultural Press, 2004: 285−295.
[14] 中华人民共和国国家卫生和计划生育委员会. GB 5009.3-2016食品安全国家标准 食品中水分的测定[S]. 北京: 中国标准出版社, 2016: 3 National Health and Family Planning Commission of the People’s Republic of China. GB 5009.3-2016 National food safety standard. Determination of water in food[S]. Beijing: China Standards Press, 2016: 3.
[15] 中华人民共和国农业部. 魔芋粉: NY/T 494-2010[S]. 北京: 中国农业出版社, 2010: 8−9 Ministry of Agriculture of the PRC. Konjac flour: NY/T 494-2010 [S]. Beijing: China Agriculture Press, 2010: 8−9.
[16] 中华人民共和国卫生部中国国家标准化管理委员会. GB/T 5009.10-2003 植物类食品中粗纤维的测定[S]. 北京: 中国标准出版社, 2003: 3 The Ministry of Health of the People’s Republic of China China National Standardization Administration. GB/T 5009.10-2003 Determination of crude fiber in plant food[S]. Beijing: China Standards Press, 2003: 3.
[17] 中华人民共和国国家卫生和计划生育委员会国家食品药品监督管理总局. GB 5009.5-2016 食品安全国家标准 食品中蛋白质的测定[S]. 北京: 中国标准质检出版社, 2016: 3−5 State Food and Drug Administration of the State Health and Family Planning Commission of the People’s Republic of China. GB 5009.5-2016 National food safety standard. Determination of protein in food[S]. Beijing: China Standards and Quality Inspection Press, 2016: 3−5.
[18] 国家食品药品监督管理总局国家卫生和计划生育委员会. GB 5009.6-2016 食品安全国家标准 食品中脂肪的测定[S]. 北京: 中国标准出版社, 2016: 3−4 State Health and Family Planning Commission of the State Food and Drug Administration. GB 5009.6-2016 National food safety standard. Determination of fat in food[S] Beijing: China Standards Press, 2016: 3−4.
[19] 国家卫生和计划生育委员会. GB 5009.4-2016 食品安全国家标准 食品中灰分的测定[S]. 北京: 中国标准出版社, 2016: 3−6 National Health and Family Planning Commission. GB 5009.4-2016 National food safety. Determination of ash in food[S] Beijing: China Standards Press, 2016: 3−6.
[20] 国家卫生和计划生育委员会. GB 5009.237-2016 食品安全国家标准 食品pH值的测定[S]. 北京: 中国标准出版社, 2016: 3−6 National Health and Family Planning Commission. GB 5009.237-2016 National food safety standard. Determination of food pH[S]. Beijing: Standards Press of China, 2016: 3−6.
[21] CHEN J, LIU D, SHI B, et al. Optimization of hydrolysis conditions for the production of glucomanno-oligosaccharides from konjac using β-mannanase by response surface methodology[J]. Carbohydrate Polymers,2013,93(1):81−88. doi: 10.1016/j.carbpol.2012.05.037
[22] ZHANG Yuan, ZHAO Yi, YANG Wanfu, et al. Structural complexity of konjac glucomannan and its derivatives governs the diversity and outputs of gut microbiota[J]. Carbohydrate Polymers,2022,292:119639. doi: 10.1016/j.carbpol.2022.119639
[23] 李文超. 特定聚合度魔芋低聚糖的筛选与制备技术研究[D]. 武汉: 华中科技大学, 2014 LI Wenchao. Screening and preparation technology analysis of konjac oligosaccharides with specific polymerization degree[D]. Wuhan: Huazhong University of Science and Technology, 2014.
[24] 郭丽萍. 不同水化与流变学性质魔芋葡甘露聚糖调控血糖和抑制肥胖的功能研究[D]. 无锡: 江南大学, 2021 GUO Liping. Study on the function of konjac glucomannan with different hydration and rheological properties in regulating glycemic response and preventing obesity[D]. Wuxi: Nanjing University. 2021
[25] 张敏. 微波-酶法从野皂荚胶制备半乳甘露低聚糖技术研究[D]. 南京: 南京农业大学, 2008 ZHANG Min. Study on preparation of galacto-mannan-oligosaccharides by microwave-enzyme hydrolysis of g. heterophylla gum in technology[D]. Nanjing: Nanjing Agricultural University, 2008.
[26] LI W A, PZZ A, JWS B, et al. Physicochemical properties and bioactivities of original and Se-enriched polysaccharides with different molecular weights extracted from Pleurotus ostreatus[J]. International Journal of Biological Macromolecules,2019,141:150−160. doi: 10.1016/j.ijbiomac.2019.08.250
[27] CHENG H, HUANG G. Extraction, characterisation and antioxidant activity of Allium sativum polysaccharide[J]. International Journal of Biological Macromolecules,2018,114:415−419. doi: 10.1016/j.ijbiomac.2018.03.156
[28] WU Caiyun, LI Tianlin, QI Jing, et al. Effects of lactic acid fermentation-based biotransformation on phenolic profiles, antioxidant capacity and flavor volatiles of apple juice[J]. LWT, 2020, 122: 109064.
[29] 李斌, 谢笔钧. 魔芋葡甘聚糖凝胶机理研究[J]. 中国农业科学,2002,35(11):1411−1415. [LI Bin, XIE Bijun. Study on the gelatin mechanism of konjac glucomannans[J]. Scientia Agricultura Sinica,2002,35(11):1411−1415. LI Bin, XIE Bijun. Study on the gelatin mechanism of konjac glucomannans[J]. Scientia Agricultura Sinica, 2002, 35(11): 1411-1415.
[30] YIN J Y, MA L Y, XIE M Y, et al. Molecular properties and gut health benefits of enzyme-hydrolyzed konjac glucomannans[J]. Carbohydrate Polymers,2020,237:116117. doi: 10.1016/j.carbpol.2020.116117
[31] JIAN W J, SUNY M, HUANG H, et al. Study on preparation and separation of konjac oligosaccharides[J]. Carbohydrate Polymers,2013,92(2):1218−1224. doi: 10.1016/j.carbpol.2012.09.065
[32] 郑梅霞, 朱育菁, 刘波, 等. 黄原胶的流变性及与魔芋胶等的协效性研究[J]. 食品工业科技,2016,37(8):303−306,322. [ZHENG Meixia, ZHU Yujing, LIU Bo, et al. Study on the rheology of xanthan and synergistic interaction with konjac gum and other gump[J]. Science and Technology of Food Industry,2016,37(8):303−306,322. ZHENG Meixia, ZHU Yujing, LIU Bo, et al. Study on the rheology of xanthan and synergistic interaction with konjac gum and other gump[J]. Science and Technology of Food Industry, 2016, 37(8): 303-306, 322.
[33] JANA U K, KANGO N. Characteristics and bioactive properties of mannooligosaccharides derived from agro-waste mannans[J]. International Journal of Biological Macromolecules,2020,149:931−940. doi: 10.1016/j.ijbiomac.2020.01.304
[34] QU W J, FENG Y T, XIONG T, et al. Preparation of corn ACE inhibitory peptide-ferrous chelate by dual-frequency ultrasound and its structure and stability analyses[J]. Ultrasonics Sonochemistry,2022,83:105937. doi: 10.1016/j.ultsonch.2022.105937
[35] 常相娜, 陈雪峰, 苏瑶. 酶解苹果渣中多糖的结构分析及其体外抗氧化活性[J]. 陕西科技大学学报,2022,40(5):63−69. [CHANG Xiangna, CHEN Xuefeng, SU Yao, et al. Structure analysis and in vitro antioxidant activity of polysaccharides fro enzymatic hydrolysis apple pomace[J]. Journal of Shaanxi University of Science & Technology,2022,40(5):63−69. CHANG Xiangna, CHEN Xuefeng, SU Yao, et al. Structure analysis and in vitro antioxidant activity of polysaccharides fro enzymatic hydrolysis apple pomace[J]. Journal of Shaanxi University of Science & Technology, 2022, 40(5): 63-69.
[36] 王艳妮. 魔芋全粉酶解方法及其特性研究[D]. 长沙: 湖南农业大学, 2019 WANG Yanni. Study on properties and enzymatic hydrolysis method of konjac powder[D]. Changsha: Hunan Agricultural University, 2019.
[37] 葛珍珍, 许明月, 靳学远, 等. 脱乙酰基魔芋葡甘聚糖理化性质及其对凉皮质构和体外消化的影响[J]. 食品科学,2023,44(4):85−90. [GE Zhenzhen, XU Mingyue, JIN Xueyuan, et al. The physicochemical properties of deacetyiated konjac giucomannan and its effects on the quality andin vitro digestion of liangpi[J]. Food Science,2023,44(4):85−90. GE Zhenzhen, XU Mingyue, JIN Xueyuan, et al. The physicochemical properties of deacetyiated konjac giucomannan and its effects on the quality and in vitro digestion of liangpi[J]. Food Science, 2023, 44(4): 85−90.
[38] 孟凡冰, 王小燕, 范定涛, 等. 脱敏魔芋粉制备集成技术初探及其对魔芋粉理化性质的影响[J]. 食品科学,2015,36(2):63−68. [MENG Fanbing, WANG Xiaoyan, FAN Dingtao et al. Preparation of konjac flour by combined use of different techniques and its physicochemical properties[J]. Food Science,2015,36(2):63−68. MENG Fanbing, WANG Xiaoyan, FAN Dingtao et al. Preparation of konjac flour by combined use of different techniques and its physicochemical properties[J]. Food Science, 2015, 36(2): 63-68.
-
期刊类型引用(1)
1. 于博涵,吴紫涵,曾琦. 一种植物质可持续服饰品材料的设计与应用. 皮革科学与工程. 2024(04): 66-72+80 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



