Effect of Methyl Jasmonate Treatment on Phenylpropanoid Pathway in Fresh-cut Melon during Storage
-
摘要: 茉莉酸甲酯(methyl jasmonate,MeJA)是一种天然存在的内源物质和信号分子,在植物胁迫应激反应和生长发育过程中起到调节作用。以“西州蜜-17”甜瓜为试材,采用100 μmol/L MeJA 20 ℃熏蒸20 h,研究其对鲜切甜瓜贮藏期间总酚含量和苯丙烷代谢途径关键酶活性和基因表达水平的影响。结果表明:切分前MeJA处理能够显著提高贮藏期间鲜切甜瓜总酚含量,增加苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)、肉桂酸4-羟化酶(cinnamate 4-hydroxylase,C4H)和4-香豆酸-CoA连接酶(4-coumarate: CoA ligase,4CL)活性,同时还发现MeJA处理提高了贮藏期间鲜切甜瓜CmPAL1/2/3、CmPAL5-9、CmC4H1/2/4和Cm4CL1/2的表达量(P<0.05)。由此表明,切分前MeJA处理能提高贮藏期间鲜切甜瓜苯丙烷代谢的水平,诱导酚类物质的积累。Abstract: Methyl jasmonate (MeJA), as a natural endogenous substance and a signal molecule, plays an important role in stress response and development in plant. The effect of MeJA fumigation (100 μmol/L, treatment at 20 ℃ for 20 h) on phenylpropanoid pathway during storage of 'Xizhoumi-17' melon was assayed in this study. Results showed that MeJA treatment significantly increased the total phenolics content, and enhanced the activities of phenylalanine ammonia-lyase (PAL), cinnamate 4-hydroxylase (C4H) and 4-coumarate: CoA ligase (4CL) (P<0.05). In addition, the expression of CmPAL1/2/3, CmPAL5-9, CmC4H1/2/4, and Cm4CL1/2 was also upregulated by MeJA treatment (P<0.05). Taken together, these results imply that MeJA treatment of fresh-cut melon would elevate the phenylpropanoid pathway and lead to the accumulation of phenolics.
-
Keywords:
- fresh-cut /
- melon /
- methyl jasmonate /
- phenylpropanoid metabolic /
- phenolic compounds
-
甜瓜(Cucumis melo L.)属于葫芦科(Cucurbitaceae)南瓜族(Trib. CUCURBITEAE Ser)黄瓜属(Cucumis),是世界第五大产量水果[1]。目前我国甜瓜品种资源约有三百种,其栽培面积和产量均居世界首位[2]。甜瓜果实肉质甘美,风味独特,营养丰富,鲜切甜瓜具有新鲜、营养、卫生、方便等特点,常作为旅游休闲食品或餐后水果食用,深受消费者的喜爱[3]。然而切分损伤会导致果蔬生理代谢紊乱和货架期缩短,加速品质劣变进程、营养水平降低等[4]。基于此,国内外许多学者关注鲜切产品品质变化研究,以期能更好的保持鲜切产品品质、保障物流中鲜切产品的安全性及运输后的货架期[5-6]。
切分是鲜切果蔬加工必不可少的一道工序,切分损伤诱导植物自身启动应答机制,通过一系列复杂的代谢途径生成酚类物质,达到修复愈合伤口的目的[7-8]。酚类物质作为一种重要的抗氧化物质,其含量也被作为衡量果蔬抗氧化能力的主要指标。在高等植物中,酚类物质的合成起始于莽草酸途径,经苯丙烷代谢途径生成最终产物。在不同切分方式的胡萝卜[9]和火龙果[10]中苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活性和酚类物质含量的变化保持一致,说明切分损伤强度越大,苯丙烷代谢越强。切分可以诱导胡萝卜、马铃薯和火龙果等果蔬酚类物质的积累,这可作为酚类物质生产新途径[9-11]。Li等[7]发现茉莉酸甲酯(methyl jasmonate,MeJA)和切分损伤可协同诱导糖的利用和转化,从而为鲜切火龙果伤口诱导的酚类物质积累提供必需的前体和能量。研究表明,外源MeJA可作为一种外源信号因子,不仅能够调节植物生长发育,促进植物合成次级代谢产物,还可参与植物防御信号的转导过程,激活多种胁迫应答基因,诱导防御基因的表达以及防御反应物质的生成,调控植物的系列连锁防御反应,提高植物对生物或非生物胁迫的抗性[12-14]。MeJA无毒、无污染,可作为传统化学杀菌剂的替代物用于果蔬贮藏保鲜[15-16]。目前已在番茄、草莓、枇杷、柑橘、菜心、火龙果、菠萝等多种果蔬采后施用MeJA,发现MeJA对这些果蔬的贮藏品质、生理代谢、抗病性、抗冷性产生了较为显著的影响[17-19]。
外源施用MeJA可减轻机械损伤对鲜切果蔬品质的影响,能够有效抑制微生物对受伤部位的侵染以及果蔬组织内部的酶促褐变,改善鲜切果蔬贮藏品质[20]。国内外学者一致认为适宜浓度的MeJA处理鲜切果蔬可以显著提高其商业价值[20],而MeJA如何改善鲜切果蔬贮藏品质,如何调控鲜切果蔬营养物质的代谢的研究还很少。本研究以“西州蜜-17”甜瓜为材料,切分前采用MeJA熏蒸,探索其对贮藏期间鲜切甜瓜苯丙烷代谢的影响,以期为MeJA处理改善鲜切甜瓜的品质和贮藏性能提供理论依据。
1. 材料与方法
1.1 材料与仪器
“西州蜜-17”甜瓜 从廊坊甜瓜种植农户中收获无机械损伤、无病虫害的商业成熟甜瓜(开花后45 d;硬度11.17±0.31 N;可溶性固形物含量13.18%±0.35%),并在2 h内运至实验室,20 ℃贮藏24 h以散去田间热。
MeJA、β-巯基乙醇、Folin-Ciocalteu试剂 美国Sigma公司;三磷酸腺苷(adenosine triphosphate,ATP)、反式肉桂酸、亮抑肽酶、苯甲基磺酰氟(benzylsulfonyl fluoride,PMSF)、三羟甲基氨基甲烷(Tris)、葡萄糖-6-磷酸钠盐、p-香豆酸、辅酶A 北京索莱宝科技有限公司;碳酸钠、氯化镁、硼酸、抗坏血酸(ascorbic acid,AsA)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、L-苯丙氨酸、盐酸、EDTA 国药集团化学试剂有限公司;植物RNA提取试剂盒(DP441) 天根生化科技(北京)有限公司;反转录试剂盒(RR036A)、SYBR®PremixEx Taq™(RR420A)试剂 宝生物工程(大连)有限公司。
WFJUV-2802PC型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;Applied Biosystems 7500 PCR仪 美国应用生物系统公司;FRESCO17型高速离心机 美国赛默飞世尔科技公司;XW-80A型漩涡仪 上海沪西分析仪器厂。
1.2 实验方法
1.2.1 实验设计
课题组采用不同浓度的MeJA(10、50、100和200 μmol/L)熏蒸甜瓜,研究发现切分前采用100和200 μmol/L MeJA熏蒸甜瓜可显著延长鲜切甜瓜贮藏期,增加其抗氧化性(数据未显示)。参照前期研究结果,将甜瓜随机分为两组,一组(30个果实)采用100 μmol/L MeJA于20 ℃熏蒸20 h(MeJA组);另一组(30个果实)不熏蒸作为对照组(CK组)。待到熏蒸结束后,将两组甜瓜果实同时切分,将果肉切分成2 cm×2 cm×2 cm左右大小的块状,置于透明聚丙烯塑料的一次性保鲜盒内(尺寸为:长17 cm×宽11.5 cm×高6 cm,厚0.4 mm),每盒果重120±10 g。将切分好的果实分别于贮藏柜中贮藏(5 ℃,相对湿度90%)。在第0、2、4、6、8 d进行鲜切甜瓜取样,样品立即用液氮冷冻,并储存在−80 ℃以备后续指标的测定。
1.2.2 总酚含量测定
总酚含量的测定参照Slinkard等[21]的方法。取20.0 g甜瓜冷冻样品进行研磨,然后取甜瓜粉末2.0 g,加入25 mL预冷的甲醇溶液,充分振荡混匀后,置于4 ℃冰箱中过夜(12 h)浸提酚类物质。提取液于4 ℃、12000×g离心15 min,上清液用于总酚含量的测定。反应体系包括:0.2 mL提取液、1.8 mL蒸馏水、1 mL Folin-Ciocalteu试剂和1 mL 7.5% Na2CO3溶液。反应液于25 ℃水浴温育2 h后,在765 nm处测定其吸光值,总酚含量以每克鲜重中没食子酸当量表示。
1.2.3 苯丙烷代谢相关酶活性测定
PAL活性的测定参照Zhou等[22]的方法。取20.0 g甜瓜冷冻样品进行研磨,然后取甜瓜粉末2.0 g,加入5 mL 50 mmol/L预冷的硼酸-硼砂缓冲液(pH8.8,内含5 mmol/L β-巯基乙醇、2 mmol/L EDTA和40 g/L PVP),充分混匀4 ℃浸提10 min。浸提液于4 ℃、12000×g离心15 min,上清液用于PAL活性测定。反应体系包括:1 mL酶粗提液、2 mL 50 mmol/L硼酸-硼砂缓冲液(pH8.8,内含5 mmol/L β-巯基乙醇和2 mmol/L EDTA)和0.5 mL 20 mmol/L苯丙氨酸溶液。反应体系于37 ℃水浴中温育1 h后,立即加入0.2 mL 6 mol/L盐酸溶液终止反应,于290 nm处测定反应前后吸光度值。一个PAL活性单位(U)定义为在A290吸光度每分钟变化0.01,并基于鲜重含量表示为U/g。
肉桂酸4-羟化酶(cinnamate 4-hydroxylase,C4H)活性的测定参照Zhou等[22]的方法。取20.0 g甜瓜冷冻样品进行研磨,然后取甜瓜粉末2.0 g,加入5 mL 50 mmol/L Tris-HCl缓冲液(pH8.9,含有10 μmol/L亮抑肽酶、1 mmol/L PMSF、4 mmol/L MgCl2、5 mmol/L AsA、15 mmol/L β-巯基乙醇、0.15% PVP(m/v)和10%丙三醇(v/v)),混匀4 ℃浸提10 min。浸提液于4 ℃、12000×g离心15 min,上清液用于C4H活性测定。反应体系包括:0.5 mL酶粗提液和1.0 mL 50 mmol/L Tris-HCl缓冲液(pH8.9,内含2 mmol/L反式肉桂酸、5 μmol/L葡萄糖-6-磷酸钠盐和2 mmol/L NADP)。反应体系在25 ℃孵育30 min,立即加入0.1 mL 6 mol/L盐酸溶液终止反应,分别在340 nm处测量孵育前后的吸光值。一个C4H活性单位(U)定义为在A340吸光度每分钟变化0.01,并基于鲜重含量表示为U/g。
4-香豆酸-CoA连接酶(4-coumarate: CoA ligase,4CL)活性的测定参照Zhou等[22]的方法。取20.0 g甜瓜冷冻样品进行研磨,然后取甜瓜粉末2.0 g,加入5 mL 50 mmol/L Tris-HCl缓冲液(pH8.0),混匀4 ℃浸提10 min。浸提液于4 ℃、12000×g离心15 min,上清液用于4CL活性测定。反应体系包括:2 mL 5 mmol/L MgCl2,0.5 mL 5 mmol/L ATP,0.05 mL 0.6 mmol/L p-香豆酸,0.05 mL 0.4 mmol/L辅酶A和0.5 mL酶粗提液。反应体系于40 ℃孵育30 min。分别在333 nm处测量孵育前后的吸光值。以在A333每分钟变化0.01吸光值为一个4CL酶活力单位(U),并基于鲜物质含量表示为U/g。
1.2.4 苯丙烷代谢关键基因的表达分析
从葫芦科植物基因网站CuGenDB通过酶名称搜索鉴定关键基因,并根据课题组先前的转录组数据筛选出15个苯丙烷代谢关键基因。参照Wu等[23]的方法,使用RNAprep Pure Plant Kit试剂盒(DP441,天根生化)按照试剂盒说明书从每个样品中提取总RNA。采用凝胶电泳实验确定RNA完整性。提取的RNA立即使用PrimeScript TM RT Master Mix试剂盒(RR036A,TaKaRa)反转成cDNA,反转生成的cDNA使用SYBR®PremixEx Taq™(RR420A,TaKaRa)试剂和Applied Biosystems 7500 PCR系统进行荧光定量分析。qRT-PCR扩增程序为:95 ℃预变性30 s;95 ℃变性3 s,60 ℃退火34 s,循环40次。特异性引物利用Primer 6.0软件进行设计,引物序列如表1所示,熔解曲线用于判定引物的特异性。
表 1 鲜切甜瓜苯丙烷代谢关键基因qRT-PCR引物序列Table 1. Primer sequence of genes involved in phenylpropanoid pathway for qRT-PCR in fresh-cut melon基因名称 基因编号 上游引物 下游引物 退火温度(℃) CmPAL1 MELO3C014223 AGGAACAAGGCTTTGCATGG GCTCGGGTTTCTACTTGCAG 56.1 CmPAL2 MELO3C014224 GCTGAGGCTGCCTTTAAACA CCTACAGCAGTGCCATTGAC 56.0 CmPAL3 MELO3C014226 GGGAAGCTCATGTTTGCTCA TGCTCAGCACTTTGAACATGA 55.5 CmPAL4 MELO3C014227 CTGCAAGCAGAAACCCAAGT GTTGCTCAGCACTTTGGACA 56.1 CmPAL5 MELO3C014228 CTGCAAGCAGAAACCCAAGT GTTGCTCAGCACTTTGGACA 56.1 CmPAL6 MELO3C014229 GCAGAGGGAGCTCATACGAT GTAGCCTTGAAGGAGGGTGT 56.1 CmPAL7 MELO3C017809 CTGGTGAAGCTTGGAGGAGA AGTGCCTTTACCCATGCTCT 56.0 CmPAL8 MELO3C017810 AGAGCATGGGTAAAGGCACT TTGTTGCGGAATGAGGCAAA 56.0 CmPAL9 MELO3C017811 CTGGTGAAGCTTGGAGGAGA AGTGCCTTTACCCATGCTCT 56.0 CmC4H1 MELO3C003932 GCCAAGTTCTCCATGCTCAG CATCCTCCCACATGCCACTA 56.2 CmC4H2 MELO3C019585 CAGAGCTAGTGAACCACCCA GGAGGTATGGGAGCTTGTGT 56.1 CmC4H3 MELO3C003933 GCTTGCTAGCCAAGTTCTCC TCTACGCATCTTACGCCAGT 56.0 CmC4H4 MELO3C003934 GGAATTCAGGCCAGAGAGGT TTCTTCTTCCAACGCCGAAC 56.1 Cm4CL1 MELO3C023493 TCCCGACATTCACATTCCCA CCGTAAGCTGAACGTCATGG 56.2 Cm4CL2 MELO3C024886 ATGAAGATCGTCGACACCGA TGCCTCCGGATTGTTGAGAT 56.1 β-actin MELO3C023264 CCGTTCTGTCCCTCTATGCT AGTAAGGTCACGACCAGCAA 56.0 1.3 数据处理
以上实验均设3个生物学重复,数据结果以平均值±标准差表示。使用SPSS 25.0进行单因素方差分析(ANOVA),采用邓肯多重比较进行差异显著性检验,P<0.05为差异显著。利用Origin 8.5软件进行绘图。同一贮藏时间点,不同厚度误差线上所标注的小写字母不同表示差异显著。
2. 结果与分析
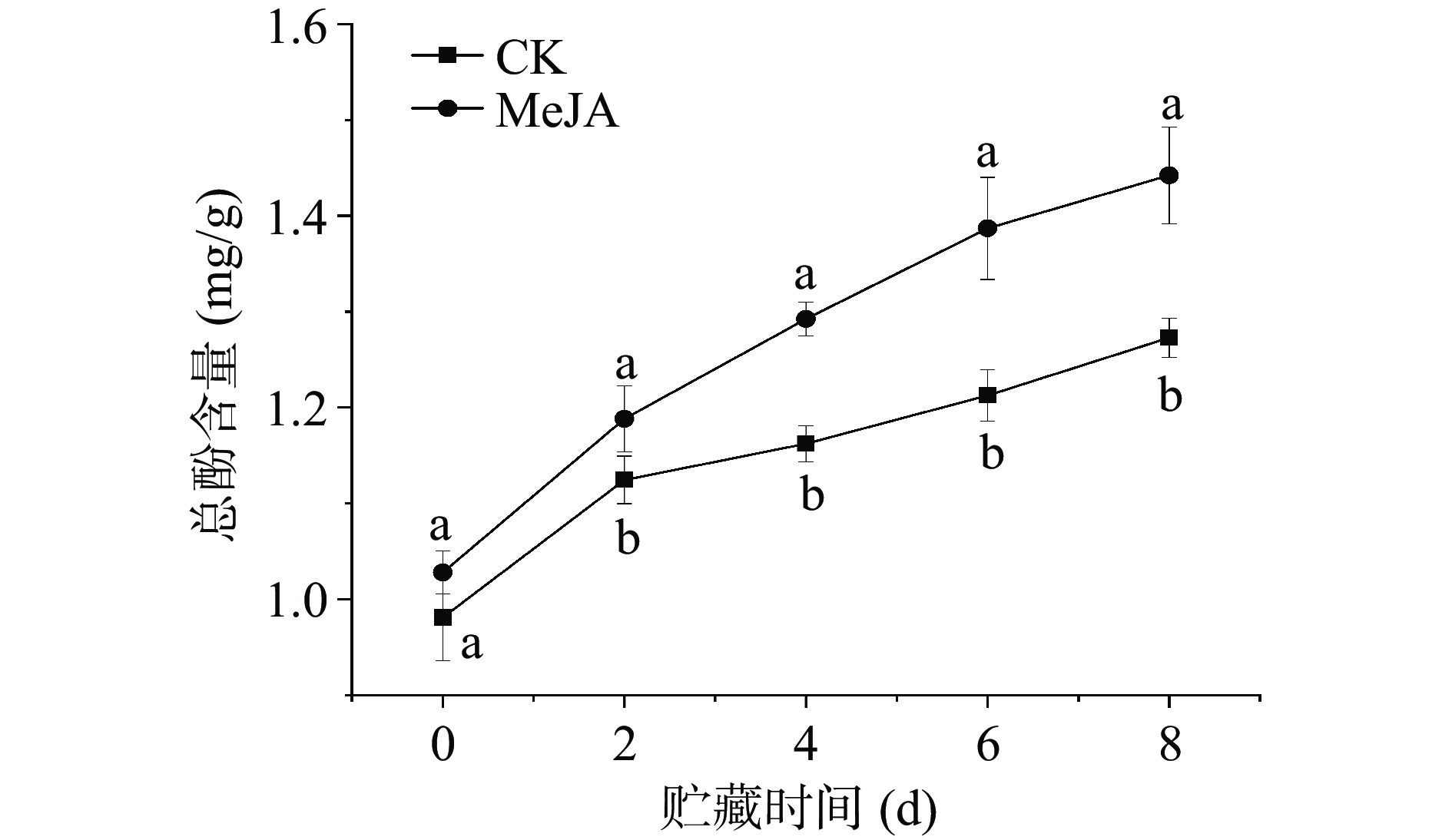
2.1 MeJA处理对鲜切甜瓜总酚含量的影响
如图1所示,鲜切甜瓜总酚含量随着贮藏时间的延长而增加。与对照组相比,MeJA处理组鲜切甜瓜总酚含量在第0 d无显著差异;在贮藏的第2~8 d,MeJA处理组鲜切甜瓜的总酚含量显著高于对照组(P<0.05)。在贮藏第6 d时,MeJA处理组总酚含量达到1.38 mg/g,比对照组高14.36%,两组总酚含量出现最大差值。由此可见,切分前MeJA处理能够有效增加贮藏期间鲜切甜瓜总酚含量;这可能是由于MeJA处理能启动鲜切甜瓜的防御反应,诱导酚类物质积累,以抵御其受到的切分损伤[24]。
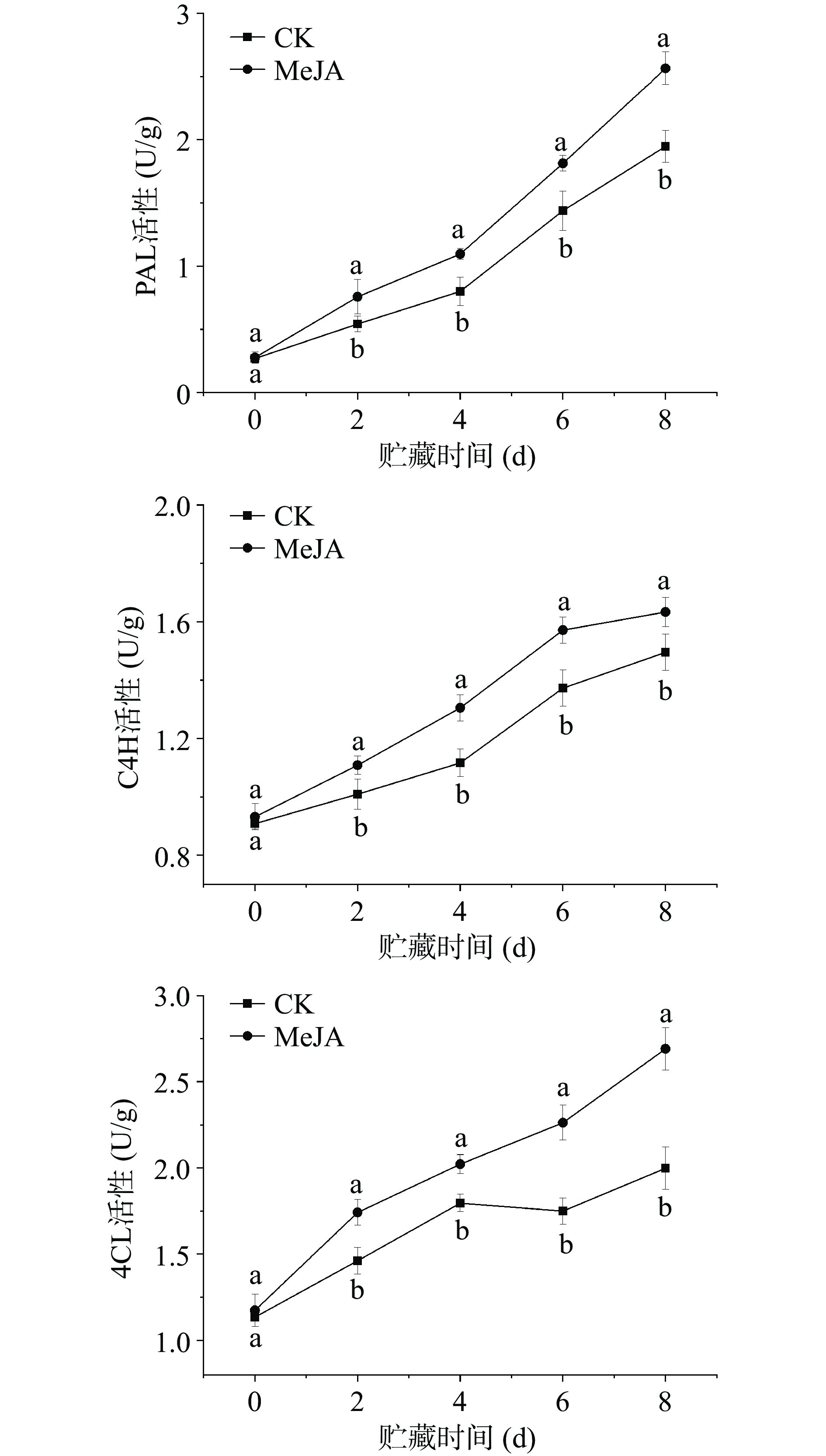
2.2 MeJA处理对苯丙烷代谢关键酶活性的影响
PAL、C4H和4CL是苯丙烷代谢途径的关键酶,其活性的大小与酚类物质、木质素合成等密切相关[25]。在贮藏期间,两组鲜切甜瓜PAL活性均呈增加趋势,且MeJA处理组鲜切甜瓜的PAL活性一直显著高于对照组(P<0.05),在第8 d时,MeJA处理组鲜切甜瓜PAL活性为2.56 U/g,比对照组高出31.63%;与对照组相比,尽管第2 d MeJA处理组鲜切甜瓜PAL活性增加较小,但其高出39.86%。这意味着MeJA处理能够迅速提高鲜切甜瓜PAL活性,且在贮藏期间一直具有促进作用。
与PAL类似,鲜切甜瓜C4H和4CL的活性在贮藏期间也呈现增加趋势,且MeJA处理组鲜切甜瓜的C4H和4CL活性在贮藏期间一直显著高于对照组(P<0.05)。在贮藏结束时,MeJA处理组鲜切甜瓜的C4H和4CL活性分别为1.63和2.69 U/g,分别比对照组高出9.23%和34.63%。这说明甜瓜切分前MeJA处理可提高贮藏期间的C4H和4CL活性。这可能是因为MeJA作为一种信号分子,可通过调节PAL、C4H和4CL活性,促进苯丙烷代谢途径,增强果实组织对切分损伤的适应性[13, 26]。
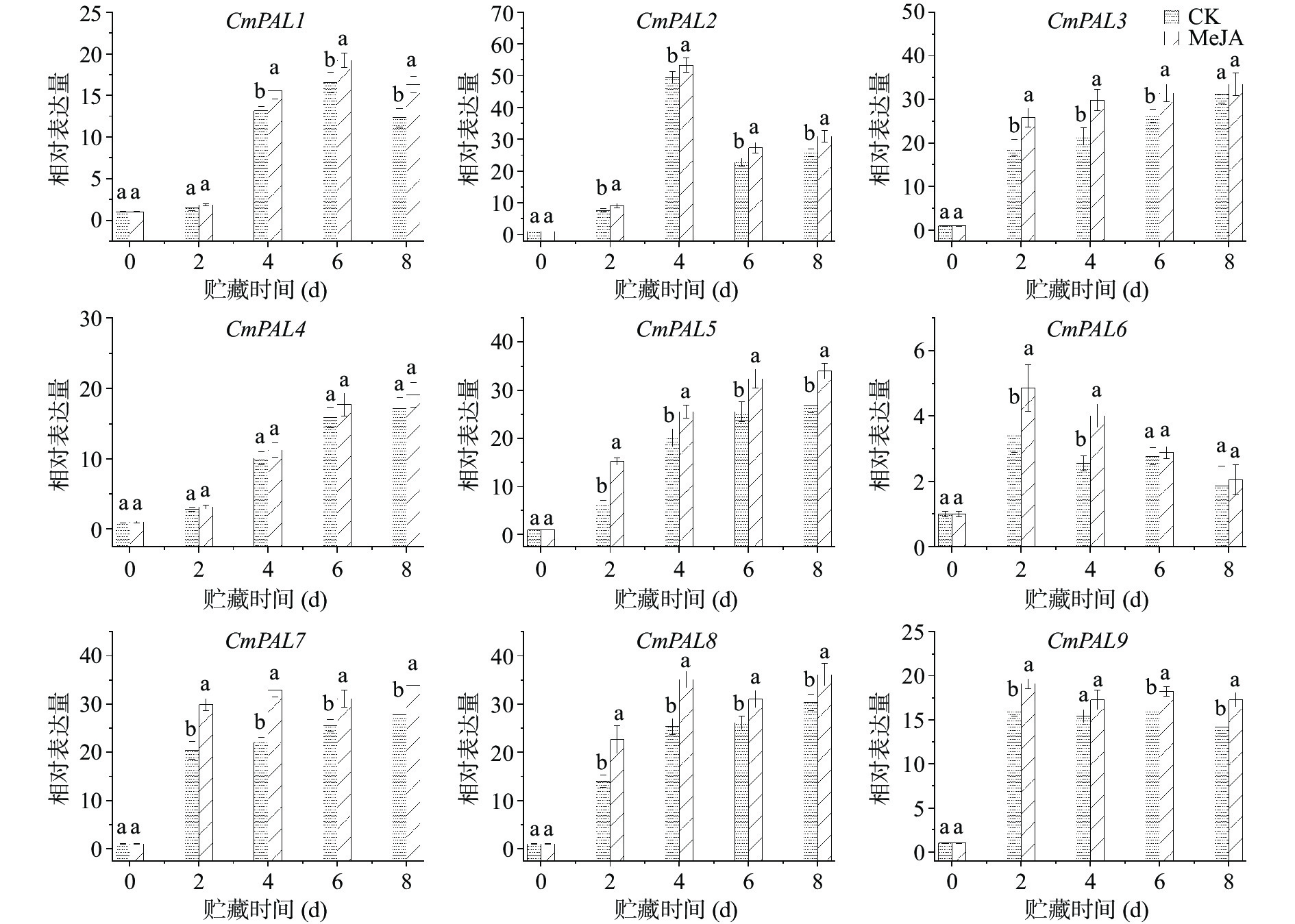
2.3 MeJA处理对苯丙烷代谢关键酶基因表达的影响
根据课题组先前的转录组数据筛选出9个PAL基因(图3),贮藏期间其表达量均比第0 d高。与对照组相比,MeJA处理组鲜切甜瓜的CmPAL1表达水平在贮藏前2 d无显著差异;从第4 d开始到贮藏结束,MeJA处理组鲜切甜瓜的CmPAL1表达水平均显著高于对照组(P<0.05)。鲜切甜瓜CmPAL2/6的表达水平在贮藏期间表现出先升高后降低的趋势,MeJA处理能显著提高贮藏期间鲜切甜瓜CmPAL2的表达,但MeJA处理组鲜切甜瓜CmPAL6的表达水平只在第2 d和第4 d比对照组高(P<0.05)。鲜切甜瓜CmPAL3/5/7/8表达水平与贮藏时间呈正相关,除了第8 d,两组鲜切甜瓜CmPAL3的表达水平无显著性差异外,MeJA处理组鲜切甜瓜的CmPAL3/5/7/8表达水平均显著高于对照组(P<0.05)。尽管鲜切甜瓜CmPAL4的表达水平在贮藏期间也随着贮藏时间的增加而增加,贮藏结束时MeJA处理组和对照组鲜切甜瓜CmPAL4的表达量分别比第0 d提高了19.09和17.12倍,但贮藏期间两组鲜切甜瓜CmPAL4表达量无显著差异。对照组鲜切甜瓜CmPAL9的表达量在贮藏的第2 d急剧增加(与第0 d相比,增加了14.17倍),然后保持在相对稳定的水平,同时MeJA处理组鲜切甜瓜CmPAL9表达量的变化与对照组变化相同,除第4 d外,MeJA处理组鲜切甜瓜CmPAL9表达量均显著高于对照组(P<0.05)。这些结果表明,甜瓜切分前MeJA处理能显著提高贮藏期间鲜切甜瓜CmPAL1/2/3和CmPAL5-9的表达,增强苯丙烷代谢,以缓解其受到的切分损伤[27]。
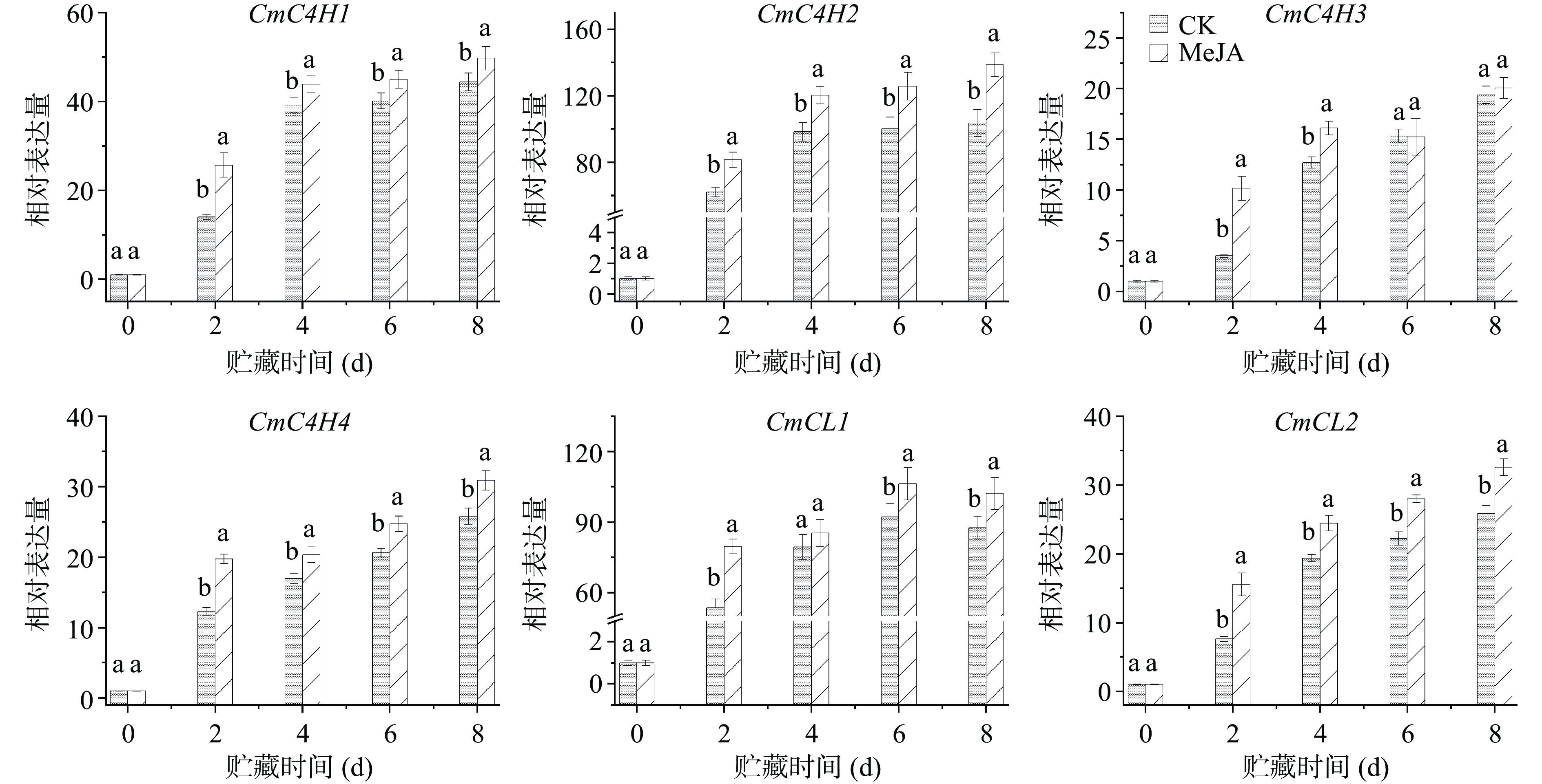
如图4所示,鲜切甜瓜贮藏期间有4个C4H基因和2个4CL基因差异表达。通过qRT-PCR实验结果显示,贮藏期间鲜切甜瓜C4H基因表达量均随着贮藏时间的延长而增加;且MeJA处理组鲜切甜瓜的CmC4H1/2/4表达量在整个贮藏期间均显著高于对照组。与CmC4H1/2/4不同,MeJA处理组鲜切甜瓜CmC4H3表达量只在贮藏前4 d显著高于对照组,在贮藏后期(第6~8 d)保持与对照组相似的基因表达水平。同时,研究还发现MeJA处理也可增强鲜切甜瓜Cm4CL1/2的表达,只有MeJA处理组鲜切甜瓜Cm4CL1在贮藏的第4 d保持着与对照组相似的表达水平。两组甜瓜Cm4CL1表达量在贮藏第4 d无显著差异,可能是由于第4 d取样果实中基因的差异表达导致的。综上,甜瓜切分前MeJA处理能提高贮藏期间鲜切甜瓜苯丙烷代谢途径相关酶的基因表达。
3. 讨论
植物受到机械损伤等非生物胁迫时,机体本身会触发自身防御机制来抵御来自外界的伤害,甚至还可以通过正常的生理代谢修复机械损伤带来的伤害。MeJA已经在火龙果[7]、马铃薯[22]和草莓[16]等果蔬中应用以促进果蔬的酚类物质积累。综合前人的研究成果,结合本实验研究表明,果蔬发生切分会导致酚类物质在果蔬体内累积,而甜瓜切分前MeJA处理可以促进鲜切甜瓜酚类物质的积累[26, 28]。
鲜切甜瓜总酚含量在贮藏期间随着贮藏时间延长而增加,切分前MeJA处理能够促进鲜切甜瓜贮藏期间酚类物质的积累(图1)。PAL是苯丙烷代谢途径中的关键酶,它也是植物体内合成酚类物质的限速酶[29]。研究表明,MeJA可通过激活果实防御系统,激活PAL和过氧化物酶等植物抗性酶[24, 30]。这些防御酶可通过诱导组织中酚类物质、木质素等次生代谢产物合成,间接提高果蔬对生物和非生物胁迫的耐受性。通过本研究发现,鲜切甜瓜PAL活性随着贮藏时间的延长呈现出持续增加的趋势,且MeJA处理显著增加鲜切甜瓜PAL活性(图2);这与MeJA处理在鲜切火龙果[26]和鲜切马铃薯[22]贮藏研究中得到的结论一致,说明MeJA可以通过提高PAL活性增强苯丙烷代谢,导致果蔬酚类物质积累。MeJA还可以通过激活PAL等酶的基因表达,调节果蔬组织中的苯丙烷代谢[13, 31-32]。为了更进一步揭示切分前MeJA处理对鲜切甜瓜贮藏期间酚类物质积累的分子机理,借助于课题组先前的转录组学研究,探究甜瓜贮藏期间差异表达的15个基因。通过qRT-PCR分析发现,MeJA处理可以提高贮藏期间鲜切甜瓜8个PAL基因(CmPAL1/2/3和CmPAL5-9)的表达水平(图3),这在基因水平上也验证了上述结论。这与Li等[26]发现切分前MeJA处理可以增加鲜切火龙果贮藏前期的HuPAL的表达水平保持一致。PAL基因在植物中的表达具有明显组织特异性,植物体内PAL基因普遍由小的多基因家族组成,拟南芥PAL亚型由AtPAL1-4基因家族编码[33-36]。本研究发现贮藏期间鲜切甜瓜不同PAL基因对MeJA处理具有不同程度的响应,也证实了PAL可能具有多样化的转录调控过程。
C4H催化肉桂酸羟化作用产生4-香豆酸盐,是苯丙烷途径中继PAL之后的第二个关键酶,最近的研究表明植株受到外界刺激时能够促进C4H基因的表达[37]。4CL是苯丙烷代谢途径流向下游的关键酶,在生成不同的产物过程中起转折作用[38]。在鲜切火龙果[26]和鲜切马铃薯[22]中,均发现切分和MeJA处理可以协同调控PAL、C4H和4CL活性,诱导酚类物质积累。与鲜切甜瓜贮藏期间PAL活性变化相似,本实验发现MeJA处理能够显著提高贮藏期间鲜切甜瓜C4H和4CL活性(图2)。这可能是因为在植物苯丙烷代谢途径中,C4H、4CL可与PAL相互协同表达,完成苯丙烷代谢后续反应[39]。作为苯丙烷途径中的关键酶,PAL、C4H和4CL被认为在植物组织受到胁迫诱导中起重要作用,起到防御反应并直接参与植物受伤部位酚类物质的生物合成,以保护和治愈致伤性损伤[40]。水杨酸处理可提高金刺梨果实中苯丙烷代谢关键酶PAL和4CL的活性,促进金刺梨果实总酚和木质素的积累[29]。Zhou等[22]采用250 μmol/L MeJA浸泡鲜切马铃薯块15 min,发现切分后MeJA处理也可提高PAL、C4H和4CL的酶活性和基因表达量,诱导鲜切马铃薯块酚类物质的积累。相比于PAL,C4H在植物的不同组织中均具有较高表达量。与PAL类似,C4H的基因拷贝数在不同植物中也不尽相同,在拟南芥中只有1个拷贝[41],而苜蓿中有2个[42]。本研究发现MeJA处理刺激了贮藏期间鲜切甜瓜CmC4H1/2/4和Cm4CL1/2的表达(图4)。这意味着C4H和4CL基因可以响应MeJA信号,在鲜切甜瓜响应胁迫和激素信号中具有重要作用,MeJA处理增加了鲜切甜瓜果实总酚含量也证实了这一结论。Cheng等[43]发现银杏GbC4H基因可响应水杨酸和脱落酸信号,增加其表达量以提升银杏抵御胁迫的能力。不同的4CL同系物对羟基肉桂酸衍生物的偏好不同,同时4CL基因表达模式也具有明显差异。基因共表达分析结果显示,拟南芥At4CL1/2/4参与木质素合成,而At4CL3参与黄酮类物质合成[44-45]。尽管上述鲜切甜瓜苯丙烷代谢基因表达水平与酚类物质呈正相关,苯丙烷代谢基因如何精准调控酚类物质积累,还需进一步探究。Li等[26]也发现MeJA可以增加鲜切火龙果HuPAL、HuC4H和Hu4CL的表达量,启动防御反应,诱导酚类物质积累,这一结论与本研究保持一致。汪开拓等[46]也发现MeJA可诱导草莓PAL、4CL和C4H活性的上升,从而有效延缓其酚类和花色苷类物质含量的下降。结合上述研究成果,推断鲜切甜瓜中MeJA激活苯丙烷途径的代谢与防御反应的启动有关,而不是直接诱导[26]。然而MeJA是如何启动果蔬防御反应,以及和切分损伤诱导的ROS等信号是如何相互作用的还需要探究[28]。
4. 结论
综上所述,MeJA处理通过提高鲜切甜瓜CmPAL1/2/3、CmPAL5-9、CmC4H1/2/4和Cm4CL1/2的表达量,增加PAL、C4H和4CL活性,增强苯丙烷代谢,启动其防御反应,诱导鲜切甜瓜贮藏期间酚类物质的增加。但是MeJA是如何调控这些基因的表达量,以及它们在时空表达的先后顺序还未可知;这需要进一步采用其它分子手段探究MeJA诱导鲜切甜瓜酚类物质积累的分子机理。
-
表 1 鲜切甜瓜苯丙烷代谢关键基因qRT-PCR引物序列
Table 1 Primer sequence of genes involved in phenylpropanoid pathway for qRT-PCR in fresh-cut melon
基因名称 基因编号 上游引物 下游引物 退火温度(℃) CmPAL1 MELO3C014223 AGGAACAAGGCTTTGCATGG GCTCGGGTTTCTACTTGCAG 56.1 CmPAL2 MELO3C014224 GCTGAGGCTGCCTTTAAACA CCTACAGCAGTGCCATTGAC 56.0 CmPAL3 MELO3C014226 GGGAAGCTCATGTTTGCTCA TGCTCAGCACTTTGAACATGA 55.5 CmPAL4 MELO3C014227 CTGCAAGCAGAAACCCAAGT GTTGCTCAGCACTTTGGACA 56.1 CmPAL5 MELO3C014228 CTGCAAGCAGAAACCCAAGT GTTGCTCAGCACTTTGGACA 56.1 CmPAL6 MELO3C014229 GCAGAGGGAGCTCATACGAT GTAGCCTTGAAGGAGGGTGT 56.1 CmPAL7 MELO3C017809 CTGGTGAAGCTTGGAGGAGA AGTGCCTTTACCCATGCTCT 56.0 CmPAL8 MELO3C017810 AGAGCATGGGTAAAGGCACT TTGTTGCGGAATGAGGCAAA 56.0 CmPAL9 MELO3C017811 CTGGTGAAGCTTGGAGGAGA AGTGCCTTTACCCATGCTCT 56.0 CmC4H1 MELO3C003932 GCCAAGTTCTCCATGCTCAG CATCCTCCCACATGCCACTA 56.2 CmC4H2 MELO3C019585 CAGAGCTAGTGAACCACCCA GGAGGTATGGGAGCTTGTGT 56.1 CmC4H3 MELO3C003933 GCTTGCTAGCCAAGTTCTCC TCTACGCATCTTACGCCAGT 56.0 CmC4H4 MELO3C003934 GGAATTCAGGCCAGAGAGGT TTCTTCTTCCAACGCCGAAC 56.1 Cm4CL1 MELO3C023493 TCCCGACATTCACATTCCCA CCGTAAGCTGAACGTCATGG 56.2 Cm4CL2 MELO3C024886 ATGAAGATCGTCGACACCGA TGCCTCCGGATTGTTGAGAT 56.1 β-actin MELO3C023264 CCGTTCTGTCCCTCTATGCT AGTAAGGTCACGACCAGCAA 56.0 -
[1] ORTIZ-DUARTE G, PÉREZ-CABRERA L E, ARTÉS-HERNÁNDEZ F, et al. Ag-Chitosan nanocomposites in edible coatings affect the quality of fresh-cut melon[J]. Postharvest Biology and Technology,2019,147:174−184. doi: 10.1016/j.postharvbio.2018.09.021
[2] 杨迎. 河北省设施甜瓜施氮的纳米碳溶胶调控技术研究[D]. 保定: 河北农业大学, 2020 YANG Y. Study on nano-carbon sol control technology of nitrogen application in facilities melon in Hebei province[D]. Baoding: Hebei Agricultural University, 2020.
[3] WU Z, TU M, YANG X, et al. Effect of cutting and storage temperature on sucrose and organic acids metabolism in postharvest melon fruit[J]. Postharvest Biology and Technology,2020,161:111081. doi: 10.1016/j.postharvbio.2019.111081
[4] HODGES D M, TOIVONEN P M A. Quality of fresh-cut fruits and vegetables as affected by exposure to abiotic stress[J]. Postharvest Biology and Technology,2008,48(2):155−162. doi: 10.1016/j.postharvbio.2007.10.016
[5] 罗海波, 姜丽, 余坚勇, 等. 鲜切果蔬的品质及贮藏保鲜技术研究进展[J]. 食品科学,2010,31(3):307−311. [LUO H B, JIANG L, YU J Y, et al. Current advances in preservation technology of fresh-cut fruits and vegetables[J]. Food Science,2010,31(3):307−311. LUO H B, JIANG L, YU J Y, et al. Current advances in preservation technology of fresh-cut fruits and vegetables[J]. Food Science, 2010, 31(3): 307-311.
[6] 时月, 李玥, 王宇滨, 等. 丁香油-壳聚糖复合膜涂膜处理对鲜切甜瓜品质的影响[J]. 食品工业科技,2021,42(24):278−283. [SHI Y, LI Y, WANG Y B, et al. Effect of clove oil-chitosan composite film coating on qualities of fresh-cut melon[J]. Science and Technology of Food Industry,2021,42(24):278−283. doi: 10.13386/j.issn1002-0306.2021030294 SHI Y, LI Y, WANG Y B, et al. Effect of clove oil-chitosan composite film coating on qualities of fresh-cut melon[J]. Science and Technology of Food Industry, 2021, 42(24): 278−283. doi: 10.13386/j.issn1002-0306.2021030294
[7] LI X, LI M, WANG J, et al. Methyl jasmonate enhances wound-induced phenolic accumulation in pitaya fruit by regulating sugar content and energy status[J]. Postharvest Biology and Technology,2018,137:106−112. doi: 10.1016/j.postharvbio.2017.11.016
[8] 韩聪. 鲜切胡萝卜酚类物质合成积累及其调控机理研究[D]. 南京: 南京农业大学, 2017 HAN C. Biosynthesis and accumulation of phenolic compounds in fresh-cut carrot and its possible regulatory mechanisms[D]. Nanjing: Nanjing Agricultural University, 2017.
[9] BECERRA-MORENO A, BENAVIDES J, CISNEROS-ZEVALLOS L, et al. Plants as biofactories: glyphosate-induced production of shikimic acid and phenolic antioxidants in wounded carrot tissue[J]. Journal of Agricultural and Food Chemistry,2012,60(45):11378−11386. doi: 10.1021/jf303252v
[10] LI X, LONG Q, GAO F, et al. Effect of cutting styles on quality and antioxidant activity in fresh-cut pitaya fruit[J]. Postharvest Biology and Technology,2017,124:1−7. doi: 10.1016/j.postharvbio.2016.09.009
[11] TORRES-CONTRERAS A M, NAIR V, CISNEROS-ZEVALLOS L, et al. Plants as biofactories: stress-induced production of chlorogenic acid isomers in potato tubers as affected by wounding intensity and storage time[J]. Industrial Crops and Products,2014,62:61−66. doi: 10.1016/j.indcrop.2014.08.018
[12] WASTERNACK C, HAUSE B. Jasmonates and octadecanoids: Signals in plant stress responses and development[M]. Progress in Nucleic Acid Research and Molecular Biology. Academic Press. 2002: 165-221.
[13] 赵曼如, 胡文忠, 于皎雪, 等. 茉莉酸甲酯对果蔬抗性、抗氧化活性及品质影响的研究进展[J]. 食品工业科技,2020,41(4):328−332. [ZHAO M R, HU W Z, YU J X, et al. Research progress on effects of methyl jasmonate on resistance, antioxidant activity and quality of fruits and vegetables[J]. Science and Technology of Food Industry,2020,41(4):328−332. doi: 10.13386/j.issn1002-0306.2020.04.056 ZHAO M R, HU W Z, YU J X, et al. Research progress on effects of methyl jasmonate on resistance, antioxidant activity and quality of fruits and vegetables[J]. Science and Technology of Food Industry, 2020, 41(4): 328-332. doi: 10.13386/j.issn1002-0306.2020.04.056
[14] 李丽, 董银卯, 姚霞, 等. 茉莉酸甲酯对植物酚类成分代谢影响研究进展[J]. 中药材,2014,37(11):2109−2112. [LI L, DONG Y M, YAO X, et al. Research progress on effects of methyl jasmonate on metabolism of phenolic components in plants[J]. Journal of Chinese Medicinal Materials,2014,37(11):2109−2112. LI L, DONG Y M, YAO X, et al. Research progress on effects of methyl jasmonate on metabolism of phenolic components in plants. Journal of Chinese Medicinal Materials, 2014, 37(11): 2109-2112.
[15] ERDAL A, BURHAN O. Effects of pre-harvest methyl jasmonate treatments on fruit quality of fuji apples during cold storage[J]. Uluslararası Tarım ve Yaban Hayatı Bilimleri Dergisi,2018,4:13−19. doi: 10.24180/ijaws.366304
[16] VAEZI S, ASGHARI M, FAROKHZAD A, et al. Exogenous methyl jasmonate enhances phytochemicals and delays senescence in harvested strawberries by modulating GABA shunt pathway[J]. Food Chemistry,2022,393:133418. doi: 10.1016/j.foodchem.2022.133418
[17] SARACOGLU O, OZTURK B, YILDIZ K, et al. Pre-harvest methyl jasmonate treatments delayed ripening and improved quality of sweet cherry fruits[J]. Scientia Horticulturae,2017,226:19−23. doi: 10.1016/j.scienta.2017.08.024
[18] WANG L, YANG X, DAI B, et al. 1-Methylcyclopropylene or methyl jasmonate-induced chilling tolerance in a stony hard peach cultivar[J]. Scientia Horticulturae,2022,304:111279. doi: 10.1016/j.scienta.2022.111279
[19] DESHI V, HOMA F, GHATAK A, et al. Exogenous methyl jasmonate modulates antioxidant activities and delays pericarp browning in litchi[J]. Physiology and Molecular Biology of Plants,2022,28(8):1561−1569. doi: 10.1007/s12298-022-01230-3
[20] 闫媛媛, 胡文忠, 姜爱丽, 等. 茉莉酸甲酯的信号分子作用及其在鲜切果蔬中应用的研究进展[J]. 食品工业科技,2015,36(2):384−387,391. [YAN Y Y, HU W Z, JIANG A L, et al. Research progress on the role of methyl jasmonate as signal molecules and application in fresh-cut fruits and vegetables[J]. Science and Technology of Food Industry,2015,36(2):384−387,391. YAN Y Y, HU W Z, JIANG A L, et al. Research progress on the role of methyl jasmonate as signal molecules and application in fresh-cut fruits and vegetables[J]. Science and Technology of Food Industry, 2015, 36(2): 384-387, 391.
[21] SLINKARD K, SINGLETON V. Total phenol analysis: Automation and comparison with manual methods[J]. American Journal of Enology and Viticulture,1977,28:49−55. doi: 10.5344/ajev.1977.28.1.49
[22] ZHOU F, JIANG A, FENG K, et al. Effect of methyl jasmonate on wound healing and resistance in fresh-cut potato cubes[J]. Postharvest Biology and Technology,2019,157:110958. doi: 10.1016/j.postharvbio.2019.110958
[23] WU Z, TU M, YANG X, et al. Effect of cutting on the reactive oxygen species accumulation and energy change in postharvest melon fruit during storage[J]. Scientia Horticulturae,2019,257:108752. doi: 10.1016/j.scienta.2019.108752
[24] 姜爱丽, 周福慧, 胡文忠, 等. 采后茉莉酸甲酯处理对蓝莓果实抗病性的影响[J]. 包装工程,2018,39(17):75−83. [JIANG A L, ZHOU F H, HU W Z, et al. Effect of postharvest methyl jasmonate treatment on blueberry fruit disease resistance during storage[J]. Packaging Engineering,2018,39(17):75−83. JIANG A L, ZHOU F H, HU W Z, et al. Effect of postharvest methyl jasmonate treatment on blueberry fruit disease resistance during storage[J]. Packaging Engineering, 2018, 39(17): 75-83.
[25] 高红豆, 胡文忠, 管玉格, 等. 鲜切果蔬酚类物质的产生及其调控研究进展[J]. 食品工业,2020,41(4):212−216. [GAO H D, HU W Z, GUAN Y G, et al. The advances of the production and regulation in phenols of fresh-cut fruits and vegetables[J]. The Food Industry,2020,41(4):212−216. GAO H D, HU W Z, GUAN Y G, et al. The advances of the production and regulation in phenols of fresh-cut fruits and vegetables[J]. The Food Industry, 2020, 41(4): 212-216.
[26] LI X, LI M, WANG L, et al. Methyl jasmonate primes defense responses against wounding stress and enhances phenolic accumulation in fresh-cut pitaya fruit[J]. Postharvest Biology and Technology,2018,145:101−107. doi: 10.1016/j.postharvbio.2018.07.001
[27] 闫媛媛, 胡文忠, 姜爱丽, 等. 茉莉酸甲酯和乙烯利处理对鲜切富士苹果抗氧化酶活力和苯丙烷代谢的影响[J]. 食品工业科技,2015,36(16):324−327,32. [YAN Y Y, HU W Z, JIANG A L, et al. Effect of antioxidant enzyme activity and phenylpropanoid metabolism to jasmonic acid methyl ester (MeJA) of and ethephon treatments for fresh-cut apple[J]. Science and Technology of Food Industry,2015,36(16):324−327,32. YAN Y Y, HU W Z, JIANG A L, et al. Effect of antioxidant enzyme activity and phenylpropanoid metabolism to jasmonic acid methyl ester (MeJA) of and ethephon treatments for fresh-cut apple[J]. Science and Technology of Food Industry, 2015, 36(16): 324-327, 32.
[28] SURJADINATA B B, JACOBO-VELÁZQUEZ D A, CISNEROS-ZEVALLOS L. Physiological role of reactive oxygen species, ethylene, and jasmonic acid on UV light induced phenolic biosynthesis in wounded carrot tissue[J]. Postharvest Biology and Technology,2021,172:111388. doi: 10.1016/j.postharvbio.2020.111388
[29] 董柏余, 汤洪敏, 姚秋萍, 等. 采后水杨酸处理对金刺梨果实活性氧和苯丙烷代谢的影响[J]. 食品工业科技,2021,42(17):308−315. [DONG B Y, TANG H M, YAO Q P, et al. Effects of salicylic acid treatment on reactive oxygen species metabolism and phenylpropanoid pathway in rosa sterilis[J]. Science and Technology of Food Industry,2021,42(17):308−315. DONG B Y, TANG H M, YAO Q P, et al. Effects of salicylic acid treatment on reactive oxygen species metabolism and phenylpropanoid pathway in rosa sterilis[J]. Science and Technology of Food Industry, 2021, 42(17): 308−315.
[30] WANG K, JIN P, HAN L, et al. Methyl jasmonate induces resistance against penicillium citrinum in chinese bayberry by priming of defense responses[J]. Postharvest Biology and Technology,2014,98:90−97. doi: 10.1016/j.postharvbio.2014.07.009
[31] MA L, ZHANG M, BHANDARI B, et al. Recent developments in novel shelf life extension technologies of fresh-cut fruits and vegetables[J]. Trends in Food Science and Technology,2017,64:23−38. doi: 10.1016/j.jpgs.2017.03.005
[32] 盘柳依, 赵显阳, 陈明, 等. 外源茉莉酸甲酯处理对采后猕猴桃果实品质和抗氧化酶活性的影响[J]. 食品与发酵工业,2019,45(9):190−196. [PAN L Y, ZHAO X Y, CHEN M, et al. Effects of exogenous methyl jasmonate on fruit qualities and antioxidases activities of postharvest kiwifruits[J]. Food and Fermentation Industries,2019,45(9):190−196. PAN L Y, ZHAO X Y, CHEN M, Et al. Effects of exogenous methyl jasmonate on fruit qualities and antioxidases activities of postharvest kiwifruits[J]. Food and Fermentation Industries, 2019, 45(9): 190-196.
[33] 郝向阳, 孙雪丽, 王天池, 等. 植物PAL基因及其编码蛋白的特征与功能研究进展[J]. 热带作物学报,2018,39(7):1452−1461. [HAO X Y, SUN X L, WANG T C, et al. Characteristics and functions of plant phenylalanine ammonia lyase genes and the encoded proteins[J]. Chinese Journal of Tropical Crops,2018,39(7):1452−1461. doi: 10.3969/j.issn.1000-2561.2018.07.028 HAO X Y, SUN X L, WANG T C, et al. Characteristics and functions of plant phenylalanine ammonia lyase genes and the encoded proteins[J]. Chinese Journal of Tropical Crops, 2018, 39(7): 1452 -1461. doi: 10.3969/j.issn.1000-2561.2018.07.028
[34] 吕思佳, 吴月燕, 贾永红, 等. 云锦杜鹃苯丙氨酸解氨酶基因的克隆及功能分析[J]. 生物工程学报,2022,38(1):374−385. [LÜ S J, WU Y Y, JIA Y H, et al. Cloning and functional analysis of the phenylalaninammo-nialyase gene from rhododendron fortunei[J]. Chinese Journal of Biotechnology,2022,38(1):374−385. doi: 10.13345/j.cjb.210325 LÜ S J, WU Y Y, JIA Y H, et al. Cloning and functional analysis of the phenylalaninammo-nialyase gene from rhododendron fortunei[J]. Chinese Journal of Biotechnology, 2022, 38(1): 374-385. doi: 10.13345/j.cjb.210325
[35] 葛文佳, 辛建攀, 田如男. 植物苯丙烷代谢及其对重金属胁迫的响应研究进展[J]. 生物工程学报,2023,39(2):425−445. [GE W J, XIN J P, TIAN R N. Phenylpropanoid pathway in plants and its role in response to heavy metal stress: A review[J]. Chinese Journal of Biotechnology,2023,39(2):425−445. doi: 10.13345/j.cjb.220338 GE W J, XIN J P, TIAN R N. Phenylpropanoid pathway in plants and its role in response to heavy metal stress: a review[J]. Chinese Journal of Biotechnology, 2023, 39(2): 425-445. doi: 10.13345/j.cjb.220338
[36] HUANG J, GU M, LAI Z, et al. Functional analysis of the arabidopsis pal gene family in plant growth, development, and response to environmental stress[J]. Plant Physiology,2010,153(4):1526−1538. doi: 10.1104/pp.110.157370
[37] 温晓丽. 外源磷酸钠对枣果实活性氧和苯丙烷代谢关键酶活性及酚类物质积累的影响[J]. 食品工业科技,2022,43(17):381−386. [WEN X L. Effects of exogenous trisodium phosphate on activities of key enzymes of reactive oxygen species and phenylpropane metabolism and accumulation of phenolic compounds in jujube fruits[J]. Science and Technology of Food Industry,2022,43(17):381−386. doi: 10.13386/j.issn1002-0306.2021120242 WEN X L. Effects of exogenous trisodium phosphate on activities of key enzymes of reactive oxygen species and phenylpropane metabolism and accumulation of phenolic compounds in jujube fruits[J]. Science and Technology of Food Industry, 2022, 43(17): 381−386. doi: 10.13386/j.issn1002-0306.2021120242
[38] 王玲平, 周生茂, 戴丹丽, 等. 植物酚类物质研究进展[J]. 浙江农业学报,2010,22(5):696−701. [WANG L P, ZHOU S M, DAI D L, et al. Progress in plant phenolic compounds[J]. Acta Agriculturae Zhejiangensis,2010,22(5):696−701. doi: 10.3969/j.issn.1004-1524.2010.05.030 WANG L P, ZHOU S M, DAI D L, et al. Progress in plant phenolic compounds[J]. Acta Agriculturae Zhejiangensis, 2010, 22(5): 696-701. doi: 10.3969/j.issn.1004-1524.2010.05.030
[39] 尚军, 吴旺泽, 马永贵. 植物苯丙烷代谢途径[J]. 中国生物化学与分子生物学报,2022,38(11):1467−1476. [SHANG J, WU W Z, MA Y G. Phenylpropanoid metabolism pathway in plants[J]. Chinese Journal of Biochemistry and Molecular Biology,2022,38(11):1467−1476. doi: 10.13865/j.cnki.cjbmb.2022.03.1604 SHANG J, WU W Z, MA Y G. Phenylpropanoid metabolism pathway in plants[J]. Chinese Journal of Biochemistry and Molecular Biology, 2022, 38(11): 1467-1476. doi: 10.13865/j.cnki.cjbmb.2022.03.1604
[40] DIXON R A, PAIVA N L. Stress-Induced phenylpropanoid metabolism[J]. The Plant Cell,1995,7(7):1085−1097. doi: 10.2307/3870059
[41] SCHILMILLER A L, STOUT J, WENG J K, et al. Mutations in the cinnamate 4-hydroxylase gene impact metabolism, growth and development in Arabidopsis[J]. The Plant Journal:for Cell and Molecular Biology,2009,60(5):771−782. doi: 10.1111/j.1365-313X.2009.03996.x
[42] FAHRENDORF T, DIXON R A. Stress responses in alfalfa (medicago sativa l. ). xviii: molecular cloning and expression of the elicitor-inducible cinnamic acid 4-hydroxylase cytochrome p450[J]. Archives of Biochemistry and Biophysics,1993,305(2):509−515. doi: 10.1006/abbi.1993.1454
[43] CHENG S, YAN J, MENG X, et al. Characterization and expression patterns of a cinnamate-4-hydroxylase gene involved in lignin biosynthesis and in response to various stresses and hormonal treatments in Ginkgo biloba[J]. Acta Physiologiae Plantarum,2017,40(1):7.
[44] DONG N Q, LIN H X. Contribution of phenylpropanoid metabolism to plant development and plant–environment interactions[J]. Journal of Integrative Plant Biology,2021,63(1):180−209. doi: 10.1111/jipb.13054
[45] EHLTING J, BÜTTNER D, WANG Q, et al. Three 4-coumarate: Coenzyme a ligases in arabidopsis thaliana represent two evolutionarily divergent classes in angiosperms[J]. The Plant Journal: for Cell and Molecular Biology,1999,19(1):9−20. doi: 10.1046/j.1365-313X.1999.00491.x
[46] 汪开拓, 郑永华, 唐双双, 等. 茉莉酸甲酯对草莓果实采后腐烂、苯丙烷类代谢及抗氧化活性的影响[J]. 食品科技,2011,36(8):40−46. [WANG K T, ZHENG Y H, TANG S S, et al. Effects of methyl jasmonate (MeJA) on postharvest decay, phenylpropanoid metabolism and antioxidant activity in strawberry fruit[J]. Food Science and Technology,2011,36(8):40−46. doi: 10.13684/j.cnki.spkj.2011.08.005 WANG K T, ZHENG Y H, TANG S S, et al. Effects of methyl jasmonate (MeJA) on postharvest decay, phenylpropanoid metabolism and antioxidant activity in strawberry fruit[J]. Food Science and Technology, 2011, 36(8): 40-46. doi: 10.13684/j.cnki.spkj.2011.08.005
-
期刊类型引用(10)
1. 侯家豪,贾子健,戴雪华,厉佳怡,周泉城,盛桂华. 黑果腺肋花楸酵素研制及功能评价. 山东理工大学学报(自然科学版). 2025(02): 62-70 .  百度学术
百度学术
2. 王佳,丁方莉,安宇,曾雪莹,张智慧,李思楠,徐开媛,周芳,王颖,张璐,徐炳政,孙泽堃. 芸豆-蓝靛果复合发酵液制备工艺优化及其抗氧化活性. 食品工业科技. 2025(03): 222-231 .  本站查看
本站查看
3. 毛伟健,李天昊,尚海燕,郭梦棋,呼建坤,张文清,江文文. 不同菌种对香蕉酵素发酵的影响. 中国果菜. 2025(02): 18-26 .  百度学术
百度学术
4. 安琪,张霞,郭玉琪,马艳弘,王翔,王愈. 发酵方式对苹果幼果果酒品质及香气成分的影响. 中国食品学报. 2025(01): 335-347 .  百度学术
百度学术
5. 唐海轮,袁嘉豪,崔海林,卢洋,简清梅,李蓉. 葡萄皮酵素发酵工艺优化及其抗氧化活性. 食品研究与开发. 2025(04): 93-99 .  百度学术
百度学术
6. 蔡跃月,麦尔哈巴·阿布拉,高路,杨立新. 滇红玫瑰发酵过程中酚类物质含量及其抗氧化和抗炎活性分析. 食品工业科技. 2024(11): 213-221 .  本站查看
本站查看
7. 曹晓倩,樊晓博,孙占育,党蓓蕾,侯清娥,彭浩,蒋宝. 猕猴桃酵素发酵工艺优化及关键技术分析. 陕西农业科学. 2024(06): 23-29 .  百度学术
百度学术
8. 孙盾,薛桂新. 不同预处理方式黑果腺肋花楸果酒营养品质和抗氧化活性的对比. 现代食品科技. 2024(10): 302-310 .  百度学术
百度学术
9. 惠美星. 黑果酵素的制备分析. 现代食品. 2024(18): 104-106 .  百度学术
百度学术
10. 李欣蔚,刘柏廷,徐铭骏,沙坤. 蓝莓酵素陈酿过程中理化指标及抗氧化活性变化研究. 食品与发酵科技. 2024(06): 79-84 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



