Effect of Different Protein Removal Methods on the Structure and Antioxidant Activity of the Cyclocarya paliurus Polysaccharides
-
摘要: 青钱柳多糖具有较强的降血糖和抗氧化活性,脱除蛋白对青钱柳多糖的纯化至关重要。为探索最适合青钱柳多糖的除蛋白方式,本文采用了三种除蛋白方法(HCl法、TCA法、NaCl法)对青钱柳粗多糖进行处理,同时采用高效液相凝胶色谱法、离子色谱法、傅里叶红外光谱法对三种脱蛋白方式得到的多糖的结构和成分进行分析,接着通过测定其对DPPH自由基、ABTS+自由基和羟基自由基的清除率评价其抗氧化能力。结果表明:HCl法在pH2时,蛋白脱除率为73.48%,多糖保留率为74.86%;TCA法在TCA体积分数为2%时,蛋白脱除率为79.88%,多糖保留率为81.78%;NaCl法在NaCl体积分数为7%时,蛋白脱除率为47.90%,多糖保留率为82.51%。三种除蛋白方法处理后得到的多糖主要包括三个不同分子量范围的组分:500~750 kDa,100~130 kDa和30~40 kDa左右的部分,但其比例各不相同,TCA法处理的多糖在100~130 kDa占比最大,NaCl法处理的多糖在30~40 kDa占比最大。三种多糖均由8种单糖组成,但其摩尔比不相同,HCl法处理后多糖中阿拉伯糖、半乳糖和葡萄糖的含量最大,TCA法处理后多糖中糖醛酸的含量更高,NaCl法处理后多糖中的鼠李糖、木糖和甘露糖的含量最大。通过比较同浓度下三种多糖对自由基的清除能力发现,TCA法处理的多糖抗氧化能力最强,HCl法次之,NaCl法最弱。由研究结果表明,不同的除蛋白方法会对青钱柳多糖的结构和活性产生不同的影响,其中TCA法是一种较好的青钱柳多糖脱除蛋白的方式。Abstract: Removal of proteins is essential for the purification of Cyclocarya paliurus polysaccharides (CPP), which have strong hypoglycemic and antioxidant activities. In order to explore the most suitable way of removing protein from the polysaccharides, three methods (HCl, TCA and NaCl) were used to treat the crude polysaccharides, and the structure and composition of the polysaccharides obtained by the three deproteinization methods were analyzed by high performance liquid gel chromatography, ion chromatography and Fourier infrared spectroscopy, and their antioxidant activity was determined by measuring the scavenging rate of DPPH radicals, ABTS+ radicals and hydroxyl radicals. The results showed that the protein removal rate of the HCl method was 73.48% and the polysaccharide residue rate was 74.86% at pH2. The protein removal rate of the TCA method was 79.88% and the polysaccharide residue rate was 81.78% at a TCA volume fraction of 2%. The protein removal rate of the NaCl method was 47.90% and the polysaccharide residue rate was 82.51% at a NaCl volume fraction of 7%. The molecular weight distribution of the polysaccharides treated by the three methods could be roughly divided into three parts, 500~750 kDa, 100~130 kDa and 30~40 kDa, but their proportions were different. The polysaccharides treated by the TCA method accounted for the largest percentage of 100~130 kDa compared with the three, and the polysaccharides treated by the NaCl method accounted for the largest percentage of 30~40 kDa. All three polysaccharides consisted of eight monosaccharides, but their molar ratios were different. Of the three deproteinization method, the HCl-treated polysaccharide had the highest content of arabinose, galactose and glucose, the TCA-treated polysaccharide had a higher content of glyoxylate, and the NaCl-treated polysaccharide had the highest content of rhamnose, xylose and mannose. The scavenging ability of the three polysaccharides against free radicals at the same concentration was compared, and the antioxidant ability of the polysaccharides treated with TCA method was the strongest, followed by HCl method and the weakest was polysaccharides treated by NaCl method. As shown by the results, different methods of protein removal have different effects on the structure and activity of CPP, among which TCA method is a better way to remove protein from CPP.
-
青钱柳(Cyclocarya paliurus (Batal.) Ijinskaja)系双子叶植物胡桃科青钱柳属植物,为我国独有的单种属植物[1],食用历史悠久(食用部位为青钱柳叶,食用方式为冲泡)[2]。已有多项研究表明,青钱柳多糖具有降血糖[3]、抗氧化[4]、提高免疫力[5]及抗炎[6]等生物活性。
多糖的提取多采用水提的方式,提取物中蛋白质的存在会干扰后续多糖的结构和活性的分析[7],因而脱除蛋白对于多糖的纯化必不可少。常用的多糖脱除蛋白的方法有Sevage法、酶法、HCl法、trichloroacetic acid (TCA)法和NaCl法。其中Sevage法虽条件温和但其操作繁琐且试剂(氯仿)对环境有害[8];酶法需要对酶的种类、比例及反应条件进行摸索,应用较为困难[9];HCl法通过调节溶液pH使其达到蛋白质的等电点沉降蛋白;TCA法根据蛋白质在有机酸的作用下形成不可逆的沉淀除去蛋白;NaCl法以增加溶液中的盐浓度而使蛋白质盐析沉淀,这三种方法操作相对简单且对环境的危害较小。并且已有不少文献报道脱除蛋白质的方式会对多糖的结构和活性产生影响[10-11]。Zeng等[10]采用中性蛋白酶法、TCA法和CaCl2法处理灵芝多糖发现,TCA法具有较好的蛋白质脱除效率,而酶法处理后多糖具有更佳的抗氧化活性。Mohammed等[11]比较了四种方法(HCl法、TCA法、NaCl法和CaCl2法)对阿尔贡棕榈果实多糖结构的影响,结果表明四种方法处理后多糖具有相似的官能团但各官能团的红外吸收峰强度不同,HCl法处理后多糖的表面粗糙、不规则具有孔隙结构,TCA法处理后多糖表面粗糙具有纺锤形分支,NaCl法和CaCl2法处理后多糖外观呈片状或碎屑状。
目前,关于青钱柳多糖(Cyclocarya paliurus polysaccharides, CPP)的研究中常用的脱除蛋白质的方法为Sevage法[3-6],而对于青钱柳多糖脱除蛋白方法的研究较少。仅有谢建华[12]考察了Sevage法在振摇次数为六次、HCl法在pH3、TCA法在10% TCA调节溶液pH3、Sevage法联用酶法在木瓜蛋白酶或胰蛋白酶处理后再用Sevage法振摇三次的处理情况下,多糖溶液中多糖保留率和蛋白脱除率的变化,但却没有比较四种方法在不同处理条件下(如振摇次数、pH高低、TCA浓度、酶反应条件等)脱除蛋白质的效果。因此,本研究采用三种方法(HCl法、TCA法和NaCl法)对青钱柳多糖进行处理,从蛋白脱除率和多糖保留率的角度对三种方法脱除蛋白效率进行了评价,同时考察了经不同除蛋白方式脱除蛋白后所得到的多糖在结构和抗氧化活性方面的差异,以期为后续青钱柳多糖的深入研究提供依据。
1. 材料与方法
1.1 材料与仪器
青钱柳叶 于2021年9月采摘自江西农业大学生态园;石油醚、水杨酸 分析纯,天津市大茂化学试剂厂;无水乙醇、浓盐酸、氯化钠、苯酚、浓硫酸、硫酸亚铁 分析纯,西陇科学股份有限公司;三氯乙酸 分析纯,阿拉丁(上海)试剂有限公司;葡萄糖 超级纯,阿拉丁(上海)试剂有限公司;牛血清白蛋白、考马斯亮蓝、DPPH(1,1-diphenyl-2-picryl-hydrazyl radical)、ABTS(2,2'-Azinobis-(3-ethylbenzthiazoline-6-sulphonate)) 北京索莱宝科技有限公司;过氧化氢 分析纯,天津玉福泰化学试剂有限公司;抗坏血酸 分析纯,国药集团化学试剂有限公司;三氟乙酸 分析纯,美国ACROS公司;醋酸钠 优级纯,美国ThermoFishe公司;50%氢氧化钠溶液 优级纯,美国Alfa Aesar公司;单糖标准品(半乳糖、阿拉伯糖、葡萄糖、半乳糖醛酸、木糖、甘露糖、鼠李糖、葡萄糖醛酸) 分析纯,深圳市博睿糖生物技术有限公司;葡聚糖标准品(5000、11600、23800、48600、80900、148000、273000、4098000、667800) 美国Sigma公司。
V-5600紫外分光光度计 上海元析仪器有限公司;101-1BS电热恒温鼓风干燥箱、UGC-24M氮吹仪 上海力辰邦西仪器科技有限公司;LC-10A高效液相色谱仪、RI-10A示差检测器 日本岛津公司;ICS5000离子色谱仪 美国ThermoFisher公司;BRT105-104-102色谱柱串联BRT105-104-102(8 mm×300 mm)凝胶柱 深圳市博睿糖生物技术有限公司。
1.2 实验方法
1.2.1 青钱柳多糖的制备
根据Zhao等[13]的方法略作修改提取。将新鲜的青钱柳叶烘干,粉碎过60目筛,置于聚乙烯袋中避光干燥保存待用。称取500 g青钱柳粉末,加入石油醚浸泡过夜除去脂质等物质,于80 ℃,料液比1:15,水浴2 h,取上清液,将滤渣重复上述操作2次,合并上清液,使用旋转蒸发仪于55 ℃减压浓缩至原体积的1/10。向浓缩液中加入95%的乙醇溶液(1:4,V/V),于4 ℃冰箱中放置过夜,以4000 r/min离心,收集沉淀复溶后减压浓缩,冷冻干燥得到青钱柳粗多糖样品。准确称取青钱柳粗多糖粉末5 g加蒸馏水定容至500 mL容量瓶中,配制青钱柳多糖溶液(10 mg/mL)。
1.2.2 TCA法脱除蛋白
根据Zeng等[10]的方法,取青钱柳多糖溶液(10 mg/mL)20 mL五份,向其中加入三氯乙酸,使其终浓度分别为0.5%、1%、2%、4%、8%,溶液混合均匀后于4 ℃冰箱中放置过夜,以4000 r/min离心10 min,取上清液测定多糖的保留率和蛋白质的脱除率。
1.2.3 HCl法脱除蛋白
根据Mohammed等[11]的方法,取青钱柳多糖溶液(10 mg/mL)20 mL五份,向其中滴加2 mol/L 盐酸溶液分别调节pH至1、2、3、4、5,将溶液混合均匀后放置12 h,4000 r/min离心10 min,取上清液测定多糖的保留率和蛋白质的脱除率。
1.2.4 NaCl法脱除蛋白
根据Cheng等[14]的方法略作修改,取青钱柳多糖溶液(10 mg/mL)20 mL五份,向其中加入2% NaOH溶液调节pH至9,后加入NaCl使其浓度为3、5、7、9、11%(W/V)煮沸30 min,冷却,以4000 r/min离心10 min,取上清液测定多糖的保留率和蛋白质的脱除率。
1.2.5 多糖含量和蛋白含量的测定
多糖含量的测定采用苯酚-硫酸法[15],以葡萄糖作为标准品绘制回归方程,测定其在490 nm处的吸光度值再通过换算因子进行计算。蛋白质含量的测定采用考马斯亮蓝染色法[16],以牛血清白蛋白作为标准品绘制回归方程,测定其在595 nm处的吸光度值再通过换算因子进行计算。
多糖的保留率和蛋白质脱除率分别按照下式进行计算:
多糖保留率(%)=A1−A水A0−A水×100 蛋白质脱除率(%)=B0−B1B0−B水×100 式中:A0和A1分别为除蛋白前后采用苯酚硫酸法测定的溶液在490 nm处的吸光度值;B0和B1分别为除蛋白前后采用考马斯亮蓝染色法测定的溶液在595 nm处的吸光度值;A水和B水为水的吸光度值。
1.2.6 脱除蛋白后多糖的制备
1.2.6.1 综合评分
通过计算多糖保留率和蛋白质脱除率的均值[17],综合评价不同条件下三种脱蛋白方法的效果,分别选择HCl法pH2;TCA法TCA质量浓度为2%;NaCl法 NaCl质量浓度为7%的处理条件进行后续研究。
1.2.6.2 HCl法脱蛋白处理后多糖的制备
向上述HCl法(pH2)处理后的多糖溶液中滴加2 mol/L的NaOH溶液,调节pH至7,蒸馏水透析24 h期间多次换水(透析袋截留分子量为3500 Da),将透析液冷冻干燥得到HCl法脱蛋白后的青钱柳多糖样品。
1.2.6.3 TCA法脱蛋白处理后多糖的制备
向上述TCA法(TCA质量浓度为2%)处理后的多糖溶液中滴加2 mol/L的NaOH溶液,调节pH至7,蒸馏水透析24 h期间多次换水(透析袋截留分子量为3500 Da),将透析液冷冻干燥得到TCA法脱蛋白后的青钱柳多糖样品。
1.2.6.4 NaCl法脱蛋白处理后多糖的制备
向上述NaCl法(NaCl质量浓度为7%)处理后的多糖溶液中滴加1 mol/L的HCl溶液,调节pH至7,蒸馏水透析24 h期间多次换水(透析袋截留分子量为3500 Da),将透析液冷冻干燥得到NaCl法脱蛋白后的青钱柳多糖样品。
1.2.7 不同除蛋白方法对青钱柳多糖结构的影响
1.2.7.1 分子量测定
参照Zhang等[18]的方法,采用高效液相凝胶色谱法测定三种青钱柳多糖的分子量分布。称取三种脱除蛋白方式得到的多糖样品,配制成5 mg/mL溶液,12000 r/min离心10 min,取上清过0.22 µm滤膜,采用高效液相色谱仪进行检测,色谱柱为BRT105-104-102串联凝胶柱(8 mm×300 mm),以0.05 mol/L NaCl溶液作为流动相,流速为0.6 mL/min,进样量为20 µL,检测器为RI-10A示差检测器。
1.2.7.2 单糖组成测定
参考钱朋志等[19]的方法略作修改,采用离子色谱法测定三种青钱柳多糖的单糖组成。精密称取5 mg三种多糖样品置于安瓿瓶中,加入3 mol/L TFA 2 mL,120 ℃水解3 h,吸取酸水解溶液转移至管中氮吹吹干,加入5 mL水,涡旋混匀,吸取50 µL混合液加入950 µL去离子水,12000 r/min离心5 min,取上清进行离子色谱检测。色谱柱为Dionex CarbopacTM PA20(3 mm×150 mm),流动相为A:H2O;B:15 mmol/L NaOH;C:15 mmol/L NaOH &100 mmol/L NaAc;流速为0.3 mL/min进样量为5 µL,检测器为电化学检测器。
1.2.7.3 傅里叶红外光谱的测定
参考Wang等[20]的方法,将三种多糖样品与KBr粉末烘干至恒重,按100:1压片后,扫描波数400~4000 cm−1,记录光谱图。
1.2.8 不同除蛋白方法对青钱柳多糖的体外抗氧化活性影响
1.2.8.1 DPPH自由基清除能力测定
DPPH自由基清除能力的测定参考Chen等[21]的方法略作修改。向0.5 mL的三种青钱柳多糖溶液(0~0.1 mg/mL)中加入0.2 mmol/L的DPPH-无水乙醇溶液0.5 mL涡旋混匀后,暗反应30 min,于517 nm处测定吸光度值,以无水乙醇作为空白对照,抗坏血酸作为阳性对照,每个处理重复三次试验。DPPH自由基清除率计算如公式所示:
DPPH自由基清除率(%)=(1−A1−A2A0)×100 式中:A0为去离子水替代多糖溶液的吸光度;A1为样品溶液的吸光度;A2为无水乙醇替代DPPH-无水乙醇溶液的吸光度。
1.2.8.2 ABTS+自由基清除能力测定
ABTS+自由基清除能力的测定参考Wang等[22]的方法略作修改。以2.45 mmol/L K2S2O4溶液为溶剂配制7 mmol/L的ABTS溶液,避光静置16 h,去离子水稀释混合液使其在734 nm处吸光度值至0.70±0.01。向200 µL多糖溶液(0~0.1 mg/mL)加入800 µL稀释后的ABTS溶液涡旋混匀后,反应10 min,于734 nm处测定吸光度值,以去离子水作为空白对照,抗坏血酸作为阳性对照,每个处理重复三次试验。ABTS+自由基清除率计算如公式所示:
ABTS+自由基清除率(%)=(1−A1−A2A0)×100 式中:A0为去离子水替代多糖溶液的吸光度;A1为样品溶液的吸光度;A2为去离子水替代ABTS溶液的吸光度。
1.2.8.3 羟基自由基清除能力测定
羟基自由基清除能力的测定参考Chen等[23]的方法略作修改。向0.4 mL的三种青钱柳多糖溶液(0~1 mg/mL)中快速加入0.4 mL 9×10−3 mol/L的FeSO4溶液和0.4 mL 9×10−3 mol/L的水杨酸-乙醇溶液(醇浓度为70%),最后再加入0.4 mL 9×10−3 mol/L的H2O2溶液,涡旋混匀后,反应30 min,于510 nm处测定吸光度值,以去离子水作为空白对照,抗坏血酸作为阳性对照,每个处理重复三次试验。羟基自由基清除率计算如公式所示:
羟基自由基清除率(%)=(1−A1−A2A0)×100 式中:A0为去离子水替代多糖溶液的吸光度;A1为样品溶液的吸光度;A2为去离子水替代H2O2溶液的吸光度。
1.3 数据处理
数据采用IBM SPSS Statistic 20.0进行处理,图形采用Origin 2021进行绘制,所有试验重复3次,结果以均值±标准差表示,显著性分析采用ANOVA法,不同小写字母表示差异显著(P<0.05)。
2. 结果与分析
2.1 不同除蛋白方法的效果比较
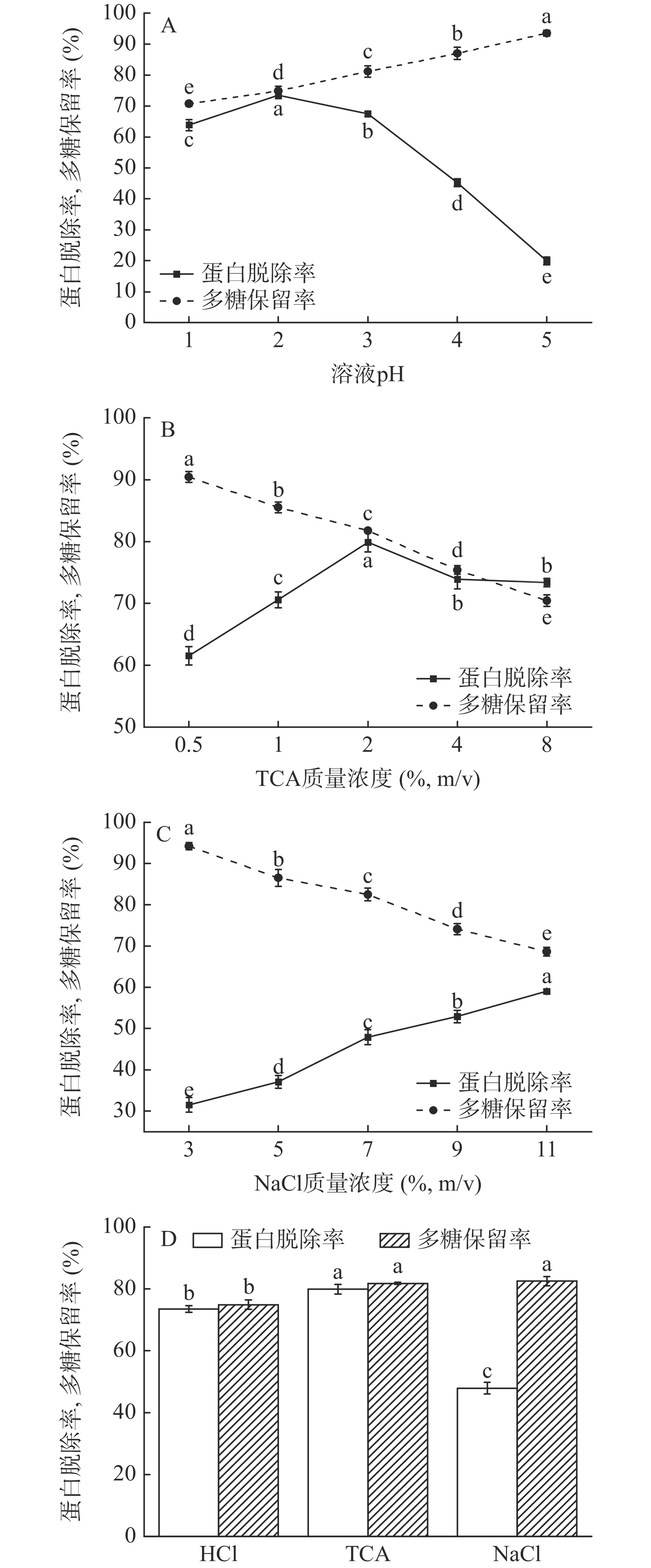
三种常见的脱蛋白方法脱除效果可见图1。
图1A为HCl法中不同pH对多糖溶液的蛋白脱除率和多糖保留率的影响。从中可看出随着pH的不断增大,蛋白脱除率呈现先增加后降低的趋势,在pH为2时达到最高,为73.48%,多糖保留率随pH的增大呈现上升趋势,表明强酸性环境可能会导致多糖的降解,其原因可能为酸性溶液能引起多糖中糖苷键的断裂,使多糖降解为低分子片段[24]。
图1B为TCA浓度对多糖溶液的蛋白脱除率和多糖保留率的影响。可以观察到随着TCA溶液体积分数的增大,蛋白脱除率上升并在质量浓度为2%时达到最高值79.88%,后随着TCA质量浓度的增加而略微下降,多糖保留率随TCA质量浓度的增大而明显降低。这一现象可能是由于两方面的原因导致:其一,当溶液pH小于蛋白质等电点时,TCA与蛋白质形成了不溶性盐[25],并且TCA使蛋白质构象发生改变,暴露出较多的疏水性基团而聚集沉淀;其二,形成的不溶性聚合物吸附了部分多糖从而造成了多糖的损失[17],并且高浓度的TCA会对青钱柳多糖造成降解,同时在一定程度上发生结构的变化[26-27]。
图1C为NaCl浓度对多糖溶液的蛋白脱除率和多糖保留率的影响。由图可知蛋白脱除率与NaCl质量浓度成正相关,而多糖保留率与之成负相关。这可能是加入的盐溶液破坏了蛋白质的水化膜,使其溶解度降低并形成沉淀[28-29],同时沉淀的蛋白质又吸附了少量的多糖导致多糖的损失。通过计算综合评分,选择NaCl质量浓度为7%的处理进行后续的研究。
图1D是在三种方法最优的条件下获得的数据比较(计算方法为多糖保留率和蛋白脱除率的均值),其中HCl法在pH为2时,蛋白脱除率为73.48%,多糖保留率为74.86%;TCA法在TCA质量浓度为2%时,蛋白脱除率为79.88%,多糖保留率为81.78%;NaCl法在NaCl质量浓度为7%时,蛋白脱除率为47.90%,多糖保留率为82.51%。可以很明显地看出NaCl法对青钱柳多糖中的蛋白质清除效果最不理想;TCA法和HCl法的清除效果较好,在最优条件下分别为79.88%和73.48%,三种方法在其最优条件下对溶液中的多糖都具有较高的保留率。综上所述,在TCA法(TCA质量浓度为2%)处理后,青钱柳多糖的多糖保留率和蛋白质脱除率都较为理想。
2.2 不同除蛋白方法对青钱柳多糖结构的影响
由于不同除蛋白方法作用于青钱柳多糖的原理不同,所以效果不同,对于青钱柳多糖的结构的影响也可能差异不同,因此,选取了在三种方法的最优条件下得到的三种青钱柳多糖,进一步对其进行了多糖分子量分布、单糖组成和红外光谱官能团的测定。
2.2.1 不同除蛋白方法对青钱柳多糖分子量分布的影响
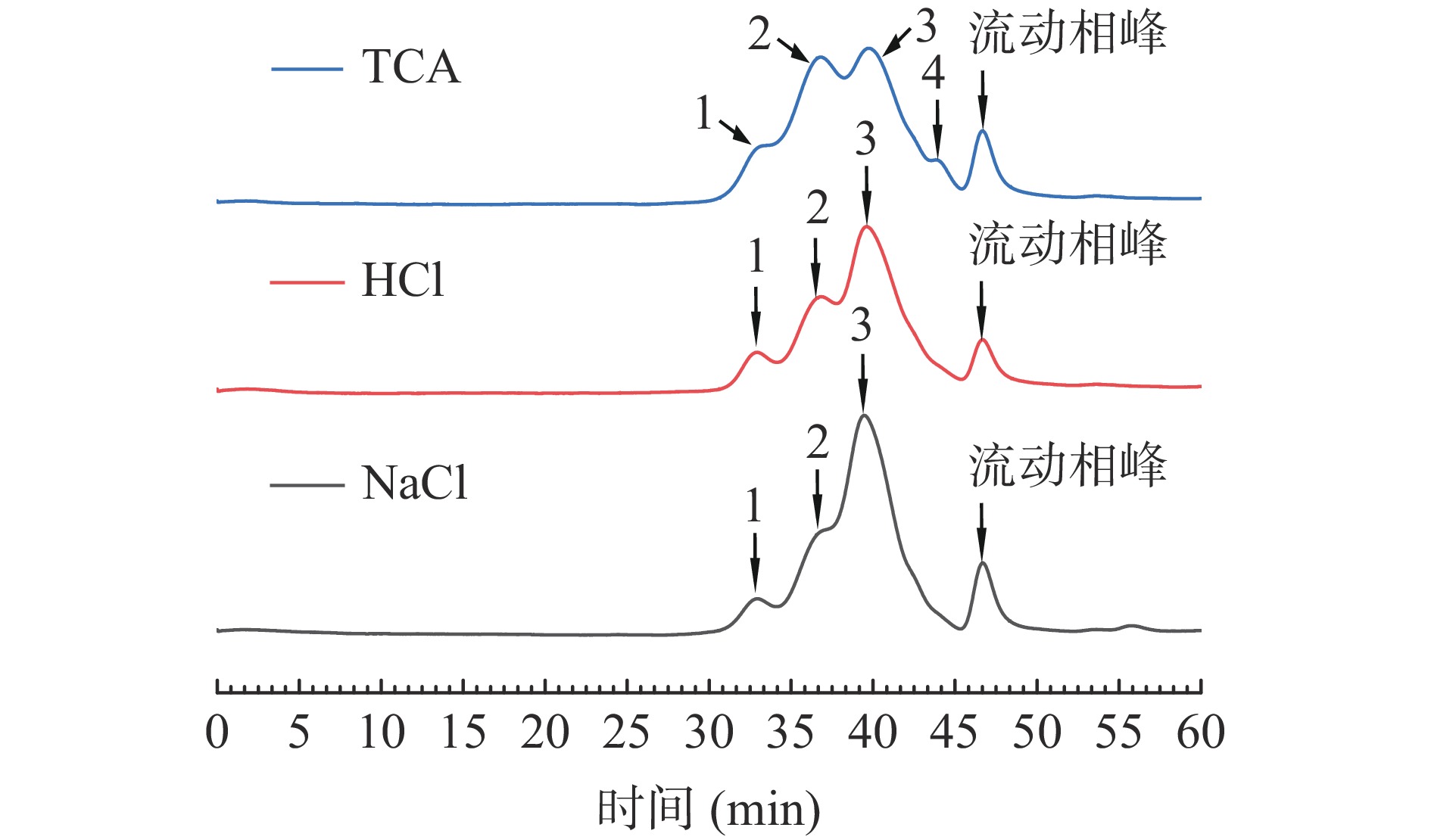
对三种除蛋白方法处理后的青钱柳多糖的分子量分布进行了测定,结果如图2所示,从高效液相凝胶色谱图可以看到,三种方法得到的多糖有相似的洗脱出峰时间,说明得到的多糖分子量分布类似,大体可分为三个部分(具体分子量分布见表1)。三者相比,NaCl法处理后多糖在30~40 kDa所占比例较高,TCA法在100~130 kDa所占比例较高。可以看出三种除蛋白的方法均能脱除多糖中的蛋白,但因原理不同,其对不同分子量组分的青钱柳多糖的影响不同。从表中可以很明显看出,TCA方法处理过后的CPP在730 kDa左右发生了降解,使其500 kDa和130 kDa左右的多糖含量增加,同时在较小分子量即40 kDa左右的组分也同样发生了降解,与另外两种方法相比出现了6 kDa左右的组分,其可能是因为TCA溶液对于多糖具有降解作用使得多糖的分子质量偏小,结果与薛丽洁等[30]的研究相似。HCl方法与NaCl方法处理后的多糖分子量分布类似,但NaCl法得到的CPP在分子量为100~130 kDa左右的组分含量降低,而在分子量为30~40 kDa左右的组分增加,这可能是由于碱性环境破坏了多糖的结构使其发生降解所致[31],Zeng等[10]的研究中也出现类似结果。
表 1 可溶性多糖各组分分子量分布Table 1. Molecular weight distribution of soluble polysaccharide fractions脱蛋白方法 峰号 分子质量Mw (kDa) 峰面积(%) HCl 1 726.745 8.380 2 130.682 25.950 3 37.717 65.670 TCA 1 499.809 9.015 2 131.437 40.529 3 35.812 46.298 4 5.844 4.158 NaCl 1 738.756 6.799 2 116.464 17.335 3 40.721 75.865 2.2.2 不同除蛋白方法对青钱柳多糖单糖组成的影响
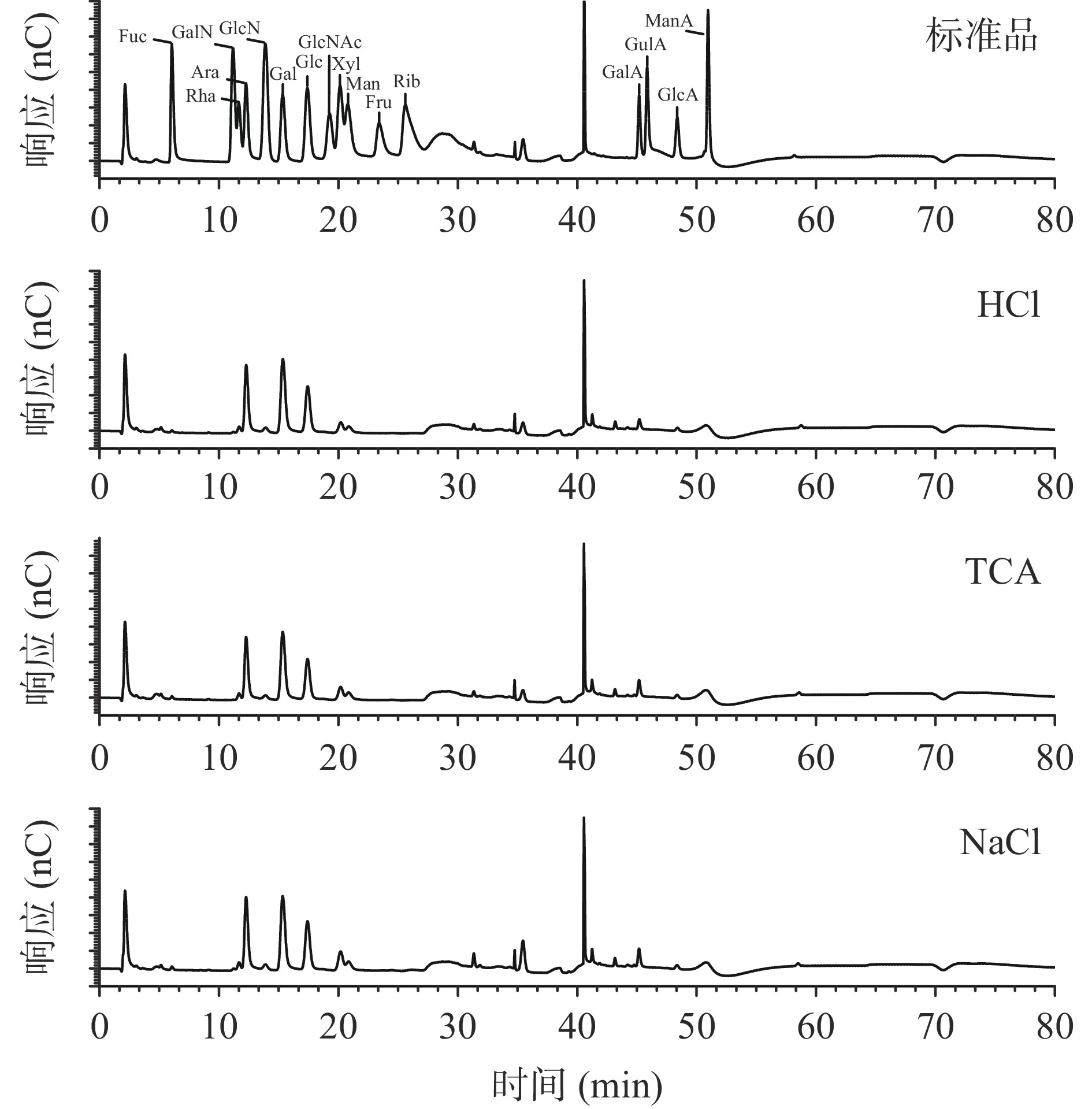
采用离子色谱法对三种青钱柳多糖的单糖组成进行了测定,离子色谱图如图3所示,具体的三种多糖的单糖组成分布见表2。
表 2 三种青钱柳多糖的单糖组成(%)Table 2. Monosaccharide composition of the three Cyclocarya paliurus polysaccharides (%)单糖组成 HCl TCA NaCl 鼠李糖Rha 2.9 3.2 3.5 阿拉伯糖Ara 24.9 23.7 23.7 半乳糖Gal 37.1 34.8 32.1 葡萄糖Glc 18.3 16.3 17.1 木糖Xyl 4.8 6.2 7.9 甘露糖Man 3.4 4.0 4.2 半乳糖醛酸GalA 4.8 8.0 7.5 葡萄糖醛酸GlcA 2.4 2.5 2.4 由单糖组成的结果可以看出,三种青钱柳多糖均由8种单糖组成,分别为半乳糖、阿拉伯糖、葡萄糖、半乳糖醛酸、木糖、甘露糖、鼠李糖、葡萄糖醛酸,且以半乳糖、阿拉伯糖、葡萄糖为主,但其摩尔比不相同,结果与之前报道过的青钱柳多糖的单糖组成相似[32-34]。其中HCl法处理后多糖中阿拉伯糖、半乳糖和葡萄糖的含量最大,TCA法处理后多糖中糖醛酸的含量更高,NaCl法处理后多糖中的鼠李糖、木糖和甘露糖的含量最大。不同的单糖具有不同的生理功能[35],三种方法处理后的多糖在单糖含量上的差异会使其结构和功能发生改变。另一方面,不同除蛋白方法得到的CPP的单糖组成相同但其比例不同,其主要原因可能是多糖分子在强酸碱条件下被部分降解并且分子间的氢键被破坏,进而引起单糖组成比例改变[36]。单糖组成结果与三种多糖的不同分子量分布结果相吻合。
2.2.3 三种青钱柳多糖的红外光谱测定结果
从图4中可看出三种多糖均在3000~3750 cm−1区域有一条宽谱带,且在3416.28 cm−1处均具有较强的吸收峰,通常是由多糖羟基的O-H伸缩振动引起的[37]。此外,2927.90 cm−1处的弱吸收峰是由多糖烷基的C-H伸缩振动引起[38],多糖类物质的典型基团就是羟基和烷基,此结果也说明上述三种物质均为多糖。在1640.16 cm−1和1323.41 cm−1处的强吸收峰分别是由C=O和C-H的弯曲振动引起的,表明三种多糖均含有糖醛酸[39],这与单糖组成结果相一致。在1000~1200 cm−1处的谱带显示了C-O-C和C-O-H键的存在,这是吡喃糖的特征峰[40]。在772.83 cm−1处的吸收峰是由D-吡喃糖环对称伸缩振动引起的[41]。其中,TCA法和HCl法相比,在上述提到的区域内没有明显的吸收峰差异,但与这两者相比,NaCl法在1323.41 cm−1和772.83 cm−1处都出现了吸收峰强度的减弱,这表明该法对多糖的D-吡喃糖环的对称性结构影响较大,这可能是由于酸碱性环境对多糖官能团产生的影响不同。
2.3 三种青钱柳多糖的体外抗氧化活性
多糖的结构与其生理活性密切相关,三种除蛋白方法处理后的青钱柳多糖结构不同,因此建立了自由基模型对三种青钱柳多糖的抗氧化活性进行了探究。由图5可知,随着浓度的增加,三种青钱柳多糖对三种自由基的清除率呈现上升的趋势,并且同浓度下其抗氧化活性有强弱之分,从强到弱依次为TCA法、HCl法、NaCl法。值得注意的是,三种青钱柳多糖对ABTS+自由基都有较好的清除率,尤其是TCA法处理后的多糖,其在浓度为100 μg/mL时对ABTS+自由基的清除率显著超过了阳性对照组VC(P<0.05)。三种青钱柳多糖在抗氧化活性上的差异通常与其结构不同有关[42],多糖具有-OH、-COOH等可供氢官能团,这些官能团可以提供氢离子中和自由基中的未配对电子,实现自由基的清除[43]。随着多糖分子量的增加,多糖含有更多的可供氢官能团,具有更强的自由基清除能力,但分子量过大会导致分子间缠绕增加,空间障碍增大,官能团无法暴露[44]。结合抗氧化活性与分子量的结果,三种方法处理后的青钱柳多糖在抗氧化活性上的差异或许与其在100~130 kDa分子量范围的多糖比例有关(TCA法>HCl法>NaCl法),后续还需要通过超滤等方法分离各个分子量片段的多糖,再对其抗氧化能力进行评价加以验证。而从单糖组成的结果来看,三种青钱柳多糖具有较好的抗氧化活性可能是与阿拉伯糖和半乳糖的含量有关[45-46]。
3. 结论
本研究采用三种不同的除蛋白方法对青钱柳多糖进行处理,同时对得到的三种多糖进行结构和抗氧化活性的分析。结果表明:三种方法因其除蛋白原理不同对多糖的结构和活性造成的影响也不相同。多糖保留率和蛋白脱除率的结果表明TCA法是一种较为理想的青钱柳多糖脱除蛋白的方法,在TCA体积分数为2%时,蛋白脱除率为79.88%,多糖保留率为81.78%。分子量分布的结果表明青钱柳多糖主要由三个部分组成,单一组分还有待进一步分离纯化。从单糖组成结果可知青钱柳多糖主要由半乳糖、阿拉伯糖、葡萄糖组成,不同方法处理会对其单糖组成比例造成影响。红外光谱结果表明三种多糖均为酸性糖,其在1640.16和1323.41 cm−1处具有C=O和C-H弯曲、振动引起的强吸收峰,这与单糖组成结果相一致。抗氧化结果表明,三种多糖对于自由基(DPPH自由基、ABTS+自由基、OH自由基)的清除率与其浓度呈正相关且不同方法对于多糖的抗氧化活性产生不同的影响;值得注意的是,在清除ABTS+自由基的试验中,同等浓度下(100 μg/mL时)TCA法处理后的多糖对自由基的清除能力超过VC。通过评价不同的除蛋白方法的清除效果及研究其对多糖的结构和抗氧化活性造成的影响,可以从构效关系的角度为挑选青钱柳多糖的分离纯化方法和更深一步地开发利用青钱柳多糖提供一定的理论参考。
-
表 1 可溶性多糖各组分分子量分布
Table 1 Molecular weight distribution of soluble polysaccharide fractions
脱蛋白方法 峰号 分子质量Mw (kDa) 峰面积(%) HCl 1 726.745 8.380 2 130.682 25.950 3 37.717 65.670 TCA 1 499.809 9.015 2 131.437 40.529 3 35.812 46.298 4 5.844 4.158 NaCl 1 738.756 6.799 2 116.464 17.335 3 40.721 75.865 表 2 三种青钱柳多糖的单糖组成(%)
Table 2 Monosaccharide composition of the three Cyclocarya paliurus polysaccharides (%)
单糖组成 HCl TCA NaCl 鼠李糖Rha 2.9 3.2 3.5 阿拉伯糖Ara 24.9 23.7 23.7 半乳糖Gal 37.1 34.8 32.1 葡萄糖Glc 18.3 16.3 17.1 木糖Xyl 4.8 6.2 7.9 甘露糖Man 3.4 4.0 4.2 半乳糖醛酸GalA 4.8 8.0 7.5 葡萄糖醛酸GlcA 2.4 2.5 2.4 -
[1] 罗丹, 陈丹, 白曦晨, 等. 富硒青钱柳-黄精复方对高尿酸血症小鼠降尿酸作用研究[J]. 今日药学,2021,31(12):909−913,917. [GUO D, CHEN D, BAI X C, et al. Effect of selenium-enriched Cyclocarya paliurus and Polygonatum sibiricum compounds on lowering uric acid in mice with hyperuricemia[J]. Pharmacy Today,2021,31(12):909−913,917. GUO D, CHEN D, BAI X, et al. Effect of selenium-enriched Cyclocarya paliurus and Polygonatum sibiricum compounds on lowering uric acid in mice with hyperuricemia[J]. Pharmacy Today, 2021, 31(12): 909-913, 917.
[2] 袁丛军, 刘娜, 谢涛, 等. 青钱柳叶片活性成分及其影响因素研究进展[J]. 贵州林业科技,2021,49(3):48−53,64. [YUAN C J, LIU N, XIE T, et al. Research progress on the active components and influencing factors of Cyclocarya paliurus leaves[J]. Guizhou Forestry Science and Technology,2021,49(3):48−53,64. YUAN C, LIU N, XIE T, et al. Research progress on the active components and influencing factors of Cyclocarya paliurus leaves[J]. Guizhou Forestry Science and Technology, 2021, 49(3): 48-53, 64.
[3] LI Q, HU J, NIE Q, et al. Hypoglycemic mechanism of polysaccharide from Cyclocarya paliurus leaves in type 2 diabetic rats by gut microbiota and host metabolism alteration[J]. Science China Life Sciences,2021,64(1):117−132. doi: 10.1007/s11427-019-1647-6
[4] TANG W, LIN L, XIE J, et al. Effect of ultrasonic treatment on the physicochemical properties and antioxidant activities of polysaccharide from Cyclocarya paliurus[J]. Carbohydrate Polymers,2016,151:305−312. doi: 10.1016/j.carbpol.2016.05.078
[5] HAN Y, OUYANG K, LI J, et al. Sulfated modification, characterization, immunomodulatory activities and mechanism of the polysaccharides from Cyclocarya paliurus on dendritic cells[J]. International Journal of Biological Macromolecules,2020,159:108−116. doi: 10.1016/j.ijbiomac.2020.04.265
[6] WU T, SHEN M, GUO X, et al. Cyclocarya paliurus polysaccharide alleviates liver inflammation in mice via beneficial regulation of gut microbiota and TLR4/MAPK signaling pathways[J]. International Journal of Biological Macromolecules,2020,160:164−174. doi: 10.1016/j.ijbiomac.2020.05.187
[7] 何美佳, 刘晓, 唐翠翠, 等. 多糖脱蛋白方法的研究进展[J]. 中国海洋药物,2019,38(3):82−86. [HE M J, LIU X, TANG C C, et al. Research progress on the methods for deproteinization of polysaccharide[J]. Chinese Journal of Marine Drugs,2019,38(3):82−86. HE M, LIU X, TANG C, et al. Research progress on the methods for deproteinization of polysaccharide[J]. Chinese Journal of Marine Drugs, 2019, 38(3): 82-86.
[8] 赵师师, 高旭红, 常君, 等. 石榴皮多糖的三氯乙酸法脱蛋白工艺研究[J]. 广州化工,2015,43(17):64−66. [ZHAO S S, GAO X H, CHANG J, et al. Study on the deproteinization of the crude polysaccharide from pomegranate peel with trichloroacetic acid method[J]. Guangzhou Chemical Industry,2015,43(17):64−66. ZHAO S, GAO X, CHANG J, et al. Study on the deproteinization of the crude polysaccharide from pomegranate peel with trichloroacetic acid method[J]. Guangzhou Chemical Industry, 2015, 43(17): 64-66.
[9] 陈越, 宋振康, 张海悦. 三氯乙酸法脱除龙葵果多糖中蛋白质的工艺优化[J]. 食品与发酵工业,2020,46(24):198−203. [CHEN Y, SONG Z K, ZHANG H Y. Study on optimization of response surface for the removement of protein from polysaccharide of Solanum nigrum fruit by chloroacetic acid method[J]. Food and Fermentation Industries,2020,46(24):198−203. CHEN Y, SONG Z, ZHANG H. Study on optimization of response surface for the removement of protein from polysaccharide of Solanum nigrum fruit by chloroacetic acid method[J]. Food and Fermentation Industries, 2020, 46(24): 198-203.
[10] ZENG X, LI P, CHEN X, et al. Effects of deproteinization methods on primary structure and antioxidant activity of Ganoderma lucidum polysaccharides[J]. International Journal of Biological Macromolecules,2019,126:867−876. doi: 10.1016/j.ijbiomac.2018.12.222
[11] MOHAMMED J K, MAHDI A A, AHMED M I, et al. Preparation, deproteinization, characterization, and antioxidant activity of polysaccharide from Medemia argun fruit[J]. International Journal of Biological Macromolecules,2019,155:919−926.
[12] 谢建华. 青钱柳多糖的分离纯化与结构解析及其生物活性研究[D]. 南昌: 南昌大学, 2007 XIE J H. Studies on the purification, structure and bioactivities of polysaccharides from Cyclocarya paliurus (Batal.) Iljinskaja[D]. Nanchang: Nanchang University, 2007.
[13] ZHAO M, HAN Y, LI J, et al. Structural characterization and antioxidant activity of an acetylated Cyclocarya paliurus polysaccharide (Ac-CPP0.1)[J]. International Journal of Biological Macromolecules,2021,171:112−122. doi: 10.1016/j.ijbiomac.2020.12.201
[14] CHENG H, HUANG G. Extraction, characterisation and antioxidant activity of Allium sativum polysaccharide[J]. International Journal of Biological Macromolecules,2018,114:415−419. doi: 10.1016/j.ijbiomac.2018.03.156
[15] DUBIOS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugar and related substances[J]. Analytical Chemistry,1956,28:250−256. doi: 10.1021/ac60110a033
[16] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248−254. doi: 10.1016/0003-2697(76)90527-3
[17] 王新嘉, 雷国风, 翟志军, 等. 平菇多糖中蛋白质脱除方法的比较[J]. 食品研究与开发,2017,38(5):8. [WANG X J, LEI G F, ZHAI Z J, et al. Comparison of methods for removing protein from polysaccharide of Pleurotus ostreatus[J]. Food Research and Development,2017,38(5):8. WANG X, LEI G, ZHAI Z, et al. Comparison of methods for removing protein from polysaccharide of Pleurotus ostreatus[J]. Food Research and Development, 2017, 38(5): 8.
[18] ZHANG Y, HAN Y, HE J, et al. Digestive properties and effects of Chimonanthus nitens Oliv polysaccharides on antioxidant effects in vitro and in immunocompromised mice[J]. International Journal of Biological Macromolecules,2021,185:306−316. doi: 10.1016/j.ijbiomac.2021.06.114
[19] 钱朋智, 张梅娟, 郭宏文, 等. 甜菜渣功能糖的制备及单糖组成分析[J]. 中国食品添加剂,2022,33(11):199−206. [QIAN P Z, ZHANG M J, GUO H W, et al. Preparation of functional sugar from beet pulp and analysis of its monosaccharide composition[J]. China Food Additives,2022,33(11):199−206. QIAN P, ZHANG M, GUO H, et al. Preparation of functional sugar from beet pulp and analysis of its monosaccharide composition[J]. China Food Additives, 2022, 33(11): 199-206.
[20] WANG J, LI Z, YANG X, et al. The antitumor role of a newly discovered α-D-glucan from Holotrichia diomphalia Bates as a selective blocker of aldolase A[J]. Carbohydrate Polymers,2021,255:117532. doi: 10.1016/j.carbpol.2020.117532
[21] CHEN H, ZENG J, WANG B, et al. Structural characterization and antioxidant activities of Bletilla striata polysaccharide extracted by different methods[J]. Carbohydrate Polymers,2021,266(3):118149.
[22] WANG L, LUO Y, WU Y, et al. Fermentation and complex enzyme hydrolysis for improving the total soluble phenolic contents, flavonoid aglycones contents and bio-activities of guava leaves tea[J]. Food Chemistry,2018,264:189−198. doi: 10.1016/j.foodchem.2018.05.035
[23] CHEN F, HUANG G, YANG Z, et al. Antioxidant activity of Momordica charantia polysaccharide and its derivatives[J]. International Journal of Biological Macromolecules,2019,138:673−680. doi: 10.1016/j.ijbiomac.2019.07.129
[24] 陈新仁, 吴琼, 郑成. 银耳多糖的分子修饰及抗氧化作用的研究[J]. 安徽农学通报,2013,19(17):17−18,38. [CHEN X R, WU Q, ZHENG C. Molecular modification of polysaccharides and antioxidant effect of Silver Fungus[J]. Anhui Agricultural Science Bulletin,2013,19(17):17−18,38. CHEN X, WU Q, ZHENG C. Molecular modification of polysaccharides and antioxidant effect of Silver Fungus[J]. Anhui Agricultural Science Bulletin, 2013, 19(17): 17-18, 38.
[25] HUANG G, CHEN Y, WANG X. Extraction and deproteinization of pumpkin polysaccharide[J]. International Journal of Food Science Nutrition,2021,62(6):568−71.
[26] 李洁, 陈琳, 刘海棠, 等. 银条菜粗多糖脱蛋白的方法研究[J]. 天津科技大学学报,2022,37(1):18−22,27. [LI J, CHEN L, LIU H T, et al. Study of deproteinization method of crude polysaccharides from Stachys floridana Schuttl. ex Benth[J]. Journal of Tianjin University of Science & Technology,2022,37(1):18−22,27. LI J, CHEN L, LIU H, et al. Study of deproteinization method of crude polysaccharides from Stachys floridana Schuttl. ex Benth[J]. Journal of Tianjin University of Science & Technology, 2022, 37(1): 18-22, 27.
[27] CHEN L, HUANG G, HU J. Preparation, deproteinization, characterisation, and antioxidant activity of polysaccharide from cucumber (Cucumis saticus L.)[J]. International Journal of Biological Macromolecules,2018,108:408−411. doi: 10.1016/j.ijbiomac.2017.12.034
[28] HUANG G, SHU S, CAI T, et al. Preparation and deproteinization of garlic polysaccharide[J]. International Journal of Food Science Nutrition,2012,63(6):739−41. doi: 10.3109/09637486.2011.652599
[29] 程芬芬, 刘春, 杨晓泉. 大豆胰蛋白酶抑制剂的制备及性质[J]. 食品科学,2017,38(3):37−44. [CHENG F F, LIU C, YANG X Q, et al. Preparation and properties of soybean trypsin inhibitor[J]. Food Science,2017,38(3):37−44. CHENG F, LIU C, YANG X, et al. Preparation and properties of soybean trypsin inhibitor[J]. Food Science, 2017, 38(3): 37-44.
[30] 薛丽洁, 马丽苹, 焦昆鹏, 等. 挤压对山药中非淀粉多糖理化性质和生物活性的影响[J]. 中国食品添加剂,2022,33(1):164−172. [XUE L J, MA L P, JIAO K P, et al. Effect of extrusion on physicochemical properties and biological activity of non-starch polysaccharides from Chinese yam[J]. China Food Additives,2022,33(1):164−172. doi: 10.19804/j.issn1006-2513.2022.01.027 XUE L, MA L, JIAO K, et al. Effect of extrusion on physicochemical properties and biological activity of non-starch polysaccharides from Chinese yam[J]. China Food Additives, 2022, 33(1): 164-172. doi: 10.19804/j.issn1006-2513.2022.01.027
[31] 申超群. 树蝴蝶多糖结构分析及生物活性研究[D]. 广州: 华南理工大学, 2017 SHEN C Q. Study on structure and bioactivities of polysaccharides from Lobaria kurokauae Yoshim[D]. Guangzhou: South China University of Technology, 2017.
[32] AN Q, YE X, HAN Y, et al. Structure analysis of polysaccharides purified from Cyclocarya paliurus with DEAE-Cellulose and its antioxidant activity in RAW264.7 cells[J]. International Journal of Biological Macromolecules,2020,157:604−615. doi: 10.1016/j.ijbiomac.2019.11.212
[33] 胡文兵, 杨占威, 陈慧, 等. Plackett-Burman和Box-Behnken试验设计优化超声波-酶法提取青钱柳多糖工艺及结构初探[J]. 天然产物研究与开发,2017,29(4):671−679. [HU W B, YANG Z W, CHEN H, et al. Optimization of ultrasonic and enzyme-assisted extraction of polysaccharides from Cyclocarya paliurus by placket-burman and box-behnken experiment and analysis of its structure[J]. Natural Product Research and Development,2017,29(4):671−679. HU W, YANG Z, CHEN H, et al. Optimization of ultrasonic and enzyme-assisted extraction of polysaccharides from Cyclocarya paliurus by placket-burman and box-behnken experiment and analysis of its structure[J]. Natural Product Research and Development, 2017, 29(4): 671-679.
[34] XIE J, ZHANG F, WANG Z, et al. Preparation, characterization and antioxidant activities of acetylated polysaccharides from Cyclocarya paliurus leaves[J]. Carbohydrate Polymers,2015,133:596−604. doi: 10.1016/j.carbpol.2015.07.031
[35] 谭婉碧, 王琴飞, 余厚美, 等. 植物源功能活性多糖的提取及其研究进展[J]. 热带农业科学,2022,42(7):90−98. [TAN W B, WANG Q F, YU H M, et al. Research progress, extraction and functional activity of plant polysaccharides[J]. Chinese Journal of Tropical Agriculture,2022,42(7):90−98. TAN W, WANG Q, YU H, et al. Research progress, extraction and functional activity of plant polysaccharides[J]. Chinese Journal of Tropical Agriculture, 2022, 42(7): 90-98.
[36] 赵晨淏, 刘钧发, 冯梦莹, 等. 不同提取方法对龙眼多糖性质的影响[J]. 现代食品科技,2012,28(10):1298−1304,1305. [ZHAO C H, LIU J F, FENG M Y, et al. Effect of different extraction methods on the properties of longan polysaccharides[J]. Modern Food Science and Technology,2012,28(10):1298−1304,1305. ZHAO C, LIU J, FENG M, et al. Effect of different extraction methods on the properties of longan polysaccharides[J]. Modern Food Science and Technology, 2012, 28(10): 1298-1304, 1305.
[37] SUN Y, HOU S, SONG S, et al. Impact of acidic, water and alkaline extraction on structural features, antioxidant activities of Laminaria japonica polysaccharides[J]. International Journal of Biological Macromolecules,2018,112:958−995.
[38] TANG Y, ZHU Z, LIU Y, et al. The chemical structure and anti-aging bioactivity of an acid polysaccharide obtained from Rose buds[J]. Food & Function,2018,9(4):2300−2312.
[39] 杨兵. 拐枣多糖的分离纯化和结构解析及其降血糖活性研究[D]. 重庆: 西南大学, 2020 YANG B. Isolation, purification, structural identification and hypoglycemic activity of polysaccharides from Hovenia dulcis[D]. Chongqing: Southwest University, 2020.
[40] JI X, ZHANG F, ZHANG R, et al. An acidic polysaccharide from Ziziphus jujuba cv. Muzao: Purification and structural characterization[J]. Food Chemistry,2019,274:494−499. doi: 10.1016/j.foodchem.2018.09.037
[41] 李彬, 陈向楠, 张建法, 等. 产胞外多糖菌株的筛选及胞外多糖结构分析[J]. 生物技术通报,2016,32(5):165−171. [LI B, CHEN X N, ZHANG J F, et al. Screening of exopolysaccharide-producing strains and structural analysis of the exopolysaccharides[J]. Biotechnology Bulletin,2016,32(5):165−171. LI B, CHEN X, ZHANG J, et al. Screening of exopolysaccharide-producing strains and structural analysis of the exopolysaccharides[J]. Biotechnology Bulletin, 2016, 32(5): 165-171.
[42] 赵谋明, 刘敏, 林恋竹, 等. 山苦茶多糖结构表征及抗氧化活性研究[J]. 现代食品科技,2015,31(7):61−66,276. [ZHAO M M, LIU M, LIN L Z, et al. Structural characteristics and antioxidant activity of polysaccharides from Mallotus oblongifolius[J]. Modern Food Science and Technology,2015,31(7):61−66,276. ZHAO M, LIU M, LIN L, et al. Structural characteristics and antioxidant activity of polysaccharides from Mallotus oblongifolius[J]. Modern Food Science and Technology, 2015, 31(7): 61-66, 276.
[43] 赵志强, 朱叙丞, 冯真颖, 等. 沙棘果多糖的理化特征及其体外抗氧化活性[J]. 食品工业科技,2023,44(13):30−38. [ZHAO Z, ZHU X, FENG Z, et al. Physicochemical characteristic and antioxidant activity in vitro of sea buckthorn fruit polysaccharide[J]. Science and Technology of Food Industry,2023,44(13):30−38. ZHAO Z, ZHU X, FENG Z, et al. Physicochemical characteristic and antioxidant activity in vitro of sea buckthorn fruit polysaccharide[J]. Science and Technology of Food Industry, 2023, 44(13): 30-38.
[44] 吴金祥, 李荣丽, 吴喆超, 等. 不同分子质量水溶性大豆皮膳食纤维的单糖组成、结构、性质研究[J]. 中国粮油学报,2022,37(7):39−45. [WU J X, LI R L, WU Z C, et al. Monosaccharide composition, structure and properties of soluble dietary fiber with different molecular mass from soybean hulls[J]. Journal of the Chinese Cereals and Oils Association,2022,37(7):39−45. WU J, LI R, WU Z, et al. Monosaccharide composition, structure and properties of soluble dietary fiber with different molecular mass from soybean hulls[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(7): 39-45.
[45] 张奇, 冯峰, 杨淑玲, 等. 不同产地霸王花粗多糖的单糖组成及体外抗氧化活性[J]. 上海交通大学学报(农业科学版),2019,37(2):83−89. [ZHANG Q, FENG F, YANG S, et al. Studies on monosaccharide composition and antioxidant activity of crude polysaccharide from Hylocereus undatus (Haw.) urilt. et. Rose of different regions[J]. Journal of Shanghai Jiaotong University (Agricultural Science),2019,37(2):83−89. doi: 10.3969/J.ISSN.1671-9964.2019.02.014 ZHANG Q, FENG F, YANG S, et al. Studies on monosaccharide composition and antioxidant activity of crude polysaccharide from Hylocereus undatus(Haw.) urilt. et. Rose of different regions[J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2019, 37(2): 83-89. doi: 10.3969/J.ISSN.1671-9964.2019.02.014
[46] 侯令. 硫酸酯化苹果渣水溶性多糖结构表征和生物活性研究[D]. 西安: 陕西科技大学, 2017 HOU L. Primary structural characterization and biological activity study of sulfated apple pomace polysaccharides[D]. Xi’an: Shaanxi University of Science and Technology, 2017.
-
期刊类型引用(1)
1. 杜晓仪,杨继国,徐玉娟,吴继军,余元善,邹波,彭健,李璐. 不同益生菌对三华李发酵果汁品质及其体外消化特性的影响. 食品工业科技. 2024(02): 143-151 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:


 下载:
下载:



