An Interlaboratory Method Applicability Study of GB 4789.40-2016 and ISO 22964:2017 for the Detection of Cronobacter spp. in Powdered Infant Formula
-
摘要: 克罗诺杆菌属(原阪崎肠杆菌)可在婴幼儿配方粉(Powdered Infant Formula,PIF)中长期存活。随着食品贸易的全球化,人们对婴幼儿配方粉(PIF)中克罗诺杆菌的污染尤为关注。本文参照ISO 16140-2 2016中方法比对的原则要求,对检测PIF中克罗诺杆菌的中国标准方法GB 4789.40-2016(参考方法)和欧盟标准方法EN ISO 22964:2017(替代方法)进行了方法比较研究。共有12个外部实验室参与检测3个不同污染水平(0 MPN/10 g, 1.299 MPN/10 g和2.210 PMN/10 g)下添加了测试菌株的576份盲样的测试。结果表明,在低污染水平和高污染水平下,GB 4789.40-2016的灵敏度分别为80.00%和81.16%,而ISO 22964:2017对应的灵敏度分别为90.00%和97.10%。无论污染程度如何,相对检测水平(RLODs)都低于接受限(AL=2.5)。同时,采用AOAC指南中提出的检测概率(POD)模型对统计数据进行了分析,结果显示替代方法和参考方法之间没有统计学上的显著差异。据此得出用于检测PIF中阪崎克罗诺杆菌的GB 4789.40-2016方法与ISO 22964:2017方法具有等效性。Abstract: It is documented that Cronobacter spp. (formely Enterobacter sakazakii) can survive in powdered infant formula (PIF) for a long period, and special concerns have been raised about the safety of powdered infant formula (PIF) contaminated by Cronobacter spp. with the globalization of the food supply. This study compared the methods for detecting Cronobacter spp. in PIF of the Chinese standard method GB 4789.40-2016 (reference method) and the European standard method EN ISO 22964:2017 (alternative method) according to the principle requirements of method comparison in ISO 16140-2 2016. A total of 576 blind-coded test portions of the product spiked with the test strain at three different contamination levels (0 MPN/ 10 g, 1.299 MPN/10 g and 2.210 PMN/10 g) were analyzed by 12 participating laboratories. The results showed that the sensitivity of GB 4789.40-2016 was 80.00% at the low contamination level and 81.16% at the high level, while those of ISO 22964:2017 were 90.00% and 97.10%, respectively. The relative levels of detection (RLODs) were below the acceptance limit (AL=2.5) regardless of the contamination level, and the probability of detection (POD) model proposed in the AOAC guidelines was analyzed. Results revealed no statistically significant difference between the alternative and reference methods. It was concluded that the GB 4789.40-2016 method for the detection of C. sakazakii in PIF was equivalent to the ISO 22964:2017 method.
-
Keywords:
- method comparison /
- Cronobacter /
- powdered infant formula /
- detection /
- equivalence
-
基于生理生化特征和DNA杂交和16s rRNA测序等分子生物学方法将克罗诺杆菌(原阪崎肠杆菌)归类为肠杆菌科的一个新的属即克罗诺杆菌属(Cronobacter spp.)[1]。该属包括7个种,包括阪崎克罗诺杆菌(C. sakazakii)、丙二酸盐阳性克罗诺杆菌(C. malonaticus)、苏黎世克罗诺杆菌(C. turicensis)、穆汀斯克罗诺杆菌(C. muytjensii)、都柏林克罗诺杆菌(C. dublinensis)、广泛克罗诺杆菌(C. universalis)、香料克罗诺杆菌(C. condimenti) [2-3]。克罗诺杆菌属菌株是一类条件致病菌,可引起新生儿和免疫力低下人群严重的感染,如脑膜炎、败血症和坏死性小肠结肠炎等疾病[4-5],其中阪崎克罗诺杆菌(C. sakazakii)、丙二酸盐阳性克罗诺杆菌(C. malonaticus)、苏黎世克罗诺杆菌(C. turicensis)被认为是导致大多数严重疾病的致病性较强的克罗诺杆菌[6]。
尽管克罗诺杆菌属菌株的污染来源及其传播方式仍不十分清楚,但被污染的食物,特别是婴幼儿配方粉(PIF),被认为是克罗诺杆菌的主要传播介质,灰尘和空气被认为是次要传播载体[5,7]。文献研究进一步发现,PIF在包装和运输过程中受到克罗诺杆菌属的二次污染也是主要的污染方式之一[8]。同时,生物膜的形成有助于克罗诺杆菌属菌株更好地黏附于设备和包材表面,从而增加了该菌污染PIF的可能性。因此,从原辅料到终产品,对生产PIF的全产业链中的克罗诺杆菌属进行检测和监控,了解克罗诺杆菌的传播途径(如原料或环境)和潜在的污染介质(如婴幼儿配方粉或谷物制品),为预防该菌污染PIF提供更好的监控,为采取控制措施提供可靠的依据[9]。
目前,国际标准化组织和国际乳品联合会推荐的用于检测PIF中克罗诺杆菌的方法主要依赖传统培养﹑分离和形态学/生理生化方法。一般来说,ISO 22964:2017被欧洲地区列为强制执行的区域性标准方法。在中国,GB 4789.40-2016被指定为检测PIF中克罗诺杆菌属的官方标准检验方法[10]。对于已批准的定性检测标准方法,这些传统培养法的共同特点和检验程序包括预增菌、选择性增菌、生化和/或血清学确认等步骤[11-12]。然而,不同标准检测方法在称样量、选择性培养基和培养温度等整个样品检测流程的个别步骤存在一定差异,可能会引起检测灵敏度和特异性等检测指标的差异。
基于对国际合作和数据交流的需求不断增加,特别是在食源性疾病爆发期间,标准方法的一致性已成为必要[13]。从监管角度来看,微生物标准通常由不同级别的公共机构(如国家、区域和国际)定义。每个级别采用不同的标准方法,并根据自己的检测方法建立微生物标准,可能会导致检测结果的解释出现差异和混乱,此外还可能增加检测数量和产品的检验成本。特别是在全球食品贸易中,如果出口国和进口国使用不同的国家标准方法,检验工作就会重复进行,贸易延误就不可避免[13]。因此,评估和建立标准方法之间的等效性,对于确保全球食品贸易立法的统一和食品的质量控制具有重要的指导意义。
通过比较研究建立替代方法和标准方法之间的等效性是方法验证的一个重要部分[14]。在正式的方法验证过程中,监管部门或有资质的第三方组织根据国际或地区认可的验证准则进行研究,主要按照国际公认的两个主要验证准则进行的,即AOAC国际方法委员会的《食品微生物官方分析方法的定性和定量验证准则》[15](以下简称“AOAC指南”)和ISO 16140系列《食品链微生物学-方法验证》(以下简称“ISO 16140”)[16-18]。我国认证认可监督管理委员会最近发布了指导食品微生物检测标准方法等效性评价的国家行业标准(RB/T 037-2020)[19]。本研究的设计方案主要遵守ISO 16140的原则进行设计和操作。
目前,污染PIF的克罗诺杆菌的真正来源和污染途径等流行病学方面的数据相对较少,同时,多个样品混样检测的操作流程也可能会影响检测方法的性能(特异性和灵敏度等)[20]。面临以上现状和问题,本研究拟对GB 4789.40-2016(参考方法)和ISO 22964:2017(替代方法)两种标准方法进行实验室间比对验证,基于多个实验室提交的数据被用来估计两种检测方法之间的检测性能指标差异,以评估两种标准方法在检测PIF中克罗诺杆菌的结果是否具有等效性。因此,评估和建立不同区域或国家的标准方法之间的等效性[21],能够为全球食品贸易的放行和产品安全性的预防与控制提供重要的数据支撑。
1. 材料和方法
1.1 材料与仪器
阪崎克罗诺杆菌C. sakazakii ATCC 29544 中国工业微生物菌种保藏中心(CICC 22924);非益生菌婴幼儿配方奶粉 根据ISO 16140-2:2016附录A和初步的单一实验室研究得到的结果,选择非益生菌婴幼儿配方奶粉(表1)作为本次研究的食品基质。同一个生产批次的测试产品从当地超市购买。
表 1 测试基质的分类Table 1. Classification of test matrices类别 类型 项目 婴幼儿配方奶粉和
婴幼儿谷类食品a非益生菌婴幼儿
配方奶粉乳清基(乳制品),大豆基
(蔬菜),强化配方注:a食品是根据ISO 16140-2的附件A选择的。 SCIENTZ-SOF/A型冷冻干燥机 宁波新芝冻干设备股份有限公司;Bagnixer 400型拍打器 英特塞恩斯有限公司;BSC-160411A2型生物安全柜 苏州安泰空气技术有限公司;GR1100A型高压灭菌锅 致微仪器有限公司;5424F型离心机 德国艾本德公司;VORTEX 3 型旋涡振荡器 德国IKA公司。
1.2 实验方法
1.2.1 基质中指示菌的测定
根据GB 4789.2-2016和GB 4789.41-2016(方法II),分别测定未人工接种产品的菌落总数(TPC)[22]和肠杆菌科总数(EB)[23],以估计测试产品中指示菌的含量。此外,根据GB 4789.40-2016(参考方法I)[10],对5份100 g婴幼儿配方粉进行克罗诺杆菌属的检测。
1.2.2 阪崎克罗诺杆菌种子液准备
阪崎克罗诺杆菌ATCC 29544在(36±1) ℃下培养18~24 h,并在胰蛋白胨大豆肉汤(TSB)培养基中于55 ℃下热应激10 min。然后将培养液离心(10000 r/min)5 min,用磷酸盐缓冲盐水(PBS,pH7.4)清洗,将颗粒重新悬浮在PBS中,后干燥48 h后形成粉末状培养物。通过向500 g婴幼儿配方粉中添加粉末状培养物,然后摇晃15~20 min来制备种子。准备好的种子在环境温度下储存至少2周,以使目标菌能够适应产品基质。
1.2.3 人工污染目标菌株的婴幼儿配方奶粉样品的制备
在产品中批量添加种子培养物,以达到1~3 CFU/10 g的低阪崎克罗诺杆菌污染水平(L1)和2~6 CFU/10 g的略高污染水平(L2)[16]。在检验程序中,未添加的产品被用作阴性对照(L0)(表2)。另外,盲样正式发放前使用最大可能数量估计法(MPN)来确定其人工污染水平[24]。
表 2 人工污染接种水平Table 2. Inoculation level of artificial pollution污染水平 污染浓度 样品数量 接种水平 L0 0 CFU/10 g 8 阴性对照 L1 1~3 CFU/10 g 8 理论检测水平 L2 2~6 CFU/10 g 8 高接种水平 注:实际接种水平L1和L2取决于实验室人工污染后实际测试结果。 1.2.4 样品分发和寄送
共有12家实验室参与该实验室间方法比对研究项目研究,且所有参与的实验室均获得了ISO/IEC 17025(ISO/IEC 17025:2017)的认证[25]。
样品制备完成后,根据表2向12家参与实验室每家发送48份盲样(每个污染水平各16份),添加了3个不同污染水平的测试菌株的测试盲样(含有编码)共制备有576份,并被分装在带有冰袋的等温容器中邮寄到参与实验室,收到样品后,所有样品被立即转移到4 ℃冰箱进行暂存,并应在1~2周内完成测试。
1.2.5 样品测试程序
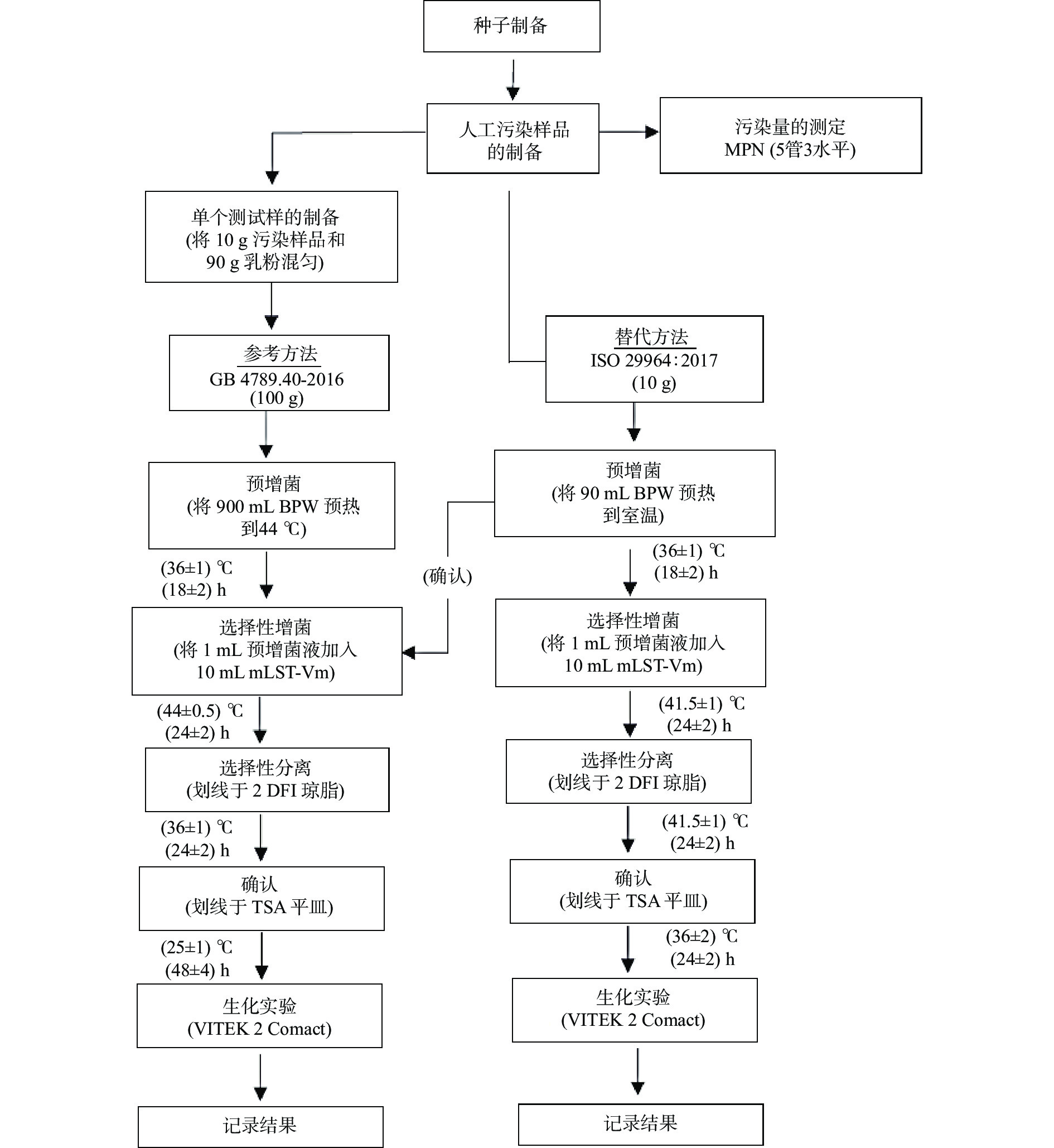
本研究选择GB 4789.40-2016方法I作为参考方法[10],选择ISO 22964:2017作为替代方法[26]。根据ISO 16140:2016的要求,替代方法(ISO 22964:2017)的检测(最终)结果必须由参考方法(GB 4789.40-2016)进一步进行确认。由于参考方法和替代方法没有共同的初始富集步骤,因此本研究属于非配对研究。每个参与实验室中共有24个样品(3个污染水平,每个污染水平8个重复)用参考方法进行检验;同时,共有24个样品用替代方法进行检验,替代方法中的预增菌液同时必须使用参考方法进行确认。详细的测试程序见图1。
1.3 指标测定
1.3.1 特异性
根据L0,参考方法和替代方法的特异性百分比(SP)计算如下。
参考方法的特异性:SPref(%)=(1−P0N)×100 替代方法的特异性:SPalt(%)=(1−CP0N)×100 式中:N是所有L0 结果的数量(份);P0 是指在确认前用空白样品得到的假阳性结果的总数(份);CP0 是用空白样品得到的假阳性结果的总数(份)。
1.3.2 灵敏度
参照方法和替代方法的灵敏度按照单一实验室研究的描述进行计算。实验室间研究中(ND-PD)的接受限(AL)值是根据ISO 16140-2:2016进行计算。
1.3.3 相对检出水平(Relative Levels of Detection,RLOD)
根据ISO 16140:2-2016,根据收集到的数据对各实验室之间的相对检测水平(RLOD)差异进行了评估[27-28]。
1.3.4 检出概率(Probability of Detection,POD)和dPOD
检出概率(POD)值以及任何两个不同污染水平POD值之间的差异(dPOD)值的计算方法参见AOAC验证指南[29]。
1.4 数据处理
收集并整理12家合作实验室的检测数据,数据统计和处理根据ISO 16140-2附录文件和AOAC验证指南附件进行计算(95%置信区间);所有实验均重复8次,统计结果以平均值±SD表示。
2. 结果与分析
2.1 样品中指标微生物测定和人工污染菌株的制备
在未接种目标菌株的样品(五个重复)中,菌落总数(TPC)和肠杆菌科(EB)的总数均小于10 CFU/g,且未检出克罗诺杆菌属菌株。当样品接种人工污染菌进行热应激后,试验菌种数量减少超过0.5 lgCFU/g,表明热激强度足够达到要求。在环境温度下储存的第一周,种子接种物水平下降了1~2 lg CFU/g,2周后变得更加稳定。14 d后,根据表2的污染水平要求,使用数量稳定后的种子接种物分别给两份重量适宜的无克罗诺杆菌属检出的样品分别进行批量接种,接种后的人工污染样品完全均质后使用MPN法进行测试,确定每个人工污染样品的真实污染水平。
2.2 数据收集和分析
2.2.1 数据统计
总共向所有参与者(12个合作实验室)发送了576份添加了3种不同污染水平的阪崎克罗诺杆菌ATCC29544的测试盲样产品,共收到了864份测试结果。
所有参与者收集到的数据显示(表3),实验室10和实验室11的结果中发现了一些异常值。实验室10,有两个样品在L0检测中呈阳性(阴性样品),这表明在样品处理过程中可能存在交叉污染。此外,参考方法中L1的阳性检出率(6/8)高于L2(5/8),而且3个样品的阳性检出结果在参考方法确认前和确认后不一致。实验室11的检测结果显示6个样品的阳性检测结果在用替代方法确认前和确认后在L1和L2中不一致。基于上述原因,在随后的分析中略去了实验室10和实验室11提交的结果。实验室1~9和实验室12的结果被保留。这些结果在表3中进行了总结。在两个污染水平(1.299 MPN/10 g和2.210 PMN/10 g)中都获得了部分阳性检测结果,符合ISO 16140-2的要求。
表 3 10个实验室检测数据统计结果Table 3. Data statistics of 10 labs results from an interlaboratory study污染水平(MPN/10 g) 方法 实验室编号 阳性样品数(npos) 测试样品数(ntested) 方法 实验室编号 阳性样品数目(npos) 测试样品数(ntested) 0 参考方法 1 0 8 替代方法 1 0 8 0 参考方法 2 0 8 替代方法 2 0 8 0 参考方法 3 0 8 替代方法 3 0 8 0 参考方法 4 0 8 替代方法 4 0 8 0 参考方法 5 0 8 替代方法 5 0 8 0 参考方法 6 0 8 替代方法 6 0 8 0 参考方法 7 0 8 替代方法 7 0 8 0 参考方法 8 0 8 替代方法 8 0 8 0 参考方法 9 0 8 替代方法 9 0 8 0 参考方法 12 0 8 替代方法 12 0 8 1.299 参考方法 1 3 8 替代方法 1 4 8 1.299 参考方法 2 3 8 替代方法 2 3 8 1.299 参考方法 3 1 8 替代方法 3 2 8 1.299 参考方法 4 3 8 替代方法 4 3 8 1.299 参考方法 5 2 8 替代方法 5 1 8 1.299 参考方法 6 1 8 替代方法 6 3 8 1.299 参考方法 7 3 8 替代方法 7 3 8 1.299 参考方法 8 3 8 替代方法 8 3 8 1.299 参考方法 9 2 8 替代方法 9 4 8 1.299 参考方法 12 3 8 替代方法 12 1 8 2.210 参考方法 1 5 8 替代方法 1 6 8 2.210 参考方法 2 4 8 替代方法 2 5 8 2.210 参考方法 3 6 8 替代方法 3 8 8 2.210 参考方法 4 6 8 替代方法 4 7 8 2.210 参考方法 5 6 8 替代方法 5 5 8 2.210 参考方法 6 6 8 替代方法 6 7 8 2.210 参考方法 7 5 8 替代方法 7 7 8 2.210 参考方法 8 6 8 替代方法 8 8 8 2.210 参考方法 9 5 8 替代方法 9 8 8 2.210 参考方法 12 7 8 替代方法 12 6 8 总数 80 240 替代方法 95 240 2.2.2 特异性分析
根据1.3.1中的公式,并对收集到的数据进行处理,计算得到参考方法和替代方法的特异性结果都是100%。
2.2.3 灵敏度分析
FPR表示假阳性结果(FP)通常被用来计算假阳性比率。根据替代方法得到的经确认后的检测结果与经参考方法得到的检测结果之间的差异值,再结合实际样品数量来计算假阳性比率。
表4总结了参考和替代方法的灵敏度。污染水平L1和污染水平L2的(ND-PD)值分别为-3和-11,均小于相应的接受限(AL)10.22和9.36。根据ISO 16140-2的相应规定,如果(ND-PD)值小于接受限,则认为两种比较方法是等同的。根据本研究的结果(表4)推断,在两个污染水平(L1和L2)上,替代方法和参考方法的检测结果被认为是等同的。
表 4 10家参与实验室检测灵敏度统计结果Table 4. Summary of data for sensitivity calculation from ten labs参数 污染水平 L1 L2 阳性结果一致性(PA) 21 54 正偏差(PD) 6 13 阴性结果一致性(NA) 50 11 负偏差(ND) 3 2 参考方法的灵敏度(SEref ,%) 80.00 81.16 替代方法的灵敏度(SEalt,% ) 90.00 97.10 相对真实度(RT,%) 88.75 81.25 替代方法的假阳性比率(FPR,%) 0 0 (ND-PD) −3 −11 接受限度(AL) 10.22 9.36 总结 (ND-PD)<AL (ND-PD)<AL 注:RT表示基于同一污染水平的样品经参考方法获得的结果和替代方法获得的结果之间的一致性程度。 2.2.4 RLOD分析
通过将CLL模型拟合为广义线性模型(GLM)来分析实验室间数据。将包括实验室效应的CLL模型拟合到3个水平和10个实验室(不包括10号和11号实验室)的综合数据中,其中1~9、12号实验室的实验室效应Labj,没有发现明显的实验室效应(P=0.16)。偏差检验分析结果表明,替代方法和参考方法没有明显的差异(Dmethod=1,P=0.32)。相比参考方法,替代方法的RLOD值为0.85,90%的CI为0.66~1.11,并低于AL(非配对研究中设定可接受限值2.5),综上表明在检测非益生菌婴幼儿配方奶粉中的阪崎克罗诺杆菌时,替代方法的灵敏度与参考方法没有显著性区别。
2.2.5 POD分析
参考AOAC验证指南使用POD模型对实验室间数据进行分析(表5)。结果显示,在POD值落在0.15和0.85之间的两个污染浓度中,每个实验室内的数据都存在变化。在低污染水平(1.299 MPN/10 g)下,dLPOD值为0.0375。而在稍高的污染水平(2.210 MPN/10 g或100 g)下,dLPOD值为0.1375。根据AOAC验证指南原则,在95%的置信度下,无论是较低的污染水平(1.299 MPN/10 g)还是稍高的污染水平(2.210 MPN/10 g),替代方法和参考方法的检测结果之间均没有显著性差异(置信区间的上限和下限之间均包含 0)。
表 5 实验室间阪崎克罗诺杆菌的检测数据及统计分析结果Table 5. Results of interlaboratory data of detection of Cronobacter sakazakii替代方法 参考方法 浓度(MPN/10 g) 实验室编号 n x PODa或LPODa 95% CI x PODr或LPODa 95% CI dPODa或dLPODa 95% CI 0 1 8 0 0 (0.00,0.046) 0 0 (0.00,0.046) 0.000 (−0.046,0.046) 0 2 8 0 0 0 0 0.000 0 3 8 0 0 0 0 0.000 0 4 8 0 0 0 0 0.000 0 5 8 0 0 0 0 0.000 0 6 8 0 0 0 0 0.000 0 7 8 0 0 0 0 0.000 0 8 8 0 0 0 0 0.000 0 9 8 0 0 0 0 0.000 0 10 8 0 0 0 0 0.000 0 总计 80 0 0.000 0 0 0.000 1.299 1 8 4 0.500 (0.243,0.446) 3 0.375 (0.211,0.408) 0.125 (−0.178,0.105) 1.299 2 8 3 0.375 3 0.375 0.000 1.299 3 8 2 0.250 1 0.125 0.125 1.299 4 8 3 0.375 3 0.375 0.000 1.299 5 8 1 0.125 2 0.250 −0.125 1.299 6 8 3 0.375 1 0.125 0.200 1.299 7 8 3 0.375 3 0.375 0.000 1.299 8 8 3 0.375 3 0.375 0.000 1.299 9 8 4 0.500 2 0.250 0.250 1.299 10 8 1 0.125 3 0.375 −0.200 1.299 总计 80 27 0.3375 24 0.300 0.0375 2.210 1 8 6 0.750 (0.727,0.892) 5 0.625 (0.592,0.789) 0.125 (−0.157,0.083) 2.210 2 8 5 0.625 4 0.500 0.125 2.210 3 8 8 1.000 6 0.750 0.250 2.210 4 8 7 0.875 6 0.750 0.100 2.210 5 8 5 0.625 6 0.750 −0.125 2.210 6 8 7 0.875 6 0.750 0.125 2.210 7 8 7 0.875 5 0.625 0.250 2.210 8 8 8 1.000 6 0.750 0.250 2.210 9 8 8 1.000 5 0.625 0.375 2.210 10 8 6 0.750 7 0.875 -0.125 2.210 总计 80 67 0.8375 56 0.700 0.1375 注:MPN为最大可能的数目;x为阳性结果的数量;CI为置信区间。 3. 讨论与结论
当前,基于传统培养法的标准检测方法费时耗力的现状,有些食品企业采用了快速检测方法作为替代传统的标准方法,但是许多替代方法并没有经过ISO 16140或AOAC OMA原则要求进行系统验证和评价。因此,因为从食品安全和生产的角度来看,基于替代方法得到的假阴性或假阳性的检测结果可能带来不良的后果。随着对国际合作和数据共享的要求越来越高,特别是在发生食源性疾病爆发事件时[13],标准方法之间的一致性对于检测结果的准确性是非常必要的。
该项研究中,对于测试样品的制备,考虑到低污染水平(1~3 MPN/10 g)的样品,人工污染的婴幼儿配方奶粉样品的同质性和均匀性是获得部分阳性样本的关键。 本研究成功实现了部分样本的阳性接种,在低接种水平(1.299 MPN/10 g)的接种样品中,替代方法和参考方法的阳性率分别为33.75%和30%,介于25%和50%之间(表5)。而对于较高水平的接种(2.210 MPN/10 g),替代方法和参考方法的阳性率则分别为83.75%和70%(表5),介于70%和100%之间,其中低水平略低于75%[17]。这可能是由于低接种水平(1.299 MPN/10 g)的样本在制备和获得阳性检出方面具有更大的难度。
该项目中替代方法和参考方法的特异性为均100%,实验室3得到一个假阳性的结果。造成这一假阳性结果的可能的原因是在整个测试过程中的某个步骤出现了交叉污染,例如是由于操作者的不规范操作所引起,或者是在样品预处理过程中使用的不合规的耗材所导致。此外,推测出现这种现象也可能是由于样品检测顺序安排不当,导致了样本之间的交叉污染,但出现这种情况的概率通常是极低的。
污染水平1(1.299 MPN/10 g)和污染水平2(2.210 MPN/10 g)的(ND-PD)值都低于0(表4),这表明替代方法和参考方法对同一污染水平样品的检测灵敏度结果不一致。根据表4反映出替代方法的灵敏度略微高于参照方法,这主要是由于检测程序的不一致等因素所造成的。此外,与参考方法相比,替代方法的RLOD为0.85,90%的CI为0.66~1.11,均低于本次非配对研究中的接受限值AL。替代方法和参考方法之间阳性检测率的差异可能是由于在低污染水平(1.299 MPN/10 g)下目标微生物的不均匀分布及实验室设备和操作人员的差异造成的。
据报道,灵敏度的差异可能是由于两个标准方法之间的样品称样量、混样和测试程序的差异造成的[18,20]。GB 4789.40-2016和ISO 22964:2017之间测试程序的主要差异在于测试样品的初始检测样本重量、增菌温度和选择性培养基不同(图1)。两个预富集步骤是为了恢复克罗诺杆菌属的受损伤细胞,这将可以提高方法的灵敏度。对于第二个富集步骤,与ISO 22964:2017中使用的克罗诺杆菌筛选肉汤相比,GB 4789.40-2016中使用的改良十二烷基硫酸盐色氨酸溶液(mLST)是一种强选择性的富集肉汤,虽然mLST中的成分可以抑制其他非克罗诺杆菌的肠杆菌科细菌的生长[30];但是,也发现极少数克罗诺杆菌属菌株的生长也会被mLST轻微抑制[30]。然而,这种克罗诺杆菌筛选肉汤(CSB)的设计是为了促进所有克罗诺杆菌菌株的生长,而不会刻意抑制其他肠杆菌科细菌的生长[31]。因此,推测mLST中热损伤克罗诺杆菌的回收率略低于CSB中热损伤克罗诺杆菌的回收率,这可能降低了GB 4789.40-2016检测方法的灵敏度。
另一方面,GB 4789.40-2016和ISO 22964:2017中克罗诺杆菌属的培养温度分别为(44.0±0.5) ℃和(41.5±1.0) ℃(图1)。之前的研究发现,与37 ℃相比,克罗诺杆菌属在43 ℃下生长更为适宜[30],选择(44.0±0.5) ℃是因为较高的培养温度会抑制肠杆菌科许多杂菌的生长,并提高热损伤克罗诺杆菌属的恢复速度和检测特异性[31]。此外,Guillaume-Gentil等[32]指出,克罗诺杆菌属在高渗透压(1 mol/L NaCl)下,在37 ℃相对较低的培养温度下,与45 ℃相比表现出更好的生长性能。需要进一步研究的是,通过在Al-Holy-Rasco(AR)肉汤中补充丙酮酸钠和3,3-硫代丙酸等成分,有助于提高浓缩肉汤对一些受胁迫抑制和生长不良的克罗诺杆菌属菌株的生长活力和恢复水平[33]。
本研究中两种标准方法的灵敏度都与富集和整个检测过程密切相关。以前的文献显示,在实验室开展PIF的实际检测过程中,由于增加了背景菌的干扰,混样对PIF中克罗诺杆菌属的富集具有不利影响,而对生长的起始时间没有明显影响[20]。本次研究的检测数据同样证实了混样的做法可能会影响检测方法的性能。未来的研究可能会集中在测试不同富集肉汤和相应培养温度的组合,从自然污染的PIF中最大程度提高回收克罗诺杆菌属细菌的能力水平。
总之,实验室间方法比较研究结果来自12个合作实验室的检测数据,其中10组为有效数据。本项目分别按ISO22964:2017和GB 4789.40-2016对576份人工污染的婴幼儿配方奶粉的克罗诺杆菌进行测试。结果显示:a. 在两个不同的人工污染浓度(2.210 MPN/10 g和1.299 MPN/10 g)下,阪崎克罗诺杆菌ATCC 29544的(ND-PD)值低于可接受限值(AL);b.基于95%置信度水平的非配对数据研究,相对检测水平(RLOD)都低于接受限值(AL);c.根据AOAC验证指南,使用POD模型的计算结果表明,在95%的置信水平下,替代方法与参考方法之间没有统计学上的显著差异。
综上所述,基于婴幼儿配方奶粉基质,采用ISO 22964:2017进行克罗诺杆菌属的检测方法被认为等同于GB 4789.40-2016。
-
表 1 测试基质的分类
Table 1 Classification of test matrices
类别 类型 项目 婴幼儿配方奶粉和
婴幼儿谷类食品a非益生菌婴幼儿
配方奶粉乳清基(乳制品),大豆基
(蔬菜),强化配方注:a食品是根据ISO 16140-2的附件A选择的。 表 2 人工污染接种水平
Table 2 Inoculation level of artificial pollution
污染水平 污染浓度 样品数量 接种水平 L0 0 CFU/10 g 8 阴性对照 L1 1~3 CFU/10 g 8 理论检测水平 L2 2~6 CFU/10 g 8 高接种水平 注:实际接种水平L1和L2取决于实验室人工污染后实际测试结果。 表 3 10个实验室检测数据统计结果
Table 3 Data statistics of 10 labs results from an interlaboratory study
污染水平(MPN/10 g) 方法 实验室编号 阳性样品数(npos) 测试样品数(ntested) 方法 实验室编号 阳性样品数目(npos) 测试样品数(ntested) 0 参考方法 1 0 8 替代方法 1 0 8 0 参考方法 2 0 8 替代方法 2 0 8 0 参考方法 3 0 8 替代方法 3 0 8 0 参考方法 4 0 8 替代方法 4 0 8 0 参考方法 5 0 8 替代方法 5 0 8 0 参考方法 6 0 8 替代方法 6 0 8 0 参考方法 7 0 8 替代方法 7 0 8 0 参考方法 8 0 8 替代方法 8 0 8 0 参考方法 9 0 8 替代方法 9 0 8 0 参考方法 12 0 8 替代方法 12 0 8 1.299 参考方法 1 3 8 替代方法 1 4 8 1.299 参考方法 2 3 8 替代方法 2 3 8 1.299 参考方法 3 1 8 替代方法 3 2 8 1.299 参考方法 4 3 8 替代方法 4 3 8 1.299 参考方法 5 2 8 替代方法 5 1 8 1.299 参考方法 6 1 8 替代方法 6 3 8 1.299 参考方法 7 3 8 替代方法 7 3 8 1.299 参考方法 8 3 8 替代方法 8 3 8 1.299 参考方法 9 2 8 替代方法 9 4 8 1.299 参考方法 12 3 8 替代方法 12 1 8 2.210 参考方法 1 5 8 替代方法 1 6 8 2.210 参考方法 2 4 8 替代方法 2 5 8 2.210 参考方法 3 6 8 替代方法 3 8 8 2.210 参考方法 4 6 8 替代方法 4 7 8 2.210 参考方法 5 6 8 替代方法 5 5 8 2.210 参考方法 6 6 8 替代方法 6 7 8 2.210 参考方法 7 5 8 替代方法 7 7 8 2.210 参考方法 8 6 8 替代方法 8 8 8 2.210 参考方法 9 5 8 替代方法 9 8 8 2.210 参考方法 12 7 8 替代方法 12 6 8 总数 80 240 替代方法 95 240 表 4 10家参与实验室检测灵敏度统计结果
Table 4 Summary of data for sensitivity calculation from ten labs
参数 污染水平 L1 L2 阳性结果一致性(PA) 21 54 正偏差(PD) 6 13 阴性结果一致性(NA) 50 11 负偏差(ND) 3 2 参考方法的灵敏度(SEref ,%) 80.00 81.16 替代方法的灵敏度(SEalt,% ) 90.00 97.10 相对真实度(RT,%) 88.75 81.25 替代方法的假阳性比率(FPR,%) 0 0 (ND-PD) −3 −11 接受限度(AL) 10.22 9.36 总结 (ND-PD)<AL (ND-PD)<AL 注:RT表示基于同一污染水平的样品经参考方法获得的结果和替代方法获得的结果之间的一致性程度。 表 5 实验室间阪崎克罗诺杆菌的检测数据及统计分析结果
Table 5 Results of interlaboratory data of detection of Cronobacter sakazakii
替代方法 参考方法 浓度(MPN/10 g) 实验室编号 n x PODa或LPODa 95% CI x PODr或LPODa 95% CI dPODa或dLPODa 95% CI 0 1 8 0 0 (0.00,0.046) 0 0 (0.00,0.046) 0.000 (−0.046,0.046) 0 2 8 0 0 0 0 0.000 0 3 8 0 0 0 0 0.000 0 4 8 0 0 0 0 0.000 0 5 8 0 0 0 0 0.000 0 6 8 0 0 0 0 0.000 0 7 8 0 0 0 0 0.000 0 8 8 0 0 0 0 0.000 0 9 8 0 0 0 0 0.000 0 10 8 0 0 0 0 0.000 0 总计 80 0 0.000 0 0 0.000 1.299 1 8 4 0.500 (0.243,0.446) 3 0.375 (0.211,0.408) 0.125 (−0.178,0.105) 1.299 2 8 3 0.375 3 0.375 0.000 1.299 3 8 2 0.250 1 0.125 0.125 1.299 4 8 3 0.375 3 0.375 0.000 1.299 5 8 1 0.125 2 0.250 −0.125 1.299 6 8 3 0.375 1 0.125 0.200 1.299 7 8 3 0.375 3 0.375 0.000 1.299 8 8 3 0.375 3 0.375 0.000 1.299 9 8 4 0.500 2 0.250 0.250 1.299 10 8 1 0.125 3 0.375 −0.200 1.299 总计 80 27 0.3375 24 0.300 0.0375 2.210 1 8 6 0.750 (0.727,0.892) 5 0.625 (0.592,0.789) 0.125 (−0.157,0.083) 2.210 2 8 5 0.625 4 0.500 0.125 2.210 3 8 8 1.000 6 0.750 0.250 2.210 4 8 7 0.875 6 0.750 0.100 2.210 5 8 5 0.625 6 0.750 −0.125 2.210 6 8 7 0.875 6 0.750 0.125 2.210 7 8 7 0.875 5 0.625 0.250 2.210 8 8 8 1.000 6 0.750 0.250 2.210 9 8 8 1.000 5 0.625 0.375 2.210 10 8 6 0.750 7 0.875 -0.125 2.210 总计 80 67 0.8375 56 0.700 0.1375 注:MPN为最大可能的数目;x为阳性结果的数量;CI为置信区间。 -
[1] IVERSEN C, LEHNER A, MULLANE N, et al. The taxonomy of Enterobacter sakazakii: Proposal of a new genus Cronobacter gen. nov. and descriptions of Cronobacter sakazakii comb. nov. Cronobacter sakazakii subsp. sakazakii, comb. nov., Cronobacter sakazakii subsp. malonaticus subsp. nov., Cronobacter turicensis sp. nov., Cronobacter muytjensii sp. nov., Cronobacter dublinensis sp. nov. and Cronobacter genomospecies 1[J]. BMC Evol Biol,2007,7:64. doi: 10.1186/1471-2148-7-64
[2] JOSEPH S, CETINKAYA E, DRAHOVSKA H, et al. Cronobacter condimenti sp. nov., isolated from spiced meat, and Cronobacter universalis sp. nov., a species designation for Cronobacter sp. genomospecies 1, recovered from a leg infection, water and food ingredients[J]. Intern J Syst Evol Microbiol,2012,62:1277−1283. doi: 10.1099/ijs.0.032292-0
[3] JOSEPH S, DESAI P, JI Y, et al. Comparative analysis of genome sequences covering the seven Cronobacter species[J]. PLoS ONE,2012,7:e49455. doi: 10.1371/journal.pone.0049455
[4] IVERSEN C, FORSYTHE S. Risk profile of Enterobacter sakazakii, an emerging pathogen associated with infant milk formula[J]. Trends Food Sci Tech,2003,14:443−454. doi: 10.1016/S0924-2244(03)00155-9
[5] ESPEILLAC, S. Importance of using international method analysis of ISO/TC 34/SC 9[C]// Beijing: The 1st Sino-French Standardization Seminar, 2015.
[6] JARADAT Z W, AL MOUSA W, ELBETIEHA A, et al. Cronobacter, an opportunistic food borne pathogen: A review of its virulence and environmental adaptive traits[J]. J Med Microbiol,2014,63:1023−1037. doi: 10.1099/jmm.0.073742-0
[7] JUNG M K, PARK J H. Prevalence and thermal stability of Enterobacter sakazakii from unprocessed ready-to-eat agricultural products and powdered infant formulas[J]. Food Sci Biotechnol,2006,15:152−157.
[8] Peng Fei, He Jing,. Cronobacter spp. in commercial powdered infant formula collected from nine provinces in China: Prevalence, genotype, biofilm formation, and antibiotic susceptibility[J]. Front Microbiol,2022,13:900690. doi: 10.3389/fmicb.2022.900690
[9] HYEIN J, ATHMANYA E, ANGELIKA L,et al. Characterization of Cronobacter sakazakii strains originating from plant-origin foods using comparative genomic analyses and zebrafish infectivity studies[J]. Microorganisms,2022,10:1396.
[10] 中华人民共和国国家卫生和计划生育委员会和国家食品药品监督管理总局. GB 4789.40-2016食品安全国家标准 -食品微生物学检验-克罗诺杆菌属(阪崎肠杆菌)检验 [S]. 2016. National Health and Family Planning Commission of the People's Republic of China and China Food and Drug Administration, GB 4789.40-2016 National food safety standard - food microbiological examination-examination of Cronobacter (Enterobacter sakazakii) [S]. 2016.
[11] NORBERG S, STANTON C, ROSS R P, et al. Cronobacter spp. in powdered infant formula[J]. Journal of Food Protection,2012,75:607−620. doi: 10.4315/0362-028X.JFP-11-285
[12] United States Food and Drug Administration [USFDA]. Isolation and enumeration of Enterobacter sakazakii from dehydrated infant formula[EB/OL]. (2002)Available at: http://www.fda.gov/Food/ScienceResearch/LaboratoryMethods/ucm114665.htm.
[13] ESPEILLAC, S. Importance of using international method analysis of ISO/TC 34/SC 9. 2015[C]// Beijing: Paper presented at the 1st Sino-French Standardization Seminar.
[14] JASSON V, JACXSENS L, LUNING P, et al. Alternative microbial methods: An overview and selection criteria[J]. Food Microbiology,2010,27(6):710−730.
[15] FELDSINE P, ABEYTA C, ANDREWS WH. AOAC International methods committee guidelines for validation of qualitative and quantitative food microbiological official methods of analysis[J]. Journal of AOAC International,2012,85:1187−1200.
[16] International Organization for Standardization. ISO 16140-1:2016 Microbiology of the food chain-Method validation-Part 1: Vocabulary[S]. 2016.
[17] International Organization for Standardization. ISO 16140-2:2016 Microbiology of the food chain-Method validation-Part 2: Protocol for the validation of alternative (proprietary) methods against a reference method[S]. 2016.
[18] International Organization for Standardization. ISO 16140-3:2017 Microbiology of the food chain-Method validation-Part 3: Protocol for the verification of reference and validated alternative methods implemented in a single laboratory[S]. 2017.
[19] 中国国家认证认可监督管理委员会. RB/T 037-2020 食品微生物检测标准方法等效性评价指南[S].2020 Certification and Accreditation Administration of China. RB/T 037-2020 Guidance for evaluating equivalence of food microbiological testing standard methods[S].2020
[20] MILED R B. Impact of pooling powdered infant formula samples on bacterial evolution and Cronobacter detection[J]. International Journal of Food Microbiology,2010,138:250−259.
[21] BENITO A DE, NATHALIE G B, ISABELLE D, et al. Validation of standard method EN ISO 22964:2017-Microbiology of the food chain-Horizontal method for the detection of Cronobacter spp[J]. International Journal of Food Microbiology, 2019, 288: 47-52.
[22] 中华人民共和国国家卫生和计划生育委员会和国家食品药品监督管理总局. GB 4789.2-2016食品安全国家标准-食品微生物学检验-菌落总数测定[S]. National Health and Family Planning Commission of the People's Republic of China and China Food and Drug Administration. GB 4789.2-2016 National food safety standards - microbiological examination of food hygiene-examination of aerobic plate count[S].
[23] 中华人民共和国国家卫生和计划生育委员会和国家食品药品监督管理总局. GB 4789.41-2016 食品安全国家标准 食品微生物学检验-肠杆菌科检验 [S]. National Health and Family Planning Commission of the People's Republic of China and China Food and Drug Administration. GB 4789.41-2016 National food safety standards. Microbiological examination of food hygiene-examination of Enterobacteriaceae [S].
[24] EKELUND F,CHRISTENSEN S, RØNN R, et al. An automated technique for most-probable-number (MPN) analysis of densities of phagotrophic protists with lux AB labelled bacteria as growth medium[J]. J Microbiol Methods,1999,38(3):177−182. doi: 10.1016/s0167-7012(99)00086-x
[25] International Organization for Standardization, ISO/IEC 17025:2017. General requirements for the competence of testing and calibration laboratories[S].
[26] International Organization for Standardization. ISO 22964:2107(E)Microbiology of the food chain-Horizontal method for the detection of Cronobacter spp[S]. 2017.
[27] International Organization for Standardization. RLOD calculation program for method comparison studies[S]. 2015.
[28] International Organization for Standardization. RLOD calculation program for comparing laboratories/methods, version 1[S]. 2015.
[29] WEHLING P, LABUDDE R A, BRUNELLE S L, et al. Probability of detection (POD) as a statistical model for the validation of qualitative methods[J]. J AOAC Int,2011,94(1):335−47.
[30] AL-HOLY M A, SHIN J H, OSAILI T M, et al. Evaluation of a new enrichment broth for detection of Cronobacter spp. in Powdered infant formula[J]. Journal of Food Protection,2011,74:387−393.
[31] IVERSEN C, DRUGGAN P, SCHUMACHER S, et al. Development of a novel screening method for the isolation of “Cronobacter” spp. Enterobacter sakazakii[J]. Applied and Environmental Microbiology,2008,74:2550−2553.
[32] GUILLAUME-GENTIL O, SONNARD V, KANDHAI M C, et al. A simple and rapid cultural method for detection of Enterobacter sakazakii in environmental samples[J]. Journal of Food Protection,2005,68:64−69.
[33] GURTLER J B, KORNACKI J L. Comparison of media supplements to enhance recovery of Salmonella spp. from thermally treated egg albumen[J]. Lett Appl Microbiol,2009,49:503−509.





 下载:
下载:


 下载:
下载:



