Research Progress of Carotenoid Isomerization and Its Effects on Biological Activity and Bioavailability
-
摘要: 类胡萝卜素是自然界中最常见的脂溶性植物色素,具有抗氧化及预防多种疾病的功能。一般而言,天然类胡萝卜素大多以全反式构型存在,生物活性和生物利用度较低。类胡萝卜素异构化成为顺式异构体是提高其应用价值的重要手段。本文在阐述异构化反应机理的基础上,综述了类胡萝卜素的异构化方法(热致异构化、热促异构化、光致异构化等)、影响异构化反应的因素,以及在不同评估方式下异构化对其生物活性和生物利用度的影响,最后对类胡萝卜素异构化过程中存在的问题及未来研究方向进行展望。Abstract: Carotenoids are the most common lipid-soluble plant pigments in nature, which have the functions of antioxidation and prevention of many diseases. In general, most natural carotenoids exist in an all trans configuration, with low biological activity and bioavailability. Cis-isomerization of carotenoids is an important means to improve its application value. On the basis of expounding the isomerization reaction mechanism, this paper reviews the isomerization methods (thermo-isomerization, thermally induced catalytic isomerization, photoisomerization, etc.), factors affecting isomerization reaction, and the effect of isomerization on its biological activity and bioavailability under different evaluation methods. Finally, the problems in the process of carotenoid isomerization and future research directions are proposed.
-
Keywords:
- carotenoid /
- isomerization /
- bioactivity /
- bioavailability
-
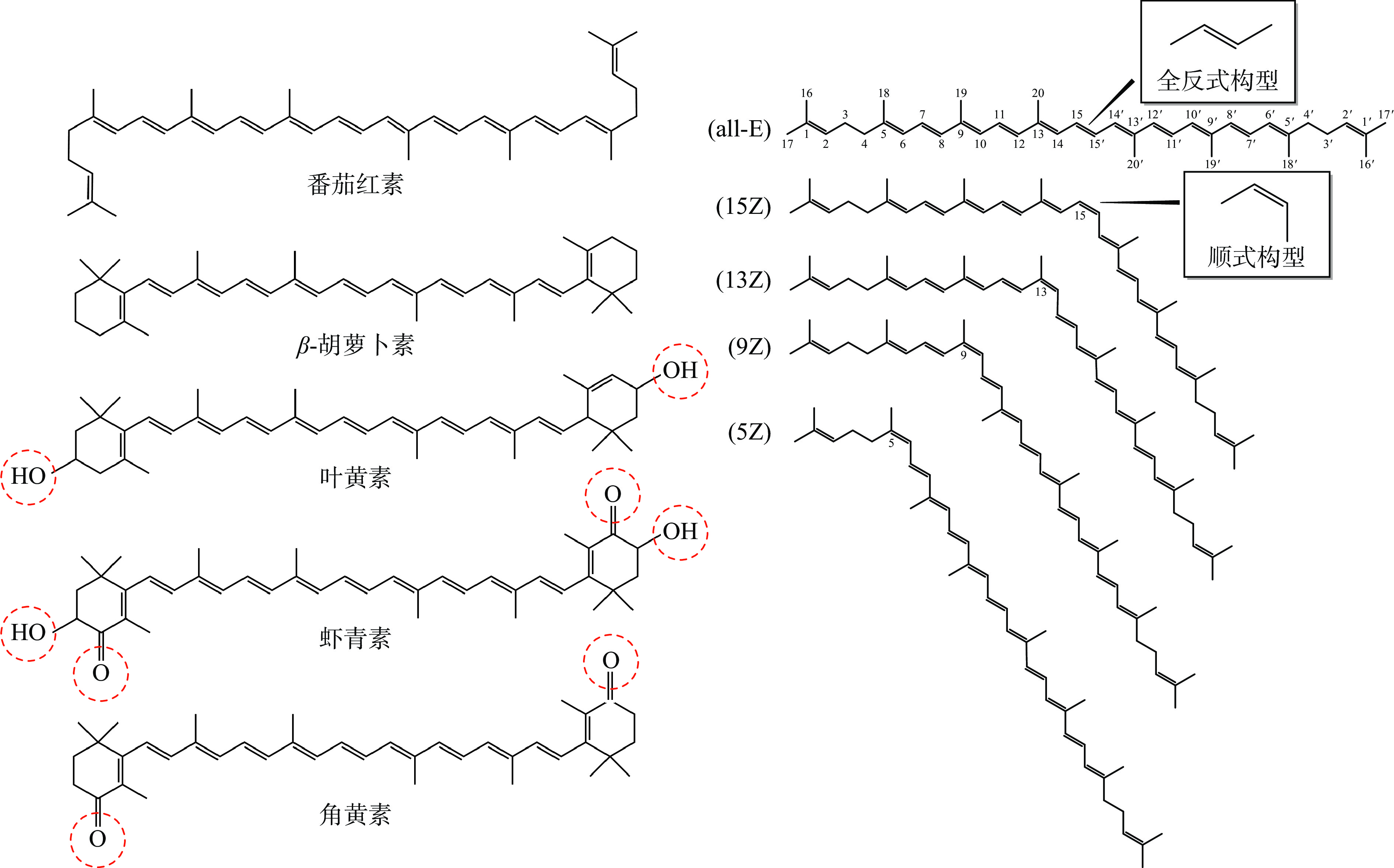
类胡萝卜素是一类普遍存在于动物、植物、真菌和藻类中具有重要生理活性的脂溶性色素[1]。目前经鉴定的类胡萝卜素在750种以上,但人类饮食中常见的不超过10种,主要包括含氧类胡萝卜素,如叶黄素(lutein),虾青素(astaxanthin)、玉米黄质(zeaxanthin)等,以及非含氧类胡萝卜素,如β-胡萝卜素(β-carotene)和番茄红素(lycopene)等,常见类胡萝卜素的分子结构如图1所示[2],其分子中的共轭双键具有捕捉单线态氧自由基的能力,因此类胡萝卜素在防癌抗癌、心血管疾病、老年性黄斑变性、白内障等方面功效显著[3]。
天然类胡萝卜素中的番茄红素90%以全反式构型的晶体形式存在,但研究发现人体血清和组织中的番茄红素50%以上为顺式异构体,即顺式结构更容易被人体消化吸收[4],当顺式类胡萝卜素的结构不同时,其生理活性也存在差异[5]。自1938年Zechmester等[6]首次发现类胡萝卜素易发生异构化反应以来,国内外学者通过物理化学方法(光、热和催化处理等)促进类胡萝卜素从全反式向顺式构型转化做了大量研究工作[7],这对于改善类胡萝卜素的生物利用度,提高其抗氧化能力等具有促进作用。
本文在阐述类胡萝卜素异构化机理的基础上,对类胡萝卜素的异构化方法以及影响异构化的因素进行了总结,同时综述了不同评估方式下类胡萝卜素的异构化对其生物活性和生物利用度的影响,以期为提高类胡萝卜素的活性及应用价值提供参考。
1. 异构化机理
类胡萝卜素分子呈对称性结构,其碳骨架上存在由π电子形成的共轭体系,以及大量的碳碳双键和单键[8]。理论上每个双键都可能存在顺反两种构型,由于双键周围组成基团的分布情况不同,特别是空间位阻效应,类胡萝卜素异构体的构型有限,例如β-胡萝卜素约20种,α-胡萝卜素32种、番茄红素72种[9]。
类胡萝卜素的(几何)异构化是一种化学转换过程,全反式分子呈完全伸展的平面结构,异构化后某些与限制旋转的官能团(如碳碳双键)相连的基团发生位置变换后产生一些单顺式或多顺式异构体[7]。以番茄红素为例,顺反异构体转化可能是因为与碳碳双键相邻的碳原子上的甲基或氢原子与氢原子发生重叠而产生,直链上第1、第4个位置上的原子发生非键合相互作用,两者相互吸引使其分子结构发生不同角度的弯曲和扭转,常见的番茄红素顺式结构是(5Z)-、(9Z)-、(13Z)-和(15Z)-,如图1所示[10]。异构化后的顺式异构体稳定性并不一致,上述结构中最稳定的是(5Z)-番茄红素,具有最强的抗氧化能力,其主要根据相互置换的基团结构大小决定,即-H与H-交互作用较稳定,而-CH3与H-的相互作用稳定性较差[11]。
2. 类胡萝卜素异构化方法及影响因素
2.1 热致异构化反应
热致异构化反应是指在有机相中直接加热,或者在一定条件下直接加热来促进类胡萝卜素构型从全反式向顺式转化[4]。热致异构化因操作简单、成本相对较低,是报道最多的异构化方法。很多因素都会影响类胡萝卜素热致异构化效率和异构体占比,比如溶剂种类、反应温度、反应时间等。另外,由于类胡萝卜素中的共轭双键极易受光、氧、酸、热等外界条件的影响,发生氧化降解,所以在异构化过程中,加强对类胡萝卜素稳定性的保护尤其重要。
2.1.1 溶剂种类对类胡萝卜素异构化的影响
在类胡萝卜素异构化过程中,溶剂的选择起到决定性作用,不同的溶剂体系影响异构化效率和异构体占比。目前主要的溶剂体系可分为两大类,一类是有机溶剂,另一类为油脂,如表1所示。在有机溶剂体系中,溶剂效应的强弱影响着异构化的速率常数。具体来说,CH2Br2、CHCl3和CH2Cl2等烷基卤代物与丙酮和正己烷等其他有机溶剂相比,更易促进异构化反应的进行,顺式异构体占比相对较高,可能是由于CH2Br2、CHCl3和CH2Cl2被认为是含酸性的电子受体,而类胡萝卜素是一种碱性的富含电子的共轭双键结构,促使烷基卤化物的碳原子与全反式类胡萝卜素的双键部分缔合,有利于类胡萝卜素发生顺式异构化[12]。近年来,在食品加工领域中,人们越来越重视食品安全和绿色环保的重要性,在满足类胡萝卜素异构化的同时,对溶剂选择方面的要求不断增加,超临界二氧化碳、乳酸乙酯等对环境友好且使用安全的溶剂逐渐被应用于类胡萝卜素异构化研究中。
表 1 溶剂种类对类胡萝卜素顺式异构化的影响Table 1. Effect of solvent types on cis-isomerization of carotenoids溶剂种类 类胡萝卜素类型 反应条件 顺式异构体占比(%) 参考文献 CH2Cl2/CHCl3/CH2Br2 番茄红素 4 ℃、24 h 19.7/11.4/60 [12] 50 ℃、24 h 77.8/48.4/75 二甲醚 番茄红素 80 ℃、3 h 60以上 [13] 核桃油/黑籽油/杏仁油/葡萄籽油/南瓜籽油/核仁油/芝麻油 番茄红素 120 ℃、5 h 70/73.3/80.1/72.2/73/63.3/58.8 [14] 超临界CO2 β-胡萝卜素 80 ℃、30 MPa、5 h 60以上 [15] 乙醇/己烷/乙酸乙酯/丙酮/乳酸乙酯 β-胡萝卜素 25 ℃、30 min 33.3/25/25.6/32.5/33 [16] 叶黄素 41.7/—/43.2/45.1/44.4 甲基叔丁基醚:甲醇 玉米黄质 75 ℃、50 min — [17] 亚临界乙醇 虾青素 200 ℃、10 MPa、30 s 60.3 [18] 类胡萝卜素作为一种脂溶性色素,油脂作为异构化溶剂时,不仅有利于促进类胡萝卜素在油脂中增溶,更有利于将油脂包裹在类胡萝卜素表面,阻断与氧气相互反应提高稳定性,同时加强顺式异构体的积累[19]。在日常烹饪加工过程中,只需添加少量油脂便能起到促进类胡萝卜素异构化的作用[20−21]。Honda等[21]发现在含有番茄红素的调味料(牛肉酱、橄榄酱、黄芥末)中只添加5%的橄榄油,番茄红素顺式异构体占比便从5%增加到32.3%。油脂作为食品体系中一种重要营养组成成分,由其替代有机溶剂作为类胡萝卜素异构化反应的介质,可一定程度提高其顺式异构体占比,且具有食用安全、绿色环保优势,这将在食品行业中具有更广阔应用前景。
2.1.2 温度对类胡萝卜素异构化的影响
在热致异构化过程中,反应温度对异构化速率影响较大。Honda等[22]通过连续流动反应器,在亚临界乙酸乙酯体系中进行全反式番茄红素异构化反应,结果表明,当反应时间为1 min,温度由80 ℃ 提高到180 ℃时,番茄红素顺式异构体占比由18.1%大幅提高到77.2%,番茄红素保留率从95.7%降低到0.1%,表明在相同反应条件下,温度升高有利于提高类胡萝卜素的异构化速率和其顺式异构体的含量,但升高温度会引起顺式异构体的稳定性下降而发生氧化降解,导致类胡萝卜素损失严重。
热致异构化过程中防止类胡萝卜素的氧化降解显得十分必要。Honda等[23]利用240 ℃过热蒸汽将番茄红素加热5 min使其异构化,并与普通热致异构化进行对比,结果表明,两种方法所得番茄红素顺式异构体含量基本相同(约70%左右),但过热蒸汽法使得番茄红素在异构化过程中处于熔融状态,且低氧环境抑制番茄红素的氧化降解损失,最终番茄红素保留率为90.7%,比普通热致异构化高出22.7%左右。且过热蒸汽法无需有机溶剂和油脂参与反应,符合绿色化学的环保理念。
2.2 热促异构化反应
在溶剂中添加催化剂促进类胡萝卜素异构化反应进程则为热促异构化反应,其中催化剂种类是影响类胡萝卜素异构化效率和异构体占比的关键,常见的催化剂有碘、重金属化合物(四氯化钛、硫酸铁、氯化铁)、硅质材料(MCM-41)、碘掺杂TiO2以及金属络合物(Ti-MCM-41和Fe-MCM-41)以及异硫氰酸酯等[24],其对类胡萝卜素异构化的影响如表2所示。通常催化剂的引入可大幅提高类胡萝卜素顺式异构体占比。上述催化剂虽然催化效果较好,但通常价格高昂,同时某些催化剂本身含有一定毒性或难以从反应物中彻底被分离出来,从而对人体健康产生危害,使其在类胡萝卜素异构化的应用中受到严重限制。
表 2 催化剂种类对类胡萝卜素顺式异构化的影响Table 2. Effect of catalyst type on carotenoid cis-isomers催化剂类型 类胡萝卜素类型 反应条件 是否添加催化剂 顺式异构体占比(%) 参考文献 FeCl3/Fe2(SO4)3/AlCl3/CuSO4/Al2(SO4)3 番茄红素 丙酮、40 ℃、60 min 未加入 20 [25] 加入 70.8/54/50.2/40/29.3 多硫化合物 番茄红素 乙酸乙酯、60 ℃、1 h 未加入 23.3 [26] 加入 68.0 碘 β-胡萝卜素 CH2Cl2、10 min 未加入 12 [27] 加入 85 异硫氰酸烯丙酯 β-胡萝卜素 超临界CO2,50 ℃、20 MPa、30 min 未加入 15 [28] 加入 38 晶态碘参杂TiO2 叶黄素 乙酸乙酯、70 ℃、2 h 未加入 15.3 [29] 加入 34.4 CMC-41/Ti-CMC-41 角黄素 CH2Cl2、10 min 未加入 1 [27] 加入 36/81 开发绿色、无毒、无害的天然催化剂用于类胡萝卜素异构化具有长远优势,Honda等[28]在大蒜、洋葱以及芥末等食物中提取出异硫氰酸酯和多硫化物作为天然催化剂分别加入到所在反应体系中,由于异硫氰酸酯具有较强的亲电性,多硫化物通过加热裂解二硫键,产生具有催化作用的硫基自由基,使得类胡萝卜素顺式异构体含量分别提高2.5倍和3倍左右。
2.3 光致异构化反应
在直接光源或光敏剂催化条件下,促使类胡萝卜素产生异构化反应,此过程被称为光致异构化。其中直接光源条件下处理是将类胡萝卜素置于一定的温度和波长且隔绝氧气的条件下,使得双键基团发生顺式转化。与直接光照相比,向上述反应体系中加入光敏催化剂,可显著提高反应产物中类胡萝卜素的顺式异构体占比。
Li等[30]利用25 ℃荧光灯作为直接光源对β-隐黄素照射10 h,光致异构化反应后得到的其顺式异构体含量为81.5%,而在同样条件下添加碘作为光敏剂后,其顺式异构体含量可达到97.5%。Murakami等[31]将全反式番茄红素分别进行热处理和光照射,结果发现进行热致异构化反应后,其顺式异构体占比达到56.1%,而通过光致异构化反应只有不到5%。Honda等[32]在无光敏剂催化条件下,将全反式番茄红素溶于正己烷,使用波长≥600 nm的灯光照射1 h,得到其顺式异构体占比仅有7.4%;同样条件下加入光敏剂叶绿素a和亚甲基蓝后,顺式异构体异构化占比分别提高至57.4%和51.3%,其中5Z-番茄红素占比显著增加,分别为39.9%和31.7%。
类胡萝卜素光致异构化反应过程中常用的光敏剂主要有碘、叶绿素、赤藓红等,不同类型的光敏剂对类胡萝卜素异构化效果各不相同,如表3所示。其中,碘作为光催化异构化反应中最常见的催化剂,可在短时间内引起自由基发生链式反应,促使全反式向顺式构型转换[33],但碘的加入却可能引起类胡萝卜素分子间发生聚合或聚集,在一定程度上会导致类胡萝卜素的结构破环[29]。同时,碘作为一种不宜在食品生产中使用的有毒物质,导致其应用受限。而叶绿素a、赤藓红B以及亚甲基蓝等无毒无害,在类胡萝卜素异构化过程中可作为碘光敏剂的代替品,具有较好的应用前景。
表 3 光敏剂类型对类胡萝卜素顺式异构化的影响Table 3. Effect of photosensitizer type on cis-isomerization of carotenoids光敏剂类型 类胡萝卜素种类 反应条件 是否加入光敏剂 顺式异构体占比(%) 参考文献 叶绿素a/亚甲基蓝 番茄红素 正己烷、32 ℃、≥600 nm滤光器、1 h 未加入 7.4 [32] 加入 51.3/57.4 赤藓红B/孟加拉玫瑰红 番茄红素 丙酮、32 ℃、480~600 nm滤光器、1 h 未加入 7.7 [32] 加入 47.7/46.4 叶绿素b/脱镁叶绿素b/原焦脱镁叶绿素酸b/
锌细菌叶绿素bβ-胡萝卜素 12 ℃、3000 lx光强、48 h 未加入 12 [34] 加入 22/23/21/22 碘 β-隐黄素 25 ℃荧光灯、10 h 未加入 81.5 [30] 加入 97.5 2.4 其他异构化方法
微波辐射作为一种安全高效的异构化方法,具有操作简单,加热均匀等特点,其异构化原理与热致异构化原理相似,但有研究表明微波辐射下的类胡萝卜素异构化效率高于热致异构化[35]。如Honda等[36]将传统油浴加热与微波辐射进行对比,发现常规热致异构化全反式番茄红素(100 ℃、1 h),其顺式异构体占比可达到13.34%,而在相同温度下微波辐射处理可在3 min内使番茄红素的顺式异构体占比达到42.3%,且其几乎不降解。
除上述几种常见的异构化方法之外,Wei[37]和Gao等[38]对全反式角黄素和β-胡萝卜素进行电解处理和FeCl3化学氧化处理,发现处理后的类胡萝卜素生成的全反式阳离子自由基/基团容易转化为顺式,之后与中性类胡萝卜素交换一个电子而转变为中性顺式类胡萝卜素,其顺式占比能达到40%~60%。该异构化方法属于非热处理,可有效防止加工过程中类胡萝卜素降解,但通常仪器成本较高且电解液含有毒性,所以目前并没有得到广泛应用。
3. 类胡萝卜素异构化对其生物活性和生物利用度的影响
类胡萝卜素种类繁多,但目前具体何种类胡萝卜素异构化对其生物活性和生物利用度的影响的研究相对较少,主要涉及番茄红素、β-胡萝卜素、叶黄素、虾青素、角黄素等几种。类胡萝卜素异构体的生物活性和生物利用度与其不同评估方式和分子结构密切相关。
3.1 番茄红素
番茄红素(C40H56)是一种直链碳氢化合物,具有11个共轭双键和2个非共轭双键,主要存在于番茄、西瓜、番石榴等果实中[16]。作为非含氧类胡萝卜素的一种,其生理活性表现为具有较强的抗氧化能力,显著降低动脉粥样硬化和前列腺癌症的发病风险[39]。然而这些生物活性成分的营养价值取决于生物利用度,即番茄红素进入体循环,达到作用部位的比例[40]。异构化反应能够影响番茄红素的消化吸收,因此对其生物活性和生物利用度具有重要影响。
番茄红素异构化在其生物活性方面扮演着重要角色,目前为了评估异构化对生物活性的影响,所采用的评估方式主要包括:铁离子还原/抗氧化能力法(FRAP)、清除过氧化自由基法(LPSC)、自由基2,2-联苯基-1-苦基肼基(DPPH)和2,2′-连氮基-双-(3-乙基苯并二氢噻唑啉)-6-磺酸)(ABTS)以及动物模型和细胞培养等,如表4所示。BöHM等[41]报道通过TEAC法中自由基类胡萝卜素加合物的形成来测量番茄红素清除过氧化自由基的能力,发现异构化后的番茄红素顺式异构体的抗氧化活性是全反式的1.3倍。Müller等[5]利用番茄红素来抑制亚油酸脂质过氧化,发现5-Z-番茄红素的抗氧化活性明显高于(all-E)-、(9Z)-、(13Z)-番茄红素。然而在使用FRAR法还原Fe3+来评估番茄红素及其异构体对电子转移的耐受性时,发现顺式异构体与反式异构体的抗氧化活性无明显差异[42]。番茄红素顺反异构体抗氧化能力说法不一,可能是由于不同测定方法对番茄红素异构体发挥抗氧化作用存在差异所导致的。但是无论采用何种方法评估都已证实异构化后的番茄红素其顺式异构体存在抗氧化活性,且其不会对机体防御系统产生不利影响[5]。
表 4 不同评估方式下类胡萝卜素异构化对其生物活性的影响Table 4. Effects of carotenoid isomerization on their biological activity under different evaluation methods类胡萝卜素 评估方式 生物活性 参考文献 番茄红素 LPSC测定 抗氧化活性:(all-E)<(Total Z) [5] FRAR测定 抗氧化活性:(all-E)≈(Total Z) [5] β-胡萝卜素 过氧化活性测定 (抗氧化活性)(all-E)≤(Total Z) [43] TEAC测定 抗氧化活性:(all-E)≥(Total Z) [44] 小鼠实验 (抗动脉粥样硬化)(9Z)>(all-E) [45] 叶黄素 DPPH测定 抗氧化活性:(13Z)>(9Z)≈(all-E) [46] FRAP测定 抗氧化活性:(13Z)>(9Z)>(all-E) [46] 虾青素 DPPH测定 抗氧化活性:(9Z)>(all-E) [29] 肠道Caco-2细胞模型 抗氧化应激损伤:(all-E)<(Total Z) [29] 秀丽线虫模型 抗衰老活性:(9Z)>(all-E) [47] 番茄红素异构化对其生物利用度具有积极影响。通常生物利用度通过体内和体外消化试验进行测定,例如体外试验(人类肠道Caco-2细胞培养、体外消化模拟和扩散模型等)、动物模型以及临床试验等[48],如表5所示。在体内试验中,Honda等[49]发现番茄红素顺式异构体在小鼠肝脏中的累积浓度是全反式的3倍以上。此外,Cooperstone等[50]通过人体临床试验发现在食用橘红色番茄汁(顺式异构体含量为94%)后,其番茄红素生物利用度是红色番茄汁(顺式异构体含量为10%)的8.5倍。在体外试验中,Failla等[51]报道了番茄红素全反式异构体在体外胶束和肠道细胞的摄取明显低于顺式异构体。上述不同评估方式得出相同结论,即番茄红素顺式异构体比全反式异构体具有更高的生物利用度。这是由于番茄红素从全反式构型转化为顺式异构体后,其分子结构从针状晶态转变为无定形非晶态,更易溶于胆汁酸胶束,有利于被小肠粘膜细胞所消化吸收。
表 5 不同评估方式下类胡萝卜素异构化对其生物利用度的影响Table 5. Effects of carotenoid isomerization on its bioavailability under different evaluation methods类胡萝卜素 评估方式 生物利用度 参考文献 番茄红素 扩散模型 (all-E)(20.3%)<(Total Z)(72.5%) [52] 体外消化模拟 (all-E)(19%)<(Total Z)(27%) [53] 肠道Caco-2细胞培养 (all-E)(10%~15%)<(Total Z)(26%~30%) [51] 大鼠实验 (all-E)<(Total Z) [54] 人体实验 90% (all-Z)(4.98%)<94% (Total Z)(47.7%) [50] β-胡萝卜素 体外消化模拟 (all-E)≤(Total Z) [55] 肠道Caco-2细胞培养 (all-E)>(Total Z) [56] 大鼠实验 肝脏/肾/皮肤/肾脏/前列腺/肾上腺素/睾丸:(all-E)<(Total Z) [53] 叶黄素 体外消化模拟 (13Z)>(9Z)>(all-E) [57] 肠道Caco-2细胞培养 (13Z)>(9Z)≈(all-E) [29] 3.2 β-胡萝卜素
β-胡萝卜素(C40H56)是一种环状非含氧类胡萝卜素,与番茄红素一同作为人类最常食用的类胡萝卜素之一,主要存在于胡萝卜和南瓜等蔬菜中[58]。β-胡萝卜素作为维生素A的前体,因同时存在两个与11个碳链相连的β-紫罗兰酮环,而具有更大的抗氧化能力,可预防癌症和动脉粥样硬化等多种慢性疾病[59]。
异构化使β-胡萝卜素的生物活性改变,在不同检测方法下,β-胡萝卜素顺反异构体的抗氧化能力存在两种不同结果,如表4所示。在亚油酸甲酯过氧化测试以及大鼠口服剂量测试中,发现异构化后的(9Z)-β-胡萝卜素抗氧化活性高于全反式异构体[43];而在低密度脂蛋白的氧化测试和等效抗氧化能力测定(TEAC)以及PSC法测试时,β-胡萝卜素顺反异构体的抗氧化活性之间无明显差异,甚至顺式异构体相对较差[44]。但是,目前现有研究表明(9Z)-β-胡萝卜素的抗动脉粥样硬化活性更强[60],该结论已经在小鼠试验中得到证实[45],从杜氏藻粉末中分离出的9Z-异构体同样具有抑制动脉粥样硬化的作用[61],但在临床试验中还没有相关报道。
β-胡萝卜素异构化后的顺反异构体在不同评估方式中,其生物利用度会出现两种相反的结果,如表5所示。Deming等[62]与Honda等[54]同样使用动物体内试验模型对β-胡萝卜素顺反异构体的生物利用度进行研究,前者顺式异构体生物利用度高而后者却相反,这可能是由于在喂养动物时,饲料中除了含有β-胡萝卜素外,其它营养物质也发挥作用,并且β-胡萝卜素的物理状态不同,也会导致动物消化吸收能力存在差异。在使用细胞模拟和动物模型两种不同评估方法时,其顺反异构体的生物利用度也出现不同结果,这可能是由于不同的β-胡萝卜素递送体系所导致[46]。由此可见,类胡萝卜素所在的基质,以及随类胡萝卜素一同进入体内的其他营养物质(蛋白质、矿物质、膳食纤维等)都会影响类胡萝卜素的吸收和代谢。
3.3 叶黄素
叶黄素(C40H56O4)是一种含羟基的类胡萝卜素,与其他类胡萝卜素相比,更容易在色谱检测中分离出来[63]。叶黄素普遍存在于玉米、胡萝卜、豌豆和蛋黄中,作为一种有益于人类健康的功能性化合物,在人体生长发育的不同阶段起到的作用也不同,在婴儿时期,叶黄素主要作用于大脑,有利于促进大脑和认知功能的发育;在成人时期,可有效缓解与年龄相关的认知障碍和眼病等发病率[2]。
在叶黄素异构体生物活性的研究方面,Sahin[64]和Gunal[65]等发现叶黄素异构化后产生的顺式异构体可显著缩小脑梗塞体积和脑水肿,并且通过调节G蛋白偶联受体和生长因子来减轻大鼠视网膜光氧化损伤,保护光感受器细胞免受过度的光退化。另外杨成等[46]通过氧自由基清除能力(ORAC-L)、DPPH和FRAP三种方法检测叶黄素顺反异构体的抗氧化活性,结果发现(13Z)-叶黄素>(9Z)-叶黄素≈(all-E)-叶黄素。现有研究表明了叶黄素经异构化后其顺式异构体的功能特性并未消失,且顺式异构体的生物活性优于全反式异构体。
叶黄素异构化对其生物利用度具有积极影响,但在不同评估方式下,异构化后的顺式异构体间的生物利用度存在差异,见表5。例如,在一体外消化模型试验中,显示叶黄素异构体的生物利用度顺序为(13Z)-叶黄素>(9Z)-叶黄素>(all-E)-叶黄素[57];而在Caco-2单细胞模型试验中,对于叶黄素异构体的生物利用度也得到相似结论,即(13Z)-叶黄素≈(9Z)-叶黄素>(all-E)-叶黄素[29]。这些结果表明叶黄素顺式异构体更易溶解且更易与胆盐和胰酶形成胶束,在肠道细胞中转运效率较高,所以具有较高的生物利用度。
3.4 其他类胡萝卜素
虾青素(C40H52O4)是一种酮式类胡萝卜素,主要存在于海洋微生物和动物中,其作为补充剂广泛应用于临床试验,并被证明具有多种药理作用,其中包括抗氧化、抗炎症以及抗凋亡等[66]。如表5所示,杨成[29]利用Caco-2细胞考察其顺反异构体抗氧化能力时发现,在吸收效率相同时,顺式异构体的抗氧化应激损伤的能力高于全反式;秀丽隐杆线虫的抗衰老性能试验也证实,通过改变调节寿命途径的基因表达,(9Z)-虾青素延长线虫寿命的效果优于(all-E)-虾青素[47]。
此外,角黄素(C40H52O2)作为一种强效抗氧化剂,(9Z)-角黄素对DPPH、超氧阴离子自由基和活性氧的清除能力高于全反式异构体[67]。并且在利用角黄素异构体考察对THP-1巨噬细胞的促凋亡作用时发现,(9Z)-角黄素促凋亡效果优于(all-E)-角黄素[68]。
综上所述,类胡萝卜素异构化对生物利用度和生物活性的影响不容忽视,选择不同的评估方式能够较全面地了解类胡萝卜素顺反异构体的功能特性,从而拓宽其应用领域。目前异构化后的类胡萝卜素的人体试验相对较少,现有评估方式并不能完全模拟类胡萝卜素异构体在人体内消化反应的全部过程,因此在确保异构化类胡萝卜素食用安全的前提下,探索这些类胡萝卜素异构体对人体生物利用度和生物活性的影响势在必行。
4. 结论
近年来类胡萝卜素异构化研究受到人们热切关注。本文综述了类胡萝卜素异构化方法及影响异构化因素,分析了不同评估方式下类胡萝卜素异构化对其生物利用度和生物活性的影响。综合评价当前的研究状况,类胡萝卜素异构化的研究有待从以下几个方面加强:a.目前的研究对象大多是番茄红素、β-胡萝卜素、叶黄素等常见类胡萝卜素,应加强对其他类胡萝卜素异构化的研究;b.现阶段对类胡萝卜素生物利用度和生物活性的评估方式并不统一,很大程度上造成了评估结果存在差异;c.异构化后的类胡萝卜素容易氧化降解,可以从提高其稳定性的加工工艺进行优化研究,提高其在食品应用中营养价值和功效。
-
表 1 溶剂种类对类胡萝卜素顺式异构化的影响
Table 1 Effect of solvent types on cis-isomerization of carotenoids
溶剂种类 类胡萝卜素类型 反应条件 顺式异构体占比(%) 参考文献 CH2Cl2/CHCl3/CH2Br2 番茄红素 4 ℃、24 h 19.7/11.4/60 [12] 50 ℃、24 h 77.8/48.4/75 二甲醚 番茄红素 80 ℃、3 h 60以上 [13] 核桃油/黑籽油/杏仁油/葡萄籽油/南瓜籽油/核仁油/芝麻油 番茄红素 120 ℃、5 h 70/73.3/80.1/72.2/73/63.3/58.8 [14] 超临界CO2 β-胡萝卜素 80 ℃、30 MPa、5 h 60以上 [15] 乙醇/己烷/乙酸乙酯/丙酮/乳酸乙酯 β-胡萝卜素 25 ℃、30 min 33.3/25/25.6/32.5/33 [16] 叶黄素 41.7/—/43.2/45.1/44.4 甲基叔丁基醚:甲醇 玉米黄质 75 ℃、50 min — [17] 亚临界乙醇 虾青素 200 ℃、10 MPa、30 s 60.3 [18] 表 2 催化剂种类对类胡萝卜素顺式异构化的影响
Table 2 Effect of catalyst type on carotenoid cis-isomers
催化剂类型 类胡萝卜素类型 反应条件 是否添加催化剂 顺式异构体占比(%) 参考文献 FeCl3/Fe2(SO4)3/AlCl3/CuSO4/Al2(SO4)3 番茄红素 丙酮、40 ℃、60 min 未加入 20 [25] 加入 70.8/54/50.2/40/29.3 多硫化合物 番茄红素 乙酸乙酯、60 ℃、1 h 未加入 23.3 [26] 加入 68.0 碘 β-胡萝卜素 CH2Cl2、10 min 未加入 12 [27] 加入 85 异硫氰酸烯丙酯 β-胡萝卜素 超临界CO2,50 ℃、20 MPa、30 min 未加入 15 [28] 加入 38 晶态碘参杂TiO2 叶黄素 乙酸乙酯、70 ℃、2 h 未加入 15.3 [29] 加入 34.4 CMC-41/Ti-CMC-41 角黄素 CH2Cl2、10 min 未加入 1 [27] 加入 36/81 表 3 光敏剂类型对类胡萝卜素顺式异构化的影响
Table 3 Effect of photosensitizer type on cis-isomerization of carotenoids
光敏剂类型 类胡萝卜素种类 反应条件 是否加入光敏剂 顺式异构体占比(%) 参考文献 叶绿素a/亚甲基蓝 番茄红素 正己烷、32 ℃、≥600 nm滤光器、1 h 未加入 7.4 [32] 加入 51.3/57.4 赤藓红B/孟加拉玫瑰红 番茄红素 丙酮、32 ℃、480~600 nm滤光器、1 h 未加入 7.7 [32] 加入 47.7/46.4 叶绿素b/脱镁叶绿素b/原焦脱镁叶绿素酸b/
锌细菌叶绿素bβ-胡萝卜素 12 ℃、3000 lx光强、48 h 未加入 12 [34] 加入 22/23/21/22 碘 β-隐黄素 25 ℃荧光灯、10 h 未加入 81.5 [30] 加入 97.5 表 4 不同评估方式下类胡萝卜素异构化对其生物活性的影响
Table 4 Effects of carotenoid isomerization on their biological activity under different evaluation methods
类胡萝卜素 评估方式 生物活性 参考文献 番茄红素 LPSC测定 抗氧化活性:(all-E)<(Total Z) [5] FRAR测定 抗氧化活性:(all-E)≈(Total Z) [5] β-胡萝卜素 过氧化活性测定 (抗氧化活性)(all-E)≤(Total Z) [43] TEAC测定 抗氧化活性:(all-E)≥(Total Z) [44] 小鼠实验 (抗动脉粥样硬化)(9Z)>(all-E) [45] 叶黄素 DPPH测定 抗氧化活性:(13Z)>(9Z)≈(all-E) [46] FRAP测定 抗氧化活性:(13Z)>(9Z)>(all-E) [46] 虾青素 DPPH测定 抗氧化活性:(9Z)>(all-E) [29] 肠道Caco-2细胞模型 抗氧化应激损伤:(all-E)<(Total Z) [29] 秀丽线虫模型 抗衰老活性:(9Z)>(all-E) [47] 表 5 不同评估方式下类胡萝卜素异构化对其生物利用度的影响
Table 5 Effects of carotenoid isomerization on its bioavailability under different evaluation methods
类胡萝卜素 评估方式 生物利用度 参考文献 番茄红素 扩散模型 (all-E)(20.3%)<(Total Z)(72.5%) [52] 体外消化模拟 (all-E)(19%)<(Total Z)(27%) [53] 肠道Caco-2细胞培养 (all-E)(10%~15%)<(Total Z)(26%~30%) [51] 大鼠实验 (all-E)<(Total Z) [54] 人体实验 90% (all-Z)(4.98%)<94% (Total Z)(47.7%) [50] β-胡萝卜素 体外消化模拟 (all-E)≤(Total Z) [55] 肠道Caco-2细胞培养 (all-E)>(Total Z) [56] 大鼠实验 肝脏/肾/皮肤/肾脏/前列腺/肾上腺素/睾丸:(all-E)<(Total Z) [53] 叶黄素 体外消化模拟 (13Z)>(9Z)>(all-E) [57] 肠道Caco-2细胞培养 (13Z)>(9Z)≈(all-E) [29] -
[1] MAOKA T. Carotenoids as natural functional pigments[J]. Journal of Natural Medicines,2020,74(1):1−16. doi: 10.1007/s11418-019-01364-x
[2] EGGERSDORFER M, WYSS A. Carotenoids in human nutrition and health[J]. Archives of Biochemistry and Biophysics,2018,652:18−26. doi: 10.1016/j.abb.2018.06.001
[3] ELVIRA-TORALES L I, GARCíA-ALONSO J, PERIAGO-CASTóN M J. Nutritional importance of carotenoids and their effect on liver health:A review[J]. Antioxidants,2019,8(7):229. doi: 10.3390/antiox8070229
[4] 孙清瑞. 碘纳米粒催化番茄红素反—顺构型转化及纳米结构脂质载体[D]. 无锡:江南大学, 2016 SUN Q R. E/Z isomerization of lycopene catalyzed by lodine-nanoparticlies and lycopene-loaded nanostructured lipid carriers[D]. Wuxi:Jiangnan University, 2016.
[5] MÜLLER L, GOUPY P, FRÖHLICH K, et al. Comparative study on antioxidant activity of lycopene (Z)-isomers in different assays[J]. Journal of Agricultural and Food Chemistry,2011,59(9):4504−4511. doi: 10.1021/jf1045969
[6] ZECHMEISTER L, TUZSON P. Spontaneous isomerization of lycopene[J]. Nature,1938,141(3562):249−250. doi: 10.1038/141249a0
[7] HONDA M, MAEDA H, FUKAYA T, et al. Effects of Z-isomerization on the bioavailability and functionality of carotenoids:A review[J]. Progress in Carotenoid Research,2018:139−159.
[8] 徐媛. 红葡萄柚番茄红素加工降解机制及其定量构效关系研究[D]. 武汉:华中农业大学, 2013 XU Y. Studies on degeradation mechanism of lycopene from red grapefruit during processing and quantitative structure-activity relationship[D]. Wuhan:Huazhong Agricultural University, 2013.
[9] ZECHMEISTER L E R B. A stereochemical study of methylbixin[J]. Journal of the American Chemical Society,1944,66(3):322−330. doi: 10.1021/ja01231a002
[10] LIANG X, MA C, YAN X, et al. Advances in research on bioactivity, metabolism, stability and delivery systems of lycopene[J]. Trends in Food Science & Technology,2019,93:185−196.
[11] 朱倩, 高瑞萍, 雷琳, 等. 番茄红素热异构化机制及其影响因素研究进展[J]. 食品科学,2018,39(15):310−315 ZHU Q, GAO R P, LEI L. Mechanism and factors influencing thermal isomerization of lycopene:A review[J]. Food Science,2018,39(15):310−315.
[12] HONDA M, TAKAHASHI N, KUWA T, et al. Spectral characterisation of Z-isomers of lycopene formed during heat treatment and solvent effects on the E/Z isomerisation process[J]. Food Chemistry,2015,171:323−329. doi: 10.1016/j.foodchem.2014.09.004
[13] MURAKAMI K, HONDA M, WAHYUDIONO, et al. Thermal isomerization of (all-E)-lycopene and separation of the Z-isomers by using a low boiling solvent:Dimethyl ether[J]. Separation Science and Technology,2017,52(16):2573−2582. doi: 10.1080/01496395.2017.1374412
[14] DINA B, GUANG-YING S, XUE-LING H, et al. Study on low-temperature preparation of high-purity lycopene isomers and their isomerization and degradation in edible oils[J]. Journal of Instrumental Analysis,2021,40(1):27−35.
[15] ONO M, HONDA M, YASUDA K, et al. Production of β-carotene nanosuspensions using supercritical CO2 and improvement of its efficiency by Z-isomerization pre-treatment[J]. The Journal of Supercritical Fluids,2018,138:124−131. doi: 10.1016/j.supflu.2018.04.006
[16] HONDA M, KAGEYAMA H, HIBINO T, et al. Synergistic effects of food ingredients and vegetable oils on thermal isomerization of lycopene[J]. Journal of Oleo Science,2020,69(12):1529−1540. doi: 10.5650/jos.ess20174
[17] MILANOWSKA J, GRUSZECKI W I. Heat-induced and light-induced isomerization of the xanthophyll pigment zeaxanthin[J]. Journal of Photochemistry and Photobiology B:Biology,2005,80(3):178−186. doi: 10.1016/j.jphotobiol.2005.05.004
[18] HONDA M, MURAKAMI K, ZHANG Y, et al. Rapid and continuous astaxanthin isomerization in subcritical ethanol[J]. Industrial & Engineering Chemistry Research,2021,60(39):14060−14068.
[19] HONDA M. Application of E/Z-isomerization technology for enhancing processing efficiency, health-promoting effects, and usability of carotenoids:A review and future perspectives[J]. Journal of Oleo Science,2022,71(2):151−165. doi: 10.5650/jos.ess21338
[20] HONDA M, MURAKAMI K, WATANABE Y, et al. The E/Z isomer ratio of lycopene in foods and effect of heating with edible oils and fats on isomerization of (all-E)-lycopene[J]. European Journal of Lipid Science and Technology,2017,119(8):1600389. doi: 10.1002/ejlt.201600389
[21] HONDA M, KAGEYAMA H, HIBINO T, et al. Impact of global traditional seasonings on thermal Z-isomerization of (all-E)-lycopene in tomato puree[J]. LWT- Food Science and Technology,2019,116:108565. doi: 10.1016/j.lwt.2019.108565
[22] HONDA M, MURAKAMI K, ZHANG Y, et al. High-efficiency lycopene isomerization with subcritical ethyl acetate in a continuous-flow reactor[J]. The Journal of Supercritical Fluids,2021,178:105383. doi: 10.1016/j.supflu.2021.105383
[23] HONDA M, KAGEYAMA H, HIBINO T, et al. Chemical‐free approach for Z‐isomerization of lycopene in tomato powder:hot air and superheated steam heating above the melting point of lycopene[J]. European Journal of Lipid Science and Technology,2019,122(3):1900327.
[24] HONDA M. Carotenoid isomers:A systematic review of the analysis, biological activity, physicochemical property, and methods for isomerization[J]. Studies in Natural Products Chemistry,2021,68:173−220.
[25] WANG Q, YANG C, LIU Y, et al. Efficient E/ Z conversion of (all-E)-lycopene to Z-isomers with a high proportion of (5Z)-lycopene by metal salts[J]. LWT-Food Science and Technology,2022,160:113268. doi: 10.1016/j.lwt.2022.113268
[26] ZHANG Y, HONDA M, KANDA H, et al. Enhanced production of β-carotene suspensions using supercritical CO2 via naturally occurring Z-isomerization-accelerating catalyst[C]//IOP Conference Series:Materials Science and Engineering. IOP Publishing, 2020:012008.
[27] GAO Y, KISPERT L D, KONOVALOVA T A, et al. Isomerization of carotenoids in the presence of MCM-41 molecular sieves:EPR and HPLC studies[J]. The Journal of Physical Chemistry B,2004,108(27):9456−9462. doi: 10.1021/jp036091e
[28] HONDA M, KAGEYAMA H, HIBINO T, et al. Isomerization of commercially important carotenoids (lycopene, β-carotene, and astaxanthin) by natural catalysts:Isothiocyanates and polysulfides[J]. Journal of Agricultural and Food Chemistry,2020,68(10):3228−3237. doi: 10.1021/acs.jafc.0c00316
[29] 杨成. 含氧类胡萝卜素异构体的制备纯化, 吸收代谢及对肠道功能的影响[D]. 无锡:江南大学, 2018 YANG C. Xanthophyll isomers:Rapid preparation, purification, metabolic fate and their effects on the intestinal function[D]. Wuxi:Jiangnan University, 2018.
[30] LI D, XIAO Y, ZHANG Z, et al. Light-induced oxidation and isomerization of all-trans- β-cryptoxanthin in a model system[J]. Journal of Photochemistry and Photobiology B:Biology,2015,142:51−58. doi: 10.1016/j.jphotobiol.2014.11.003
[31] MURAKAMI K, HONDA M, TAKEMURA R, et al. Effect of thermal treatment and light irradiation on the stability of lycopene with high Z-isomers content[J]. Food Chemistry,2018,250:253−258. doi: 10.1016/j.foodchem.2018.01.062
[32] HONDA M, IGAMI H, KAWANA T, et al. Photosensitized E/Z isomerization of (all-E)-lycopene aiming at practical applications[J]. Journal of Agricultural and Food Chemistry,2014,62(47):11353−11356. doi: 10.1021/jf504502t
[33] HONDA M, KAGEYAMA H, HIBINO T, et al. Efficient and environmentally friendly method for carotenoid extraction from paracoccus carotinifaciens utilizing naturally occurring Z-isomerization-accelerating catalysts[J]. Process Biochemistry,2020,89:146−154. doi: 10.1016/j.procbio.2019.10.005
[34] O'NEIL C A, SCHWARTZ S J. Photoisomerization of β-carotene by photosensitization with chlorophyll derivatives as sensitizers[J]. Journal of Agricultural and Food Chemistry,1995,43(3):631−635. doi: 10.1021/jf00051a014
[35] HONDA M, WATANABE Y, MURAKAMI K, et al. Enhanced lycopene extraction from gac ( momordica cochinchinensis spreng.) by the Z‐isomerization induced with microwave irradiation pre‐treatment[J]. European Journal of Lipid Science and Technology,2018,120(2):1700293. doi: 10.1002/ejlt.201700293
[36] HONDA M, SATO H, TAKEHARA M, et al. Microwave‐accelerated Z‐isomerization of (all‐E)‐lycopene in tomato oleoresin and enhancement of the conversion by vegetable oils containing disulfide compounds[J]. European Journal of Lipid Science and Technology,2018,120(7):1800060. doi: 10.1002/ejlt.201800060
[37] CHIH-CHANG WEI, GAO G, KISPERT L D. Selected cis/trans isomers of carotenoids formed by bulk electrolysis and iron(III) chloride oxidation[J]. Journal of the Chemical Society, Perkin Transactions 2,1997,4:783−786.
[38] G G, C W C, A J S, et al. Geometrical isomerization of carotenoids mediated by cation radical/dication formation[J]. The Journal of Physcial Chemisty,1996,100(13):5362−5366.
[39] CHENG H M, KOUTSIDIS G, LODGE J K, et al. Lycopene and tomato and risk of cardiovascular diseases:A systematic review and meta-analysis of epidemiological evidence[J]. Critical Reviews in Food Science and Nutrition,2019,59(1):141−158. doi: 10.1080/10408398.2017.1362630
[40] 于颖, 张维, 谢凡, 等. 改善番茄红素生物利用度的研究进展[J]. 食品科学,2019,40(19):346−352 doi: 10.7506/spkx1002-6630-20181011-094 ZHANG Y, ZHANG W, XIE F, et al. Progress in the improvement of lycopene bioavailability[J]. Food Science,2019,40(19):346−352. doi: 10.7506/spkx1002-6630-20181011-094
[41] BöHM V, PUSPITASARI-NIENABER N L, FERRUZZI M G, et al. Trolox equivalent antioxidant capacity of different geometrical isomers of α-carotene, β-carotene, lycopene, and zeaxanthin[J]. Journal of Agricultural and Food Chemistry,2002,50(1):221−226. doi: 10.1021/jf010888q
[42] CAMPOS-LOZADA G, PéREZ-MARROQUíN X A, CALLEJAS-QUIJADA G, et al. The effect of high-intensity ultrasound and natural oils on the extraction and antioxidant activity of lycopene from tomato ( solanum lycopersicum) waste[J]. Antioxidants,2022,11(7):1404. doi: 10.3390/antiox11071404
[43] LEVIN G, YESHURUN M, MOKADY S. In vivo antiperoxidative effect of 9‐cis β‐carotene compared with that of the all‐trans isomer[J]. Nutrition and Cancer,1997:293−297.
[44] RODRIGUES E, MARIUTTI L R, CHISTé R C, et al. Development of a novel micro-assay for evaluation of peroxyl radical scavenger capacity:Application to carotenoids and structure-activity relationship[J]. Food Chemistry,2012,135(3):2103−2111. doi: 10.1016/j.foodchem.2012.06.074
[45] HARARI A, HARATS D, MARKO D, et al. Supplementation with 9-cis β-carotene-rich alga dunaliella improves hyperglycemia and adipose tissue inflammation in diabetic mice[J]. Journal of Applied Phycology,2013,25(2):687−693. doi: 10.1007/s10811-012-9903-4
[46] YANG C, FISCHER M, KIRBY C, et al. Bioaccessibility, cellular uptake and transport of luteins and assessment of their antioxidant activities[J]. Food Chemistry,2018,249:66−76. doi: 10.1016/j.foodchem.2017.12.055
[47] LIU X, CHEN X, LIU H, et al. Antioxidation and anti-aging activities of astaxanthin geometrical isomers and molecular mechanism involved in caenorhabditis elegans[J]. Journal of Functional Foods,2018,44:127−136. doi: 10.1016/j.jff.2018.03.004
[48] GENG T, BAO S, SUN X, et al. A clarification of concepts related to the digestion and absorption of carotenoids and a new standardized carotenoids bioavailability evaluation system[J]. Food Chemistry,2023,400:134060.
[49] HONDA M, NAKAYAMA Y, NISHIKAWA S, et al. Z-isomers of lycopene exhibit greater liver accumulation than the all-E-isomer in mice[J]. Bioscience, Biotechnology, and Biochemistry,2020,84(2):428−431. doi: 10.1080/09168451.2019.1677144
[50] COOPERSTONE J L, RALSTON R A, RIEDL K M, et al. Enhanced bioavailability of lycopene when consumed as cis‐isomers from tangerine compared to red tomato juice, a randomized, cross‐over clinical trial[J]. Molecular Nutrition & Food Research,2015,59(4):658−669.
[51] FAILLA M L, CHITCHUMROONCHOKCHAI C, ISHIDA B K. In vitro micellarization and intestinal cell uptake of cis isomers of lycopene exceed those of all-trans lycopene[J]. The Journal of Nutrition,2008,138(3):482−486. doi: 10.1093/jn/138.3.482
[52] SUN Q, YANG C, LI J, et al. Lycopene:Heterogeneous catalytic E/Z isomerization and in vitro bioaccessibility assessment using a diffusion model[J]. Journal of Food Science,2016,81(10):C2381−C2389. doi: 10.1111/1750-3841.13419
[53] VERKEMPINCK S, SALVIA-TRUJILLO L, MOENS L, et al. Kinetic approach to study the relation between in vitro lipid digestion and carotenoid bioaccessibility in emulsions with different oil unsaturation degree[J]. Journal of Functional Foods,2018,41:135−147. doi: 10.1016/j.jff.2017.12.030
[54] HONDA M, TAKASU S, NAKAGAWA K, et al. Differences in bioavailability and tissue accumulation efficiency of (all-E)-and (Z)-carotenoids:A comparative study[J]. Food Chemistry,2021,361:130119. doi: 10.1016/j.foodchem.2021.130119
[55] FERRUZZI M G, LUMPKIN J L, SCHWARTZ S J, et al. Digestive stability, micellarization, and uptake of β-carotene isomers by Caco-2 human intestinal cells[J]. Journal of Agricultural and Food Chemistry,2006,54(7):2780−2785. doi: 10.1021/jf0530603
[56] AHERNE S A, DALY T, JIWAN M A, et al. Bioavailability of β-carotene isomers from raw and cooked carrots using an in vitro digestion model coupled with a human intestinal Caco-2 cell model[J]. Food Research International,2010,43(5):1449−1454. doi: 10.1016/j.foodres.2010.04.026
[57] RODRIGUES D B, MARIUTTI L R B, MERCADANTE A Z. An in vitro digestion method adapted for carotenoids and carotenoid esters:Moving forward towards standardization[J]. Food & Function,2016,7(12):4992−5001.
[58] BOHN T, DESMARCHELIER C, EL S N, et al. β-carotene in the human body:Metabolic bioactivation pathways-from digestion to tissue distribution and excretion[J]. Proceedings of the Nutrition Society,2019,78(1):68−87. doi: 10.1017/S0029665118002641
[59] JOHRA F T, BEPARI A K, BRISTY A T, et al. A mechanistic review of β-carotene, lutein, and zeaxanthin in eye health and disease[J]. Antioxidants,2020,9(11):1046. doi: 10.3390/antiox9111046
[60] MILLER A P, CORONEL J, AMENGUAL J. The role of β-carotene and vitamin a in atherogenesis:Evidences from preclinical and clinical studies[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids,2020,1865(11):158635. doi: 10.1016/j.bbalip.2020.158635
[61] RELEVY N Z, RÜHL R, HARARI A, et al. 9-cis β-carotene inhibits atherosclerosis development in female LDLR-/-mice[J]. Functional Foods in Health and Disease,2015,5(2):67−79. doi: 10.31989/ffhd.v5i2.172
[62] DEMING D M, TEIXEIRA S R, ERDMAN JR J W. All-trans β-carotene appears to be more bioavailable than 9-cis or 13-cis β-carotene in gerbils given single oral doses of each isomer[J]. The Journal of Nutrition,2002,132(9):2700−2708. doi: 10.1093/jn/132.9.2700
[63] BECERRA M O, CONTRERAS L M, LO M H, et al. Lutein as a functional food ingredient:Stability and bioavailability[J]. Journal of Functional Foods,2020,66:103771. doi: 10.1016/j.jff.2019.103771
[64] SAHIN K, GENCOGLU H, AKDEMIR F, et al. Lutein and zeaxanthin isomers may attenuate photo-oxidative retinal damage via modulation of g protein-coupled receptors and growth factors in rats[J]. Biochemical and Biophysical Research Communications,2019,516(1):163−170. doi: 10.1016/j.bbrc.2019.06.032
[65] GUNAL M Y, SAKUL A A, CAGLAYAN A B, et al. Protective effect of lutein/zeaxanthin isomers in traumatic brain injury in mice[J]. Neurotoxicity Research,2021,39(5):1543−1550. doi: 10.1007/s12640-021-00385-3
[66] BROTOSUDARMO T H P, LIMANTARA L, SETIYONO E, et al. Structures of astaxanthin and their consequences for therapeutic application[J]. International Journal of Food Science,2020,2020:2156582.
[67] VENUGOPALAN V, TRIPATHI S K, NAHAR P, et al. Characterization of canthaxanthin isomers isolated from a new soil dietzia sp. and their antioxidant activities[J]. Journal of Microbiol Biotechnol,2013,23(2):237−245. doi: 10.4014/jmb.1203.03032
[68] VENUGOPALAN V, VERMA N, GAUTAM H K, et al. 9-cis-canthaxanthin exhibits higher pro-apoptotic activity than all-trans-canthaxanthin isomer in THP-1 macrophage cells[J]. Free Radic Res,2009,43(2):100−105. doi: 10.1080/10715760802616668





 下载:
下载:
 下载:
下载:



