Preparation of Hydrophobic Modified Tapioca Starch and Its Effect on Emulsifying Properties of Myofibrillar Protein
-
摘要: 为了提高木薯淀粉的疏水性,使其作为颗粒乳化剂改善肌原纤维蛋白(myofibrillar protein,MP)的乳化特性,实验利用辛烯基琥珀酸酐(octenyl succinate anhydride,OSA)对原料木薯淀粉(native tapioca starch,NTS)进行疏水改性处理,得到不同改性水平和取代度(DS值)的疏水改性木薯淀粉(octenyl succinate tapioca starch,OSTS),并利用OSTS与MP制备复合乳化液。通过XRD、FT-IR、SEM和PLM分析了OSTS的结构变化,并测定了乳化液的乳液指数(EI值)、乳化活性(emulsifying activity index,EAI)、乳化稳定性(emulsion stability index,ESI)、Zeta-电位、粒径分布、巯基含量和界面蛋白含量。结果显示,在木薯淀粉分子中成功引入了疏水基团,疏水改性处理对木薯淀粉颗粒的晶体结构基本无影响;随淀粉改性水平和DS值的增加OSTS-MP复合乳化液的EAI和ESI呈显著增加趋势(P<0.05),3.0% OSTS-MP复合乳化液稳定性最好;淀粉与MP在复合乳化液中的相互作用对MP空间结构产生了影响,二者在乳化液滴界面存在竞争吸附作用,且改性水平和DS值越高,这种影响和作用越强。研究结果为OSTS在乳化肉糜制品中的应用提供了理论依据。Abstract: In order to improve the hydrophobicity of tapioca starch, and used it as a granular emulsifier to improve the emulsification properties of myofibrillar protein (MP). In this study, a hydrophobic modification of native tapioca starch (NTS) by octenyl succinate anhydride (OSA), which produced ocentyl succinic tapioca starch (OSTS) with different modification levels and degrees of substitution (DS), and the compound emulsions were prepared using OSTS and MP. The structural changes of the OSTS were analyzed by XRD, FT-IR, SEM, and PLM, and the emulsion index (EI), emulsifying activity index (EAI), emulsion stability index (ESI), Zeta-potential, particle size distribution, sulfhydryl content, and interface protein content of the emulsions were determined. The results showed that the hydrophobic groups were successfully introduced in the tapioca starch molecules, and the hydrophobic modification treatment had basically no effect on the crystal structure type of the tapioca starch particles. The EAI and ESI of the OSTS-MP compound emulsions improved significantly (P<0.05) with increased starch modification levels and DS values, which of the 3.0% OSTS-MP compound emulsion had the best stability. The interaction of starch and MP in the compound emulsion impacted on the spatial structure of MP, both of them had a competitive adsorption effect at the emulsion droplet interface, and which of these were enhanced with modification levels and DS values. The results obtained provided a theoretical basis for the application of OSTS in emulsified comminuted meat products.
-
Keywords:
- hydrophobic modified /
- tapioca starch /
- myofibrillar protein /
- emulsifying propertis
-
由于天然淀粉具有亲水性质,其在食品中的应用受到限制。可以通过疏水改性处理在淀粉分子中引入亲油的疏水基团,使其兼具亲水和亲油的双重特性,并具有稳定水包油(O/W)型乳化液的能力,有助于淀粉在食品中尤其是乳化肉糜制品中的应用[1]。利用辛烯基琥珀酸酐(ocentyl succinic anhydride,OSA)对淀粉进行改性处理得到的辛烯基琥珀酸淀粉酯(octenyl succiniate starch,OS-Starch)是公认的安全乳化剂[2]。OS-Starch分子在OSA酯化取代过程同时引入了疏水性烯基长链和亲水性羧酸基团,表现出亲水亲油的两亲特性[3]。OS-Starch无味、无色、廉价、非过敏,在食品体系中的应用十分广泛,作为食品添加剂使用时的限量标准为:改性程度小于3%(OSA使用量低于淀粉干基质量的3%),取代度(DS)不超过0.02[2, 4]。
近年来,乳化肉糜制品(如:香肠、乳化肠、火腿肠等)的产量逐年上升,消费者对肉糜制品的品质要求也越来越高。肌原纤维蛋白(myofibrillar protein,MP)作为肉糜制品原料中重要的功能性蛋白质,其乳化特性对产品的品质会产生直接影响[5-6],同时,产品配料中的淀粉类原料对MP的乳化特性是否有良好的促进和改善作用也直接影响了产品的质量。因此,如何选择更加适合的改性淀粉对于肉糜制品的生产与发展具有重要作用。在提高MP功能特性,尤其是进一步改善MP乳化特性方面更应考虑改性淀粉的疏水特性产生的影响,并深入研究疏水改性淀粉与MP相互作用的机理。OS-Starch属于疏水改性淀粉,目前,OS-Starch制备的乳化液在诸多领域都发挥了其独特的优势和重要作用[7-9],但在肉制品领域的应用较少。
本研究利用OSA对原料木薯淀粉(native tapioca starch,NTS)进行改性处理,改性水平和DS值均控制在食品添加剂限量要求范围内,将得到的OSTS与MP混合制备OSTS-MP复合乳化液,考察不同改性水平和DS值的OSTS对MP乳化特性的影响,并分析OSTS与MP的相互作用机理。为OSTS在乳化肉糜类制品中的应用提供理论依据。
1. 材料与方法
1.1 材料与仪器
木薯淀粉 南京甘汁园糖业有限公司;新鲜猪里脊肉 市场购买;OSA、EGTA、甘氨酸、Tris 上海阿拉丁生化科技股份有限公司;葵花籽油 佳格投资(中国)有限公司;DNTB 美国Sigma公司;十二烷基璜酸钠(SDS) 合肥巴斯夫生物科技有限公司;磷酸二氢钠、磷酸氢二钠等 均为分析纯试剂,国药集团化学试剂有限公司。
JX-2008组织捣碎机 拓赫机电科技(上海)有限公司;UPT 203i偏光显微镜 重庆重光实业有限公司;H2050R-1大容量高速冷冻离心机 湖南湘仪实验室仪器有限公司;FA25D-031-S弗鲁克高剪切分散乳化机 上海弗鲁克科技发展有限公司;Regulus 8100冷场扫描电镜 日本日立公司;D8ADVANCE衍射仪 德国Bruker公司;NICOLET 5700傅立叶红外光谱仪 美国热电尼高力仪器公司;Mastersizer 2000马尔文激光粒度、ZETA电位仪 英国马尔文公司。
1.2 实验方法
1.2.1 OSTS的制备
准确称量50.00 g NTS,与去离子水混合,制成20%(w/w)的淀粉乳液,35 ℃水浴并保持搅拌状态(1000 r/min),设定6个改性水平(OSA添加量分别为淀粉质量的0.5%、1.0%、1.5%、2.0%、2.5%、3.0%),OSA由95%乙醇稀释成10%(w/w)的OSA溶液,2 h内分次向淀粉乳液中添加完,反应3 h,0.5 mol/L NaOH溶液维持反应体系pH8.2~8.4。反应完成后,0.5 mol/L HCl溶液调节pH至6.5,分别用去离子水和95%乙醇清洗两次,离心取沉淀,40 ℃烘干,粉碎,过100目筛,分别得到0.5% OSTS、1.0% OSTS、1.5% OSTS、2.0% OSTS、2.5% OSTS和3.0% OSTS样品备用。
1.2.2 MP的制备
参考Xia等[10]的方法并略有改动,以猪里脊肉为原料提取MP,去除肉中明显的脂肪和结缔组织,切成小肉块并称重,加入4倍体积预冷(4 ℃)的提取液(pH7.0、10 mmol/L磷酸盐缓冲液:其中包括0.1 mol/L NaCl、2 mmol/L MgCl2和 1 mmol/L EGTA),在组织捣碎机中18000 r/min匀浆60 s,得到的肉浆在3500 r/min、2~4 ℃下离心15 min,弃上清液取沉淀,按上述步骤重复两次,得到的沉淀物为粗MP。向粗MP中加入4倍体积预冷(4 ℃)洗液(0.1 mol/L NaCl),匀浆60 s,3500 r/min、2~4 ℃下离心15 min,取沉淀,重复上述操作一次,再取沉淀加入4倍体积洗液,匀浆60 s,4层纱布过滤,滤液用0.1 mol/L HCl调节pH至6.0,3500 r/min、2~4 ℃离心15 min,取沉淀,得肌原纤维蛋白于2~4 ℃保存,48 h内利用,蛋白含量采用双缩脲法测定。
1.2.3 淀粉-MP复合乳化液的制备
参考王家豪[1]的方法略有改动,将MP溶解于50 mmol/L pH6.2的磷酸缓冲液(含有0.6 mol/L NaCl)中,制得MP溶胶,并使蛋白质含量保持0.5%恒定。向MP溶胶中添加2%(w/w)的NTS、OSTS样品,再取葵花籽油与MP溶胶按照质量比1:4的比例混合,高剪切分散乳化机22000 r/min搅打30 s后,得到NTS-MP、OSTS-MP复合乳化液。
1.2.4 OSTS取代度的测定
参考王婵[11]的方法略有改动,准确称取1.00 g淀粉样品,加入5.00 mL盐酸-乙醇溶液(2.50 mol/L),25 ℃、1000 r/min磁力搅拌30 min,加95%乙醇10.00 mL,继续搅拌10 min,过滤,90%乙醇洗去氯离子(用0.10 mol/L硝酸银检验),样品加入60.00 mL去离子水中,沸水浴20 min,趁热用NaOH标准溶液(0.10 mol/L)滴定,酚酞作指示剂,颜色由透明变粉色判定为终点。取代度(degree of substitution,DS)计算公式如下:
DS=162×(A×M)/W1000−209×(A×M)/W (1) 式中:A:耗用0.1 mol/L NaOH标准溶液的体积(mL);W:辛烯基琥珀酸淀粉酯样品的干基质量(g);M:NaOH标准溶液的浓度(mol/L);162:葡萄糖单元分子量;209:OSA分子量减去氢原子分子量。
1.2.5 淀粉颗粒XRD分析
采用D8ADVANCE衍射仪进行物相分析,测试条件:管压40 kV,管流40 mA,起始角5°,终止角40°,扫描速度2°/min,连续扫描。淀粉颗粒相对结晶度(RC)由JADE软件分析衍射图谱,按以下公式计算:
RC=AcAc+Aa×100 (2) 式中:Ac:结晶区域面积;Aa:非结晶区域面积。
1.2.6 淀粉颗粒微观结构观察
1.2.6.1 偏光显微(PLM)观察
称取0.30 g NTS、OSTS与少许去离子水混匀配制成样品液,样品液滴在载玻片上,盖上盖玻片。用偏光显微镜进行观察、拍照。
1.2.6.2 扫描电镜(SEM)观察
将淀粉样品制成1%(m/V)的悬浊液,将每个样品均匀平铺于观察表面,32 ℃烘干1 h。然后,将所用样品镀金膜,加速电压5 kV,在扫描电子显微镜下观察。
1.2.7 淀粉颗粒FT-IR分析
取适量的淀粉干燥样品与光谱级溴化钾(1:100)共同研磨,在常压条件下加压成型,制成透明状片剂,扫描范围为400~4000 cm−1。
1.2.8 乳液指数(EI)测定
参考Marefati等[8]的方法并略有改动,乳液指数(emulsion index,EI)是指乳化液的乳化层相对于乳化液总体积所占的比例,将1.2.3得到的淀粉-MP复合乳化液密封在25 mL的刻度管中,按照式(3)计算EI值。
EI=VcreamVtotal×100 (3) 式中,Vcream:乳化均质后观察到的乳液乳化层体积(mL);Vtotal:乳液总体积(mL),即MP、水、油和淀粉颗粒的总和。
1.2.9 乳化液电势的测定
将1.2.3得到的淀粉-MP复合乳化液注入毛细管吸收池中,用马尔文激光粒度及ZETA电位仪测定乳化液油滴的电势。
1.2.10 乳化液粒径的测定
将1.2.3得到的淀粉-MP复合乳化液以去离子水作为分散介质,分散剂折射率为1.330,用马尔文激光粒度及ZETA电位仪测定乳化液的粒度分布及平均粒径。
1.2.11 EAI、ESI的测定
将1.2.3得到的淀粉-MP复合乳化液,立即用移液器在容器底部取样50 μL,加入5 mL 0.1%的SDS溶液,混匀后在500 nm处测定吸光值,以SDS溶液作为空白。室温放置10 min后再次取样测定。EAI及ESI分别按下式计算:
EAI(m2/g)=2×2.303C×(1−φ)×104×A500×dilution (4) ESI(%)=A10A0×100 (5) 式中:C:样品蛋白浓度(g/mL);φ:油的体积分数(v/v);dilution:稀释倍数;A0:初始乳化液的吸光度;A10:10 min后乳化液的吸光度。
1.2.12 乳化液巯基含量的测定
参考Ellman[12]的方法,取1.5 mL乳化液悬浮于10.0 mL的Tris-甘氨酸缓冲液(0.086 mol/L Tris,0.09 mol/L甘氨酸,4 mmol/L EDTA,8 mol/L尿素,pH8.0)测定总巯基含量;取1.5 mL的乳化液悬浮于10.0 mL的Tris-甘氨酸缓冲液测定活性巯基含量;将以上处理样品分别加50 μL Ellman试剂(4 mg DTNB溶解于1 mL的Tris-甘氨酸缓冲液中),剧烈振荡后在25 ℃条件下水浴1 h,12000×g离心10 min,同时以不加DTNB的为对照,取上清液在412 nm波长处测定吸光度,按式(6)计算活性巯基含量。
巯基含量(µmol/g蛋白质)=73.53×Aρ (6) 式中:73.53=106/1.36×104,1.36×104为摩尔消光系数(L·cm/mol);A:吸光度值;ρ:样品的蛋白浓度(mg/mL)。
1.2.13 界面蛋白含量的测定
将1.2.3得到的淀粉-MP复合乳化液在4 ℃、12000×g离心10 min,离心完成后移取下层清液,用考马斯亮蓝法测定蛋白质含量[1]。
1.3 数据处理
每个实验重复三次,结果表示为平均数±标准差。数据统计分析采用Statistix 8.1(分析软件,St Paul, MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。采用Originpro2021、Sigmaplot 11.0软件作图。
2. 结果与分析
2.1 淀粉颗粒取代度的测定
淀粉颗粒的取代度(DS)是指淀粉分子中每个脱水葡萄糖单元上所接枝OSA基团的平均数量。由表1可知,随OSA处理水平的增加(0.5%~3.0%),OSTS的DS值呈增加趋势(0.0038~0.0121)。FAO/WHO要求合成OS-Starch时,OSA的用量应小于等于淀粉质量的3%,作为食品添加剂使用时改性淀粉产品的DS≤0.02,即100个葡萄糖单元中≤2个羟基被取代。实验制得的OSTS产品OSA用量和DS值均在限量要求范围内,可以在食品中添加和使用。
表 1 不同改性水平OSTS的DS值Table 1. The DS of different levels of modified OSTS不同OSA处理水平的OSTS DS 0.5% OSTS 0.0038 1.0% OSTS 0.0045 1.5% OSTS 0.0082 2.0% OSTS 0.0090 2.5% OSTS 0.0098 3.0% OSTS 0.0121 2.2 淀粉颗粒XRD分析
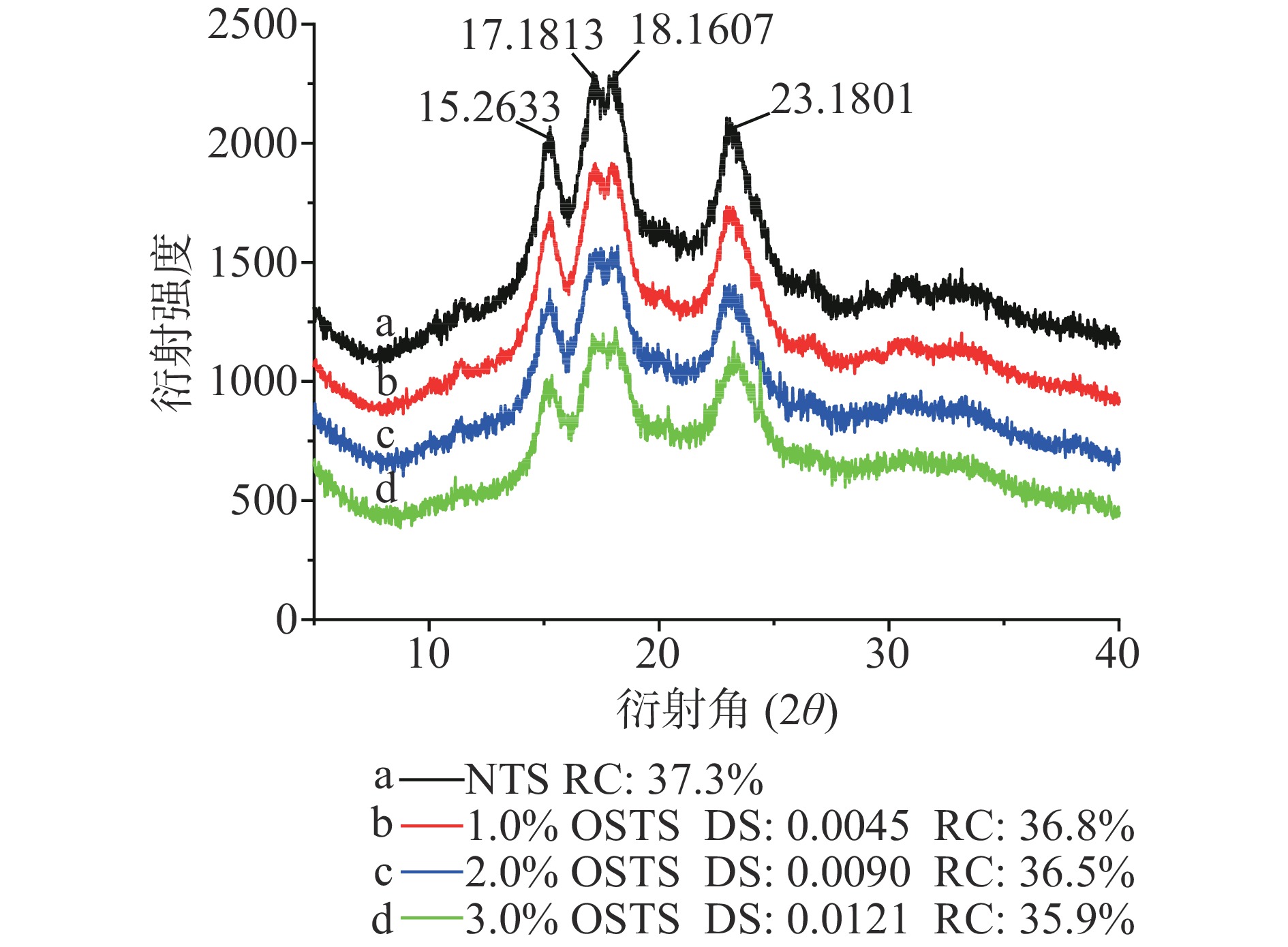
淀粉分子的不同排列方式使淀粉颗粒内部存在结晶结构和非结晶结构(无定型区域)。淀粉分子在结晶结构中是有序排列的,并使淀粉颗粒具有固定的形态;而在非结晶结构中排列无序,使这一区域无固定的形态。淀粉的XRD衍射图谱会呈现出特定的类型图,为淀粉颗粒的有序结晶结构提供了充足的证据,即结晶结构呈尖峰衍射特征,而非结晶结构呈弥散峰衍射特征,可根据XRD图谱的轮廓对淀粉晶体的结构进行分类,为A、B、C和V四种类型[13-15]。如图1所示,选取了NTS、1.0% OSTS、2.0% OSTS和3.0% OSTS进行XRD分析。NTS在2θ=15.2°、17.1°、18.1°和23.1°处出现了四个A型淀粉晶体结构的特征峰[16-17]。经疏水改性处理后,1.0% OSTS、2.0% OSTS和3.0% OSTS等与NTS基本相同,在相应的2θ角位置均出现了A型淀粉相应特征峰,这说明经疏水改性后的木薯淀粉晶形结构没有发生变化。但可以看出,随OSA处理水平的增加,OSTS的XRD图谱中峰强度和锐度有所减弱,相对结晶度(RC)也随OSA处理水平和DS值的增加(0.0045~0.0121)呈降低趋势(36.8~35.9)且变化不大,可以推测改性作用主要发生在木薯淀粉颗粒的非结晶结构,对结晶结构的影响较小。李志坤[18]利用OSA对蜡质玉米淀粉、马铃薯淀粉和豌豆淀粉等进行改性处理也得到相同的结论。
2.3 淀粉颗粒的微观结构
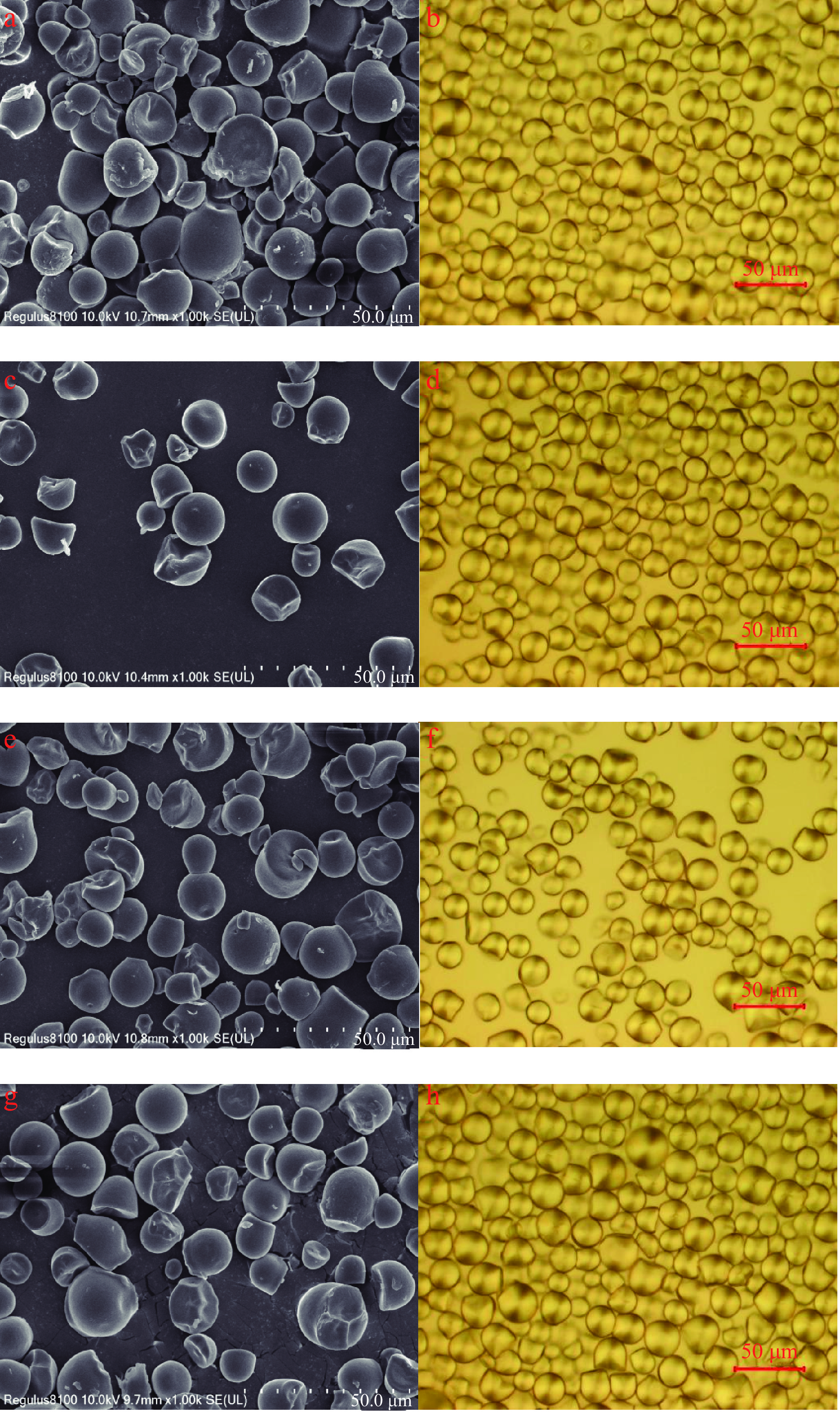
如图2所示,木薯淀粉颗粒直径一般为5~30 μm,较大粒径的淀粉颗粒有断裂或未形成球形,中等和较小尺寸的淀粉颗粒呈圆球形,表面平整光滑,颗粒完整轮廓清晰。SEM照片显示,1.0% OSTS、2.0% OSTS和3.0% OSTS相比于NTS颗粒表面没有明显变化。淀粉的结晶结构和非晶结构在淀粉颗粒中的密度和折射率不同,通过偏振光的照射,能够清晰地观察到结晶结构的偏光十字,当结晶结构发生变化时,其偏光十字也发生变化。偏光显微照片中能够明显地观察到淀粉颗粒的偏光十字,说明其具有完整的结晶结构。1.0% OSTS、2.0% OSTS和3.0% OSTS相比于NTS的偏光十字没有发生明显改变,也可以判断淀粉改性过程中酯化反应对木薯淀粉的晶体结构基本无影响,且反应主要发生在淀粉颗粒的非结晶区域,这与XRD的分析结果也是一致的。
2.4 淀粉颗粒FT-IR分析
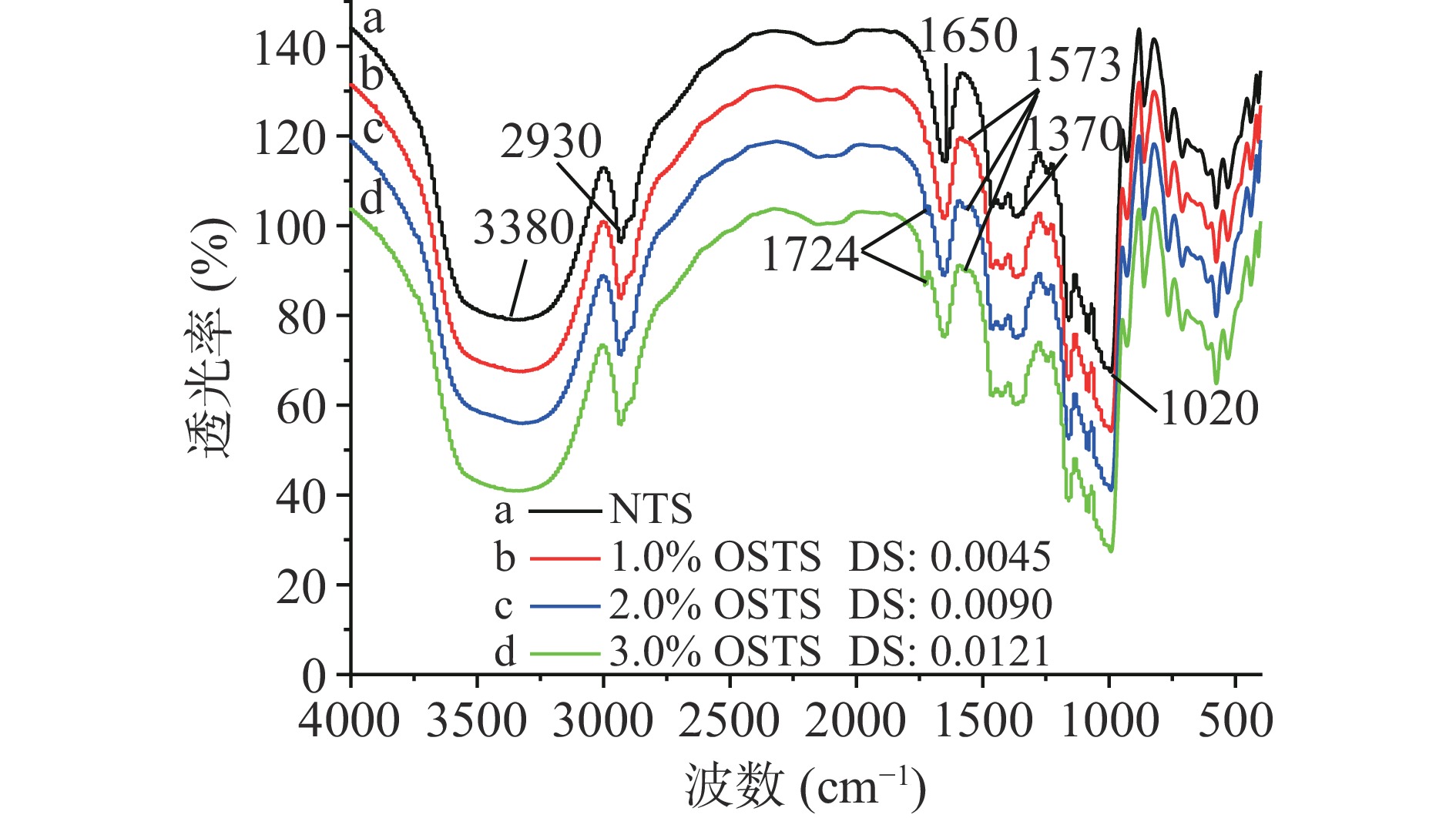
有机物分子中的官能团在红外光的照射下可以进行选择性吸收,因此可对官能团进行定性和定量的分析。淀粉分子的结构单元是α-D-吡喃葡萄糖,其红外光谱的主要特征吸收峰来自C2、C3、C6上的羟基以及葡萄糖分子的环状结构。如图3所示,选取了NTS、1.0% OSTS、2.0% OSTS和3.0% OSTS进行FT-IR分析。可以观察到NTS、1.0% OSTS、2.0% OSTS和3.0% OSTS在3380、2930、1650、1370和1020 cm−1处均具有相同的特征吸收峰,其中3380 cm−1处出现较大的峰是由O-H伸缩振动产生的,2930 cm−1处出现的峰是由C-H伸缩振动产生的[19],1650、1370和1020 cm−1处出现的峰是由C-O伸缩振动产生的[20]。不同的是,随OSA处理水平的增加,1.0% OSTS在1573 cm−1处出现的新的特征吸收峰,2.0% OSTS和3.0% OSTS在1724和1573 cm−1处均出现的新的特征吸收峰,1724和1573 cm−1处的两个吸收峰分别对应酯羰基的C=O伸缩振动和羧酸盐RCOO-基团的不对称伸缩振动[11],并随DS值的增大(0.0045~0.0121)吸收峰增强。这表明,OS基团取代了NTS分子上的部分羟基,并与葡萄糖单元上的羟基以酯键的形式相连,是OSA成功与NTS酯化的标志。王家豪[1]、王婵[11]利用OSA分别对大米淀粉和玉米淀粉进行疏水改性处理得到了相似的研究结果。
2.5 乳化液的乳液指数(EI)
乳液指数(EI)的大小可以表征多糖大分子乳化剂的乳化活性[21-22],乳化液EI值越大,乳化剂的乳化活性越好。由图4和表2可知,MP乳化液、添加NTS及不同改性水平OSTS的淀粉-MP复合乳化液中,乳化层有明显增高的趋势,添加3.0% OSTS的复合乳化液具有最高的乳化层和EI值(82.30)。添加淀粉后,复合乳化液的EI值显著高于MP乳化液(P<0.05),而添加OSTS的复合乳化液EI值则显著高于添加NTS的复合乳化液(P<0.05),并且随改性水平和DS值的增加复合乳化液的EI值呈显著增加趋势(P<0.05)。这说明,经疏水改性处理后,OSTS更有利于稳定MP乳化液中的油滴,且改性水平越高、DS值越大乳化活性越好。
表 2 MP乳化液、添加NTS及不同改性水平OSTS的淀粉-MP复合乳化液的EI值Table 2. The EI of MP emulsion and compound emulsions of starch-MP added NTS and different levels of modified OSTS乳液 EI值 MP 70.55±0.28f NTS-MP 73.00±0.35e 0.5% OSTS-MP 75.35±0.52d 1.0% OSTS-MP 76.50±0.74d 1.5% OSTS-MP 78.90±0.59c 2.0% OSTS-MP 80.21±0.47bc 2.5% OSTS-MP 81.17±0.49ab 3.0% OSTS-MP 82.30±0.39a 注:EI数据表示为平均值±标准差(n=3);同列不同字母表示差异显著(P<0.05),表3同。 2.6 乳化液Zeta电位分析
大多数稳定的乳化液液滴都带有电荷,通常用Zeta电位(ζ)来表示,一般情况下,ζ-电位的绝对值越大,乳化液体系越稳定[23]。MP在pH6.2时带负电荷,而NTS本身带负电荷[24],OSA处理后的OSTS引入了带负电的羧酸盐RCOO-基团,因此淀粉-MP复合乳化液呈电负性,并且NTS、OSTS分子链上的负电荷基团可与MP之间发生相互作用,从而改善乳化液的稳定性[25]。
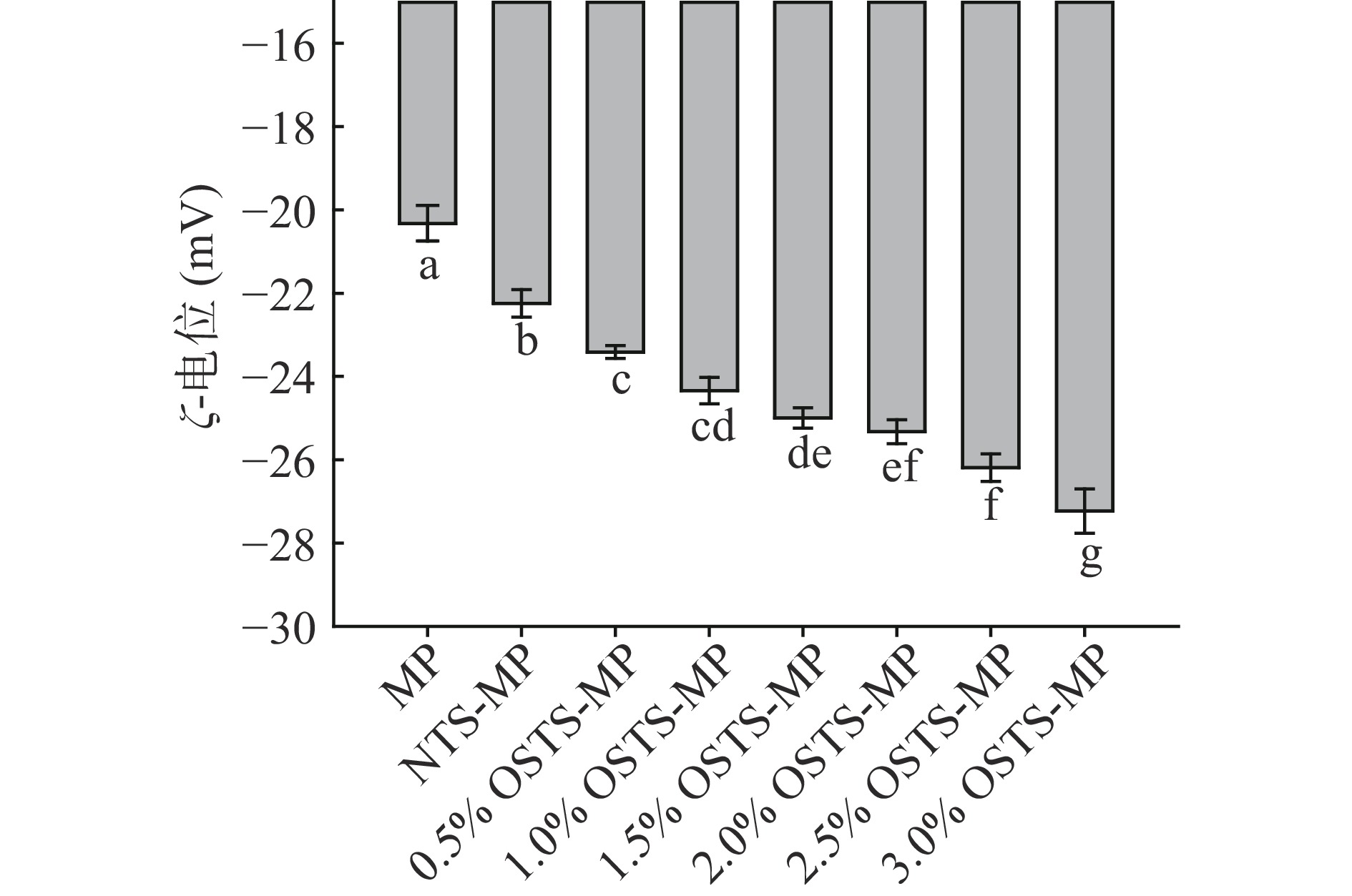
MP乳化液及淀粉-MP复合乳化液的ζ-电位如图5所示,乳化液均带负电荷。相比于MP乳化液,NTS-MP、OSTS-MP复合乳化液的电负性随OSA处理水平的增加呈显著降低趋势(P<0.05),3.0% OSTS-MP具有相对最低的ζ-电位(−27.23 mV)。由于NTS带负电荷,而随改性水平和淀粉DS值的增加,淀粉分子中引入了更多带负电的羧酸盐RCOO-基团,从而进一步增强了淀粉-MP乳化体系的电负性[11]。乳化体系中的电负性越强,ζ-电位的绝对值越大,乳化液液滴间会产生良好的静电排斥效果,不容易相互接近,从而使乳化液更稳定[26]。王家豪[1]研究指出,淀粉分子在经过OSA改性后结合了负电基团,OSA改性淀粉分子上的负电基团与MP分子发生静电相互作用使乳化体系ζ-电位降低。可以推断3.0% OSTS-MP乳化液的稳定性相对最高,这与乳液指数(EI)的分析结果是一致的。
2.7 乳化液的粒径分析
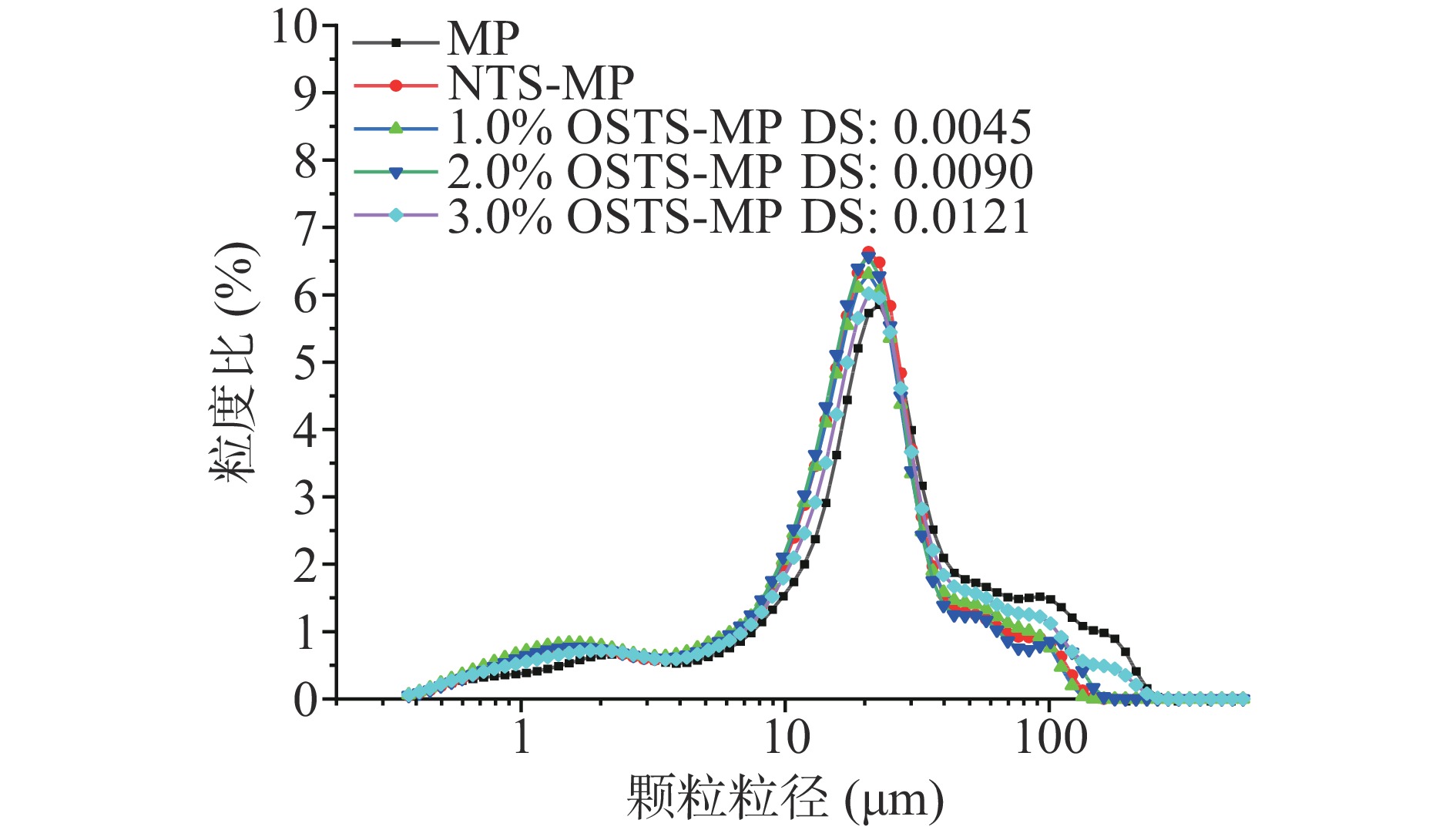
乳化液液滴的粒径分布和粒径的大小会影响乳化液的稳定性,通常情况下,液滴的粒度越小,乳化体系越稳定,当乳化液液滴表面吸附多糖和蛋白质时会促使乳化体系趋于稳定,即空间位阻作用[23],此作用是影响乳化液稳定性的重要因素之一。同时,乳化液液滴粒度分布也是评价乳化液的重要因素之一[27]。当液滴尺寸相近时,则乳化液属于单分散体系。当液滴尺寸不同或范围较大时,乳化液属于多分散体系[23]。
MP乳化液、OSTS-MP复合乳化液的粒度分布和粒径大小结果如图6及表3。图6显示,所有乳化液的粒度呈双峰分布,具有大体积峰(较大粒径范围)和小体积峰(较小粒径范围),属于多分散乳化体系。MP乳化液粒度分布以代表乳液液滴的大体积峰为主(峰顶点:22.73 μm,粒径范围:4.65~282.07 μm)、小体积峰(峰顶点:2.01 μm,粒径范围:1.05~3.86 μm)代表脱吸附的MP。相比于MP乳化液,NTS-MP、1.0% OSTS-MP、2.0% OSTS-MP和3.0% OSTS-MP复合乳化液粒度分布均呈现出明显的大、小体积峰,大体积峰代表乳液液滴,小体积峰代表脱吸附的淀粉颗粒[28],大、小体积峰高度均增加,粒径分布整体向小粒径方向(左)移动。四种复合乳化液的峰顶点位置基本重合,粒径分布范围比较相近,大体积峰顶点位于20.71 μm处、粒径范围在4.24~161.17 μm之间,小体积峰顶点位于1.66 μm处、粒径范围在0.86~3.52 μm之间。复合乳化液液滴粒径分布的左移和粒径范围的缩小,说明乳液液滴的分散程度小、集中程度高,乳液体系趋于稳定[1]。
表 3 MP乳化液及淀粉-MP复合乳化液的粒径Table 3. Droplet diameters of MP emulsion and starch-MP compound emulsions乳化液 Dv10(μm) Dv50(μm) Dv90(μm) MP 4.936±0.166a 23.223±0.229a 91.590±5.837a NTS-MP 2.365±0.079b 19.293±0.116c 45.197±0.381d 1.0% OSTS-MP 2.401±0.015b 19.750±0.382bc 48.590±1.178cd 2.0% OSTS-MP 2.411±0.029b 20.287±0.491bc 54.083±0.680bc 3.0% OSTS-MP 2.499±0.038b 20.693±0.529b 58.343±1.295b 表3中,Dv10、Dv50和Dv90分别指乳化液液滴中颗粒或液滴粒径积累值达到10%、50%和90%时所对应的粒径大小。相比于MP乳化液,NTS-MP、1.0% OSTS-MP、2.0% OSTS-MP和3.0% OSTS-MP复合乳化液液滴的Dv10、Dv50和Dv90显著降低(P<0.05)。而四种复合乳化液随淀粉改性水平的增加,Dv10有增加趋势但差异不显著(P>0.05);Dv50和Dv90则呈显著增加趋势(P<0.05)。这可能是由于随改性水平和DS的增加,淀粉分子中引入的疏水基团(RCOO-)也逐渐增多,使淀粉分子间疏水相互作用逐渐增强,在乳化液中,附着在乳液液滴表面的淀粉颗粒发生了一定程度地聚集[28]。也可能是由于OSTS与MP分子中疏水基团间的疏水相互作用随淀粉改性水平和DS的增加而增强,使OSTS与MP分子间也发生了聚集。在乳液液滴表面附着致密的生物大分子颗粒是有助于乳化液的稳定的[1]。Rayner等[29]研究利用疏水改性藜麦淀粉制备皮克林乳液,随着DS的增加淀粉颗粒间的疏水相互作用增强,促使颗粒在乳液液滴表面形成多层而致密的界面吸附,从而有助于提高乳液稳定性。因此,可以认为OSTS与MP分子在乳液液滴表面的聚集是有利于OSTS-MP复合乳化液的稳定的。
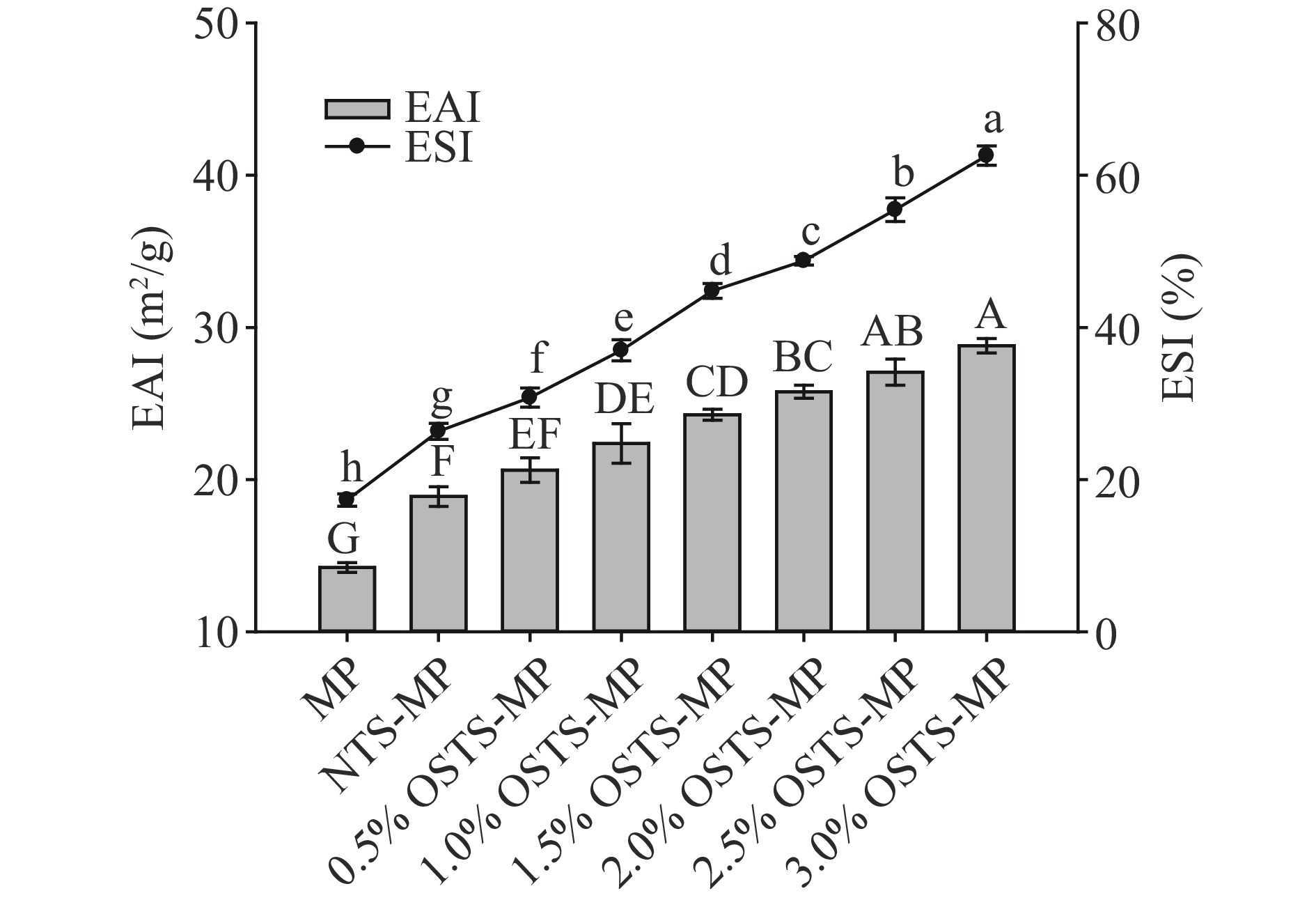
2.8 乳化液的EAI及ESI
EAI和ESI是评价乳化液乳化特性的常用指标,二者的增加有助于乳化液的形成和稳定[11]。乳化过程中,MP分子会迅速地吸附于乳化液液滴的油水界面并降低界面张力,这一过程发生越迅速,则乳化液的EAI越高[30]。如图7可以看出,NTS-MP和OSTS-MP复合乳化液的EAI和ESI均显著高于MP乳化液(P<0.05),并且随淀粉改性水平的增加,复合乳化液的EAI和ESI均呈显著增加趋势(P<0.05),3.0% OSTS-MP的EAI和ESI达到了最高。这说明OSTS更能进一步改善MP的EAI和ESI,且改性水平越高、改善作用越强。Dickinson[26]认为,在蛋白质稳定的乳化液中,液滴表面蛋白吸附层的性质通常决定其EAI,适量地添加淀粉颗粒能够对蛋白吸附层的密度和结构起到增强的作用,从而有效减少乳液液滴之间的聚集。Cheng等[31]研究指出,淀粉-蛋白乳化液EAI的增强是由于淀粉与蛋白在乳化液中发生了相互作用,使蛋白吸附在液滴表面的能力增强,进而增加蛋白乳化体系的稳定性。
![]() 图 7 MP乳化液及淀粉-MP复合乳化液的乳化活性及乳化稳定性注:不同字母表示同一指标差异显著(P<0.05),图8同。Figure 7. EAI and ESI of MP emulsion and starch-MP compound emulsions
图 7 MP乳化液及淀粉-MP复合乳化液的乳化活性及乳化稳定性注:不同字母表示同一指标差异显著(P<0.05),图8同。Figure 7. EAI and ESI of MP emulsion and starch-MP compound emulsions2.9 乳化液的巯基及界面蛋白含量
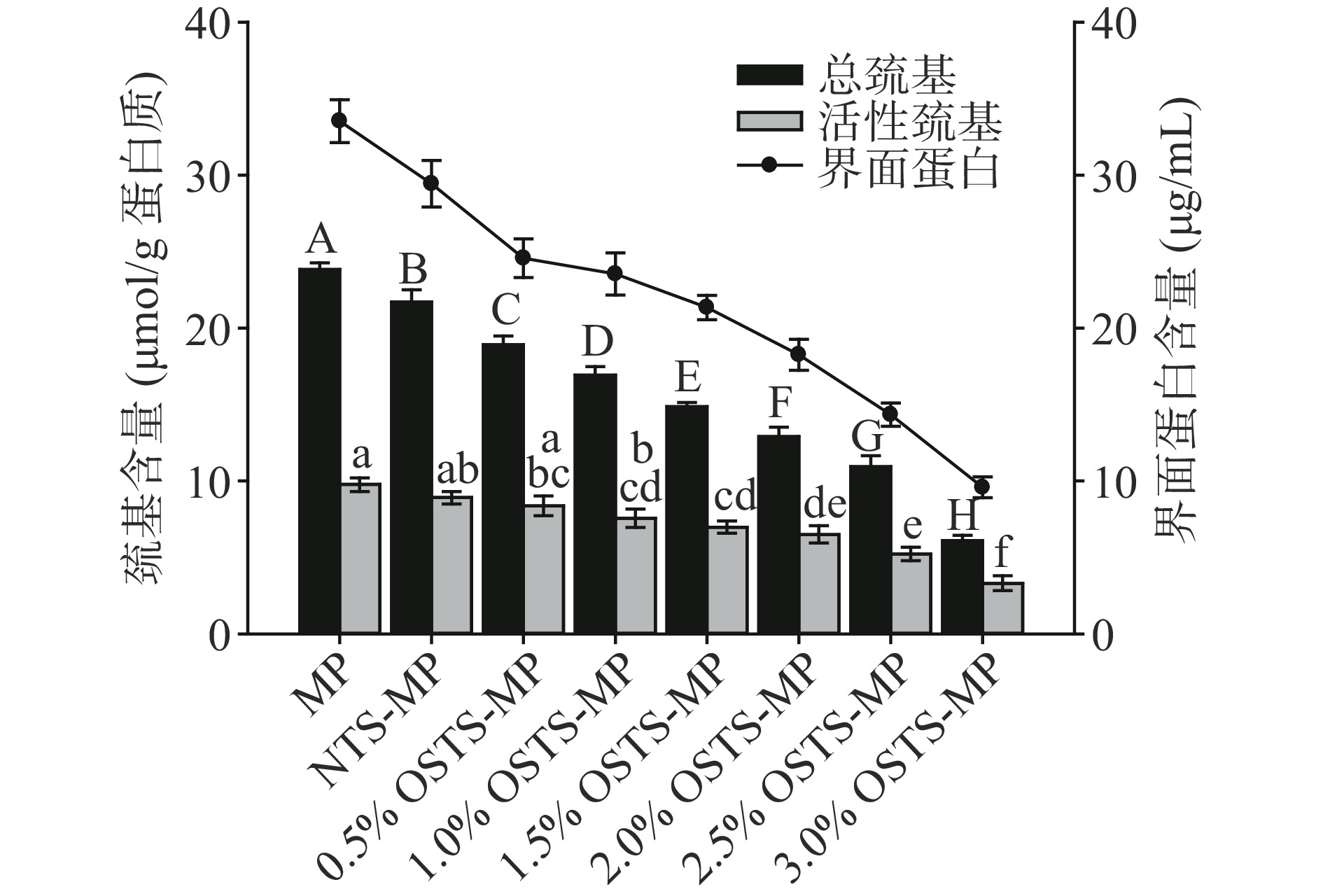
MP主要由肌球蛋白、肌动蛋白、肌动球蛋白、原肌球蛋白和肌钙蛋白组成。其中,肌球蛋白占MP的50%~60%,是肌肉中含量最高也是最重要的蛋白质。肌球蛋白中含有42个巯基,大概有1/3包埋于肌球蛋白头部(重酶解肌球蛋白)[32],当肌球蛋白结构发生变化时会暴露出自由巯基,并且巯基间也会发生氧化反应形成二硫键[33-34]。因此,MP乳化液中巯基和二硫键含量非常丰富。此外,MP乳化液在均质乳化过程中,MP分子能够快速吸附在乳液液滴界面,形成一层具有粘弹性的界面膜并阻止乳液液滴之间相互接触。而淀粉-MP复合乳化液中,淀粉的加入会对乳液液滴界面MP分子的吸附产生影响。
如图8可知,MP乳化液、NTS-MP和OSTS-MP复合乳化液(随淀粉改性水平和DS的增加)的总巯基、活性巯基以及界面蛋白含量从左至右呈显著下降趋势(P<0.05),3.0% OSTS-MP复合乳化液的三项指标最低。基于上述研究结果推测,巯基含量的降低主要是由于淀粉与MP的相互作用使MP空间结构发生变化,尤其是肌球蛋白头部结构的变化使巯基暴露,MP分子的变构驱动巯基之间发生氧化脱氢形成二硫键,并且随淀粉改性水平和DS值的增加,木薯淀粉分子中引入的疏水基团会通过疏水相互作用进一步作用于MP分子,从而进一步驱动暴露的巯基相互靠近形成二硫键,使复合乳化液的总巯基及自由巯基含量显著下降[33]。王家豪[1]将不同质量分数(0.25%~1.0%)的疏水改性大米淀粉添加于的MP乳化液(蛋白浓度1%)中,复合乳化液的巯基含量随淀粉质量分数的增加显著下降,分析认为,巯基含量的减少表明复合乳化液中,疏水改性大米淀粉颗粒可以通过作用于肌球蛋白头部与MP发生作用,增强了淀粉与蛋白的交联。曹云刚[35]考察了添加不同含量EGCG(50~1000 ppm)对于乳化后MP巯基含量的影响,分析认为,EGCG的添加可能导致了MP结构的展开,有利于巯基间的接触以转化为二硫键,会导致巯基含量的降低。此外,OSTS与MP的相互作用也在乳化液滴界面形成了竞争吸附的效果,淀粉改性水平和DS值越大,其与MP相互作用越强,导致竞争吸附效果越显著,使复合乳化液的界面蛋白含量显著下降。
3. 结论
OSA改性处理没有改变木薯淀粉颗粒的晶体结构类型,但有效地提高了木薯淀粉的乳化能力,且乳化能力随DS值的增加呈显著增加趋势。在OSTS-MP乳化体系中,OSTS和MP作为高聚物分子在各自分子链上分布了大量的亲水和亲油基团,均可吸附在乳化液液滴表面,形成有效的液滴保护层。OSTS可以通过与MP的相互作用改变MP空间结构并与MP在乳化液液滴界面形成竞争吸附的作用,从而有效地改善MP的乳化特性。OSTS在MP乳化液中所发挥的作用对于其在乳化肉糜类制品中的应用具有现实意义。在接下来的研究中,应进一步深入考察OSTS与MP分子在复合乳化液中相互作用的分子动力学机制,为OSTS作为良好的食品颗粒乳化剂在肉制品中的应用提供可靠的理论依据。
-
图 7 MP乳化液及淀粉-MP复合乳化液的乳化活性及乳化稳定性
注:不同字母表示同一指标差异显著(P<0.05),图8同。
Figure 7. EAI and ESI of MP emulsion and starch-MP compound emulsions
表 1 不同改性水平OSTS的DS值
Table 1 The DS of different levels of modified OSTS
不同OSA处理水平的OSTS DS 0.5% OSTS 0.0038 1.0% OSTS 0.0045 1.5% OSTS 0.0082 2.0% OSTS 0.0090 2.5% OSTS 0.0098 3.0% OSTS 0.0121 表 2 MP乳化液、添加NTS及不同改性水平OSTS的淀粉-MP复合乳化液的EI值
Table 2 The EI of MP emulsion and compound emulsions of starch-MP added NTS and different levels of modified OSTS
乳液 EI值 MP 70.55±0.28f NTS-MP 73.00±0.35e 0.5% OSTS-MP 75.35±0.52d 1.0% OSTS-MP 76.50±0.74d 1.5% OSTS-MP 78.90±0.59c 2.0% OSTS-MP 80.21±0.47bc 2.5% OSTS-MP 81.17±0.49ab 3.0% OSTS-MP 82.30±0.39a 注:EI数据表示为平均值±标准差(n=3);同列不同字母表示差异显著(P<0.05),表3同。 表 3 MP乳化液及淀粉-MP复合乳化液的粒径
Table 3 Droplet diameters of MP emulsion and starch-MP compound emulsions
乳化液 Dv10(μm) Dv50(μm) Dv90(μm) MP 4.936±0.166a 23.223±0.229a 91.590±5.837a NTS-MP 2.365±0.079b 19.293±0.116c 45.197±0.381d 1.0% OSTS-MP 2.401±0.015b 19.750±0.382bc 48.590±1.178cd 2.0% OSTS-MP 2.411±0.029b 20.287±0.491bc 54.083±0.680bc 3.0% OSTS-MP 2.499±0.038b 20.693±0.529b 58.343±1.295b -
[1] 王家豪. 淀粉基皮克林乳液特性及其对肉蛋白乳化特性和凝胶特性的影响研究[D]. 扬州: 扬州大学, 2019. WANG J H. Characteristics of starch-based pickering emulsion and its influence on emulsification and gel properties of meat protein[D]. Yangzhou: Yangzhou University, 2019.
[2] BHOSALE R, SINGHAL R. Process optimization for the synthesis of octenyl succinyl derivative of waxy corn and amaranth starches[J]. Carbohydrate Polymers,2006,66(4):521−527. doi: 10.1016/j.carbpol.2006.04.007
[3] DOKIC L, KRSTONOSIC V, NIKOLIC I. Physicochemical characteristics and stability of oil-in-water emulsions stabilized by OSA starch[J]. Food Hydrocolloids,2012,29(1):185−192. doi: 10.1016/j.foodhyd.2012.02.008
[4] TIMGRE A, RAYNER M, SJOO M, et al. Starch particles for food based pickering emulsions[J]. Procedia Food Science,2011(1):95−103.
[5] COLMENERO F J. Technologies for developing low-fat meat products[J]. Trends in Food Science & Technology,1996,7(2):41−48.
[6] 孟令义, 戴瑞彤. 脂肪替代物及其在食品中的应用[J]. 肉类研究,2007,21(6):40−43. [MENG L Y, DAI R T. Fat substitutes and their applications in food products[J]. Meat Research,2007,21(6):40−43. doi: 10.3969/j.issn.1001-8123.2007.06.016 [7] MAREFATI A, WIEGE B, HAASE N U, et al. Pickering emulsifiers based on hydrophobically modified small granular starches-Part I: Manufacturing and physico-chemical characterization[J]. Carbohydrate Polymers,2017(175):473.
[8] MAREFATI A, MATOS M, WIEGE B, et al. Pickering emulsifiers based on hydrophobically modified small granular starches Part II-Effects of modification on emulsifying capacity[J]. Carbohydrate Polymers,2018(201):416−424.
[9] YU Z Y, JIANG S W, ZHENG Z, et al. Preparation and properties of OSA-modified taro starches and their application for stabilizing Pickering emulsions[J]. International Journal of Biological Macromolecules,2019(137):277−285.
[10] XIA X F, KONG B H, LIU Q. Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freeze-thaw cycles[J]. Meat Science,2009,83:239−245. doi: 10.1016/j.meatsci.2009.05.003
[11] 王婵. 淀粉疏水改性基团分布及其构效关系[D]. 广州: 华南理工大学, 2015. WANG C. Study on the substituent distribution and the structure-activity relationship[D]. Guangzhou: South China University of Technology, 2015.
[12] ELLMAN G L. Tissue sulphydryl groups[J]. Archives of Biochemistry and Biophysics,1959,82(1):70−77. doi: 10.1016/0003-9861(59)90090-6
[13] PARKER R, RING S G. Aspects of the physical chemistry of starch[J]. Journal of Cereal Science,2001,34(1):1−17. doi: 10.1006/jcrs.2000.0402
[14] ZHANG G, VENKATACHALAM M, HAMAKER B R. Structural basis for the slow digestion property of native cereal starches[J]. Biomacromolecules,2006,7(11):3259−3266. doi: 10.1021/bm060343a
[15] 陈福泉, 张本山, 卢海凤, 等. X射线衍射在淀粉颗粒结晶度研究中的应用[J]. 食品科学,2010,31(3):284−287. [CHEN F Q, ZHANG B S, LU H F, et al. A review of application of X ray diffraction in crystal structure determination of starch granules[J]. Food Chemistry,2010,31(3):284−287. [16] SULLIVAN W R, HUGHES J G, COCKMAN R W, et al. The effects of temperature on the crystalline properties and resistant starch during storage of white bread[J]. Food Chemistry,2017,228(1):57−61.
[17] LI Y T, WANG R S, LIANG R H, et al. Dynamic high-pressure microfluidization assisting octenyl succinic anhydride modification of rice starch.[J]. Carbohydrate Polymers,2018,193:336−342. doi: 10.1016/j.carbpol.2018.03.103
[18] 李志坤. 不同晶型OSA淀粉的制备、乳化性质及其在肉糜中应用研究[D]. 扬州: 扬州大学, 2021. LI Z K. Study on preparation, emulsification properties and application of OSA starches with different crystal types in emulsified meat products[D]. Yangzhou: Yangzhou University, 2021.
[19] 宋晓燕. 早籼米辛烯基琥珀酸淀粉酯的制备及其理化性质的研究[D]. 杭州: 浙江大学, 2007. SONG X Y. Preparation and physicochemical properties of octenyl succinic anhydride modified early indica rice starches[D]. Hangzhou: Zhejiang University, 2007.
[20] FANG J M, FOWLER P A, SAYERS C, et al. The chemical modification of a range of starches under aqueous reaction conditions[J]. Carbohydrate Polymers,2004,55(3):283−289. doi: 10.1016/j.carbpol.2003.10.003
[21] ZHAO Y, KHALID N, SHU G, et al. Formulation and characterization of oil-in-water emulsions stabilized by gelatinized kudzu starch[J]. International Journal of Food Properties,2017,20:1329−1341.
[22] GOMEZLURIA A, VERNONCARTER E J, ALVAREZRAMIREZ J, et al. Insights of the ability of gelatinized fractions from non-chemical modified corn, rice, wheat, and waxy corn starches to stabilize O/W emulsions[J]. Food Hydrocolloids,2019,89:726−734. doi: 10.1016/j.foodhyd.2018.11.045
[23] 刘丽娅. 酪蛋白酸钠-多糖界面相互作用及其对乳状液稳定性的影响[D]. 广州: 华南理工大学, 2011. LIU L Y. Sodium caseinate-polysaccharide interactions at the oil-water interface: Effect on emulsion stability[D]. Guangzhou: South China University of Technology, 2011.
[24] SHI X, BEMILLER J N. Effects of food gums on viscosities of starch suspensions during pasting[J]. Carbohydrate Polymers,2002,50(1):7−18. doi: 10.1016/S0144-8617(01)00369-1
[25] 张利. 卵清蛋白-多糖共混凝胶的研究[D]. 重庆: 西南农业大学, 2003. ZHANG L. Studies on ovalbumin-polysaccharide mixed gel[D]. Chongqing: Southwest Agricultural University, 2003.
[26] DICKINSON E. Hydrocolloids at interfaces and the influence on the properties of dispersed system[J]. Food Hydrocolloids,2003,17:25−39. doi: 10.1016/S0268-005X(01)00120-5
[27] HUCK-IRIART C, PIZONES RUIZ-HENESTROSA V M, CANDAL R J. Effect of aqueous phase composition on stability of sodium caseinate/sunflower oil emulsions[J]. Food and Bioprocess Technology,2013,6:2406−2418. doi: 10.1007/s11947-012-0901-y
[28] 余振宇. OSA改性芋头淀粉基Pickering乳液运载体系稳定机制及其特性研究[D]. 合肥: 合肥工业大学, 2020. YU Z Y. Stabilization mechanism and characteristics of pickering emulsion delivery system based on OSA modified taro starch[D]. Hefei: Hefei University of Technology, 2020.
[29] RAYNER M, SJ M, TIMGREN A, et al. Quinoa starch granules as stabilizing particles for production of Pickering emulsions[J]. Faraday Discussions,2012,158(35):139−155.
[30] 邵俊花, 吴菊清, 周光宏等. 巯基和疏水性对蛋白质乳化及凝胶特性的影响[J]. 食品科学,2013,34(23):155−159. [SHAO J H, WU J Q, ZHOU G H, et al. Effects of sulfhydryl content and hydrophobicity on gel and emulsifying properties of pork proteins[J]. Food Chemistry,2013,34(23):155−159. [31] CHENG J, MA Y, LI X, et al. Effects of milk protein-polysaccharide interactions on the stability of ice cream mix model systems[J]. Food Hydrocolloids,2015(45):327−336.
[32] 雷姝敏. 二硫键在不同蛋白乳化液和乳液蛋白复合凝胶中的作用研究[D]. 扬州: 扬州大学, 2017. LEI S M. Study of disulfide bond in different protein emulsion and emulsion protein compound gel[D]. Yangzhou: Yangzhou University, 2017.
[33] OMANA D A, XU Y, MOAYEDI V, et al. Alkali-aided protein extraction from chicken dark meat: Chemical and functional properties of recovered proteins[J]. Process Biochemistry,2010,45(3):375−381. doi: 10.1016/j.procbio.2009.10.010
[34] MONAHAM F J, GERMAN J B, KINSELLA J E. Effect of pH and temperature on protein unfolding and thiol/disulfide interchange reactions during heat-induced gelation of whey proteins[J]. Journal of Agricultural and Food Chemistry,1995,43(1):46−52. doi: 10.1021/jf00049a010
[35] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D]. 无锡: 江南大学, 2016. CAO Y G. Effect of plant-derived polyphenols on oxidative stability and functional properties of meat proteins: Mechanism and application[D]. Wuxi: Jiangnan University, 2016.











 下载:
下载:

 下载:
下载:



