Effect of Inotodiol on LPS-induced Injury of RAW264.7 Cells
-
摘要: 探究桦褐孔菌醇(INO)对LPS诱导小鼠单核巨噬细胞(RAW264.7)炎症反应的影响。实验采用CCK-8实验检测RAW264.7细胞活力;利用Hoechst33342和PI检测细胞凋亡;应用酶联免疫吸附法、Griess法测定细胞白介素-6(IL-6)、白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白介素-18(IL-18)分泌及细胞中一氧化氮(NO)含量;利用荧光探针和试剂盒检测活性氧(ROS)生成及细胞中丙二醛(MDA)、过氧化氢(H2O2)含量和超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽(GSH)活性。结果表明20 μmol/L的INO能抑制LPS诱导的RAW264.7细胞活力下降,阻止细胞凋亡,能极显著抑制IL-6、IL-1β、TNF-α、IL-18和NO的分泌(P<0.01),极显著降低细胞中MDA、H2O2的含量(P<0.01),能极显著提高细胞中SOD、CAT、GSH活性(P<0.01)。以上结果表明INO能有效抑制LPS诱导RAW264.7细胞中促炎因子和过氧化物的产生,提高细胞抗炎和抗氧化能力,从而保护细胞免受损伤。
-
关键词:
- 桦褐孔菌醇 /
- LPS /
- RAW264.7细胞 /
- 炎症反应 /
- 氧化应激
Abstract: To explore the effect of Inotolinol (INO) on the inflammatory response of LPS-induced mouse mononuclear macrophages (RAW264.7). The experiment has investigated in vitro the effects of INO on mouse mononuclear macrophages (RAW264.7) induced by LPS. To do this, the following methods were adopted: The viability of RAW264.7 cells was detected by CCK-8 assay. Cell apoptosis was examined by Hoechst33342 and PI. The secretion of interleukin-6 (IL-6), interleukin-1β (IL-1β), tumor necrosis factor-α (TNF-α), interleukin-18 (IL-18) and the content of nitric oxide (NO) in cells were measured by ELISA and Griess. The production of reactive oxygen species (ROS), the content of malondialdehyde (MDA) and hydrogen peroxide (H2O2), and the activities of superoxide dismutase (SOD), catalase (CAT) and glutathione (GSH) in cells were detected by fluorescence probe and kit. The results showed that 20 μmol/L INO could inhibit the decline of RAW264.7 cell viability induced by LPS, prevent cell apoptosis, and significantly inhibit the secretion of IL-6, IL-1β, TNF-α, IL-18 and NO (P<0.01), could significantly reduce the contents of MDA and H2O2 in cells (P<0.01), and could significantly increase the activities of SOD, CAT and GSH in cells (P<0.01). The above results indicate that INO can effectively inhibit the production of pro-inflammatory factors and superoxides induced by LPS in RAW264.7 cells, improve the anti-inflammatory and anti-oxidative abilities of cells, and thus protect cells from damage.-
Keywords:
- inotodiol /
- LPS /
- RAW264.7 cells /
- the inflammatory response /
- oxidative stress
-
桦褐孔菌(Inonotus obliquus)也称作白桦茸、桦树茸,多生于桦树的树皮下,并在树皮破损处形成肉瘤状的菌核。桦褐孔菌的活性极强,会不断吸去桦树养分,大约10~15年后会把桦树的精髓吸收殆尽。其主要分布在俄罗斯、北欧、日本北海道、中国北部黑龙江、吉林长白山等地[1],并且桦褐孔菌可煎煮作为茶饮饮用,世界各国癌症患者也将其视为抗癌和防癌的天然药物。桦褐孔菌化学成分含量丰富,包含多糖类、三萜类、芳香族化合物、叶酸衍生物等[2-4]。其中三萜类是桦褐孔菌的主要活性成分,有抗炎、抗氧化、抗肿瘤、抗病毒等功效[5-7]。实验室前期研究证明桦褐孔菌乙醇提取物可有效抑制朊病毒复制[8],从乙醇提取物中分离出的单体化合物对癌细胞有较好的细胞毒性,能显著抑制人肝癌细胞(BEL-7402)、人胃癌细胞(SGC-7901)、人肝癌细胞(HepG2)等细胞增殖[9]。桦褐孔菌醇(Inotodiol,INO)是从桦褐孔菌中分离得到的三萜类化合物,是桦褐孔菌的主要标志性成分[10],许多研究表明桦褐孔菌醇在抗肿瘤方面发挥较大的作用[11],但对抗炎抗氧化功能研究甚少,目前仅有研究表明INO可减少哮喘小鼠炎性细胞的数量,降低炎症反应[12]。但是INO是否主要发挥抗炎活性及发挥抗炎活性后对哪些因子产生作用尚不明确。
炎症是生物体内外环境受到有害刺激后产生的生理或病理反应,当机体的炎症反应过强时,会导致体内环境失衡、组织损伤等病理后果,从而加剧疾病恶化。巨噬细胞在炎症反应中起着至关重要的作用,当巨噬细胞的炎症反应被激活后,耗氧量提升,细胞中合成大量促炎因子,加速自由基的生成,进而导致氧化应激产生[13]。氧化应激也会加重细胞的炎症反应,进一步对细胞或机体造成损伤。桦褐孔菌一直被当做药用真菌而得以应用,桦褐孔菌的活性普遍被认同,但从目前的开发现状而言,桦褐孔菌大多都是以子实体煎服或水提为主的粗提物,未对其中活性物质进行富集和分离,也很少对其单一物质的活性进行研究并将之开发成新型保健品或药品。目前大多数研究停留在对桦褐孔菌总三萜类化合物抗炎抗氧化活性的检测,但是进一步对其主要成分INO抗炎抗氧化活性的具体作用研究未见报道,因此本实验利用LPS刺激RAW264.7细胞,通过建立体外炎症模型,分析INO对RAW264.7细胞的保护作用,为INO用于炎症治疗和产品开发提供理论基础和新思路。
1. 材料与方法
1.1 材料与仪器
桦褐孔菌 俄罗斯贝加尔湖;RAW264.7细胞 购于中国科学院上海生命研究院细胞库;柱层析用硅胶 购于青岛海洋化工集团公司;DMEM培养基(8122114) 购于美国Gibco公司;胎牛血清(FB15015) 购于美国CLARK公司;DMSO(0219605590) 购于美国MP公司;CCK-8试剂盒(M4839) 购于美国AbMole公司;IL-6 ELISA试剂盒(QS4289)、IL-1β ELISA试剂盒(QS42776)、IL-18 ELISA试剂盒(QS42905)、TNF-α ELISA试剂盒(QS42868) 购于北京奇松生物科技有限公司;一氧化氮(NO)检测试剂盒(A013-2-1)、超氧化物歧化酶(SOD)检测试剂盒(A001-3-2) 购于南京建成生物工程研究所;过氧化氢酶(CAT)测定试剂盒(BC0205)、乳酸脱氢酶(LDH)测定试剂盒(BC0685)、丙二醛(MDA)测定试剂盒(BC0025)、谷胱甘肽(GSH)测定试剂盒(BC1175)、过氧化氢(H2O2)测定试剂盒(BC3595),Hoechst33342(C0031)、PI(P8080)荧光染料 北京索莱宝科技有限公司;ROS检测试剂盒(S0033S) 上海碧云天生物技术有限公司。
N-1200B旋转蒸发仪 上海爱朗仪器有限公司;3K15高速冷冻离心机 德国Sigma公司;MOC-18AIC二氧化碳恒温细胞培养箱 日本SANYO公司;CKX53倒置显微镜、XD30荧光显微镜 日本Olympus公司;FC型Thermo酶标仪 上海赛默飞世尔仪器有限公司;2HH.SY-24恒温水浴锅 北京精科华瑞仪器有限公司。
1.2 实验方法
1.2.1 桦褐孔菌醇(INO)分离提取及鉴定
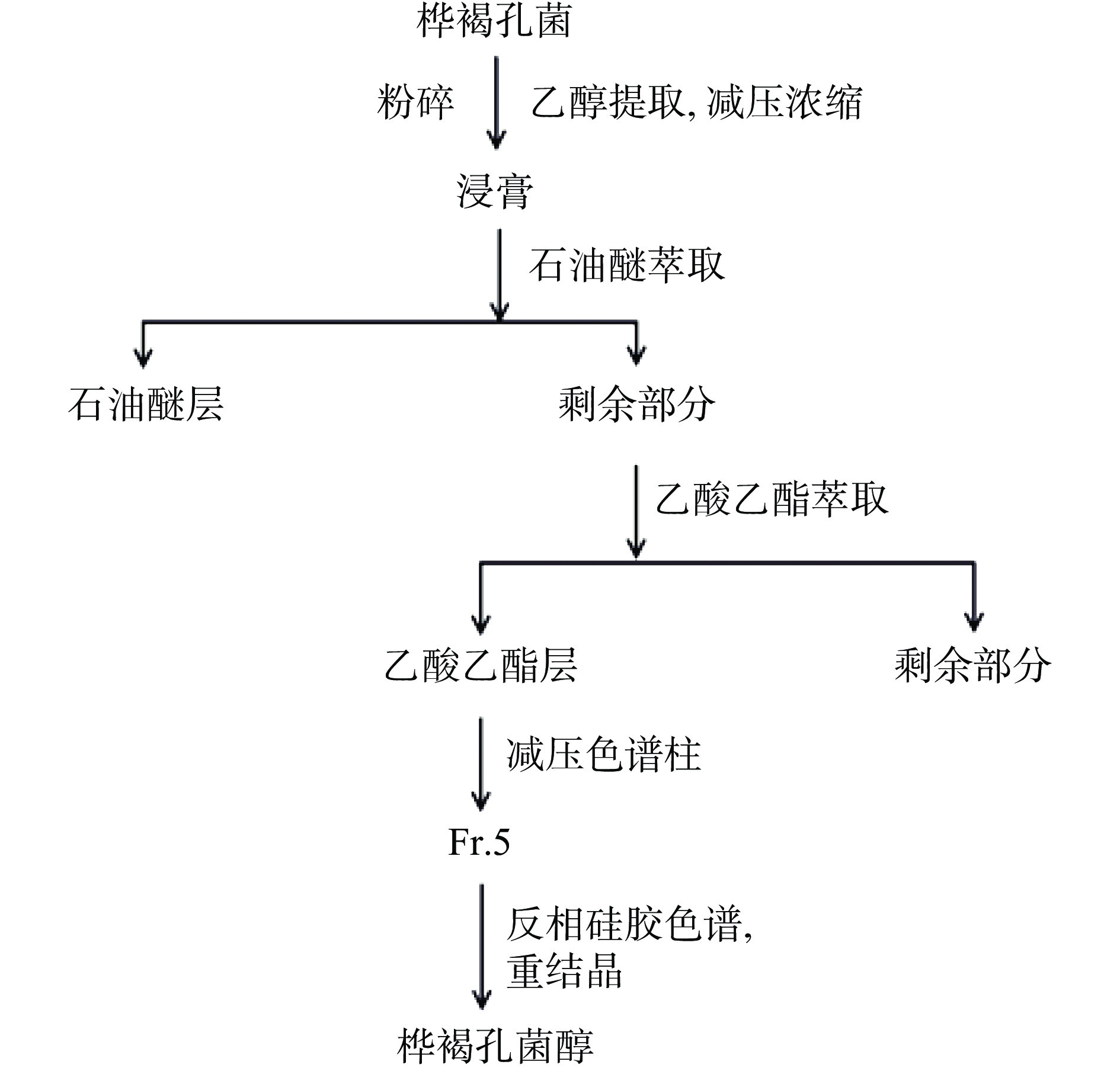
参考文献[14-16]方法提取INO。把呈块状的桦褐孔菌进行粉碎后,用95%的乙醇反复浸泡提取3次,通过减压浓缩获得乙醇提取物。将获得的乙醇提取物用水分散,并依次用石油醚、乙酸乙酯、正丁醇进行萃取,重复3次后便获得石油醚萃取物、乙酸乙酯萃取物、正丁醇萃取物。取乙酸乙酯萃取物,经过减压硅胶色谱,调节流速为6 mL/min,以石油醚-乙酸乙酯(100:1→1:1)梯度洗脱得到28个流份(Fr.1~Fr.28)。
取Fr.5先经 C18反相硅胶柱色谱,调节流速为2 mL/min,以甲醇-水(1:1→1:0)梯度洗脱,得到25个流分(subfr.5-1~subfr.5-25)。subfr.5-22经硅胶柱色谱,调节流速为2 mL/min,以石油醚-乙酸乙酯(100:1→4:1)梯度洗脱,得到17个流分(subfr.5-22-1~subfr.5-22-17)。通过重结晶subfr.5-22-13得到INO,加入少量氯仿溶解subfr.5-22-23后,重结晶得到INO。INO分离纯化流程如图1所示。
将分离得到的化合物用可溶解的氘代试剂溶解(常用的氘代试剂有CDCl3、CD3OD、C3D6O、DMSO、C5D5N 等),少量多次转移到干净的核磁管中,封口膜密封,进行核磁共振测试。根据1D NMR确定化合物的纯度,微谱数据库判断是否为已知化合物。
1.2.2 RAW264.7细胞培养和分组
将冻存的细胞进行复苏,复苏后的细胞用含10%FBS和1%双抗的DMEM培养基,放置在37 ℃、体积分为5%的CO2恒温培养箱中培养,待细胞密度大约达到80%~90%时,按照1:3或1:5的比例对细胞进行传代处理。将细胞分为对照组、LPS组、INO低浓度组、INO中浓度组、INO高浓度组,用于后续实验。
1.2.3 INO和LPS对RAW264.7细胞活力的影响
取对数生长期细胞,以1×104/孔的数量将细胞接种到96孔板中,放置在37 ℃、体积分数为5%的CO2恒温培养箱中培养12 h,待细胞完全贴壁。分别用浓度为0、1、2.5、5、10、20、40、80、160 μmol/L的INO处理细胞3、6、12、24 h,用12.5、25、50、100、200 μg/mL的LPS溶液分别处理细胞6、12、24 h,之后加入10% CCK-8溶液,放入培养箱中孵育1 h。用酶标仪在450 nm处测定各组的吸光度值并计算出各组的细胞活力值。根据细胞活力来确定INO和LPS最佳处理时间及浓度,将细胞分为对照组、LPS组(LPS 50 μg/mL)、INO低浓度组(INO 5 μmol/L+LPS 50 μg/mL)、INO中浓度组(INO 10 μmol/L+LPS 50 μg/mL)、INO高浓度组(INO 20 μmol/L+LPS 50 μg/mL),检测INO对LPS刺激细胞后RAW264.7细胞的活力。细胞活力计算公式如下:
细胞活力(%)=(A样本−A0)/(A空白−A0)×100 1.2.4 INO对RAW264.7细胞凋亡的影响
将细胞接种到24孔板中并将细胞分为对照组、LPS组、INO低浓度组、INO中浓度组、INO高浓度组,放入培养箱中孵育。用PBS洗涤处理后的细胞2次。用PBS对Hoechst33342和PI染料进行稀释,每100 μL PBS中加入1 μL染料,将配制好的染料依次加入,冰浴或4 ℃条件下孵育20~30 min。孵育结束后用荧光显微进行观察。利用Image J软件分析凋亡细胞的相对荧光强度,并将各组数据标准化为对照组荧光强度。
1.2.5 INO对RAW264.7细胞炎性因子和NO的影响
利用试剂盒检测RAW264.7细胞培养液中炎性因子的含量。将细胞分为对照组、LPS组、INO低浓度组、INO中浓度组、INO高浓度组,并进行药物处理,收集处理后的细胞培养液于1.5 mL离心管中,根据ELISA试剂盒和NO含量测定试剂盒的操作说明对细胞培养液中IL-6、IL-1β、IL-18、TNF-α、NO含量进行检测,并计算出各个炎性因子的含量。
1.2.6 INO对RAW264.7细胞内ROS含量的影响
将细胞接种到24孔板中并将细胞分为对照组、LPS组、INO低浓度组、INO中浓度组、INO高浓度组,取出药物处理后的细胞,弃除培养液,用PBS洗涤 2 次。将 DCFH-DA 荧光探针用 PBS 按照 1:500比例进行稀释,并加入到培养板中,37 ℃,避光孵育20 min。20 min后取出细胞,用PBS洗涤2~3次,利用荧光显微镜进行观察,利用Image J软件分析各组细胞中ROS荧光强度,并将各组数据标准化为对照组荧光强度。
1.2.7 INO对RAW264.7细胞中SOD、LDH、MDA、GSH、CAT、H2O2水平的影响
将细胞接种到6孔板中并将细胞分为对照组、LPS组、INO低浓度组、INO中浓度组、INO高浓度组,进行药物处理,收集处理后的细胞,离心取上清液于1.5 mL离心管中,细胞用PBS洗涤2次,加入相应细胞提取液,冰浴条件下对细胞进行超声破碎,200 W,3 s/次,间隔9 s,循环30次。按照相应试剂盒方法检测细胞中SOD、LDH、MDA、GSH、CAT、H2O2水平。
1.3 数据处理
本实验所有数据均采用均数±标准差(ˉx±s)表示,利用Graphad Prism软件进行绘图制作,使用SPSS23.0软件进行统计分析。显著性差异表示为:与对照组相比用“*”表示,*(P<0.05),**(P<0.01),***(P<0.001);与LPS组相比用“#”表示,#(P<0.05),##(P<0.01),###(P<0.001)。
2. 结果与分析
2.1 桦褐孔菌醇(INO)化合物结构鉴定
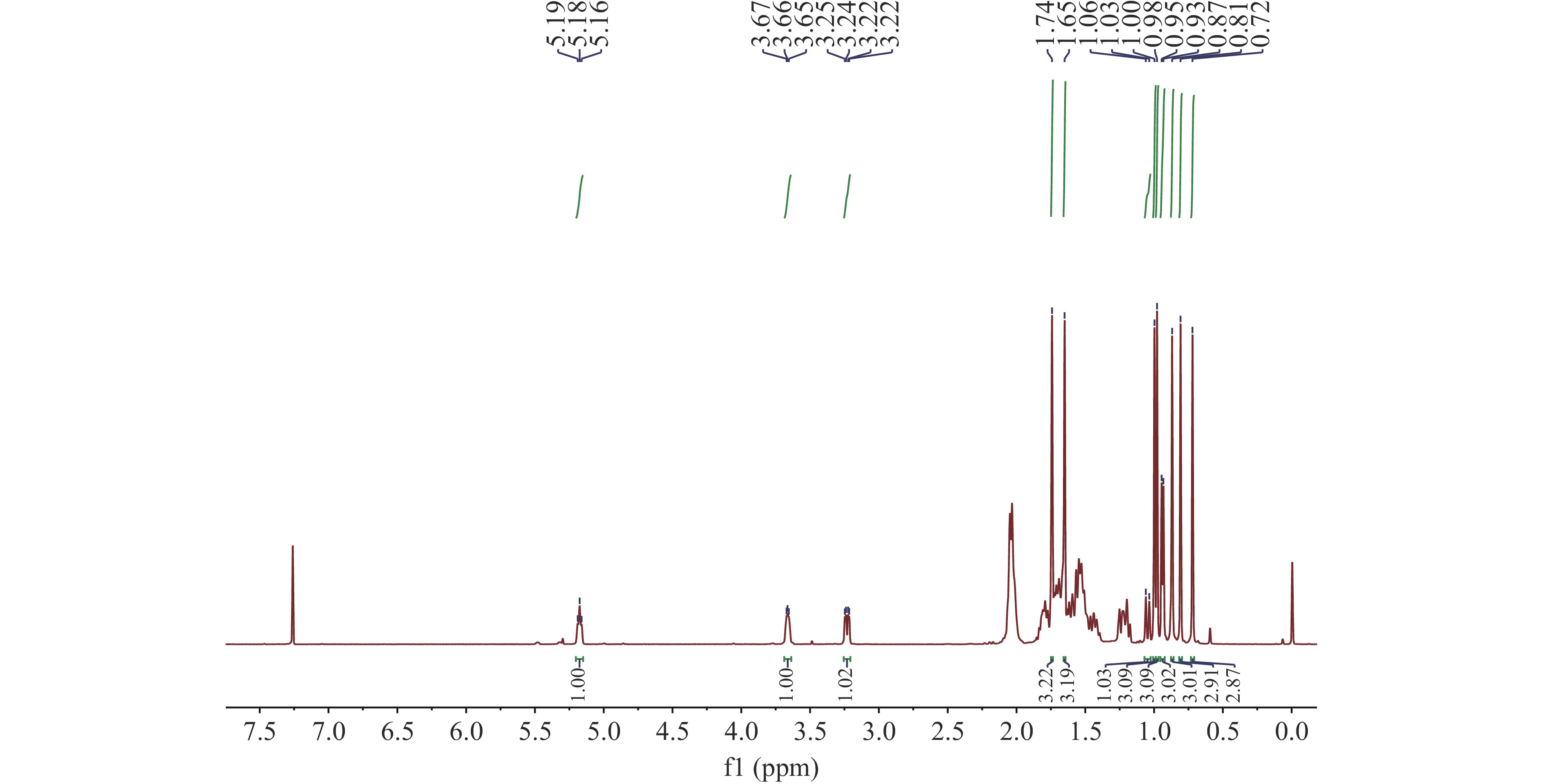
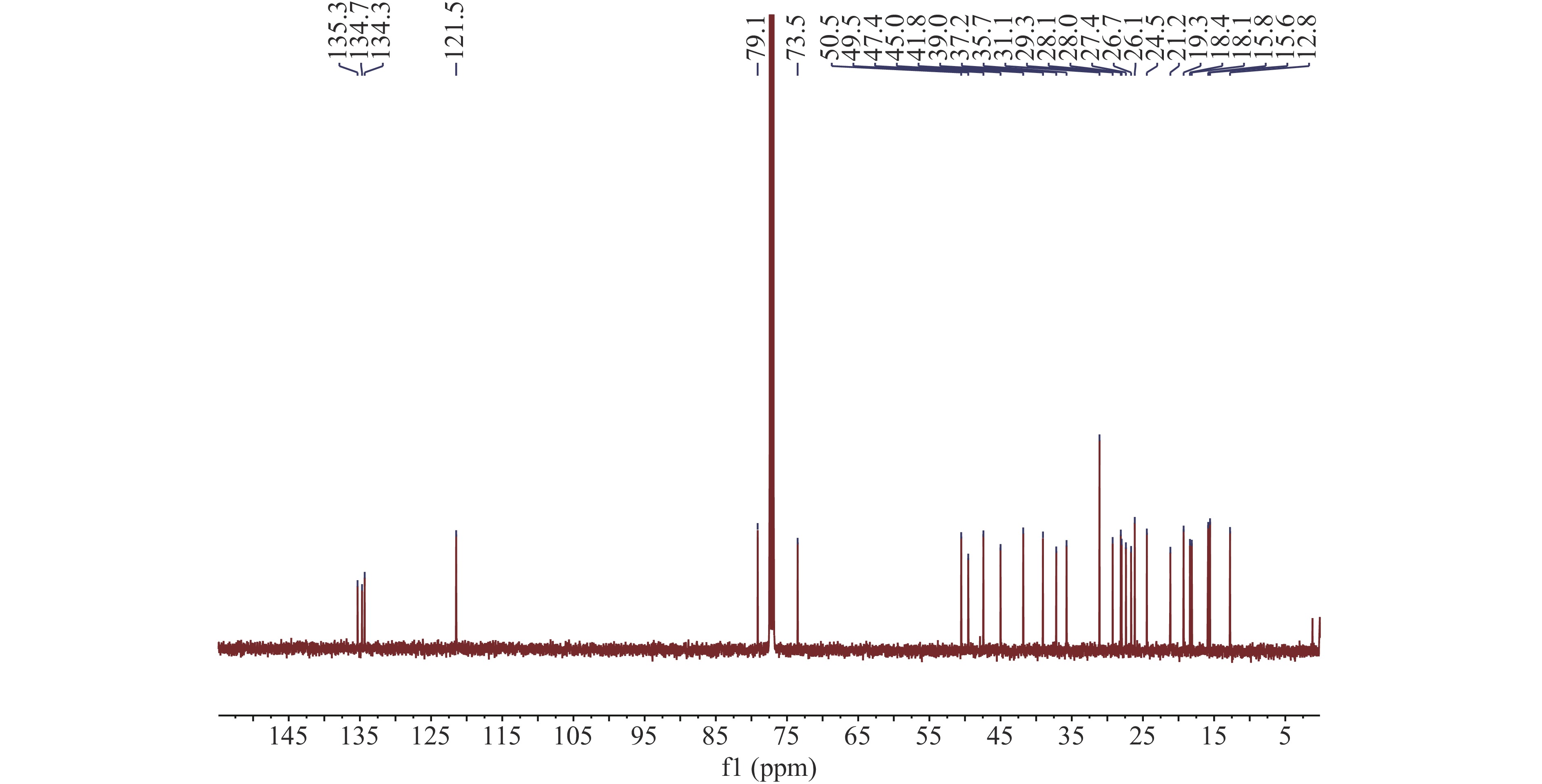
INO样品呈白色,粉末状,溶于氯仿;ESI-MS m/z 465.6[M+Na]+;分子式C30H50O2;1H NMR(500 MHz,CDCl3):δH 5.18(1H,t,J=7.0 Hz,H-24),3.66(1H,m,H-22),3.23(1H,dd,J=11.5,3.9 Hz,H-3),2.05(2H,m,H-23),2.04(2H,m,H-7),2.02(2H,m,H-11),1.81(1H,m,H-16a),1.79(1H,m,H-20),1.74(3H,s,H-26),1.73(1H,m,H-1a),1.72(2H,m,H-12),1.68(1H,m,H-6a),1.65(3H,s,H-27),1.63(2H,m,H-2),1.62(1H,m,H-15a),1.55(1H,m,H-17),1.51(1H,m,H-6b),1.42(1H,m,H-16b),1.23(1H,m,H-1b),1.19(1H,m,H-15b),1.05(1H,d,J=12.6 Hz,H-5),1.00(3H,s,H-29),0.98(3H,s,H-19),0.94(3H,d,J=6.5 Hz,H-21),0.87(3H,s,H-30),0.81(3H,s,H-28),0.72(3H,s,H-18)(图2);13C NMR(125 MHz,CDCl3)(图3)。该化合物经数据比对,确定为INO。
2.2 桦褐孔菌醇(INO)对RAW264.7细胞活力的影响
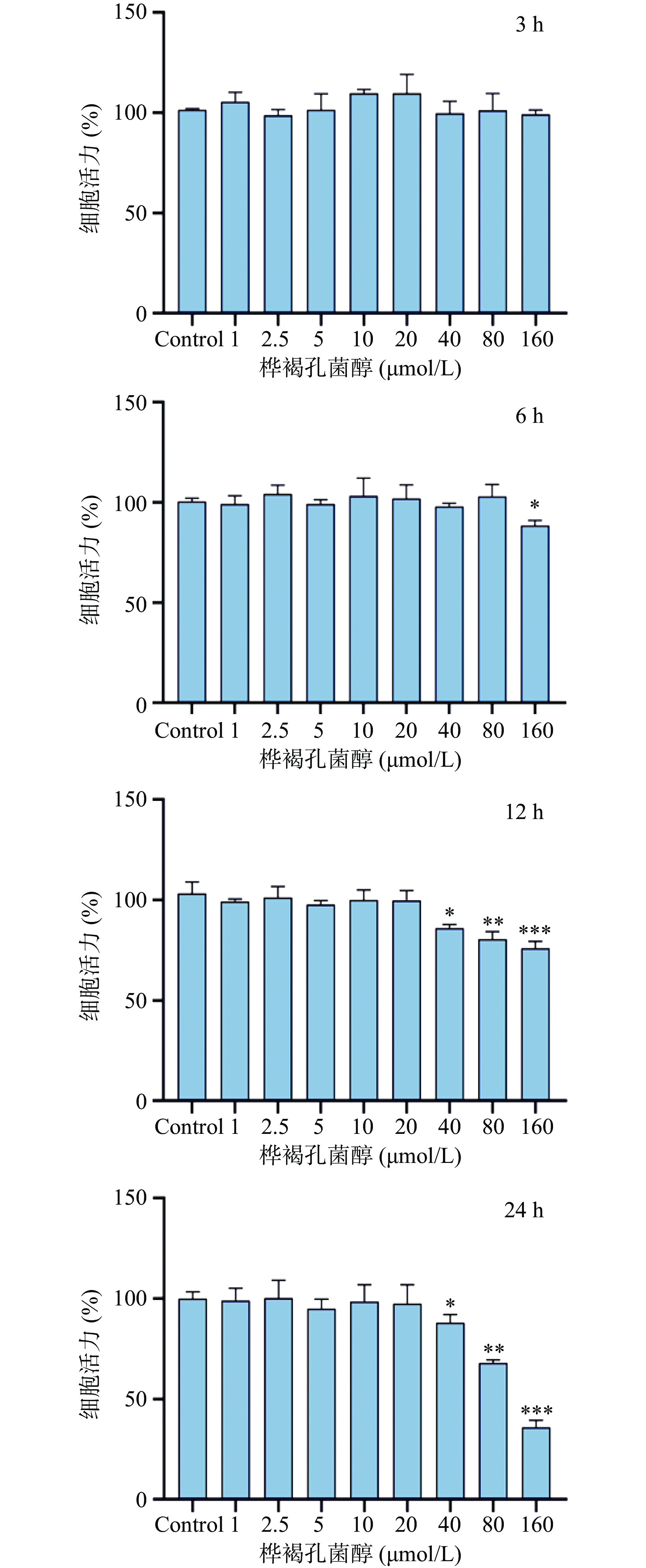
高浓度药物或不同给药时间均可对细胞产生毒性作用,为防止高浓度INO对细胞造成损伤影响实验准确性,本实验采用CCK-8方法对INO进行细胞安全性评价,根据不同浓度INO对细胞活力的影响,确定其安全浓度范围,并选择最佳给药浓度及时间。用0、2.5、5、10、20、40、80、160 μmol/L浓度的INO对RAW264.7细胞分别处理3、6、12、24 h,利用CCK-8法检测细胞活力,结果如图4所示,INO处理RAW264.7细胞3 h后,各浓度组细胞活力无显著性差异;处理6 h后,当浓度为160 μmol/L时,细胞活力显著下降(P<0.05);处理12、24 h后,随着INO浓度提升,细胞活力呈现下降趋势,当INO浓度大于20 μmol/L时,细胞活力显著降低(P<0.05),并呈现剂量依赖性;处理12 h与24 h后,INO的最大安全剂量稳定在20 μmol/L,所以可得出INO对RAW264.7细胞的安全浓度范围为0~20 μmol/L。根据细胞活力的结果,最终本实验选择5、10、20 μmol/L作为后续实验的INO浓度梯度,12 h为INO处理RAW264.7细胞的最佳处理时间。
![]() 图 4 不同浓度INO处理不同时间对RAW264.7细胞活力的影响注:与对照组相比用“*”表示显著性差异,*(P<0.05),**(P<0.01),***(P<0.001);图6同。Figure 4. Effect of different concentration of inotodiol on RAW264.7 cell viability
图 4 不同浓度INO处理不同时间对RAW264.7细胞活力的影响注:与对照组相比用“*”表示显著性差异,*(P<0.05),**(P<0.01),***(P<0.001);图6同。Figure 4. Effect of different concentration of inotodiol on RAW264.7 cell viability2.3 LPS对RAW264.7细胞活力影响
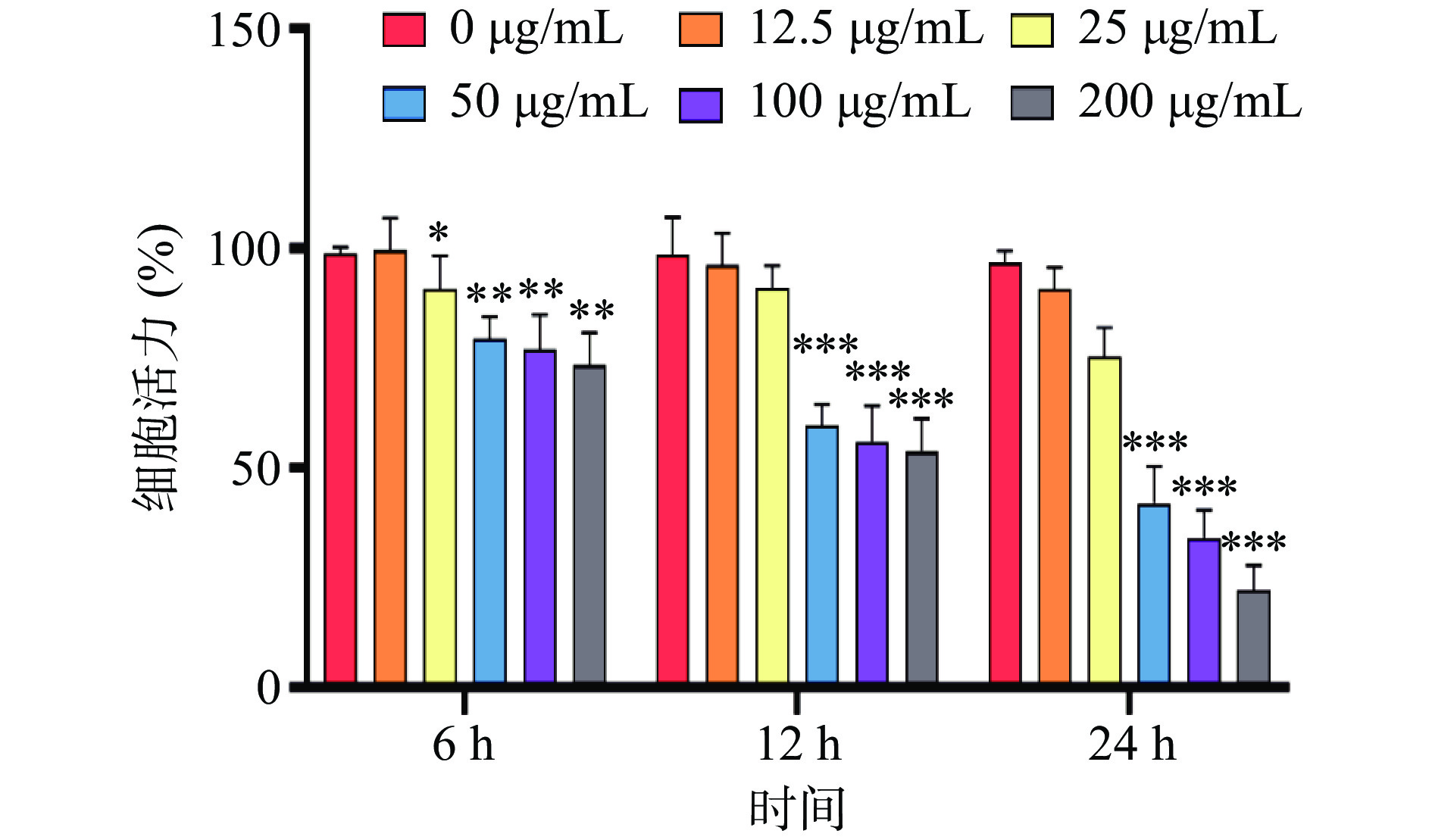
LPS可以刺激RAW264.7细胞产生炎症,并引发其细胞形态上的变化。在光学显微镜下观察细胞形态变化如图5所示,正常状态下RAW264.7细胞贴壁生长通常呈圆形或椭圆形,以圆形居多,在显微镜下观察细胞透亮。RAW264.7细胞经过50 μmol/L LPS处理后,细胞发生形变,并分化出大量触角,部分细胞也出现死亡。用CCK-8检测RAW264.7细胞活力,结果如图6所示,随着LPS浓度的增长,各处理时间的细胞活力均呈现下降趋势,当LPS浓度达到50 μg/mL时,细胞活力均显著降低(P<0.001),并且随着处理时间的延长,显著性也逐渐升高,当处理12 h时,50 μmol/L的LPS使得RAW264.7细胞活力达到55%左右,最终确定LPS刺激浓度为50 μg/mL,处理时间为12 h。
2.4 INO对LPS诱导的RAW264.7细胞活力的影响
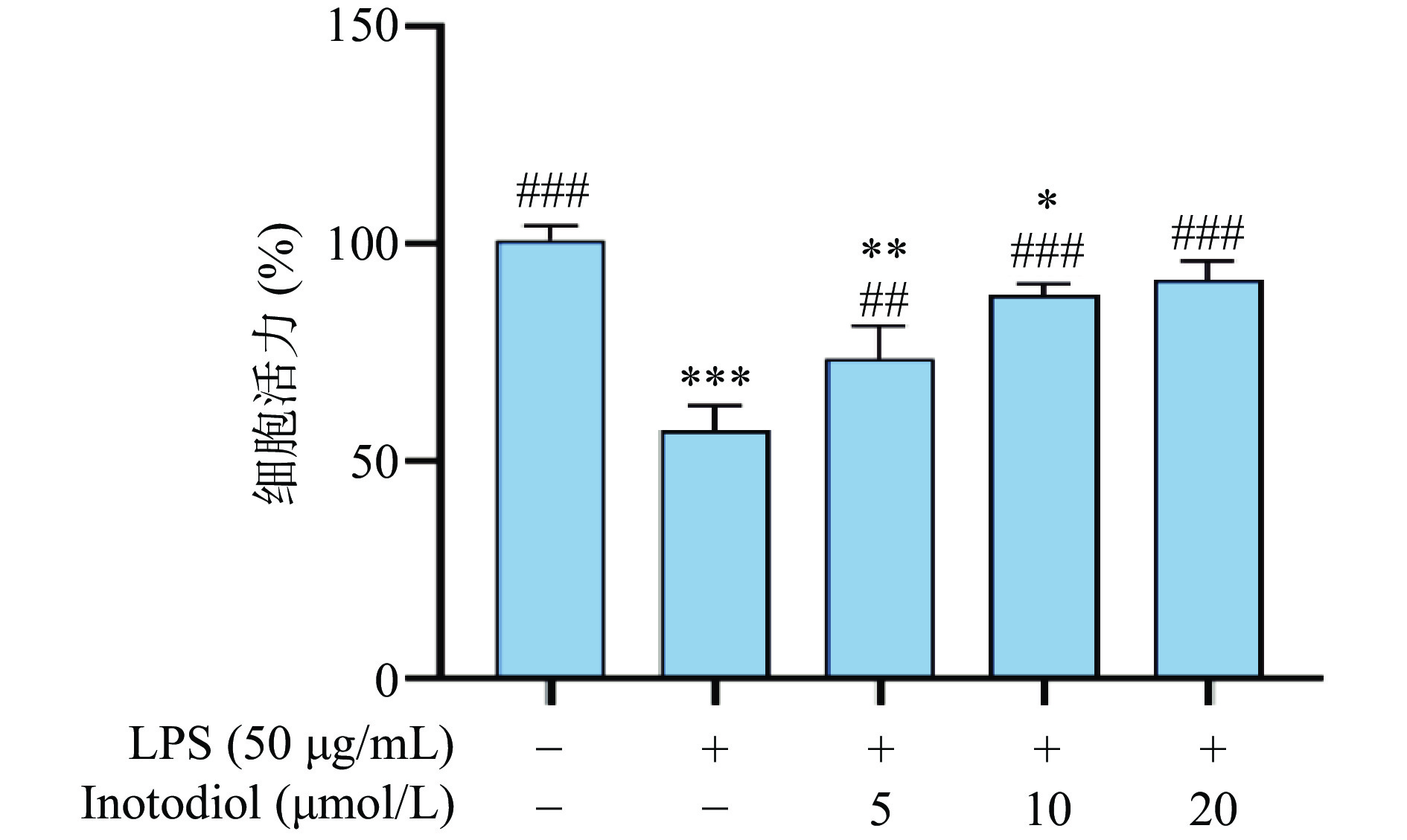
为了验证和INO对RAW264.7细胞的保护作用,本实验首先用INO对细胞进行12 h的预处理,再加入50 μg/mL的LPS进行刺激,12 h后用CCK-8检测RAW264.7细胞活力,结果如图7所示,LPS组细胞活力与对照组相比显著降低(P<0.01),用INO预保护后,各浓度INO组细胞活力与LPS组相比均显著升高(P<0.01),并随INO浓度的提高呈现浓度依赖性,当INO到达20 μmol/L时,与对照组相比无显著性差异(P>0.05)。实验表明INO对RAW264.7细胞有较好的保护效果,能够有效缓解LPS对其造成的损伤,减少细胞死亡,但是具体的调节作用尚不明确。
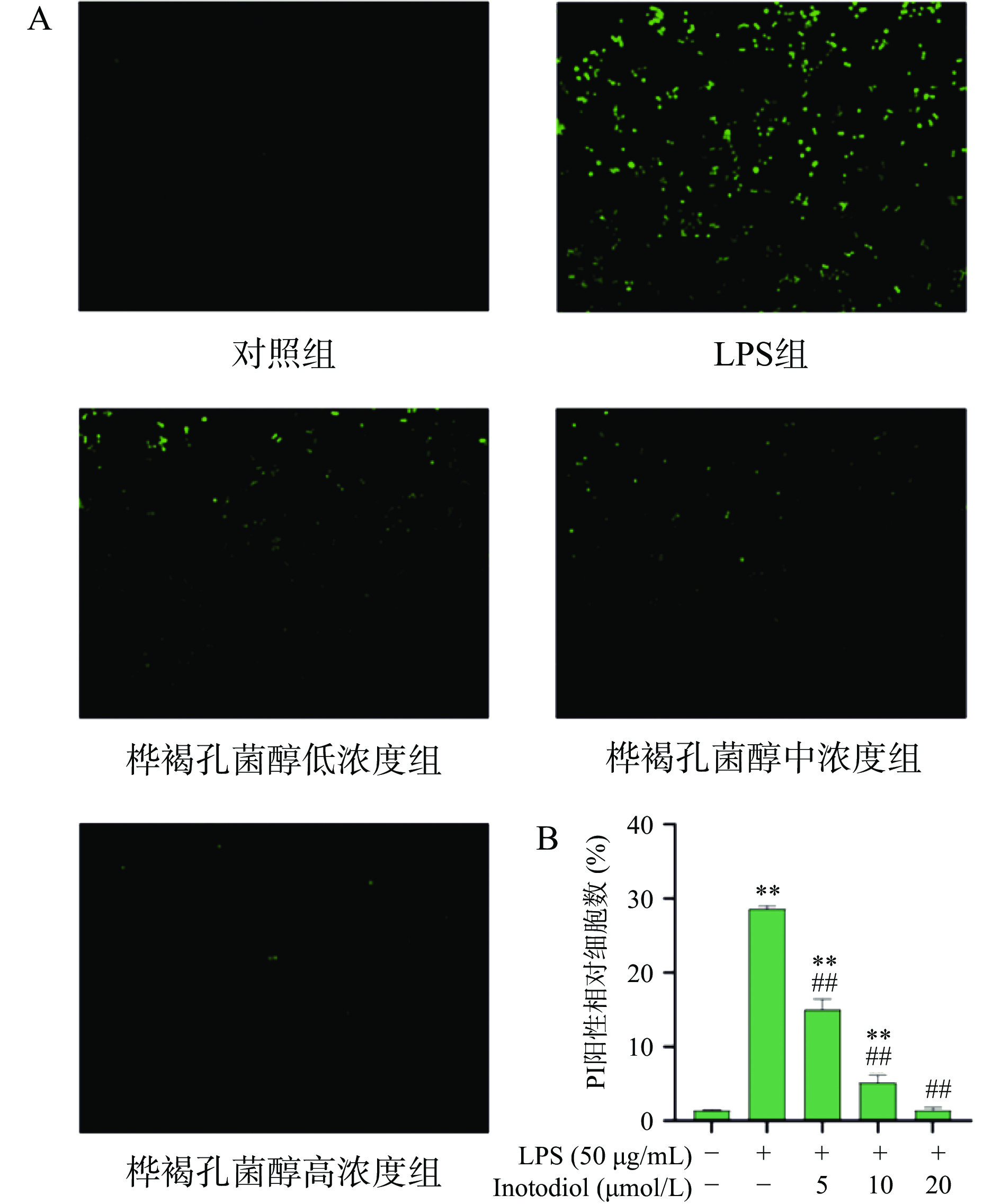
2.5 INO对LPS诱导的RAW264.7细胞凋亡的影响
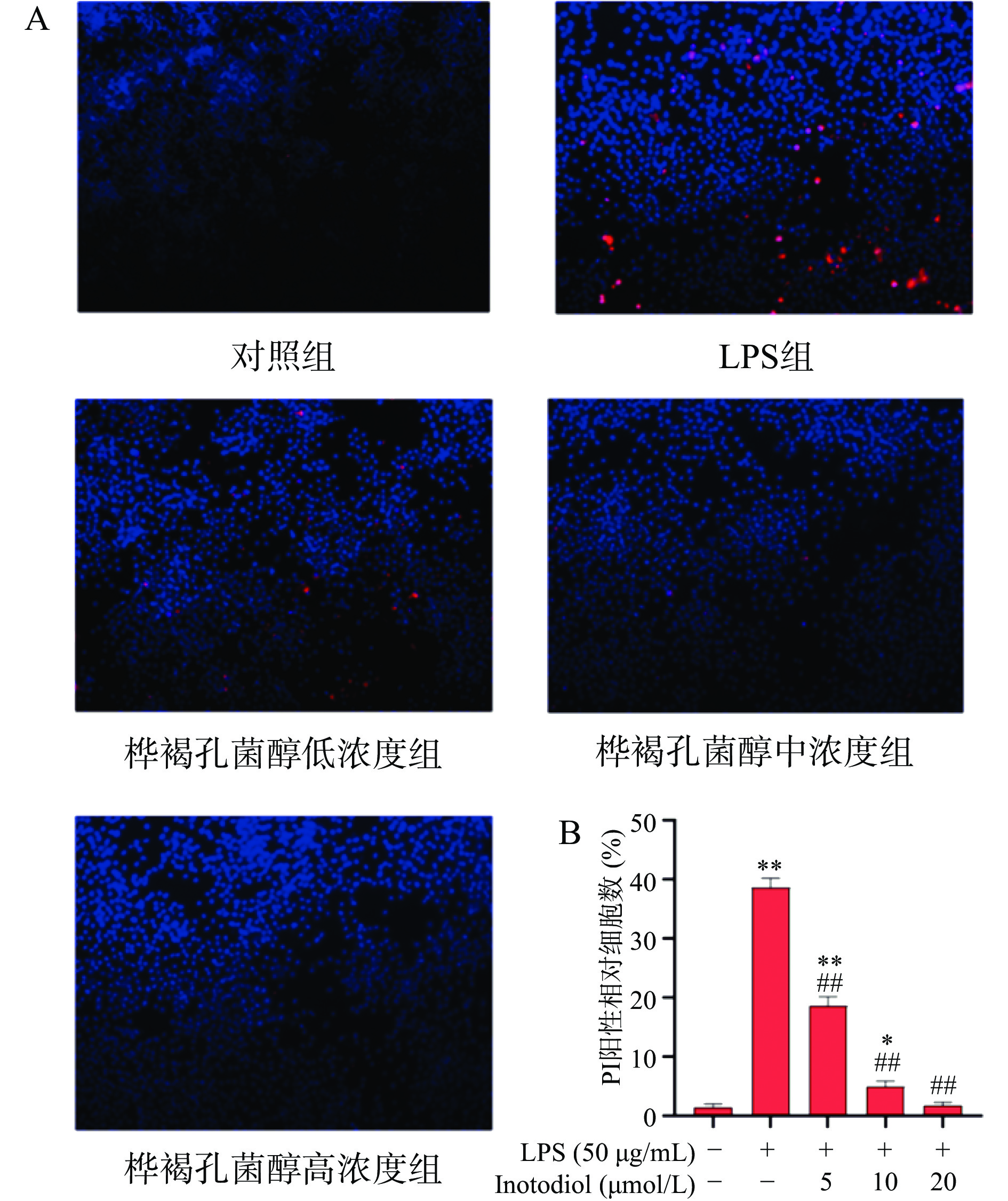
CCK-8实验证明INO可以缓解LPS诱导的RAW264.7细胞损伤,提高细胞活力。而RAW264.7细胞损伤的同时会促使细胞凋亡,从而清除损伤细胞。为了验证INO是否可以抑制细胞凋亡,通过Hoechst33342/PI对细胞进行染色,利用荧光显微镜观察细胞凋亡情况。实验结果如图8所示,LPS处理细胞后凋亡细胞数量增加极显著(P<0.01),INO保护后,凋亡细胞数量极显著降低(P<0.01),并呈现浓度依赖性降低。这表明,INO能显著抑制LPS诱导的RAW264.7细胞凋亡。
2.6 INO对RAW264.7细胞IL-6、IL-1β、IL-18、TNF-α、NO的影响
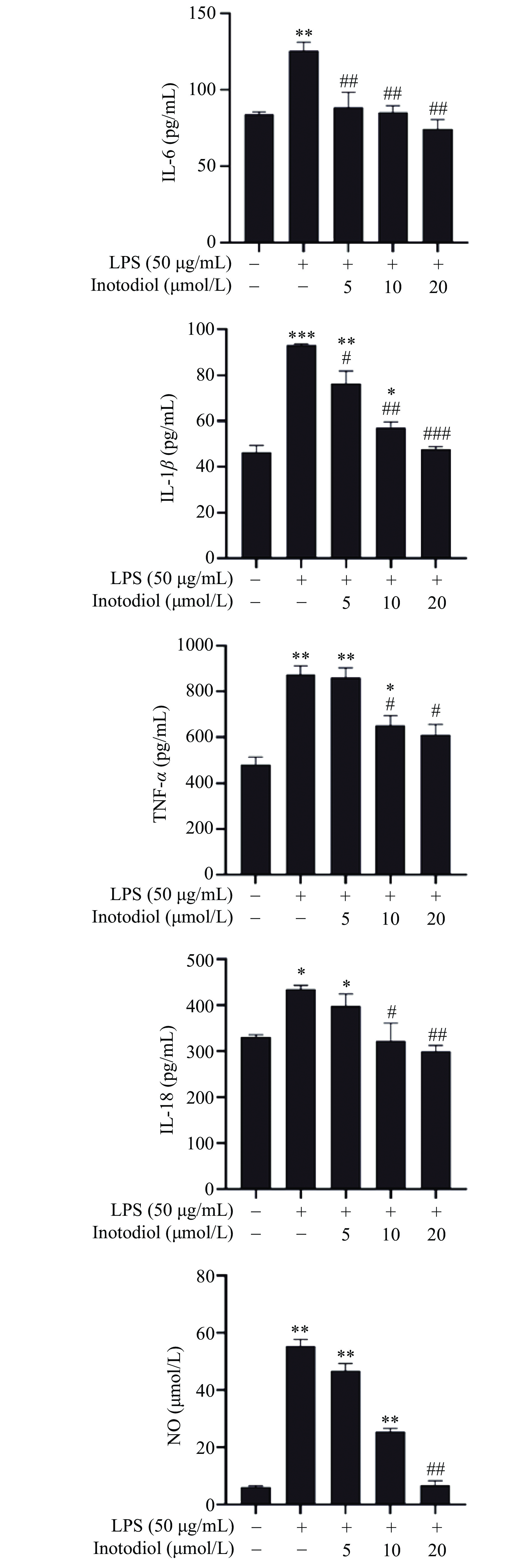
当RAW264.7细胞受到LPS刺激,会产生炎症反应,并大量分泌促炎因子,加剧细胞的炎症反应[17]。如图9实验结果表明LPS组细胞的上清液中IL-6、IL-1β、IL-18、TNF-α、NO含量最高,与对照组相比差异显著(P<0.05),可以证明此时细胞已经发生炎症反应,当使用20 μmol/L的INO进行保护后与LPS组相比,IL-6、IL-1β、IL-18、TNF-α、NO含量均显著性降低(P<0.05),并随INO浓度升高呈现剂量依赖性。实验表明,INO可有效缓解LPS引发的促炎因子的升高,缓解细胞炎症反应,从而保护细胞。
2.7 INO对LPS诱导的RAW264.7细胞内ROS含量的影响
LPS可激活细胞产生炎症反应,同时也可引起细胞内ROS和自由基大量积累,引发氧化应激。细胞产生氧化应激会加剧炎症反应,形成恶性循环,最终导致细胞损伤,功能受损。如图10所示,与对照组相比,LPS组细胞内ROS水平增加极显著(P<0.01);各INO组细胞内ROS水平与LPS相比极显著降低(P<0.01),并呈现浓度依赖性,证明INO可有效降低细胞内ROS水平,初步证明可缓解LPS引发的氧化应激。
2.8 INO对RAW264.7细胞MDA、GSH、LDH水平及SOD活性的影响
MDA是脂质过氧化的产物,其含量可以直接证明氧化应激下细胞膜的损伤程度[18];LDH存在于细胞内,当细胞受损,LDH被释放到细胞外,细胞外LDH的含量可以直接反映细胞整体的受损程度[19]。如表1所示,与对照组相比,LPS组MDA、LDH含量极显著升高(P<0.01),证明LPS使细胞膜受损,导致胞内LDH大量释放。与LPS组相比,20 μmol/L的INO组MDA、LDH含量极显著降低(P<0.01),并呈现剂量依赖性,表明INO能够有效缓解LPS诱导的细胞损伤,抑制MDA、LDH的增加与释放。检测GSH、SOD结果显示,与对照组相比,LPS组细胞内GSH和SOD被明显抑制,GSH含量极显著降低(P<0.01)、SOD活性极显著下降(P<0.01)。与LPS组相比,20 μmol/L的INO使细胞中GSH含量极显著升高(P<0.01)、SOD活性极显著增强(P<0.01),这表明INO可通过提高细胞内GSH含量及SOD活性发挥抗氧化作用,从而保护细胞缓解氧化应激对细胞造成的损伤。
表 1 INO对MDA、GSH水平及SOD、LDH活性的影响Table 1. Effects of inonotol on the levels of MDA, GSH and the activities of SOD and LDHMDA
(nmol·mg−1)SOD
(U·mg−1)GSH
(μg·mg−1)LDH
(U·mL−1)对照组 5.216±
0.94529.893±
2.36620.271±
0.70972.957±
0.972LPS组 15.151±
1.746**8.144±
1.170**10.698±
0.954**140.649±
2.760**INO低浓度组 11.866±
1.920**17.409±
2.007**16.152±
0.601**84.936±
1.675**INO中浓度组 8.363±
0.748**32.148±
1.918*17.695±
0.911**80.850±
2.275**INO高浓度组 5.485±
1.032##41.044±
3.391**##20.376±
0.256##68.964±
0.739*##注:与对照组相比用“*”表示,*(P<0.05),**(P<0.01);与LPS组相比用“#”表示,#(P<0.05),##(P<0.01)。 2.9 INO对RAW264.7细胞H2O2水平及CAT活性的影响
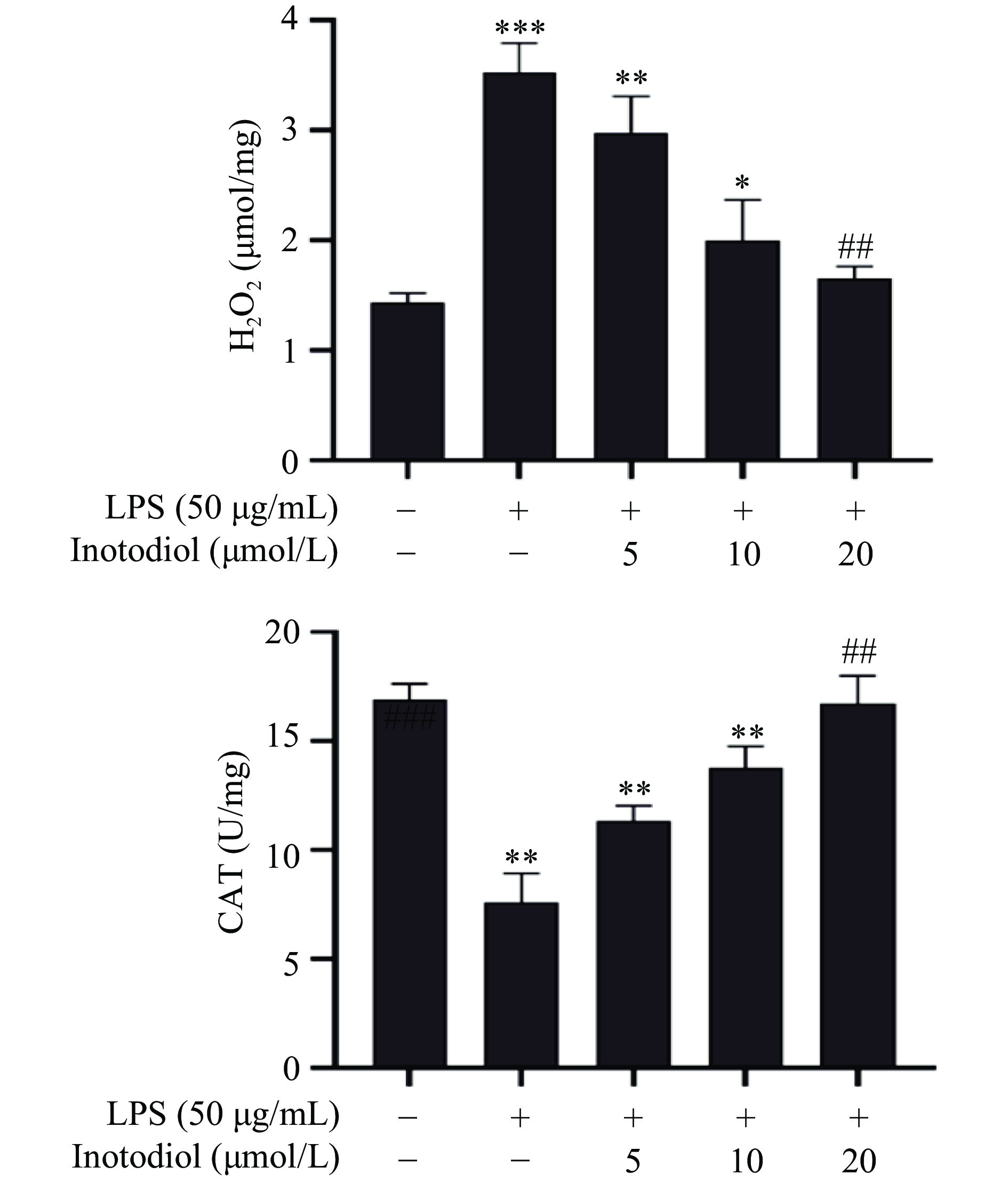
CAT是清除细胞内H2O2的关键酶,可将H2O2分解为H2O和O2,保护细胞免受损伤[20]。如图11,与对照组相比,LPS组H2O2含量极显著升高(P<0.01),CAT活性极显著降低(P<0.01)。与LPS相比20 μmol/L的INO使细胞中H2O2含量极显著降低(P<0.01),CAT活性极显著提升(P<0.01),表明INO可提高细胞内CAT活性,帮助细胞清除氧化应激产生的H2O2,发挥抗氧化作用。
3. 讨论与结论
巨噬细胞是机体炎症反应中的主要参与者。机体发生炎症反应时,巨噬细胞会吞噬病原体并与相应的抗体形成抗原抗体复合物,将病原体清除[21]。巨噬细胞在不同的调控作用下会发生极化,加剧机体炎症反应[22]。LPS可诱巨噬细胞向M1型极化,并分泌不同的细胞因子发挥免疫调节作用[23-25],导致促炎因子大量生成并释放[26],还能刺激NO产生,加剧对细胞的损伤,进而引发多种炎症疾病破坏机体健康[27]。实验结果表明,LPS刺激RAW264.7细胞后,细胞活力与对照组相比显著下降,导致IL-6、IL-1β、TNF-α的分泌和NO含量显著提高,桦褐孔菌醇(INO)可有效提高RAW264.7细胞活力,抑制细胞促炎因子分泌,减轻细胞的炎症反应。促炎因子的大量释放还会激活细胞的凋亡程序,引发细胞凋亡[28-29]。细胞凋亡结果显示,LPS处理RAW264.7细胞后,细胞凋亡率到达38%,而20 μmol/L的INO可有效阻止细胞凋亡的发生,使凋亡率降低到2%,与对照组相比无显著差异。IL-18主要由巨噬细胞合成并表达,能促进细胞中炎性小体的成熟诱导细胞产生严重的炎症性损伤[30]。实验结果表明,LPS刺激RAW264.7后,细胞大量分泌IL-18,而INO能有效抑制IL-18的分泌,减轻细胞的炎症性损伤。以上结果表明,INO可以提高RAW264.7细胞活力,抑制细胞促炎因子的分泌,降低细胞NO的合成,减轻细胞凋亡,发挥抗炎活性缓解LPS诱导RAW264.7细胞的炎症损伤。
炎症的发生也会伴随氧化应激的产生[31],当细胞出现炎症反应,细胞本身会产生ROS抵御病原体的攻击。而ROS又是巨噬细胞经典的促炎介质[32],未被清除的ROS加剧细胞的炎症反应,提高细胞内MDA、LDH、H2O2含量,抑制细胞中抗氧化酶活性,最终导致细胞损伤,发生凋亡,甚至死亡。实验结果表明,LPS刺激RAW264.7细胞后,ROS、H2O2、MDA、LDH含量与对照组相比显著提高,说明细胞发生氧化应激,使细胞活力下降;INO处理RAW264.7细胞后,能显著提高细胞中SOD、GSH、CAT活性,降低细胞中ROS、H2O2含量,抑制细胞氧化应激反应,同时细胞中MDA、LDH含量的降低,表明细胞损伤得到缓解,使INO高浓度组细胞活力恢复到98%,与对照组无显著差异。以上结果表明INO能通过提高RAW264.7细胞中SOD、GSH、CAT活性,抑制细胞中ROS、H2O2的生成,发挥抗氧化活性提高RAW264.7细胞活力缓解LPS诱导的氧化应激反应,保护细胞免受损伤。
综上所述,INO能有效抑制LPS诱导的RAW264.7细胞促炎因子分泌,提高细胞中抗氧化酶活性,降低细胞的炎症和氧化应激反应,缓解LPS诱导的RAW264.7细胞损伤。这说明INO具有较好抗炎作用,但对其具体的调控机制尚未明确,有待进一步研究。桦褐孔菌由于其天然、绿色、安全、具有多种药学活性,为功能性食品开发和炎症疾病防治提供实验依据。
-
图 4 不同浓度INO处理不同时间对RAW264.7细胞活力的影响
注:与对照组相比用“*”表示显著性差异,*(P<0.05),**(P<0.01),***(P<0.001);图6同。
Figure 4. Effect of different concentration of inotodiol on RAW264.7 cell viability
表 1 INO对MDA、GSH水平及SOD、LDH活性的影响
Table 1 Effects of inonotol on the levels of MDA, GSH and the activities of SOD and LDH
MDA
(nmol·mg−1)SOD
(U·mg−1)GSH
(μg·mg−1)LDH
(U·mL−1)对照组 5.216±
0.94529.893±
2.36620.271±
0.70972.957±
0.972LPS组 15.151±
1.746**8.144±
1.170**10.698±
0.954**140.649±
2.760**INO低浓度组 11.866±
1.920**17.409±
2.007**16.152±
0.601**84.936±
1.675**INO中浓度组 8.363±
0.748**32.148±
1.918*17.695±
0.911**80.850±
2.275**INO高浓度组 5.485±
1.032##41.044±
3.391**##20.376±
0.256##68.964±
0.739*##注:与对照组相比用“*”表示,*(P<0.05),**(P<0.01);与LPS组相比用“#”表示,#(P<0.05),##(P<0.01)。 -
[1] 黄年来. 俄罗斯神秘的民间药用真菌-桦褐孔菌[J]. 中国食用菌,2002(4):7−8. [HUANG N L. A mysterious folk medicinal fungus in Russia-Inonotus obliquus[J]. Chinese Edible Fungi,2002(4):7−8. HUANG N L. A mysterious folk medicinal fungus in Russia-Inonotus obliquus[J]. Chinese Edible Fungi, 2002(4): 7-8.
[2] LU Y, JIA Y, XUE Z, et al. Recent developments in Inonotus obliquus (Chaga mushroom) polysaccharides: isolation, structural characteristics, biological activities and application[J]. Polymers (Basel),2021,13(9):1441. doi: 10.3390/polym13091441
[3] ZOU C X, ZHANG Y Y, BAI M, et al. Aromatic compounds from the sclerotia of Inonotus obliquus[J]. Natural Product Research,2021,35(14):2454−2457. doi: 10.1080/14786419.2019.1677656
[4] 魏艳梅. 桦褐孔菌中化合物的分离鉴定及其部分生物活性初探[D]. 大庆: 黑龙江八一农垦大学, 2020. WEI Y M. Isolation and identification of compounds from Inonotus obliquus and preliminary study on some biological activities[D]. Daqing: Heilongjiang Bayi Agricultural Reclamation University, 2020.
[5] PENG A, LIU S, FANG L, et al. Inonotus obliquus and its bioactive compounds alleviate non-alcoholic fatty liver disease via regulating FXR/SHP/SREBP-1c axis[J]. European Journal of Pharmacology,2022,921:174841. doi: 10.1016/j.ejphar.2022.174841
[6] LEE M G, KWON Y S, NAM K S, et al. Chaga mushroom extract induces autophagy via the AMPK-mTOR signaling pathway in breast cancer cells[J]. Journal of Ethnopharmacology,2021,274:114081. doi: 10.1016/j.jep.2021.114081
[7] KIM J, YANG S C, HWANG A Y, et al. Composition of triterpenoids in Inonotus obliquus and their anti-proliferative activity on cancer cell lines[J]. Molecules,2020,25(18):4066. doi: 10.3390/molecules25184066
[8] 杨微, 陈志宝, 陈操, 等. 桦褐孔菌乙醇粗提物对朊病毒复制的抑制作用[J]. 现代食品科技,2021,37(7):8−13. [YANG W, CHEN Z B, CHEN C, et al. Inhibitory effect of ethanol crude extract of Inonotus obliquus on prion replication[J]. Modern Food Technology,2021,37(7):8−13. YANG W, CHEN Z B, CHEN C, et al. Inhibitory effect of ethanol crude extract of Inonotus obliquus on prion replication[J]. Modern food technology, 2021, 37(7): 8-13.
[9] 魏艳梅, 陈惠琴, 杨理, 等. 桦褐孔菌化学成分的胆碱酯酶抑制和细胞毒活性研究[J]. 天然产物研究与开发,2020,32(7):1156−1163. [WEI Y M, CHEN H Q, YANG L, et al. Cholinesterase inhibition and cytotoxic activity of chemical components of Inonotus obliquus[J]. Research and Development of Natural Products,2020,32(7):1156−1163. WEI Y M, CHEN H Q, YANG L, et al. Cholinesterase inhibition and cytotoxic activity of chemical components of Inonotus obliquus[J]. Research and Development of Natural Products, 2020, 32(7): 1156-1163.
[10] 贺紫薇, 刘旭, 李东辉, 等. 桦褐孔菌研究进展[J]. 中医药信息,2020,37(2):119−123. [HE Z W, LIU X, LI D H, et al. Research progress of Inonotus obliquus[J]. Information of Traditional Chinese Medicine,2020,37(2):119−123. HE Z W, LIU X, LI D H, et al. Research progress of Inonotus obliquus[J]. Information of Traditional Chinese Medicine, 2020, 37(2): 119-123.
[11] ZHAO Y, ZHENG W. Deciphering the antitumoral potential of the bioactive metabolites from medicinal mushroom Inonotus obliquus[J]. Journal of Ethnopharmacology,2021,265:113321. doi: 10.1016/j.jep.2020.113321
[12] 张如平, 姚建南, 李国立, 等. 桦褐孔菌多糖抗哮喘作用实验研究[J]. 当代医学,2012,18(12):19−20. [ZHANG R P, YAO J N, LI G L, et al. Experimental study on anti asthma effect of Inonotus obliquus polysaccharide[J]. Contemporary Medicine,2012,18(12):19−20. ZHANG R P, YAO J N, LI G L, et al. Experimental study on anti asthma effect of Inonotus obliquus polysaccharide[J]. Contemporary Medicine, 2012, 18(12): 19-20
[13] MATYAS C, HASKÓ G, LIAUDET L, et al. Interplay of cardiovascular mediators, oxidative stress and inflammation in liver disease and its complications[J]. Nature Reviews Cardiology,2021,18(2):117−135. doi: 10.1038/s41569-020-0433-5
[14] DU D, ZHU F, CEHN X, et al. Rapid isolation and purification of inotodiol and trametenolic acid from Inotodiol obliquus by high speed counter current chromatography with evaporative light scatting detection[J]. Phytochemical Analysis,2011,22(5):419−423. doi: 10.1002/pca.1297
[15] KUKULIANSKAIA T A, KURCHENKO N V, KURCHENKO V P, et al. Physicochemical properties of melanins produced by Inonotus obliquus (“chagi”) in the nature and the cultivated fungus[J]. Prikl Biokhim Mikrobiol,2002,38:68−72.
[16] WANG Y, GUO L, LIU C, et al. Total triterpenoid extraction from Inonotus obliquus using ionic liquids and separation of potential lactate dehydrogenase inhibitors via ultrafiltration high-speed countercurrent chromatography[J]. Molecules,2021,26(9):2467. doi: 10.3390/molecules26092467
[17] XU R, MA L, CEHN T, et al. Sophorolipid suppresses lps-induced inflammation in RAW264.7 cells through the NF-κB signaling pathway[J]. Molecules,2022,27(15):5037. doi: 10.3390/molecules27155037
[18] GAWEL S, WARDAS M, NIEDWOROK E, et al. Dialdehyd malonowy (MDA) jako wskaźnik procesów peroksydacji lipidów w organizmie [Malondialdehyde (MDA) as a lipid peroxidation marker][J]. Wiad Lek,2004,57(9-10):453−455.
[19] MAEKAWA M. Lactate dehydrogenase (LDH)[J]. Nihon Rinsho,1995,53(5):1151−1156.
[20] ZHANG Z, XU Y, XIE Z, et al. Association-dissociation of glycolate oxidase with catalase in rice: A potential switch to modulate intracellular H2O2 levels[J]. Molecular Plant,2016,9(5):737−748. doi: 10.1016/j.molp.2016.02.002
[21] SHAPOURI M A, MOHAMMADIAN S, VAZINI H, et al. Macrophage plasticity, polarization, and function in health and disease[J]. Journal of Cellular Physiology,2018,233(9):6425−6440. doi: 10.1002/jcp.26429
[22] MILLS C D. M1 and M2 macrophages: Oracles of health and disease[J]. Critical Reviews in Immunology,2012,32(6):463−88. doi: 10.1615/CritRevImmunol.v32.i6.10
[23] QIU P, LIU Y, ZHANG J. Review: The role and mechanisms of macrophage autophagy in sepsis[J]. Inflammation,2019,42(1):6−19. doi: 10.1007/s10753-018-0890-8
[24] KADOMOTO S, IZUMI K, MIZOKAMI A. Macrophage polarity and disease control[J]. International Journal of Molecular Sciences,2021,23(1):144. doi: 10.3390/ijms23010144
[25] WYNN T A, VANNELLA K M. Macrophages in tissue repair, regeneration, and fibrosis[J]. Immunity,2016,44(3):450−462. doi: 10.1016/j.immuni.2016.02.015
[26] OISHI Y, MANABE I. Macrophages in inflammation, repair and regeneration[J]. International Immunology,2018,30(11):511−528. doi: 10.1093/intimm/dxy054
[27] AGGARWAL B B, GUPTA S C, KIM J H. Historical perspectives on tumor necrosis factor and its superfamily: 25 years later, a golden journey[J]. Blood,2012,119(3):651−655. doi: 10.1182/blood-2011-04-325225
[28] BEDOUI S, HEROLD M J, STRASSER A. Emerging connectivity of programmed cell death pathways and its physiological implications[J]. Nature Reviews Molecular Cell Biology,2020,21(11):678−695. doi: 10.1038/s41580-020-0270-8
[29] CHU W M. Tumor necrosis factor[J]. Cancer Letter,2013,328(2):222−225. doi: 10.1016/j.canlet.2012.10.014
[30] VECCHIÉ A, BONAVENTURA A, TOLDO S, et al. IL-18 and infections: Is there a role for targeted therapies?[J]. Journal of Cellular Physiology,2021,236(3):1638−1657. doi: 10.1002/jcp.30008
[31] LEE S, SEOK B G, LEE S J, et al. Inhibition of mito NEET attenuates LPS-induced inflammation and oxidative stress[J]. Cell Death and Disease,2022,13(2):127. doi: 10.1038/s41419-022-04586-2
[32] HERB M, SCHRAMM M. Functions of ROS in macrophages and antimicrobial immunity[J]. Antioxidants (Basel),2021,10(2):313. doi: 10.3390/antiox10020313





 下载:
下载:

 下载:
下载:



