Optimization of the Preparation Process and Evaluation of the Activity of β-Glucan/Nano-selenium Complex (DNT-Se) from Black Fungus
-
摘要: 探索黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的最佳制备条件,并探究其安全性。以多糖(DNTs)浓度、维生素C(VC)与亚硒酸钠配比、亚硒酸钠浓度、反应时间、反应温度作为实验因素,采用双波长比色法及马尔文粒径测定法表征DNT-Se中Se NPs的粒径变化,以Se NPs的粒径大小为评价指标,采用单因素及正交试验设计的方法考察DNT-Se的制备工艺,并采用CCK-8法评价DNT-Se对293T人胚胎肾细胞和AML-12小鼠正常肝细胞的毒性。DNTs浓度1.0 mg/mL,维生素C与亚硒酸钠配比为6:1,亚硒酸钠浓度为1.0 mg/mL、反应时间12 h、反应温度25 ℃为制备DNT-Se的最佳条件。该条件下制备的DNT-Se中Se NPs的粒径大小均值为34.50 nm,细胞增殖实验结果表明,DNT-Se对293T人胚胎肾细胞和AML-12小鼠正常肝细胞在200 μg/mL时细胞存活率仍高于82%,同时DNT-Se能够抑制HepG2细胞的增殖,在72 h时对HepG2细胞的IC50值为42.54 μg/mL。本研究成功确定了DNT-Se的最优制备工艺,所得纳米硒粒径较小、分散均匀,对肝癌细胞HepG2有抑制增殖的效果,对正常细胞无毒性,具有良好的生物安全性。Abstract: This study aimed to explore the optimal conditions for the preparation of β-glucan/nanosized selenium (Se NPs) complexes (DNT-Se) and determining the safety of DNT-Se. The concentration of polysaccharides (DNTs), the ratio of vitamin C (VC) to Na2SeO3, the concentration of Na2SeO3, the reaction time, and the reaction temperature were used as experimental factors. The dual-wavelength colorimetric method and the Malvern particle-size assay method were used to characterize changes in the particle size of Se NPs in DNT-Se, and the single-factors and orthogonal experimental design were used to investigate the preparation process of DNT-Se, and the toxicity of DNT-Se to 293T human embryonic kidney cells and normal liver cells of AML-12 mice was evaluated by using CCK-8. The results showed that the optimal conditions for DNT-Se preparation were list as follows: 1.0 mg/mL of DNTs, and 1.0 mg/mL of Na2SeO3 with the ratio of vitamin C to Na2SeO3 6:1. Moreover, the reaction time was 12 h, and the reaction temperature was 25 ℃. The mean diameter of DNT-Se prepared under such conditions was around 34.50 nm. Cell proliferation experiment results showed that DNT-Se was non-toxic to 293T human embryonic kidney cells and normal liver cells of AML-12 mice, but it could inhibit the proliferation of HepG2 cells, and the IC50 value of DNT-Se for HepG2 cells at 72 h was 42.54 μg/mL. The synthesis process of DNT-Se was fixed in this work, and the obtained nanoparticles were with smaller size and uniform distribution. Moreover, the DNT-Se could significantly inhibit the proliferation of HepG2 hepatoma cells without toxicity to normal cells, which was of good biosafety.
-
Keywords:
- Se NPs /
- black fungus /
- β-glucans /
- process investigation
-
近年来,随着纳米技术的发展,许多金属及非金属的无机纳米颗粒被用于各种疾病的治疗。其中,纳米硒(Se NPs)因其毒性低、生物利用度高、活性高成为硒类物质研究和发展的焦点。但纯的 Se NPs不稳定,在水溶液中容易聚集,因此为保持其良好的水溶性和稳定性,在制备过程一般要添加分散剂或保护剂使其在水溶液中稳定分散[1−4]。化学类表面活性剂虽然对纳米硒有较强的分散能力,但因其本身的毒性使纳米硒在生物活性方面的应用受限[5]。核酸、蛋白质和多糖等天然生物大分子,由于其本身的生物相容性好,被更为广泛地用于构建生物医用材料。如Meng等[6]利用多糖-亚硒酸钠螯合法制得一种新型的水溶性黄芪多糖纳米硒(Se-APS)。结果表明,Se-APS含硒量高、水溶性好、副作用小,不仅能够促进T淋巴细胞的增殖,还能够抑制HepG2细胞的恶性增殖,减少细胞的迁移和侵袭。Zhu等[7]探讨了石笋多糖(ULP)稳定的Se NPs对DSS诱导的小鼠溃疡性结肠炎产生保护作用。因此,开发多糖-纳米硒复合物对临床疾病的治疗具有重要的意义。
黑木耳是生长在朽木上的一种腐生菌,具有补脾益气、止咳润肺、延缓衰老、辅助降血糖降血脂及抗癌等功效[8]。黑木耳的主要活性成分为多糖,目前已有多篇研究报道了从黑木耳中提取得到的不同结构的多糖,并证明了他们具有多种生物活性,如抗肿瘤、抗氧化、降血脂及免疫调节等功效[9−13]。在本课题组前期研究中,发现从黑木耳中提取的一种多糖,可在水中自组装成树枝状纳米管(DNTs)[14−17],这种中空纳米管结构可以负载多种客体分子,如DOX药物、Pt(IV)前药、聚集诱导发光(AIE)染料以及金、银纳米粒子[14,16−18]。并在治疗中展现出优良的疗效[19]。然而,该复合物作为一种新型制剂,其制备工艺并未进行过系统研究,阻碍其作为药物的深入开发。
因此,本文拟通过系统的制备工艺考察来探索DNT-Se复合物的最优制备条件。有研究表明,在纳米硒的制备工艺中,多糖浓度、维生素C与亚硒酸钠的比例、反应温度等都是制备理想纳米颗粒的重要因素[20]。因此,本文对黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的制备工艺进行考察,主要研究黑木耳β-葡聚糖溶液浓度、维生素C和亚硒酸钠配比、反应温度、反应时间、亚硒酸钠浓度等反应条件对DNT-Se复合物粒径的影响,采用单因素考察结合正交试验进行比例筛选,从而确定制备DNT-Se的最佳工艺,并考察其对HepG2肝癌细胞增殖的作用。
1. 材料与方法
1.1 材料与仪器
黑木耳 湖北房县;乙酸乙酯 天津市富宇精细化工有限公司;氯化钠 天津市大茂化学试剂厂;甲醇、无水乙醇、维生素C、亚硒酸钠 国药集团化学试剂有限公司;氘代二甲基亚砜、溴化钾 上海阿拉丁生化科技股份有限公司;Cell Counting Kit-8 东仁化学科技(上海)有限公司;DMEM培养基、双抗(青霉素-链霉素溶液)、胰酶(0.25%)、磷酸盐缓冲液 美国HyClone公司;胎牛血清(FBS) 美国Gbico公司;二甲亚砜(DMSO) 美国Sigma公司;人胚胎肾细胞株293T、小鼠正常肝细胞株AML-12及人肝癌细胞株HepG2 购自中国科学院生物化学与细胞生物学研究所。
Implen N60超微量紫外分光光度计 北京诺汇诚生物科技有限公司;Nicolet 6700傅里叶红外光谱仪 赛默飞世尔科技有限公司;YP-2压片机 上海山岳科学仪器有限公司;Mercury VX-300核磁共振仪 Varian Mercury公司;LC-10A高效液相色谱仪、RI-10A示差检测器 Shimadzu;色谱柱BRT105-104-102串联凝胶柱 BRT105-104-102 (8 mm×300 mm) BoRuiSaccharide;Nano-ZS90粒径测定仪 马尔文仪器有限公司;JEM1400透射电镜 日本JEOL有限公司;QUANTA200扫描式电子显微镜 FEI公司;XPertPro X射线衍射仪 荷兰帕纳科公司;ESCALAB250Xi X射线光电子能谱仪 Thermo FisherScientific。
1.2 实验方法
1.2.1 黑木耳β-葡聚糖的提取、分离及表征
按照参考文献[21]的方法,黑木耳粉碎后,分别使用丙酮、乙酸乙酯回流4 h脱脂,将脱脂粉末烘干后使用70%乙醇溶胀24 h后用0.9% NaCl提取,收集上清,然后使用Sevage法脱蛋白、H2O2脱色,透析7 d后冻干即得黑木耳多糖。按照参考文献[22]的方法,采用苯酚-硫酸法对黑木耳β-葡聚糖的总糖含量进行测定。将冻干的黑木耳多糖配制成多糖溶液,使用紫外分光光度计测定样品溶液在490 nm处的吸光度值,利用标准曲线计算样品的总糖含量。使用傅里叶红外光谱仪,采用溴化钾压片法采集黑木耳β-葡聚糖的红外光谱,检测范围为400~4000 cm−1。另取30 mg黑木耳β-葡聚糖冻干品溶于1 mL氘代二甲基亚砜(DMSO-d6)中,置于核磁仪上进行测定以得核磁共振(NMR)谱图,测定温度为25 ℃。
1.2.2 黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的制备
将β-葡聚糖于60 °C溶于蒸馏水(1 mg/mL),冷却至室温,即可通过其在水中自组装得黑木耳β-葡聚糖纳米管,命名为DNTs。纯纳米硒对照组(Se NPs),采用VC还原法制备。将VC水溶液(1 mg/mL)以4:1(n/n)的比例逐滴滴加到亚硒酸钠水溶液中,即可得到纳米硒粒子,命名为Se NPs。DNT-Se的制备方法类似,将黑木耳β-葡聚糖配制成终浓度1 mg/mL的多糖溶液,待完全溶解后逐滴滴加0.1 mol/L的亚硒酸钠(Na2SeO3)水溶液,搅拌30 min后再按照维生素C与亚硒酸钠配比为4:1(n/n)逐滴滴加维生素C水溶液(1 mg/mL),于25 ℃反应24 h。之后转入透析袋中(MWCO 3000)透析,冷冻干燥即得多糖/纳米硒复合物,命名为DNT-Se。
1.2.3 β-葡聚糖/纳米硒复合物中纳米硒粒径的评价指标
1.2.3.1 双波长吸光度比值法
将浓度为1 mg/mL DNTs、1 mg/mL维生素C溶液以及1 mg/mL维生素C+1 mg/mL DNTs(v/v=1:1)、1 mg/mL DNTs+1 mg/mL维生素C+1 mol/L亚硒酸钠溶液(v/v/v=1:1:1),进行紫外全波长扫描(200~800 nm),确定波长λ1(410 nm)、λ2(490 nm)的吸光度A1、A2,并计算A1/A2的值,以各因素为横坐标,以波长比(A1/A2)为纵坐标,绘制曲线图,以比值大小判断DNT-Se复合物中Se NPs的粒径大小,每个样品重复3次。
1.2.3.2 粒径仪测定法
将所得的DNT-Se置于马尔文激光粒度仪中,稳定120 s,于25 ℃下测定DNT-Se复合物中Se NPs的粒径,每个样品重复3次。
1.2.4 DNTs-Se粒径的单因素考察
分别考察DNTs浓度、亚硒酸钠浓度、维生素C与亚硒酸钠配比、反应温度、反应时间对DNT-Se形成的影响。分别配制浓度为0.1、0.5、1.0、1.5、2.0 mg/mL的DNTs溶液,其他条件保持不变,考察DNTs浓度对DNT-Se形成的影响;保持其他条件不变,考察0.6、0.8、1.0、1.2 mol/L的亚硒酸钠溶液对DNT-Se形成的影响;精密称取维生素C与亚硒酸钠,使二者终配比为2:1、3:1、4:1、5:1、6:1(n/n物质的量之比),考察维生素C与亚硒酸钠配比对DNT-Se形成的影响;分别考察反应温度为25、37、60、80 ℃时对DNT-Se形成的影响;在保持其他条件不变的条件下分别考察反应3、6、12、24、36 h对DNT-Se形成的影响。
1.2.5 正交试验优化DNT-Se的制备工艺
以DNTs-Se中Se NPs粒径大小的单因素考察实验结果为依据,选取三种因素作为实验对象,将最适宜的条件作为中间水平,以L9(34)设计正交因素水平表为模板,按照表1进行正交试验,以对DNT-Se的制备进行进一步的优化。
表 1 正交设计中的因素与水平Table 1. Factors and levels in orthogonal design因素 代号 水平 1 2 3 DNTs浓度(mg/mL) A 0.5 1.0 1.5 VC:Na2SeO3(n/n) B 4:1 5:1 6:1 Na2SeO3浓度(mol/L) C 0.6 0.8 1.0 1.2.6 黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的形貌表征
DNT-Se的形貌特征通过透射电子显微镜(TEM)来观察。取一滴新制备的DNTs、Se NPs及DNT-Se溶液分别小心滴于100目的铜网上,待样品被吸附10 min后,用滤纸吸走各剩余样品溶液,室温下晾干铜网,通过TEM观察依次各样品的微观形态。同时用能量色散光谱仪对其表面积断面进行观察,加速电压为5 kV,测试前均进行喷金操作。
1.2.7 细胞增殖实验
采用CCK8法[23]检测DNT-Se等样品对各种细胞增殖抑制的情况。首先采用该法检测DNTs、Se NPs及DNT-Se对HepG2肝癌细胞的增殖抑制情况。将处于对数生长期的HepG2细胞消化,加适量完全培养基轻吹散成细胞悬液,并用细胞计数器计数以便进行密度换算。将细胞混悬液稀释后以1.0×104个/孔的密度分别接种于96孔板内,于细胞培养箱中待其贴壁。贴壁后将含有一定浓度梯度的DNTs、Se NPs、DNT-Se培养基(6.25、12.5、25、50、100、200 μg/mL)分别加入到各孔中,同时建立无药物、无细胞的空白组和无药物、有细胞的对照组,每组设置4个复孔,置于5% CO2、37 ℃的培养箱中继续分别培养24、48、72 h。
接着采用该法检测DNT-Se对293T人胚胎肾细胞及AML-12小鼠正常肝细胞活性的影响,以进一步确定DNT-Se的生物安全性。将293T细胞和AML-12细胞以1×105的密度接种于96孔板,待其贴壁。之后加入含有一定浓度梯度的DNT-Se培养基(6.25、12.5、25、50、100、200 μg/mL),同时建立无药物、无细胞的空白组和无药物、有细胞的对照组,每组设置4个复孔,置于5% CO2、37 ℃的培养箱中继续培养48 h。
以上三种细胞终止培养后,每孔加入无菌PBS清洗细胞2次以洗净培养基,再加入100 μL含10% CCK8培养基,于培养箱中继续孵育20 min,最后用酶标仪在450 nm处检测每孔的吸光度OD值。用下式计算各细胞的存活率,用Graphpad prism 7.0计算药物的半数致死浓度(IC50):
细胞存活率(%)=(OD实验组−OD空白组)/(OD对照组−OD空白组)×100
1.3 数据处理
采用 Graph Pad Prism 7.0 软件对数据进行统计分析,计量资料以平均值±标准差($\overline {\rm x} $±s )表示,多组间均数采用 One-Way ANOVA 检验。P<0.05表示差异有统计学意义。
2. 结果与分析
2.1 黑木耳β-葡聚糖的理化性质表征
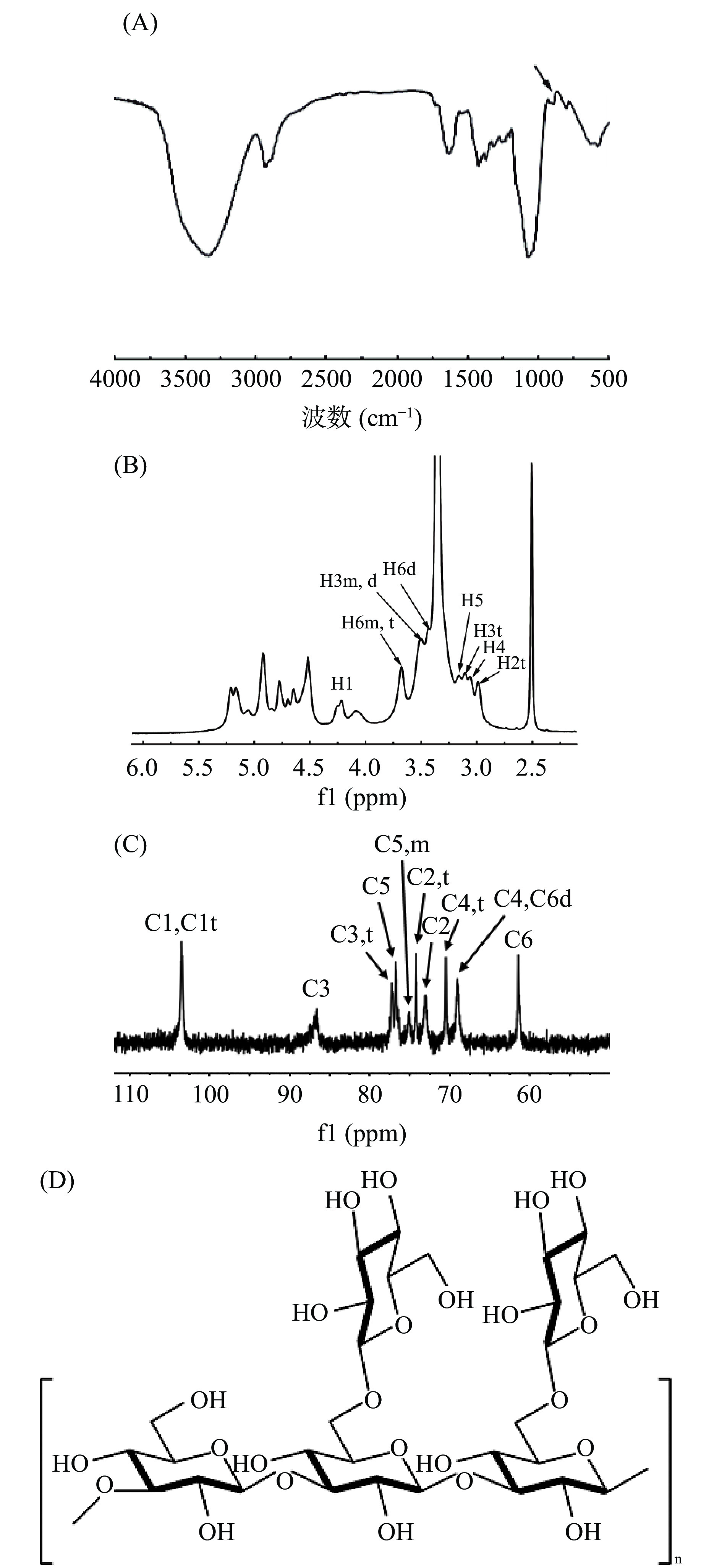
所得多糖采用苯酚-硫酸法测得总糖含量为94.1%,因前期[24−25]已通过色谱洗脱、甲基化分析等手段对黑木耳β-葡聚糖的平均高度、长度、分子量、链构象等进行了详细的表征,故本文仅对该多糖进行初步验证并与之对比,从而确证二者的相似性。红外光谱图如图1A所示。由图1A可知,黑木耳葡聚糖在890 cm−1处有明显的吸收峰,为β构型的特征峰[26],结合前期研究,该黑木耳多糖为β-葡聚糖。
采用核磁共振氢谱和碳谱分析黑木耳β-葡聚糖的连接方式。如图1B和图1C所示,在13C核磁共振谱中未发现典型的糖醛酸信号(176.5 ppm),表明β-葡聚糖是中性多糖。黑木耳β-葡聚糖在74.26 ppm处C2t积分值(侧链)和在72.99 ppm处C2(主链)积分值的比值为1:1.4,DNTs的所有化学位移如表2所示。与前期报道黑木耳多糖[27−29]的NMR特征峰等进行对比可确定其化学结构为主链上每三个β-(1,3)-葡萄糖主链带有两个β-(1,6)-葡聚糖的侧链,具体结构式如图1D所示。
表 2 黑木耳β-葡聚糖的1H和13C NMR化学位移Table 2. 1H and 13C NMR chemical shifts of β-glucan from Auricularia auricula化学位移
(ppm)1 2 3 4 5 6 2m,d 2t 3m,d 3t 4m,d 4t 5d,t 5m 6m,t 6d 1H 4.24 — 2.93 3.20 3.10 3.16 3.28 3.67 3.43 13C 103.5 73.0 74.2 86.6 77.2 69.0 70.6 76.7 75.2 61.4 69.0 注:m、d和t分别代表1,3-葡萄糖链、1,3,6-葡萄糖和末端葡萄糖。 2.2 黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的制备工艺研究
2.2.1 不同溶液的全扫描吸收光谱
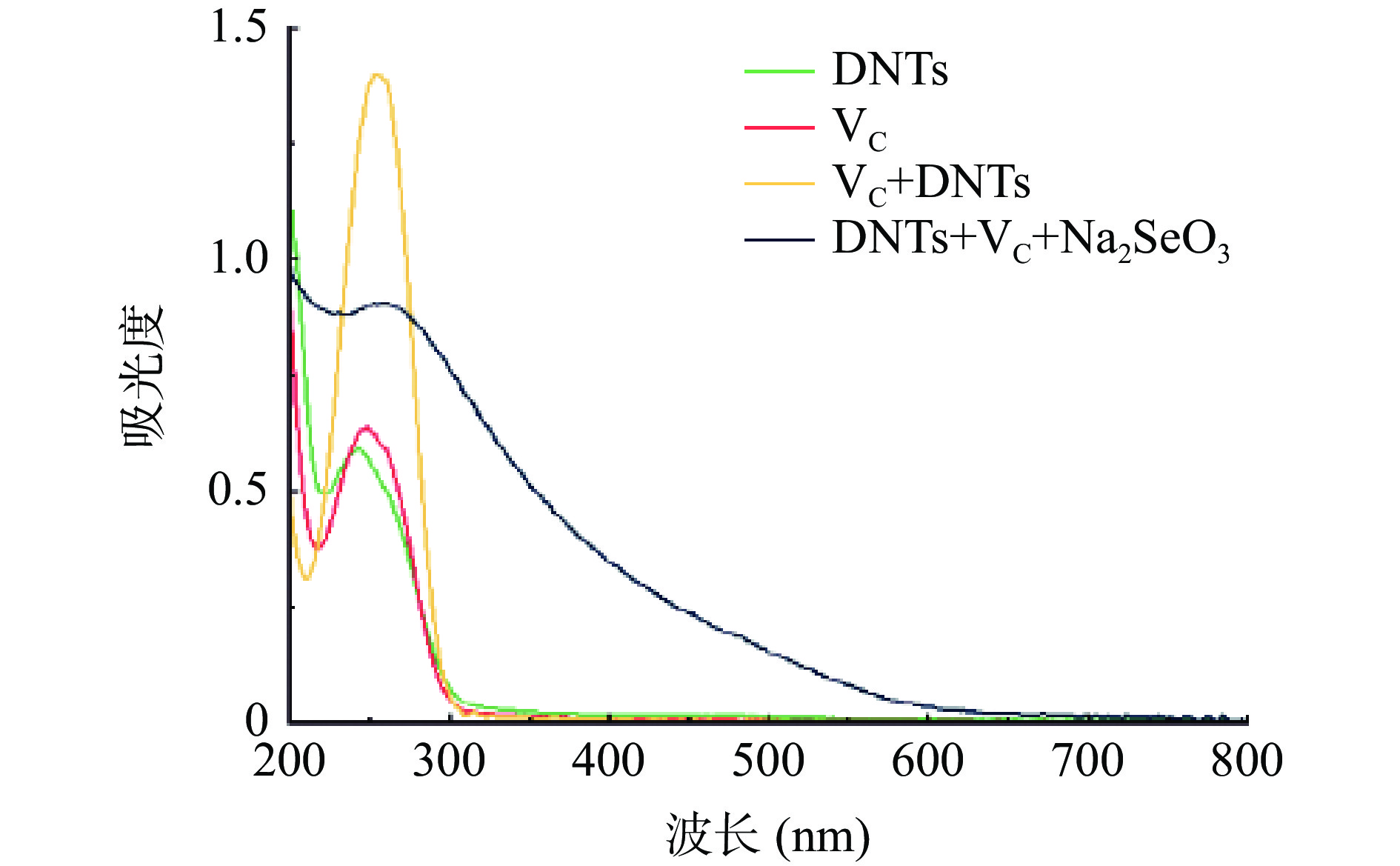
根据之前报道的胶体溶液双波长法[30−31]可知,硒纳米颗粒的粒径参数ε=lg(A2/A1) / lg(λ1/λ2),其中 A1、A2分别表示样品在波长λ1、λ2下的吸收值。可用A1/A2的比值来表征纳米硒的粒径变化,当比值不变时,纳米硒的粒径不再发生变化;比值越大,纳米硒的粒径越小,形貌越稳定。图2为不同溶液的UV-Vis全波长扫描吸收光谱。从图中可以看出,DNTs、VC及二者的混合样品在200~300 nm范围内有明显的吸收峰,但在300~600 nm范围内无明显吸收;而DNTs+VC+Na2SeO3(总反应介质)在200~600 nm处均有吸收,且峰值较宽,说明在加入Na2SeO3后生成了一定的纳米硒,因此在300~600 nm范围内选取410和490 nm作为纳米硒的测定波长,并以A410/A490作为表征纳米硒粒径随时间变化的依据及指标。
2.2.2 单因素考察实验结果
2.2.2.1 DNTs浓度对DNT-Se形成的影响
本试验以黑木耳β-葡聚糖溶液DNTs作为模板剂,研究了DNTs浓度对DNT-Se复合物中Se NPs粒径的影响。各浓度下的吸光度比值及DNT-Se复合物中Se NPs的粒径如表3所示。随着DNTs浓度的增加,A410/A490的数值呈现先上升后下降的趋势,在DNTs浓度为1.0 mg/mL 时A410/A490达到最大值2.549±0.025。同时,马尔文粒径仪测得的结果表明,DNT-Se复合物中Se NPs的粒径出现先减小后增大的趋势,在1.0 mg/mL时Se NPs的粒径最小。将各组溶液放置7 d后,均未发现聚沉等现象,可初步说明各组的稳定性良好。因此,选择1.0 mg/mL DNTs作为反应体系中DNTs的浓度。
表 3 不同DNTs浓度对纳米硒的粒径及A410/A490的影响Table 3. Effect of different DNTs concentration on the size of Se NPs and A410/A490DNTs浓度(mg/mL) A410/A490
(双波长比色法)纳米硒粒径(nm) 0.1 1.796±0.008a 49.37±9.61c 0.5 1.798±0.002a 36.86±4.44b 1.0 2.549±0.025b 32.30±6.62a 1.5 2.384±0.030ab 41.04±3.73b 2.0 2.313±0.041ab 39.71±6.03b 注:同列标有不同小写字母者表示组间差异显著(P<0.05);标有相同小写字母者表示组间差异不显著(P>0.05)。 2.2.2.2 维生素C与亚硒酸钠的配比对DNT-Se形成的影响
各配比下的吸光度比值及纳米硒的粒径如表4所示。固定反应体系中亚硒酸钠的终浓度为0.1 mol/L,VC的量对反应的影响主要表现在体系中的亚硒酸钠是否得到完全反应,能否生成足够量的纳米硒。判断反应完全的程度的最直观的变化则是溶液颜色的深浅,越深表明纳米硒生成量越多,同时,A410、A490也可能会越大并且趋于稳定。从表4中可以看出,随着VC/Na2SeO3的升高,A410/A490逐渐增加,这说明溶液中越来越多的亚硒酸钠参与了反应;而当比值达到5:1之后,A410/A490呈现下降的趋势,这说明当VC/Na2SeO3达到5:1之后,反应体系中的亚硒酸钠得到了完全反应,由于纳米硒生成过多,产生聚集导致A410/A490开始减小。接着测定了各体系中纳米硒的粒径,发现其在VC/Na2SeO3为5:1时的粒径最小,该结果与双波长比值结果一致。将各组溶液放置7 d后,均未发现聚沉等现象,可初步说明各组的稳定性良好。结合该实验结果,故选择VC/Na2SeO3=5:1作为反应体系中维生素C与亚硒酸钠的比例。
表 4 不同VC与Na2SeO3的配比对纳米硒的粒径及A410/A490的影响Table 4. Effect of different ratio of VC and Na2SeO3 on the size of Se NPs and A410/A490nVc:$\rm n_{Na_2SeO_3} $ A410/A490
(双波长比色法)纳米硒粒径(nm) 2:1 1.646±0.005a 42.85±3.42a 3:1 1.797±0.005b 41.99±5.62a 4:1 2.153±0.012c 40.86±1.79a 5:1 2.183±0.008d 37.88±7.32a 6:1 2.158±0.003c 44.86±1.12a 2.2.2.3 反应温度对DNT-Se形成的影响
反应温度不仅对纳米硒粒径的大小有影响,而且对作为稳定剂的多糖DNTs也有影响。因此,确定一定的反应温度是至关重要的一环。本试验研究了不同的反应温度对纳米硒形成的影响,实验结果如表5所示。从结果中可以得知,随着反应温度的升高,A410/A490逐渐降低,纳米硒粒径逐渐增加,甚至在80 ℃ 时出现了聚沉,因为温度过高会破坏多糖的链状结构,同时其自组装能力也会受到影响,导致整个反应体系不稳定,多糖稳定纳米硒的能力减弱[32−33]。尽管在25、37、60 ℃时均未发生聚沉,但25 ℃ 时DNT-Se粒径最小,因此,选择25 ℃作为制备DNT-Se的最佳反应温度。
表 5 不同反应温度对纳米硒的粒径及A410/A490的影响Table 5. Effect of different reaction temperature on the size of Se NPs andA410/A490反应温度(℃) A410/A490
(双波长比色法)纳米硒粒径(nm) 25 2.085±0.015b 37.65±2.64a 37 2.047±0.010a 42.41±3.10ab 60 1.882±0.008a 49.06±5.70b 80 — — 注:“—”表示样品为浑浊状态;表7同。 2.2.2.4 反应时间对DNT-Se形成的影响
与反应温度对纳米硒粒径大小的影响一样,反应时间对纳米硒的粒径也有着重要影响。因此,本试验也探究了反应时间对纳米硒形成的影响,实验结果如表6所示。从结果中可以看出,反应时间在12 h内,随着反应时间的增加,A410/A490也逐渐增加,纳米硒粒径逐渐减小;当反应时间大于12 h时,A410/A490开始降低,纳米硒粒径增加。在反应温度一定时,随着反应时间的延长,体系中生成的纳米硒逐渐增多,溶液的颜色会出现浅黄色→橙色→红色的变化, A410/A490增加,DNT-Se粒径减小[34−35]。但反应时间过长,纳米硒会发生集聚,硒纳米粒子的粒径增大,溶液的颜色会由红色变为砖红色,甚至出现红色沉淀。因此,反应时间不宜过长,故选择12 h作为制备DNT-Se的反应时间。
表 6 不同反应时间对纳米硒的粒径及A410/A490的影响Table 6. Effect of different reaction time on the size of Se NPs and A410/A490反应时间(h) A410/A490
(双波长比色法)纳米硒粒径(nm) 3 1.812±0.007a 49.25±7.16b 6 1.845±0.005b 41.25±7.52ab 12 2.092±0.019e 35.76±7.45a 24 2.039±0.013d 40.16±4.38ab 36 1.913±0.007c 44.93±6.37b 2.2.2.5 亚硒酸钠浓度对DNT-Se形成的影响
本研究最主要的目的是在纳米硒分散且稳定的前提下,利用DNTs负载尽可能多的纳米硒。因此纳米硒的浓度至关重要。不同亚硒酸钠浓度对粒径的影响如表7所示。随着浓度的增加,A410/A490逐渐减小,纳米硒粒径也呈现增加的趋势;在浓度为1.2 mol/L时,样品出现了聚沉现象。实验数据表明,0.6、0.8、1.0 mol/L的A410/A490与粒径相差不大,结合实验的目的,选择Na2SeO3为1.0 mol/L作为反应体系中亚硒酸钠的浓度。
表 7 不同Na2SeO3浓度对纳米硒的粒径及A410/A490的影响Table 7. Effect of different Na2SeO3 concentration on the size of Se NPs and A410/A490Na2SeO3浓度(mol/L) A410/A490
(双波长比色法)纳米硒粒径(nm) 0.6 2.158±0.043b 37.93±4.70a 0.8 1.832±0.003a 41.79±1.96a 1 1.795±0.016a 43.40±3.08a 1.2 — — 2.2.3 正交试验优化DNT-Se的制备工艺
基于前述单因素实验的结果及本研究的主要目的,选择DNTs浓度(A)、维生素C与亚硒酸钠的配比(B)和亚硒酸浓度(C)作为因素,选择最适宜的条件作为中间水平,各设三个水平,第四个因素为空白组,作为本实验的误差列,采用四因素三水平L9(34)设计正交试验表,继续优化DNT-Se的制备工艺,优化指标为纳米硒粒径。实验使用的因素水平如表1,实验结果如表8所示。
表 8 正交试验设计与结果Table 8. Orthogonal experimental design and results实验号 水平 纳米硒粒径(nm) A
DNTs浓度B
VC:Na2SeO3C
Na2SeO3浓度空白 1 1 1 1 1 47.56 2 1 2 2 2 46.22 3 1 3 3 3 44.28 4 2 1 2 3 37.97 5 2 2 3 1 40.12 6 2 3 1 2 39.64 7 3 1 3 2 43.87 8 3 2 1 3 47.06 9 3 3 2 1 44.70 K1 138.1 86.3 89.5 88.3 K2 78.5 88.9 85.9 86.5 K3 90.4 85.7 85.5 86.2 $\overline{\rm K}_1 $ 46.020 43.133 44.753 44.127 $\overline{\rm K}_2 $ 39.243 44.467 42.963 43.243 $\overline{\rm K}_3 $ 45.210 42.873 42.757 43.103 R 6.8 1.6 2.0 1.0 对正交试验的结果,以DNTs-Se中Se NPs粒径大小为指标,进行直观分析及方差分析,如表8和表9所示,以空白组作为误差项,因素A、B、C的F值与临界值比较后可知,因素A不同水平对纳米硒的影响有显著性差异,即DNTs浓度对纳米硒的影响显著(P<0.05)。各因素对纳米硒粒径的影响程度为A>C>B。根据正交试验结果,得出最佳方案为A2B3C3。
表 9 正交试验结果方差分析Table 9. Analysis of variance of orthogonal experiment results因素 偏差平方和 自由度 F比 F临界值 显著性 A 82.180 2 44.494 19.000 * B 4.384 2 2.374 19.000 C 7.233 2 3.916 19.000 误差 1.850 2 ”*“表示差异显著,P<0.05。 2.2.4 验证实验
运用正交试验所得的最优条件进行5组实验对其进行验证,即DNTs浓度1.0 mg/mL,维生素C与亚硒酸钠配比6:1,亚硒酸钠浓度为1.0 mol/L。5次验证试验的结果中纳米硒粒径分别为33.59、35.10、34.48、35.32、34.01 nm,5次验证实验中纳米硒粒径的均值为34.50±0.72 nm。故选择A2B3C3作为最佳制备条件。
2.3 黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的形貌表征
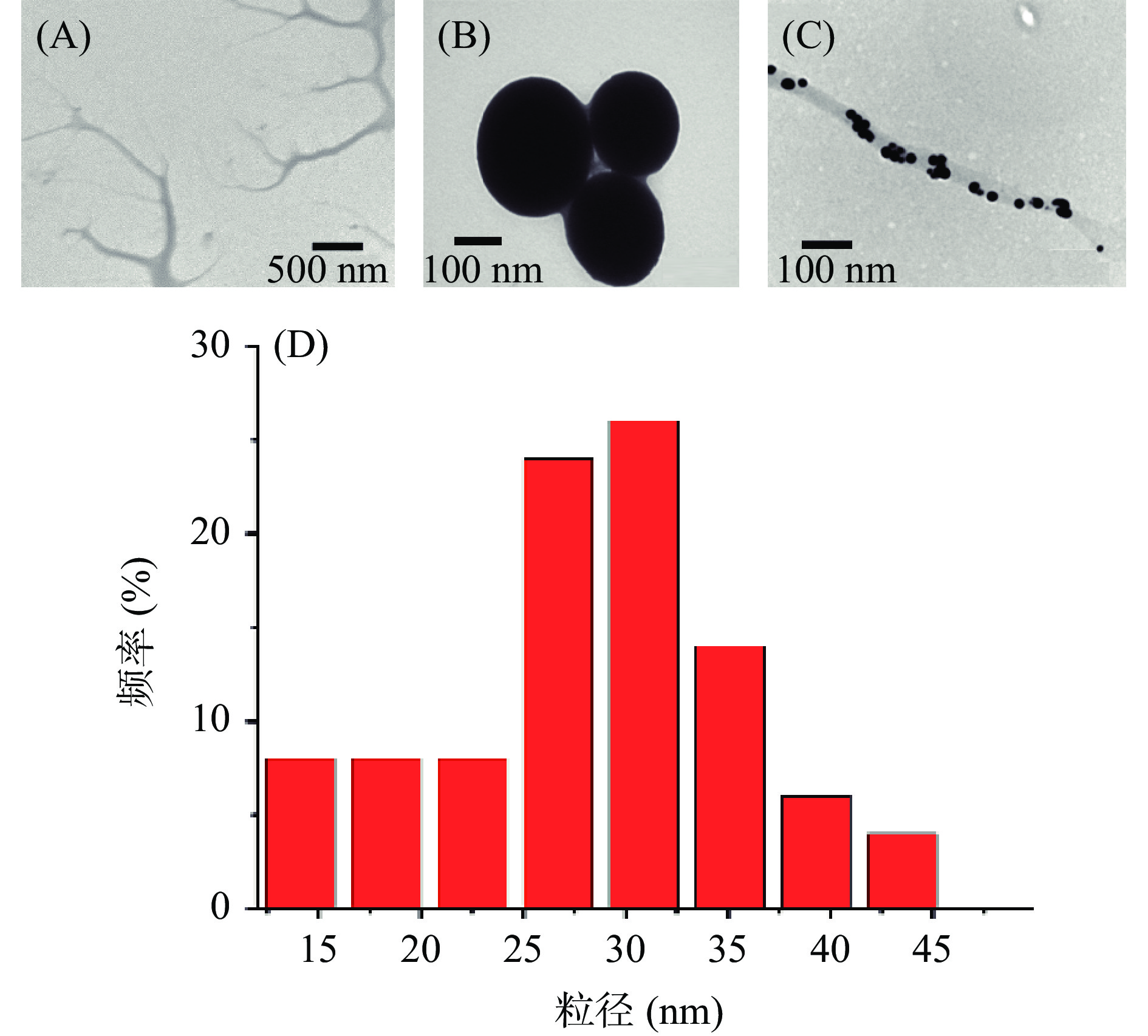
DNTs及Se NPs的透射电镜结果如图3所示。由图3A所示,DNTs在水中可自组装成为平均直径约为200 nm的树枝状的中空纳米纤维。而没有分散剂的纯Se NPs则聚集成团且粒径较大,约为220 nm(图3B)。图3C和图3D是DNT-Se的透射电镜图、粒径分布图。显然,因DNTs的存在,Se NPs不再聚集成团,而是均一、单一地分散于DNTs的中空纳米管中,与文献[17]报道相符。DNT-Se形态良好,粒径较小,约为30.9 nm(图3C),而正交试验所得的粒径大小约为34.50 nm,这是因为正交验证时中测量粒径时DNT-Se是以一个液体的状态存在,多糖在溶液中会有一定的体积膨胀。而透射电镜中,DNT-Se是处于干燥状态的。此时的粒径确实会与溶液状态下粒径大小具有一定的差异。
2.4 细胞增殖实验
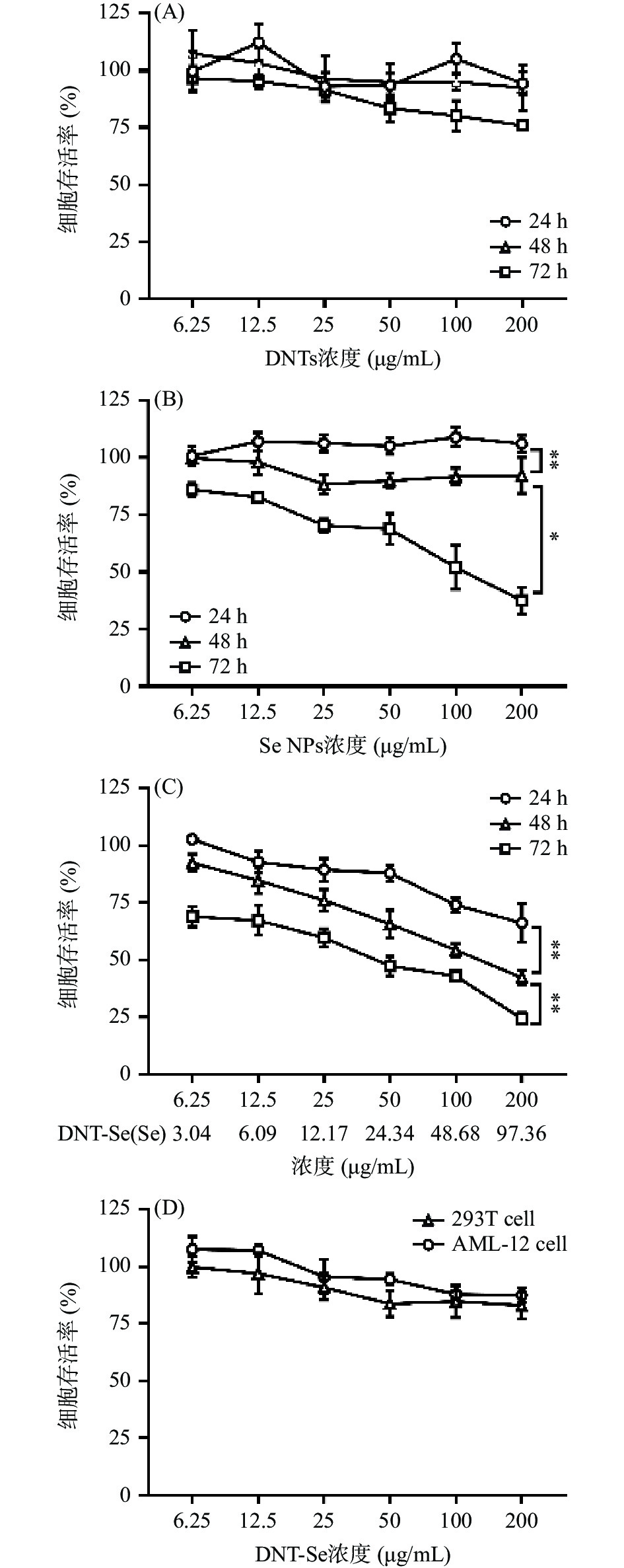
有研究表明,含硒的材料通过诱导细胞凋亡而发挥抗癌活性[33]。故为考察各样品对肝癌细胞和正常细胞的作用,本研究采用CCK8法对DNTs、Se NPs及DNT-Se对HepG2细胞的作用进行了探讨。结果如图4所示,由图4A可知,DNTs与细胞作用72 h后,在最高浓度下存活率仍高于75%,说明DNTs基本不杀死细胞,也可推测其基本不引起细胞凋亡;由图4B可知,200 μg/mL的Se NPs与细胞作用48 h后,在最高浓度下存活率大于92%,而当其作用时间达72 h时,其存活率显著下降且与48 h时存在显著性差异(P<0.05);由图4C可知,随着DNT-Se与细胞共孵育的时间的增加,其存活率逐渐降低,对三个时间段的半数致死浓度进行计算,DNT-Se在24、48、72 h的IC50分别为412.81、125.64、42.54 μg/mL。可见,DNT-Se对HepG2细胞的作用具有时间依赖性,且在各时间段内,DNT-Se组的IC50均低于Se NPs组,可说明经DNTs分散后的制剂(DNT-Se)能使更多的Se NPs进入肝癌细胞,从而更好地发挥抑制癌细胞增殖的作用。考虑到制剂在体内的代谢情况,后续实验拟采用48 h作为DNT-Se及各组样品与细胞的作用时间。
为了进一步考察DNT-Se对正常细胞的影响,本研究采用293T人胚胎肾细胞及AML-12小鼠正常肝细胞的CCK8实验以确证其安全性。如图4D所示,DNT-Se分别与293T细胞和AML-12细胞作用48 h后,即使在最高浓度(200 μg/mL)时,其细胞存活率仍高于82%,说明DNT-Se对正常细胞并无毒性作用,具有良好的生物安全性。
3. 结论
本文采用原位还原法制备黑木耳β-葡聚糖/纳米硒复合物(DNT-Se),考察了DNTs浓度、维生素C与亚硒酸钠配比、反应温度、反应时间、亚硒酸钠浓度对DNT-Se粒径大小的影响,最终确定DNT-Se的最佳制备工艺为DNTs浓度1.0 mg/mL,维生素C与亚硒酸钠配比6:1,亚硒酸钠浓度为1.0 mol/L,反应温度为25 ℃,反应时间为12 h,所得DNT-Se粒径平均值为34.50 nm。细胞增殖实验结果表明,DNT-Se对293T人胚胎肾细胞及AML-12小鼠正常肝细胞基本无毒性,但是对HepG2肝癌细胞的增殖具有显著的抑制作用,且其对HepG2肝癌细胞增殖的抑制作用明显优于Se NPs。本研究为多糖/纳米硒复合物的研究奠定了基础。
-
表 1 正交设计中的因素与水平
Table 1 Factors and levels in orthogonal design
因素 代号 水平 1 2 3 DNTs浓度(mg/mL) A 0.5 1.0 1.5 VC:Na2SeO3(n/n) B 4:1 5:1 6:1 Na2SeO3浓度(mol/L) C 0.6 0.8 1.0 表 2 黑木耳β-葡聚糖的1H和13C NMR化学位移
Table 2 1H and 13C NMR chemical shifts of β-glucan from Auricularia auricula
化学位移
(ppm)1 2 3 4 5 6 2m,d 2t 3m,d 3t 4m,d 4t 5d,t 5m 6m,t 6d 1H 4.24 — 2.93 3.20 3.10 3.16 3.28 3.67 3.43 13C 103.5 73.0 74.2 86.6 77.2 69.0 70.6 76.7 75.2 61.4 69.0 注:m、d和t分别代表1,3-葡萄糖链、1,3,6-葡萄糖和末端葡萄糖。 表 3 不同DNTs浓度对纳米硒的粒径及A410/A490的影响
Table 3 Effect of different DNTs concentration on the size of Se NPs and A410/A490
DNTs浓度(mg/mL) A410/A490
(双波长比色法)纳米硒粒径(nm) 0.1 1.796±0.008a 49.37±9.61c 0.5 1.798±0.002a 36.86±4.44b 1.0 2.549±0.025b 32.30±6.62a 1.5 2.384±0.030ab 41.04±3.73b 2.0 2.313±0.041ab 39.71±6.03b 注:同列标有不同小写字母者表示组间差异显著(P<0.05);标有相同小写字母者表示组间差异不显著(P>0.05)。 表 4 不同VC与Na2SeO3的配比对纳米硒的粒径及A410/A490的影响
Table 4 Effect of different ratio of VC and Na2SeO3 on the size of Se NPs and A410/A490
nVc:nNa2SeO3 A410/A490
(双波长比色法)纳米硒粒径(nm) 2:1 1.646±0.005a 42.85±3.42a 3:1 1.797±0.005b 41.99±5.62a 4:1 2.153±0.012c 40.86±1.79a 5:1 2.183±0.008d 37.88±7.32a 6:1 2.158±0.003c 44.86±1.12a 表 5 不同反应温度对纳米硒的粒径及A410/A490的影响
Table 5 Effect of different reaction temperature on the size of Se NPs andA410/A490
反应温度(℃) A410/A490
(双波长比色法)纳米硒粒径(nm) 25 2.085±0.015b 37.65±2.64a 37 2.047±0.010a 42.41±3.10ab 60 1.882±0.008a 49.06±5.70b 80 — — 注:“—”表示样品为浑浊状态;表7同。 表 6 不同反应时间对纳米硒的粒径及A410/A490的影响
Table 6 Effect of different reaction time on the size of Se NPs and A410/A490
反应时间(h) A410/A490
(双波长比色法)纳米硒粒径(nm) 3 1.812±0.007a 49.25±7.16b 6 1.845±0.005b 41.25±7.52ab 12 2.092±0.019e 35.76±7.45a 24 2.039±0.013d 40.16±4.38ab 36 1.913±0.007c 44.93±6.37b 表 7 不同Na2SeO3浓度对纳米硒的粒径及A410/A490的影响
Table 7 Effect of different Na2SeO3 concentration on the size of Se NPs and A410/A490
Na2SeO3浓度(mol/L) A410/A490
(双波长比色法)纳米硒粒径(nm) 0.6 2.158±0.043b 37.93±4.70a 0.8 1.832±0.003a 41.79±1.96a 1 1.795±0.016a 43.40±3.08a 1.2 — — 表 8 正交试验设计与结果
Table 8 Orthogonal experimental design and results
实验号 水平 纳米硒粒径(nm) A
DNTs浓度B
VC:Na2SeO3C
Na2SeO3浓度空白 1 1 1 1 1 47.56 2 1 2 2 2 46.22 3 1 3 3 3 44.28 4 2 1 2 3 37.97 5 2 2 3 1 40.12 6 2 3 1 2 39.64 7 3 1 3 2 43.87 8 3 2 1 3 47.06 9 3 3 2 1 44.70 K1 138.1 86.3 89.5 88.3 K2 78.5 88.9 85.9 86.5 K3 90.4 85.7 85.5 86.2 ¯K1 46.020 43.133 44.753 44.127 ¯K2 39.243 44.467 42.963 43.243 ¯K3 45.210 42.873 42.757 43.103 R 6.8 1.6 2.0 1.0 表 9 正交试验结果方差分析
Table 9 Analysis of variance of orthogonal experiment results
因素 偏差平方和 自由度 F比 F临界值 显著性 A 82.180 2 44.494 19.000 * B 4.384 2 2.374 19.000 C 7.233 2 3.916 19.000 误差 1.850 2 ”*“表示差异显著,P<0.05。 -
[1] DAVY T, CASTELLANO S. The genomics of selenium:Its past, present and future[J]. Biochimica et Biophysica Acta (BBA)-General Subjects,2018,1862(11):2427−2432. doi: 10.1016/j.bbagen.2018.05.020
[2] LIU X, SUN J, GAO W. Site-selective protein modification with polymers for advanced biomedical applications[J]. Biomaterials,2018,178:413−434. doi: 10.1016/j.biomaterials.2018.04.050
[3] XIE M, YANG M, SUN X, et al. WS 2 nanosheets functionalized by biomimetic lipids with enhanced dispersibility for photothermal and chemo combination therapy[J]. Journal of Materials Chemistry B,2020,8(11):2331−2342. doi: 10.1039/C9TB01604J
[4] ZENG D, ZHAO J, LUK K H, et al. Potentiation of in vivo anticancer efficacy of selenium nanoparticles by mushroom polysaccharides surface decoration[J]. Journal of Agricultural and Food Chemistry,2019,67(10):2865−2876. doi: 10.1021/acs.jafc.9b00193
[5] 李泽甫, 钟国清. 纳米硒的制备与应用研究进展[J]. 当代化工,2011,40(4):396−399 doi: 10.3969/j.issn.1671-0460.2011.04.021 LI Z F, ZHONF G Q. Progress in preparation and application of selenium nanoparticles[J]. Contemporary Chemical Industry,2011,40(4):396−399. doi: 10.3969/j.issn.1671-0460.2011.04.021
[6] MENG Y, ZHANG Y, JIA N, et al. Synthesis and evaluation of a novel water-soluble high Se-enriched Astragalus polysaccharide nanoparticles[J]. International Journal of Biological Macromolecules,2018,118:1438−1448. doi: 10.1016/j.ijbiomac.2018.06.153
[7] ZHU C, ZHANG S, SONG C, et al. Selenium nanoparticles decorated with Ulva lactuca polysaccharide potentially attenuate colitis by inhibiting NF- κB mediated hyper inflammation[J]. Journal of Nanobiotechnology,2017,15(1):1−15. doi: 10.1186/s12951-016-0241-6
[8] 朱雪琼. 黑木耳多糖的提取、功能及单糖组成的研究[D]. 南宁:广西大学, 2014 ZHU X Q. Study on the extraction, separation and functional activity of the Auricularia auricula polysaccharide[D]. Nanning:Guangxi University, 2014.
[9] CHEN G, LUO Y C, LI B P, et al. Effect of polysaccharide from Auricularia auricula on blood lipid metabolism and lipoprotein lipase activity of ICR mice fed a cholesterol‐enriched diet[J]. Journal of Food Science,2008,73(6):H103−H108. doi: 10.1111/j.1750-3841.2008.00821.x
[10] KHASKHELI S G, ZHENG W, SHEIKH S A, et al. Characterization of Auricularia auricula polysaccharides and its antioxidant properties in fresh and pickled product[J]. International Journal of Biological Macromolecules,2015,81:387−395. doi: 10.1016/j.ijbiomac.2015.08.020
[11] MA Z, WANG J, ZHANG L, et al. Evaluation of water soluble β-D-glucan from Auricularia auricular-judae as potential anti-tumor agent[J]. Carbohydrate Polymers,2010,80(3):977−983. doi: 10.1016/j.carbpol.2010.01.015
[12] YOON S J, YU M A, PYUN Y R, et al. The nontoxic mushroom Auricularia auricula contains a polysaccharide with anticoagulant activity mediated by antithrombin[J]. Thrombosis Research,2003,112(3):151−158. doi: 10.1016/j.thromres.2003.10.022
[13] 庄伟, 屈咪, 赵迪, 等. 黑木耳多糖的结构组成及其免疫活性研究[J]. 食品科技,2020,45(2):205−210 doi: 10.13684/j.cnki.spkj.2020.02.034 ZHUANG W, QU M, ZHAO D, et al. Structual composition and immunomodulatory activities of polysaccharides from Auricularia auricula[J]. Food Science and Technology,2020,45(2):205−210. doi: 10.13684/j.cnki.spkj.2020.02.034
[14] CHEN K, CAI L, YANG S, et al. Pt (IV) prodrugs designed to embed in nanotubes of a polysaccharide for drug delivery[J]. ACS Applied Bio Materials,2021,4(6):4841−4848. doi: 10.1021/acsabm.1c00128
[15] MENG Y, ZHANG H, HU N, et al. Construction of silver nanoparticles by the triple helical polysaccharide from black fungus and the antibacterial activities[J]. International Journal of Biological Macromolecules,2021,182:1170−1178. doi: 10.1016/j.ijbiomac.2021.04.130
[16] PING Z, LIU T, XU H, et al. Construction of highly stable selenium nanoparticles embedded in hollow nanofibers of polysaccharide and their antitumor activities[J]. Nano Research,2017,10:3775−3789. doi: 10.1007/s12274-017-1590-7
[17] 孟燕. 黑木耳多糖的螺旋链构象及其生物医学应用[D]. 武汉:武汉大学, 2018 MENG Y. Helical chain conformation of a polysaccharide isolated from black fungus and its biomedical applications[D]. Wuhan:Wuhan University, 2018.
[18] SONG H, HU N, GAO Z, et al. Construction of gold nanoparticles by tubular polysaccharide from black fungus and their apoptosis-inducing activities in HepG2 cells[J]. Journal of Applied Polymer Science,2021,138(48):51537. doi: 10.1002/app.51537
[19] JIN Y, CAI L, YANG Q, et al. Anti-leukemia activities of selenium nanoparticles embedded in nanotube consisted of triple-helix β-D-glucan[J]. Carbohydrate Polymers,2020,240:116329. doi: 10.1016/j.carbpol.2020.116329
[20] SHI X D, TIAN Y Q, WU J L, et al. Synthesis, characterization, and biological activity of selenium nanoparticles conjugated with polysaccharides[J]. Critical Reviews in Food Science and Nutrition,2021,61(13):2225−2236. doi: 10.1080/10408398.2020.1774497
[21] XU S, XU X, ZHANG L. Branching structure and chain conformation of water-soluble glucan extracted from Auricularia auricula-judae[J]. Journal of Agricultural and Food Chemistry,2012,60(13):3498−3506. doi: 10.1021/jf300423z
[22] 王迎香, 唐子惟, 彭腾, 等. 苯酚-硫酸法测定酒蒸多花黄精多糖含量的优化[J]. 食品工业科技,2021,42(18):308−316 doi: 10.13386/j.issn1002-0306.2021010069 WANG Y X, TANG Z W, PENG T, et al. Optimization of phenol sulfuric acid method for the polysaccharide content of wine-steamed Polygonatum cyrtonema Hua[J]. Science and Technology of Food Industry,2021,42(18):308−316. doi: 10.13386/j.issn1002-0306.2021010069
[23] 张聪, 胡娜, 李珊, 等. 马钱苷对肝癌细胞HepG2增殖与凋亡的影响及机制研究[J]. 中国药房,2020,31(7):782−788 doi: 10.6039/j.issn.1001-0408.2020.07.04 ZHANG C, HU N, LI S, et al. Study on the effects of loganin on the proliferation and apoptosis of liver cancer HepG2 cells and its mechanism[J]. China Pharmacy,2020,31(7):782−788. doi: 10.6039/j.issn.1001-0408.2020.07.04
[24] 平兆华. 黑木耳刚性链β-葡聚糖及其复合物的抗癌活性和构效关系[D]. 武汉:武汉大学, 2016 PING Z H. Antitumor activities and correlation of structure to bioactivity of stiff β-glucan from Auricularia auricula-judae and its composites[D]. Wuhan:Wuhan University, 2016.
[25] 许淑琴. 黑木耳刚性链葡聚糖结构、链构象转变及自组装行为[D]. 武汉:武汉大学, 2013 XU S Q. Chemical structure, chain conformational transition, and self- assembly behaviors of stiff glucan from Auricularia auricular-judae[D]. Wuhan:Wuhan University, 2013.
[26] TAJMIR-RIAHI H A. Infrared spectra of crystalline β-d-glucuronic acid and its Na+, K+, and Rb+ salts[J]. Carbohydrate Research,1984,125(1):13−20. doi: 10.1016/0008-6215(84)85139-3
[27] CHAUVEAU C, TALAGA P, WIERUSZESKI J M, et al. A water-soluble β-D-glucan from Boletus erythropus[J]. Phytochemistry,1996,43(2):413−415. doi: 10.1016/0031-9422(96)00234-8
[28] RINAUDO M, VINCENDON M. 13C NMR structural investigation of scleroglucan[J]. Carbohydrate Polymers,1982,2(2):135−144. doi: 10.1016/0144-8617(82)90059-5
[29] SANTOS-NEVES J C, PEREIRA M I, CARBONERO E R, et al. A gel-forming β-glucan isolated from the fruit bodies of the edible mushroom Pleurotus florida[J]. Carbohydrate Research,2008,343(9):1456−1462. doi: 10.1016/j.carres.2008.03.001
[30] SHIBATA S. Dual-wavelength spectrophotometry[J]. Angewandte Chemie International Edition in English,1976,15(11):673−679. doi: 10.1002/anie.197606731
[31] 王红艳, 张胜义, 刘明珠, 等. 壳聚糖模板法制备纳米硒[J]. 应用化学,2004(8):788−792 doi: 10.3969/j.issn.1000-0518.2004.08.008 WANG H Y, ZHANG S Y, LIU M Z, et al. Synthesis of selenium nanoparticles in the presence of chitosan template[J]. Chinese Journal of Applied Chemistry,2004(8):788−792. doi: 10.3969/j.issn.1000-0518.2004.08.008
[32] ZHANG J, TENG Z, YUAN Y, et al. Development, physicochemical characterization and cytotoxicity of selenium nanoparticles stabilized by beta-lactoglobulin[J]. International Journal of Biological Macromolecules,2018,107:1406−1413. doi: 10.1016/j.ijbiomac.2017.09.117
[33] 赵胜男. 不同尺寸纳米硒的制备及其生物活性研究[D]. 佳木斯:佳木斯大学, 2019 ZHAO S N. Preparation and bioactivity of different sizes nano selenium[D]. Jiamusi:Jiamusi University, 2019.
[34] 杨梦涛. 纳米硒—牡蛎多糖的制备及其抗氧化活性研究[D]. 青岛:中国海洋大学, 2014. [YANG M T. Synthesis of selenium nanoparticles in the presence of oyster polysaccharides and the antioxidant activity[D]. Qingdao:Ocean University of China, 2014. YANG M T. Synthesis of selenium nanoparticles in the presence of oyster polysaccharides and the antioxidant activity[D]. Qingdao: Ocean University of China, 2014.
[35] 郑晓凤, 侯丽然, 廉亚楠, 等. 桔梗多糖软模板法制备纳米硒及表征[J]. 广东化工,2016,43(16):25−26 doi: 10.3969/j.issn.1007-1865.2016.16.012 ZHENG X F, HOU L R, LIAN Y N, et al. Preparation and characterization of nano-selenium using Platycodon grandiflorum polysaccharides as soft template[J]. Guangdong Chemical Industry,2016,43(16):25−26. doi: 10.3969/j.issn.1007-1865.2016.16.012
-
期刊类型引用(1)
1. 赵猛,丁子康,李欣悦,王晓梅,胡祖广,张忠山. 低分子量坛紫菜多糖纳米硒的制备、表征及其体外抗氧化活性. 食品工业科技. 2024(23): 170-178 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:
 下载:
下载:



