Preparation of β-Casein Based on Escherichia coli Expression System
-
摘要: 牛乳中β-酪蛋白含有多种变异体,其中A1β-酪蛋白(A1)和A2β-酪蛋白(A2)是其最常见的2种变异体。由于A1和A2蛋白在氨基酸序列上仅存在个别氨基酸的差异,因此通过常规的分离、纯化手段较难以实现纯度较高的A1和A2蛋白的制备。本研究利用分子生物学手段,分别构建含有CSN2-A1和CSN2-A2目的基因的重组质粒载体pET28a(+)-CSN2-A1和pET28a(+)-CSN2-A2。将构建的重组表达载体导入到大肠杆菌BL21(DE3)中进行诱导表达和纯化。结果表明,在0.2 mmol/L IPTG,37 ℃下诱导表达4 h可获得大量蛋白,但通过SDS-PAGE电泳显示目的蛋白以包涵体形式表达,存在于细胞破碎后的沉淀中。通过洗涤、溶解、镍柱亲和色谱纯化、复性以及鉴定等步骤最终可获得纯度大于90%(PAGE)的A1和A2重组蛋白,从而为制备A1和A2蛋白提供新的途径。Abstract: The β-casein of bovine milk contains a variety of variants, among which A1-β-casein (A1) and A2-β-casein (A2) are the two most common variants. Because of only few differences between with A1 and A2 in amino acid sequence, it is difficult to preparation of A1 and A2 proteins with higher purity by conventional separation and purification methods. In this study, recombinant plasmid of pET28a(+)-CSN2-A1 and pET28a (+)-CSN2-A2, which contained the target genes of CSN2-A1 and CSN2-A2 were constructed by molecular biological methods, respectively. Then two recombinant vectors were introduced into Escherichia coli BL21 for induced expression and purification, respectively. The results showed that abundant of proteins could be obtained by induced expression at 0.2 mmol/L IPTG at 37 ℃ for 4 h. However, the results of SDS-PAGE showed that the target proteins were expressed in the form of inclusion bodies, and existed in the pellet after cell disruption. In addition, the purity of more than 90% (SDS-PAGE) of the A1 and A2 recombinant proteins were obtained by several processes, which contained dissolution, nickel affinity chromatography, renaturation and qualification. Thereby, it could provide a new way for the preparation of A1 and A2 proteins.
-
Keywords:
- β-casein /
- Escherichia coli /
- prokaryotic expression /
- CSN2-A1 /
- CSN2-A2
-
酪蛋白是牛乳中含量最多的蛋白质,约占牛奶总蛋白质的80%。其中,β-酪蛋白约占酪蛋白的30%左右[1]。根据研究显示,由于受到自然界奶牛的杂交和基因突变等因素的影响,牛乳中β-酪蛋白有多达10余种变异体,其中以A1和A2为比较常见的变异体[2-4]。有研究表明,A2β-酪蛋白(A2,β-casein-A2)在消化过程中不会像A1β-酪蛋白(A1,β-casein-A1)一样产生β-酪啡肽-7(BCM-7)[5-6],而BCM-7可能与过敏、消化吸收障碍有关[7-8]。因此近几年A2β-酪蛋白牛奶成为人们关注的焦点之一。通过分析表明,A1和A2β-酪蛋白区别在于第67位氨基酸的不同,这种分子结构细微的差别,为后期分离和纯化带来了挑战[9],也是市面上还无商业化的A1和A2蛋白标准品可供使用的重要原因。目前对A1和A2蛋白的定量主要通过购买的β-酪蛋白的混合标准品进行折算定量,从而会对其定量的准确性和稳定性带来影响[10]。
随着生物学技术的发展,细胞工厂概念应运而生。以大肠杆菌、酵母为代表的微生物表达系统具有成本低、易于扩大培养等特点[11-13],已作为最为常用的生物合成手段之一,广泛应用于目标蛋白[14]、天然产物[15-16]、药物[17]和食品[18]的合成中。牛乳中的酪蛋白作为牛乳蛋白质的重要组成成分之一,具有很高的营养价值和经济价值。虽然陈爱亮等[19]通过筛选纯合型A1或A2奶牛,并从其乳汁中通过反复离心、过滤以及沉淀等过程可以得到A1或者A2蛋白,但是传统方式获取牛奶中的特定β-酪蛋白具有生产效率低、蛋白纯度低以及资源消耗大的特点。如何高效且低成本的获得可替代蛋白成为在过去的一段时间内各国研究的热点,且并在此领域研究已经取得了一系列突破[20-21]。虽然目前通过基因工程手段已在实验室阶段实现了利用大肠杆菌、毕赤酵母菌等微生物作为底盘细胞实现α-乳白蛋白、β-乳球蛋白以及乳铁蛋白等乳成分蛋白的生物合成[22-25]。Keppler等[23]以大肠杆菌为载体成功实现了β-乳球蛋白不同变异体的重组表达,所获得的重组蛋白与原生β-乳球蛋白在理化特性、结构稳定性以及翻译后修饰都基本相似,然而目前针对β-酪蛋白变异体合成的相关研究还鲜有报道。
本研究以大肠杆菌为工程载体,通过构建特定β-酪蛋白变异体表达系统,探索A1和A2β-酪蛋白生物合成的可能性,从而解决采用传统分离纯化手段制备结构细微差异的变异体蛋白带来的工艺难题,从而为后续乳蛋白定向合成以及相关乳制品的A1和A2蛋白定量检测提供基础。
1. 材料与方法
1.1 材料与仪器
表达质粒pET-28a(+)、大肠杆菌感受态细胞转化宿主Top10 上海生工;表达宿主菌大肠杆菌BL21(DE3) 卡梅德生物;蛋白Maker、aq DNA聚合酶、NdeI、XhoI限制性内切酶 赛默飞世尔公司;Ni Sepharose FF GE;Tricine、SDS、丙烯酰胺、甲叉双丙烯酰胺 大连宝生物工程公司;引物合成和测序 均由上海生工完成;卡那霉素、异丙基-β-D-硫代半乳糖吡喃糖苷(IPTG)等其他化学试剂 均为国产市售分析纯。
AKTAprime plus蛋白纯化系统 GE公司;5418R高速冷冻离心机 Eppendorf;5200凝胶成像仪 上海天能科技有限公司;BJ-2CD超净工作台 上海博迅仪器有限公司;FreeZone真空冷冻干燥机 Labconco;Mini-PROTEAN Tetra电泳仪 伯乐生命医学产品(上海)有限公司;HPP110恒温恒湿培养箱 德国美墨尔特公司;ZQLY-180ES摇床 上海知楚仪器有限公司;ABI Veriti PCR仪 赛默飞世尔公司;UV-1780紫外分光光度计 岛津公司。
1.2 实验方法
1.2.1 目的表达蛋白氨基酸序列
通过在Uniprot数据库(www.uniprot.org)中查找β-酪蛋白有224氨基酸序列(P02666),其中在N端包含15个氨基酸组成的信号肽序列[26]。根据A1和A2蛋白在氨基酸组成上的差异分别得到对应的氨基酸序列后委托卡梅德生物设计相应的碱基序列。同时通过Prot Param软件分别对A1和A2蛋白理化性质进行预测。
A1蛋白氨基酸序列:
MKVLILACLVALALARELEELNVPGEIVESLSSSEESITRINKKIEKFQSEEQQQTEDELQDKIHPFAQTQSLVYPFPGPIHNSLPQNIPPLTQTPVVVPPFLQPEVMGVSKVKEAMAPKHKEMPFPKYPVEPFTESQSLTLTDVENLHLPLPLLQSWMHQPHQPLPPTVMFPPQSVLSLSQSKVLPVPQKAVPYPQRDMPIQAFLLYQEPVLGPVRGPFPIIV
A2蛋白氨基酸序列:
MKVLILACLVALALARELEELNVPGEIVESLSSSEESITRINKKIEKFQSEEQQQTEDELQDKIHPFAQTQSLVYPFPGPIPNSLPQNIPPLTQTPVVVPPFLQPEVMGVSKVKEAMAPKHKEMPFPKYPVEPFTESQSLTLTDVENLHLPLPLLQSWMHQPHQPLPPTVMFPPQSVLSLSQSKVLPVPQKAVPYPQRDMPIQAFLLYQEPVLGPVRGPFPIIV
1.2.2 表达载体的构建
根据其设计对应的碱基序列和相应的带Nde I和Xho I酶切位点的引物(见表1)进行目的片段的克隆。然后将PCR扩增产物和表达载体pET28a(+)分别用Nde I和Xho Ⅰ双酶切,用试剂盒回收后进行连接得到pET28a(+)-CSN2-A1和pET28a(+)-CSN2-A2。连接产物随后分别转入TOP10感受态细胞,并提取质粒进行双酶切鉴定。根据鉴定结果,将鉴定正确的质粒做进一步测序[27]。
表 1 设计引物序列Table 1. Design primer sequence引物 序列及方向(5’-3’) 酶切位点 A1_F CCATATGACGTTCCGGGTGAAATTGTTG Nde I A1_R CCTCGAGTCTGGCTTTCGGTAAAGGGC Xho I A2_F CCATATGGATTCTGGCGTGTCTGGTTG Nde I A2_R CCTCGAGGGGATGTTTTGTGGGAGGCT Xho I 1.2.3 表达菌株转化
取大肠杆菌BL21(DE3)感受态一只100 μL,放置冰上化冻,超净工作台内取1.5 mL无菌离心管,并均分50 μL感受态细胞。在超净工作台中向感受态细胞中加入20 μL制备的质粒,轻轻混匀后,冰浴30 min。随后,在42 ℃条件下热击90 s后立即冰浴5 min,取30 μL涂布LB(含50 μg/mL卡那霉素)平板,37 ℃培养14 h(过夜培养)后挑取单克隆进行活化培养。
1.2.4 表达鉴定
方法参考文献[28-29]略作修改,具体如下,从1.2.3的LB平板中挑取单克隆,加入2 mL LB液体培养基(含50 μg/mL卡那霉素)活化至菌体OD600为0.6~0.8后,转接到5 mL LB液体培养基(含50 μg/mL卡那霉素)培养至菌体OD600为0.6~0.8后加入不同浓度的IPTG(0.2 mmol/L和1 mmol/L)在37 ℃和15 ℃分别诱导表达4 h和30 h,收集菌体。
取诱导表达前与诱导后各条件的菌体进行超声破碎后,取上清和沉淀制样SDS-PAGE分析,SDS-PAGE分离胶的配制和实验方法见相关文献报道[15]。
1.2.5 放大表达与亲和纯化
1.2.5.1 放大表达
从1.2.3表达鉴定中选取能够表达目的蛋白的BL21菌株,接种到1L LB培养基(含50 μg /mL卡那霉素)中,220 r/min,37 ℃摇床扩大培养至OD600值至0.6~0.8,再加入终浓度为0.2 mmol/L IPTG 37 ℃诱导培养4 h后,4000 r/min离心收集菌体待用[30]。
1.2.5.2 亲和纯化
重组蛋白的亲和纯化方法主要参考文献[31-32],并稍作修改。即将收集获得的菌泥用40 mL含20 mmol/L PB+150 mmol/L NaCl的缓冲液(pH=7.2)进行重悬。然后在参考冰浴条件下超声破碎,功率为420 W,超声3 s,间隔5 s,持续15 min。最后4 ℃,12000 r/min条件下离心20 min,收集上清和沉淀,待用。
1.2.5.3 上清纯化
1.2.5.2中上清经过0.22 μm过滤后进行Ni柱亲和层析纯化。正式纯化前先用不少于5倍柱体积的双蒸水冲洗Ni柱,然后柱子用平衡缓冲液平衡100 mL。平衡后用上清分批缓慢注入Ni柱中,随后用不同梯度的咪唑缓冲液依次洗脱柱子,并分别取样。实验过程中可以利用Bradford检测洗脱情况,当洗脱液在Bradford液中未变蓝,则冲洗干净。平衡缓冲液为20 mmol/L PB+150 mmol/L NaCl,pH=8.0。清洗缓冲液为20 mmol/L PB+150 mmol/L NaCl,咪唑浓度分别为5、20、50、和80 mmol/L,pH=8.0。最后用pH=8.0,20 mmol/L PB+150 mmol/L NaCl+300 mmol/L咪唑缓冲液洗脱。
1.2.5.4 包涵体纯化
1.2.5.2中沉淀加入适量20 mmol/L PB+150 mmol/L NaCl,pH=8.0缓冲液分散后在4℃,12000 r/min条件下离心10 min。随后沉淀用含0.3%曲拉通的缓冲液(20 mmol/L PB+150 mmol/L NaCl,pH=8.0)和20 mmol/L PB+150 mmol/L NaCl+2mol/L尿素, pH=8.0再按照相同步骤清洗两次。然后在沉淀中加入15 mL的20 mmol/L PB+150 mmol/L NaCl+8 mol/L尿素,pH=8.0,在4 ℃条件下缓慢搅拌,溶解沉淀。最后4 ℃,12000 r/min离心10 min获得沉淀复溶上清并经过0.22 μm过滤后进行Ni柱亲和富集纯化。后续纯化步骤同“上清纯化”,平衡缓冲液为20 mmol/L PB+150 mmol/L NaCl+8 mol/L尿素,pH=8.0,清洗缓冲液为20 mmol/L PB+150 mmol/L NaCl+8 mol/L尿素(pH=8.0),咪唑浓度分别为5、20、50和80 mmol/L清洗。最后用20 mmol/L PB+150 mmol/L NaCl+8 mol/L尿素+300 mmol/L咪唑,pH=8.0缓冲液洗脱。流穿纯化样品取50 μL加入loading buffer后100 ℃煮样后进行SDS-PAGE分析。
1.2.5.5 包涵体复性
上述纯化样品先用20 mmol/L PB+150 mmol/L NaCl,pH=8.0,以2 mL/min流速滴加稀释至尿素终浓度为4 mol/L,4 ℃冰箱中以350 r/min搅拌速度搅拌48 h后,将样品装入7 kDa孔径透析袋中进行复性,方法参考相关文献报道并略作调整[15,33],详细步骤如下:用1 L 20 mmol/L PB+150 mmol/L NaCl+2 mol/L尿素,pH=8.0缓冲液,4 ℃冰箱中以350 r/min搅拌速度搅拌24 h,按顺序更换1L 20 mmol/L PB+150 mmmol/L NaCl+1 mol/L 尿素(pH=8.0)、1 L 20 mmol/L PB+150 mmol/L NaCl+0.5 mol/L尿素(pH=8.0)、1L 20 mmol/L PB+150 mmol/L NaCl+0.5 mol/L尿素(pH=8.0)和1L 20 mmol/L PB+150 mmol/L NaCl(pH=8.0)透析缓冲液,分别在4 ℃冰箱中以350 r/min搅拌速度搅拌24 h。从透析袋中移出经透析的蛋白质溶液,然后12000 r/min,4 ℃离心10min取上清50 μL,加入10 μL loading buffer 100 ℃煮样,进行SDS-PAGE检测。同时用BCA蛋白检测试剂盒对复性后的蛋白浓度进行测定。
1.2.6 质谱鉴定
通过SDS-PAGE分离得到的目的蛋白,利用干净的刀片收集目的蛋白胶条经酶解后在卡梅德生物科技有限公司进行质谱覆盖度检测。同时目的蛋白经过胰蛋白酶酶解后采用LC-MS/MS,分别以IHPFAQTQSLVYPFPGPIHNSLPQNIPPLTQTPVVVPPFLQPEVMGVSK(A1)和IHPFAQTQSLVYPFPGPIPNSLPQNIPPLTQTPVVVPPFLQPEVMGVSK(A2)为特征性肽段进行定性分析,具体方法可参考文献[34]报道。
1.3 数据处理
数据处理采用Excel 2010,蛋白质理化特性分析采用在线Prot Param软件,引物设计采用Primer 5,序列分析采用软件DNASTAR。
2. 结果与分析
2.1 A1和A2蛋白理化性质预测
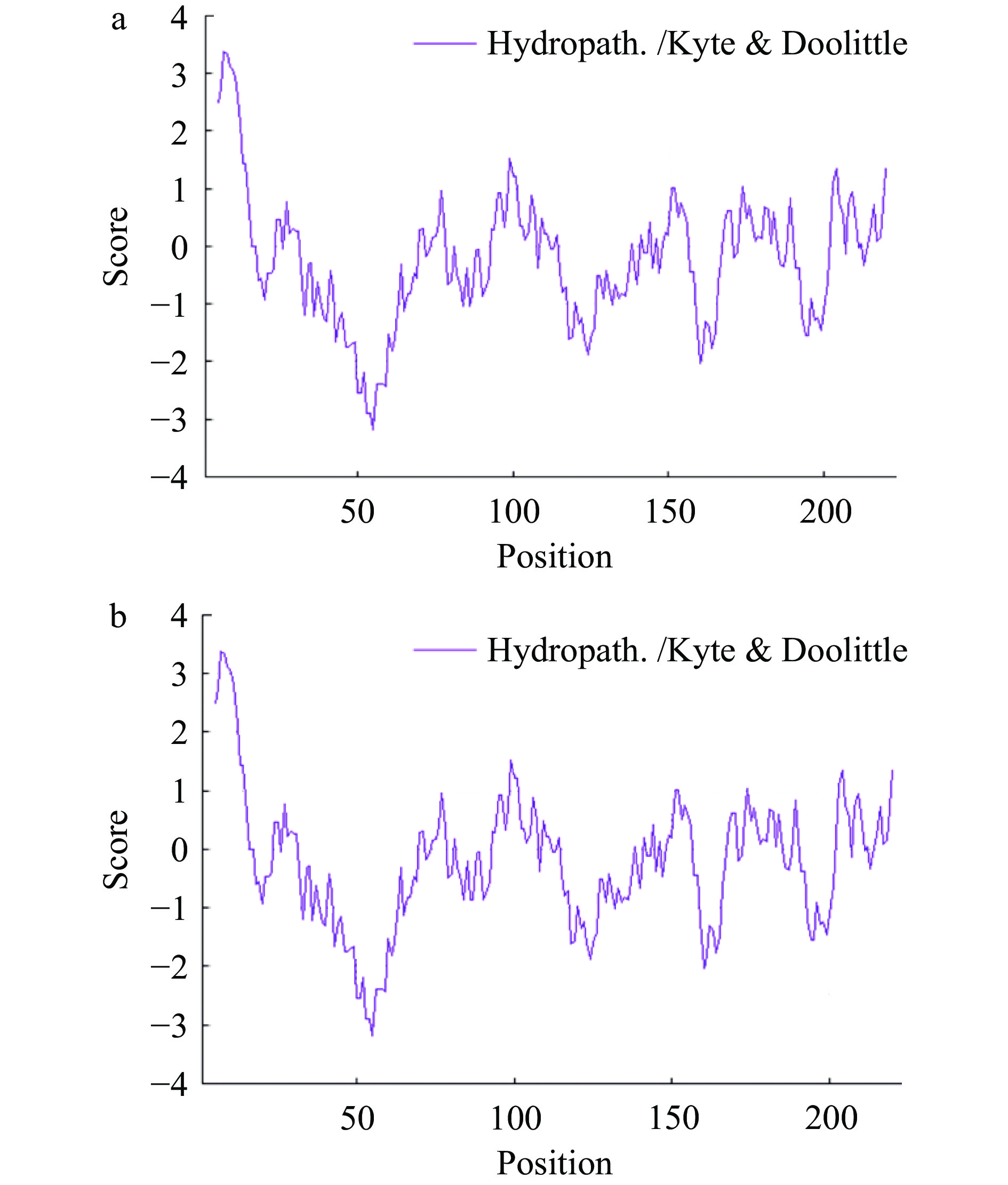
通过Prot Param软件对A1和A2蛋白氨基酸序列进行分析得到对应蛋白质理化性质,结果见表2。A1和A2蛋白分子量在25 kDa左右,理论等电点在5.2~5.4之间,为酸性蛋白质,其中带负电残基明显多于带正电残基。此外A1和A2蛋白经过预测,不稳定系数均超过40,因此均属于不稳定蛋白[26]。同时,根据所有氨基酸亲水值的总和与氨基酸总数量的比值(亲水系数)来看这两种蛋白均偏亲水性,其负值越大表示亲水性越强[35]。从图1可以看到A1和A2蛋白亲疏水性基本相同,最强疏水性氨基酸残基均位于氨基酸序列的第7位(Ala,Score:3.378),而最强亲水性氨基酸残基同样位于氨基酸序列的第55位(Gln,Score:−3.189)。
表 2 A1/A2蛋白理化性质Table 2. Physicochemical properties of A1/A2 proteins蛋白质名称 氨基酸个数 分子量(kDa) 理论等电点 带正电残基数(Asp+Glu) 带负电残基数(Arg+Lys) 不稳定系数 平均亲水系数 A1蛋白 224 25.14 5.37 16 23 95.86 −0.161 A2蛋白 224 25.10 5.26 16 23 94.12 −0.154 2.2 A1和A2蛋白重组表达载体的构建
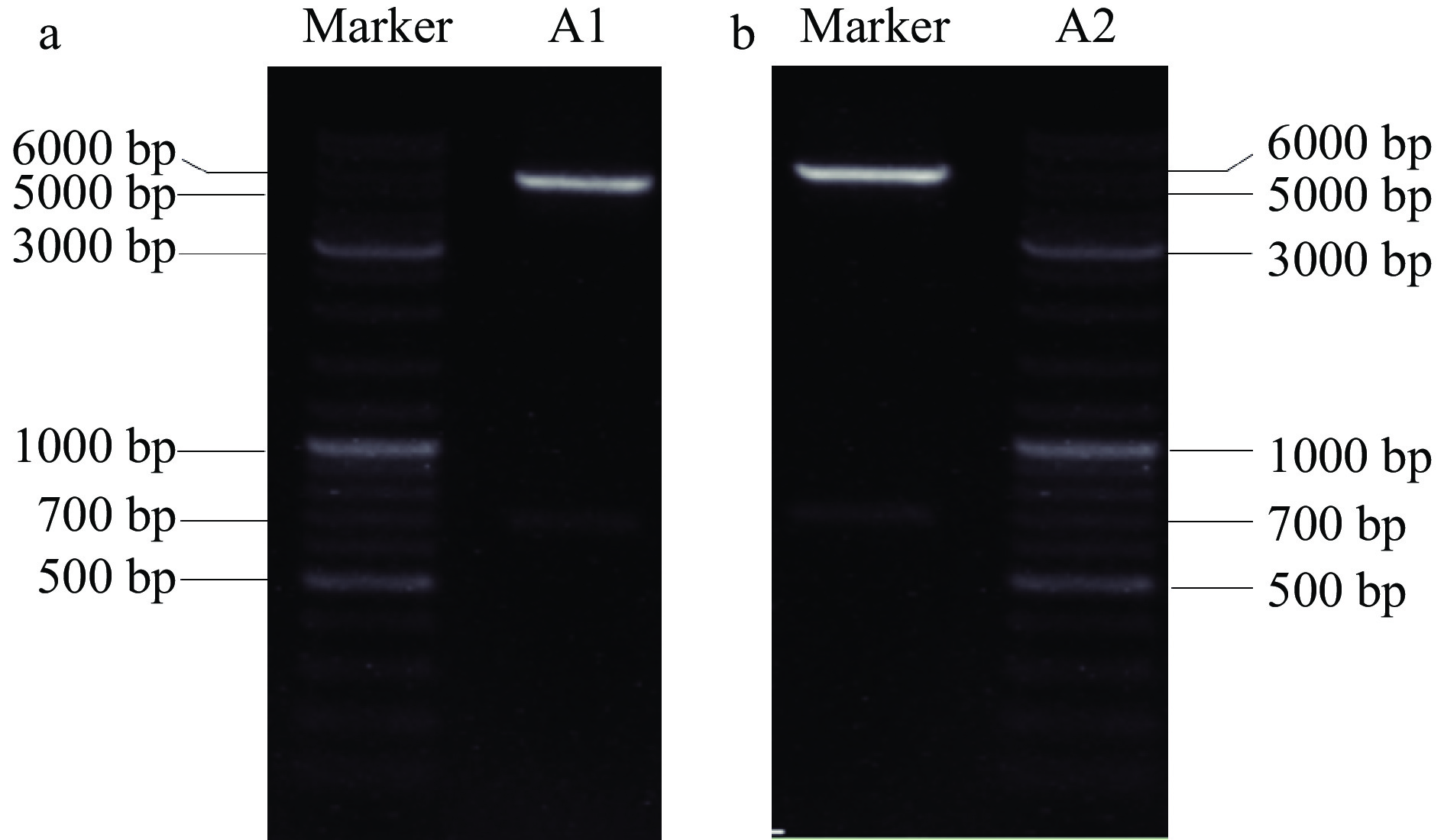
A1和A2蛋白目标基因片段长度为684 bp,并分别与表达质粒pET28a(+)构建得到pET28a(+)-CSN2-A1和pET28a(+)-CSN2-A2(产物长度:684+5.3k bp)重组表达质粒后分别转化到大肠杆菌TOP10感受态细胞。挑取阳性克隆进行质粒提取,用Nde I和Xho I双酶切鉴定。通过SDS-PAGE电泳发现有符合大小的目的条带出现(图2),鉴定结果表明提取的质粒为重组表达,且测序结果与理论一致。
2.3 单克隆菌株的筛选
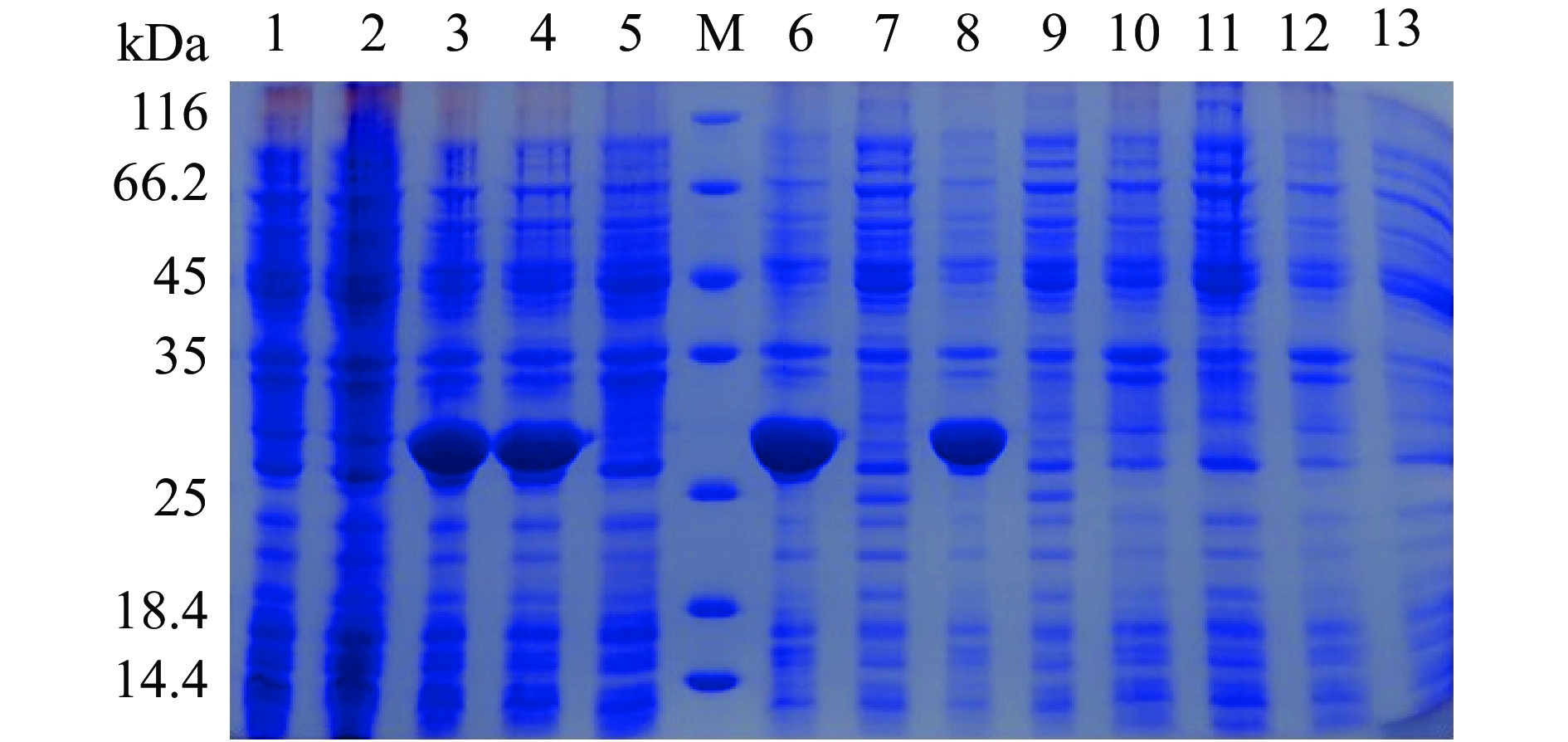
分别将提取的质粒加入到感受态大肠杆菌BL21(DE3)中,然后在含有卡那霉素的LB培养基中活化培养。随后挑选单菌落加入到含卡那霉素的LB培养基中活化、传代培养至OD600为0.6~0.8,加入浓度为0.2 mmol/L的IPTG进行诱导表达。因此取诱导表达前与诱导后各条件的菌体进行超声破碎后,取沉淀制样SDS-PAGE分析,验证结果见图3。两种重组表达菌株分别与各自未加IPTG的重组表达菌株做对比。由于在重组蛋白C端分别带有6×His标签,因此A1和A2重组蛋白的理论相对分子量分别为25.98和25.94 kDa。
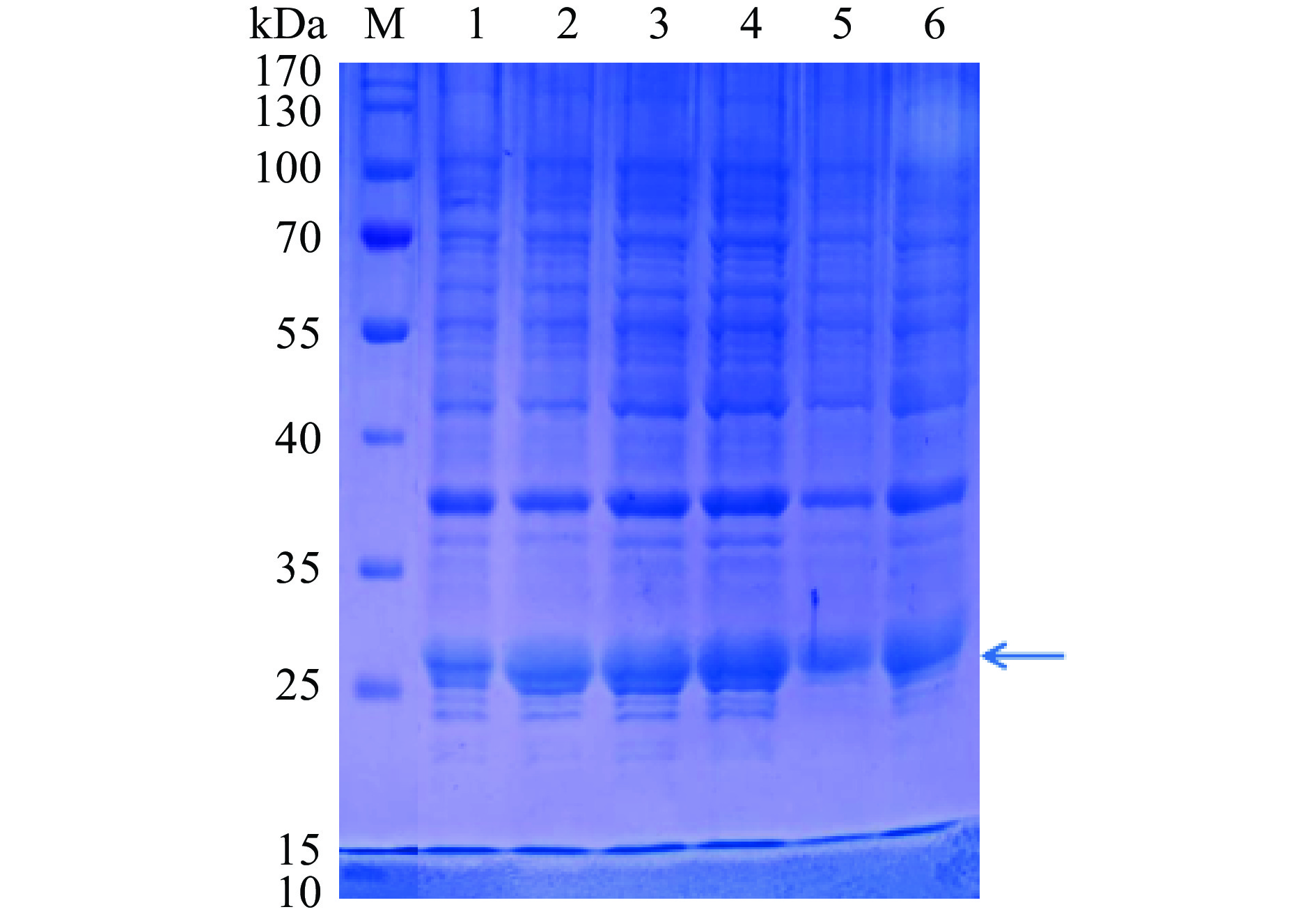
![]() 图 3 不同A1重组菌体诱导表达SDS-PAGE考马斯亮蓝染色结果注:M:Marker;1:未诱导;2~6:诱导后不同单克隆菌株;图4同。Figure 3. Results of SDS-PAGE by commassie blue staining for different A1 recombinant stains of induced expression
图 3 不同A1重组菌体诱导表达SDS-PAGE考马斯亮蓝染色结果注:M:Marker;1:未诱导;2~6:诱导后不同单克隆菌株;图4同。Figure 3. Results of SDS-PAGE by commassie blue staining for different A1 recombinant stains of induced expression结果表明,A1和A2不同单克隆菌株均在25 kDa条带附近具有比较明显的目的蛋白条带。从表1可知,A1/A2蛋白中带负电的氨基酸残基较多,分子间和分子内的静电斥力较大,因此电泳图中显示的实际蛋白分子量略微偏大[26]。此外,从图3和图4中均可以发现,未经诱导的A1和A2重组表达载体在分子量25 kDa处也有不同程度的目的条带出现,因此显示A1和A2单克隆菌株未经诱导即可能发生了轻微泄露表达,但是经过诱导单克隆菌株表达相对更加明显。随后挑选表达明显单克隆菌株用于后续表达放大。
2.4 不同温度以及不同IPTG浓度诱导表达结果
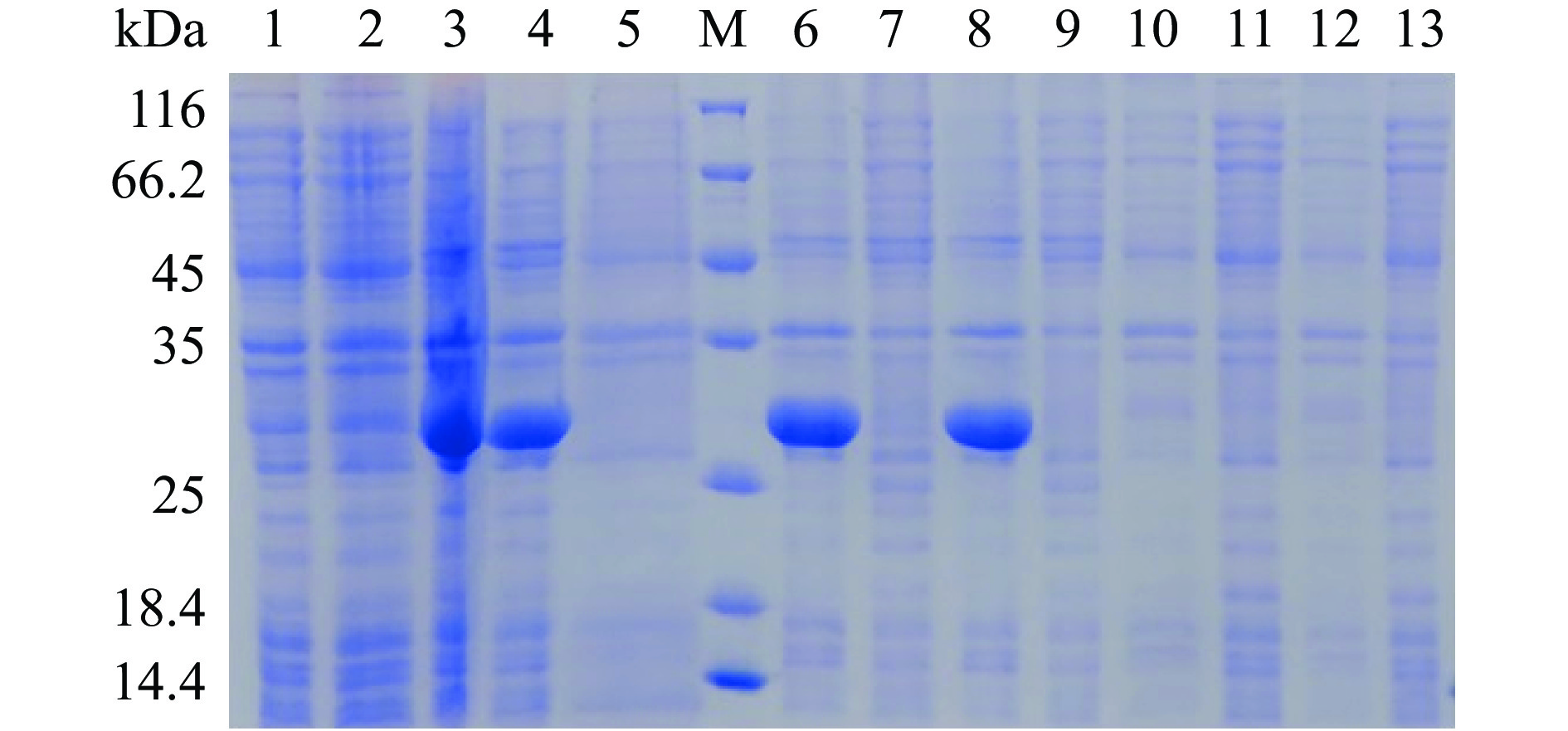
为了研究阳性克隆菌株在不同诱导剂浓度和温度条件下重组表达载体目的蛋白表达情况,分别将A1和A2重组表达载体在37 ℃和16 ℃条件下添加不同浓度的IPTG(0.2和1 mmol/L)进行诱导表达。实验结果见图5和图6。结果表明,A1和A2蛋白均以包涵体的形式表达,存在于细胞破碎后的沉淀中,而上清液中基本不含目的表达蛋白。这与相关研究结果类似[24],原因可能与大肠杆菌表达系统的特点有关。当重组蛋白在大肠杆菌细胞内大量表达时,可能受到环境胁迫以及缺乏某些蛋白质折叠的辅助因子等因素,从而造成不溶性蛋白的产生[36]。目前有研究报道通过低温培养能够提高目标蛋白的表达可溶性[37],但是通过对蛋白表达条件进行优化发现,A1和A2重组蛋白在15 ℃条件下仅少量表达,同时鉴于IPTG具有一定的毒性[30],因此选择37 ℃,0.2 mmol/L IPTG为后续诱导表达条件。
![]() 图 5 A1重组菌株诱导表达SDS-PAGE考马斯亮蓝染色结果注:M:Protein Marker;1:15 ℃ 0.2 mmol/L IPTG诱导后全菌;2:15 ℃ 1.0 mmol/L IPTG诱导后全菌;3:37 ℃ 0.2 mmol/L IPTG诱导后全菌;4:37 ℃ 1.0 mmol/L IPTG诱导后全菌;5:未诱导样品;6:37 ℃ 1.0 mmol/L IPTG诱后沉淀样;7:37 ℃ 1.0 mmol/L IPTG诱后上清样;8:37 ℃ 0.2 mmol/L IPTG诱后沉淀样;9:37 ℃ 0.2 mmol/L IPTG诱后上清样;10:15 ℃ 1.0 mmol/L IPTG诱后沉淀样;11:15 ℃ 1.0 mmol/L IPTG诱后上清样;12:15 ℃ 0.2 mmol/L IPTG诱后沉淀样;13:15 ℃ 0.2 mmol/L IPTG诱后上清样;图6同。Figure 5. Results of SDS-PAGE by commassie blue staining for A1 recombinant stains of induced expression
图 5 A1重组菌株诱导表达SDS-PAGE考马斯亮蓝染色结果注:M:Protein Marker;1:15 ℃ 0.2 mmol/L IPTG诱导后全菌;2:15 ℃ 1.0 mmol/L IPTG诱导后全菌;3:37 ℃ 0.2 mmol/L IPTG诱导后全菌;4:37 ℃ 1.0 mmol/L IPTG诱导后全菌;5:未诱导样品;6:37 ℃ 1.0 mmol/L IPTG诱后沉淀样;7:37 ℃ 1.0 mmol/L IPTG诱后上清样;8:37 ℃ 0.2 mmol/L IPTG诱后沉淀样;9:37 ℃ 0.2 mmol/L IPTG诱后上清样;10:15 ℃ 1.0 mmol/L IPTG诱后沉淀样;11:15 ℃ 1.0 mmol/L IPTG诱后上清样;12:15 ℃ 0.2 mmol/L IPTG诱后沉淀样;13:15 ℃ 0.2 mmol/L IPTG诱后上清样;图6同。Figure 5. Results of SDS-PAGE by commassie blue staining for A1 recombinant stains of induced expression2.5 包涵体蛋白纯化和复性
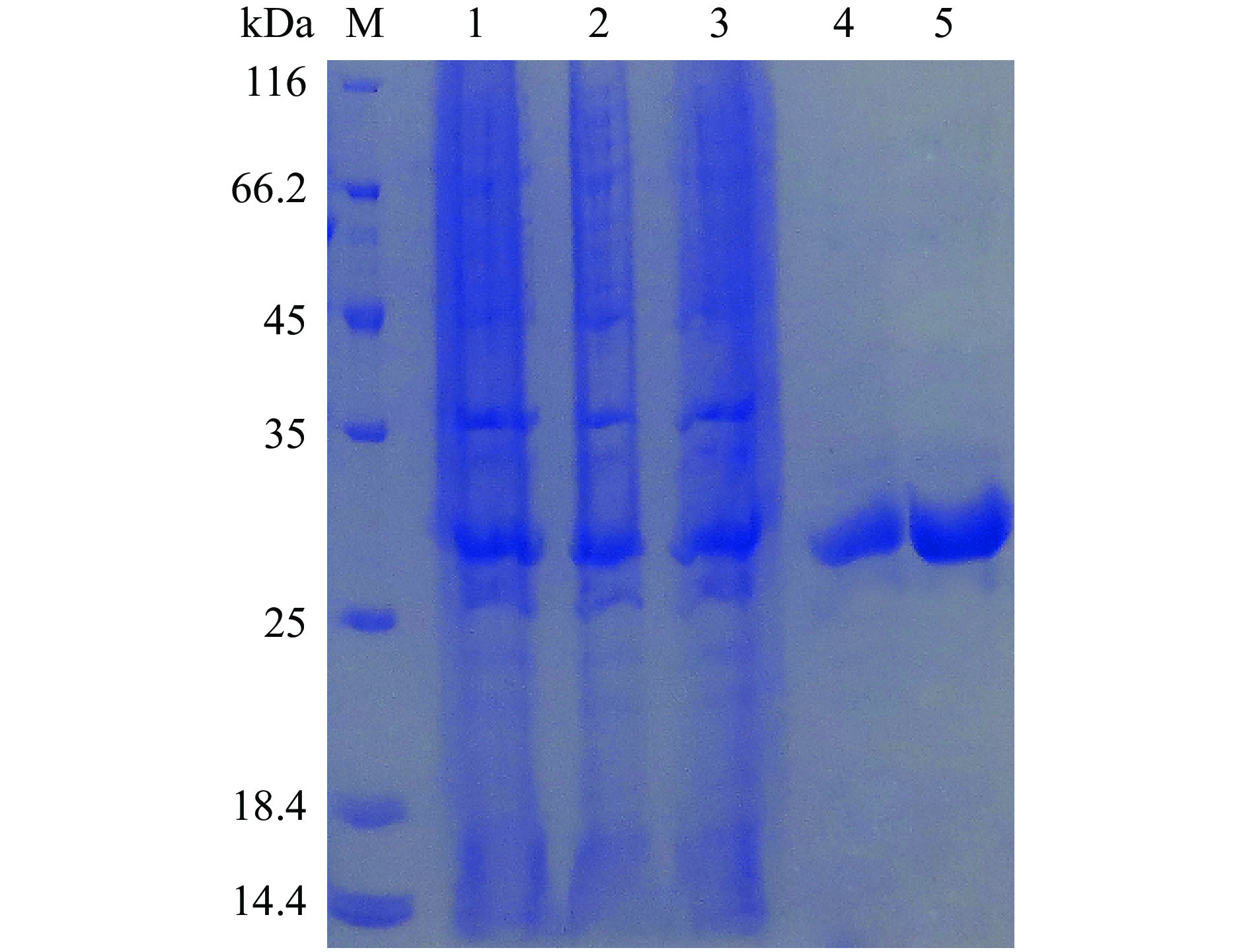
由于A1和A2蛋白均以包涵体的形式表达,因此将1.2.5.2获得的沉淀进行梯度洗脱后用8 mol/L尿素溶解,沉淀复溶上清过膜后用Ni柱进行亲和富集纯化,分别收集上样流出液、清洗样和洗脱样进行SDS-PAGE电泳。图7和图8分别为A1和A2重组表达菌株诱导后得到的沉淀样、复溶以及纯化后样品SDS-PAGE电泳图。实验结果表明A1和A2包涵体蛋白经过清洗、复溶和纯化后在25 kDa附近出现目的蛋白条带以外基本无其他杂蛋白,因此达到了预期纯化目标。
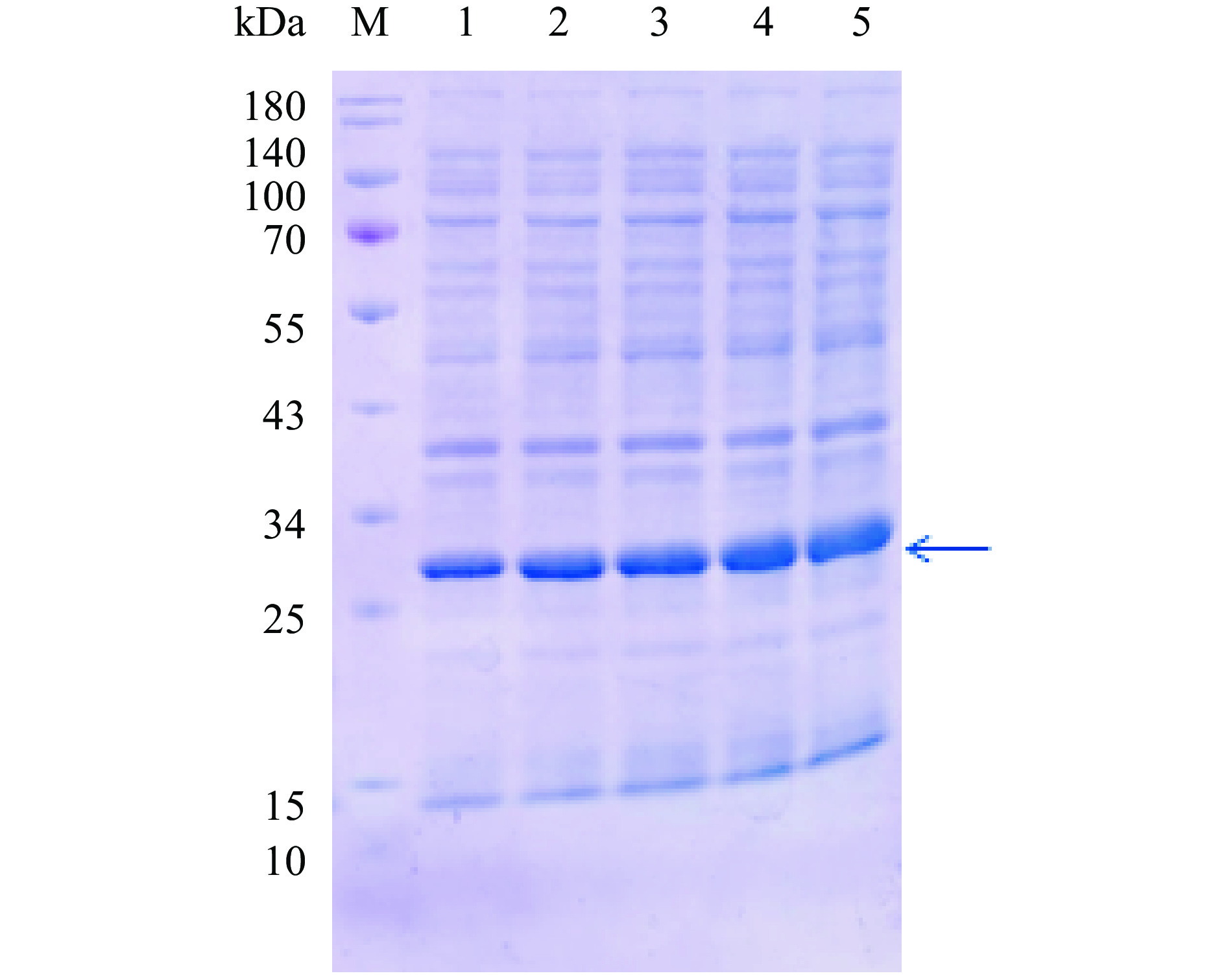
![]() 图 7 A1重组蛋白包涵体纯化SDS-PAGE考马斯亮蓝染色结果注:M:Marker;1:破碎后沉淀;2:破碎溶解后上清;3:过柱流出液;4:清洗样;5:洗脱样;图8同。Figure 7. Purification results of SDS-PAGE by commassie blue staining for inclusion bodies of A1 recombinant protein
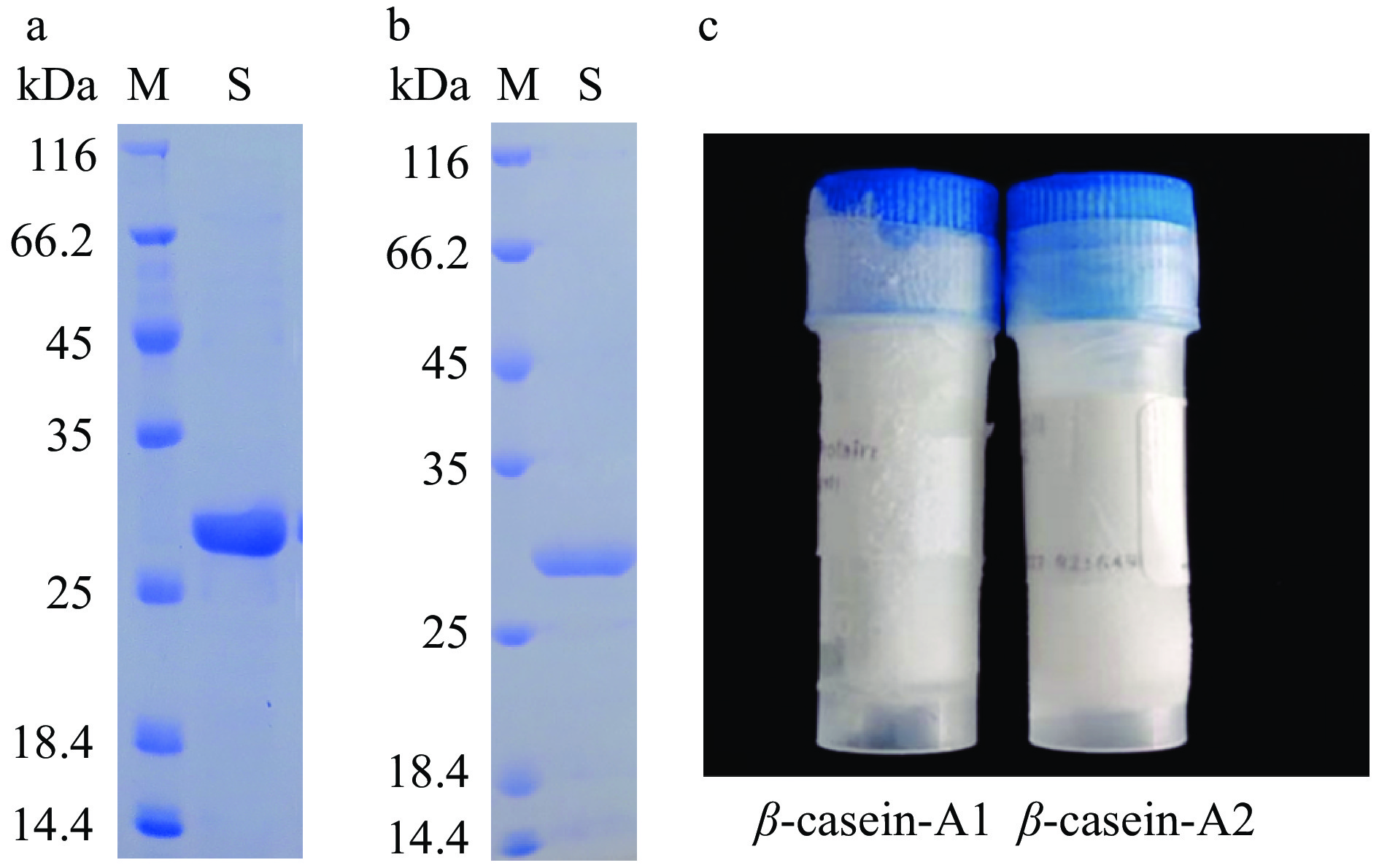
图 7 A1重组蛋白包涵体纯化SDS-PAGE考马斯亮蓝染色结果注:M:Marker;1:破碎后沉淀;2:破碎溶解后上清;3:过柱流出液;4:清洗样;5:洗脱样;图8同。Figure 7. Purification results of SDS-PAGE by commassie blue staining for inclusion bodies of A1 recombinant protein包涵体通过纯化后利用透析袋进行复性,得到复性后的重组的A1和A2蛋白样品。SDS-PAGE检测后呈单一条带(图9),且纯度超过90%。经BCA蛋白定量检测试剂盒测定,A1和A2重组蛋白浓度分别为1.5和2.0 mg/mL。
2.6 质谱鉴定
将重组表达得到的目的蛋白条带切胶后用胰蛋白酶酶解后,离心和过滤后用于质谱检测。以A1和A2蛋白理论序列为模板,利用质谱检测得到的多肽片段与理论氨基酸序列进行比较,图10分别为A1和A2重组表达蛋白质谱检测中匹配到的短肽,多肽覆盖率分别为54%和45%。同时利用LC-MS/MS对合成的重组A1和A2蛋白进行定性,实验结果表明在重组表达的A1和A2蛋白中分别未检出A2和A1蛋白特征肽段,且A1和A2蛋白占β-酪蛋白百分比均为100%。因此可以基本确定重组蛋白表达满足要求。
3. 结论
A1和A2蛋白作为β-酪蛋白两种常见的变异体类型,由于两者在分子结构上的细微差异使其在用常规方法制备和纯化上存在困难。通过Prot Param分析表明A1/A2蛋白属于不稳定亲水性蛋白,本研究利用分子生物学方法分别构建了pET28a(+)-CSN2-A1和pET28a (+)-CSN2-A2两个原核表达载体,并将其分别转化到大肠杆菌BL21(DE3)中,在37 ℃,0.2 mmol/L IPTG诱导条件下培养4 h可以实现β-酪蛋白变异体蛋白的过表达,最终获得的A1和A2重组蛋白含量分别为1.5和2.0 mg/mL。这为人工合成特定变异体的β-酪蛋白提供了新的借鉴。然而由于大肠杆菌表达系统的局限性,实验结果表明重组A1和A2蛋白均以包涵体形式表达,需要进行复性等操作后才能进一步应用。如何进一步优化表达系统,实现重组蛋白可溶性表达是后续需要进一步的研究方向。
-
图 3 不同A1重组菌体诱导表达SDS-PAGE考马斯亮蓝染色结果
注:M:Marker;1:未诱导;2~6:诱导后不同单克隆菌株;图4同。
Figure 3. Results of SDS-PAGE by commassie blue staining for different A1 recombinant stains of induced expression
图 5 A1重组菌株诱导表达SDS-PAGE考马斯亮蓝染色结果
注:M:Protein Marker;1:15 ℃ 0.2 mmol/L IPTG诱导后全菌;2:15 ℃ 1.0 mmol/L IPTG诱导后全菌;3:37 ℃ 0.2 mmol/L IPTG诱导后全菌;4:37 ℃ 1.0 mmol/L IPTG诱导后全菌;5:未诱导样品;6:37 ℃ 1.0 mmol/L IPTG诱后沉淀样;7:37 ℃ 1.0 mmol/L IPTG诱后上清样;8:37 ℃ 0.2 mmol/L IPTG诱后沉淀样;9:37 ℃ 0.2 mmol/L IPTG诱后上清样;10:15 ℃ 1.0 mmol/L IPTG诱后沉淀样;11:15 ℃ 1.0 mmol/L IPTG诱后上清样;12:15 ℃ 0.2 mmol/L IPTG诱后沉淀样;13:15 ℃ 0.2 mmol/L IPTG诱后上清样;图6同。
Figure 5. Results of SDS-PAGE by commassie blue staining for A1 recombinant stains of induced expression
图 7 A1重组蛋白包涵体纯化SDS-PAGE考马斯亮蓝染色结果
注:M:Marker;1:破碎后沉淀;2:破碎溶解后上清;3:过柱流出液;4:清洗样;5:洗脱样;图8同。
Figure 7. Purification results of SDS-PAGE by commassie blue staining for inclusion bodies of A1 recombinant protein
表 1 设计引物序列
Table 1 Design primer sequence
引物 序列及方向(5’-3’) 酶切位点 A1_F CCATATGACGTTCCGGGTGAAATTGTTG Nde I A1_R CCTCGAGTCTGGCTTTCGGTAAAGGGC Xho I A2_F CCATATGGATTCTGGCGTGTCTGGTTG Nde I A2_R CCTCGAGGGGATGTTTTGTGGGAGGCT Xho I 表 2 A1/A2蛋白理化性质
Table 2 Physicochemical properties of A1/A2 proteins
蛋白质名称 氨基酸个数 分子量(kDa) 理论等电点 带正电残基数(Asp+Glu) 带负电残基数(Arg+Lys) 不稳定系数 平均亲水系数 A1蛋白 224 25.14 5.37 16 23 95.86 −0.161 A2蛋白 224 25.10 5.26 16 23 94.12 −0.154 -
[1] 李建斌, 刘文娇, 王秀革, 等. 奶牛β-酪蛋白基因分型及A2型牛群培育技术研究进展[J]. 中国奶牛,2017(6):31−33. [LI Jiangbin, LIU wenjiao, WANG Xiuge, et al. Research progress on β-casein genotyping of dairy cattle and breeding technology of A2 herds[J]. China Dairy Cattle,2017(6):31−33. LI Jiangbin, LIU wenjiao, WANG Xiuge, et al. Research progress on β-casein genotyping of dairy cattle and breeding technology of A2 herds[J]. China Dairy Cattle, 2017(6): 31-33.
[2] 冯慿, 丁晓静, 高铁, 等. 毛细管区带电泳测定液态奶及奶粉中的A2β-酪蛋白及总β-酪蛋白[J]. 色谱,2020,38(6):722−729. [FENG Ping, DING Xiaojing, GAO Tie, DU Ruyun, et al. Quantification of A2 variant and total β-casein content in cow milk based liquid and powder products by capillary zone electrophoresis[J]. Chinese Journal of Chromatography,2020,38(6):722−729. FENG Ping, DING Xiaojing, GAO Tie, DU Ruyun, et al. Quantification of A2 variant and total β-casein content in cow milk based liquid and powder products by capillary zone electrophoresis[J]. Chinese Journal of Chromatography, 2020, 38(6): 722-729.
[3] 王丹, 王青云, 王慧敏, 等. 牛乳β-酪蛋白遗传多态性及A2型乳制品研究进展[J]. 中国奶牛,2021(3):40−43. [WANG Dan, WANG Qingyun, WANG Huimin, et al. Research progress on genetic polymorphism of β-casein in bovine milk and type A2 dairy products[J]. China Dairy Cattle,2021(3):40−43. WANG Dan, WANG Qingyun, WANG Huimin, et al. Research progress on genetic polymorphism of β-casein in bovine milk and type A2 dairy products[J]. China Dairy Cattle, 2021(3): 40-43.
[4] CAROLI A M, SAVINO S, BULGARI O, et al. Detecting β-casein variation in bovine milk[J]. Molecules,2016,21(2):141−147. doi: 10.3390/molecules21020141
[5] 陈龙, 付王艳, 方琼燕, 等. 牛乳中β-酪蛋白基因分型及β-酪啡肽-7的研究进展[J]. 中国乳品工业,2019,47(08):29−34. [CHEN Long, FU Wangyan, FANG Qiongyan, et al. Recent advances of β-casein genotyping in bovine milk and potential impact of β-casomorphin-7 on human health[J]. China Dairy Industry,2019,47(08):29−34. CHEN Long, FU Wangyan, FANG Qiongyan, et al. Recent advances of β-casein genotyping in bovine milk and potential impact of β-casomorphin-7 on human health[J]. China Dairy Industry, 2019, 47(08): 29-34.
[6] 罗卉卉, 金素钰, 黄林, 等. 牦牛β-酪蛋白A1、A2型遗传变异体的基因和蛋白质水平分析[J]. 黑龙江畜牧兽医,2020(06):133−135,140,158. [LUO Benben, JIN Suyu, HUANG Lin, et al. Analysis of yak β-casein A1 and A2 genetic variants on the level of gene and protein[J]. Heilongjiang Animal Science and Veterinary Medicine,2020(06):133−135,140,158. LUO Benben, JIN Suyu, HUANG Lin, et al. Analysis of yak β-casein A1 and A2 genetic variants on the level of gene and protein[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020,(06): 133-135, 140, 158.
[7] SUN Jianqin, XU Leiming, XIA Lu, et al. Effects of milk containing only A2 beta casein versus milk containing both A1 and A2 beta casein proteins on gastrointestinal physiology, symptoms of discomfort, and cognitive behavior of people with self-reported intolerance to traditional cows' milk[J]. Nutrition Journal,2016,15(1):35−50.
[8] DANILOSKI D, CUNHA N, MCCARTHY N A, et al. Health-related outcomes of genetic polymorphism of bovine β-casein variants: A systematic review of randomised controlled trials[J]. Trends in Food Science & Technology,2021,111(6):233−248.
[9] 刘泽阳, 李明, 吴佩泽, 等. 液相色谱-高分辨串联质谱法检测牛奶中A1和A2 β-酪蛋白[J]. 吉林大学学报(理学版),2021,59(3):696−702. [LIU Zeyang, LI Ming, WU Peize, et al. Deterination of A1 and A2 β-casein in milk by liquid chromatography-high resolution tandem mass spectrometry[J]. Journal of Jilin University (Science Edition),2021,59(3):696−702. LIU Zeyang, LI Ming, WU Peize, et al. Deterination of A1 and A2 β-casein in milk by liquid chromatography-high resolution tandem mass spectrometry[J]. Journal of Jilin University(Science Edition), 2021, 59(3): 696-702.
[10] 常硕. 牛奶中A1和A2 β-酪蛋白的检测与分析[J]. 中国奶牛,2018(3):48−50. [CHANG Shuo. Detection and analysis of A1 β-casein and A2 β-casein in bovine milk[J]. China Dairy Cattle,2018(3):48−50. CHANG Shuo. Detection and analysis of A1 β-casein and A2 β-casein in bovine milk[J]. China Dairy Cattle, 2018(3): 48-50.
[11] MAKINO T, SKRETAS G, GEORGIOU G. Strain engineering for improved expression of recombinant proteins in bacteria[J]. Microbial Cell Factories,2011,10(1):32−41. doi: 10.1186/1475-2859-10-32
[12] HEMAMALINI N, EZHILMATHi S, MERCY A A. Recombinant protein expression optimization in Escherichia coli: A review[J]. Indian Journal of Animal Research,2020,54(6):653−660.
[13] GOYAL V, KOHLI I, AMBASTHA V, et al. Synthetic biology tools: Engineering microbes for biotechnological applications[M]. New and Future Developments in Microbial Biotechnology and Bioengineering, 2022: 369−98.
[14] 周正富, 庞雨, 张维, 等. 乳蛋白重组表达与人造奶生物合成: 全球专利分析与技术发展趋势[J]. 合成生物学,2021,2(5):764−777. [ZHOU Zhengfu, PANG Yu, ZHANG Wei, et al. Recombinant expression of milk proteins and biosynthesis of animal-free milk: analysis on related patents and trend for technology development[J]. Synthetic Biology Journal,2021,2(5):764−777. doi: 10.12211/2096-8280.2021-057 ZHOU Zhengfu, PANG Yu, ZHANG Wei, et al. Recombinant expression of milk proteins and biosynthesis of animal-free milk: analysis on related patents and trend for technology development[J]. Synthetic Biology Journal, 2021, 2(5): 764-777. doi: 10.12211/2096-8280.2021-057
[15] 张艳敏. 对虾溶菌酶重组蛋白在大肠杆菌表达及包涵体复性研究[D]. 大连: 大连工业大学, 2014. ZHANG Yanmin. Recombinant expression of shrimp lysozyme in Escherichia coli and refolding of shrimp lysozyme inclusion bodies[D]. Dalian: Dalian Polytechnic University, 2014.
[16] BASIONY M, OUYANG L, WANG D, et al. Optimization of microbial cell factories for astaxanthin production: Biosynthesis and regulations, engineering strategies and fermentation optimization strategies[J]. Synthetic and Systems Biotechnology,2022,7(2):689−704. doi: 10.1016/j.synbio.2022.01.002
[17] 朱明慧, 李晓静, 王浩民, 等. 原核和真核双表达载体的构建及功能分析[J]. 中国细胞生物学学报,2022,44(3):437−442. [ZHU Minghui, LI Xiaojing, WANG Haomin, et al. Construction and functional analysis of prokaryotic and eukaryotic dual expression vectors[J]. Chinese Journal of Cell Biology,2022,44(3):437−442. ZHU Minghui, LI Xiaojing, WANG Haomin, et al. Construction and functional analysis of prokaryotic and eukaryotic dual expression vectors[J]. Chinese Journal of Cell Biology, 2022, 44(3): 437–442.
[18] LIU Y, DONG X, WANG B, et al. Food synthetic biology-driven protein supply transition: From animal-derived production to microbial fermentation[J]. Chinese Journal of Chemical Engineering,2021,30:29−36. doi: 10.1016/j.cjche.2020.11.014
[19] 陈爱亮. 一种酪蛋白多肽、多肽抗原、抗体、试纸条及其应. CN114716531A[P]. 2022-07-08. CHEN Ailiang. Casein polypeptide, polypeptide antigen, antibody, test strip and its application. CN114716531A[P]. 2022-07-08.
[20] BAUMAN D E, MATHER I H, WALL R J, et al. Major advances associated with the biosynthesis of milk[J]. Journal of Dairy Science,2006,89(4):1235−1243. doi: 10.3168/jds.S0022-0302(06)72192-0
[21] NIELSEN J, TILLEGREEN C B, PETRANOVIC D. Innovation trends in industrial biotechnology[J]. Trends Biotechnol,2022,40(10):1160−1172. doi: 10.1016/j.tibtech.2022.03.007
[22] HETTINGA K, BIJL E. Can recombinant milk proteins replace those produced by animals?[J]. Curr Opin Biotechnol,2022,75:102690. doi: 10.1016/j.copbio.2022.102690
[23] KEPPLER J K, HEYSE A, SCHEIDLER E, et al. Towards recombinantly produced milk proteins: Physicochemical and emulsifying properties of engineered whey protein beta-lactoglobulin variants[J]. Food Hydrocolloids,2021,110:106132.1−106132.14.
[24] HANSSON L, BERGSTRÖM S, HERNELL O, et al. Expression of human milk beta-casein in Escherichia coli: Comparison of recombinant protein with native isoforms[J]. Protein Expression and Purification,1993,4(5):373−381. doi: 10.1006/prep.1993.1049
[25] GEISTLINGER T, JHALA R, KRUEGER K P, et al. Food products comprising milk proteins and non-animal proteins, and methods of producing the same: US20190216106[P]. 2019-07-18.
[26] 庞雨. 牛乳蛋白在大肠杆菌中的异源表达和组合合成[D]. 北京: 中国农业科学院, 2021. PANG Yu. Heterologous expression and combinatorial synthesis of bovine milk proteins in Escherichia coli[J]. Beijing: Chinese Academy of Agricultural Sciences Thesis, 2021.
[27] 张齐, 崔金明, 蒙海林, 等. 7种牛奶蛋白基因在大肠杆菌中的异源表达[J]. 集成技术,2016,5(6):79−84. [ZHANG Qi, CUI Jinming, MENG Hailin, et al. Synthesis of seven milk proteins in Escherichia coli[J]. Journal of Integration Technology,2016,5(6):79−84. ZHANG Qi, CUI Jinming, MENG Hailin, et al. Synthesis of seven milk proteins in Escherichia coli[J]. Journal of Integration Technology, 2016, 5(6): 79-84.
[28] 邢芳芳, 印遇龙, 黄瑞林, 等. 重组牛乳铁蛋白素在大肠杆菌中的表达[J]. 食品科学,2008,29(04):221−224. [XING Fangfang, YIN Yulong, HUANG Ruilin, et al. Expression of recombinant lactoferricin B in E. coli[J]. Food Science,2008,29(04):221−224. XING Fangfang, YIN Yulong, HUANG Ruilin, et al. Expression of recombinant lactoferricin B in E. coli[J]. Food Science, 2008, 29(04): 221-224.
[29] LE N T P, PHAN T T P, PHAN H T T, et al. Influence of N-terminal His-tags on the production of recombinant proteins in the cytoplasm of Bacillus subtilis[J]. Biotechnology Reports,2022,35:e00754−760. doi: 10.1016/j.btre.2022.e00754
[30] KHANI M H, BAGHERI M. Skimmed milk as an alternative for IPTG in induction of recombinant protein expression[J]. Protein expression and purification,2020,170:105593−105596. doi: 10.1016/j.pep.2020.105593
[31] 金亮. 牛乳铁蛋白在枯草芽孢杆菌中的高效表达及铁饱和度的理性改造[D]. 无锡: 江南大学, 2022. JIN Liang. High expression of bovine lactoferrin in Bacillus subtilis and rational design of its iron saturation[D]. Wuxi: Jiangnan University, 2022.
[32] 李秋凤, 陈静, 赵婧邑, 等. D-阿洛酮糖3-差向异构酶在大肠杆菌内的高效可溶性表达及发酵条件研究[J]. 食品工业科技,2022,43(22):136−143. [LI Qiufeng, CHEN Jing, ZHAO Jingyi, et al. Efficient soluble expression and fermentation conditions of D-allulose 3-epimerase in Escherichia coli[J]. Science and Technology of Food Industry,2022,43(22):136−143. LI Qiufeng, CHEN Jing, ZHAO Jingyi, et al. Efficient soluble expression and fermentation conditions of D-allulose 3-epimerase in Escherichia coli[J]. Science and Technology of Food Industry, 2022, 43(22): 136−143.
[33] 郭帅, 陈梦仟, 朱新术, 等. 大肠杆菌表达的重组琼胶酶包涵体的纯化与复性条件研究[J]. 基因组学与应用生物学,2018,37(3):1197−1202. [GUO Shuai, CHEN Mengqian, ZHU Xinshu, et al. Purification and renaturation of recombinant agarase from inclusion body expressed by Escherichia coli[J]. Genomics and Applied Biology,2018,37(3):1197−1202. GUO Shuai, CHEN Mengqian, ZHU Xinshu, et al. Purification and renaturation of recombinant agarase from inclusion body expressed by Escherichia coli[J]. Genomics and Applied Biology, 2018, 37(3): 1197-1202.
[34] 古淑青. 一种A1/A2β-酪蛋白的质谱检测方法: 中国, 108519484A[P]. 2018-09-11. GU Shuqing. A method for the detection of A1/A2 β-casein by mass spectrometry: China, 108519484A[P]. 2018-09-11.
[35] 孟鑫. 嗜盐四联球菌CICC10469butA生物信息学分析及其表达的研究[D]. 广州: 华南理工大学, 2016. MENG Xin. The bioinformatics analysis and the expression study of butA gene from Tetragenococcus halophilus CICC10469[D]. Guangzhou: South China University of Technology, 2016.
[36] SU Y, ZOU Z, FENG S, et al. The acidity of protein fusion partners predominantly determines the efficacy to improve the solubility of the target proteins expressed in Escherichia coli[J]. Journal of Biotechnology,2007,129(3):373−382. doi: 10.1016/j.jbiotec.2007.01.015
[37] 王振, 邓超, 程咏梅, 等. cspA冷休克启动子-重组人bFGF表达载体的构建及在大肠杆菌中可溶性表达研究[J]. 工业微生物,2015,45(4):12−18. [WANG Zhen, DENG Chao, CHENG Yongmei, et al. Construction of cspA cold-shock promoter-recombinant human bFGF expression vector and its soluble expression in E. coli[J]. Industrial Microbiology,2015,45(4):12−18. WANG Zhen, DENG Chao, CHENG Yongmei, et al. Construction of cspA cold-shock promoter-recombinant human bFGF expression vector and its soluble expression in E. coli[J]. Industrial Microbiology, 2015, 45(4): 12-18.
-
期刊类型引用(22)
1. 熊波,杨丽涓,尹涛,普娅丽. QuEChERS净化-气相色谱-串联质谱法测定玫瑰花中24种农药残留. 食品安全导刊. 2025(02): 56-60 .  百度学术
百度学术
2. 邓涵玉,鲁莎莎,陈非凡,毛涛,邓祥宜,李继伟. 白萝卜精酿啤酒酿造工艺优化及品质分析. 中国酿造. 2025(02): 231-238 .  百度学术
百度学术
3. 和丽媛. 蓝莓-玫瑰复合饮料的研制. 轻工科技. 2024(01): 1-3+32 .  百度学术
百度学术
4. 丁献华,周红琴,马雪玲. 芳香植物缓解大学生焦虑情绪的比较研究. 现代园艺. 2024(06): 13-15 .  百度学术
百度学术
5. 刘晓雨,李雪松,单艳琴,张博雅,李景明. PDMS膜渗透浓缩对天然玫瑰冻干露香气的影响. 食品科学. 2024(05): 158-165 .  百度学术
百度学术
6. 欧阳雪灵,江新凤,刘书玲,王国行,彭玉辅,彭勇,彭火辉,陈紫梅,杨雪珍. 基于顶空固相微萃取-气相色谱-质谱法和相对气味活性值分析不同发酵时间玫瑰花茶香气的差异. 食品安全质量检测学报. 2024(10): 243-250 .  百度学术
百度学术
7. 和丽媛,李安佳,玉叫勐,钱星蓉. 藜麦玫瑰面包研制. 粮食科技与经济. 2024(02): 109-112 .  百度学术
百度学术
8. 高飞,尹思雨,皮汨源,朱月星. 大马士革玫瑰纯露发酵液制备工艺及功效评价. 广东化工. 2024(16): 49-51+27 .  百度学术
百度学术
9. 李芬,夏瑞萍,王智慧,王玮,李梅. 不同花源窨制红茶研究进展. 蚕桑茶叶通讯. 2024(05): 17-19 .  百度学术
百度学术
10. 丁献华,段丽君,乔晓丽,万丽,肖敏. 芳香植物玫瑰缓解高职学生焦虑情绪的研究. 现代园艺. 2023(03): 175-177+180 .  百度学术
百度学术
11. 赵珊,杨飞洋,秦琳,李曦,黄世群,郑幸果,雷欣宇,仲伶俐. 代用茶茶汤中功能性成分组成及含量分析. 食品研究与开发. 2023(02): 162-168 .  百度学术
百度学术
12. 代丽凤,蒋洁琳,官兴丽,邹小林,杨智,符宗林,罗赛. 普洱茶玫瑰花葡萄籽复合饮料的研制及其抗氧化活性评价. 茶叶学报. 2023(02): 1-13 .  百度学术
百度学术
13. 和丽媛,杨志龙,樊丹敏. 黑松露玫瑰酥性饼干的研制. 现代食品. 2022(02): 81-84 .  百度学术
百度学术
14. 黄一承,史玉,马艳丽,丁云峰,马琳,李丹,李晓磊. 玫瑰、百合煎饼风味成分比较研究. 食品工业科技. 2022(05): 302-309 .  本站查看
本站查看
15. 姜苗,黄晓琴,伊冉,曹美琪,丁凯华,代智慧,刘红,焦春梅,扈兴强,王庆卫,石磊. 玫瑰花红茶抗氧化性研究. 山东林业科技. 2022(05): 39-47 .  百度学术
百度学术
16. 姜苗,黄晓琴,伊冉,曹美琪. 不同加工工艺对玫瑰花红茶品质的影响. 中国茶叶. 2022(12): 34-40 .  百度学术
百度学术
17. 杨丽,柯南,龚秋霞,刘雯雯,魏琴. 响应面法优化玫瑰风味酸奶工艺. 宜宾学院学报. 2022(12): 56-61+84 .  百度学术
百度学术
18. 郭香香,胥鑫萌,张恺欣,宋锦博,刘军海. 几种植物提取物在抗衰老化妆品中的应用. 中国洗涤用品工业. 2021(04): 94-97 .  百度学术
百度学术
19. 孙瑶,朱雅婧,李武,赵付安. 玫瑰花冠茶总黄酮提取的工艺优化. 农产品加工. 2021(14): 31-34 .  百度学术
百度学术
20. 丁强,董纪超,荚启安,吴泽宇,张文成. 响应面法优化固定超声辅助提取玫瑰花黄酮的工艺. 安徽化工. 2021(05): 37-40 .  百度学术
百度学术
21. 青舒婷,杨丰,张海仑,李宇龙,许军,岳进. 远红外辅助热泵干燥食用玫瑰花瓣及产品品质分析. 食品工业科技. 2021(22): 246-253 .  本站查看
本站查看
22. 熊海燕,林敏,鲁萌. 蟠桃玫瑰米露酒加工工艺研究. 食品安全导刊. 2021(31): 114-116 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:


 下载:
下载:



