Effect of Enzymolysis and in Vitro Simulated Gastrointestinal Digestion on the ACE Inhibitory Activity of Defatted Goat Milk Powder
-
摘要: 本研究旨在探究商业蛋白酶酶解与体外模拟胃肠消化对高消化率的脱脂羊奶粉释放ACE抑制肽的影响,以评价脱脂羊奶粉酶解必要性及所需酶解程度。采用中性蛋白酶、碱性蛋白酶、复合蛋白酶和风味蛋白酶对脱脂后的圭山羊奶粉进行酶解反应,并对脱脂羊奶粉及其酶解物进行体外模拟胃肠消化,测定酶解液及模拟胃肠消化液的多肽含量、ACE抑制活性以及分子量分布。研究发现,羊奶粉经过体外模拟胃肠消化后,消化液的多肽含量与ACE抑制率分别达到20.81 mg/mL和62.55%;而经过碱性蛋白酶和风味蛋白酶的适度酶解,其模拟胃肠消化液多肽含量与ACE抑制活性反而下降;经过复合蛋白酶的适度酶解,其模拟胃肠消化液的多肽含量与ACE抑制活性小幅度提高,分别达到22.67 mg/mL和69.29%;经过中性蛋白酶的适度酶解,其模拟胃肠消化液多肽含量与ACE抑制活性均显著提高,分别达到23.76 mg/mL和81.10%。分子量分布结果显示,经过体外模拟胃肠消化后,<1000 Da的小分子肽由酶解液中的70.77%提高到90%。综上,圭山羊奶粉经过体内胃肠消化就可以释放出较多的ACE抑制肽,而经过中性蛋白酶酶解至水解度8%后,ACE抑制活性还可以再提升28.83%,因此在一定程度上具有进一步酶解的必要性。Abstract: This study aimed to investigate the effect of commercial protease enzymolysis and in vitro simulated gastrointestinal digestion on the release of ACE inhibitory peptides from the defatted goat milk powder with high digestibility, and to evaluate the necessity and the extent of enzymatic hydrolysis. Neutrase, alcalase, protamex, and flavourzyme were used for the enzymolysis of the defatted Kuishan goat milk powder. The goat milk and its enzymatic hydrolysates were further digested via simulated gastrointestinal digestion in vitro. The peptide content, ACE inhibitory activity and molecular weight distribution of the enzymatic hydrolysates and the simulated gastrointestinal digests were determined. Results showed that after the simulated gastrointestinal digestion in vitro, the peptide content and ACE inhibitory activity of the goat milk powder digests were 20.81 mg/mL and 62.55%, respectively. However, after moderate enzymatic hydrolysis by alcalase and flavourzyme, the peptide content and ACE inhibitory activity of simulated gastrointestinal digests decreased. After moderate enzymolysis by protamex, the peptide content and ACE inhibitory activity of simulated gastrointestinal digests were increased slightly to 22.67 mg/mL and 69.29%, respectively. After moderate enzymolysis by neutrase, the peptide content and ACE inhibitory activity of simulated gastrointestinal digests were significantly increased to 23.76 mg/mL and 81.10%, respectively. The molecular weight (MW) distribution results showed that after in vitro simulated gastrointestinal digestion, the amount of the small molecular peptides with MW<1000 Da increased from 70.77% to 90%. Above results indicate that Kuishan goat milk powder can exert ACE inhibitory activity after gastrointestinal digestion, and the ACE inhibitory activity can be further increased by 28.83% after neutral protease hydrolysis to degree of hydrolysis of 8%. Therefore, it was necessary to further enzymatic hydrolysis to a certain extent.
-
生物活性肽是由2~50个氨基酸残基组成的功能化合物[1-2],主要通过酶解、微生物发酵、化学提取、体外模拟或体内消化等方式从蛋白中释放出来[3]。酶解法因其高效性和专一性,是最为常用的制备生物活性肽的方法[4]。通常,酶解制备生物活性肽时,直接测定酶解后酶解液的生物活性,并以此为标准来评价酶解产物。然而,这种酶解评价方法忽视了人体胃肠道消化酶的功能[5-6]。在胃肠道的极端pH环境以及胃蛋白酶和胰酶的作用下,生物活性肽原有的结构、功能和生物活性会发生改变[7]。因此,在酶解制备生物活性肽时,酶解物的生物活性评价应当后移至胃肠消化之后。应用这种酶解评价方法,大米蛋白仅需要在体外酶解至水解度为8%,经过胃肠消化后,就可以发挥较高的降血压活性[7]。一些高消化率的蛋白可能不需要体外酶解制备生物活性肽,直接经过胃肠消化就可以发挥其生物活性。例如,Liu等[5,8-9]研究发现,核桃蛋白不需要进行体外酶解,仅在胃肠道消化酶的作用下就能获得与体外酶解后接近的降血压与抗氧化活性。
羊奶被视为乳品中的精品,其干物质中蛋白质、脂肪和矿物质含量均高于人奶和牛奶,具有营养丰富、易于吸收等特点[10]。Shu等[11]研究发现,碱性蛋白酶水解羊奶后,酶解物具有较高的水解度和血管紧张素转换酶(Angiotensin-converting enzyme, ACE)抑制活性,认为羊奶是获取ACE抑制肽的良好来源。Chen等[12]采用复合酶酶解羊奶,在最佳条件下酶解液的ACE抑制活性的IC50值为72.14 μg/mL。然而,研究表明羊奶具有较高的体外胃消化率、肠消化率及胃肠总消化率[13]。体外酶解获取的高活性的ACE抑制肽经过胃肠消化后,原有的结构可能被破坏,从而导致其活性发生改变[2]。因此,本团队提出“体外酶解+体内消化”的酶解评价方法,根据这一方法,羊奶可能不需要酶解或者仅需部分酶解即可通过胃肠消化酶的作用发挥其降血压活性。
因此,本研究选用4种蛋白酶,包括中性蛋白酶、碱性蛋白酶、复合蛋白酶和风味蛋白酶,酶解羊奶制备羊奶酶解物,并对羊奶及酶解物进行体外模拟胃肠消化,比较消化前后的多肽含量、ACE抑制活性和分子量分布,以评价羊奶直接进入胃肠消化系统是否可以在人体消化酶的作用下发挥降血压活性,酶解是否会进一步提升该活性。
1. 材料与方法
1.1 材料与仪器
圭山羊奶粉(蛋白含量20%) 昆明百年龙腾乳业有限公司;中性蛋白酶、碱性蛋白酶、复合蛋白酶、风味蛋白酶 南京诚纳化工有限公司;胃蛋白酶、胰酶、N-[3-(2-呋喃基)丙烯酰 ]-L-苯丙氨酰-甘氨酸-甘氨酸(N-[3-(2-furylacryloyl)-Lphenyalanyl-glycyl-glycyl, FAPGG) Sigma-Aldrich公司;血管紧张素转换酶(Angiotensin-I-Converting Enzyme, ACE) 根据Liu等[9]的方法从猪肺中提取;细胞色素C、胰岛素、胸腺素 Aladdin公司;杆菌酶 乙氨酸-乙氨酸-酪氨酸-精氨酸和乙氨酸-乙氨酸-乙氨酸 索莱宝生物科技有限公司;其他试剂均为分析纯 由国药集团提供。
HH-2数显恒温水浴锅 常州越新仪器制造有限公司;82-2A磁力集热式小型搅拌器 上海司乐仪器有限公司;TGL-16高速台式冷冻离心机 上海沪粤明仪器公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;UDK149全自动凯氏定氮仪 上海纤检仪器有限公司;PHS-25型数显式pH计 上海精密科学仪器有限公司;1010-3B电热鼓风干燥箱 上海实验仪器厂有限公司;Christ RVC 2-18 CD plus离心浓缩仪 北京博劢行仪器有限公司;S433D氨基酸分析仪 德国卡塞姆有限公司;LCQ型液相色谱-质谱联用仪(配有电喷雾离子源(ESI)及Xcalibur1.2数据处理系统) 美国Finnigan公司;HP 1100型高效液相色谱系统(配有可变波长紫外检测器和Rev.A.06.03色谱工作站) 美国惠普公司。
1.2 实验方法
1.2.1 羊奶粉基本组成测定
水分含量测定参照国家标准GB/T 5009.3-2016;脂肪含量测定参照国家标准GB/T 5009.6-2016;灰分含量测定参照国家标准GB/T 5009.4-2016;总糖量测定参照Liu等[9]的方法;蛋白含量测定参照国家标准GB/T 5009.5-2016。
1.2.2 羊奶粉的氨基酸组成及含量测定
参照Ketnawa等[14]的方法,称取30 mg的羊奶粉与6 mol/L HCl(含0.1%苯酚,v/v)混合后,在110 ℃下水解24 h,冷却后过滤,定容至25 mL,取2 mL滤液在离心浓缩仪上浓缩挥发至无剩余HCl。重新加水稀释20倍后,取1 mL使用自动氨基酸分析仪上机检测。
1.2.3 羊奶蛋白的营养价值评价
主要包括必需氨基酸(E)与总氨基酸(T)之比,即E/T、蛋白质的功效比值(Protein efficiency ratio, PER)预测值和蛋白质的生物价(Biological value, BV)预测值,具体操作参照Liu等[15]的方法,计算公式如下:
E/T根据式(1)计算:
(1) PER根据式(2)和式(3)计算:
(2) (3) 式中,Leu、Pro和Tyr分别是亮氨酸、脯氨酸和酪氨酸的氨基酸评分。
BV根据式(4)计算:
(4) 式中,当ai样品≥ai参考值时,qi=ai参考值/ai样品;ai样品≤ai参考值时,qi=ai样品/ai参考值。ai代表每种必需氨基酸含量与必需氨基酸总量的比值,参考值见表1。
表 1 羊奶蛋白氨基酸评分Table 1. Amino acid rating of goat milk protein必需氨基酸 婴幼儿均值 2~5岁儿童 10~12岁儿童 成人 His 1.11 1.52 1.52 1.80 Ile 1.42 2.32 2.32 5.01 Leu 1.30 1.83 2.75 6.37 Lys 1.23 1.40 1.85 5.08 Met+Cys 0.73 1.23 1.40 1.81 Phe+Tyr 1.20 1.37 3.93 4.56 Thr 1.46 1.85 2.25 7.00 Val 1.23 1.94 2.71 5.21 Trp / / / / 1.2.4 脱脂羊奶粉酶解物的制备
参照Liu等[9]的方法,称取88.33 g圭山羊奶粉溶于500 mL蒸馏水制成16.7%(w/v)的羊奶蛋白溶液,搅拌至充分溶解,4000 r/min离心15 min,除去上层脂肪层后,取上清液作为脱脂羊奶(此时羊奶蛋白含量为3.3%),4 ℃备用。量取500 mL脱脂羊奶溶液倒入水浴加热器中,调整水浴温度至蛋白酶的最适温度(见表2),用1 mol/L NaOH调节pH至蛋白酶最适pH(表2),然后加入3000 U/g的蛋白酶开始酶解。在酶解过程中使用1 mol/L NaOH维持反应体系pH恒定,用磁力搅拌器不断搅拌使溶液保持均一。在不同酶解度处取样,沸水浴灭酶10 min,冷却后用于下一步操作。
表 2 蛋白酶的酶活、最适作用条件及酶切位点Table 2. Enzymatic activity, optimum reaction conditions and cleavage sites of the different proteases蛋白酶 蛋白酶活力(U/g) 最适作用条件 主要酶切位点 中性蛋白酶 155153.80 pH7.0; T 50 °C 酶切位点较为广泛 碱性蛋白酶 220157.69 pH9.0; T 50 °C 疏水性氨基酸残基,
如Ala和Leu复合蛋白酶 184000.00 pH6.5; T 50 °C 酶切位点较为广泛 风味蛋白酶 26553.85 pH6.5; T 50 °C 酶切位点较为广泛 注:T 温度。 1.2.5 水解度计算
采用pH-stat法[16],根据式(5)和式(6)计算出酶解反应过程中每个水解度对应的NaOH消耗量,在该耗碱量处取得的酶解液即为该水解度的酶解液。
(5) (6) 式中,DH为脱脂羊奶的水解度,%;B为消耗的碱量,mL;N为NaOH的摩尔浓度,mol/L;α为α-NH2在蛋白底物中的平均解离度;pH为水解溶液的pH;pK为α-NH2的解离度的负对数,通常取7.0;m为原料中净蛋白质量,g;htot为每克蛋白质底物具有的肽键毫摩尔数,羊奶蛋白htot=8.0[17]。
1.2.6 体外模拟胃肠消化
将配制好的脱脂羊奶溶液与不同水解度的酶解液进行体外胃肠模拟消化,具体操作参照Liu等[8]略有改动。胃消化:将酶解液在 37 ℃ 预热 30 min,用 2 mol/L 的 HCl 调 pH 至1.5,加入4%(E/S)的胃蛋白酶(32600.12 U/g),于恒温振荡器(37 ℃,200 r/min)中振荡孵育2 h,沸水浴灭酶,冷却,调pH至7.0后12000 r/min离心10 min获取胃消化液;肠消化:胃消化后,直接将消化液的pH调至7.5,加入4%(E/S)的胰酶(109000.00 U/g)后于37 ℃、200 r/min下振荡孵育4 h,沸水浴灭酶,冷却,调节pH至7.0后12000 r/min离心10 min,保存上清液备用。
1.2.7 多肽含量的测定
将酶解液与胃、肠消化液与10%(w/v)三氯乙酸(TCA)按体积比1:1混合,于室温下静置30 min,10000 r/min离心10 min后取上清液用福林酚法[16]测定多肽含量。以牛血清白蛋白为标准品绘制标准曲线(Y=0.0025X+0.0194, R2=0.9942)。
1.2.8 ACE抑制活性的测定
具体方法参照Li等[18]略有改动。配制0.08 mol/L的HEPES缓冲液(含0.3 mol/L NaCl,pH8.3),1 mmol/L的FAPGG工作液,在酶标板上依次加50 μL ACE,100 μL待测样品和60 μL FAPGG工作液。在340 nm下,测初始吸光度和37 ℃下反应30 min后的吸光度,以HEPES缓冲液替代样品做空白对照,并按式(7)计算ACE抑制率:
(7) 式中,a1、a2分别是空白孔的初始吸光度和反应30 min后的吸光度;b1、b2分别是样品孔的初始吸光度和反应30 min后的吸光度。
1.2.9 分子量分布的测定
采用高效液相色谱法[19]测定脱脂羊奶酶解物及其胃肠消化物的分子量分布。实验条件:仪器工作参数:色谱柱:TSKgel 2000 SWXL 300 mm×7.8 mm,5 μm 粒径;流动相:乙腈/水/三氟乙酸,45/55/0.1(v/v);检测波长:UV 220 nm;流速:0.5 mL/min;柱温:30 ℃。
标样配制:称取细胞色素C(MW12400)、胰岛素(MW5733)、胸腺素(MW3108)、杆菌酶(MW1450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW451)、乙氨酸-乙氨酸-乙氨酸(MW189)标准品用流动相溶解配制成0.2 mg/mL左右的标准分子量溶液。标准曲线为logy=41.80−4.299x+0.1593x2−0.001939x3 (R2=0.9874)。
样品制备:取1 mL样品溶液,0.45 μm微孔过滤膜过滤后供进样。样品溶液在上述色谱条件下分析,用GPC软件处理数据,得到样品中肽的相对分子质量分布和其分布范围。
1.3 数据处理
采用三次测定的平均值和标准误差的形式表示实验数据,采用OriginPro 2018及Excel软件对试验数据进行处理、作图,使用SPSS 19.0软件进行单因素方差分析,采用t检验分析组间数据差异性,显著性水平在P<0.05条件下进行分析。
2. 结果与分析
2.1 羊奶粉基本组成分析
羊奶粉的基本组成如表3所示,其中粗蛋白含量为20.0%,与企业产品营养成分质检报告基本一致(19.9%)。在该研究中直接将羊奶粉配制成溶液后进行脱脂操作,用作羊奶蛋白溶液,以保留羊奶粉中其他活性物质[20]。
表 3 羊奶粉基本成分Table 3. Elementary components of goat milk powder指标 水分 灰分 粗蛋白 脂肪 总糖 含量(%) 2.26±0.26 4.60±0.19 20.00±0.21 19.40±0.36 52.00±0.34 2.2 羊奶蛋白的氨基酸组成分析
羊奶蛋白的氨基酸组成及含量如表4所示,结果显示,在羊奶蛋白中,Glu含量最高(21.01%),其次是Leu(12.11%)、Lys(8.13%)和Asp(7.96%),Met+Cys是第一限制氨基酸,His是第二限制氨基酸,这一结果与Mohsin等[21]的研究相似。表5羊奶蛋白必需氨基酸及氨基酸分布显示,羊奶蛋白的必需氨基酸占总氨基酸的47.27%,必需氨基酸含量较高,氨基酸组成合理;疏水性氨基酸含量占总氨基酸的38.45%。有研究表明,胰凝乳蛋白酶能够特异性切割大型疏水性氨基酸残基旁边的肽键[22],因此,疏水性氨基酸含量较高的羊奶蛋白较容易在肠道被酶解,释放出具有ACE活性的多肽,是一种优质的动物蛋白。
表 4 羊奶蛋白的氨基酸组成及含量Table 4. Amino acid composition and content of goat milk protein氨基酸 含量(%) 氨基酸 含量(%) Asp 7.96±0.11 Ile 6.51±0.10 Thr 6.30±0.09 Leu 12.11±0.06 Ser 4.88±0.01 Tyr 4.29±0.01 Glu 21.01±0.25 Phe 4.36±0.02 Gly 2.11±0.01 His 2.89±0.01 Ala 3.70±0.02 Lys 8.13±0.09 Val 6.77±0.06 Arg 3.96±0.03 Met 3.08±0.02 Pro 1.93±0.01 表 5 羊奶蛋白必需氨基酸及氨基酸分布Table 5. Amino acid distribution and essential amino acids of goat milk protein氨基酸种类 含量(%) 必需氨基酸 Lys、Trp、Phe、Met、Thr、Ile、Leu、Val 47.27 疏水性氨基酸 Ala、Phe、Ile、Leu、Met、Pro、Val、Trp 38.45 亲水性氨基酸 Ser、Thr、Tyr、Cys、Gly 17.58 酸性氨基酸 Glu、Asp 28.98 碱性氨基酸 Lys、Arg、His 14.98 2.3 羊奶蛋白的营养价值分析
羊奶蛋白的营养价值分析结果如表6所示。PER是衡量蛋白质利用率的指标之一,优质蛋白的PER标准为2.0[15]。羊奶蛋白PER I预测值为4.75,PER II预测值为4.58,远高于其他蛋白[15, 23],说明羊奶蛋白的人体利用率高;羊奶蛋白BV预测值为93.63,说明其易于被机体消化吸收。因此羊奶蛋白是一种易于被机体消化利用的优质蛋白。
表 6 羊奶蛋白营养价值分析Table 6. Nutritional value of goat milk protein营养评价参数 评分 E/T(%) 47.27 PER I 4.75 PER II 4.58 BV 93.63 2.4 酶解和体外模拟胃肠消化对脱脂羊奶及其酶解物中多肽含量的影响
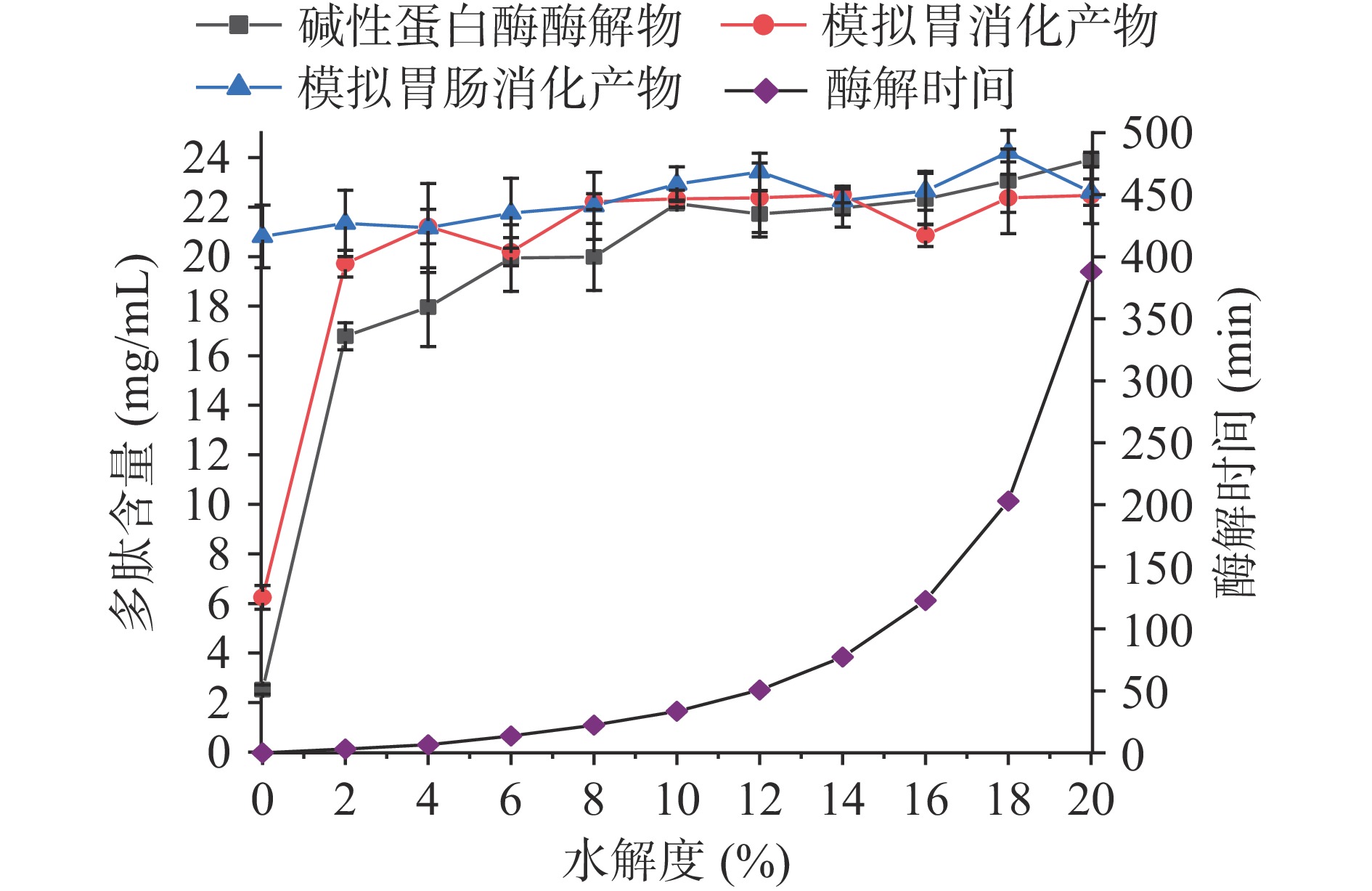
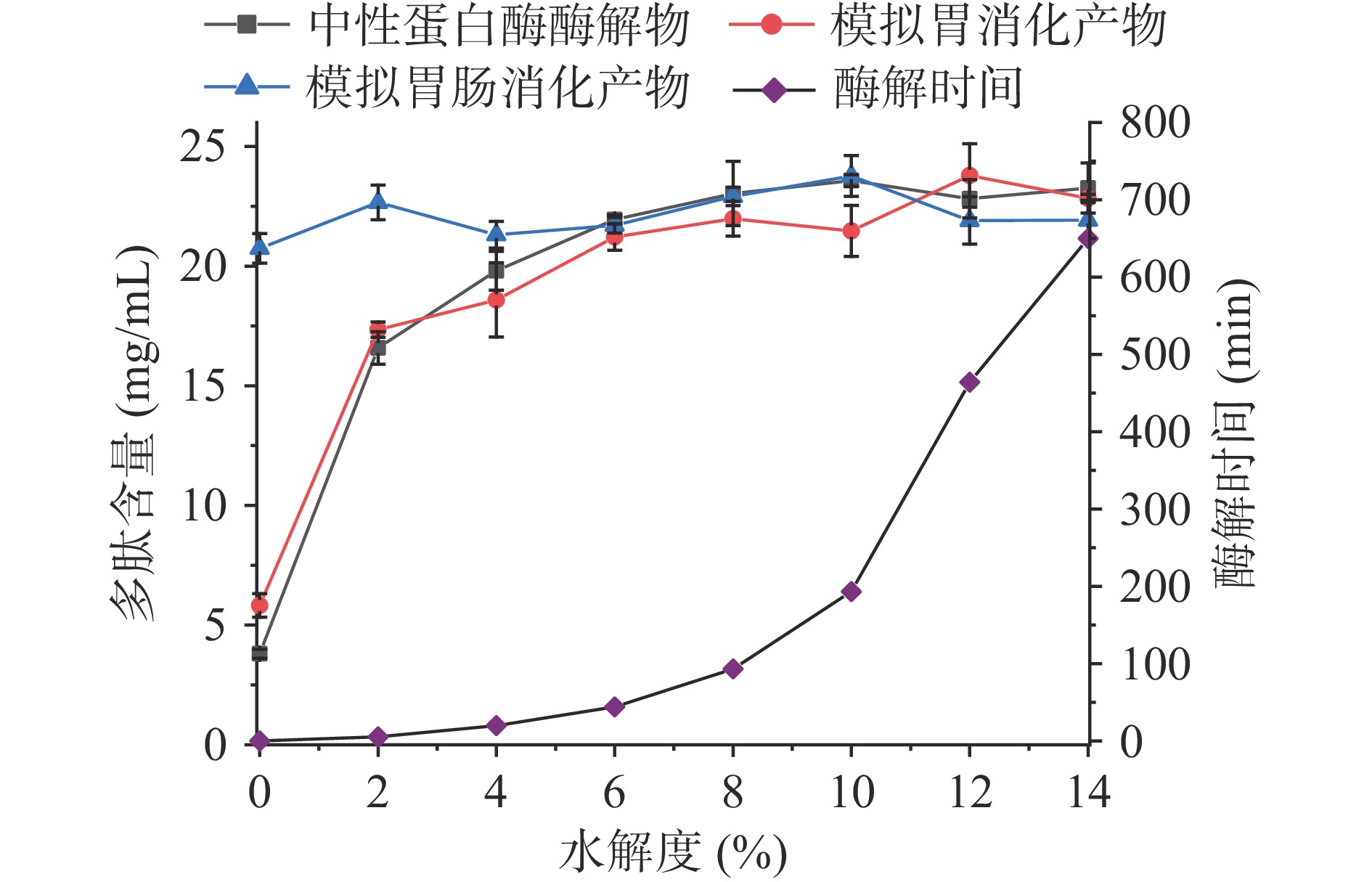
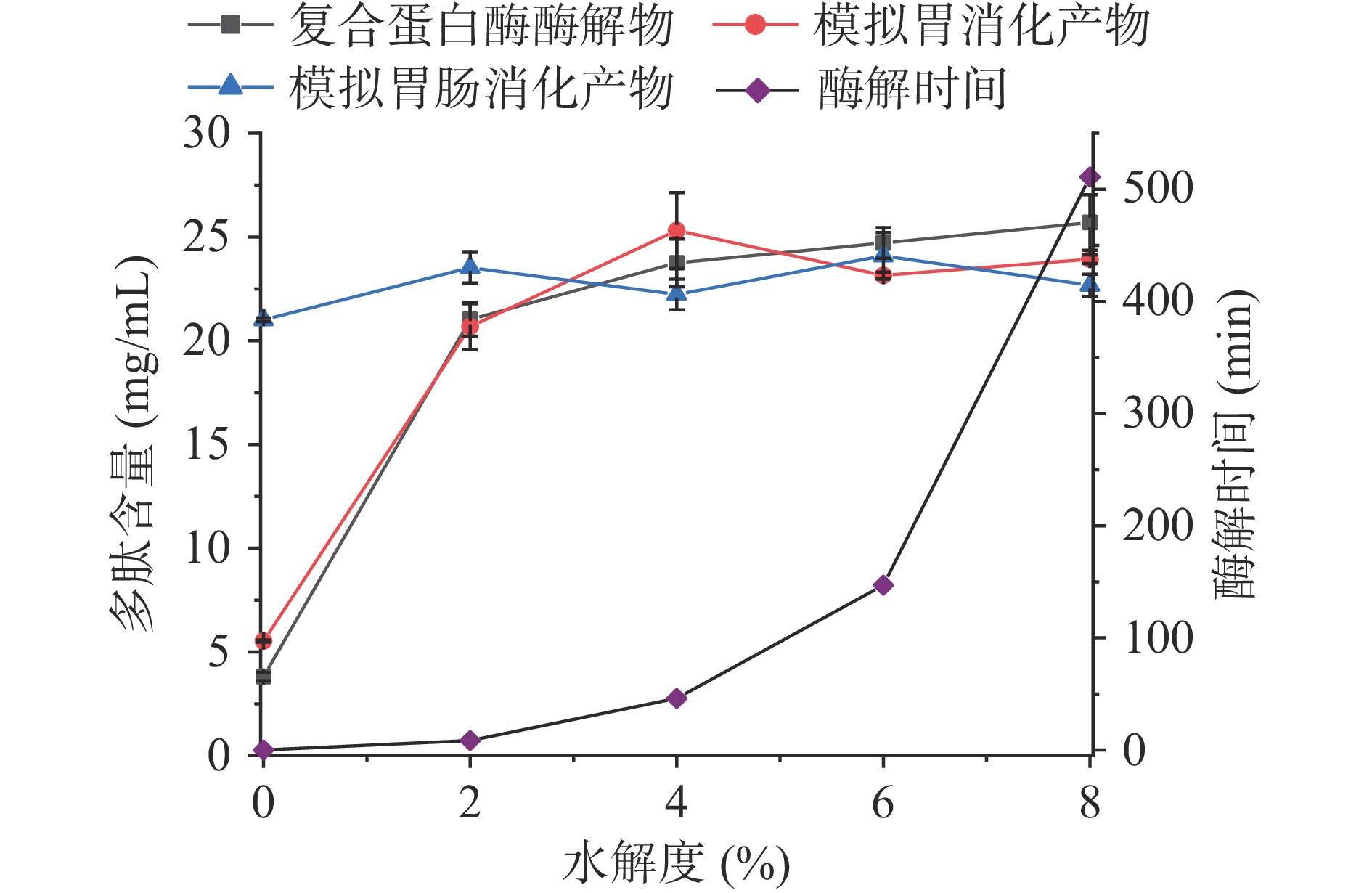
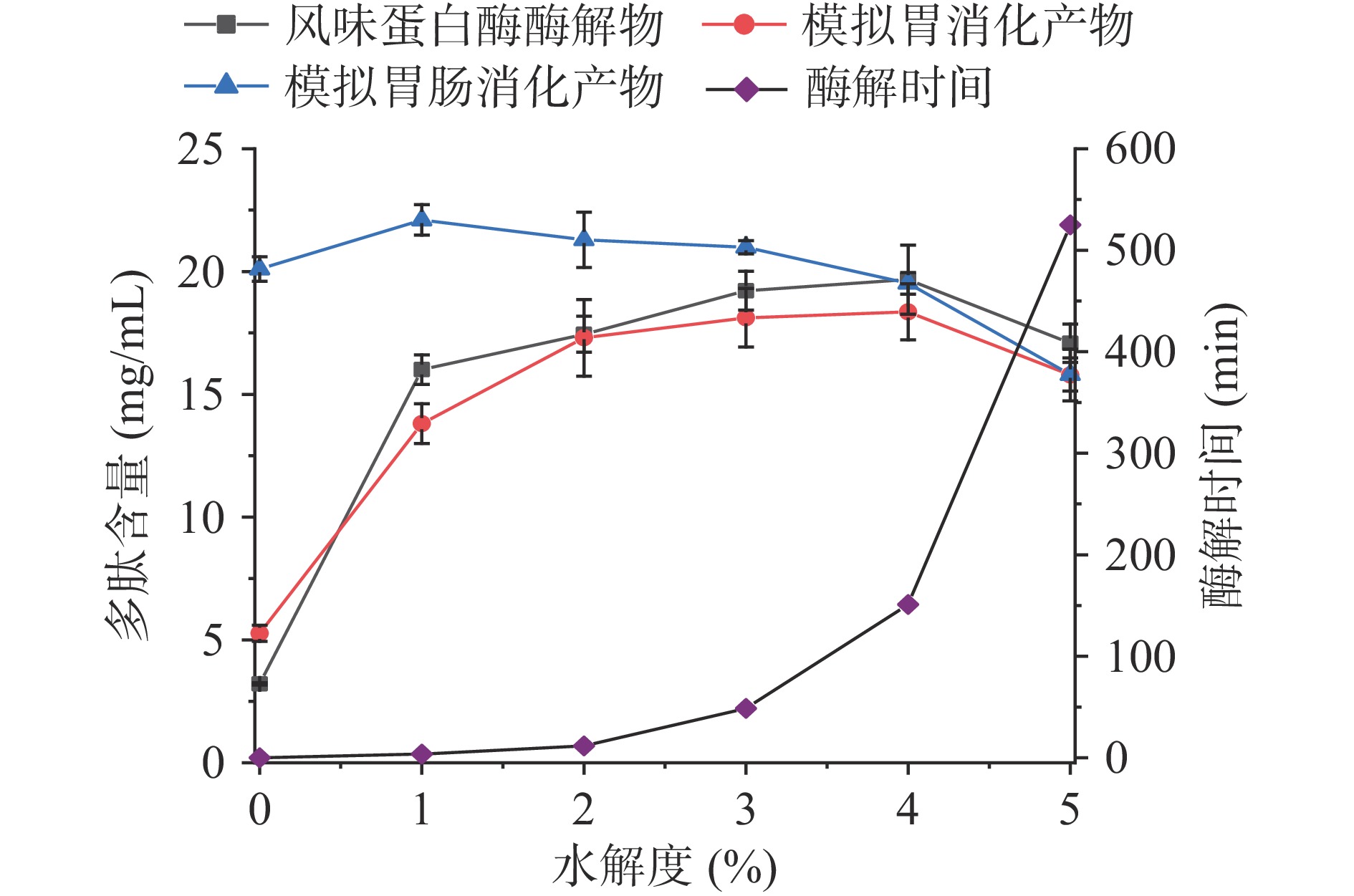
不同水解度下碱性蛋白酶、中性蛋白酶、风味蛋白酶和复合蛋白酶酶解脱脂羊奶的酶解物及其胃消化模拟物、胃肠消化模拟物的多肽含量如图1~图4所示。结果显示,酶促水解与体外模拟胃肠消化均可提升脱脂羊奶的多肽含量。脱脂羊奶的多肽含量为2.52 mg/mL,经过胃蛋白酶体外消化后,多肽含量略有提升(6.25 mg/mL),经过胰酶的模拟肠消化后,消化液中的多肽含量达到20.81 mg/mL,与脱脂羊奶相比提升了725.79%。类似的研究结果在核桃蛋白[8]中也有发现,高消化率的蛋白质在胃蛋白酶和胰酶的作用下可以被水解为多肽,并发挥其生物活性。商业蛋白酶的酶解也是提高脱脂羊奶多肽含量的手段之一,不同的蛋白酶水解效率不同。碱性蛋白酶(图1)在水解度20%时可以获得最高的多肽含量(23.92 mg/mL),此时的酶解时间为388 min。经过胃肠消化后,多肽含量略有下降(22.60 mg/mL),这是由于商业蛋白酶酶解获得多肽在胃蛋白酶和胰酶的进一步水解作用下部分降解,具体下降程度取决于羊奶蛋白的氨基酸组成与蛋白酶的酶切位点[2]。而在水解度为18%时,酶解液的多肽含量(23.06 mg/mL)经过模拟胃肠消化后提高至24.21 mg/mL,此时酶解时间为203 min。因此,酶解制备生物活性肽时应充分考虑胃肠消化酶的作用,与传统直接酶解相比,该方法节约了酶解时间(185 min),且多肽含量提高了7.12%。与碱性蛋白酶相比,中性蛋白酶(图2)具有更高的酶解效率,在水解度10%(酶解时间为193 min)时多肽含量即可达到23.57 mg/mL,进一步胃肠消化没有显著(P>0.05)改变多肽含量。复合蛋白酶(图3)由于具有更丰富的酶切位点,在酶解过程中获得了最高的多肽含量(25.69 mg/mL,水解度8%,酶解时间511 min),而经过体外模拟胃肠消化后,多肽含量降至22.67 mg/mL。风味蛋白酶(图4)水解脱脂羊奶的能力相对较低,多肽含量最高仅19.66 mg/mL,低水解度(<3%)的酶解物经过胃肠消化后多肽含量会进一步提升,高水解度(≥3%)的酶解物经过模拟消化后多肽含量没有显著变化(P>0.05)。总之,羊奶蛋白作为一种消化率高的蛋白,易受肠道消化酶的影响,在制备生物活性肽时应充分考虑胃蛋白酶和胰酶的消化作用,以判断该蛋白是否需要商业蛋白酶的酶解以及酶解的程度。
2.5 酶解和体外模拟胃肠消化对脱脂羊奶及其酶解物中ACE抑制活性的影响
在酶促水解和体外模拟胃肠消化的过程中,羊奶蛋白的结构发生改变,进而导致其活性和功能的改变。不同蛋白酶的酶解产物及其模拟胃消化和胃肠消化产物的ACE抑制活性如图5~图8所示。碱性蛋白酶是制备ACE抑制肽最常用的蛋白酶[9]。脱脂羊奶经碱性蛋白酶水解至不同水解度后,酶解产物及其胃肠模拟消化产物的ACE抑制活性见图5。结果显示,脱脂羊奶直接经过体外模拟胃肠消化后,ACE抑制活性可以达到62.55%。虽然碱性蛋白酶酶解后,产物的ACE抑制活性较高,最高时可达68.43%(水解度4%),然而,经过胃肠消化后,消化液的ACE抑制活性显著(P<0.05)降低。通常,ACE抑制肽多由疏水性氨基酸组成,多项研究表明,ACE抑制肽的结构与活性关系中,疏水性氨基酸残基占60%以上,且C末端的氨基酸种类若为芳香族氨基酸或疏水性氨基酸残基,则ACE抑制活性强[24]。由于碱性蛋白酶和胰酶的酶切位点相似,均能作用于疏水性氨基酸[2]。因此,碱性蛋白酶酶解产生的ACE抑制肽在胃蛋白酶和胰酶的进一步消化后被破环,原有的ACE抑制活性降低。
中性蛋白酶的酶解提高了脱脂羊奶的ACE抑制活性(图6),随着水解度的增加,酶解产物的ACE抑制活性逐渐增加,在水解度为8%时,ACE抑制活性达到最大值63.64%,之后逐渐降低。体外模拟胃肠消化进一步提升了酶解液的ACE抑制活性,水解度为8%时的酶解产物经过模拟消化后ACE抑制活性达81.10%。与碱性蛋白酶相比,脱脂羊奶中性蛋白酶的酶解产物ACE抑制活性低于碱性蛋白酶的酶解产物,但是经过体外模拟胃肠消化之后,消化物的ACE抑制活性却明显高于碱性蛋白酶。这是由于中性蛋白酶是酶切位点为非疏水性氨基酸末端[25],中性蛋白酶的酶解产物经过胃肠模拟消化之后活性升高,其原因可能是中性蛋白酶与胃蛋白酶和胰酶的酶切位点之间存在互补关系,这种互补既防止了中性蛋白酶酶解液中原有的ACE抑制肽被破坏,又可继续水解羊奶蛋白产生新的ACE抑制肽,从而导致ACE抑制活性的提升[26]。
脱脂羊奶经复合蛋白酶水解后,酶解产物及其胃肠模拟消化产物的ACE抑制活性如图7所示。随着水解度的增加,酶解产物的ACE抑制活性逐渐增加,水解度4%时ACE抑制活性最高(79.35%),之后逐渐下降。经过体外模拟胃肠消化后,酶解物的ACE抑制活性均下降,水解度4%的酶解产物经过模拟消化后ACE抑制活性(69.29%)下降了12.68%。复合蛋白酶同时具备内切酶和外切酶两者的活性,可以比较彻底地酶解蛋白质[27],获得相对较高的ACE抑制活性,而经过胃蛋白酶和胰酶的过度酶解后,原有的ACE抑制肽遭到破坏导致活性降低。
与其他三种商业蛋白酶相比,风味蛋白酶对脱脂羊奶的ACE抑制活性提升能力有限(图8)。水解度5%时ACE抑制率也仅为48.45%,而此时酶解时间525 min。模拟胃消化产物的ACE抑制活性在水解度0%~3%时逐渐增加,水解度3%时ACE抑制率为31.59%,之后呈下降趋势;模拟胃肠消化产物的ACE抑制活性在水解度0%~4%时整体呈缓慢下降趋势,在4%~5%快速下降,最大值为水解度0%时,即脱脂羊奶直接胃肠消化时ACE抑制活性高于风味蛋白酶不同水解度的酶解物。综上结果表明,中性蛋白酶的适度酶解产物经过胃肠消化后可以获得最高的多肽含量和ACE抑制活性,因此选取中性蛋白酶的酶解产物与胃肠消化产物进行后续研究。
2.6 体外模拟胃肠消化对脱脂羊奶酶解物分子量分布的影响
为了进一步探究脱脂羊奶在酶解和体外模拟胃肠消化过程中的变化,测定了中性蛋白酶酶解物及体外模拟胃肠消化产物的相对分子量分布,分子量色谱图如图9所示,经过对样品色谱峰进行积分,根据分子量大小切割成8个独立的区域(如表7所示),各区域的相对峰面积即为该分子量范围的相对含量。结果显示,酶解液与胃肠消化液中,小分子物质占主要部分。酶解液中>10000 Da的大分子蛋白仅占2.83%,说明中性蛋白酶酶解已经将大部分羊奶蛋白降解成了小分子多肽和氨基酸,180~500 Da的小肽占主要部分(36.37%)。通常ACE抑制肽由2~15个氨基酸残基组成[28],小分子肽(MW<3 kDa)具有更高的ACE抑制活性[29-30]。在体外模拟胃肠消化液中,>10000 Da的大分子蛋白组分进一步减少至0.34%,分子量<1000 Da的小分子肽由酶解液中的70.77%提高到90%,这可能胃肠消化后ACE抑制活性提高28.83%的原因。
表 7 中性蛋白酶酶解物及其胃肠模拟消化产物中肽的相对分子质量分布和其分布范围Table 7. Molecular weight distribution of the neutrase hydrolysates and its simulated gastrointestinal digests分子量范围
(Da)酶解液各组分含量
(%)胃肠模拟消化液各组分含量
(%)>10000 2.83 0.34 5000~10000 2.52 0.27 3000~5000 3.31 0.78 2000~3000 6.00 1.64 1000~2000 14.57 6.98 500~1000 19.45 16.96 180~500 36.37 46.43 <180 14.95 26.60 3. 结论
本研究比较分析了体外模拟胃肠消化前后脱脂羊奶及其四种商业蛋白酶酶解产物的多肽含量及ACE抑制率,以评价对其进行酶解是否有必要性。结果表明,脱脂羊奶是一种优质蛋白资源,可以被胃蛋白酶和胰酶水解,脱脂羊奶的胃肠消化模拟产物的多肽含量较高,约20.81 mg/mL,ACE抑制活性约62.55%,这表明经过胃肠中胃蛋白酶和胰酶的酶解,可以一定程度上释放出脱脂羊奶中具有降血压活性的ACE抑制肽段。脱脂羊奶经碱性蛋白酶酶解至水解度18%时酶解物的模拟胃肠消化产物多肽含量为24.21 g/mL,与未水解的脱脂羊奶相比提高了16.32%;脱脂羊奶经中性蛋白酶酶解至水解度8%,胃肠消化模拟产物ACE抑制活性可进一步提高28.83%,分子量分布结果显示中性蛋白酶酶解物经过体外模拟胃肠消化,小分子肽含量增加,体外适度的酶解反应对羊奶ACE抑制活性有显著影响,因此脱脂羊奶在一定程度上具有进一步酶解的必要性。
-
表 1 羊奶蛋白氨基酸评分
Table 1 Amino acid rating of goat milk protein
必需氨基酸 婴幼儿均值 2~5岁儿童 10~12岁儿童 成人 His 1.11 1.52 1.52 1.80 Ile 1.42 2.32 2.32 5.01 Leu 1.30 1.83 2.75 6.37 Lys 1.23 1.40 1.85 5.08 Met+Cys 0.73 1.23 1.40 1.81 Phe+Tyr 1.20 1.37 3.93 4.56 Thr 1.46 1.85 2.25 7.00 Val 1.23 1.94 2.71 5.21 Trp / / / / 表 2 蛋白酶的酶活、最适作用条件及酶切位点
Table 2 Enzymatic activity, optimum reaction conditions and cleavage sites of the different proteases
蛋白酶 蛋白酶活力(U/g) 最适作用条件 主要酶切位点 中性蛋白酶 155153.80 pH7.0; T 50 °C 酶切位点较为广泛 碱性蛋白酶 220157.69 pH9.0; T 50 °C 疏水性氨基酸残基,
如Ala和Leu复合蛋白酶 184000.00 pH6.5; T 50 °C 酶切位点较为广泛 风味蛋白酶 26553.85 pH6.5; T 50 °C 酶切位点较为广泛 注:T 温度。 表 3 羊奶粉基本成分
Table 3 Elementary components of goat milk powder
指标 水分 灰分 粗蛋白 脂肪 总糖 含量(%) 2.26±0.26 4.60±0.19 20.00±0.21 19.40±0.36 52.00±0.34 表 4 羊奶蛋白的氨基酸组成及含量
Table 4 Amino acid composition and content of goat milk protein
氨基酸 含量(%) 氨基酸 含量(%) Asp 7.96±0.11 Ile 6.51±0.10 Thr 6.30±0.09 Leu 12.11±0.06 Ser 4.88±0.01 Tyr 4.29±0.01 Glu 21.01±0.25 Phe 4.36±0.02 Gly 2.11±0.01 His 2.89±0.01 Ala 3.70±0.02 Lys 8.13±0.09 Val 6.77±0.06 Arg 3.96±0.03 Met 3.08±0.02 Pro 1.93±0.01 表 5 羊奶蛋白必需氨基酸及氨基酸分布
Table 5 Amino acid distribution and essential amino acids of goat milk protein
氨基酸种类 含量(%) 必需氨基酸 Lys、Trp、Phe、Met、Thr、Ile、Leu、Val 47.27 疏水性氨基酸 Ala、Phe、Ile、Leu、Met、Pro、Val、Trp 38.45 亲水性氨基酸 Ser、Thr、Tyr、Cys、Gly 17.58 酸性氨基酸 Glu、Asp 28.98 碱性氨基酸 Lys、Arg、His 14.98 表 6 羊奶蛋白营养价值分析
Table 6 Nutritional value of goat milk protein
营养评价参数 评分 E/T(%) 47.27 PER I 4.75 PER II 4.58 BV 93.63 表 7 中性蛋白酶酶解物及其胃肠模拟消化产物中肽的相对分子质量分布和其分布范围
Table 7 Molecular weight distribution of the neutrase hydrolysates and its simulated gastrointestinal digests
分子量范围
(Da)酶解液各组分含量
(%)胃肠模拟消化液各组分含量
(%)>10000 2.83 0.34 5000~10000 2.52 0.27 3000~5000 3.31 0.78 2000~3000 6.00 1.64 1000~2000 14.57 6.98 500~1000 19.45 16.96 180~500 36.37 46.43 <180 14.95 26.60 -
[1] ZENG Q, CAI Z X, LIU Y P, et al. A comprehensive review on bioactive peptides derived from egg proteins[J]. Food Science,2021,42(19):362−378.
[2] LIU D, GUO Y, MA H. Production, bioactivities and bioavailability of bioactive peptides derived from walnut origin by-products: A review [J/OL]. Critical Reviews in Food Science and Nutrition, 2022.https://doi.org/10.1080/10408398.2022.2054933.
[3] WANG R X, YI L, JI R M T. Research progress on the bioactive peptides in camel milk[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(7):299−306.
[4] LI H, LÜ Y, DING K, et al. Preparation and function assessment of antihypertensive peptides from food[J]. Food and Nutrition in China,2015,21(1):26−30.
[5] LIU D, CHEN M, ZHU J, et al. A two-stage enzymolysis method and its application in exerting antioxidant activity of walnut protein[J]. Frontiers in Nutrition,2022,9:889434. doi: 10.3389/fnut.2022.889434
[6] HUANG S, LI Y, LI C, et al. Effects of ultrasound-assisted sodium bisulfite pretreatment on the preparation of cholesterol-lowering peptide precursors from soybean protein[J]. International Journal of Biological Macromolecules,2021,183:295−304. doi: 10.1016/j.ijbiomac.2021.04.125
[7] YANG X, LI Y L, LU F, et al. Effects of ultrasonic frequencies on ACE inhibitory activity of hydrolysate and gastrointestinal simulated digestive products from rice protein[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(3):60−66.
[8] LIU D, GUO Y, WU P, et al. The necessity of walnut proteolysis based on evaluation after in vitro simulated digestion: ACE inhibition and DPPH radical-scavenging activities[J]. Food Chemistry,2019,311:125960.
[9] LIU D, GUO Y, ZHU J, et al. The necessity of enzymatically hydrolyzing walnut protein to exert antihypertensive activity based on in vitro simulated digestion and in vivo verification[J]. Food & Function,2021,12(8):3647−3656.
[10] KASHYAP S, SHIVAKUMAR N, SEJIAN V, et al. Goat milk protein digestibility in relation to intestinal function[J]. The American Journal of Clinical Nutrition,2021,113(4):845−853. doi: 10.1093/ajcn/nqaa400
[11] SHU G, HUANG J, BAO C, et al. Effect of different proteases on the degree of hydrolysis and angiotensin I-converting enzyme-inhibitory activity in goat and cow milk[J]. Biomolecules,2019,8(4):101.
[12] CHEN L, WANG J, SHU G, et al. Purification and production of novel angiotensin I-converting enzyme (ACE) inhibitory bioactive peptides derived from fermented goat milk[J]. Emirates Journal of Food and Agriculture,2018,30(9):742−749.
[13] GU H F, ZHANG F X, ZHANG Y. In vitro digestion of proteins in goat milk formula[J]. Food Science,2013,34(19):302−305.
[14] KETNAWA S, MARTINEZ A O, BENJAKUL S, et al. Gelatin hydrolysates from farmed giant catfish skin using alkaline proteases and its antioxidative function of simulated gastro-intestinal digestion[J]. Food Chemistry,2016,192(1):34−42.
[15] LIU D D, ZHU J S, ZHANG X L, et al. Nutritional evaluation of walnut protein and its ameliorative effect on DSS induced acute colitis in mice[J]. Science and Technology of Food Industry,2022,43(20):372−379.
[16] YANG X, LI Y, LI S, et al. Effects of ultrasound pretreatment with different frequencies and working modes on the enzymolysis and the structure characterization of rice protein[J]. Ultrasonics Sonochemistry,2017(38):19−28.
[17] ADLERNISSEN J. Enzymic hydrolysis of food proteins[J]. Canadian Medical Association Journal,1986,172:1783−1785.
[18] LI M, XIA S, ZHANG Y, et al. Optimization of ACE inhibitory peptides from black soybean by microwave-assisted enzymatic method and study on its stability[J]. LWT-Food Science and Technology,2018,98:358−365. doi: 10.1016/j.lwt.2018.08.045
[19] JIN J, MA H, ZHOU C, et al. Effect of degree of hydrolysis on the bioavailability of corn gluten meal hydrolysates[J]. Journal of the Science of Food and Agriculture,2015,95(12):2501−2509. doi: 10.1002/jsfa.6982
[20] BHASKAR B, ANATHANARAYAN L, JAMDAR S. Purification, identification, and characterization of novel angiotensin I-converting enzyme (ACE) inhibitory peptides from alcalase digested horse gram flour[J]. LWT- Food Science and Technology,2019(103):155−161.
[21] MOHSIN A Z, SUKOR R, SELAMAT J, et al. Chemical and mineral composition of raw goat milk as affected by breed varieties available in Malaysia[J]. International Journal of Food Properties,2019,22(1):815−824. doi: 10.1080/10942912.2019.1610431
[22] ZHENG L, REN J, SU G, et al. Comparison of in vitro digestion characteristics and antioxidant activity of hot- and cold-pressed peanut meals[J]. Food Chemistry,2013,141(4):4246−4252. doi: 10.1016/j.foodchem.2013.06.081
[23] 邹平. 基于生物信息学与QSAR及分子对接的菜粕活性肽筛选及活性研究 [D]. 杭州: 浙江大学, 2014. ZOU Ping. Screening of bioactive peptides from rapeseed meal by bioinformatics, QSAR and molecular docking and research on their activity [D]. Hangzhou: Zhejiang University, 2014.
[24] DASKAVA D C, YUCETEPE F, KARBANCIOGLU G H, et al. Angiotensin-I-converting enzyme (ACE)-inhibitory peptides from plants[J]. Nutrients,2017,9(4):316. doi: 10.3390/nu9040316
[25] SHAUKAT A, NADEEM M, RANJHA M, et al. Effect of ripening and in vitro digestion on free amino acids and angiotensin I converting enzyme inhibitory (ACE-I) potential of cow and Buffalo milk cheddar cheeses[J]. International Journal of Food Properties,2022,25(1):948−959. doi: 10.1080/10942912.2022.2070200
[26] WANG S, ZHAO M, FAN H, et al. Emerging proteins as precursors of bioactive peptides/hydrolysates with health benefits[J]. Current Opinion in Food Science,2022,48:100914. doi: 10.1016/j.cofs.2022.100914
[27] MA H, LIU B, LI S, et al. Enzymatic preparation of rice anti-oxidation peptide[J]. Transactions of the Chinese Society for Agricultural Machinery,2010,41(11):119−123.
[28] ZAHARUDDIN N, BARKIA I, IBADULLAH W, et al. Identification, molecular docking, and kinetic studies of six novel angiotensin-I-converting enzyme (ACE) inhibitory peptides derived from Kenaf (Hibiscus cannabinus L.) seed[J]. International Journal of Biological Macromolecules,2022,220:1512−1522. doi: 10.1016/j.ijbiomac.2022.09.142
[29] RUI X, BOVE J I, SIMPSON B K, et al. Purification and characterization of angiotensin I-converting enzyme inhibitory peptides of small red bean (Phaseolus vulgaris) hydrolysates[J]. Journal of Functional Foods,2013,5(3):1116−1124. doi: 10.1016/j.jff.2013.03.008
[30] GONZALEZ M, VALLE M, ALUKO R E, et al. Production of antihypertensive and antidiabetic peptide fractions from quinoa (Chenopodium quinoa Willd.) by electrodialysis with ultrafiltration membranes[J]. Food Science and Human Wellness,2022,11(6):1650−1659. doi: 10.1016/j.fshw.2022.06.024
-
期刊类型引用(6)
1. 徐柠檬,董仕豪,秦粉,申开泽,李为兰,华燕,郭磊. 基于UPLC-Q-TOF-MS/MS和网络药理学探讨天麻抗炎的物质基础及其作用机制. 食品科学. 2025(04): 30-43 .  百度学术
百度学术
2. 王剑涛,赵旭东,邓丽,葛梦君,高贝贝,李雷. 亚甲基蓝改善脑炎性衰老大鼠认知功能及机制探索. 中华老年心脑血管病杂志. 2024(03): 336-340 .  百度学术
百度学术
3. 刘潇聪,张玉苗,潘亚磊. 天麻素药理作用及临床应用研究进展. 中南药学. 2024(06): 1615-1620 .  百度学术
百度学术
4. 董欣,隋欣彤,胡力铭,王仁广,李占国,王景龙,王淑敏,梁磊. 米汤炮制天麻工艺的优化及抗炎作用. 食品工业科技. 2024(16): 358-367 .  本站查看
本站查看
5. 应春苗,刘飞祥,潘小龙,樊飞燕,陈娜,张运克. 中药延缓神经血管单元衰老治疗神经退行性疾病的研究进展. 中国中药杂志. 2023(15): 4060-4071 .  百度学术
百度学术
6. 宗芳,陈永华,代玉强. 真方白丸子联合注射用阿替普酶对急性缺血性卒中风痰入络证患者血清炎症因子及血管内皮活性物质的影响. 国际中医中药杂志. 2023(09): 1075-1080 .  百度学术
百度学术
其他类型引用(5)









 下载:
下载:








 下载:
下载:



