Highly Efficient Expression of Tannase in Aspergillus niger and Its Enzymatic Properties
-
摘要: 运用基因工程手段,构建高效表达单宁酶的黑曲霉重组菌株,并对重组酶活性及酶学性质进行研究,以期提高单宁酶的表达,更好地实现单宁酶在茶饮料、饲料等行业的重要作用。以内源高表达的glaA基因位点为整合靶位点,集成glaA多拷贝强启动子PglaA6R和信号肽SglaA,构建单宁酶基因AnTan黑曲霉重组表达载体pSZHG6R-AnTan,采用农杆菌介导法转化黑曲霉,获得单宁酶黑曲霉纯合重组菌株A1。聚丙烯酰胺凝胶电泳(SDS-PAGE)检测结果表明,目的蛋白大小约为76 kDa;以10%糊精为碳源摇瓶发酵至11 d时,酶活最高达到134.36 U·mL−1,约为宿主菌株的192倍。酶学性质研究表明,最适温度为50 ℃,高温时热稳定性较差;最适pH为7.0。K+和Ca2+对重组酶没有影响;Mg2+对重组酶有微弱的促进作用;Zn2+对重组酶有明显的促进作用;Cu2+和Fe2+对重组酶有微弱的抑制作用;Mn2+和EDTA对重组酶有明显的抑制作用。研究结果为进一步优化单宁酶的分泌表达提供了有价值的参考。Abstract: The recombinant strains of Aspergillus niger with high expression of tannase were constructed by means of genetic engineering. The activity and enzymatic properties of the recombinant enzyme were studied to improve the expression of tannase and better realize the important role of tannase in tea beverage, feed and other industries. GlaA multi-copy strong promoter PglaA6R and signal peptide SglaA were integrated to construct tannase gene AnTan Aspergillus niger recombinant expression vector pSZHG6R-AnTan with the endogenous highly expressed glaA gene site as the integration target site, and the Aspergillus niger pure recombinant strain A1 of tannase was obtained by agrobacterium-mediated transformation of Aspergillus niger. The results of polyacrylamide gel electrophoresis (SDS-PAGE) detection results showed that the size of the target protein was about 76 kDa. The maximum enzyme activity reached 134.36 U·mL−1 when 10% dextrin was used as carbon source for shaking flask fermentationat to 11 days, which was about 192 times of the host strain. The study of enzymatic properties showed that the optimal temperature was 50 ℃ and the thermal stability was poor at high temperature, the optimal pH was 7.0. K+ and Ca2+ had no effect on recombinant enzyme, Mg2+ had weak promoting effect on recombinant enzyme, Zn2+ had obvious promoting effect on recombinant enzyme, Cu2+ and Fe2+ had weak inhibition on recombinant enzyme, Mn2+and EDTA had obvious inhibitory effect on recombinant enzyme. The results provide a valuable reference for further optimizing the secretion and expression of tannase.
-
Keywords:
- tannase /
- Aspergillus niger /
- high expression /
- enzymology properties /
- recombinant strains /
- genetic engineering
-
单宁酶(单宁酰基水解酶,EC3.1.1.20)也称鞣酸酶,可在水相中水解没食子酸单宁、没食子酸脂类的酯键、缩酚酸酯键和缩酚羧键,生成葡萄糖、没食子酸和其他醇类化合物[1-4]。自然界中的单宁酶广泛存在于动物、植物和微生物体内,尤其是真菌类的曲霉属、青霉属和根霉属[5-7]。单宁酶已被列入食品工业的安全添加剂,并在食品、饲料等领域广泛应用[8-9]。可降低茶汤中单宁酸含量,解决茶饮料“冷后浑”问题[10];可降低单宁含量,解决果汁类饮料除涩、抗氧化等问题[11-14];可降低饲料中单宁酸含量,提高营养物质利用率等[15-17]。
不同来源的单宁酶酶学性质差异较大,多数单宁酶的最适温度在35~50 ℃范围内,最适pH在5.5~7.0范围内[18-20]。王喆丽[21]发现野生型黑曲霉中单宁酶的酶活力为0.782 U·mL−1,优化后酶活力增加至2.686 U·mL−1。林健辉等[22]以β-环糊精为碳源优化发酵培养基后的单宁酶酶活力为116.51 U·mL−1。徐璐等[23]在土壤中筛选出产单宁酶的黑曲霉Lys117高活性菌株,并对其发酵条件进行优化,优化后酶活达到233.78 U·mL−1。
黑曲霉是规模化生产重组蛋白的理想系统,被誉为“理想的真核蛋白细胞工厂”,是目前和未来工业蛋白质表达系统研究的热点[24-25]。目前单宁酶仍存在产量低、生产成本高等问题。本研究以糖化酶黑曲霉工业生产菌为宿主菌,该菌株的糖化酶基因位点为转录活跃位点,因此,以内源高表达的糖化酶基因glaA位点为基因整合的靶位点,并使用glaA六拷贝强启动子和信号肽来提高单宁酶的表达量,并对其酶学性质进行研究,以期使单宁酶的生产性能达到国内领先水平。
1. 材料与方法
1.1 材料与仪器
野生型糖化酶生产菌黑曲霉TH-2 由肇东日成酶制剂有限公司赠予;大肠杆菌感受态细胞DH5α 购于北京全式金生物技术有限公司;农杆菌AGL1 由东北农业大学真菌遗传工程研究室保存;载体pSZHG6R-AnTan、黑曲霉菌株A1(ΔglaA:AnTan) 为本研究构建;克隆载体pMD-19T、Es Taq Master Mix、限制性内切酶、DNA Maker、T4 DNA连接酶 均购于TaKaRa生物公司;利福平(Rifamycin)、头孢霉素(Cefalexin)、乙酰丁香酮(Acetylsyringone)、氨苄青霉素(Ampicillin)、卡那霉素(Kanamycin)、潮霉素B(Hygromycin B) 均购于Sangon公司;Protein Maker 购于Thermo公司;质粒提取试剂盒、DNA凝胶回收试剂盒、植物DNA基因组提取试剂盒 均购于康为世纪生物科技有限公司;罗丹宁 购于上海aladinn生化科技股份有限公司;柠檬酸 购于天津市东丽区天大化学试剂厂;甲醇、磷酸氢二钠 均购于天津市天力化学试剂有限公司;没食子酸正丙酯 购于南京都莱生物公司;没食子酸 购于北京Solarbio科技有限公司;葡萄糖、麦芽糖 均购于西安天茂化工有限公司;糊精 购于山东萍聚生物科技有限公司;FeSO4·7H2O 购于武汉北国奉化工有限公司;ZnSO4·7H2O 购于上海铺振生物科技有限公司;CuSO4·5H2O 购于重庆名宏化工材料有限公司;MgSO4·7H2O 购于长沙锐启化工产品有限公司;MnCl2·4H2O 购于武汉吉业升化有限公司;CaCl2 购于山东皓宇新材料科技有限公司;K2SO4 购于湖北兴银河化工有限公司;EDTA 购于陕西晨明生物科技有限公司;SDS 购于无锡市亚泰联合化工有限公司;玉米浆 购于天津市利发隆化工科技有限公司。
DK-8D型三温三控水槽 购于上海百典仪器有限公司;SW-CJ-1G型超净工作台 购于上海鼎科科学仪器有限公司;DTC-3G型PCR仪 购于西安天隆科技有限公司;GELDoc Go型凝胶成像系统、1658033型蛋白质电泳系统 购于BIO-RAD公司;UV-5100型紫外可见分光光度计 购于上海元析仪器有限公司;DYCZ-24型蛋白质电泳系统 购于北京六一仪器厂;A6型匀浆器 购于上海欧河机械设备有限公司。
1.2 实验方法
1.2.1 培养基的配制
a. YEB(Yeast extract beef medium):由1 g酵母提取物,5 g蛋白胨,0.493 g硫酸镁,5 g蔗糖,5 g牛肉膏定容至1 L,pH调至7.0,固体培养基加入10% 琼脂粉,121 ℃高压灭菌1 h;b. PDA培养基:由200 g土豆(称量200 g土豆,去皮后切成小块,加入1 L蒸馏水,电磁炉煮30 min,纱布过滤留滤液),20 g葡萄糖,3 g磷酸二氢钾,1.5 g硫酸镁。固体培养基按100 mL加入15 g琼脂粉;c. 液体发酵培养基:由10 g葡萄糖,2 mL玉米浆(浓度52%,蛋白质含量47%),2 g豆饼粉定容至100 mL,pH5.0~6.0,固体培养基加入10%琼脂粉,121 ℃高压灭菌1 h。
1.2.2 引物设计
根据GenBank单宁酶序列(Gene ID: 4990850),单宁酶基因AnTan的上下游引物P1、P2是通过Primer5.0软件设计而来。P3和P4为鉴定同源重组菌株所用引物(如表1所示)。
表 1 所需引物序列Table 1. The desired prime sequence引物名称 引物序列 酶切位点 P1:AnTan-sense TCTAGAGCAACTCCCTCCACGTTG Apa I P2:AnTan-antisense AAGCTTGGATCCTTAGTACACAGGCATAGGAAC Hind III P3:5'GLA-sense TCTAGACTCGGCGACTTGGTCTTCAC Xba I P4:3'GLA-antisense CTCGAGCATAAGGCGGGTTCACATC Xho I 1.2.3 基因克隆
以黑曲霉TH-2基因组DNA为模板,以P1和P2为引物,通过PCR技术扩增出大小为1700 bp(PCR扩增条件:预变性95 ℃ 5 min,(变性95 ℃ 30 s、退火56 ℃ 45 s、延伸72 ℃ 90 s)共30个循环,终延伸72 ℃ 10 min,4 ℃ 2 h)的目的基因片段AnTan。基因片段AnTan和克隆载体pMD-19T进行连接反应,将获得的质粒送到测序公司进行测序,选择Blast结果为100%的质粒进行下一步实验。
1.2.4 单宁酶基因AnTan表达载体的构建
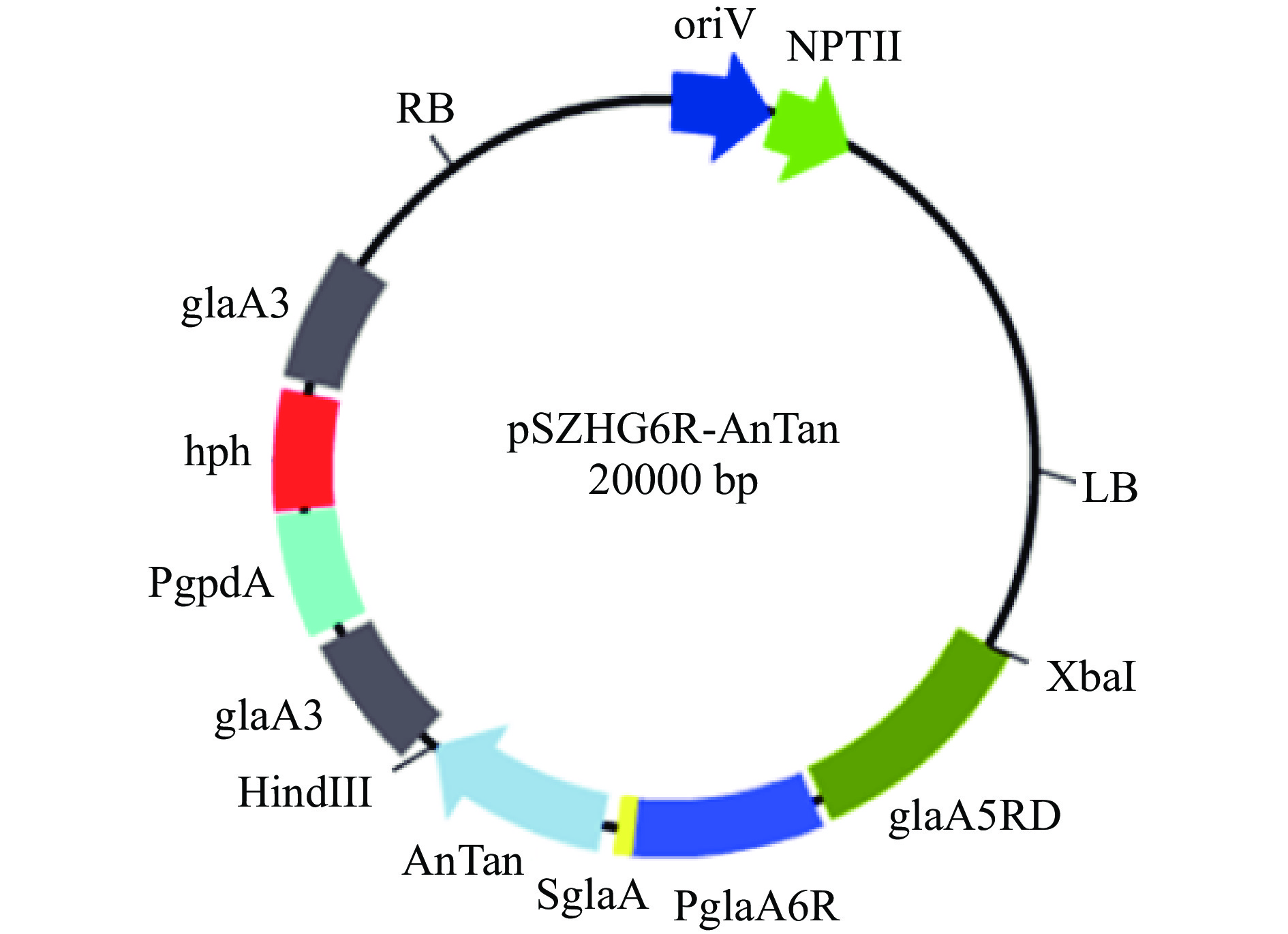
用Xba I/Hind III 双酶切克隆载体质粒pT-AnTan,回收约1700 bp的目的基因片段。用Nhe I/Hind III双酶切表达载体质粒pSZHG6R,回收约15000 bp的表达载体片段pSZHG6R,将回收的目的基因片段AnTan和表达载体片段pSZHG6R用T4 DNA Ligase连接,构建重组表达载体pSZHG6R-AnTan(ΔglaA:AnTan),质粒图如图1所示。
1.2.5 单宁酶基因AnTan黑曲霉共培养及转化子的筛选、鉴定
采用冻融法将重组表达载体pSZHG6R-AnTan转入农杆菌感受态细胞中。向新鲜灭菌的液体YEB培养基(含100 mg·L−1 Rif,100 mg·L−1 km+)中加入鉴定正确的农杆菌转化子进行初次活化,28 ℃,200 r·min−1振荡培养12~14 h;另取一瓶新鲜灭菌的液体YEB培养基(含100 mg·L−1 Rif,100 mg·L−1 km+和200 μmol·L−1As)接入初次活化的菌液(按1:10的比例),28 ℃,200 r·min−1振荡培养4~5 h;待菌液摇起后吸取200~300 μL菌液置于EP管中,12000 r·min−1,离心1 min,留取沉淀以备使用;取1 mL的黑曲霉TH-2菌液,匀浆器打碎后静置15 min,取75 μL上清和75 μL菌丝于农杆菌沉淀的EP管中混匀,取50 μL的混合菌液涂布于铺有玻璃纸的PDA固体培养基(含200 μmol·L−1 As)上,放置于30 ℃恒温箱,培养2 d;取新鲜灭菌的PDA固体培养基(含200 mmol·L−1头孢,200 mmol·L−1 Hygromycin B)将覆有菌丝的玻璃纸倒置其中,30 ℃恒温箱进行培养,培养时间为12 h,玻璃纸揭去后继续培养6~8 d直至长出黑曲霉单菌落。向液体PDA培养基(含200 mmol·L−1头孢,200 mmol·L−1 Hygromycin B)中加入长势良好的黑曲霉单菌落,培养2~3 d;待菌丝大量生长后,吸取1 mL菌丝液于EP管中进行基因组DNA的提取,提取方法参考基因组提取试剂盒。以提取的基因组DNA为模板,将P3和P4作为上下游引物进行PCR鉴定,以水为阴性对照,重组表达载体质粒pSZHG6R-AnTan为阳性对照,筛选出单宁酶基因AnTan黑曲霉纯合重组菌,标记为A1。
1.2.6 单宁酶基因AnTan黑曲霉纯合重组菌株的SDS-PAGE检测
向装有100 mL液体发酵培养基的锥形瓶中分别接入10 mL的野生型菌株TH-2和单宁酶黑曲霉重组菌株A1,然后将锥形瓶置于30 ℃ 270 r·min−1的培养箱里振荡培养,吸取第4 d~第11 d的发酵液上清进行SDS-PAGE检测。
1.2.7 单宁酶酶活力测定
参考文献[26]方法,单宁酶酶活定义:30 ℃条件下,每分钟产生1 μmol没食子酸所需单宁酶的量为一个酶活力单位,计算公式如下:
U(µmol/mL)=X×4×D2000×t 式中:U:单宁酶酶活力(μmol·mL−1),X:没食子酸浓度(μmol·L−1),D:发酵液上清总稀释倍数,t:酶解反应时间(min)。
1.2.8 重组单宁酶的酶学性质分析
将摇瓶发酵培养的100 mL培养液于第11 d取出,收集上清。对上清液进行抽滤,去除杂质。
1.2.8.1 最适温度
取8份A1发酵液上清,用pH7.0的0.2 mol·L−1磷酸氢二钠-柠檬酸缓冲液进行稀释,加入0.05 mol·L−1甲醇饶丹宁底物,分别在20、30、40、50、60、70、80、90 ℃的条件下反应30 min后测定A1的酶活力,计算各组酶活数值与最大值的比值为相对酶活力,绘制相对酶活力与温度曲线关系,以最大酶活力为100%[27]。
1.2.8.2 温度稳定性
取9份A1发酵液上清,其中8份分别在20、30、40、50、60、70、80、90 ℃水浴锅中保温15、30、45、60 min,之后在pH为7.0,温度为50 ℃的条件下反应30 min后测定A1的酶活力;另一份酶液作为对照组不进行保温处理,并定义其酶活力为100%[27],计算处理组与对照组酶活比值为残余酶活力并绘制曲线关系。
1.2.8.3 最适pH
取7份A1发酵液上清,分别用pH为3.0、4.0、5.0、6.0、7.0、8.0、9.0的0.2 mol·L−1磷酸氢二钠-柠檬酸缓冲液进行稀释,加入0.05 mol·L−1甲醇饶丹宁底物,50 ℃条件下反应30 min后测定A1的酶活力,以最大酶活力为100%[27]。
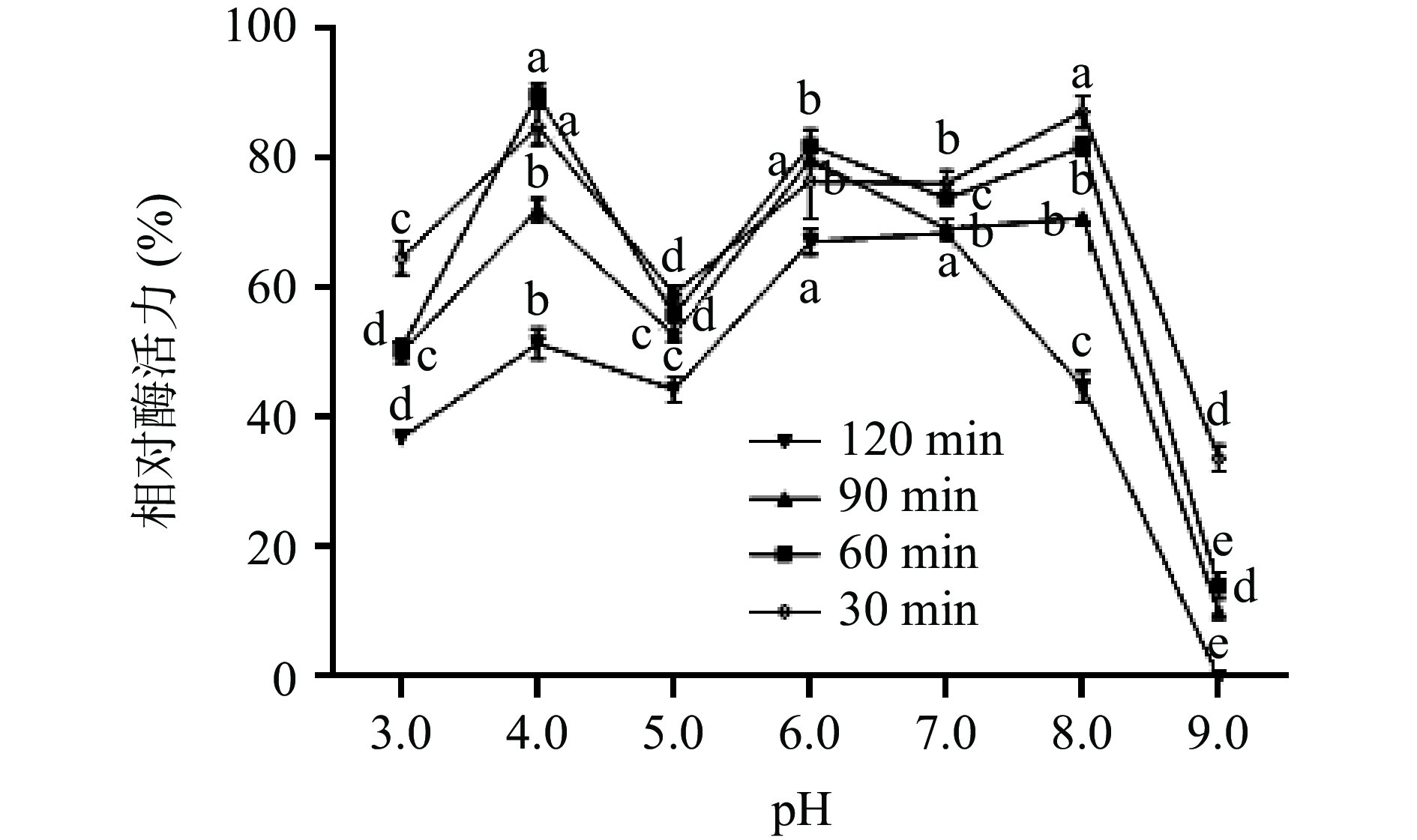
1.2.8.4 pH稳定性
取8份A1发酵液上清,其中7份分别用0.2 mol·L−1磷酸氢二钠-柠檬酸缓冲液调成pH为3.0、4.0、5.0、6.0、7.0、8.0、9.0的酶液混合液,37 ℃处理30、60、90、120 min。用pH5.0的缓冲液稀释处理后的样品,加入0.05 mol·L−1甲醇饶丹宁底物,50 ℃条件下反应30 min后测定A1的酶活力,另一份酶液作为对照组未经 pH处理,并定义其酶活力为100%[27],计算处理组与对照组比值为残余酶活力并绘制曲线关系。
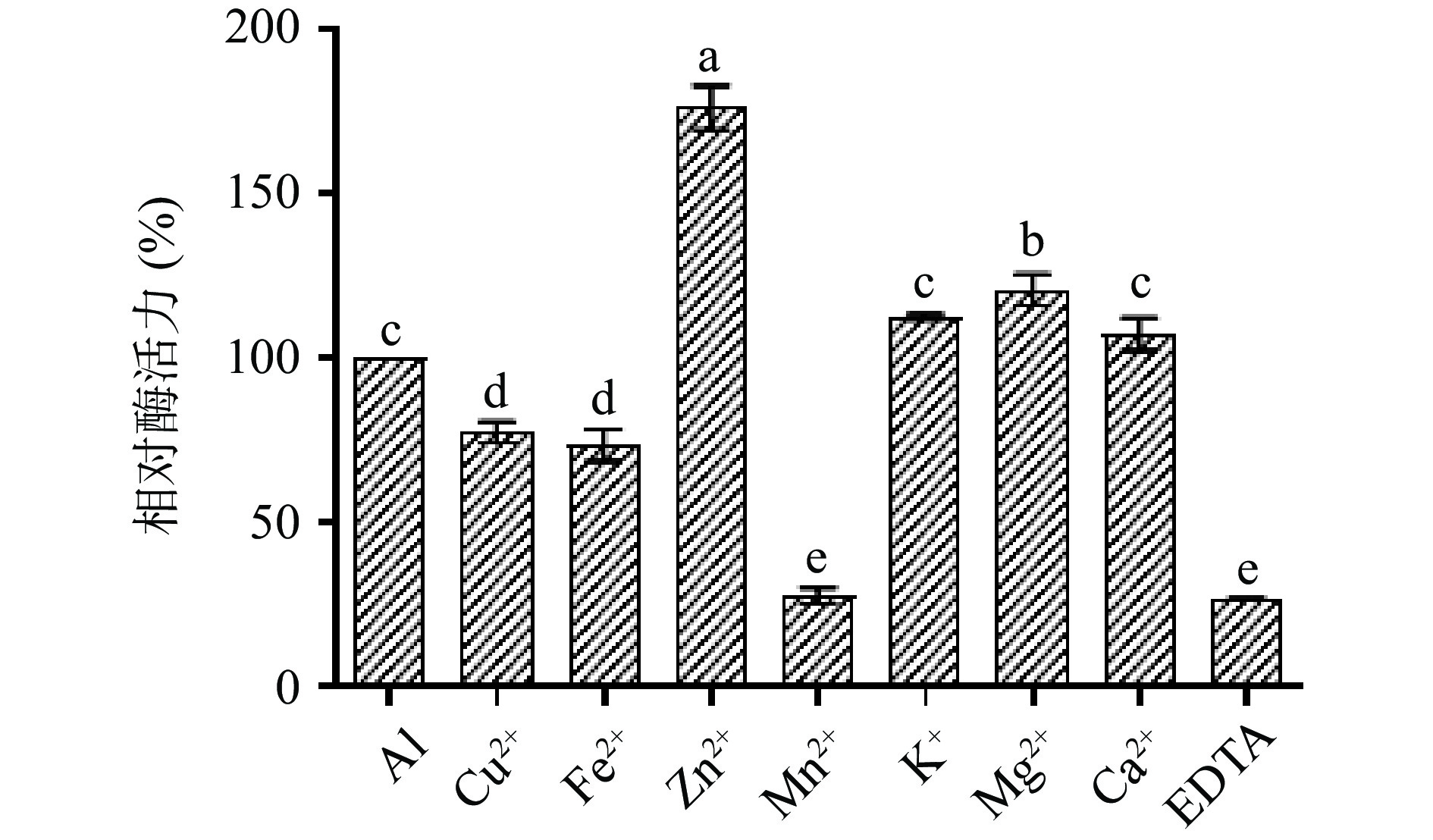
1.2.8.5 金属离子和化学试剂对A1活性的影响
取9份A1发酵液上清,其中8份分别添加终浓度为5 mmol·L−1 KCl、MnSO4、ZnSO4、MgSO4、CaCl2、CuSO4、FeSO4、EDTA,在50 ℃、pH5.0条件下处理1 h,研究不同金属离子和化学试剂对A1酶活力的影响,另一份酶液作为对照组不加任何金属离子,并定义其酶活力为100%[27],计算处理组与对照组酶活比值为残余酶活力并绘制曲线关系。
1.3 数据处理
在酶活性相关实验中,每组数据处理重复三次,计算得到的酶活数据利用SPSS软件进行单因素方差分析,以确定组间显著差异,使用Graphpad Prism v 8.0软件绘图。
2. 结果与分析
2.1 单宁酶AnTan基因黑曲霉重组表达载体的构建
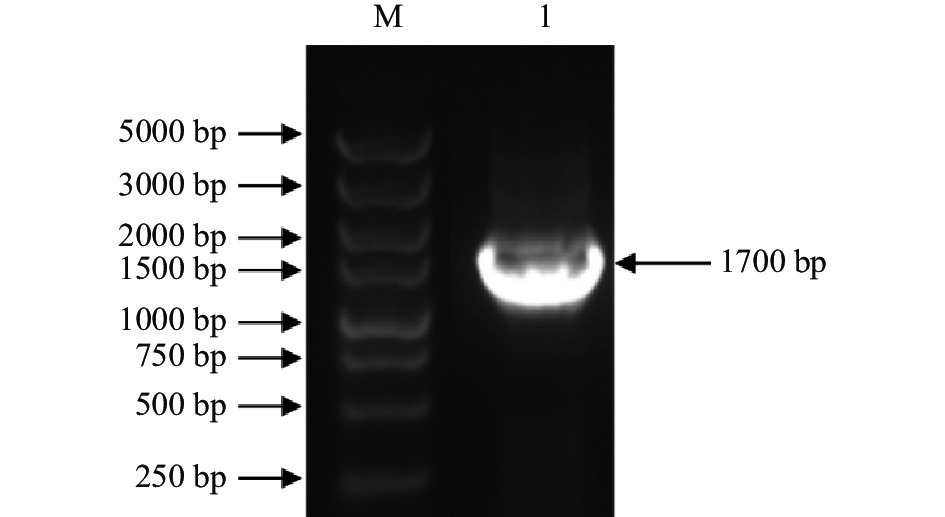
以实验室构建并保存的单宁酶基因载体质粒pSZHG-tan为模板,以单宁酶基因引物P1和P2为引物进行PCR扩增,得到大小约1700 bp的基因片段AnTan,结果如图2所示。将测序后的序列在GenBanK上进行Blast序列比对分析,结果该序列与登录号XM_001401772相似性达100%,表明单宁酶基因片段AnTan克隆成功。
将回收的目的基因片段AnTan和表达载体片段pSZHG6R用T4 DNA Ligase连接,构建重组表达载体pSZHG6R-AnTan,Xba I/Hind III双酶切重组质粒,获得大小约15000和3300 bp的片段,结果如图3所示,说明重组表达载体pSZHG6R-AnTan构建成功。
2.2 单宁酶AnTan基因农杆菌转化子的筛选及鉴定
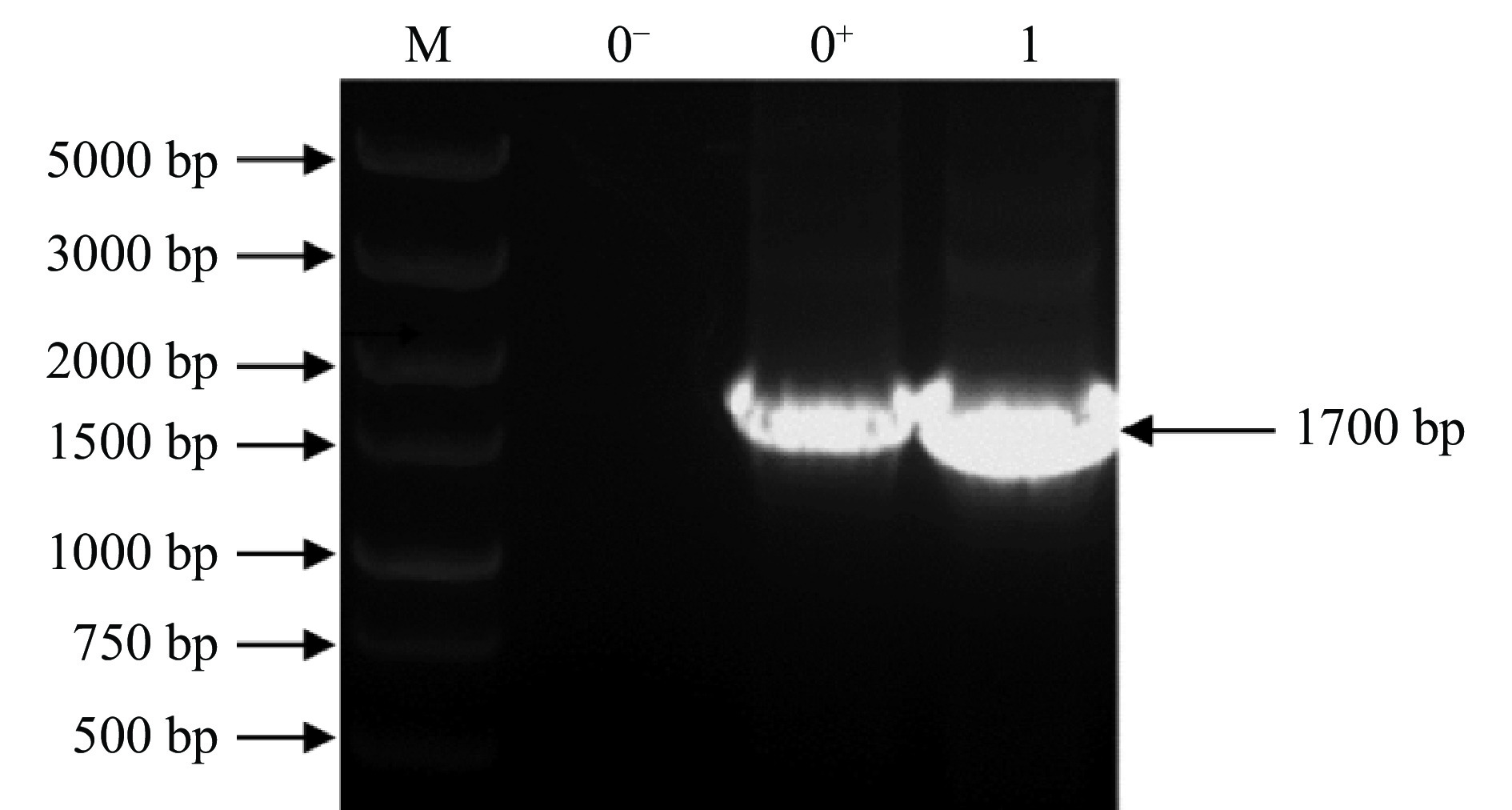
采用冻融法将单宁酶黑曲霉重组表达载体质粒pSZHG6R-AnTan转入农杆菌感受态AGL1中,28 ℃培养3~4 d至长出单菌落,挑取菌落为模板,水为阴性对照,表达载体质粒pSZHG6R-AnTan为阳性对照,用单宁酶基因特异引物P1、P2进行菌落PCR鉴定。结果如图4所示,菌落1扩增出与阳性对照相同大小的片段,证明单宁酶黑曲霉重组表达载体pSZHG6R-AnTan成功转入农杆菌AGL1。
2.3 单宁酶AnTan基因黑曲霉纯合重组菌株的筛选及鉴定
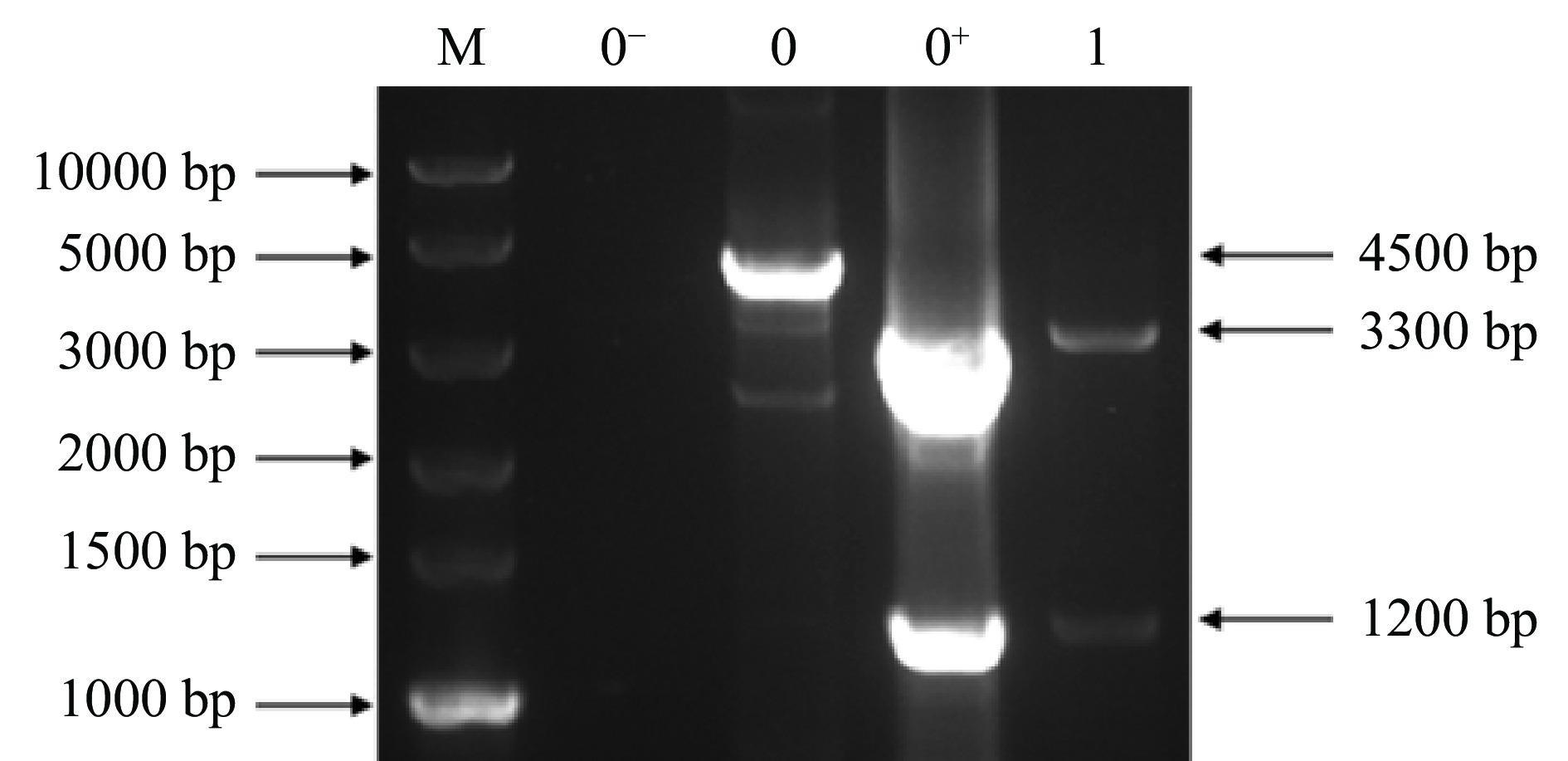
用同源臂引物P3和P4对重组菌株进行基因组PCR鉴定,野生型菌株黑曲霉TH-2和重组菌株均能扩增出约4500 bp条带,因此,通过PCR方法不能直接鉴定出转化子。进一步将PCR产物用Hind III单酶切,结果如图5所示,泳道0为野生型菌株黑曲霉TH-2,糖化酶基因表达框上无Hind III酶切位点,因此切不开;泳道0+为单宁酶黑曲霉重组表达载体质粒,可将扩增出的单宁酶基因表达框切成3300和1200 bp条带;泳道1为重组菌株,能切出与阳性质粒一样大小的条带,而无野生型菌株4500 bp条带,证明其为纯合的单宁酶黑曲霉重组菌株,记为A1。
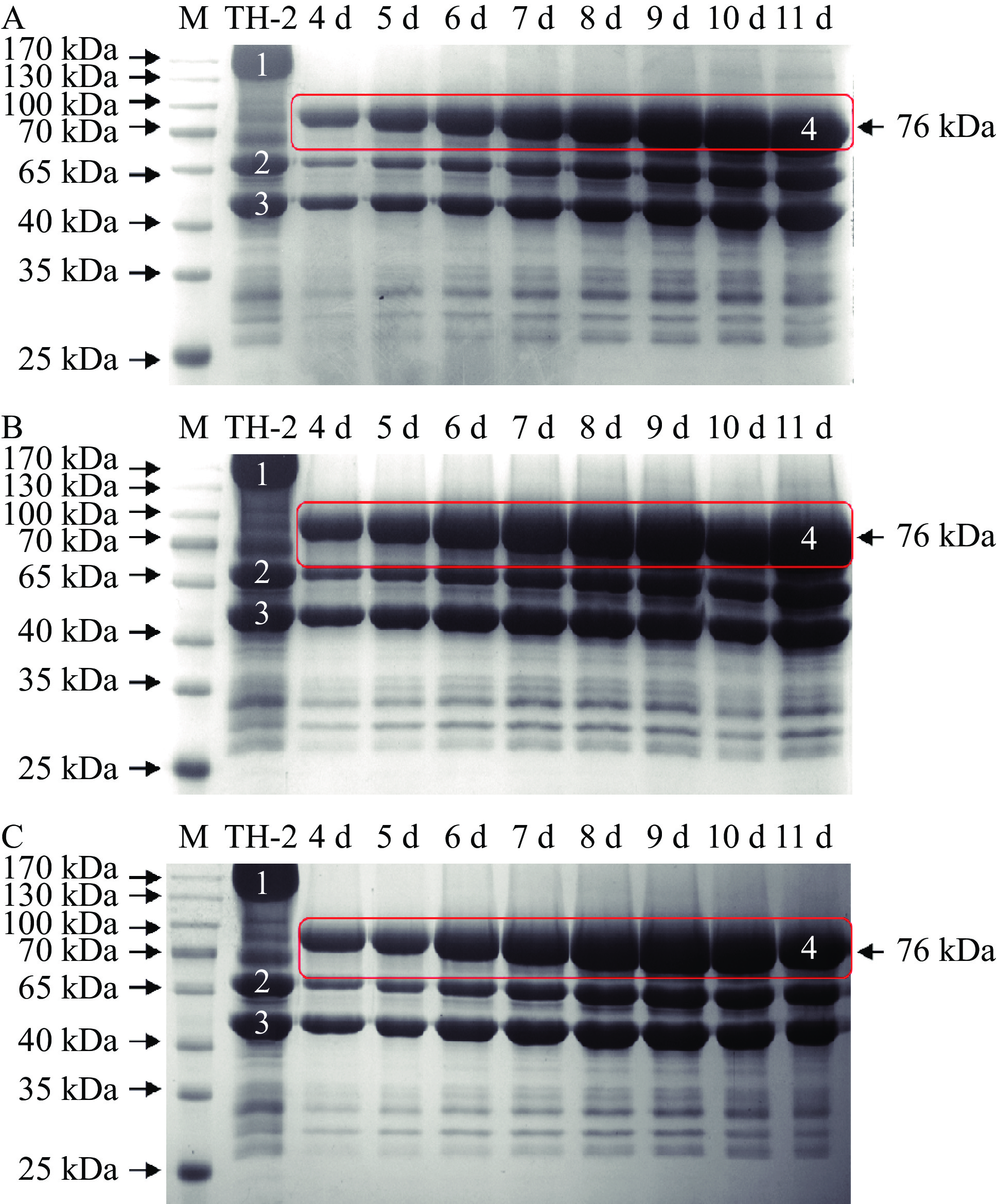
2.4 单宁酶黑曲霉重组菌株A1的SDS-PAGE检测
不改变培养基其他成分的条件下,分别以10%葡萄糖、10%糊精及10%麦芽糖为碳源,按10%接种比例分别将野生型菌株黑曲霉TH-2和单宁酶黑曲霉重组菌株A1进行摇瓶发酵培养,取第4~11 d的发酵上清液进行SDS-PAGE检测,经CalMolWt软件预测,A1蛋白条带大小约为76 kDa,结果如图6所示。实验室前期对野生型菌株黑曲霉TH-2进行转录组测序和分泌蛋白质组测序分析表明,图中位置1为糖化酶,位置2为酸稳定的ɑ-淀粉酶,位置3为ɑ-淀粉酶,本研究将单宁酶基因定点整合到位置1糖化酶基因位点,所以重组菌株失去了糖化酶基因活性,与野生型菌株黑曲霉TH-2相比,在位置4处观察到一条明显的蛋白条带,大小约为76 kDa,与预估值相似,且没有位置1的糖化酶蛋白带,证明重组菌株A1为纯合同源重组菌株。
2.5 单宁酶黑曲霉重组菌株A1的酶活测定
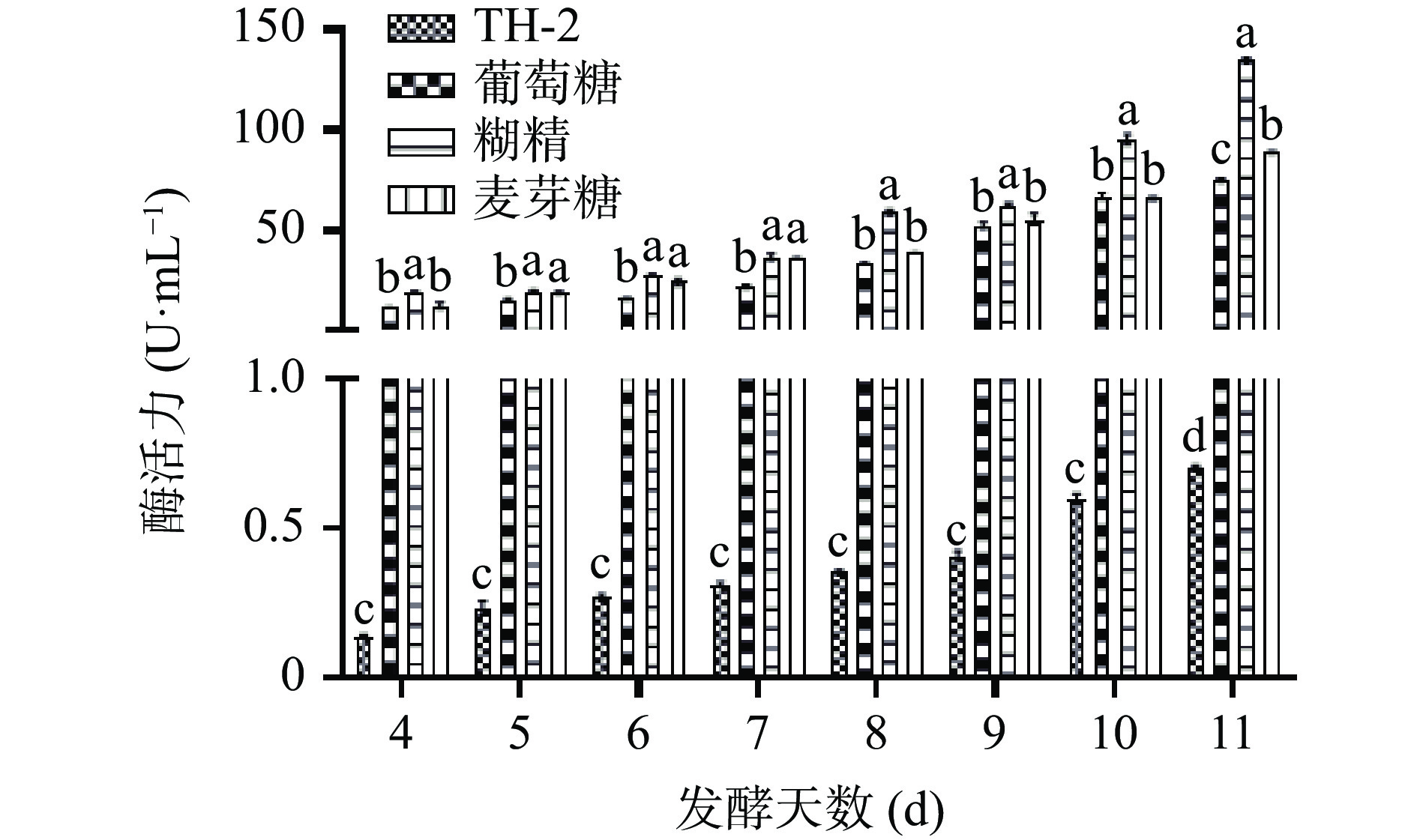
取第4~11 d的发酵上清液进行单宁酶活性检测,野生型菌株A.niger TH-2单宁酶酶活力最高为0.7 U·mL−1。重组菌株A1单宁酶酶活力分别为75.23 U·mL−1(10%葡萄糖),134.36 U·mL−1(10%糊精),88.97 U·mL−1(10%麦芽糖),最高约为野生型菌株的192倍,具有明确的产业化价值。以葡萄糖为基准,碳源为糊精时,单宁酶酶活力提高约78.60%,碳源为麦芽糖时,单宁酶酶活力提高约18.26%,因此,糊精是单宁酶黑曲霉重组菌株A1的最佳碳源,结果如图7所示。
2.6 单宁酶黑曲霉重组菌株A1中单宁酶酶学性质分析
2.6.1 温度对重组酶活性的影响及其稳定性
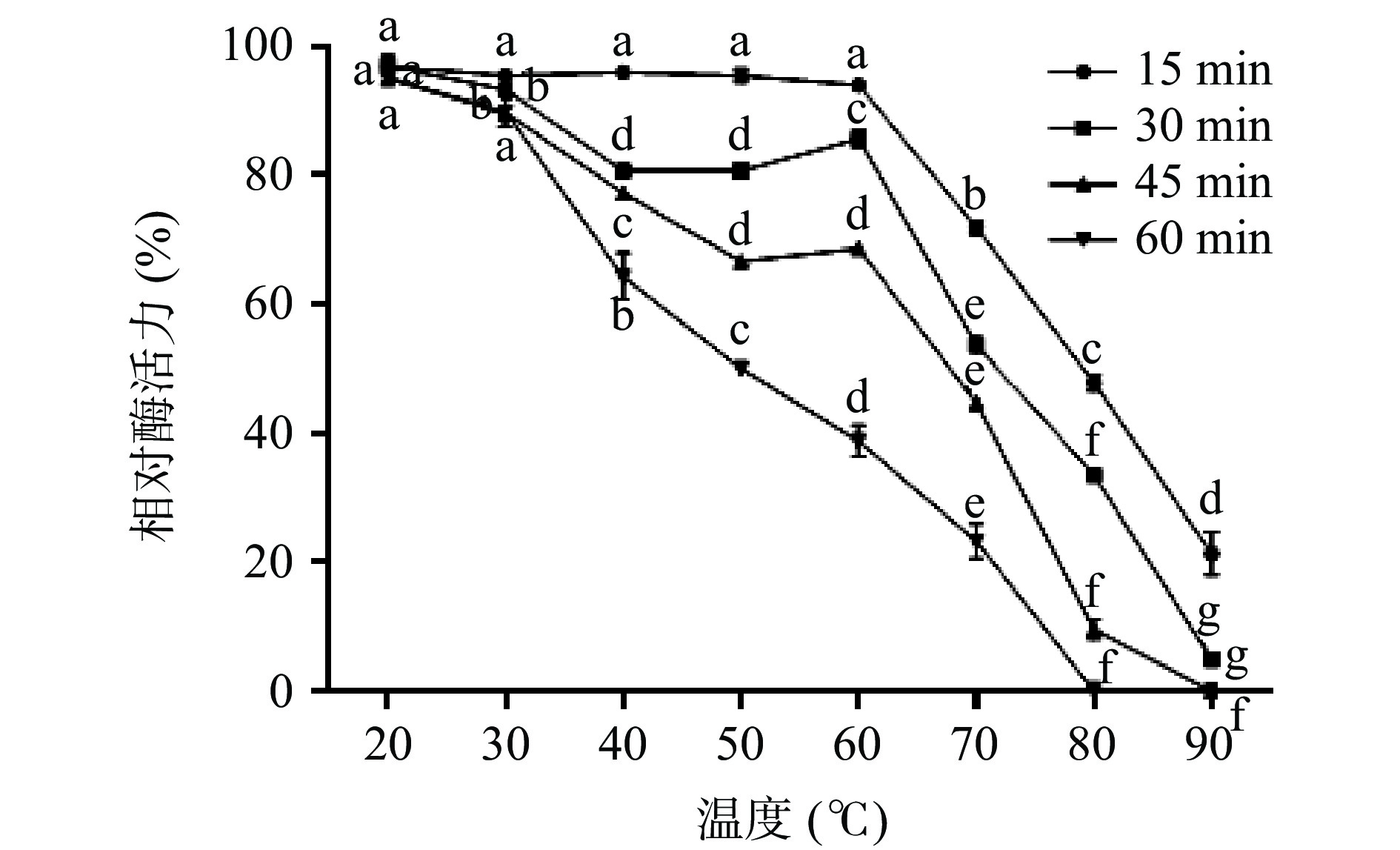
不同温度(20~90 ℃)下,单宁酶的活性变化差异显著,结果如图8所示,当温度处于40~70 ℃范围内时,酶活性相对较高,说明单宁酶适宜的温度范围较广;在50 ℃时,酶活达到最大值。热稳定性结果如图9所示,不同温度(20~90 ℃)条件下处理60 min之后,酶在20~50 ℃范围内相对稳定,残余酶活力仍然在50%以上;60 ℃时残余酶活力维持在40%左右;酶在80~90 ℃范围内时,残余酶活不足10%。
![]() 图 8 不同温度下重组菌株A1的酶活测定结果注:不同小写字母表示差异显著性(P<0.05);图10同。Figure 8. Enzyme activity of recombinant strain A1 at different temperature
图 8 不同温度下重组菌株A1的酶活测定结果注:不同小写字母表示差异显著性(P<0.05);图10同。Figure 8. Enzyme activity of recombinant strain A1 at different temperature2.6.2 pH对重组酶活性的影响及其稳定性
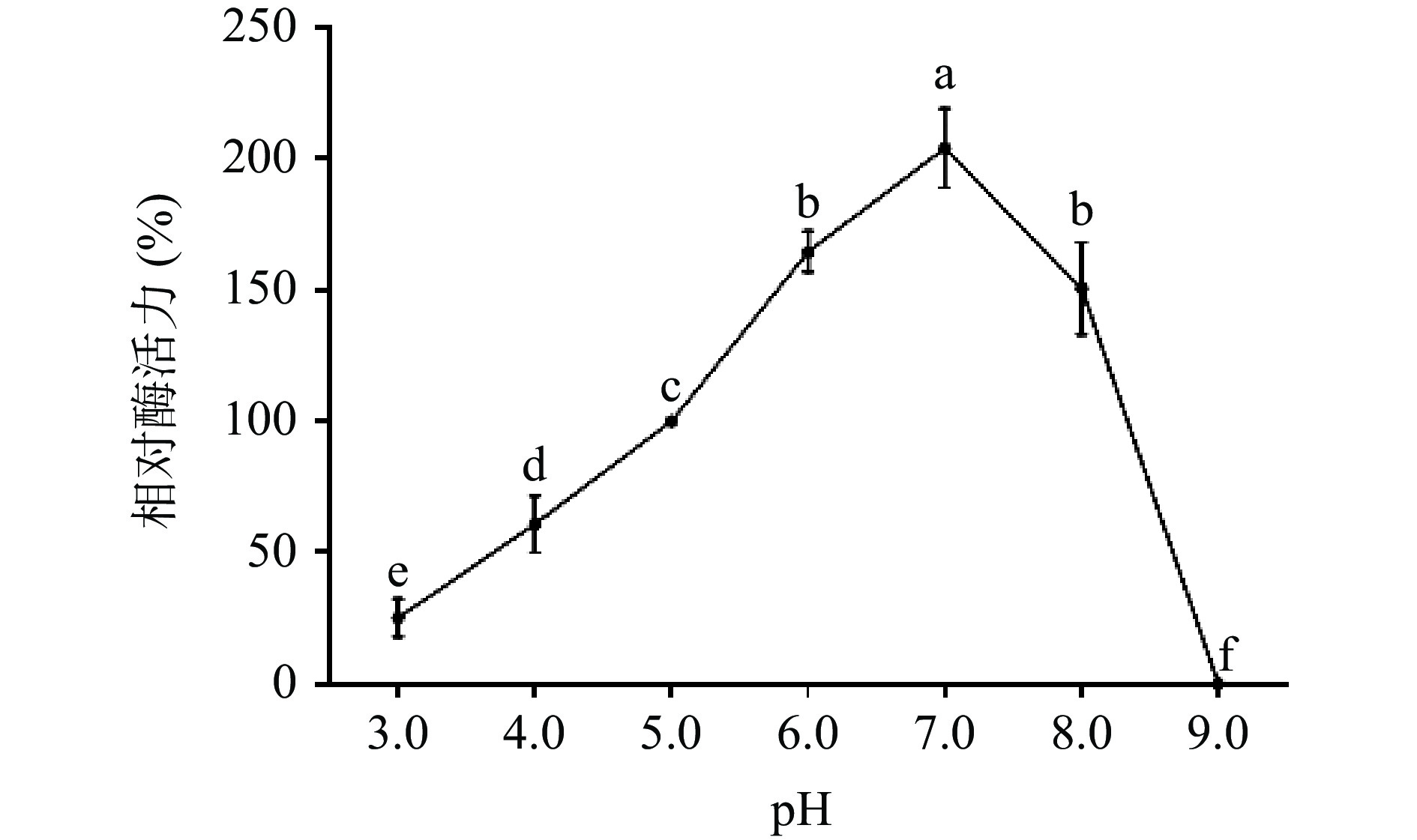
不同pH(pH3.0~9.0)条件下,单宁酶的活性变化差异显著,结果如图10所示。pH在3.0~7.0之间酶活性呈上升趋势,并在7.0时酶活达到最大,说明单宁酶适宜的pH范围较广,pH在7.0~9.0时,其酶活呈现下降趋势。pH稳定性结果如图11所示,结果表明不同pH条件下处理120 min后,酶在pH6.0~8.0条件下,残余酶活总体仍然在50%以上,稳定性相对较高;在pH3.0~5.0条件下,残余酶活在40%左右;在pH在9.0条件下,残余酶活几乎为0。
2.6.3 金属离子和化学试剂对重组酶活性的影响
向重组菌株A1的发酵培养基中加入不同的金属离子和化合物(浓度为5 mmol·L−1),结果如图12所示。其中,检测结果表明,K+和Ca2+对重组菌株A1的酶活力没有影响,Mg2+对重组菌株A1的酶活力有微弱的促进作用,Zn2+对重组菌株A1的酶活力有明显的促进作用,Cu2+和Fe2+对重组菌株A1的酶活力有微弱的抑制作用,Mn2+和化学试剂EDTA对重组菌株A1的酶活力有明显的抑制作用,不同的二价金属离子对酶的作用并不一致,其机理与原因有待进一步研究。
3. 结论
本研究以黑曲霉糖化酶工业生产菌为宿主菌,以内源高表达的glaA基因位点为整合靶位点,并使用内源高表达的glaA六拷贝强启动子PglaA6R和信号肽SglaA,获得单宁酶黑曲霉纯合重组菌株A1,最高酶活为134.36 U·mL−1,约是野生型菌株的192倍,具有明确的产业化价值。获得的重组单宁酶最适作用温度是50 ℃,最适作用pH为7.0。Zn2+对重组酶有明显的促进作用,Mn2+和EDTA对重组酶有明显的抑制作用。未来可进一步通过更换信号肽、基因融合、密码子优化、增加基因拷贝数、优化培养条件及使用蛋白酶缺陷菌株等来提高重组蛋白的产量。通过多重策略的组合使用解除重组蛋白在转录和翻译水平的限制,以期进一步提高单宁酶的表达量,实现单宁酶的工业化生产。
-
图 8 不同温度下重组菌株A1的酶活测定结果
注:不同小写字母表示差异显著性(P<0.05);图10同。
Figure 8. Enzyme activity of recombinant strain A1 at different temperature
表 1 所需引物序列
Table 1 The desired prime sequence
引物名称 引物序列 酶切位点 P1:AnTan-sense TCTAGAGCAACTCCCTCCACGTTG Apa I P2:AnTan-antisense AAGCTTGGATCCTTAGTACACAGGCATAGGAAC Hind III P3:5'GLA-sense TCTAGACTCGGCGACTTGGTCTTCAC Xba I P4:3'GLA-antisense CTCGAGCATAAGGCGGGTTCACATC Xho I -
[1] 吴秀伟. 产单宁酶菌核青霉发酵条件优化及酶学性质研究[D]. 合肥: 安徽农业大学, 2018. WU Xiuwei. Optimization of fermentation conditions and enzymatic properties of penicillium tannin-producing bacteria[D]. Hefei: Anhui Agricultural University, 2018.
[2] GOVINDARAJAN R K, REVATHI S, RAMESHKUMAR N, et al. Microbial tannase: Current perspectives and biotechnological advances[J]. Biocatal Agr Biotechnol,2016,6:168−175. doi: 10.1016/j.bcab.2016.03.011
[3] AOKI K, SHINKE R, NISHIRA H. Purification and some properties of yeast tannase[J]. Agri Biol Chem,1976,40(1):79−85.
[4] 王征, 谢达平, 谭淑宜, 等. 单宁酶的研究与应用[J]. 湖南农业大学学报,1998(4):3−5. [WANG Zheng, XIE Daping, TAN Shuyi, et al. Research and application of tanninase[J]. Journal of Hunan Agricultural University,1998(4):3−5. WANG Zheng, XIE Daping, TAN Shuyi, et al. Research and application of tanninase[J]. Journal of Hunan Agricultural University, 1998 (4): 3-5.
[5] FREUDENBERG K, BLOMMEL F, FRANK T. Tannase II[J]. Physiol Chem,1927,164:262−270. doi: 10.1515/bchm2.1927.164.4-6.262
[6] 保玉心, 黄永光, 李盛, 等. 单宁酶的性质与应用研究进展[J]. 酿酒,2007(5):53−57. [BAO Yuxin, HUANG Yongguang, LI Sheng, et al. Advances in the properties and applications of tanninase[J]. Vintage,2007(5):53−57. BAO Yuxin, HUANG Yongguang, LI Sheng, et al. Advances in the properties and applications of tanninase[J]. Vintage, 2007(5): 53-57.
[7] AI X L, LIU Y Z, ZHUANG J H, et al. Discovery and characterization of tannase genes in plants: Roles in hydrolysis of tannins[J]. New Phytol,2020,226(4):1104−1116. doi: 10.1111/nph.16425
[8] 詹晶晶, 潘虎, 杨辉, 等. 微生物源单宁酶的研究进展[J]. 中国酿造,2020,39(12):15−19. [ZHAN Jingjing, PAN Hu, YANG Hui, et al. Research progress of microbial-derived tanninase[J]. Chinese Brewing,2020,39(12):15−19. ZHAN Jingjing, PAN Hu, YANG Hui, et al. Research progress of microbial-derived tanninase[J]. Chinese brewing, 2020, 39(12): 15-19.
[9] ZHANG S, GAO X, HE L, et al. Novel trends for use of microbial tannases[J]. Preparat Biochem Biotechn,2015,45(3):221−232. doi: 10.1080/10826068.2014.907182
[10] SHAO Y, ZHANG Y H, ZHANG F, et al. Thermostable tannase from Aspergillus niger and its application in the enzymatic extraction of green tea[J]. Molecules,2020,25(4):952. doi: 10.3390/molecules25040952
[11] NI H, CHEN F, JIANG Z D, et al. Biotransformation of tea catechins using Aspergillus niger tannase prepared by solid state fermentation on tea byproduct[J]. LWT-Food Sci Technol,2015,60(2):1206−1213. doi: 10.1016/j.lwt.2014.09.010
[12] RAGHUWANSHI S, MISRA S, SAXENA R K. Enzymatic treatment of black tea (CTC and Kangra Orthodox) using Penicillium charlesii tannase to improve the quality of tea[J]. J Food Process Preservat,2013,37(5):855−863. doi: 10.1111/j.1745-4549.2012.00721.x
[13] 黄蕾, 卢海强, 谷新晰, 等. 嗜热真菌单宁酶的克隆表达及在柿子汁中的应用[J]. 中国食品学报,2020,20(2):120−126. [HUANG Lei, LU Haiqiang, GU Xinchun, et al. Cloning and expression of tannase from Thermophilic fungi and its application in persimmon juice[J]. Chinese Journal of Food,2020,20(2):120−126. HUANG Lei, LU Haiqiang, GU Xinchun, et al. Cloning and expression of tannase from Thermophilic fungi and its application in persimmon juice[J]. Chinese Journal of food, 2020, 20(2): 120-126.
[14] 肖甜甜, 胡娜, 冯子娟, 等. 黑曲霉B1401固态发酵茶叶加工废料产单宁酶的研究[J]. 食品研究与开发,2021,42(6):104−111. [XIAO Tiantian, HU Na, FENG Zijuan, et al. Study on tannase production from tea processing waste by Aspergillus niger B1401 by solid-state fermentation[J]. Food Research and Development,2021,42(6):104−111. XIAO Tiantian, HU Na, FENG zijuan, et al. Study on tannase production from tea processing waste by Aspergillus niger B1401 by solid-state fermentation[J]. Food Research and development, 2021, 42(6) 104-111.
[15] 李淑颖. 单宁降解菌筛选及其降解木本饲料中单宁的研究[D]. 长春: 吉林农业大学, 2017. LI Shuying. Screening of tannin-degrading bacteria and study on the degradation of tannin in woody feedstuff[D]. Changchun: Jilin Agricultural University, 2017.
[16] EBRAHIMZADEH S K, NAVIDSHAD B, FARHOOMAND P, et al. Effects of exogenous tannase enzyme on growth performance, antioxidant status, immune response, gut morphology and intestinal microflora of chicks fed grape pomace[J]. South Afr J Animal Sci,2018,48(1):2−18. doi: 10.4314/sajas.v48i1.2
[17] 董春晓, 张金龙, 郭晓飞, 等. 单宁对反刍动物生产性能、瘤胃发酵及微生物区系影响的研究进展[J]. 畜牧兽医学,2020,51(2):234−242. [DONG Chunxiao, ZHANG Jinlong, GUO Xiaofei, et al. Advances in research on the effects of tannin on Ruminantia performance, rumen fermentation and microbial flora[J]. Animal Husbandry and Veterinary Medicine,2020,51(2):234−242. DONG Chunxiao, ZHANG Jinlong, GUO Xiaofei, et al. Advances in research on the effects of tannin on Ruminantia performance, rumen fermentation and microbial flora[J]. Animal husbandry and veterinary medicine, 2020, 51(2): 234 -242.
[18] 谷新晰, 卢海强, 刘亚娟, 等. 1株产单宁酶嗜热真菌的鉴定、酶学性质分析及碳水化合物活性酶表达[J]. 食品科学,2018,39(18):88−93. [GU Xinchun, LU Haiqiang, LIU Yajuan, et al. dentification and characterization of tannase-producing thermophilic fungus and expression of carbohydrate-active enzyme[J]. Food Science,2018,39(18):88−93. GU Xinchun, LU Haiqiang, LIU Yajuan, et al. dentification and characterization of tannase-producing thermophilic fungus and expression of carbohydrate-active enzyme[J]. Food science, 2018, 39(18): 88-93.
[19] 张帅, 曹庸, 梁晓莹, 等. 黑曲霉N5-5单宁酶的纯化及酶学性质测定[J]. 食品科学,2017,38(6):142−146. [ZHANG Shuai, CAO Yong, LIANG Xiaoying, et al. Purification and characterization of tannase from Aspergillus niger N5-5[J]. Food Science,2017,38(6):142−146. ZHANG Shuai, CAO Yong, LIANG Xiaoying, et al. Purification and characterization of tannase from Aspergillus niger N5-5[J]. Food science, 2017, 38(06): 142-146.
[20] TAKUYA Koseki, KYOTARO Ichikawa, KATSUTO Sasaki, et al. Characterization of a novel Aspergillus oryzae tannase expressed in Pichia pastoris[J]. Journal of Bioscience and Bioengineering,2018,126(5):553−558. doi: 10.1016/j.jbiosc.2018.05.010
[21] 王喆丽. 微生物源单宁酶的发酵条件优化、性质研究及应用初探[D]. 秦皇岛: 燕山大学, 2019. WANG Zheli. Optimization of fermentation conditions, properties and application of microbial tannase[D]. Qinhuangdao: Yanshan University, 2019.
[22] 林健辉, 黄曼曼, 陈雪香, 等. 曲霉T3-5-1产单宁酶培养条件优化[J]. 食品科学,2010,31(19):245−249. [LIN Jianhui, HUANG Manman, CHEN Xuexiang, et al. Optimization of tanninase production conditions of Aspergillus T3-5-1[J]. Food Science,2010,31(19):245−249. LIN Jianhui, HUANG Manman, CHEN Xuexiang, et al. Optimization of tanninase production conditions of Aspergillus T3-5-1[J]. Food Science, 2010, 31(19): 245-249.
[23] 徐璐, 班燕宁, 陈琼丽, 等. 高活性单宁酶产生菌黑曲霉的筛选与发酵条件优化[J]. 甘肃科技,2019,35(17):66−69. [XU Lu, BAN Yanning, CHEN Qiongli, et al. Screening of high activity tannase-producing strain Aspergillus niger and optimization of fermentation conditions[J]. Gansu Science and Technology,2019,35(17):66−69. XU Lu, BAN Yanning, CHEN Qiongli, et al. Screening of high activity tannase-producing strain Aspergillus niger and optimization of fermentation conditions[J]. Gansu science and technology, 2019, 35(17): 66-69.
[24] FRISVAD J C, MOLLER L L H, LARSEN T O, et al. Safety of the fungal workhorses of industrial biotechnology: Update on the mycotoxin and secondary metabolite potential of Aspergillus niger, Aspergillus oryzae, and Trichoderma reesei[J]. Appl Microbiol Biotechnol,2018,102:9481−9515. doi: 10.1007/s00253-018-9354-1
[25] HAB Wösten. Filamentous fungi for the production of enzymes, chemicals and materials[J]. Current Opinion in Biotechnology,2019,59:65−70. doi: 10.1016/j.copbio.2019.02.010
[26] 保玉心, 邱树毅, 李秧针, 等. 一种胞外单宁酶的活力检测方法[J]. 精加工,2008(6):621−624. [BAO Yuxin, QIU Shuyi, LI Yangzhu, et al. A method for detecting the activity of extracellular tannins[J]. Finishing,2008(6):621−624. BAO Yuxin, QIU Shuyi, LI Yangzhu, et al. A method for detecting the activity of extracellular tannins[J]. Finishing, 008(6): 621-624.
[27] 阚新意. 茶树单宁酶的理化性质及其在茶叶加工中的应用[D]. 合肥: 安徽农业大学, 2020. KAN X Y. Physical and chemical properties of tannase from tea plant and its application in tea processing[D]. Hefei: Anhui Agricultural University, 2020.
-
期刊类型引用(1)
1. 蔡梦婷,刘荔,黄若楠,孙学宁,曾名湧. 亲水胶体调控全牡蛎-大豆分离蛋白热诱导凝胶的形成机制. 食品工业科技. 2024(23): 129-139 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:


 下载:
下载:



