Optimization and Analysis of Physicochemical Properties of Protein Extraction from Flax Seed by Nitrogen-Assisted Positive Pressure Cavitation
-
摘要: 以脱壳火麻仁粉为原料,通入氮气产生正压空化作用,实现加快蛋白质提取速率的效果。以蛋白质的得率为评价指标,将单因素实验和响应面试验相结合,探究了pH、温度、时间、料液比和通气量对蛋白质提取率的影响。结果表明,氮气辅助正压空化提取火麻仁蛋白质的最优工艺条件为:料液比为1:50(g/mL),pH为12,提取温度为52 ℃,提取时间为50 min,氮气通气量1.6 L/min,在此条件下,蛋白质得率为76.03%±1.64%。明显高于同等条件下的磁力搅拌法56.32%。比较了4种方法(正压碱溶、磁力碱溶、正压酶解、磁力酶解)提取火麻仁蛋白的理化性质,发现磁力碱溶法的蛋白的起泡性与持油性最强,分别为145%、246%;4种方法的持水性与乳化性差别不大。比较了4种提取方法的蛋白质变性温度,正压碱溶法的蛋白质变性的终止温度为105.5 ℃,比其他3种方法提高了4~13 ℃。正压酶解处理的火麻仁蛋白含有17种氨基酸,EAA/TAA得分接近40%,十分符合FAO/WHO对于优质蛋白质的推荐值。实验表明氮气辅助正压空化对于可以提高火麻仁蛋白的提取速率,并且具有良好的理化性质。Abstract: Using hulled hemp seed powder as raw material, nitrogen was introduced to produce positive pressure cavitation, which realized the effect of accelerating the protein extraction rate. Taking the yield of protein as the evaluation index, the effects of pH, temperature, time, material-liquid ratio and aeration on protein extraction rate were explored by combining univariate test and response surface test. Results showed that, the optimal process conditions for nitrogen-assisted positive pressure cavitation extraction of hemp seed protein were as follows: The material-liquid ratio was 1:50 (g/mL), the pH was 12, the extraction temperature was 52 °C, the extraction time was 50 min, and the nitrogen ventilation was 1.6 L/min, under these conditions, the protein yield was 76.03%±1.64%. It was significantly higher than the magnetic stirring method under the same conditions by 56.32%. The physicochemical properties of hemp seed protein extracted by four methods (positive pressure alkaline solubility, magnetic alkaline solubility, positive pressure enzymatic hydrolysis, and magnetic enzymatic hydrolysis) were compared, and the results showed that the foaming and oil-holding properties of the proteins by magnetic alkalinity solution method were the strongest, 145% and 246%, respectively. There was little difference between water holding capacity and emulsification of the four methods. The protein denaturation temperature of the four extraction methods was compared, and the termination temperature of protein denaturation of the positive pressure alkaline solution method was 105.5 ℃, which was 4~13 ℃ higher than the other three methods. Hemp seed protein treated by positive pressure enzymatic hydrolysis contains 17 amino acids and an EAA/TAA score of nearly 40%, which was very in line with the FAO/WHO recommendation for high-quality protein. Experiments showed that nitrogen-assisted positive pressure cavitation could increase the extraction rate of hemp seed protein and had good physicochemical properties.
-
火麻仁蛋白含大量的必需氨基酸[1],氨基酸比例合理,36.4 g/100 g总蛋白含量和黄豆相当[2]。蛋白质中65%为麻仁球蛋白,35%为白蛋白[3],麻仁球蛋白有很好的促进消化功能,白蛋白能有效的增强身体免疫力[4]。精氨酸和组氨酸含量分别高达123和27 mg/g[5],这两种氨基酸对儿童成长非常重要。因此火麻仁可以作为一种十分优异的植物蛋白质的新来源[6],本文对其进行进一步的开发和利用。
常规的蛋白提取方法如碱溶-酸沉[7]、酶解[8]、有机溶液提取[9]等,耗时较长,且提取率不高。碱溶-酸沉法优点是提取较为完全,但是当碱性过高时,颜色会产生变化,且气味难闻,不利于后期的开发利用。酶解法[8]提取速度较碱溶-酸沉法快,但是灭酶过程中,会破坏蛋白质结构。有机溶剂提取法使用范围比较小,不适用于植物蛋白的提取。空化效应是一种发生在液体介质中的剧烈的物理现象,Yang等[10]通过涡流空化技术使大豆分离蛋白粒径减小,溶解度和表面疏水性增加,乳化性得到显著改善。本文以火麻仁为原料,采用正压空化-碱溶酸沉复合法提取火麻仁蛋白。探究碱溶pH、通气量、料液比、温度、时间对提取的影响。通过单因素实验和响应面设计,确定最佳的提取条件并验证正压空化-碱溶酸沉复合法在火麻仁蛋白提取上的可行性。
1. 材料与方法
1.1 材料与仪器
火麻仁 购自广西巴马;结晶牛血清蛋白、考马斯亮蓝G250、硫酸铜、硫酸钾、氢氧化钠、过氧化氢、无水乙醇、磷酸氢二钾、磷酸二氢钾、甲基红、溴甲酚绿、浓硫酸等 均为分析纯,购自上海阿拉丁试剂有限公司。
Cubis® II分析天平 赛多利斯科学仪器(北京)有限公司;FA1204B电子天平 余姚市纪铭称重校验设备有限公司;移液枪 上海嘉安分析仪器厂;721N型可见光分光光度计 上海仪电分析仪器有限公司;RE-2000B型旋转蒸发仪 上海亚荣生化仪器厂;DF-Ⅱ型集热式磁力搅拌器、HH-1数显恒温水浴锅 金坛市杰瑞尔电器有限公司;粉碎机 永康市小宝电器有限公司;PHS-25型数显pH计 上海精密科学仪器股份有限公司;SKD-100型全自动凯氏定氮仪 上海沛欧分析仪器有限公司。
1.2 实验方法
1.2.1 火麻仁预处理
以脱壳火麻仁为原料,使用料液比为1:2(g/mL)的石油醚对脱壳火麻仁进行脱脂,脱脂3~4次,每次24 h,然后倒出石油醚,随后通风处常温挥发,在50 ℃的烘箱中干燥6 h,再用高速粉碎机粉碎,过60目筛密封备用。
1.2.2 火麻仁糟粕提取蛋白液的工艺
准确称取5.00 g火麻仁粉,以pH、通气量、料液比、温度、时间为影响因素。碱提后在4500 r/min离心20 min,取上清液稀释适当倍数,按考马斯亮蓝法测定蛋白质含量。重复试验3次。对照试验为不通氮气,改为磁力搅拌,其他条件一致。
火麻仁蛋白提取工艺的优化通过单因素实验和响应面试验,确定最佳火麻仁蛋白提取工艺。单因素实验通过改变pH、通气量、料液比、温度、时间为影响因素。
1.2.2.1 碱溶pH对蛋白提取率的影响
在提取溶剂为蒸馏水,通气量:2 L/min,提取温度:50 ℃,提取时间:40 min,料液比:1:50 g/mL的条件下,探究不同pH(11.0、11.5、12.0、12.5、13.0、13.5)对火麻仁蛋白提取率的影响。
1.2.2.2 通气量对蛋白提取率的影响
在提取溶剂为蒸馏水,pH12.0,提取温度:50 ℃,提取时间:40 min,料液比:1:50 g/mL的条件下,探究不同通气量(1.0、1.5、2.0、2.5、3.0、3.5、4.0 L/min)对火麻仁蛋白提取率的影响。
1.2.2.3 料液比对蛋白提取率的影响
在提取溶剂为蒸馏水,pH12.0,提取温度:50 ℃,提取时间:40 min,通气量:2 L/min的条件下,探究不同料液比(1:20、1:30、1:40、1:50、1:60、1:70 g/mL)对火麻仁蛋白提取率的影响。
1.2.2.4 碱提温度对蛋白提取率的影响
在提取溶剂为蒸馏水,pH12.0,料液比:1:50 g/mL,提取时间:40 min,通气量:2 L/min的条件下,探究不同提取温度(30、35、40、45、50、55、60 ℃)对火麻仁蛋白提取率的影响。
1.2.2.5 响应面优化
测试不同提取条件的提取率。在单因素实验的基础上,将碱液pH、通气量、料液比、提取温度、提取时间作为响应面分析的实验因素,从而得出最佳蛋白提取率的条件。设计5因素3水平响应面试验,运用Design-expert 8.0.6.1软件进行数据统计分析,编码及因素水平见表1。
表 1 响应面试验因素水平设计Table 1. Response surface test factor level table水平 因素 A
pHB 通气量
(L/min)C 料液比
(g/mL)D 温度
(℃)E 时间
(min)−1 11.5 1 40 45 30 0 12 2 50 50 40 1 12.5 3 60 55 50 1.2.3 火麻仁蛋白提取率的测定
火麻仁蛋白采用四种方法(正压碱溶、磁力碱溶、正压酶解、磁力酶解)提取,正压碱溶采用料液比为1:50(g/mL),pH为12,提取温度为52 ℃,提取时间为50 min,氮气通气量1.6 L/min提取条件;磁力碱溶采用采用料液比为1:50(g/mL),pH为12,提取温度为52 ℃,提取时间为50 min,氮气通气量1.6 L/min提取条件;磁力碱溶采用料液比为1:50(g/mL),pH为12,提取温度为52 ℃,提取时间为50 min,磁力搅拌1.5 h提取条件;正压酶解采用料液比为1:50(g/mL),pH为12,提取温度为52 ℃,提取时间为50 min,氮气通气量1.6 L/min提取条件;正压酶解采用料液比为1:50(g/mL),pH为12,提取温度为52 ℃,提取时间为50 min,氮气通气量1.6 L/min,上清液用pH4.8稀盐酸进行酸沉蛋白;磁力酶解采用料液比为1:50(g/mL),pH为12,提取温度为52 ℃,提取时间为50 min,氮气通气量1.6 L/min,磁力搅拌1.5 h后上清液用pH4.8稀盐酸进行酸沉蛋白。
火麻仁蛋白提取率的计算见公式(1)。利用自动凯氏定氮法[11]测定火麻仁粉末中的总蛋白的含量(g),其蛋白系数为5.71。利用考马斯亮蓝法测定蛋白提取液中的蛋白质含量(g)。
蛋白提取率(%)=C提取液×N×V/10005×W×100 (1) 式中:C提取液:由吸光度标曲可得的提取液中蛋白浓度;N:稀释倍数:20倍;V:提取液的体积,mL;W:火麻仁粉末中蛋白质含量:56.19%。
1.2.4 火麻仁粗蛋白的颗粒形状观察
将冷冻干燥完全的火麻仁蛋白粉,在研钵上进行充分的研磨。取少量样品,采用扫描电镜进行观察。依次放大倍数至1000倍,采样,观察粗蛋白颗粒形状与结构。
1.2.5 蛋白特性测定
1.2.5.1 溶解度的测定
依照文献[12]并加以改动。取20 mg火麻仁蛋白,溶解于10 mL 0.2% KOH溶液中,24000 r/min均质1.5 min后,静置30 min,4000 r/min离心5 min取上清液。取3 mL上清液加3 mL双缩脲试剂,在540 nm处测吸光度,记为AD。另取20 mg火麻仁蛋白,溶解于10 mL PBS缓冲溶液(加入适量氯化钠、蔗糖)中,24000 r/min均质1.5 min后,静置30 min,4000 r/min离心5 min取上清液。取3 mL上清液加3 mL双缩脲试剂,在540 nm处测吸光度,记为AC。蛋白溶解度能力用公式(2)来计算。改变磷酸缓冲溶液的pH、氯化钠浓度、蔗糖浓度和温度,探索不同条件的改变对蛋白溶解能力的影响。
蛋白溶解性(%)=ADAC×100 (2) 1.2.5.2 泡沫特性的测定
参照文献[13]的方法并加以改进。用pH8.0 PBS缓冲溶液,配制1%的蛋白分散液。取10 mL室温下,用高速分散机12000 r/min均质2 min,记下体积V1。按公式(3)计算起泡性。
起泡性(AF)=V110×100 (3) 1.2.5.3 乳化性的测定
采用浊度法来测定火麻仁蛋白的乳化性,用pH7.0 PBS缓冲溶液,配制成0.25%的蛋白溶液。取2 mL玉米食用油和6 mL 0.25%的蛋白溶液,12000 r/min均质2 min。将均质后的乳液,置于80 ℃的水浴中加热30 min后取出,按上述方法测定吸光度(AT),按公式(4)计算乳化性。
ES(%)=ATA×100 (4) 1.2.5.4 持水性测定
准确称取0.1000 g蛋白样品于10 mL离心管中,加入5 mL混合液(pH7.0 PBS缓冲溶液,添加适量氯化钠和蔗糖)。充分混匀,3000 r/min下离心15 min,小心去除上清液,称量离心管和沉淀的质量。按公式(5)计算持水性[14](water holding,WH)。
WH(%)=C−A−BB×100 (5) 式中:A:离心管重量,g;B:蛋白粉重量,g;C:离心管和沉淀的质量,g。
1.2.5.5 持油性测定
准确称取0.1000 g蛋白样品于10 mL离心管中,加入2 mL玉米食用油。充分混匀,室温下静置1 h后,3500 r/min下离心15 min,小心去除上清液,10 min后称量离心管和沉淀的质量。按公式(6)计算持油性[15](fat absorption,FA)。
FA(%)=C−A−BB×100 (6) 式中:A:离心管重量,g;B:蛋白粉重量,g;C:离心管和沉淀的质量,g。
1.2.5.6 热特性测定
采用差示扫描量热仪(DSC),分别称取2 mg不同方法制备的火麻仁蛋白,置于铝盒中密封。测试条件为:氮气流速20 mL/min,扫描范围30~120 ℃、升温速率10 ℃/min。对4种方法提取的蛋白进行热稳定分析[16]。
1.2.6 氨基酸组成分析
样品的前处理:蛋白质过60目筛,称取含25 mg纯蛋白的粗蛋白于水解管中。加入10 mL 6 mol/L的HCl溶液,用液氮冷冻,待凝固后,抽真空,并在真空状态下进行封口,将真空封口的水解管在110 ℃的烘箱中水解24 h后,取出冷却,并用去离子水定容,将定容后的溶液进行旋转蒸发(温度低于60 ℃),蒸发至干,再加入适量0.02 mol/L的HCl溶液在空气中放置30 min,过0.22 μm滤膜后,上机,测定组成及含量[17]。
1.3 数据处理
各组实验都重复测定3次,取平均值。利用Design Expert 8.0.6.0响应面软件进行实验设计。利用 Origin Pro9.0 软件进行绘图。
2. 结果与分析
2.1 不同反应条件对火麻仁蛋白提取率的影响
2.1.1 碱溶pH对蛋白提取率的影响
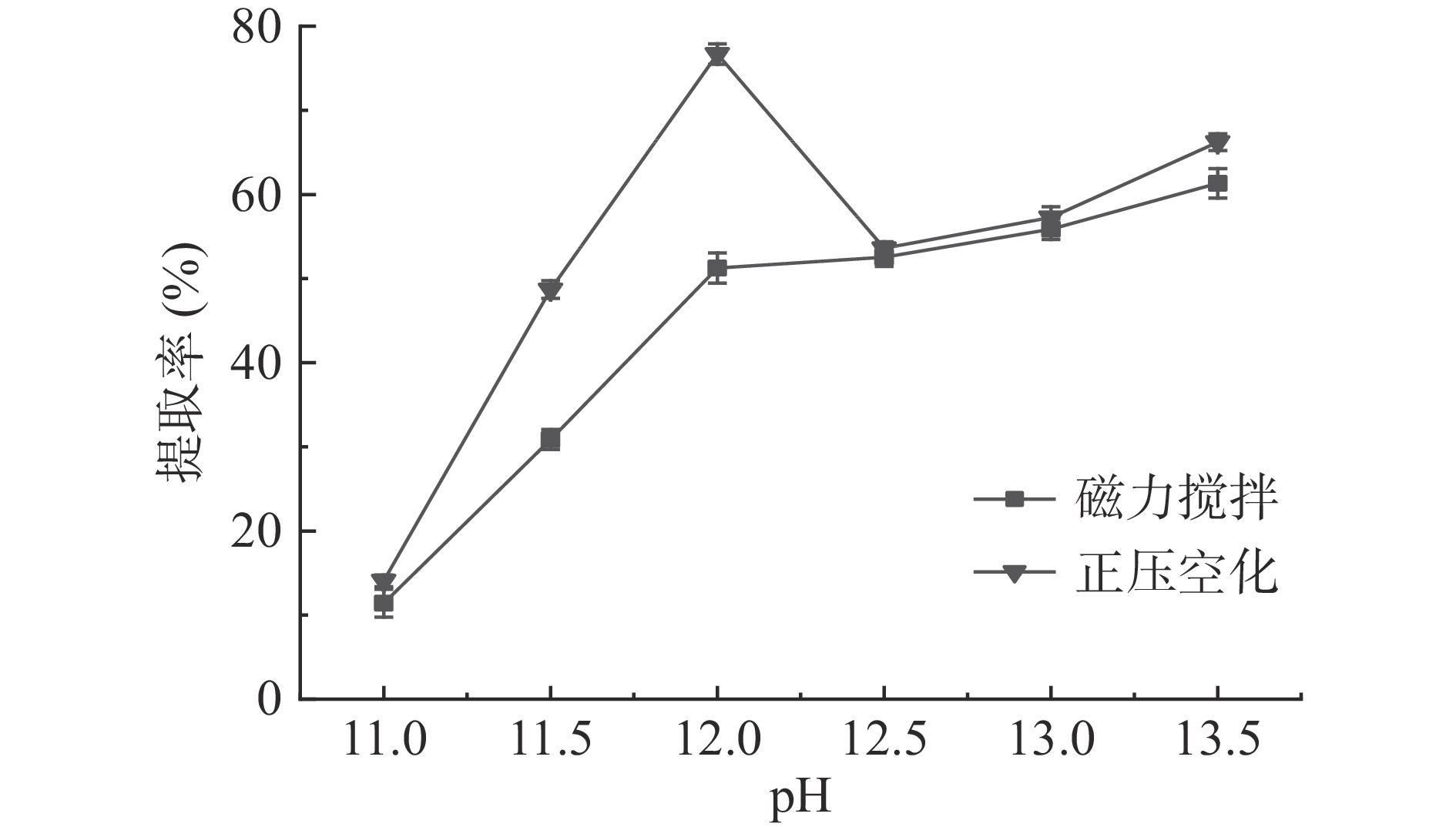
如图1所示。当pH在11.0~12.0时,蛋白质的提取率随碱液pH的增加而增加,pH12.0时,提取率最高,但当碱液pH大于12时,提取率反而有所下降,继续提高pH,提取率又有所上升,但是提取液颜色由之前的奶白色变为灰白色且气味难闻,不利于后期的开发利用。磁力搅拌法随pH的增大,提取率呈上升趋势,pH在11~12期间,提取率上升幅度比较大,大于12之后,上升趋势趋于平缓。正压空化法优于磁力搅拌法,两者在pH12时,正压空化提取率为77.62%,磁力搅拌为50.12%,差值为27.5%,所以选择pH12为后期实验提取液的pH。
2.1.2 通气量对蛋白提取率的影响
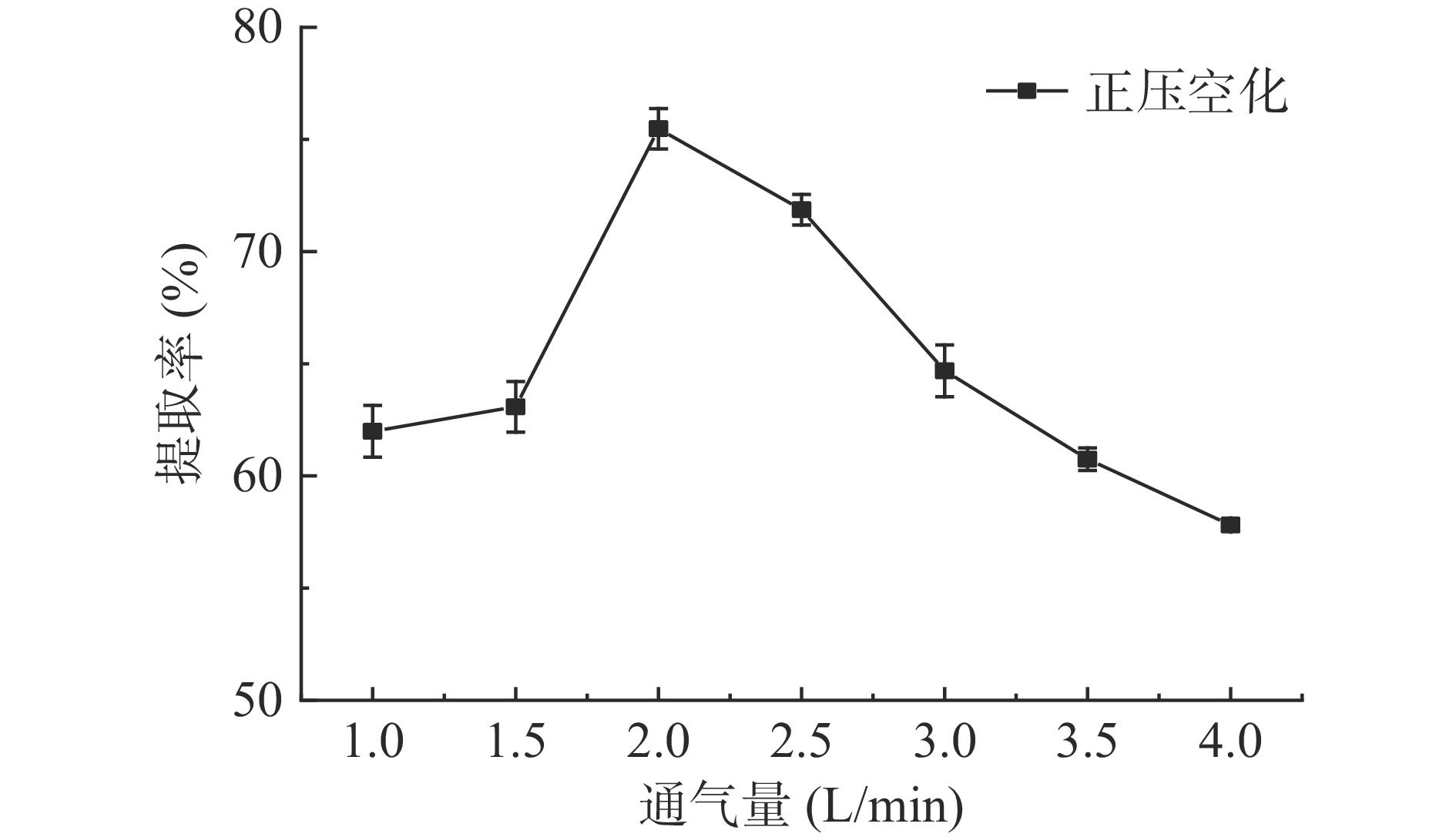
如图2所示。提取率随通气量的增加,先上升再下降,在通气量为2 L/min时,达到最大值为75.54%,当通气量大于2 L/min时,开始快速下降。通气量在1~1.5 L/min时,通入气体较少,反应罐内的空化作用和涌动作用不明显,所以,提取率较低。当通气量为2 L/min时,通入的气体刚好使罐内提取液充分上下涌动,且剧烈的空化作用打破植物外壁,加速蛋白的提取[18]。当通气量大于2 L/min时,提取液反应过于剧烈,而且水的表面张力较大,过量细小气体会产生过多气泡。火麻仁粉会附着在气泡上,逐渐往上溢出,涌入回流瓶,不利于反应持续进行。综合考虑,选择2 L/min为后期实验通气量。
2.1.3 料液比对蛋白提取率的影响
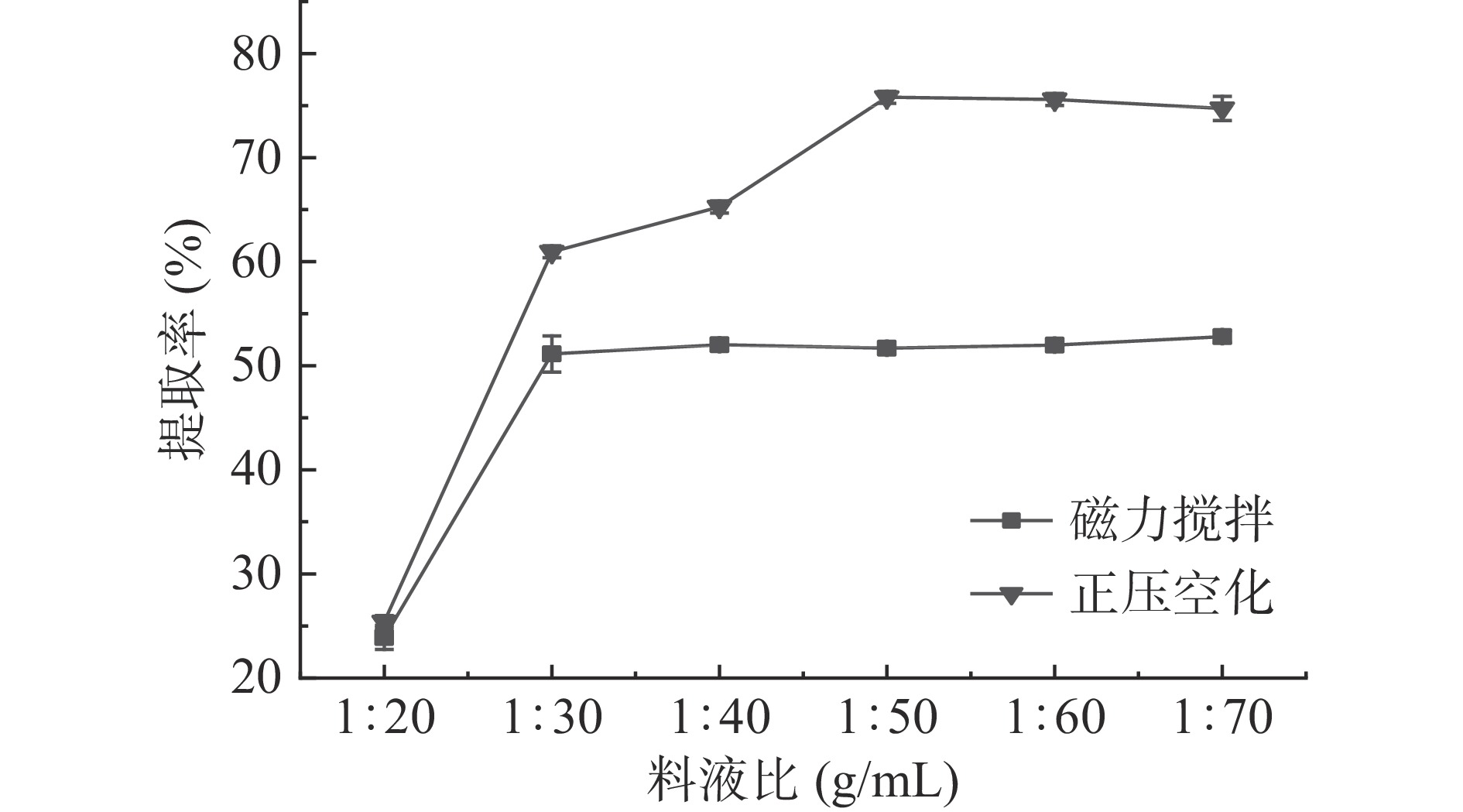
如图3所示,正压空化法提取率随着料液比的增大先逐渐提高后再趋于平稳,料液比在1:20~1:50(g/mL)期间,提取率呈现上升的趋势,在1:50(g/mL)时达到最高点为76.13%,再添加提取溶剂,提取率也不会有明显的上升。原因是当提取溶剂较少时,火麻仁蛋白不能完全从火麻仁粉中析出,且较少的提取溶剂不利于液体上下涌动,加快反应。随着提取溶剂的增加,气体产生的空化作用和涌动作用明显,加速蛋白的析出,所以提取率上升。当提取溶剂的比例增加到了一定程度后,两相体系接触程度最大化,蛋白含量达到饱和,不再继续增加,因此提取率趋于平缓[19]。磁力搅拌法的提取率变化趋势与正压空化法一致,料液比在1:20~1:30(g/mL)时,快速上升,后趋于平缓。整体而言,正压空化法优于磁力搅拌法,两者在1:50(g/mL)时,正压空化为76.13%,磁力搅拌为51.36%,有最大差值为24.77%,所以选取1:50(g/mL)为后续实验的料液比。
2.1.4 碱提温度对蛋白提取率的影响
如图4所示,正压空化法对温度的敏感性较高。当温度在30~35 ℃时,提取率较低,在53%左右。随着温度的提升,提取率逐渐提高,40~45 ℃时,提取率在68%左右。当温度升至50 ℃时,提取率达到最大值为75.69%。再升高温度,提取率反而有所下降。原因是:温度较低时,分子运动不剧烈,不利于蛋白分子析出。提升温度,加速分子运动,使一些难溶于水的蛋白质溶解于水中,增加蛋白的溶解性,同时削弱了溶剂分子之间的相互作用,从而提高蛋白的提取率[20]。当温度大于50 ℃时,影响蛋白和水分子之间的相互作用,使蛋白溶解度降低,同时,一些热不稳定的蛋白质会变性,导致提取率下降。所以选取50 ℃为后续实验的提取温度。
2.1.5 碱提时间对蛋白提取率的影响
如图5所示,正压空化法在较短的时间内,就可以达到较高的提取率。提取10 min,即可达到60.32%,相比磁力搅拌法,在60 min,达到54.32%。采用正压空化法,在提取40 min后即可达到最大值77.32%。继续延长时间,会使已溶解的蛋白质发生结构变化[21],部分基团的水化层被破坏,使原来连接好的蛋白质分子又被剥离水分子,导致提取率的降低。且时间过长,反应罐内气泡会过多,会使部分物质得不到充分反应。因此,提取40 min最佳。
2.2 火麻仁蛋白提取条件优化
2.2.1 响应面法优化火麻仁蛋白提取工艺
按照Box-Behnken实验方案进行5因素3水平实验,实验数据为三次实验的平均值,结果见表2。利用Design Expert8.0.6.1响应面软件进行回归分析,得到蛋白质提取率对pH(A)、通气量(B)、料液比(C)、提取温度(D)、提取时间(E)五因素的二次多项回归方程:Y(%)=75.57+3.92A−1.61B+2.63C+1.90D+1.92E−2.28AB−5.65AC−3.44AD+4.17AE−1.73BC−0.71BD−2.07BE−0.98CD−2.97CE+0.83DE−22.51A2−4.30B2−1.77C2−3.51D2−2.37E2。
表 2 提取率的中心复合试验响应值Table 2. Central composite test response value of extraction rate实验号 因素 提取率
(%)A pH B通气量
(L/min)C料液比
(g/mL)D温度
(℃)E时间
(min)1 12 1 50 50 50 73.38 2 11.5 1 50 50 40 46.36 3 11.5 2 40 50 40 36.65 4 12 2 50 50 40 75.60 5 12.5 1 50 50 40 59.51 6 12.5 2 60 50 40 53.14 7 12 2 60 50 50 70.87 8 12.5 3 50 50 40 48.28 9 12.5 2 50 50 30 45.22 10 12 2 40 50 50 74.57 11 12 2 50 45 30 69.99 12 12 2 50 50 40 78.13 13 11.5 2 60 50 40 55.74 14 12 3 60 50 40 68.50 15 12 2 60 50 30 74.11 16 11.5 2 50 50 50 45.83 17 12 3 50 50 30 69.01 18 12 1 40 50 40 68.46 19 12 3 50 45 40 65.58 20 12 3 40 50 40 68.30 21 12 1 50 55 40 67.76 22 12 2 50 50 40 76.03 23 11.5 2 50 45 40 38.60 24 12 1 50 45 40 66.01 25 12 2 50 55 50 72.70 26 12 2 40 50 30 65.92 27 12 2 50 50 40 73.47 28 12 2 50 55 30 69.85 29 11.5 2 50 50 30 46.34 30 12.5 2 50 45 40 52.36 31 12 2 50 50 40 75.75 32 12 2 40 45 40 64.00 33 12.5 2 50 55 40 55.42 34 12 2 50 45 50 69.53 35 12 2 50 50 40 74.41 36 12.5 2 50 50 50 61.38 37 12 1 60 50 40 75.60 38 12 3 50 55 40 64.50 39 12 2 40 55 40 69.37 40 12.5 2 40 50 40 56.65 41 12 1 50 50 30 65.58 42 12 3 50 50 50 68.54 43 12 2 60 55 40 74.76 44 11.5 2 50 55 40 55.42 45 11.5 3 50 50 40 44.26 46 12 2 60 45 40 73.31 对模型进行方差分析,结果见表3。从表3中可以看出:R2=0.9707,R2Adj=0.9473,说明该模型线性拟合较好,能够反应94.73%响应值的变化。同时,回归模型达到极显著的水平(P<0.0001),且失拟项不显著(P>0.05),模型与实际情况较为吻合,误差较小,可用该模型对实验结果进行分析。各因素的影响大小为:pH>料液比>提取时间>提取温度>通气量。
表 3 回归方程及方差分析Table 3. Regression equation and analysis of variance方差来源 平方和 自由度 均方 F值 Pr>F 显著性 模型 5548.27 20 277.41 41.45 <0.0001 ** A 246.18 1 246.18 36.79 <0.0001 ** B 41.25 1 41.25 6.16 0.0201 * C 110.83 1 110.83 16.56 0.0004 * D 57.76 1 57.76 8.63 0.007 * E 59.21 1 59.21 8.85 0.0064 * AB 20.84 1 20.84 3.11 0.0898 AC 127.69 1 127.69 19.08 0.0002 * AD 47.33 1 47.33 7.07 0.0135 * AE 69.47 1 69.47 10.38 0.0035 * BC 12.04 1 12.04 1.8 0.1919 BD 2 1 2 0.3 0.5892 BE 17.1 1 17.1 2.55 0.1225 CD 3.84 1 3.84 0.57 0.4557 CE 35.34 1 35.34 5.28 0.0302 * DE 2.74 1 2.74 0.41 0.5281 A2 4420.47 1 4420.47 660.55 <0.0001 ** B2 161.37 1 161.37 24.11 <0.0001 ** C2 27.44 1 27.44 4.1 0.0537 D2 107.27 1 107.27 16.03 0.0005 * E2 48.92 1 48.92 7.31 0.0122 * 残差 167.3 25 6.69 失拟项 154.75 20 7.74 3.08 0.1077 不显著 纯误差 12.55 5 2.51 总和 5715.57 45 R2=0.9707 R2Adj=0.9473 注:**表示P<0.001,差异极显著;*表示P<0.05,差异显著。 2.2.2 交互作用分析
从响应面图可知:从外到内,颜色逐渐变深且呈椭圆形,颜色变化越大,表明三维图中坡度越陡。如图6所示,5个因素交互作用响应面中心呈椭圆形,说明各个因素交互作用明显。颜色最深处(椭圆中心)即为提取率最高的点。因此选取pH为12.11、通气量为1.55 L/min、料液比为1:46.78(g/mL)、提取温度为51.87 ℃、提取时间为50 min的提取液提取率最好。符合之前单因素实验。
2.2.3 火麻仁蛋白提取的最佳条件和模型验证
响应面法对火麻仁蛋白提取率的优化结果为:碱液pH为12.11、通气量为1.55 L/min、料液比为1:46.78(g/mL)、提取温度为51.87 ℃、提取时间为50 min,此时火麻仁蛋白提取率的最优值为77.38%。为了检验响应面设计法得出的提取率模型的合理性和有效性,进行3组验证试验,根据实验条件,适当调整。在pH为12.10、通气量为1.6 L/min、料液比1:50(g/mL)、提取温度为52 ℃、提取时间为50 min条件下,测得蛋白提取率为76.03%±1.64%,与单因素最佳条件的77.32%相近,没有显著性的不同,原因可能是酶解反应同时受到多种条件的限制,响应面优化试验所采用的pH与酶的最佳pH有所差别,导致结果出现偏差,但经过多次测试,响应面优化条件最高提取率为77.67%,高于单因素。这说明该模型可以较好的分析预测火麻仁蛋白提取率。
2.3 4种提取方法制备的火麻仁蛋白质理化特性的研究
2.3.1 火麻仁粗蛋白的颗粒形状
4种提取方法制备的蛋白粉如图7所示。通过感官分析,可以看出碱溶酸沉法(图7a)提取的两种蛋白粉呈现亮白色,更加细腻。而酶解法(图7d)制得的两种蛋白粉呈现暗白色,粉末较为蓬松。且酶解法制得的蛋白粉更多。通过扫描电镜放大不同倍数,观察蛋白颗粒形状。由图8a和图8b可知,碱溶法制得的颗粒形状有大有小,酶解法制得的蛋白颗粒较大,且大小较为均等,其中正压辅助提取的颗粒形状更小。由图8c和图8d可知,碱溶酸沉法提取的蛋白表面鳞片状突起,凹凸不平且层次复杂,正压辅助的更为明显。酶解法制得的蛋白表面较为光滑圆润,尤其是磁力搅拌辅助的。可能原因是:添加的NaOH,对蛋白表面有刺激和腐蚀作用[22]。其次正压空化产生的细小气泡,在炸裂时,会产生较大的能量,破坏蛋白结构。
2.3.2 蛋白含量及提取率
由图9右可知,碱溶酸沉法制备的蛋白含量要高于酶解法,尤其是正压辅助提取的,蛋白含量高达93.79%。正压酶解法的蛋白含量最低为70.35%,但是其提取率最高为46.16%。酶解法的提取率要高于碱溶法。两种碱溶法的提取率几乎一致可能是在制备洗涤时,有不可避免的损失。单比较两种提取方法,正压辅助技术,不管是在蛋白纯度,还是在蛋白提取率上,都有明显的改进。可用于后续其他植物蛋白的提取。
2.3.3 pH、蔗糖浓度、氯化钠浓度、温度对蛋白溶解度的影响
蛋白溶解度较其他的理化特性更为重要,溶解性的高低会直接影响到其他理化性质[23]。选择探究pH、蔗糖浓度、氯化钠浓度、温度4个因素对蛋白实际应用的影响。
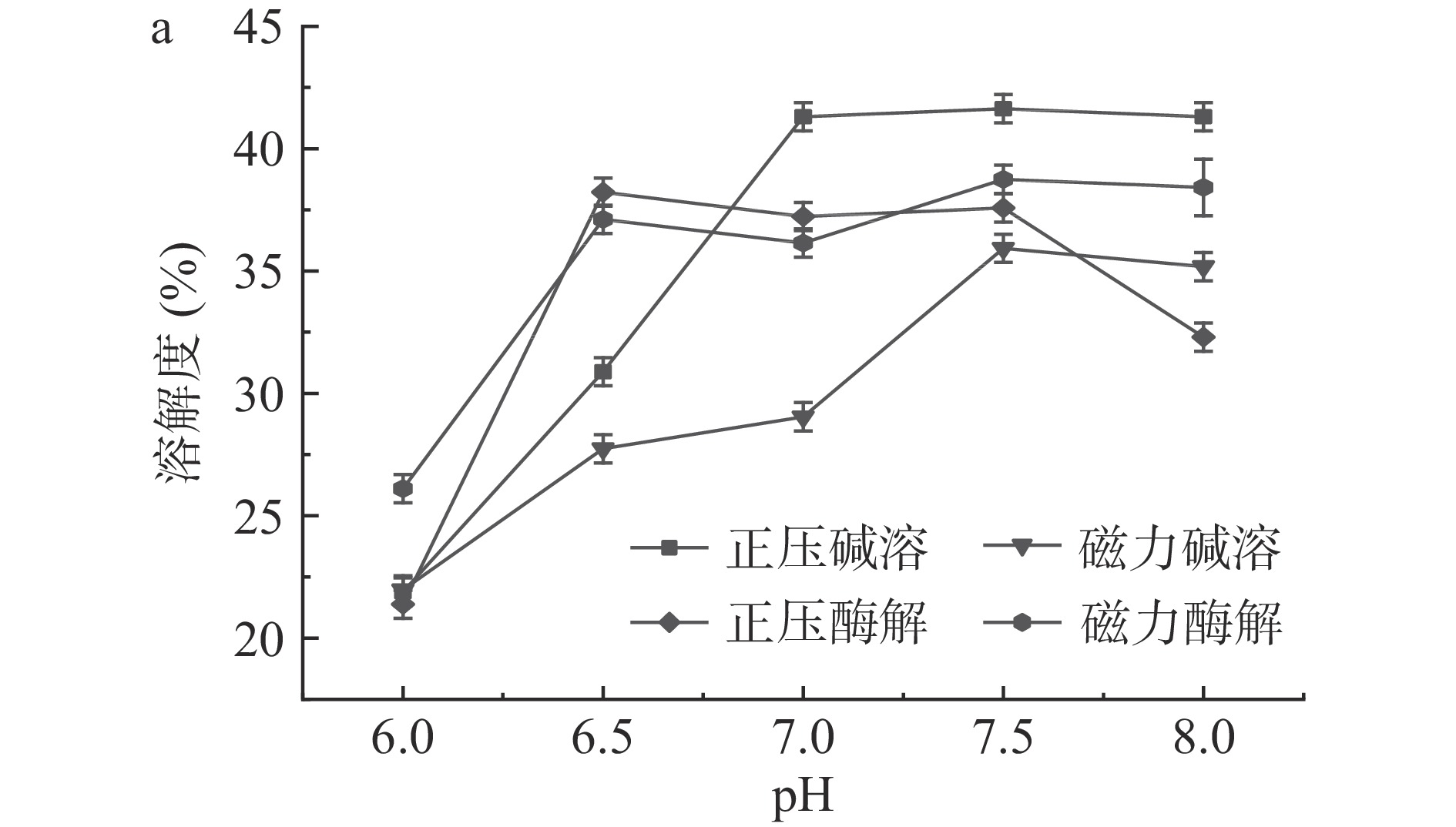
pH对蛋白溶解度的影响如图10a所示。在不同的pH条件下,蛋白的溶解度也有所改变。基本随着pH的提高,溶解度也随之提升。pH较低时,溶解度仅为20%左右,正压碱溶法制得的蛋白在pH为7~8时,溶解度趋于平稳,最佳为40.97%。如图10b所示,蔗糖的添加对蛋白溶解度的影响比较大。氯化钠浓度对蛋白溶解度的影响如图10c所示。磁力酶解蛋白整体的溶解度要优于其他三者,在1%时溶解度最佳,继续提高氯化钠含量,反而有所下降。氯化钠对正压碱溶蛋白的影响较小,在2%时略有提升。温度对蛋白溶解度的影响如图10d所示,正压碱溶和磁力碱溶蛋白在40 ℃时,溶解度最佳,温度越高,溶解度逐步降低,表现出相同的变化趋势。正压酶解蛋白的溶解度,随温度的增加而不断提高。整体而言,火麻仁蛋白溶解的最适pH为7.5,蔗糖浓度为3%,氯化钠含量为0%或2%时,温度为40 ℃时,溶解度最佳。
2.3.4 蛋白起泡性、乳化性、持水性、持油性
4种提取方法对蛋白起泡性、乳化性、持水性、持油性的影响如图11所示。磁力碱溶蛋白的起泡能力最强。4种方法提取的蛋白质的持油性如图11所示,都比较高。持油性最好的是磁力碱溶蛋白为246%。其次是正压碱溶蛋白为240%。两种酶解法提取的蛋白的持油性最差为234%。导致差异的原因可能是4种方法提取的蛋白结构差异,碱溶方法提取的蛋白表面凹凸不平,多有小孔层次较多,比表面积大,因此导致起泡性与持油性稍有提升;正压酶解法提取的蛋白纯度高,亲水性蛋白含量较多,因而持水性相对较好[24]。
2.3.5 蛋白质的稳定性
4种方法提取的蛋白质的热稳定性[21]如图12所示。除磁力碱溶法是一次热降解外,其余方法都有两个降解过程。正压碱溶蛋白第一次降解比较平缓,大约在120 ℃达到第一次平衡;磁力酶解第一次平衡发生在约97 ℃时;正压酶解第一次平衡在93 ℃时,原因是:高温破环蛋白结构以及部分的可挥发性物质的损失。第二次降解温度开始于200 ℃,主要原因是:火麻仁蛋白氨基酸含量丰富,含有精氨酸、谷氨酸、天冬氨酸等熔点在200 ℃以上的氨基酸。
4种方法提取的蛋白质的热变性温度如表4所示。采用碱溶法提取的两种蛋白的变性温度都在62 ℃左右。但采用正压辅助提取的蛋白的变性终止温度为105.5 ℃,较磁力搅拌辅助的提高了4 ℃。说明采用正压辅助提取可以提高蛋白的热稳定性。采用酶解法提取的两种蛋白,变性温度和终止温度都有较大的差别。采用磁力搅拌辅助提取的蛋白,变性温度更高,达到70.5 ℃。采用正压辅助提取的蛋白的变性终止温度仅为92.8 ℃,低于磁力搅拌的101.3 ℃。可能原因为:正压空化技术在促进酶解的过程中,除了提供传质的能量,其细小气泡瞬时炸裂,会破坏蛋白的二、三级结构[25],降低其结构的相对强度,使其热稳定性降低。
表 4 4种蛋白的热变性温度Table 4. Thermal denaturation temperatures of the four proteins方法 变性温度(℃) 终止温度(℃) 正压碱溶法 62.6 105.5 磁力碱溶法 62.3 101.3 正压酶解法 67.0 92.8 磁力酶解法 70.5 101.3 2.3.6 蛋白质的氨基酸组成
4种方法提取的蛋白质的氨基酸含量分析如表5所示。一共检测出17种氨基酸,4种方法提取的蛋白质除在含量上有所差别,其分布、组成、比例均表现出一致性。火麻仁蛋白中氨基酸含量丰富,主要含有精氨酸、谷氨酸、天冬氨酸、颉氨酸和亮氨酸等氨基酸。人体必须的8种氨基酸,火麻仁蛋白质含有7种(除色氨酸外)。其中精氨酸的含量最高,其次是谷氨酸,谷物类第一限制氨基酸赖氨酸的含量也接近10 mg/g。精氨酸和谷氨酸具有多种生理功能,参与多种生理活性物质的合成。其中最突出的是:精氨酸谷氨酸可以明显降低血氨水平。因为精氨酸进入人体后会立刻参与鸟苷酸循环,促进人体内的氨合成尿素排出体外。另外,谷氨酸可以和氨相结合形成谷氨酰胺,在肾脏内经谷氨酰胺酶离解形成氨,经尿液排出体外[26]。所以,火麻仁蛋白有潜在的医疗价值。
表 5 4种不同方法提取火麻仁蛋白的氨基酸组分分析Table 5. Analysis of amino acid components of sesame seed protein extracted by four different methods氨基酸 正压碱溶(mg/g) 磁力碱溶
(mg/g)正压酶解
(mg/g)磁力酶解
(mg/g)天冬氨酸 27.22 24.09 30.56 28.26 苏氨酸 9.83 8.88 11.86 9.64 丝氨酸 12.31 12.86 14.22 12.54 谷氨酸 39.84 44.55 54.26 41.52 甘氨酸 8.56 11.30 12.55 8.31 丙氨酸 8.36 11.56 15.34 8.52 胱氨酸 2.51 2.89 4.31 4.52 缬氨酸 28.64 21.42 32.11 29.56 蛋氨酸 8.56 8.29 10.37 10.57 异亮氨酸 9.24 8.07 12.03 11.34 亮氨酸 25.02 23.03 28.94 28.61 酪氨酸 9.34 7.62 11.07 10.22 苯丙氨酸 9.02 7.19 10.02 9.56 组氨酸 7.63 5.52 9.82 10.24 赖氨酸 9.45 8.63 10.25 11.34 谷氨酰胺 6.23 6.59 12.37 11.24 精氨酸 62.35 51.00 67.34 65.28 脯氨酸 9.03 8.04 9.86 10.64 4种方法从25 g火麻仁粉中提取的氨基酸总含量如表6所示。酶解法制得的氨基酸要远多于碱溶酸沉法。可能原因是:酶解法提取蛋白时,有的蛋白质已经酶解成多肽或者氨基酸,在后期的进样前处理时,水解的更完全。其中采用正压辅助酶解的,氨基酸总含量最高。所以,正压空化技术可以用于促进植物蛋白的提取。
表 6 4种方法处理25 g火麻仁粉中提取的氨基酸总含量Table 6. Total amino acid content extracted from 25 g flax seed powder treated by 4 methods氨基酸 正压碱溶
(mg/25 g)磁力碱溶
(mg/25 g)正压酶解
(mg/25 g)磁力酶解
(mg/25 g)天冬氨酸 176.57 132.40 298.91 247.04 苏氨酸 63.77 48.81 116.01 84.27 丝氨酸 79.85 70.67 139.09 109.62 谷氨酸 258.43 244.89 530.73 362.96 甘氨酸 55.53 62.10 122.75 72.64 丙氨酸 54.23 63.54 150.04 74.48 胱氨酸 16.28 15.88 42.16 39.51 缬氨酸 185.78 117.77 314.08 258.41 蛋氨酸 55.53 45.57 101.43 92.40 异亮氨酸 59.94 44.37 117.67 99.13 亮氨酸 162.30 126.61 283.07 250.10 酪氨酸 60.59 41.87 108.28 89.34 苯丙氨酸 58.51 39.55 98.01 83.57 组氨酸 49.49 30.33 96.05 89.52 赖氨酸 61.30 47.42 100.26 99.13 谷氨酰胺 40.41 36.22 120.99 98.26 精氨酸 404.45 280.37 658.67 570.67 脯氨酸 58.58 44.18 96.44 93.01 根据FAO/WHO的理想模式[27-28]:质量较好的蛋白质,其氨基酸的EAA/TAA值在40%左右,EAA/NEAA值在60%左右。对4种蛋白质的氨基酸组成进行氨基酸评分,结果如表7所示。EAA/TAA值最佳的是正压酶解法提的蛋白,为60.09%,较为接近理想值。EAA/NEAA值最佳的也是正压酶解法提的蛋白为39.91%,较为接近理想值。可见,正压空化技术有助于改善蛋白提取中氨基酸的组成。
表 7 不同提取方法的氨基酸评分Table 7. Amino acid scores of different extraction methods指标 正压碱溶 磁力碱溶 正压酶解 磁力酶解 总氨基酸
(mg/g)293.14 271.52 357.28 321.91 必须氨基酸
(mg/g)99.76 85.52 142.58 110.62 非必须氨基酸(mg/g) 193.38 186.00 214.70 211.29 EAA/TAA(%) 34.03 31.50 39.91 34.36 EAA/NEAA(%) 65.97 68.50 60.09 65.64 3. 结论
近年来,植物蛋白资源一直备受关注,本实验以脱壳火麻仁粉为原料,通过实验获得氮气辅助正压空化提取火麻仁蛋白质的最优条件。得到影响火麻仁蛋白质的提取率的先后顺序为pH>料液比>提取时间>提取温度>通气量,最优工艺条件为:料液比为1:50(g/mL),pH为12,提取温度为52 ℃,提取时间为50 min,通气量为1.6 L/min。在此条件下,蛋白质得率为76.03%±1.64%,明显高于同等条件下的磁力搅拌法56.32%,可能因为空化反应较为剧烈,利于蛋白的提取。通过氮气辅助正压空化提取的火麻仁蛋白具有良好的理化性质,正压辅助的蛋白质变性的终止温度为105.5 ℃,比磁力搅拌的提高了4 ℃,可能原因为正压空化技术在促进酶解的过程中,除了提供传质的能量,其细小气泡瞬时炸裂,会破坏蛋白的二、三级结构,降低其结构的相对强度,使其热稳定性降低。火麻仁蛋白的氨基酸含量和组成非常丰富,特别是采用正压碱溶法提取的蛋白,其氨基酸组成更加合理科学,十分接近FAO/WHO推荐的理想蛋白。因此,氮气辅助正压空化技术在火麻仁蛋白质的提取上具有可行性,也为火麻仁蛋白的深入研究提供理论基础。
-
表 1 响应面试验因素水平设计
Table 1 Response surface test factor level table
水平 因素 A
pHB 通气量
(L/min)C 料液比
(g/mL)D 温度
(℃)E 时间
(min)−1 11.5 1 40 45 30 0 12 2 50 50 40 1 12.5 3 60 55 50 表 2 提取率的中心复合试验响应值
Table 2 Central composite test response value of extraction rate
实验号 因素 提取率
(%)A pH B通气量
(L/min)C料液比
(g/mL)D温度
(℃)E时间
(min)1 12 1 50 50 50 73.38 2 11.5 1 50 50 40 46.36 3 11.5 2 40 50 40 36.65 4 12 2 50 50 40 75.60 5 12.5 1 50 50 40 59.51 6 12.5 2 60 50 40 53.14 7 12 2 60 50 50 70.87 8 12.5 3 50 50 40 48.28 9 12.5 2 50 50 30 45.22 10 12 2 40 50 50 74.57 11 12 2 50 45 30 69.99 12 12 2 50 50 40 78.13 13 11.5 2 60 50 40 55.74 14 12 3 60 50 40 68.50 15 12 2 60 50 30 74.11 16 11.5 2 50 50 50 45.83 17 12 3 50 50 30 69.01 18 12 1 40 50 40 68.46 19 12 3 50 45 40 65.58 20 12 3 40 50 40 68.30 21 12 1 50 55 40 67.76 22 12 2 50 50 40 76.03 23 11.5 2 50 45 40 38.60 24 12 1 50 45 40 66.01 25 12 2 50 55 50 72.70 26 12 2 40 50 30 65.92 27 12 2 50 50 40 73.47 28 12 2 50 55 30 69.85 29 11.5 2 50 50 30 46.34 30 12.5 2 50 45 40 52.36 31 12 2 50 50 40 75.75 32 12 2 40 45 40 64.00 33 12.5 2 50 55 40 55.42 34 12 2 50 45 50 69.53 35 12 2 50 50 40 74.41 36 12.5 2 50 50 50 61.38 37 12 1 60 50 40 75.60 38 12 3 50 55 40 64.50 39 12 2 40 55 40 69.37 40 12.5 2 40 50 40 56.65 41 12 1 50 50 30 65.58 42 12 3 50 50 50 68.54 43 12 2 60 55 40 74.76 44 11.5 2 50 55 40 55.42 45 11.5 3 50 50 40 44.26 46 12 2 60 45 40 73.31 表 3 回归方程及方差分析
Table 3 Regression equation and analysis of variance
方差来源 平方和 自由度 均方 F值 Pr>F 显著性 模型 5548.27 20 277.41 41.45 <0.0001 ** A 246.18 1 246.18 36.79 <0.0001 ** B 41.25 1 41.25 6.16 0.0201 * C 110.83 1 110.83 16.56 0.0004 * D 57.76 1 57.76 8.63 0.007 * E 59.21 1 59.21 8.85 0.0064 * AB 20.84 1 20.84 3.11 0.0898 AC 127.69 1 127.69 19.08 0.0002 * AD 47.33 1 47.33 7.07 0.0135 * AE 69.47 1 69.47 10.38 0.0035 * BC 12.04 1 12.04 1.8 0.1919 BD 2 1 2 0.3 0.5892 BE 17.1 1 17.1 2.55 0.1225 CD 3.84 1 3.84 0.57 0.4557 CE 35.34 1 35.34 5.28 0.0302 * DE 2.74 1 2.74 0.41 0.5281 A2 4420.47 1 4420.47 660.55 <0.0001 ** B2 161.37 1 161.37 24.11 <0.0001 ** C2 27.44 1 27.44 4.1 0.0537 D2 107.27 1 107.27 16.03 0.0005 * E2 48.92 1 48.92 7.31 0.0122 * 残差 167.3 25 6.69 失拟项 154.75 20 7.74 3.08 0.1077 不显著 纯误差 12.55 5 2.51 总和 5715.57 45 R2=0.9707 R2Adj=0.9473 注:**表示P<0.001,差异极显著;*表示P<0.05,差异显著。 表 4 4种蛋白的热变性温度
Table 4 Thermal denaturation temperatures of the four proteins
方法 变性温度(℃) 终止温度(℃) 正压碱溶法 62.6 105.5 磁力碱溶法 62.3 101.3 正压酶解法 67.0 92.8 磁力酶解法 70.5 101.3 表 5 4种不同方法提取火麻仁蛋白的氨基酸组分分析
Table 5 Analysis of amino acid components of sesame seed protein extracted by four different methods
氨基酸 正压碱溶(mg/g) 磁力碱溶
(mg/g)正压酶解
(mg/g)磁力酶解
(mg/g)天冬氨酸 27.22 24.09 30.56 28.26 苏氨酸 9.83 8.88 11.86 9.64 丝氨酸 12.31 12.86 14.22 12.54 谷氨酸 39.84 44.55 54.26 41.52 甘氨酸 8.56 11.30 12.55 8.31 丙氨酸 8.36 11.56 15.34 8.52 胱氨酸 2.51 2.89 4.31 4.52 缬氨酸 28.64 21.42 32.11 29.56 蛋氨酸 8.56 8.29 10.37 10.57 异亮氨酸 9.24 8.07 12.03 11.34 亮氨酸 25.02 23.03 28.94 28.61 酪氨酸 9.34 7.62 11.07 10.22 苯丙氨酸 9.02 7.19 10.02 9.56 组氨酸 7.63 5.52 9.82 10.24 赖氨酸 9.45 8.63 10.25 11.34 谷氨酰胺 6.23 6.59 12.37 11.24 精氨酸 62.35 51.00 67.34 65.28 脯氨酸 9.03 8.04 9.86 10.64 表 6 4种方法处理25 g火麻仁粉中提取的氨基酸总含量
Table 6 Total amino acid content extracted from 25 g flax seed powder treated by 4 methods
氨基酸 正压碱溶
(mg/25 g)磁力碱溶
(mg/25 g)正压酶解
(mg/25 g)磁力酶解
(mg/25 g)天冬氨酸 176.57 132.40 298.91 247.04 苏氨酸 63.77 48.81 116.01 84.27 丝氨酸 79.85 70.67 139.09 109.62 谷氨酸 258.43 244.89 530.73 362.96 甘氨酸 55.53 62.10 122.75 72.64 丙氨酸 54.23 63.54 150.04 74.48 胱氨酸 16.28 15.88 42.16 39.51 缬氨酸 185.78 117.77 314.08 258.41 蛋氨酸 55.53 45.57 101.43 92.40 异亮氨酸 59.94 44.37 117.67 99.13 亮氨酸 162.30 126.61 283.07 250.10 酪氨酸 60.59 41.87 108.28 89.34 苯丙氨酸 58.51 39.55 98.01 83.57 组氨酸 49.49 30.33 96.05 89.52 赖氨酸 61.30 47.42 100.26 99.13 谷氨酰胺 40.41 36.22 120.99 98.26 精氨酸 404.45 280.37 658.67 570.67 脯氨酸 58.58 44.18 96.44 93.01 表 7 不同提取方法的氨基酸评分
Table 7 Amino acid scores of different extraction methods
指标 正压碱溶 磁力碱溶 正压酶解 磁力酶解 总氨基酸
(mg/g)293.14 271.52 357.28 321.91 必须氨基酸
(mg/g)99.76 85.52 142.58 110.62 非必须氨基酸(mg/g) 193.38 186.00 214.70 211.29 EAA/TAA(%) 34.03 31.50 39.91 34.36 EAA/NEAA(%) 65.97 68.50 60.09 65.64 -
[1] KOLODZIEJCZYK P, OZIMEK L, KOZŁOWSKA J. The application of flax and hemp seeds in food, animal feed and cosmetics production [M]. Handbook of Natural Fibres, 2012: 329−366.
[2] 邓文亚, 徐婧婷, 郭顺堂, 等. 火麻仁蛋白与大豆蛋白的营养评价及比较[J]. 食品工业科技,2021,42(23):273−279. [DENG W Y, XU J T, GUO S T, et al. Nutritional evaluation and comparison of hemp seed protein and soybean protein[J]. Science and Technology of Food Industry,2021,42(23):273−279. DENG W Y, XU J T, GUO S T, et al. Nutritional evaluation and comparison of hemp seed protein and soybean protein [J]. Science and Technology of Food Industry, 2021, 42(23): 273-279.
[3] 徐鹏伟, 刘家宁, 常森林, 等. 火麻仁蛋白的提取分离及理化性质研究[J]. 食品研究与开发,2021,42(3):97−104. [XU P W, LIU J N, CHANG S L, et al. Extraction and isolation of hemp seed protein and its physicochemical properties[J]. Journal of Food Research and Development,2021,42(3):97−104. XU P W, LIU J N, CHANG S L, et al. Extraction and isolation of hemp seed protein and its physicochemical properties [J]. Journal of Food Research and Development, 2021, 42(3): 97-104.
[4] 谢集照, 林丰, 邱莉, 等. 广西不同产地火麻仁中脂肪和蛋白质成分含量比较研究[J]. 农业机械,2013(20):49−51. [XIE J Z, LIN F, QIU L, et al. Comparative study on fat and protein components in hemp seeds of different origins in Guangxi[J]. Agricultural Machinery,2013(20):49−51. doi: 10.16167/j.cnki.1000-9868.2013.29.006 XIE J Z, LIN F, QIU L, et al. Comparative study on fat and protein components in hemp seeds of different origins in Guangxi [J]. Agricultural Machinery, 2013(20): 49-51. doi: 10.16167/j.cnki.1000-9868.2013.29.006
[5] TELESZKO M, ZAJĄC A, RUSAK T. Hemp seeds of the polish 'Bialobrzeskie' and 'Henola' varieties (Cannabis sativa L. var. sativa) as prospective plant sources for food production[J]. Molecules,2022,27(4):1448. doi: 10.3390/molecules27041448
[6] KALINIEWICZ Z, JADWISIENCZAK K, ŻUK Z, et al. Selected physical and mechanical properties of hemp seeds[J]. BioResources,2021,16(1):1411. doi: 10.15376/biores.16.1.1411-1423
[7] 王宇凡, 张文斌, 徐琳娜. 酸浸超声预处理辅助水酶法提取火麻籽油[J]. 食品与发酵工业,2021,47(23):169−175. [WANG Y F, ZHANG W B, XU L N. Extraction of hemp seed oil by acid immersion ultrasonic pretreatment assisted by water enzymatic method[J]. Food and Fermentation Industry,2021,47(23):169−175. WANG Y F, ZHANG W B, XU L N. Extraction of hemp seed oil by acid immersion ultrasonic pretreatment assisted by water enzymatic method[J]. Food and Fermentation Industry, 2021, 47(23): 169-175.
[8] 刘猛, 樊凤娇, 曲谱, 等. 酶解法提取核桃粕中蛋白质的工艺优化[J]. 食品工业,2021,42(4):58−62. [LIU M, FAN F J, QU P, et al. Process optimization of enzymatic extraction of proteins from walnut meal[J]. Food Industry,2021,42(4):58−62. LIU M, FAN F J, QU P, et al. Process optimization of enzymatic extraction of proteins from walnut meal [J]. Food Industry, 2021, 42(4): 58-62.
[9] 温浩辉, 崔春, 刘鹏展. 火麻仁蛋白的组成, 功能特性及提取方法研究进展[J]. 粮食与油脂,2022,35(4):28−31. [WEN H H, CUI C, LIU P Z. Research progress on composition, functional characteristics and extraction methods of hemp seed protein[J]. Grain and Oil,2022,35(4):28−31. doi: 10.3969/j.issn.1008-9578.2022.04.008 WEN H H, CUI C, LIU P Z. Research progress on composition, functional characteristics and extraction methods of hemp seed protein[J]. Grain and Oil, 2022, 35(4): 28-31. doi: 10.3969/j.issn.1008-9578.2022.04.008
[10] YANG F, LIU X, HUANG Y, et al. Swirling cavitation improves the emulsifying properties of commercial soy protein isolate[J]. Ultrasonics Sonochemistry,2018,42:471−481. doi: 10.1016/j.ultsonch.2017.12.014
[11] 张品, 余顺波, 朱文秀, 等. 紫苏饼粕分离蛋白中蛋白质含量测定方法比较[J]. 粮食与油脂,2021,34(11):150−154. [ZHANG P, YU S B, ZHU W X, et al. Comparison of determination methods for protein content in perilla cake meal protein isolate[J]. Grain and Oil,2021,34(11):150−154. doi: 10.3969/j.issn.1008-9578.2021.11.034 ZHANG P, YU S B, ZHU W X, et al. Comparison of determination methods for protein content in perilla cake meal protein isolate [J]. Grain and Oil, 2021, 34(11): 150-154. doi: 10.3969/j.issn.1008-9578.2021.11.034
[12] 朱慧, 涂世, 刘蓉蓉, 等. 酶法提取苦荞麦蛋白的理化性质和加工性质[J]. 食品科学,2010(19):197−203. [ZHU H, TU S, LIU R R, et al. Physicochemical properties and processing properties of enzymatic extraction of buckwheat protein[J]. Food Science,2010(19):197−203. ZHU H, TU S, LIU R R, et al. Physicochemical properties and processing properties of enzymatic extraction of buckwheat protein[J]. Food Science, 2010(19): 197-203.
[13] 程云辉, 赵红清, 张丽琍, 等. 3种物理改性方法对大米蛋白质功能性质的影响[J]. 食品与机械,2020,36(12):7−11,78. [CHENG Y H, ZHAO H C, ZHANG L L, et al. Effects of three physical modification methods on protein function properties of rice[J]. Food and Machinery,2020,36(12):7−11,78. CHENG Y H, ZHAO H C, ZHANG L L, et al. Effects of three physical modification methods on protein function properties of rice[J]. Food and Machinery, 2020, 36(12): 7-11, 78.
[14] TROUT G R. Techniques for measuring water-binding capacity in muscle foods—a review of methodology[J]. Meat Science,1988,23(4):235−252. doi: 10.1016/0309-1740(88)90009-5
[15] 孙小斐, 乔玉辉. 不同因素对白果蛋白持油性, 持水性和起泡性的影响[J]. 食品与机械,2012(3):17−20. [SUN X F, QIAO Y H. Effects of different factors on oil holding, water retention and foaming properties of albumin[J]. Food and Machinery,2012(3):17−20. SUN X F, QIAO Y H. Effects of different factors on oil holding, water retention and foaming properties of albumin[J]. Food and Machinery, 2012, (3): 17-20.
[16] 展海军, 张佳佳, 徐飞, 等. 用热重分析法同时测定大豆中主要成分含量[J]. 粮食与饲料工业,2016(11):56−61. [ZHAN H J, ZHANG J J, XU F, et al. Simultaneous determination of the content of major components in soybeans by thermogravimetric analysis[J]. Food and Feed Industry,2016(11):56−61. ZHAN H J, ZHANG J J, XU F, et al. Simultaneous determination of the content of major components in soybeans by thermogravimetric analysis [J]. Food and Feed Industry, 2016(11): 56-61.
[17] 王晴, 臧凤, 钱玉梅, 等. 沙棘籽蛋白质分级提取及其氨基酸组成研究[J]. 通化师范学院学报,2021,42(2):76−80. [WANG Q, ZANG F, QIAN Y M, et al. Protein grading and amino acid composition of sea buckthorn seeds[J]. Journal of Tonghua Normal University,2021,42(2):76−80. doi: 10.13877/j.cnki.cn22-1284.2021.02.013 WANG Q, ZANG F, QIAN Y M, et al. Protein grading and amino acid composition of sea buckthorn seeds[J]. Journal of Tonghua Normal University, 2021, 42(2): 76-80. doi: 10.13877/j.cnki.cn22-1284.2021.02.013
[18] JAHAN K, ASHFAQ A, ISLAM R U, et al. Optimization of ultrasound-assisted protein extraction from defatted mustard meal and determination of its physical, structural, and functional properties[J]. Journal of Food Processing and Preservation,2022,46(8):e16764.
[19] ZHANG K, WEN Q, LI T, et al. Comparative study of the effects of ultrasonic power on the structure and functional properties of gliadin in wheat and green wheat[J]. Journal of Food Science,2022,87(3):1020−1034. doi: 10.1111/1750-3841.16050
[20] ZHAO M, XIONG W, CHEN B, et al. Enhancing the solubility and foam ability of rice glutelin by heat treatment at pH12: Insight into protein structure[J]. Food Hydrocolloids,2020,103:105626. doi: 10.1016/j.foodhyd.2019.105626
[21] ZHANG X, XU S, SHEN L, et al. Factors affecting thermal stability of collagen from the aspects of extraction, processing and modification[J]. Journal of Leather Science and Engineering,2020,2(1):1−29. doi: 10.1186/s42825-019-0016-6
[22] FLETCHER S, HAMILTON A D. Protein surface recognition and proteomimetics: Mimics of protein surface structure and function[J]. Current Opinion in Chemical Biology,2005,9(6):632−638. doi: 10.1016/j.cbpa.2005.10.006
[23] TREVINO S R, SCHOLTZ J M, PACE C N. Measuring and increasing protein solubility[J]. Journal of Pharmaceutical Sciences,2008,97(10):4155−66. doi: 10.1002/jps.21327
[24] HARRYSSON H, HAYES M, EIMER F, et al. Production of protein extracts from Swedish red, green, and brown seaweeds, Porphyra umbilicalis Kützing, Ulva lactuca Linnaeus, and Saccharina latissima (Linnaeus) JV Lamouroux using three different methods[J]. Journal of Applied Phycology,2018,30(6):3565−3580. doi: 10.1007/s10811-018-1481-7
[25] MA L, WANG D D, LIU X, et al. Co-clustering analysis of protein secondary structures[J]. Current Bioinformatics,2017,12(3):213−224. doi: 10.2174/1574893612666170111145319
[26] ZHANG H, JIN Y, WANG M, et al. N-Carbamylglutamate and l-arginine supplementation improve hepatic antioxidant status in intrauterine growth-retarded suckling lambs[J]. RSC Advances,2020,10(19):11173−11181. doi: 10.1039/C9RA09316H
[27] 田大才. 大西洋鲑, 三倍体虹鳟和金鳟的肌肉营养成分与品质特性[J]. 中国水产科学,2020,2:186−194. [TIAN D C. Muscle nutrient composition and quality characteristics of Atlantic salmon, triploid rainbow trout and golden trout[J]. Chinese Journal of Fishery Sciences,2020,2:186−194. doi: 10.12264/6184 TIAN D C. Muscle nutrient composition and quality characteristics of Atlantic salmon, triploid rainbow trout and golden trout[J]. Chinese Journal of Fishery Sciences, 2020, 2: 186-194. doi: 10.12264/6184
[28] 叶健明, 石宁蕙, 杨群慧, 等. 鹰嘴豆短肽的分步酶解法制备及其营养价值评价[J]. 保鲜与加工,2020,20(1):140−148. [YE J M, SHI N H, YANG Q H, et al. Stepwise enzymatic preparation of chickpea short peptide and its nutritional value evaluation[J]. Preservation and Processing,2020,20(1):140−148. doi: 10.3969/j.issn.1009-6221.2020.01.023 YE J M, SHI N H, YANG Q H, et al. Stepwise enzymatic preparation of chickpea short peptide and its nutritional value evaluation[J]. Preservation and Processing, 2020, 20(1): 140-148. doi: 10.3969/j.issn.1009-6221.2020.01.023





 下载:
下载:









 下载:
下载:



