Analysis of Anthocyanin Accumulation and Gene Expression of Anthocyanin Synthesis Pathway during Fruit Ripening of 'Benihoppe' Strawberry
-
摘要: 为探究‘红颜’草莓果实成熟过程中花色苷积累和合成相关基因表达规律,以‘红颜’草莓白果期(white fruit,WF)、转色期(initial ripening fruit,IR)、半红期(part ripening fruit,PR)、全红期(full ripe fruit,FR)四个发育时期果实为研究对象,采用高效液相色谱-串联质谱方法对其花色苷物质进行定性和定量分析,并测定不同发育过程中的花色苷生物合成途径中结构基因表达水平,以期为草莓果实花色苷代谢以及色泽品质调控提供理论依据。结果表明:‘红颜’草莓中有24种花色苷化合物和4种原花青素,随着果实成熟,总花色苷含量逐渐增加,原花青素含量逐渐降低。各发育时期的差异代谢物质主要是天竺葵素和矢车菊素。其中天竺葵素-3-O-葡萄糖苷、天竺葵素-3-O-芸香糖苷和矢车菊素-3-O-葡萄糖苷是花色苷中的主要物质,在‘红颜’草莓全熟期时,分别占花色苷总量的79.7%,14.1%和3.56%。实时定量PCR分析表明,花色苷合成途径基因FaPAL1、FaC4H、FaF3H、FaANS、FaUFGT和转录因子FaMYB10表达水平随果实发育逐渐升高。综上所述,‘红颜’草莓果实的花色苷含量随果实成熟逐渐积累,花色苷差异代谢的物质包含天竺葵素和矢车菊素,花色苷合成途径相关结构基因FaPAL1、FaC4H、FaF3H、FaANS、FaUFGT表达水平影响果实花色苷的积累。Abstract: To explore the genes related to anthocyanin accumulation and synthesis during the ripening process of strawberry fruit, qualitative and quantitative analysis of anthocyanin substances was conducted using high-performance liquid chromatography tandem mass spectrometry (HPLC-MS/MS) on the fruits of four development stages of 'Benihoppe' strawberry: White (WF), initial ripening (IR), part ripening (PR), and full red fruits (FR). The expression level of structural genes in anthocyanin biosynthesis pathway in different development processes was determined to provide a theoretical basis for anthocyanin metabolism and color quality regulation of strawberry fruit. The results showed 24 anthocyanins and four proanthocyanidins in 'Benihoppe' strawberry. With the ripening of the fruit, the total anthocyanin and proanthocyanidin contents gradually increased and decreased, respectively. Pelargonidin and cyanidin were the main differential metabolites in different developmental stages. Among them, pelargonidin-3-O-glucoside, pelargonidin-3-O-rutinoside and cyanidin-3-O-glucoside were the main substances in anthocyanins, accounting for 79.7%, 14.1% and 3.56% of the total anthocyanins at the full maturity of 'Benihoppe' strawberry, respectively. Real-time PCR analysis showed that the transcription levels of the anthocyanin synthesis pathway genes FaPAL1, FaC4H, FaF3H, FaANS, FaUFGT, and FaMYB10 gradually increased with the fruit development. In summary, the anthocyanin content of 'Benihoppe' strawberry fruit gradually accumulates with fruit maturity, and the substances of anthocyanin differential metabolism include pelargonidin and cyanidin. The expression level of structural genes related to anthocyanin synthesis pathway affects the anthocyanin accumulation of fruit.
-
Keywords:
- 'Benihoppe' strawberry /
- anthocyanins /
- metabolites /
- genes
-
草莓(Fragaria×ananassa Duch)是蔷薇科草莓属多年生的草本植物,是一种重要的经济作物。草莓果实颜色艳丽,柔软多汁,口感清新,营养丰富,深受广大消费者喜爱。草莓果实中含有的丰富花色苷,是重要的功能性营养物质,具有抗氧化、抗炎、抗癌、预防慢性病等作用[1]。除此之外,花色苷可增强植物的抗性,不仅可抵御生物和非生物胁迫,还可清除非生物胁迫下过量的活性氧[2]。另外,花色苷的形成是果实成熟的标志,使果实产生特征性的红色、蓝色和紫色色调,对果实的品质有重要影响[3]。花色苷是由花青素和糖苷组成,花青素的结构决定了呈现出的颜色,糖苷使花青素分子更加稳定,在植物中多以花色苷形式存在[4]。自然界中发现的花色苷有600多种,其中锦葵素(Malvidin, Mv)、天竺葵素(Pelargonidin, Pg)、矢车菊素(Cyanidin, Cy)、飞燕草素(Delphinidin, Dp)、矮牵牛素(Petunidin, Pt)、芍药素(Peonidin, Pn)为植物中常见的6种类型花色苷[5]。在草莓果实中主要富含天竺葵素,葡萄糖是最常见的替代糖[6]。
花色苷生物合成受到一系列编码生物合成过程酶基因的转录调节进而影响花色苷的生物合成[7]。苯丙氨酸裂解酶(PAL)是花色苷合成途径中的第一个酶,也是该途径的关键酶。Pombo等[8]发现FaPAL6的表达是果实特异性的,并且其表达和活性可能与草莓花青素积累增强有关。肉桂酸羟化酶(C4H)参与花色苷合成途径的第一阶段,是生成花色苷生物合成的前体,在黑树莓中,C4H基因在果实成熟后期的颜色发育过程中发挥作用,而早期C4H基因的表达可能与黄烷醇的积累有关[9]。查尔酮合成酶(CHS)是进入花色苷合成途径中第二阶段的第一个酶,已有研究表明果实组织中CHS基因的表达受到发育调节并与果实着色相关,除此之外,反义CHS基因构建的草莓果实CHS活性降低,果实中花色苷、黄酮醇和原花青素的水平下调,类黄酮途径的前体被分流到苯丙素途径,Hoffmann等[10]发现沉默CHS基因后同样使花色苷水平下调。黄烷酮3-羟化酶(F3H)在花色苷生物合成途径的早期阶段将黄烷酮转化为二氢黄烷醇。当RNAi沉默F3H后草莓果实的花青素含量显着降低,花色苷生物合成途径被阻断,代谢物被分流至苯丙素途径[11]。二氢黄酮醇在类黄酮-3'-羟化酶(F3'H)是在3'位引入B环羟基的关键,FaF3'H阻断红肉和白肉两个品种草莓花色苷3-葡萄糖苷的积累[12]。二羟黄酮醇-4-还原酶(DFR)催化底物生成无色花青素,研究发现RNAi沉默FaDFR降低草莓果实DFR酶活性,影响花色苷的生物合成,最终导致草莓果实的表皮颜色变浅[13]。ANS通过将无色花色苷转化为有色花色苷直接影响花色苷的积累[14]。此外,UFGT催化植物中花青素稳定性和水溶性的关键步骤,在草莓红肉品种中检测到的UFGT表达水平远高于草莓白肉品种[12]。总之,单个酶也会对生物合成途径的整体稳定性产生影响,因为单酶基因的沉默、过表达或异源表达通常会导致靶组织类黄酮成分的显著变化[15-17]。
花色苷合成途径中相关基因也是协调诱导的,并且在几个物种中已经鉴定出直接调节该途径结构基因表达的转录因子[18]。转录因子通过转录调控,激活或抑制花色苷合成过程中结构基因的表达。例如,Zhang等[19]发现草莓转录因子FaRAV1可直接结合并激活FaMYB10、CHS、F3H、DFR和GT1启动子正调控花色苷积累。其中大多数参与花色苷合成第二阶段(类黄酮生物合成)调控的MYB转录因子都是增强其途径结构基因表达的正调控因子。之前已有研究证明草莓中的FaMYB10可与FvbHLH33相互作用并激活FvDFR和FvUFGT启动子调节花色苷积累[20]。然而,草莓中FaMYB1转录因子抑制花色苷和黄酮醇的积累,可能起到抑制转录的作用,以平衡草莓果实成熟后期产生的花青素水平[21]。FvMAPK3可诱导FvMYB10磷酸化和FvCHS1降解,抑制草莓果实中花青素的积累[22]。但花色苷生物合成相关的转录因子和结构基因也受品种、果实成熟度以及外界因素的影响[23]。ABA和钙处理增加花色苷的积累,ABA还可增强花青素相关酶的活性,而钙可上调FvDFR2、FvANS1和FvUGT1花色苷生物合成关键结构基因的转录水平[24-25]。
而在本研究中,以‘红颜’草莓为材料,对草莓果实白果期、转色期、半红期、全红期四个发育时期果实的花色苷合成相关基因和转录因子的表达量及花色苷化合物含量及变化进行分析,明确花色苷的代谢机制,为草莓果实的色泽品质调控提供理论依据。
1. 材料与方法
1.1 材料与仪器
草莓 品种为‘红颜’草莓。采自北京市昌平草莓种植园。如图1,选择白果期(white fruit,WF)、转色期(initial ripening fruit,IR)、半红期(part ripening fruit,PR)、全红期(full ripe fruit,FR)四个时期草莓果实,采摘当天运回实验室,果实切成小块,液氮速冻后置于−80 ℃冰箱保存,以待测定;甲醇 色谱纯,美国Sigma公司;甲酸 色谱纯,德国默克公司;盐酸 分析纯,信阳市化学试剂厂;超纯水 由艾科浦超纯水系统(美国艾科浦国际有限公司)制备;植物RNA提取试剂盒 天根生化科技(北京)有限公司;反转录试剂盒 美国赛默飞世尔科技公司;引物 上海生工生物工程有限公司。
LGJ-100F真空冷冻干燥机 北京松源华兴科技发展有限公司;MM400球磨仪 德国Retsch公司;MIX-200涡旋振荡仪 上海净信实业发展有限公司;KQ5200E超声清洗仪 昆山舒美超声仪器有限公司;QTRAP 6500+高效液相色谱-串联质谱 美国AB SCIEX公司;ACQUITY BEH C18色谱柱 美国Waters公司;CFX96Touch实时荧光定量PCR仪 美国伯乐公司。
1.2 实验方法
1.2.1 花色苷物质提取
花色苷提取方法参照Jiang等[26]的方法并略做修改。草莓样品真空冷冻干燥后利用球磨仪研磨至粉末状。称取50 mg的粉末,溶解于500 μL提取液(50%的甲醇水溶液,含0.1%盐酸)中,涡旋震荡混匀,超声提取5 min后离心3 min(12000 r/min, 4 ℃),吸取上清,用0.22 μm微孔滤膜过滤样品,并保存于进样瓶中,用于LC-MS/MS分析。
1.2.2 花色苷定性定量检测
花色苷定性定量测定方法参照Yuan等[27]的方法。采用高效液相色谱(ExionLC™ AD,SCIEX)-串联质谱(QTRAP® 6500+,SCIEX)(HPLS-MS/MS)的方法对花色苷进行定性定量分析。液相色谱所用色谱柱为ACQUITY BEH C18色谱柱(1.7 µm,2.1 mm×100 mm),流动相A液为超纯水(加入0.1%的甲酸),B液为甲醇(加入0.1%的甲酸)。洗脱梯度为0.00 min B液比例为5%,6.00 min增至50%,12.00 min增至95%,保持2 min,14 min降至5%,并平衡2 min。流动相流速为0.35 mL/min;柱温40 ℃,进样量2 μL。质谱条件主要包括:电喷雾离子源温度550 ℃,正离子模式下质谱电压5500 V,气帘气35 psi。获得不同样本的质谱分析数据后,对所有目标物的色谱峰进行积分,通过迈维代谢建立的标准品数据库进行定性和定量分析。采用Analyst 1.6.3软件处理质谱数据。
1.2.3 花色苷合成相关基因表达分析
1.2.3.1 ‘红颜’草莓不同发育时期总RNA提取和cDNA合成
‘红颜’草莓的总RNA参照RNAprep Pure Plant Plus Kit多糖多酚试剂盒(TIANGEN,DP441)进行提取。使用RevertAid First Strand cDNA Synthesis Kit反转录试剂盒(Thermo Scientific,K1622)将‘红颜’草莓不同发育时期RNA反转录为cDNA。利用Primer Premier 5.0软件,设计花色苷生物合成途径过程中关键基因的实时荧光定量PCR引物(表1),主要包括查尔酮合成酶基因(FaCHS)、查尔酮异构酶基因(FaCHI)、反式肉桂酸-4-单氧化酶(FaC4H)、黄烷酮-3-羟化酶基因(FaF3H)、类黄酮3'单加氧酶(FaF3'H)、苯丙氨酸解氨酶基因(FaPAL1和FaPAL2)、二氢黄酮醇4-还原酶基因(FaDFR)、花色苷合成酶基因(FaANS)、类黄酮-3-葡糖基转移酶基因(FaUFGT)及转录因子FaMYB1、FaMYB10。引物序列合成由上海生工生物工程有限公司北京测序部进行。
表 1 荧光定量PCR引物序列Table 1. Primers sequences for real-time PCR analysis基因名称 上游引物 下游引物 FaCHS GGCTCACCGTCGAGACCG GGTGAACCCAGATACCTTC FaCHI TCGGAGTCTACTTGGAGGATAAG CGATCTCCCTGAAGAACTCAAC FaC4H CGTTTGGTGTTGGGAGG ATGGTGGAGTGCTTTAGGA FaF3H AGGGTGGCTTCATCGTTTC GGCTGGGGGCATTTCGGGT FaF3'H CCGTAGCGTCTCAGTTCTTG ACGAGGTCCTGGTAGTTGTA FaPAL1 GATCTCGGAAAGAACAGCTAGAG GAAGGACTTGCTTTGGTGAATG FaPAL2 AGGGAGTAATGTTGTGGTTGAG GAGCAGCCATGCTTGTTAGA FaDFR CACGATTCACGACATTGCGAAATT GAACTCAAACCCCATCTCTTTCAGCTT FaANS GAAGTGCGTACCCAACTCCATCGT ACCTTCTCCTTGTTGACGAGCCC FaUFGT GGTAAGCCACAGGAGGACA TATGAGCACCGAACCAAAA FaMYB1 GCAACTTGAGGATCAGCC GGTGCCTGAGTTGAATCTC FaMYB10 TTACCAACAGAACCACCACA AAACCAAGACCAGAACACAT Actin TGTGCGACAATGGAACT CCCACATAGGCATCTTT 1.2.3.2 实时荧光定量PCR(RT-qPCR)分析
RT-qPCR在BIO-RAD/伯乐CFX96Touch荧光定量PCR仪器上进行,以1.4.1的cDNA为模板,使用表1引物通过PCR扩增目的基因。扩增体系为:5.0 μL(2×SYBR q PCR Mix,上、下游引物各1.0 μL(10 mmol·L−1),1 μL cDNA模板和2.0 μL灭菌双蒸水)。反应条件:95 ℃预变性5 min;95 ℃变性10 s;60 ℃退火30 s;72 ℃延伸10 s;循环数40;72 ℃延伸3 min。以草莓Actin作为内参基因,每个样品3个生物学重复。通过2−△△CT方法[28]计算花色苷合成途径中关键基因以及相关转录因子FaMYB10、FaMYB1的表达量,所有结果重复3次,以平均数±标准误表示。
1.3 数据处理
采用Graphpad Prism 9.3.1软件和Excel 2013软件分析试验数据及绘图。使用OmicShare工具绘制热图和韦恩图(www.OmicShare.com/tools)。
2. 结果与分析
2.1 ‘红颜’草莓果实花色苷和原花青素物质的鉴定
采用液相色谱质谱联用技术对草莓果实中的花色苷进行定性和定量分析,经过分析共鉴定到24种花色苷和4种原花青素,物质鉴定结果见表2。在鉴定到24种花色苷中,天竺葵素类花色苷种类最多,鉴定到了10种,矢车菊素类花色苷种类数量次之,鉴定到6种。芍药花素、飞燕草素和锦葵色素类花色苷分别鉴定到了4、3和1种。此外还鉴定到了4种原花青素物质,包括原花青素B1、原花青素B2、原花青素B3、原花青素C1。植物种常见的花色苷主要分为6种类型,分别为锦葵色素、天竺葵素、矢车菊素、飞燕草素、矮牵牛素和芍药素。除矮牵牛素类花色苷外,其他种类花色苷都在草莓果实中鉴定到。植物中的花青素不稳定,与糖结合发生糖基化化反应后才能形成稳定的有色花色苷。‘红颜’草莓果实中花色苷的糖苷以葡萄糖类糖苷为主,包括葡萄糖苷、酰化葡糖苷、二葡萄糖苷等,此外还含有芸香糖苷、半乳糖苷、木糖苷、阿拉伯糖苷、桑布双糖苷。
表 2 ‘红颜’草莓花色苷物质Table 2. Anthocyanins of 'Benihoppe' strawberry strawberry序号 Compounds 物质 1 Pelargonidin-3-O-glucoside 天竺葵素-3-O-葡萄糖苷 2 Pelargonidin-3,5-O-diglucoside 天竺葵素-3,5-O-二葡萄糖苷 3 Pelargonidin-3-O-galactoside 天竺葵素-3-O-半乳糖苷 4 Pelargonidin-3-O-rutinoside 天竺葵素-3-O-芸香糖苷 5 Pelargonidin-3-O-(6-O-malonyl-beta-D-glucoside) 天竺葵素-3-O-(6-O-丙二酰-β-D-葡萄糖苷) 6 Pelargonidin-3-O-arabinoside 天竺葵素-3-O-阿拉伯糖苷 7 Pelargonidin-3-O-sophoroside 天竺葵素-3-O-槐糖苷 8 Pelargonidin-3-O-sambubioside 天竺葵素-3-O-桑布双糖苷 9 Pelargonidin-3-O-sophoroside-5-O-(malonyl)-glucoside 天竺葵素-3-O-槐糖苷-5-O-(丙二酰基)-葡萄糖苷 10 Pelargonidin-3-O-(6-O-p-coumaroyl)-glucoside 天竺葵素-3-(6-O-p-对香豆酰)-葡萄糖苷 11 Cyanidin-3-O-(6-O-malonyl-beta-D-glucoside) 矢车菊素-3-O-(6-O-丙二酰-β-D-葡萄糖苷) 12 Cyanidin-3-O-glucoside 矢车菊素-3-O-葡萄糖苷 13 Cyanidin-3-O-xyloside 矢车菊素-3-O-木糖苷 14 Cyanidin-3-O-sambubioside 矢车菊素-3-O-桑布双糖苷 15 Cyanidin-3,5-O-diglucoside 矢车菊素-3,5-O-二葡萄糖苷 16 Cyanidin-3-O-rutinoside 矢车菊素-3-O-芸香糖苷 17 Peonidin-3-O-glucoside 芍药花素-3-O-葡萄糖苷 18 Peonidin-3-O-(6-O-malonyl-beta-D-glucoside) 芍药花素-3-O-(6-O-丙二酰-β-D-葡萄糖苷) 19 Peonidin-3-O-rutinoside 芍药花素-3-O-芸香糖苷 20 Peonidin-3-O-(6-O-p-coumaroyl)-glucoside 芍药花素-3-(6-O-p-对香豆酰)-葡萄糖苷 21 Delphinidin-3-O-galactoside 飞燕草素-3-O-半乳糖苷 22 Delphinidin-3-O-glucoside 飞燕草素-3-O-葡萄糖苷 23 Delphinidin-3-O-(6-O-malonyl-beta-D-glucoside) 飞燕草素-3-O-(6-O-丙二酰-β-D-葡萄糖苷) 24 Malvidin-3-O-glucoside 锦葵色素-3-O-葡萄糖苷 25 Procyanidin B1 原花青素B1 26 Procyanidin B2 原花青素B2 27 Procyanidin B3 原花青素B3 28 Procyanidin C1 原花青素C1 2.2 ‘红颜’草莓果实中花色苷和原花青素总含量的变化
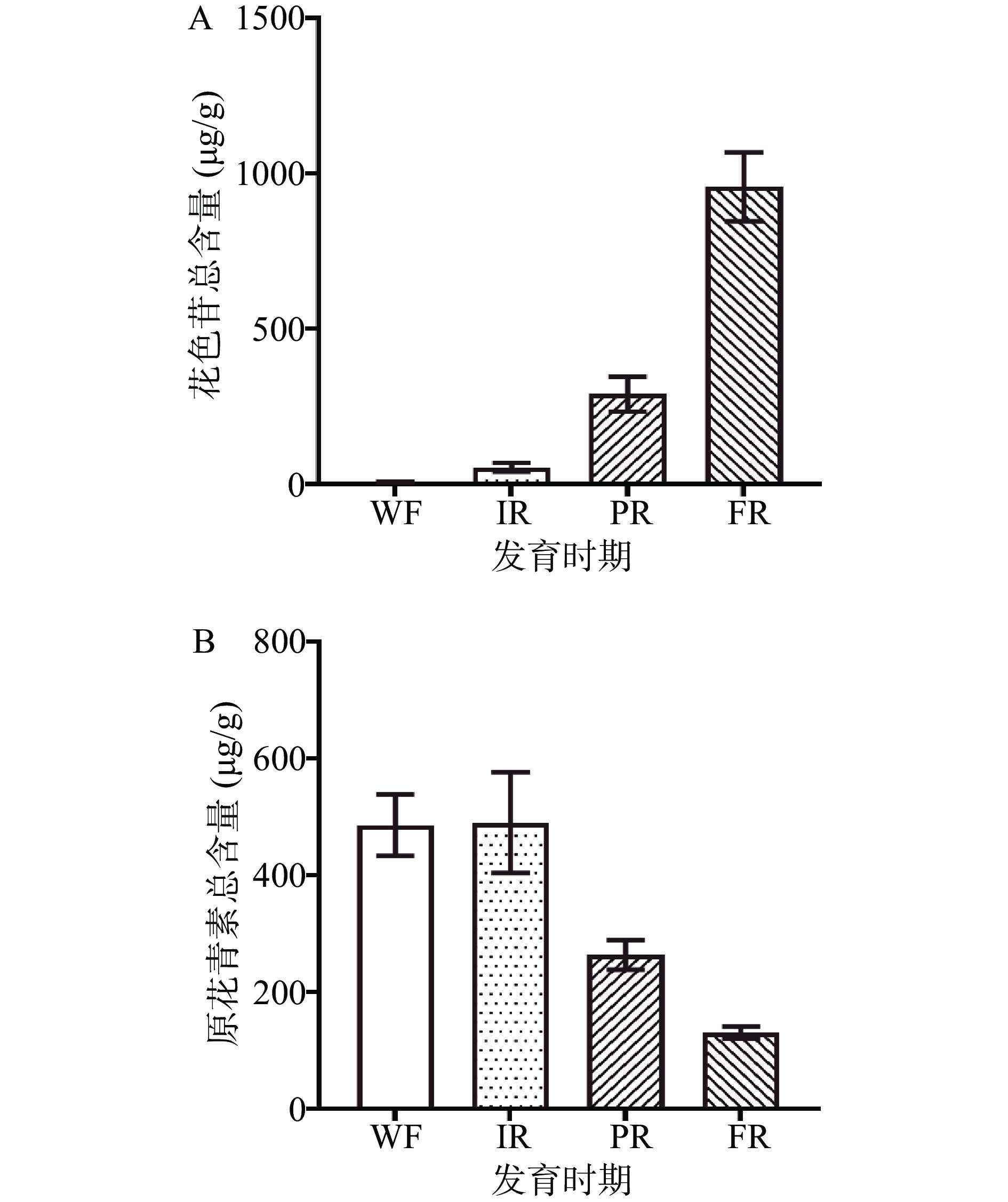
‘红颜’草莓果实成熟过程中颜色逐渐变红,花色苷总量显著增加(图2A),原花青素总含量随着果实成熟呈下降趋势(图2B)。在白果期果实表面虽未观察到红色,但仍有少量花色苷被检测到(图3)。这一时期花色苷以矢车菊素-3-O-葡萄糖苷为主,占花色苷总量的68.5%。草莓果实在转色期开始着色,花色苷总量快速增加。在果实刚开始着色时,矢车菊素-3-O-葡萄糖苷、天竺葵素-3-O-葡萄糖苷、矢车菊素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)、天竺葵素-3-O-芸香糖苷及芍药花素-3-O-葡萄糖苷的含量增长较快,发生数量级的改变,在这一时期仍以矢车菊素-3- O -葡萄糖苷为主要花色苷类型,占花色苷总量的61.3%,天竺葵素-3-O-葡萄糖苷含量占花色苷总量的17.9%,矢车菊素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)占花色苷总量的12.3%。 随着果实成熟,天竺葵素-3-O-葡萄糖苷和天竺葵素-3-O-芸香糖苷含量急速增加,在果实完全成熟时,天竺葵素-3-O-葡萄糖苷的含量占花色苷总量的79.7%,天竺葵素-3-O-芸香糖苷含量占花色苷总量的14.1%。矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)含量虽然也随果实成熟而增加,但含量变化并不显著,在果实完全成熟时,矢车菊素-3-O-葡萄糖苷含量占总花色苷含量的3.56%,矢车菊素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)含量占花色苷总量的0.87%。芍药花素-3-O-葡萄糖苷含量在转色期含量达到最大值,后随果实成熟含量降低。在果实完全成熟时,天竺葵素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)的含量也较高,占花色苷总量的1.10%。在发育早期,原花青素总含量较高,达486.3 μg/g(图2B),其中原花青素B3的含量占原花青素总量69.4%,在整个发育阶段,原花青素B3在原花青素总量的占比较为稳定。当‘红颜’草莓转色时,原花青素总量略有增加,但到达果实半红期时,原花青素总量下降。果实成熟时,原花青素总量降至130.7 μg/g,与白果期相比含量降低了73.1%。
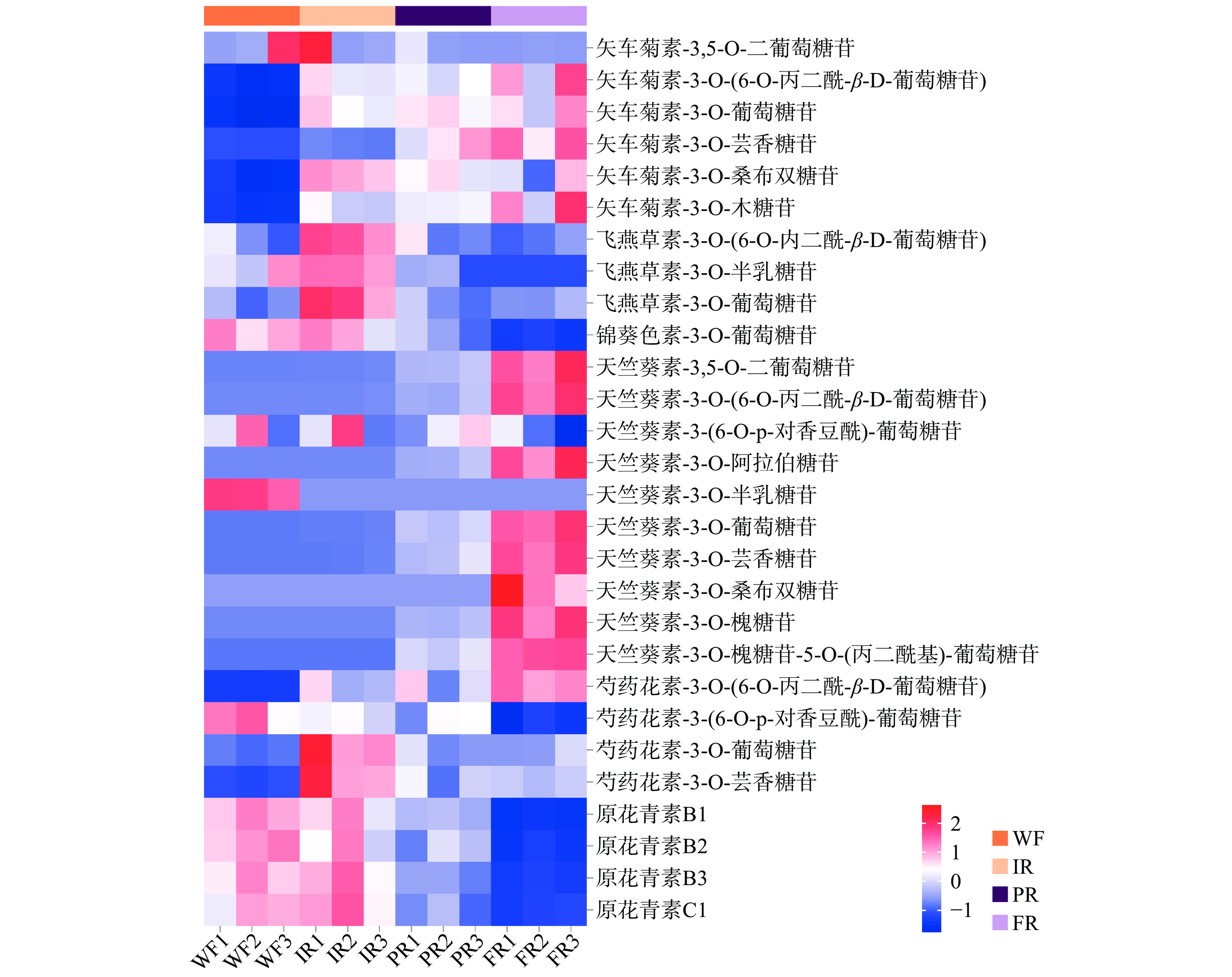
随着果实成熟,各种类花色苷和原花青素含量有明显差异。从图3中可看出‘红颜’草莓中原花青素、锦葵色素-3-O-葡萄糖苷、天竺葵素-3-O-半乳糖苷和芍药花素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)在发育过程中逐渐减少;而芍药花素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)、矢车菊素-3-O-木糖苷、矢车菊素-3-O-芸香糖苷、矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)和天竺葵色素类花色苷含量则不断增加,在成熟期达到峰值;矢车菊素-3,5-O-二葡萄糖苷、矢车菊素-3-O-桑布双糖苷、天竺葵素-3-(6-O-p-对香豆酰)-葡萄糖苷、芍药花素-3-O-葡萄糖苷、芍药花素-3-O-芸香糖苷和飞燕草色素类花色苷含量均先增加后减少。
2.3 ‘红颜’草莓不同发育时期花色苷物质差异分析
草莓果实成熟过程中,花色苷物质含量呈现不同的变化趋势,不同时期差异显著的物质也不同。图4中表示的是不同发育时期花色苷代谢物质差异分析。左边蓝色矩形可以看出,WF-VS-IR、WF-VS-PR、WF-VS-FR、IR-VS-PR、IR-VS-FR、PR-VS-FR各有13、15、18、13、15、11个差异表达的代谢物质。WF-VS-FR和PR-VS-FR组对应有单个黑色点,WF-VS-FR组特有花色苷代谢物质共3个(天竺葵素-3-O-阿拉伯糖苷,天竺葵素-3-O-槐糖苷,天竺葵素-3-O-槐糖苷-5-O-(丙二酰基)-葡萄糖苷),PR-VS-FR组特有花色苷物质1个(芍药花素-3-(6-O-p-对香豆酰)-葡萄糖苷)。WF-VS-FR∩IR-VS-FR和WF-VS-PR∩IR-VS-PR两点中间有线相连,其共有花色苷代谢物质各为1个。IR-VS-PR∩IR-VS-FR∩PR-VS-FR、WF-VS-FR∩IR-VS-FR∩PR-VS-FR、WF-VS-FR∩IR-VS-PR∩IR-VS-FR、WF-VS-IR∩IR-VS-PR∩IR-VS-FR、WF-VS-IR∩WF-VS-PR∩WF-VS-FR三黑点及线相连,代表其共有花色苷代谢物质各是1、1、1、2和5个。WF-VS-PR∩WF-VS-FR∩IR-VS-FR∩PR-VS-FR的共有花色苷代谢物质为锦葵色素-3-O-葡萄糖苷。WF-VS-PR∩WF-VS-FR∩IR-VS-PR∩IR-VS-FR∩PR-VS-FR和WF-VS-IR∩WF-VS-PR∩WF-VS-FR∩IR-VS-PR∩IR-VS-FR的共有花色苷代谢各为2和3个。而6个组共有的花色苷物质则有3个,分别为天竺葵素-3-O-(6-O-丙二酰-β-D-葡萄糖苷),天竺葵素-3-O-葡萄糖苷,天竺葵素-3-O-芸香糖苷。
2.4 红颜草莓果实花色苷合成途径基因表达量的分析
花色苷合成受到其合成途径的结构基因调控,还受到转录因子的调控。花色苷合成主要包括苯丙烷代谢和类黄酮生物合成两个环节[29]。对花色苷合成途径过程中的关键基因进行qRT-PCR分析(图5)发现,随着果实发育阶段,苯丙烷代谢途径的关键基因FaPAL1和FaC4H表达量均呈上升趋势,而FaPAL2表达量在半红期达到峰值后下降。类黄酮生物合成途径的上游结构基因FaCHS和FaCHI是合成花色苷的关键基因,其表达直接影响果实着色,它们在‘红颜’草莓发育阶段中均呈先上升后下降的趋势,表明其在果实着色阶段发挥重要作用。类黄酮生物合成途径的下游结构基因FaF3H的转录水平呈现出从果实白果期到果实成熟期表达增加的趋势,从而增加草莓成熟期花色苷的积累。然而FaF3'H在果实半熟期达到峰值后下降,FaF3'H的高表达与类黄酮的高含量有关。FaDFR在前三个发育时期的转录水平变化不显著,但在果实成熟期的表达下降。FaANS的表达直接影响花色苷的积累,在‘红颜’草莓中,其转录水平随着果实逐渐成熟而增加。在成熟草莓的果实中抑制FaUFGT的表达会使花青素苷积累显著下降,在‘红颜’草莓中FaUFGT的转录水平随着果实成熟逐渐增加,与已有研究一致[15]。FaMYB1是草莓中花青素和黄酮醇生物合成的抑制剂,沉默FaMYB1会影响原花青素的积累,而在 ‘红颜’草莓中FaMYB1各时期的转录水平较为稳定,仅在白果期和转色期降低,与原花青素在白果期和转色期的含量一致[21]。FaMYB10是不同颜色果实花色苷合成的关键正调控因子,其转录水平逐渐增加[30]。
3. 讨论
果实的花色苷含量及其组成是影响果实色泽品质的重要因素,也是吸引消费者和提高果实经济价值的关键[6]。花色苷是重要的次生代谢产物,同时具有一定的果实抗氧化能力和营养价值[31]。花色苷的积累与其生物合成途径过程中相关结构基因的表达水平密切相关,目前关于花色苷生物合成关键基因已经被鉴定,并进行大量的功能研究,例如草莓[12,14]、苹果[32]、葡萄[33]等果实中已鉴定到影响花色苷合成途径的相关基因。
已有研究表明原花青素具有极强的抗氧化活性,是一种良好的自由基清除剂和脂质过氧化抑制剂,具有很强的抗氧化活性和自由基清除功能[34-35]。在本研究中,从‘红颜’草莓中鉴定到4种原花青素以及24种花色苷。在24种花色苷中,发现矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)、天竺葵素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)、天竺葵素-3-O-葡萄糖苷、天竺葵素-3-O-芸香糖苷在不同发育时期的含量均高于其它花色苷。在草莓中富含矢车菊素和天竺葵素类花色苷,这一结果与先前研究结果一致[6]。其中,有趣的是‘红颜’草莓花色苷总含量随着果实成熟逐渐增加,然而原花青素总含量反而呈现降低的趋势。随着果实成熟老化,原花青素发挥作用防止果实的脂质过氧化发生衰老,因此原花青素含量随果实成熟才会逐渐降低。除此之外,原花青素在未成熟草莓果实中提供了一种涩的味道,并且其高水平与草莓对灰霉病的敏感性呈负相关[36]。‘红颜’草莓的抗病性是否与果实原花青素含量存在联系,需要进一步研究。
果实着色程度除了受到各花色苷物质含量影响之外,其合成途径中的各酶基因调控也非常重要。在‘红颜’草莓和白果肉突变体的研究中发现,FaC4H是决定果肉颜色变化的因素[37]。富士和乔纳金苹果中,CHS、F3H、DFR、ANS、UFGT等5个结构基因在果实成熟过程中被显著诱导,其表达水平也与花色苷含量呈正相关[38]。也有研究发现桑果成熟过程中CHI基因表达与花青素的积累有关。在本研究中发现‘红颜’草莓的总花色苷含量从转色期和到成熟期大量积累,同时FaPAL1、FaC4H、FaF3H、FaANS、FaUFGT花色苷合成途径的关键结构基因的表达模式也与花色苷积累时期相一致。另外FaPAL2、FaCHI和FaCHS在红颜草莓果实半红期均达到峰值后下降,这3个基因作为合成途径的上游结构基因,随着果实成熟着色,果实的花色苷合成进程加快,而果实成熟后,主要是果实花色苷合成途径中的下游结构基因发挥作用,因此上游结构基因可能在果实成熟时有所下调。MYB转录因子在草莓中花色苷合成调控中发挥重要作用的。已有研究表明FaMYB10在高花青素品种草莓中的成熟果实中有更高的表达[39],FaMYB10是花色苷合成的关键正调控因子[30],而FaMYB1可能在花青素/原花青素生物合成的分支点负调控草莓果实中的花青素生物合成[31]。在本研究中FaMYB10随果实成熟逐渐增加,其表达水平与花色苷的积累模式一致。而FaMYB1通过其它花色苷合成途径关键基因调控花色苷的积累,在本研究中其表达水平除转色期外,未有明显差别。然而,MYB转录因子在‘红颜’草莓中如何调控花色苷合成途径关键基因,以及其它转录因子是否和MYB转录因子共同作用调控花色苷合成途径关键基因值得深入探究。另外,草莓中花色苷的含量受到激素、光照等影响,其影响机制需进一步研究。
4. 结论
花色苷是植物中普遍存在的黄酮类色素化合物,它是直接影响果蔬感官品质的重要因素。在‘红颜’草莓不同发育时期的花色苷合成和积累研究中,鉴定了24种花色苷物质和4种原花青素。随着果实成熟花色苷总含量逐渐增加,除此之外,在果实全红期,主要的花色苷物质为天竺葵素和矢车菊素,而在发育早期白果期主要是原花青素。对不同发育时期果实花色苷合成途径的基因分析后,其合成途径的上游结构基因FaPAL1、FaC4H和下游结构基因FaANS、FaFaF3'H、FaUFGT以及转录因子FaMYB10的表达模式与花色苷积累一致。但花色苷合成途径结构基因表达受多种因素的影响,除了转录因子的转录调控外,激素和外部环境等也调控花色苷物质积累,需要更深入的研究来理解其相互作用的性质以及调控果实发育和成熟的其他因素之间的串扰,以丰富果实色泽品质调控网络,为未来育种工作提供理论依据。
-
表 1 荧光定量PCR引物序列
Table 1 Primers sequences for real-time PCR analysis
基因名称 上游引物 下游引物 FaCHS GGCTCACCGTCGAGACCG GGTGAACCCAGATACCTTC FaCHI TCGGAGTCTACTTGGAGGATAAG CGATCTCCCTGAAGAACTCAAC FaC4H CGTTTGGTGTTGGGAGG ATGGTGGAGTGCTTTAGGA FaF3H AGGGTGGCTTCATCGTTTC GGCTGGGGGCATTTCGGGT FaF3'H CCGTAGCGTCTCAGTTCTTG ACGAGGTCCTGGTAGTTGTA FaPAL1 GATCTCGGAAAGAACAGCTAGAG GAAGGACTTGCTTTGGTGAATG FaPAL2 AGGGAGTAATGTTGTGGTTGAG GAGCAGCCATGCTTGTTAGA FaDFR CACGATTCACGACATTGCGAAATT GAACTCAAACCCCATCTCTTTCAGCTT FaANS GAAGTGCGTACCCAACTCCATCGT ACCTTCTCCTTGTTGACGAGCCC FaUFGT GGTAAGCCACAGGAGGACA TATGAGCACCGAACCAAAA FaMYB1 GCAACTTGAGGATCAGCC GGTGCCTGAGTTGAATCTC FaMYB10 TTACCAACAGAACCACCACA AAACCAAGACCAGAACACAT Actin TGTGCGACAATGGAACT CCCACATAGGCATCTTT 表 2 ‘红颜’草莓花色苷物质
Table 2 Anthocyanins of 'Benihoppe' strawberry strawberry
序号 Compounds 物质 1 Pelargonidin-3-O-glucoside 天竺葵素-3-O-葡萄糖苷 2 Pelargonidin-3,5-O-diglucoside 天竺葵素-3,5-O-二葡萄糖苷 3 Pelargonidin-3-O-galactoside 天竺葵素-3-O-半乳糖苷 4 Pelargonidin-3-O-rutinoside 天竺葵素-3-O-芸香糖苷 5 Pelargonidin-3-O-(6-O-malonyl-beta-D-glucoside) 天竺葵素-3-O-(6-O-丙二酰-β-D-葡萄糖苷) 6 Pelargonidin-3-O-arabinoside 天竺葵素-3-O-阿拉伯糖苷 7 Pelargonidin-3-O-sophoroside 天竺葵素-3-O-槐糖苷 8 Pelargonidin-3-O-sambubioside 天竺葵素-3-O-桑布双糖苷 9 Pelargonidin-3-O-sophoroside-5-O-(malonyl)-glucoside 天竺葵素-3-O-槐糖苷-5-O-(丙二酰基)-葡萄糖苷 10 Pelargonidin-3-O-(6-O-p-coumaroyl)-glucoside 天竺葵素-3-(6-O-p-对香豆酰)-葡萄糖苷 11 Cyanidin-3-O-(6-O-malonyl-beta-D-glucoside) 矢车菊素-3-O-(6-O-丙二酰-β-D-葡萄糖苷) 12 Cyanidin-3-O-glucoside 矢车菊素-3-O-葡萄糖苷 13 Cyanidin-3-O-xyloside 矢车菊素-3-O-木糖苷 14 Cyanidin-3-O-sambubioside 矢车菊素-3-O-桑布双糖苷 15 Cyanidin-3,5-O-diglucoside 矢车菊素-3,5-O-二葡萄糖苷 16 Cyanidin-3-O-rutinoside 矢车菊素-3-O-芸香糖苷 17 Peonidin-3-O-glucoside 芍药花素-3-O-葡萄糖苷 18 Peonidin-3-O-(6-O-malonyl-beta-D-glucoside) 芍药花素-3-O-(6-O-丙二酰-β-D-葡萄糖苷) 19 Peonidin-3-O-rutinoside 芍药花素-3-O-芸香糖苷 20 Peonidin-3-O-(6-O-p-coumaroyl)-glucoside 芍药花素-3-(6-O-p-对香豆酰)-葡萄糖苷 21 Delphinidin-3-O-galactoside 飞燕草素-3-O-半乳糖苷 22 Delphinidin-3-O-glucoside 飞燕草素-3-O-葡萄糖苷 23 Delphinidin-3-O-(6-O-malonyl-beta-D-glucoside) 飞燕草素-3-O-(6-O-丙二酰-β-D-葡萄糖苷) 24 Malvidin-3-O-glucoside 锦葵色素-3-O-葡萄糖苷 25 Procyanidin B1 原花青素B1 26 Procyanidin B2 原花青素B2 27 Procyanidin B3 原花青素B3 28 Procyanidin C1 原花青素C1 -
[1] 辛宇, 孙敬蒙, 张炜煜. 花青素生物活性及制剂的研究进展[J]. 食品工业科技,2021,42(17):413−422. [XIN Y, SUN J, ZHANG W. Research progress of physiological activity and preparations of anthocyanins[J]. Science and Technology of Food Industry,2021,42(17):413−422. XIN Y, SUN J, ZHANG W. Research progress of physiological activity and preparations of anthocyanins[J]. Science and Technology of Food Industry, 2021, 42(17): 413−422. (in Chinese with English abstract).
[2] 刘恺媛, 王茂良, 辛海波, 等. 植物花青素合成与调控研究进展[J]. 中国农学通报,2021,37(14):41−51. [LIU K Y, WANG M L, XIN H B, et al. Anthocyanin biosynthesis and regulate mechanisms in plants: A review[J]. Chinese Agricultural Science Bulletin,2021,37(14):41−51. doi: 10.11924/j.issn.1000-6850.casb2020-0390 LIU K Y, WANG M L, XIN H B, et al. Anthocyanin biosynthesis and regulate mechanisms in plants: A review [J]. Chinese Agricultural Science Bulletin, 2021, 37(14): 41-51. doi: 10.11924/j.issn.1000-6850.casb2020-0390
[3] 刘淑华, 臧丹丹, 孙燕, 等. 花青素生物合成途径及关键酶研究进展[J]. 土壤与作物,2022,11(3):336−346. [LIU S H, ZANG D D, SUN Y, et al. Research advances on biosynthesis pathway of anthocyanins and relevant key enzymes[J]. Soils and Crops,2022,11(3):336−346. doi: 10.11689/j.issn.2095-2961.2022.03.011 LIU S H, ZANG D D, SUN Y, et al. Research advances on biosynthesis pathway of anthocyanins and relevant key enzymes[J]. Soils and Crops, 2022, 11(3): 336-346. doi: 10.11689/j.issn.2095-2961.2022.03.011
[4] BURTON-FREEMAN B, SANDHU A, EDIRISINGHE I. Nutraceuticals. Chapter 35-anthocyanins[M]. Boston: Academic Press, 2016: 489-500.
[5] GROTEWOLD E. The genetics and biochemistry of floral pigments[J]. Annual Review of Plant Biology,2006,57:761−778. doi: 10.1146/annurev.arplant.57.032905.105248
[6] DA SILVA F L, ESCRIBANO-BAILÓN M T, PÉREZ ALONSO J J, et al. Anthocyanin pigments in strawberry[J]. LWT - Food Science and Technology,2007,40(2):374−382. doi: 10.1016/j.lwt.2005.09.018
[7] FRASER L G, SEAL A G, MONTEFIORI M, et al. An R2R3 MYB transcription factor determines red petal colour in an Actinidia (kiwifruit) hybrid population[J]. BMC Genomics,2013,14(1):1−19. doi: 10.1186/1471-2164-14-1
[8] POMBO M A, MARTÍNEZ G A, CIVELLO P M. Cloning of FaPAL6 gene from strawberry fruit and characterization of its expression and enzymatic activity in two cultivars with different anthocyanin accumulation[J]. Plant Science,2011,181(2):111−118. doi: 10.1016/j.plantsci.2011.04.012
[9] LUNKENBEIN S, COINER H, de VOS C H R, et al. Molecular characterization of a stable antisense chalcone synthase phenotype in strawberry (Fragaria×ananassa)[J]. Journal of Agricultural and Food Chemistry,2006,54(6):2145−2153. doi: 10.1021/jf052574z
[10] HOFFMANN T, KALINOWSKI G, SCHWAB W. RNAi-induced silencing of gene expression in strawberry fruit (Fragaria×ananassa) by agroinfiltration: A rapid assay for gene function analysis[J]. The Plant Journal,2006,48(5):818−826. doi: 10.1111/j.1365-313X.2006.02913.x
[11] JIANG F, WANG J, JIA H, et al. RNAi-mediated silencing of the flavanone 3-hydroxylase gene and its effect on flavonoid biosynthesis in strawberry fruit[J]. Journal of Plant Growth Regulation,2013,32(1):182−190. doi: 10.1007/s00344-012-9289-1
[12] LIN Y, JIANG L, CHEN Q, et al. Comparative transcriptome profiling analysis of red- and white-fleshed strawberry (Fragaria×ananassa) provides new insight into the regulation of the anthocyanin pathway[J]. Plant and Cell Physiology,2018,59(9):1844−1859.
[13] LIN X, XIAO M, LUO Y, et al. The effect of RNAi-induced silencing of FaDFR on anthocyanin metabolism in strawberry (Fragaria×ananassa) fruit[J]. Scientia Horticulturae,2013,160:123−128. doi: 10.1016/j.scienta.2013.05.024
[14] REDDY A M, REDDY V S, SCHEFFLER B E, et al. Novel transgenic rice overexpressing anthocyanidin synthase accumulates a mixture of flavonoids leading to an increased antioxidant potential[J]. Metabolic Engineering,2007,9(1):95−111. doi: 10.1016/j.ymben.2006.09.003
[15] GRIESSER M, HOFFMANN T, BELLIDO M L, et al. Redirection of flavonoid biosynthesis through the down-regulation of an anthocyanidin glucosyltransferase in ripening strawberry fruit[J]. Plant Physiology,2008,146(4):1528−1539. doi: 10.1104/pp.107.114280
[16] HAN Y, VIMOLMANGKANG S, SORIA-GUERRA R E, et al. Ectopic expression of apple F3′ H genes contributes to anthocyanin accumulation in the Arabidopsis tt7 mutant grown under nitrogen stress[J]. Plant Physiology,2010,153(2):806−820. doi: 10.1104/pp.109.152801
[17] HAN Y, VIMOLMANGKANG S, SORIA-GUERRA R E, et al. Introduction of apple ANR genes into tobacco inhibits expression of both CHI and DFR genes in flowers, leading to loss of anthocyanin[J]. Journal of Experimental Botany,2012,63(7):2437−2447. doi: 10.1093/jxb/err415
[18] JAAKOLA L. New insights into the regulation of anthocyanin biosynthesis in fruits[J]. Trends in Plant Science,2013,18(9):477−483. doi: 10.1016/j.tplants.2013.06.003
[19] ZHANG Z, SHI Y, MA Y, et al. The strawberry transcription factor FaRAV1 positively regulates anthocyanin accumulation by activation of FaMYB10 and anthocyanin pathway genes[J]. Plant Biotechnology Journal,2020,18(11):2267−2279. doi: 10.1111/pbi.13382
[20] LIN-WANG K, MCGHIE T K, WANG M, et al. Engineering the anthocyanin regulatory complex of strawberry (Fragaria vesca)[J]. Frontiers in Plant Science, 2014, 5.
[21] AHARONI A, De VOS C H R, WEIN M, et al. The strawberry FaMYB1 transcription factor suppresses anthocyanin and flavonol accumulation in transgenic tobacco[J]. The Plant Journal,2001,28(3):319−332. doi: 10.1046/j.1365-313X.2001.01154.x
[22] MAO W, HAN Y, CHEN Y, et al. Low temperature inhibits anthocyanin accumulation in strawberry fruit by activating FvMAPK3-induced phosphorylation of FvMYB10 and degradation of Chalcone Synthase 1[J]. The Plant Cell,2022,34(4):1226−1249. doi: 10.1093/plcell/koac006
[23] LEE C, LEE J, LEE J. Relationship of fruit color and anthocyanin content with related gene expression differ in strawberry cultivars during shelf life[J]. Scientia Horticulturae,2022,301:111109. doi: 10.1016/j.scienta.2022.111109
[24] LI D, LUO Z, MOU W, et al. ABA and UV-C effects on quality, antioxidant capacity and anthocyanin contents of strawberry fruit (Fragaria ananassa Duch.)[J]. Postharvest Biology and Technology,2014,90:56−62. doi: 10.1016/j.postharvbio.2013.12.006
[25] XU W, PENG H, YANG T, et al. Effect of calcium on strawberry fruit flavonoid pathway gene expression and anthocyanin accumulation[J]. Plant Physiology and Biochemistry,2014,82:289−298. doi: 10.1016/j.plaphy.2014.06.015
[26] JIANG T, ZHANG M D, WEN C X, et al. Integrated metabolomic and transcriptomic analysis of the anthocyanin regulatory networks in Salvia miltiorrhiza bge[J]. BMC Plant Biology,2020,20(1):349. doi: 10.1186/s12870-020-02553-7
[27] YUAN H, ZENG X, SHI J, et al. Time-Course comparative metabolite profiling under osmotic stress in tolerant and sensitive tibetan hulless barley[J]. BioMed Research International,2018,2018:9415409.
[28] SALVATIERRA A, PIMENTEL P, MOYA-LEON M A, et al. Comparison of transcriptional profiles of flavonoid genes and anthocyanin contents during fruit development of two botanical forms of Fragaria chiloensis ssp. Chiloensis[J]. Phytochemistry,2010,71(16):1839−1847. doi: 10.1016/j.phytochem.2010.08.005
[29] 李栋. 高浓度CO2处理调控采后草莓花色苷合成机制研究[D]. 杭州: 浙江大学, 2021. LI D. The regulation of elevated CO2 on anthocyanin synthesis in postharvest strawberry fruit[D]. Hangzhou: Zhejiang University, 2021.
[30] 宋盼, 赵凤莉, 宋艳红, 等. 草莓果实花色苷合成途径相关结构基因及FaMYB10表达模式差异分析[J]. 果树学报,2020,37(11):1636−1646. [SONG P, ZHAO F L, SONG Y H, et al. Expression analysis of FaMYB10 transcription factor and structural genes related to anthocyanin biosynthesis in strawberry (Fragaria×ananassa) fruit[J]. Journal of Fruit Science,2020,37(11):1636−1646. SONG P, ZHAO F L, SONG Y H, et al. Expression analysis of FaMYB10 transcription factor and structural genes related to anthocyanin biosynthesis in strawberry (Fragaria×ananassa) fruit[J]. Journal of Fruit Science, 2020, 37(11): 1636-1646.
[31] KADOMURA-ISHIKAWA Y, MIYAWAKI K, TAKAHASHI A, et al. RNAi-mediated silencing and overexpression of the FaMYB1 gene and its effect on anthocyanin accumulation in strawberry fruit[J]. Biologia Plantarum,2015,59(4):677−685. doi: 10.1007/s10535-015-0548-4
[32] HONDA C, MORIYA S. Anthocyanin biosynthesis in apple fruit[J]. The Horticulture Journal,2018,87(3):305−314. doi: 10.2503/hortj.OKD-R01
[33] SUN X, HAN J, FANG J G, et al. Important research progress of coloring molecular mechanisms in grape berry[J]. Plant Physiology Journal,2012,48:333−342.
[34] 羊芹, 杜泓璇, 马尧, 等. 柳树叶的原花青素的抗氧化性研究[J]. 西南大学学报(自然科学版),2009,31(6):106−110. [YANG Q, DU H X, MA Y, et al. Study on antioxidantive activity of procyanidins from the leaves of willow[J]. Journal of Southwest University (Natural Science Edition),2009,31(6):106−110. YANG Q, DU H X, MA Y, et al. Study on antioxidantive activity of procyanidins from the leaves of willow[J]. Journal of Southwest University (Natural Science Edition), 2009, 31(6): 106-110.
[35] 李小乐. 重庆地区四种鲜食葡萄原花青素含量与品质的相关性研究[D]. 重庆: 西南大学, 2012. LI X L. Research of the procyanidins and quality relationship of the four grape varieties in Chongqing[D]. Chongqing: Southwest University, 2012.
[36] HÉBERT C, CHARLES M T, GAUTHIER L, et al. Strawberry proanthocyanidins: Biochemical markers for Botrytis cinerea resistance and shelf-life predictability[J]. Acta Horticulturae, 2000: 659-662.
[37] JIANG L, YUE M, LIU Y, et al. Alterations of phenylpropanoid biosynthesis lead to the natural formation of Pinkish-Skinned and White-Fleshed strawberry (Fragaria×ananassa)[J]. International Journal of Molecular Sciences,2022,23(13):7375. doi: 10.3390/ijms23137375
[38] HONDA C, KOTODA N, WADA M, et al. Anthocyanin biosynthetic genes are coordinately expressed during red coloration in apple skin[J]. Plant Physiology and Biochemistry,2002,40(11):955−962. doi: 10.1016/S0981-9428(02)01454-7
[39] HOSSAIN M R, KIM H, SHANMUGAM A, et al. Expression profiling of regulatory and biosynthetic genes in contrastingly anthocyanin rich strawberry (Fragaria×ananassa) cultivars reveals key genetic determinants of fruit color[J]. International Journal of Molecular Sciences,2018,19(3):656. doi: 10.3390/ijms19030656
-
期刊类型引用(2)
1. 龙会英,张德. 干热区紫花苜蓿的生产性能和营养价值评价. 草业科学. 2024(01): 117-125 .  百度学术
百度学术
2. 王子凌,张子豪,曾璐瑶,劳梦甜,王海滨,王琦,彭利娟,路洪艳,邹圣碧. 不同卤制加工阶段中食盐添加量对小龙虾尾品质及挥发性风味的影响. 食品科学. 2024(11): 52-60 .  百度学术
百度学术
其他类型引用(2)






 下载:
下载:


 下载:
下载:



