Research Progress Based on Gliadin Delivery Systems
-
摘要: 麦醇溶蛋白,作为从小麦中提取得到的醇溶谷蛋白,因其良好的生物相容性、疏水性、微极性、胶黏性以及修饰和增强功能成分释放的能力,使其成为众多功能成分的潜在载体。本文对麦醇溶蛋白的结构、麦醇溶蛋白基载体的制备方法(反溶剂沉淀法、pH循环法、溶剂蒸发法、静电喷雾法、非静电络合法)及其在各类功能成分(抗氧化剂、酶、维生素、抗生素)递送中应用进行综述,并对不同制备方法的优缺点进行比较,以期为不同应用需求下麦醇溶蛋白递送体系的制备、拓展、开发以及为麦醇溶蛋白递送体系在食品、医药、生物骨架等方面的应用提供理论基础。Abstract: Gliadins, as prolamins extracted from wheat, have become potential promising carriers of multitudinous functional components due to their excellent biocompatibility, hydrophobicity, micropolarity, tackiness and ability to modify and enhance the release of functional components. This paper reviews the structure of gliadin, the preparation methods of gliadin-based carriers (antisolvent precipitation methods, pH-cycle methods, solvent evaporation methods, electrospraying methods, non-electrostatic complexation methods) and their applications in the delivery of a wide range of functional components (antioxidants, enzymes, vitamins, antibiotics), further more compares the corresponding advantages and disadvantages of each, in the hope of providing a theoretical basis for the preparation, expansion and development of gliadin delivery systems under different application requirements, as well as the applications of gliadin delivery systems in food, medicine, biological skeleton, etc.
-
Keywords:
- gliadin /
- delivery system /
- antioxidant /
- vitamin /
- enzyme
-
蛋白质的两亲性、可生物降解性和可代谢性使其十分适用于功能成分的特异性结合和靶向递送[1]。相较于动物蛋白的免疫原性以及被动物传染病污染的风险[2],而从天然植物中提取的植物蛋白,包括豆类蛋白、醇溶谷蛋白等,则可以克服上述动物蛋白的限制[3]。根据联合国粮食及农业组织《作物前景与粮食形势》统计数据,截至2021年,小麦在全球谷物产量和贸易量中排名第二[4]。麦醇溶蛋白是小麦蛋白的主要成分,占小麦总蛋白质含量45%~50%[5],其不溶于水、稀盐溶液、稀酸和稀碱溶液以及无水乙醇,除极端pH条件下,麦醇溶蛋白仅溶于60%~90%(v/v)的乙醇水溶液,较强的疏水性是由于麦醇溶蛋白中的二硫键的存在和疏水相互作用导致肽链呈折叠形式[6]。麦醇溶蛋白具有良好的生物相容性、疏水性、微极性、胶黏性及修饰、增强和靶向功能成分释放的能力,这些性质使其在功能成分递送中发挥着关键作用,除此之外,其来源广、成本低的特性也促使其广泛应用于食品、制药、生物骨架和功能成分递送等方面[7]。
本文总结了麦醇溶蛋白的结构、麦醇溶蛋白的制备方法以及麦醇溶蛋白作为功能成分载体在不同功能成分递送体系构建中的应用,以期为拓展麦醇溶蛋白基递送体系提供一定的理论依据,推动麦醇溶蛋白基递送体系的深入研究。
1. 麦醇溶蛋白结构
麦醇溶蛋白为分子量约为30~80 kDa的单体小分子球状蛋白,主体由分子内氢键、二硫键、范德华力以及疏水相互作用等作用力连结的单一多肽链构成[8]。麦醇溶蛋白包含两个主要结构域:富含谷氨酰胺和脯氨酸的中心疏水区域(CS)以及包围中心疏水结构域且富含疏水氨基酸的末端疏水部分(T)[9]。按照低pH条件下的电泳迁移率可将麦醇溶蛋白分成四组带:α-麦醇溶蛋白(25%,25~35 kDa)、β-麦醇溶蛋白(30%,30~35 kDa)、γ-麦醇溶蛋白(30%,35~40 kDa)和ω-麦醇溶蛋白(15%,55~70 kDa)[10]。电泳迁移率并不完全反映蛋白质特性,以氨基酸序列和氨基酸组成对麦醇溶蛋白进行分析,可将其分为三种类型:α/β-麦醇溶蛋白、γ-麦醇溶蛋白、ω-麦醇溶蛋白[11]。其中α/β-麦醇溶蛋白和γ-麦醇溶蛋白由于具有长碳-TS链和短氨基-TS链而具有高度两亲性;而ω-麦醇溶蛋白则由CS占据ω-麦醇溶蛋白结构的90%~95%且具有短碳-TS链和短氨基-TS链[12],由于ω-麦醇溶蛋白具有比α/β-麦醇溶蛋白和γ-麦醇溶蛋白更少的疏水表面,因而ω-麦醇溶蛋白是麦醇溶蛋白中疏水性最弱的[13]。由于ω-麦醇溶蛋白没有半胱氨酸残基,因此不存在二硫键,故被称为贫硫醇溶蛋白;对应的α/β-麦醇溶蛋白和γ-麦醇溶蛋白被称为富硫醇溶蛋白[14]。
α/β-麦醇溶蛋白通常包含一个由20个氨基酸残基组成的多肽,一个由5个氨基酸残基组成的N端区域,一个由110~130个氨基酸残基组成的重复区域和一个由140~160个氨基酸残基组成的C端区域[15]。重复区域主要由富含谷氨酰胺、脯氨酸、苯丙氨酸和酪氨酸的重复单元组成,α/β-麦醇溶蛋白的重复单元是PFP(Q)3-6[16]。γ-麦醇溶蛋白包含一个由19个氨基酸残基组成的多肽、一个12个氨基酸残基的N端区域、一个由80~160个氨基酸残基组成的重复区域和一个由140~150个氨基酸残基组成的C端区域[15]。γ-麦醇溶蛋白重复区域的典型重复单元是(PFPQ)1-2(PQQ)1-2[16]。ω-麦醇溶蛋白包含一个由19个氨基酸残基组成的多肽、一个11个氨基酸残基的N端区域、一个由约238个氨基酸残基组成的重复区域和一个由12个氨基酸残基组成的C端区域[33]。按照分子量的不同可将ω-麦醇溶蛋白分为1A ω-麦醇溶蛋白、1B ω-麦醇溶蛋白和1D ω-麦醇溶蛋白。1A ω-麦醇溶蛋白和1D ω-麦醇溶蛋白的重复区域具有类似的重复单元PF(PQQ)1-2PQ2;1B ω-麦醇溶蛋白的重复单元略有不同:FP(Q)2-4[16]。ω-麦醇溶蛋白的特点是谷氨酰胺、脯氨酸和苯丙氨酸含量最高,这些氨基酸总和可占总氨基酸含量的80%左右[17]。
2. 麦醇溶蛋白基载体制备方法
目前,麦醇溶蛋白基递送体系以麦醇溶蛋白纳米颗粒或由麦醇溶蛋白纳米颗粒制备得到的Pickering乳液为主,因此在麦醇溶蛋白基载体制备方法中主要介绍纳米颗粒的制备方法。
2.1 反溶剂沉淀法
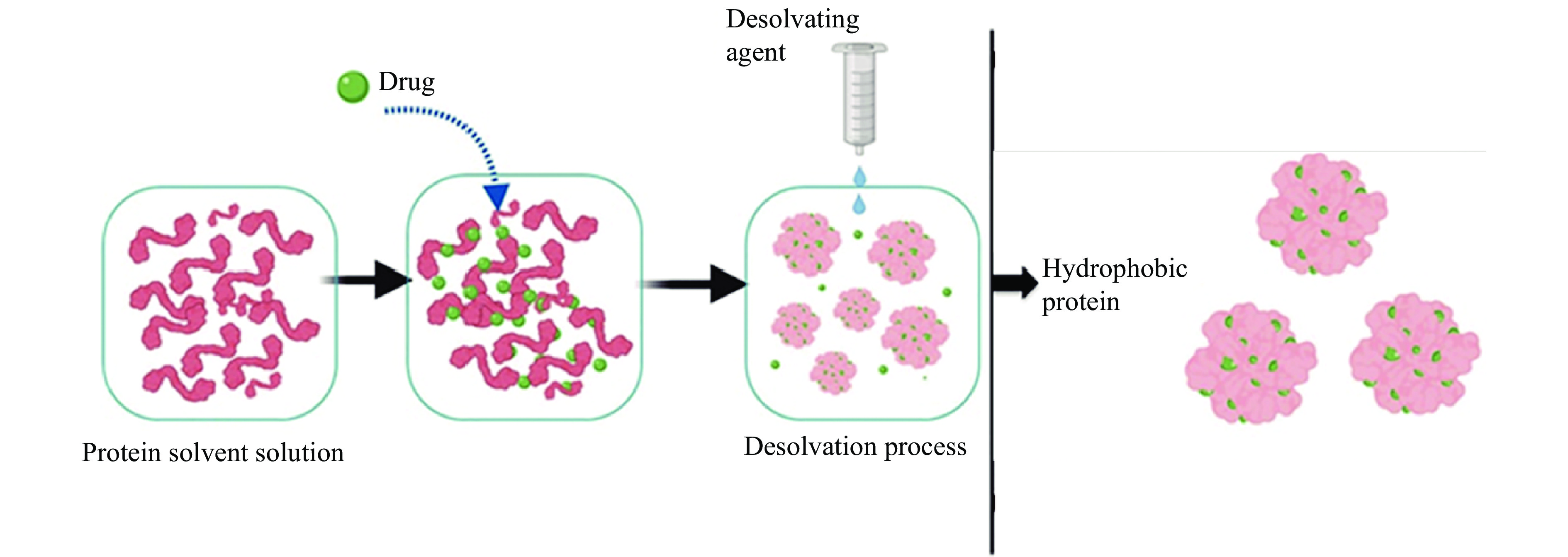
目前最主流的制备麦醇溶蛋白纳米颗粒的方法是反溶剂沉淀法,这种方法是基于蛋白质的脱溶(纳米沉淀)现象。首先,将蛋白和功能成分溶解在有机相(醇/水)中;其次,在各种混合条件(例如,涡流搅拌、超声处理和均质化)下,在溶液中注入pH远离等电点的水等反溶剂;最后,体系中的有机相可通过旋转蒸发或冷冻干燥除去,如图1所示[18]。纳米颗粒的形成主要是通过氢键、静电相互作用和疏水相互作用。有机相的组成会影响形成的纳米颗粒的平均尺寸,一般来说,有机相为乙醇/水制备得到的颗粒比丙醇/水得到纳米颗粒的平均尺寸更小[19]。通过反溶剂沉淀法诱导的单一蛋白纳米颗粒由于较低的Zeta电位因而有聚集和形成大的团聚体的趋势[20]。为了优化单一蛋白纳米颗粒性质,可通过添加两种或多种水不溶性成分(例如,蛋白质、脂质和多糖)使用反溶剂沉淀法制备复合纳米颗粒。在这些情况下,这些方法可分为逐步反溶剂沉淀法和反溶剂共沉淀法[21]。在逐步反溶剂沉淀过程中,将成分溶液逐步注入反溶剂中,纳米颗粒在第一个反溶剂沉淀步骤中自发形成,然后其他成分在随后的反溶剂沉淀步骤中自发附着到预先制备的纳米粒子上。在反溶剂共沉淀过程中,各成分溶解在同一溶液中,而后将具有多组分成分的溶液注入反溶剂中,其中多组分成分自发地同时形成复合的纳米颗粒。与逐步反溶剂沉淀法相比,反溶剂共沉淀法产生的纳米颗粒粒径更小,表面更粗糙,浊度更低,包埋率更高[22]。反溶剂沉淀法有许多明显的优点,如操作过程简单,稳定性高,包埋率高、可制备得到粒径较小的纳米颗粒,并且能够通过调整制备条件控制纳米颗粒粒径大小。然而反溶剂沉淀法也存在一些不足:一方面反溶剂后溶剂中低比例有机溶剂使得有机溶剂较难去除,使用旋转蒸发或冷冻干燥又会导致一定程度上纳米颗粒的聚集;另一方面反溶剂沉淀法制备出的纳米颗粒浓度较低,在工业生产应用上有明显的局限性;除此之外,该方法只适用于受脱溶过程影响较小或被转运蛋白稀释的蛋白质[23]。
2.2 pH循环法
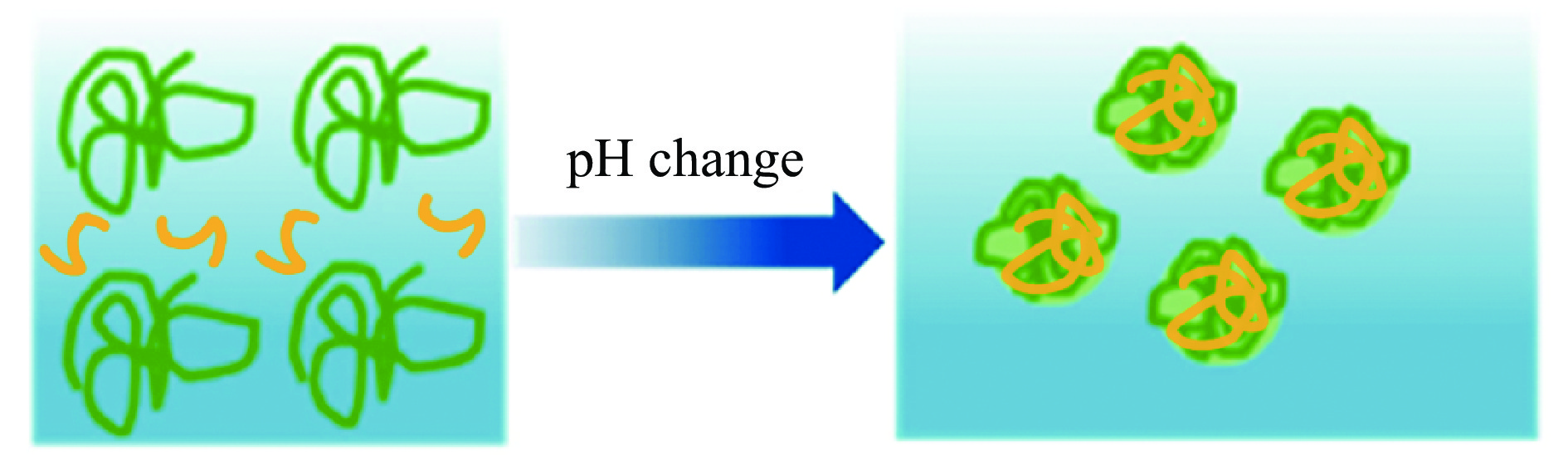
pH循环法是一种基于不同pH下疏水麦醇溶蛋白的不同溶解度制备疏水麦醇溶蛋白纳米颗粒的有效方法。首先,将蛋白和功能成分溶解在强碱性水溶液中;其次,将pH调节至中性或酸性等蛋白溶解度较低的pH,从而形成自组装纳米颗粒(如图2),其可以由蛋白质、蛋白质/多糖混合物或蛋白质/多酚混合物等组成[21]。可以通过添加D-葡萄糖酸-δ-内酯或盐酸[24]或添加酸性成分[25]来调节体系的pH,诱导纳米颗粒的形成。与盐酸相比D-葡萄糖酸-δ-内酯可以诱导形成粒径更小、更稳定、粒径分布更窄的纳米颗粒[24]。pH循环法适用于多种谷蛋白纳米颗粒的制备(如:豌豆蛋白、大豆蛋白、玉米醇溶蛋白等),也是制备谷蛋白纳米颗粒最常用的方法之一,这种方法能够规避纳米颗粒制备过程中使用的有机化学品造成的可燃性风险和爆炸危害、并且该方法操作过程简单、成本低廉、适合工业生产。pH循环法也存在一些缺点:滴定过程费时费力;体系中添加的酸性物质与碱中和后会形成大量的盐。这些盐的存在一方面会产生一定的电性中和,造成纳米颗粒的聚集,影响纳米颗粒的稳定性;另一方面也工业生产中体系中添加的其他成分的稳定性也会受到影响;除此之外,大量盐的存在对于食品安全的影响也值得考虑[21]。
2.3 溶剂蒸发法
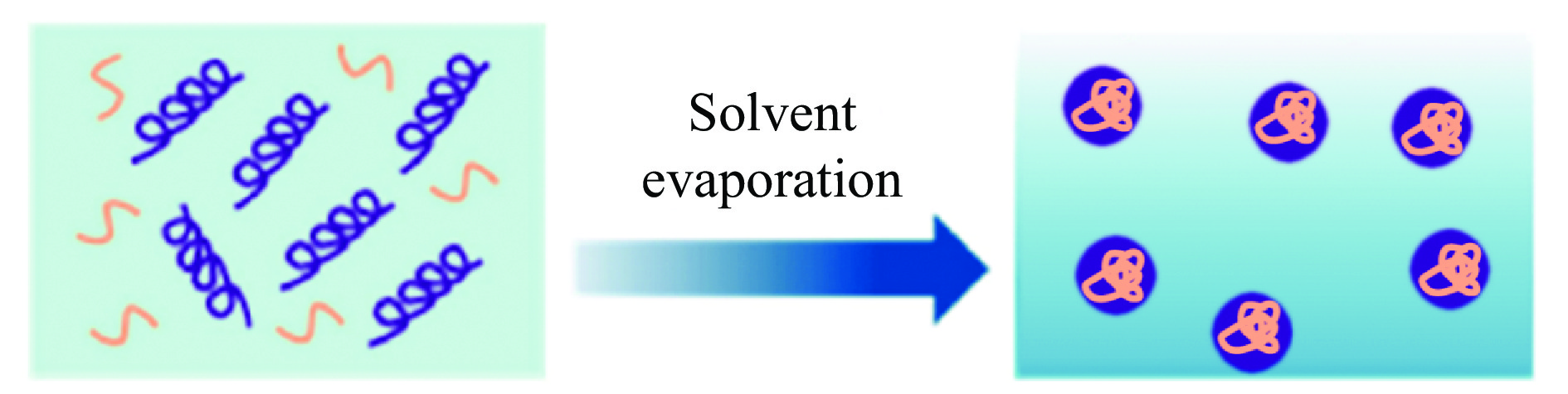
溶剂蒸发法是通过蒸发溶剂制备麦醇溶蛋白纳米颗粒的常见方法。首先,将蛋白和功能成分溶解在有机相(醇/水)中。然后,通过旋转蒸发去除体系中的有机溶剂,由于体系中蛋白的过饱和从而自发形成纳米颗粒[21](图3)。通过向有机相中添加可溶于有机相的蛋白、多糖或小分子乳化剂,可以制备得到复合醇溶蛋白纳米颗粒[26]。溶剂蒸发法具有操作流程简单、成本低廉、稳定性高、包埋率高、纳米颗粒形状大小可控等显著优势。由于蒸发过程中体系中有机相的去除以及部分水相的去除,因此在制备高浓度醇溶蛋白颗粒的情况下,溶剂蒸发法是获得理想的蛋白质基纳米颗粒的有效方法[27]。由于蒸发过程中溶剂的减少以及长时间的升温环境,溶剂蒸发法一般需要两亲性的表面活性剂和稳定剂,且该法制备出纳米颗粒的粒径一般大于反溶剂沉淀法[21]。
2.4 静电喷雾法
麦醇溶蛋白纳米颗粒也可以通过静电喷雾法进行制备。首先,将溶解在乙醇/水相中的蛋白和功能成分的混合溶液加入设定流速的注射泵中,注射泵所连喷嘴同时接有高压电源,静电喷雾系统通过对混合溶液施加高电压来产生液滴,带电的液滴从喷嘴的尖端喷射出来由于溶剂蒸发或固化形成颗粒,如图4所示[18]。静电喷雾法与传统方法相比具有几个优点,例如:高稳定性、可重复性、可制备得到粒径较小的纳米颗粒且适于工业生产应用,除此之外,静电喷雾法可以提高功能成分的负载率且有利于颗粒的自分散,而不会降低包埋率和生物相容性,并且以静电喷雾法制备得到的纳米颗粒不需要任何模板或表面活性剂来避免颗粒的沉积[28-29]。然而,静电喷雾法产生纳米颗粒仅适用于喷雾液体为低粘度流体,若喷雾液体为较高粘度的液体则会产生纳米纤维(静电纺丝);由于高压喷雾过程中施加的应力(例如干燥中的热应力,喷嘴中的剪切应力),这种技术可能会导致一些大分子降解[30]。
2.5 非静电络合法
在典型的非静电络合过程中,纳米颗粒可以通过两种或多种物质在水溶液中通过疏水相互作用和氢键等非静电相互作用形成,其中,蛋白质和多酚可以通过这些非静电相互作用形成了复杂的纳米颗粒(如图5),这也是食品饮料中雾度的由来。在非静电络合法中,可以通过在醇/水溶液中简单地混合麦醇溶蛋白、多酚等成分来简易地制备复合纳米颗粒。该方法具有制备工艺简单、温和等多种优点。此外,这种方法不需要使用有机溶剂、剧烈的机械剪切或高能量输入,是一种绿色、节能、环保的纳米颗粒制备方法[31]。但需要注意的是,这种方法只适用于能产生非静电相互作用的成分,除此之外,多酚还可以通过诱导蛋白共价交联的方式形成纳米颗粒[32-33]。表1对麦醇溶蛋白纳米颗粒的制备方法进行比较总结。
表 1 麦醇溶蛋白纳米颗粒制备方法比较Table 1. Comparison of preparation methods of gliadin nanoparticles制备方法 机理 优点 缺点 参考文献 反溶剂沉淀法 蛋白质的脱溶现象 操作简单
稳定性高
包埋率高
粒径较小且可控有机溶剂较难去除
纳米颗粒浓度较低
只适用于受脱溶过程影响较小或被转运蛋白稀释的蛋白质[18,22-23] pH循环法 不同pH下的溶解度不同 操作简单
稳定性高
绿色安全
适合工业生产滴定费时费力
酸碱中和形成大量的盐[21] 溶剂蒸发法 蛋白的过饱和 操作简单
稳定性高
包埋率高
纳米颗粒形状大小可控
适合制备高浓度纳米颗粒一般需要两亲性的表面活性剂和稳定剂
粒径一般大于反溶剂沉淀法[21,27] 静电喷雾法 高压喷射 稳定性高
包埋率高
可重复性
自分散性
粒径较小
适合工业生产仅适用于低粘度流体
操作应力会导致大分子降解[28-30] 非静电络合法 非静电相互作用 工艺简单温和
绿色节能环保只适用于能产生非静电相互作用的成分 [31-32] 3. 麦醇溶蛋白在功能成分递送中的应用
麦醇溶蛋白具有的生物相容性、疏水性、微极性以及修饰和增强功能成分释放的能力,使它们成为许多功能成分的潜在载体[7]。此外,麦醇溶蛋白的物理特性使其可以制备为纳米颗粒、薄膜、纤维和生物骨架等多种形态。
3.1 麦醇溶蛋白作为抗氧化剂载体
抗氧化剂可作为氢供体,通过形成稳定自由基以减缓或终止自由基链式反应,从而延迟或抑制细胞内外成分的氧化,有效预防各类相关疾病的发生[34]。常见的抗氧化剂包括:黄酮、多酚、维生素及一些天然色素(如类胡萝卜素、叶绿素等),而麦醇溶蛋白中高含量的谷氨酰胺残基也促使其成为一种具有较高的抗氧化活性的功能蛋白[35]。与玉米醇溶蛋白、白蛋白和大豆蛋白相比,高水分活度的麦醇溶蛋白是抑制亚油酸过氧化最有效的抗氧化剂[36]。因而以麦醇溶蛋白作为抗氧化剂载体可能会提高体系的抗氧化活性。
Sinekar等[37]以反溶剂沉淀法制备了叶酸偶联和非叶酸偶联麦醇溶蛋白姜黄素纳米颗粒,结果显示,非叶酸偶联麦醇溶蛋白纳米颗粒对姜黄素的累积释放率最高可达92.92%,叶酸偶联麦醇溶蛋白纳米颗粒对姜黄素的累积释放率最高可达94%,在整个实验过程中,两种颗粒都具有更好的稳定性、生物利用度以及更强的对结肠癌肿瘤细胞的靶向能力,且未观察到体内毒性。Akman等[30]研究了食品级麦胶蛋白纳米纤维作为姜黄素运载载体的可行性和潜力,结果显示,随着麦醇溶蛋白浓度的增加,麦醇溶蛋白纳米颗粒逐渐转化为麦醇溶蛋白纳米纤维,纳米纤维几乎均匀,表面光滑,平均直径在258~375 nm之间,麦醇溶蛋白蛋白纳米纤维的包埋率随着姜黄素负载量的增加而增加,对纳米纤维的体外评估表明,负载姜黄素的麦醇溶蛋白纳米纤维表现出对姜黄素的可控释放,并增强其自由基清除能力。此外,这些纳米纤维对金黄色葡萄球菌和大肠杆菌表现出较高水平的抗菌活性。Kelte等[38]以麦醇溶蛋白和壳聚糖对橙皮苷进行包埋,结果显示,复合纳米颗粒48 h后的释放效率可达98%,纳米颗粒降低了橙皮苷对健康细胞(Vero细胞)的细胞毒性,并增强了对肿瘤细胞(HeLa、PC-3和Caco-2细胞)的细胞毒性,这一结果表明,壳聚糖包被的麦醇溶蛋白纳米颗粒是用于癌症治疗的橙皮苷递送的潜在载体。He等[39]发现麦醇溶蛋白可以提高根皮素的光热稳定性、pH稳定性和抗氧化活性,抑制活性氧的产生,可使细胞内抗氧化酶活性恢复到正常水平,抑制丙二醛的产生,从而保护红细胞免受氧化应激;其包埋的根皮素的生物可及性达到约55%,是游离根皮素的两倍多,B16小鼠黑色素瘤细胞活力和摄取实验结果表明纳米颗粒无细胞毒性。综上,麦醇溶蛋白不仅能够提高抗氧化功能成分的理化稳定性、生物利用度、抗氧化活性和抗菌活性,还可以降低这些功能成分对正常细胞的细胞毒性,特异性提高功能成分对肿瘤细胞的细胞毒性,麦醇溶蛋白可以成为抗氧化剂递送的有效载体,其在食品医药工业中具有应用潜力。表2对麦醇溶蛋白在递送抗氧化剂方面的其他应用进行了总结。
表 2 麦醇溶蛋白在抗氧化剂递送体系中应用Table 2. Applications of gliadin in the delivery of antioxidants功能成分 形态 制备方法 主要发现 参考文献 类黄酮 姜黄素 纳米颗粒 pH循环法 以麦醇溶蛋白-鼠李糖脂制备的纳米颗粒具有更好的热稳定性、光稳定性、物理稳定性和再分散性。 [40] 纳米颗粒 反溶剂沉淀法 三聚磷酸钠交联的麦醇溶蛋白-壳聚糖复合纳米颗粒的热稳定性、光稳定性、DPPH自由基清除能力和体外神经保护作用得到提高。 [41] 槲皮素 纳米颗粒 反溶剂沉淀法 调整麦醇溶蛋白:卵磷脂比例可以增强槲皮素的生物可及性,提高其生物活性,有利于槲皮素的位点特异性口服递送。 [42] 纳米颗粒 反溶剂沉淀法 pH5.0时麦醇溶蛋白的结构转变可能会降低麦醇溶蛋白的过敏原性。 [43] 纳米颗粒 静电喷雾法 槲皮素均匀分布在麦醇溶蛋白基质中,负载槲皮素的麦醇溶蛋白颗粒的释放行为:较短的初始突释期、较长的缓释期和较短的稳定释放期。 [44] 芦丁 纳米颗粒 反溶剂沉淀法 复合颗粒改善了颗粒的乳化特性并增强了所制备乳液的稳定性和凝胶特性。 [45] 聚甲氧基黄酮 纳米颗粒 反溶剂沉淀法 麦醇溶蛋白纳米颗粒对Caco-2细胞的毒性很小或没有毒性,Caco-2细胞对聚甲氧基黄酮的摄取是时间依赖性的。 [46] 纳米颗粒 旋转蒸发法 麦醇溶蛋白纳米颗粒复合颗粒表现出对HUVEC细胞更强的细胞内
自由基清除能力。[47] 非黄酮类多酚 白藜芦醇 纳米颗粒 反溶剂沉淀法 麦醇溶蛋白-阿拉伯胶-壳聚糖复合纳米颗粒提高了白藜芦醇的理化稳定性和生物利用度,复合颗粒具有更强的DPPH自由基清除活性和Fe3+负载能力。 [48] 原花青素 纳米颗粒 非静电络合法 负载原花青的麦醇溶蛋白颗粒的DPPH自由基清除活性明显提高,复合颗粒对正常肝细胞未发现细胞毒性,而对肝癌细胞表现出明显的细胞毒性。 [49] 单宁酸 纳米颗粒 反溶剂沉淀法 由复合颗粒稳定的乳液在30 d的贮藏期内具有最好的贮藏稳定性,共价复合颗粒在油/水界面表现出中等润湿性和较好的乳化性能。 [50] 类胡萝
卜素岩藻黄质 纳米颗粒 反溶剂沉淀法 复合颗粒提高了岩藻黄质的光热稳定性,并抑制了模拟胃液中岩藻黄质的释放,增强了模拟肠液和模拟结肠液中岩藻黄质的释放。 [51] β-胡萝卜素 Pickering乳液 高速剪切 随麦醇溶蛋白颗粒浓度提高,β-胡萝卜素乳液的热稳定性和贮藏稳定性提高,提高β-胡萝卜素的生物利用度。 [52] Pickering乳液 高速剪切 麦醇溶蛋白颗粒增强了β-胡萝卜素乳液的热稳定性、pH稳定性、物理稳定性和离子强度稳定性。 [53] 3.2 麦醇溶蛋白作为维生素载体
维生素是满足人体多项生化功能的主要营养素之一。其具有增强免疫和神经系统,预防心血管疾病,提高体力并维持正常的代谢率等各项功能,然而维生素易受氧气、光、热、水分和pH等因素的影响[54]。Duclairoir等[55]以反溶剂沉淀法制备了包埋维生素E的麦醇溶蛋白纳米颗粒,结果显示,负载维生素E的麦醇溶蛋白颗粒粒径约为900 nm,电位接近于零,麦醇溶蛋白对维生素E的包埋率超过77%,麦醇溶蛋白对维生素E的释放行为为“爆发效应”,而后通过均匀球体扩散,说明麦醇溶蛋白纳米颗粒是负载和释放维生素E的有效载体。Duclairoir等[56]以反溶剂沉淀法制备了包埋全反式维甲酸的麦醇溶蛋白纳米颗粒,这些纳米颗粒在PBS缓冲液及去离子水中表现出良好的贮藏稳定性,作为全反式维甲酸的载体,麦醇溶蛋白的包埋率约为75%,全反式维甲酸以两相释放的方式释放,特征是初期快速释放,而后进行连续而缓慢的扩散释放,这证明了麦醇溶蛋白在运载缓释全反式维甲酸方面的优势。
3.3 麦醇溶蛋白作为酶载体
超氧化物歧化酶(SOD)是一种抗氧化酶,其在治疗氧化应激相关的疾病方面发挥着重要作用,比如炎症、感染、呼吸系统疾病、代谢疾病、心血管疾病、和生育障碍等[57]。然而这种抗氧化酶会在胃肠道内被消化失活,使其生物利用度降低。哈密瓜提取物是一种富含SOD、过氧化氢酶和谷胱甘肽过氧化物酶活性的一种植物提取物[58]。麦醇溶蛋白具有的粘膜粘附和捕获活性成分的特性使其能够在消化过程中保护SOD并启动肠粘膜免疫系统,不仅延缓SOD在胃肠消化过程中的降解,而且还能够增强细胞的抗氧化状态并防止氧化应激诱导的细胞死亡[59]。Kick等[58]探究了负载哈密瓜提取物的麦醇溶蛋白对氧化应激引起的DNA损伤的效果,结果显示,这种组合减少了氧化应激造成的DNA损伤,减少了脊髓细胞凋亡,减轻局部静脉酸中毒,并减少了硝酸盐和亚硝酸盐的产生,但对脂质过氧化和器官功能没有任何影响。Ouali等[60]探究了负载哈密瓜提取物的麦醇溶蛋白对偶氮甲烷诱导的大鼠结肠氧化应激和癌变的保护作用,结果显示,哈密瓜提取物-麦醇溶蛋白不仅降低了脂质过氧化物酶水平,还提高了SOD、还原型谷胱甘肽(GSH)、GSH-S-转移酶和过氧化氢酶的活性,哈密瓜提取物-麦醇溶蛋白还能减少炎性细胞因子和趋化因子的产生,降低结直肠癌标志物水平,说明负载哈密瓜提取物的麦醇溶蛋白对于大鼠结肠细胞癌变具有预防和抑制作用这归因于其抗氧化作用和抗炎活性。Koike等[61]探究了哈密瓜提取物-麦醇溶蛋白对机车综合征(骨关节炎、骨质疏松症和肌肉减少症导致的活动能力下降)的影响,结果显示,哈密瓜提取物-麦醇溶蛋白具有降低氧化标志物和炎性标志物水平的趋势,倾向于改善患有膝关节或下背部疼痛不适的参与者的主观症状,有助于预防运动综合征的恶化。
溶菌酶是一种广泛存在于多种生物中的酶,对细菌细胞壁具有特定的水解活性,对人体无毒害,其通过水解细胞壁肽聚糖中N-乙酰胞壁酸和N-乙酰氨基葡萄糖之间的β-1,4键从而杀灭革兰氏阳性菌,而革兰氏阴性菌由于只有夹在内膜和外膜之间不含磷壁酸的单层肽聚糖而对溶菌酶并不敏感[62]。Fajardo等[63]制备了负载溶菌酶的麦醇溶蛋白膜,结果显示,溶菌酶的释放速率由麦醇溶蛋白基质的网状结构控制。因此,较高的交联度会导致溶菌酶释放速率减慢,而对于具有松散交联结构的薄膜,其释放的溶菌酶剂量最大,具有最高的抗菌活性。
3.4 麦醇溶蛋白作为抗生素载体
由于麦醇溶蛋白富含能与消化道黏膜尤其是肠粘膜的上部区域建立多种相互作用的中性和亲脂性氨基酸,因而已被广泛用于胃肠道给药[13]。除此之外,麦醇溶蛋白的生物相容性、疏水性、微极性以及修饰和增强药物释放曲线的能力,使其成为许多药物的潜在载体[7]。Liu等[64]以改进的同轴静电喷雾法制备一种新型的核-鞘结构麦醇溶蛋白纳米纤维,在该结构中,鞘状无药麦醇溶蛋白层成功地包覆在核心酮洛芬-麦醇溶蛋白蛋白纳米复合材料上,结果显示,酮洛芬以非晶态分散在麦醇溶蛋白中,体外溶出试验表明,鞘状无药麦醇溶蛋白纳米涂层明显改善了酮洛芬的药物释放动力学,从传统的指数方程到零级控释模型,并在16 h的时间内线性释放了95.7%±4.7%的酮洛芬。Ramteke等[65]采用反溶剂沉淀法制备三联疗法(阿莫西林、克拉霉素和奥美拉唑)的麦醇溶蛋白纳米颗粒以及凝集素偶联麦醇溶蛋白纳米颗粒,结果显示,不同配方的最大包埋率在65%~85%之间,三种药物的最大累积释放率在22%~76%之间,在体外抗菌研究中,三联疗法的凝集素偶联麦醇溶蛋白纳米颗粒对幽门螺杆菌根除率最高为94.83%,表现出优异的体内幽门螺杆菌清除功效,比三联疗法的麦醇溶蛋白纳米颗粒(88.28%)高7.4%,比普通三联疗法高约16%。Sharma等[66]采用反溶剂沉淀法结合脂质膜水合法制备负载抗癌药物紫杉醇的麦醇溶蛋白纳米颗粒,纳米颗粒包埋率超过55%,在乳腺癌细胞系(MCF-7和MDA-MB-231)上研究了纳米颗粒配方的抗癌活性,该配方显示出对癌细胞生长的显著抑制作用,体外释放研究显示紫杉醇从纳米颗粒中释放的时间延长,这有利于靶向癌症化疗。综上,麦醇溶蛋白可以改善抗生素药物的释放动力学模型,提高抗生素的抗菌活性和抗癌活性,是递送抗生素的有效载体。表3对麦醇溶蛋白在递送抗生素方面的其他应用进行了总结。
表 3 麦醇溶蛋白在抗生素递送体系中应用Table 3. Applications of gliadin in the delivery of antibiotics功能成分 形态 制备方法 主要发现 参考文献 纳他霉素 纳米颗粒 反溶剂沉淀法 麦醇溶蛋白-酪蛋白复合纳米颗粒提高了纳他霉素的光稳定性、贮藏稳定性和抗真菌活性。 [67] 纳米颗粒 反溶剂沉淀法 麦醇溶蛋白对纳他霉素的最大包埋率和负载量分别为80.1%和8.6%,形成的纳米颗粒可以提高纳他霉素的光稳定性并将纳他霉素的溶解度提高到0.16 mg/mL以上, [68] 克拉霉素、
奥美拉唑纳米颗粒 反溶剂沉淀法 麦醇溶蛋白对克拉霉素和奥美拉唑的最大包埋率分别为81.7%和73.7%,纳米颗粒具有粘膜粘附性,与单药治疗相比,双药包埋制剂对幽门螺杆菌的治疗效果更好。 [69] 阿莫西林 纳米颗粒 反溶剂沉淀法 麦醇溶蛋白纳米颗粒对胃有更强的粘膜粘附性向和特异性且能控制阿莫西林释放速率,其抗幽门螺杆菌活性比阿莫西林悬浮液增加10倍 [70] 布洛芬 纳米纤维 静电喷雾法 形成了核壳结构的纳米纤维,体外溶出试验表明,醋酸纤维素-麦醇溶蛋白纳米纤维未出现初始突释现象,并延长了释放持续时间。 [71] 雷帕霉素 纳米颗粒 非静电络合法 纳米颗粒对雷帕霉素的缓释作用明显,且均能降低乳糜泻造成的足底肿胀超敏反应,是治疗乳糜泻的潜在方法。 [72] 4. 结论与展望
麦醇溶蛋白良好生物相容性、疏水性、微极性以及修饰和增强功能成分释放的能力使其成为许多功能成分的载体。目前,麦醇溶蛋白基载体常用的制备方法有:反溶剂沉淀法、pH循环法、溶剂蒸发法、静电喷雾法、非静电络合法等,这些制备方法各有利弊,其中,反溶剂沉淀法在科研探究中应用最为广泛,然而其制备的颗粒较低限制了该方法在工业生产中的应用;与之相比,pH循环法则十分适用于工业生产,但是其生产过程中产生的大量盐又限制了其在食品中的应用;经济高效的静电喷雾法和非静电络合法又因为局限的适用性而应用较窄,因此需要根据不同需求选择不同的制备方法。麦醇溶蛋白的理化特性使其可以通过这些方法制备成纳米颗粒、纳米纤维、薄膜等多种形态;麦醇溶蛋白抗氧化活性及黏膜粘附性使其能够在递送抗氧化剂、维生素、酶和抗生素等多种功能成分的同时提高功能成分的生物活性,延长功能成分的缓释时间并有利于病症的靶向治疗。近年来麦醇溶蛋白的相关研究多集中于结构研究、基因表达及降低应激免疫等方面。如何促进不同应用需求下麦醇溶蛋白递送体系的制备、拓展和开发,推进麦醇溶蛋白递送体系在食品、医药、生物骨架等方面的应用仍需要相关研究人员的不断努力。
-
表 1 麦醇溶蛋白纳米颗粒制备方法比较
Table 1 Comparison of preparation methods of gliadin nanoparticles
制备方法 机理 优点 缺点 参考文献 反溶剂沉淀法 蛋白质的脱溶现象 操作简单
稳定性高
包埋率高
粒径较小且可控有机溶剂较难去除
纳米颗粒浓度较低
只适用于受脱溶过程影响较小或被转运蛋白稀释的蛋白质[18,22-23] pH循环法 不同pH下的溶解度不同 操作简单
稳定性高
绿色安全
适合工业生产滴定费时费力
酸碱中和形成大量的盐[21] 溶剂蒸发法 蛋白的过饱和 操作简单
稳定性高
包埋率高
纳米颗粒形状大小可控
适合制备高浓度纳米颗粒一般需要两亲性的表面活性剂和稳定剂
粒径一般大于反溶剂沉淀法[21,27] 静电喷雾法 高压喷射 稳定性高
包埋率高
可重复性
自分散性
粒径较小
适合工业生产仅适用于低粘度流体
操作应力会导致大分子降解[28-30] 非静电络合法 非静电相互作用 工艺简单温和
绿色节能环保只适用于能产生非静电相互作用的成分 [31-32] 表 2 麦醇溶蛋白在抗氧化剂递送体系中应用
Table 2 Applications of gliadin in the delivery of antioxidants
功能成分 形态 制备方法 主要发现 参考文献 类黄酮 姜黄素 纳米颗粒 pH循环法 以麦醇溶蛋白-鼠李糖脂制备的纳米颗粒具有更好的热稳定性、光稳定性、物理稳定性和再分散性。 [40] 纳米颗粒 反溶剂沉淀法 三聚磷酸钠交联的麦醇溶蛋白-壳聚糖复合纳米颗粒的热稳定性、光稳定性、DPPH自由基清除能力和体外神经保护作用得到提高。 [41] 槲皮素 纳米颗粒 反溶剂沉淀法 调整麦醇溶蛋白:卵磷脂比例可以增强槲皮素的生物可及性,提高其生物活性,有利于槲皮素的位点特异性口服递送。 [42] 纳米颗粒 反溶剂沉淀法 pH5.0时麦醇溶蛋白的结构转变可能会降低麦醇溶蛋白的过敏原性。 [43] 纳米颗粒 静电喷雾法 槲皮素均匀分布在麦醇溶蛋白基质中,负载槲皮素的麦醇溶蛋白颗粒的释放行为:较短的初始突释期、较长的缓释期和较短的稳定释放期。 [44] 芦丁 纳米颗粒 反溶剂沉淀法 复合颗粒改善了颗粒的乳化特性并增强了所制备乳液的稳定性和凝胶特性。 [45] 聚甲氧基黄酮 纳米颗粒 反溶剂沉淀法 麦醇溶蛋白纳米颗粒对Caco-2细胞的毒性很小或没有毒性,Caco-2细胞对聚甲氧基黄酮的摄取是时间依赖性的。 [46] 纳米颗粒 旋转蒸发法 麦醇溶蛋白纳米颗粒复合颗粒表现出对HUVEC细胞更强的细胞内
自由基清除能力。[47] 非黄酮类多酚 白藜芦醇 纳米颗粒 反溶剂沉淀法 麦醇溶蛋白-阿拉伯胶-壳聚糖复合纳米颗粒提高了白藜芦醇的理化稳定性和生物利用度,复合颗粒具有更强的DPPH自由基清除活性和Fe3+负载能力。 [48] 原花青素 纳米颗粒 非静电络合法 负载原花青的麦醇溶蛋白颗粒的DPPH自由基清除活性明显提高,复合颗粒对正常肝细胞未发现细胞毒性,而对肝癌细胞表现出明显的细胞毒性。 [49] 单宁酸 纳米颗粒 反溶剂沉淀法 由复合颗粒稳定的乳液在30 d的贮藏期内具有最好的贮藏稳定性,共价复合颗粒在油/水界面表现出中等润湿性和较好的乳化性能。 [50] 类胡萝
卜素岩藻黄质 纳米颗粒 反溶剂沉淀法 复合颗粒提高了岩藻黄质的光热稳定性,并抑制了模拟胃液中岩藻黄质的释放,增强了模拟肠液和模拟结肠液中岩藻黄质的释放。 [51] β-胡萝卜素 Pickering乳液 高速剪切 随麦醇溶蛋白颗粒浓度提高,β-胡萝卜素乳液的热稳定性和贮藏稳定性提高,提高β-胡萝卜素的生物利用度。 [52] Pickering乳液 高速剪切 麦醇溶蛋白颗粒增强了β-胡萝卜素乳液的热稳定性、pH稳定性、物理稳定性和离子强度稳定性。 [53] 表 3 麦醇溶蛋白在抗生素递送体系中应用
Table 3 Applications of gliadin in the delivery of antibiotics
功能成分 形态 制备方法 主要发现 参考文献 纳他霉素 纳米颗粒 反溶剂沉淀法 麦醇溶蛋白-酪蛋白复合纳米颗粒提高了纳他霉素的光稳定性、贮藏稳定性和抗真菌活性。 [67] 纳米颗粒 反溶剂沉淀法 麦醇溶蛋白对纳他霉素的最大包埋率和负载量分别为80.1%和8.6%,形成的纳米颗粒可以提高纳他霉素的光稳定性并将纳他霉素的溶解度提高到0.16 mg/mL以上, [68] 克拉霉素、
奥美拉唑纳米颗粒 反溶剂沉淀法 麦醇溶蛋白对克拉霉素和奥美拉唑的最大包埋率分别为81.7%和73.7%,纳米颗粒具有粘膜粘附性,与单药治疗相比,双药包埋制剂对幽门螺杆菌的治疗效果更好。 [69] 阿莫西林 纳米颗粒 反溶剂沉淀法 麦醇溶蛋白纳米颗粒对胃有更强的粘膜粘附性向和特异性且能控制阿莫西林释放速率,其抗幽门螺杆菌活性比阿莫西林悬浮液增加10倍 [70] 布洛芬 纳米纤维 静电喷雾法 形成了核壳结构的纳米纤维,体外溶出试验表明,醋酸纤维素-麦醇溶蛋白纳米纤维未出现初始突释现象,并延长了释放持续时间。 [71] 雷帕霉素 纳米颗粒 非静电络合法 纳米颗粒对雷帕霉素的缓释作用明显,且均能降低乳糜泻造成的足底肿胀超敏反应,是治疗乳糜泻的潜在方法。 [72] -
[1] OLSHEFSKY A, RICHARDSON C, PUN S H. Engineering self-assembling protein nanoparticles for therapeutic delivery[J]. Bioconjugate Chemistry,2022,3(13):13−20.
[2] KARIMI M, MALEKZAD H, MIRSHEKARI H. Plant protein-based hydrophobic fine and ultrafine carrier particles in drug delivery systems[J]. Critical Reviews in Biotechnology,2018,38(1):47−67. doi: 10.1080/07388551.2017.1312267
[3] DONG F, DONG X, ZHOU L. Doxorubicin-loaded biodegradable self-assembly zein nanoparticle and its anti-cancer effect: Preparation, in vitro evaluation, and cellular uptake[J]. Colloids and Surfaces B: Biointerfaces,2016,140(6):324−331.
[4] . Food and Agriculture Organization of the United Nations. Crop prospects and food situation [EB/OL]. [2022-03-04]. https://www.fao.org/giews/reports/crop-prospects/en/.
[5] . 郭嘉. 谷朊粉中麦谷蛋白和麦醇溶蛋白的分离及应用研究[D]. 郑州: 河南工业大学, 2011. GUO J. Separation and application of glutenin and gliadin from gluten [D]. Zhengzhou: Henan University of Technology, 2011.
[6] . ELZOGHBY A O, ELGOHARY M M. Implications of protein- and peptide-based nanoparticles as potential vehicles for anticancer drugs[J]. Advances in Protein Chemistry and Structural Biology, 2015, 98: 169-221
[7] MEHANNA M M, MNEIMNEH A T. Updated but not outdated ''Gliadin'': A plant protein in advanced pharmaceutical nanotechnologies[J]. International Journal of Pharmaceutics,2015,40(7):34−41.
[8] SHEWRY P R, TATHAM A S, FORDE J, et al. The classification and nomenclature of wheat gluten proteins-a reassessment[J]. Journal of Cereal Science,1986,4(2):97−106. doi: 10.1016/S0733-5210(86)80012-1
[9] OKITA T W, CHEESBROUGH V, REEVES C D. Evolution and heterogeneity of the alpha-/beta-type and gamma-type gliadin DNA sequences[J]. Journal of Biological Chemistry,1985,260(13):8203−8213. doi: 10.1016/S0021-9258(17)39582-0
[10] BYERS M, MIFLIN B J, SMITH S J. A quantitative comparison of the extraction of protein fractions from wheat grain by different solvents, and of the polypeptide and amino acid composition of the alcohol-soluble proteins[J]. Journal of the Science of Food and Agriculture,1983,34(5):447−462. doi: 10.1002/jsfa.2740340506
[11] WIESER H. Relation between gliadin structure and coeliac toxicity[J]. Acta Paediatrica,1996,85:3−9.
[12] THEWISSEN B G, CELUS I, BRIJS K. Foaming properties of wheat gliadin[J]. Journal of Agricultural and Food Chemistry,2011,59(4):1370−1375. doi: 10.1021/jf103473d
[13] VOCI S. Gliadins as versatile biomaterials for drug delivery applications[J]. Journal of Controlled Release,2021,329:385−400. doi: 10.1016/j.jconrel.2020.11.048
[14] . 杨璐. 麦醇溶蛋白对小麦直、支链淀粉回生的影响及相互作用研究[D]. 天津: 天津商业大学, 2021. YANG L. Effects of gliadin on the regeneration of amylopectin and amylopectin in wheat [D]. Tianjin: Tianjin University of Commerce, 2021.
[15] FERRANTI P, MAMONE G, PICARIELLO G. Mass spectrometry analysis of gliadins in celiac disease[J]. Journal of Mass Spectrometry,2007,42(12):1531−1548. doi: 10.1002/jms.1361
[16] BLANCH E W, KASARDA D D, HECHT L, NIELSEN K, BARRON L D. New insight into the solution structures of wheat gluten proteins from Raman optical activity[J]. Biochemistry,2003,42:5665−5673. doi: 10.1021/bi027059y
[17] HERBERT W. Chemistry of gluten proteins[J]. Food Microbiology,2007,24:115−119.
[18] MARTÍNEZ-LÓPEZ A L, PANGUA C, REBOREDO C. Protein-based nanoparticles for drug delivery purposes[J]. International Journal of Pharmaceutics,2020,581:278−289.
[19] ORECCHIONI A-M, DUCLAIROIR C, RENARD D. Gliadin characterization by sans and gliadin nanoparticle growth modelization[J]. Journal of Nanoscience and Nanotechnology,2006,6(9):3171−3178. doi: 10.1166/jnn.2006.455
[20] RAMTEKE S, JAIN N K. Clarithromycin- and omeprazole-containing gliadin nanoparticles for the treatment of Helicobacter pylori[J]. Journal of Drug Targeting,2018,16(1):65−72.
[21] ZHANG T, XU J, CHEN J. Protein nanoparticles for Pickering emulsions: A comprehensive review on their shapes, preparation methods, and modification methods[J]. Trends in Food Science & Technology,2021,113:26−41.
[22] YANG S, DAI L, SUN C. Characterization of curcumin loaded gliadin-lecithin composite nanoparticles fabricated by antisolvent precipitation in different blending sequences[J]. Food Hydrocolloids,2018,85:185−194. doi: 10.1016/j.foodhyd.2018.07.015
[23] JOYE I J, MCCLEMENTS D J. Production of nanoparticles by anti-solvent precipitation for use in food systems[J]. Trends in Food Science & Technology,2013,34(2):109−123.
[24] SUN C, GAO Y, ZHONG Q. Effects of acidification by glucono-delta-lactone or hydrochloric acid on structures of zein-caseinate nanocomplexes self-assembled during a pH cycle[J]. Food Hydrocolloids,2018,82:173−185. doi: 10.1016/j.foodhyd.2018.04.007
[25] SUN C, GAO Y, ZHONG Q. Properties of ternary biopolymer nanocomplexes of zein, sodium caseinate, and propylene glycol alginate and their functions of stabilizing high internal phase pickering emulsions[J]. Langmuir,2018,34(31):9215−9227. doi: 10.1021/acs.langmuir.8b01887
[26] WEI Y, WANG C, LIU X. Effects of microfluidization and thermal treatment on the characterization and digestion of curcumin loaded protein–polysaccharide–tea saponin complex nanoparticles[J]. Food & Function,2021,12(3):1192−1206.
[27] DAI L, ZHAN X, WEI Y. Composite zein-propylene glycol alginate particles prepared using solvent evaporation: Characterization and application as Pickering emulsion stabilizers[J]. Food Hydrocolloids,2018,85:281−290. doi: 10.1016/j.foodhyd.2018.07.013
[28] GULFAM M, KIM J, LEE J M. Anticancer drug-loaded gliadin nanoparticles induce apoptosis in breast cancer cells[J]. Langmuir,2012,28(21):8216−8223. doi: 10.1021/la300691n
[29] SEYOUNG H, DONG W C, et al. Protein-based nanoparticles as drug delivery systems[J]. Pharmaceutics,2020,12(3):604−633.
[30] AKMAN P K, BOZKURT F, BALUBAID M. Fabrication of curcumin-loaded gliadin electrospun nanofibrous structures and bioactive properties[J]. Fibers and Polymers,2019,20(6):1187−1199. doi: 10.1007/s12221-019-8950-8
[31] LI R, DAI T, TAN Y. Fabrication of pea protein-tannic acid complexes: Impact on formation, stability, and digestion of flaxseed oil emulsions[J]. Food Chemistry,2020,310:817−828.
[32] QIN X S, GAO Q Y, LUO Z G. Enhancing the storage and gastrointestinal passage viability of probiotic powder (Lactobacillus plantarum) through encapsulation with pickering high internal phase emulsions stabilized with WPI-EGCG covalent conjugate nanoparticles[J]. Food Hydrocolloids,2021,116:646−658.
[33] URADE R, SATO N, SUGIYAMA M. Gliadins from wheat grain: an overview, from primary structure to nanostructures of aggregates[J]. Biophysical reviews,2018,10(2):435−443. doi: 10.1007/s12551-017-0367-2
[34] 刘立群, 喻倩倩, 刘毅, 戴瑞彤. 天然抗氧化剂作用机理及在肉类制品中的应用研究进展[J]. 肉类研究,2017,31(6):45−50. [LIU L Q, YU Q Q, LIU Y, DAI R T. Mechanism of natural antioxidants and their application in meat products[J]. Meat Research,2017,31(6):45−50. LIU L Q, YU Q Q, LIU Y, DAI R T. Mechanism of natural antioxidants and their application in meat products [J]. Meat Research, 2017, 31(6): 45-50.
[35] . POMERANZ Y. Relation between chemical composition and bread-making potentialities of wheat flour[J]. Advances in Food Research, 1968: 335–455.
[36] IWAMI K, HATTORI M, IBUKI F. Prominent antioxidant effect of wheat gliadin on linoleate peroxidation in powder model systems at high water activity[J]. Journal of Agricultural and Food Chemistry,1987,35(4):628−631. doi: 10.1021/jf00076a046
[37] SONEKAR S, MISHRA M, PATEL A. Formulation and evaluation of Folic acid conjugated gliadin nanoparticles of curcumin for targeting colon cancer cells[J]. Journal of Applied Pharmaceutical Science,2016,36:068−074.
[38] KELTE FILHO I, MACHADO C S, DIEDRICH C. Optimized chitosan-coated gliadin nanoparticles improved the hesperidin cytotoxicity over tumor cells[J]. Brazilian Archives of Biology and Technology, 2021, 64.
[39] HE J R, ZHU J J, YIN S W. Bioaccessibility and intracellular antioxidant activity of phloretin embodied by gliadin/sodium carboxymethyl cellulose nanoparticles[J]. Food Hydrocolloids,2022,122:67−76.
[40] CHEN S, MA Y, DAI L. Fabrication, characterization, stability and re-dispersibility of curcumin-loaded gliadin-rhamnolipid composite nanoparticles using pH-driven method[J]. Food Hydrocolloids,2021,118:106−118.
[41] YANG S, LIU L, CHEN H. Impact of different crosslinking agents on functional properties of curcumin-loaded gliadin-chitosan composite nanoparticles[J]. Food Hydrocolloids,2021,112(56):251−258.
[42] CHEN X, CHEN Y, HUANG Y. Hybrid Bionanoparticle-stabilized pickering emulsions for quercetin delivery: effect of interfacial composition on release, lipolysis, and bioaccessibility[J]. ACS Applied Nano Materials,2019,2(10):6462−6472. doi: 10.1021/acsanm.9b01413
[43] WANG Q, TANG Y, YANG Y. Interaction between wheat gliadin and quercetin under different pH conditions analyzed by multi-spectroscopy methods[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2020,229(45):129−137.
[44] YANG Y Y, ZHANG M, LIU Z P. Meletin sustained-release gliadin nanoparticles prepared via solvent surface modification on blending electrospraying[J]. Applied Surface Science,2018,434:1040−1047. doi: 10.1016/j.apsusc.2017.11.024
[45] LI C, WANG Q, ZHANG C. Effect of simultaneous treatment combining ultrasonication and rutin on gliadin in the formation of nanoparticles[J]. Journal of Food Science,2021,87(1):80−93.
[46] . WANG X G. Assessing the cytotoxicity of newly developed gliadin nanoparticles loading polymethoxy flavones[D]. Rutgers, The State University of New Jersey, 2016.
[47] 刘亚男, 郝柏妹, 许为东. 负载山奈酚的小麦醇溶蛋白纳米颗粒的制备及其抗氧化活性研究[J]. 中国粮油学报,2021,36(12):44−49. [LIU Y N, HAO B S, XU W D. Preparation and antioxidant activity of wheat gliadin nanoparticles loaded with kaempferol[J]. Chinese Journal of Cereals and Oils,2021,36(12):44−49. doi: 10.3969/j.issn.1003-0174.2021.12.008 LIU Y N, HAO B S, XU W D. Preparation and antioxidant activity of wheat gliadin nanoparticles loaded with kaempferol [J]. Chinese Journal of Cereals and Oils, 2021, 36(12): 44-49. doi: 10.3969/j.issn.1003-0174.2021.12.008
[48] WU W, KONG X, ZHANG C. Fabrication and characterization of resveratrol-loaded gliadin nanoparticles stabilized by gum Arabic and chitosan hydrochloride[J]. LWT,2020,129(32):522−532.
[49] LIU C, LI M, YANG J. Fabrication and characterization of biocompatible hybrid nanoparticles from spontaneous co-assembly of casein/gliadin and proanthocyanidin[J]. Food Hydrocolloids,2017,73:74−89. doi: 10.1016/j.foodhyd.2017.06.036
[50] ZHU X, CHEN Y, HU Y. Tuning the molecular interactions between gliadin and tannic acid to prepare Pickering stabilizers with improved emulsifying properties[J]. Food Hydrocolloids,2021,111(6):166−179.
[51] . WANG L, WEI Z, XUE C Fucoxanthin-loaded nanoparticles composed of gliadin and chondroitin sulfate: Synthesis, characterization and stability[J]. Food Chemistry, 2022, 379: 152–163.
[52] CHENG C, GAO Y, WU Z. Gliadin Nanoparticles Pickering Emulgels for β-Carotene Delivery: Effect of Particle Concentration on the Stability and Bioaccessibility[J]. Molecules,2020,25(18):4188. doi: 10.3390/molecules25184188
[53] MA L, ZOU L, MCCLEMENTS D J. One-step preparation of high internal phase emulsions using natural edible Pickering stabilizers: Gliadin nanoparticles/gum Arabic[J]. Food Hydrocolloids,2020,100(7):370−381.
[54] PANIGRAHI S S, SYED I, SIVABALAN S. Nanoencapsulation strategies for lipid-soluble vitamins[J]. Chemical Papers,2018,73(1):1−16.
[55] DUCLAIROIR C, ORECCHIONI A M, DEPRAETERE P. α-Tocopherol encapsulation and in vitro release from wheat gliadin nanoparticles[J]. Journal of Microencapsulation,2002,19(1):53−60. doi: 10.1080/02652040110055207
[56] DUCLAIROIR C, IRACHE J M, NAKACHE E. Gliadin nanoparticles: formation, all-trans-retinoic acid entrapment and release, size optimization[J]. Polymer International,1999,48(4):327−333. doi: 10.1002/(SICI)1097-0126(199904)48:4<327::AID-PI165>3.0.CO;2-Y
[57] CARILLON J, ROUANET J M, CRISTOL J P. Superoxide dismutase administration, a potential therapy against oxidative stress related diseases: Several routes of supplementation and proposal of an original mechanism of action[J]. Pharmaceutical Research,2013,30(11):2718−2728. doi: 10.1007/s11095-013-1113-5
[58] KICK J, HAUSER B, BRACHT H. Effects of a cantaloupe melon extract/wheat gliadin biopolymer during aortic cross-clamping[J]. Intensive Care Medicine,2007,33(4):694−702. doi: 10.1007/s00134-006-0518-6
[59] VOULDOUKIS I, CONTI M, KRAUSS P. Supplementation with gliadin-combined plant superoxide dismutase extract promotes antioxidant defences and protects against oxidative stress[J]. Phytotherapy Research,2004,18(12):957−962. doi: 10.1002/ptr.1542
[60] OUALI K, BABA-AHMED F, GUEDRI K. Protective role of a melon superoxide dismutase combined with gliadin (GliSODin) on the status of lipid peroxidation and antioxidant defense against azoxymethane-induced experimental colon carcinogenesis[J]. Journal of Cancer Research and Therapeutics,2021,17(6):1445−1453. doi: 10.4103/jcrt.JCRT_175_19
[61] KOIKE M, NAGAO M, IWASE Y. Clinical Efficacy of Melon GliSODin® for the treatment of aging-related dysfunction in motor organs-a double blind, randomized placebo-controlled study[J]. Journal of Clinical Medicine,2022,11(10):2747. doi: 10.3390/jcm11102747
[62] 张新帅, 阮瑶, 刘武康. 致病菌抵抗溶菌酶机制的研究进展[J]. 食品科学,2020,41(17):298−306. [ZHANG X S, RUAN Y, LIU W K. Research progress of resistance mechanism of pathogenic bacteria to lysozyme[J]. Food Science,2020,41(17):298−306. doi: 10.7506/spkx1002-6630-20190809-100 ZHANG X S, RUAN Y, LIU W K. Research progress of resistance mechanism of pathogenic bacteria to lysozyme [J]. Food Science, 2020, 41(17): 298-306. doi: 10.7506/spkx1002-6630-20190809-100
[63] FAJARDO P, BALAGUER M P, GOMEZ-ESTACA J. Chemically modified gliadins as sustained release systems for lysozyme[J]. Food Hydrocolloids,2014,41:53−59. doi: 10.1016/j.foodhyd.2014.03.019
[64] LIU X, SHAO W, LUO M. Electrospun blank nanocoating for improved sustained release profiles from medicated gliadin nanofibers[J]. Nanomaterials,2018,8(4):184. doi: 10.3390/nano8040184
[65] RAMTEKE S, GANESH N, BHATTACHARYA S. Triple therapy-based targeted nanoparticles for the treatment ofHelicobacter pylori[J]. Journal of Drug Targeting,2008,16(9):694−705. doi: 10.1080/10611860802295839
[66] SHARMA K, DEEVENAPALLI M, SINGH D. Preparation and characterization of paclitaxel-loaded gliadin nanoparticles[J]. Journal of Biomaterials and Tissue Engineering,2014,4(5):399−404. doi: 10.1166/jbt.2014.1182
[67] WU X, HU Q, LIANG X. Fabrication of colloidal stable gliadin-casein nanoparticles for the encapsulation of natamycin: Molecular interactions and antifungal application on cherry tomato[J]. Food Chemistry,2022,391:277−288.
[68] 陈方圆. 麦醇溶蛋白基递送体系对天然抗菌剂的稳态化输送及特性研究[D]. 杭州: 浙江科技学院, 2022. CHEN F Y. Study on stable transportation and characteristics of natural antibacterial agents by wheat gliadin based delivery system[D]. Hangzhou: Zhejiang University of Science and Technology, 2022.
[69] SAFAROV T, KIRAN B, BAGIROVA M. An overview of nanotechnology-based treatment approaches against Helicobacter Pylori[J]. Expert Review of Anti-infective Therapy,2019,17(10):829−840. doi: 10.1080/14787210.2019.1677464
[70] UMAMAHESHWARI R B, RAMTEKE S, JAIN N K. Anti-Helicobacter pylori effect of mucoadhesive nanoparticles bearing amoxicillin in experimental gerbils model[J]. AAPS PharmSciTech,2004,5(2):60−68. doi: 10.1208/pt050232
[71] YANG Y, LI W, YU D G. Tunable drug release from nanofibers coated with blank cellulose acetate layers fabricated using tri-axial electrospinning[J]. Carbohydrate Polymers,2019,203:228−237. doi: 10.1016/j.carbpol.2018.09.061
[72] 范文涛, 陶雨文, 范志宁. 麦醇溶蛋白-雷帕霉素复合纳米颗粒治疗乳糜泻的探索研究[J]. 中国临床研究,2022,35(5):593−598, 605. [FAN W T, TAO Y W, FAN Z N. Study on the treatment of chylous diarrhea with gliadin rapamycin composite nanoparticles[J]. China Clinical Research,2022,35(5):593−598, 605. FAN W T, TAO Y W, FAN Z N. Study on the treatment of chylous diarrhea with gliadin rapamycin composite nanoparticles [J]. China Clinical Research, 2022, 35 (5): 593-598, 605.





 下载:
下载:


 下载:
下载:



