Characterization of Aroma Volatiles in Three Sundried Ulva spp. by GC-MS and Sensory Evaluation
-
摘要: 为探讨3种干制浒苔的挥发性风味,本研究采用顶空固相微萃取(HS-SPME)和气相色谱-质谱联用技术(GC-MS)对浒苔的挥发性成分进行分析,在条浒苔(U. clathrata)样品X、缘管浒苔(U. linza)样品Y、浒苔(U. prolifera)样品N中共检测出醛类(19种)、酮类(9种)、醇类(6种)、酸类(8种)、酯类(3种)、含硫化合物(2种)和其它化合物(14种)等61种物质,其中含硫化合物含量最高,达40.39%~58.09%。采用相对香气活度值法(ROAV)和感官评价鉴定浒苔的特征香气成分,结果表明,干制浒苔关键特征风味化合物为二甲基硫醚(洋葱味、熟大蒜、硫磺)和β-紫罗酮(紫罗兰、花香)。此外,3种浒苔共有的挥发性香气成分还包括二甲基亚砜、4-甲基-3-戊烯-2-酮、苯甲醛、二氢猕猴桃内酯等。其中,样品N特征香气物质最多,特别是酮醛类羰基化合物,(E)-2-丁烯醛、(E)-2-辛烯醛、(E)-2,6-壬二醛和1-辛烯-3-醇等被认为是影响风味的关键性挥发物质。浒苔Y特有的风味物质包括(5Z)-1,5-辛二烯-3-醇、4-乙基苯甲醛、5-甲基呋喃醛等,这些物质具有独特的青香和果香等香气特征。感官评价结果表明,样品N和样品Y具有更多的花香、果香、脂肪青香气味,而样品X海腥味较显著(P<0.05)。本文通过对3种浒苔的挥发性风味成分研究,可为进一步阐明不同浒苔的风味物质差异及合理开发相关产品提供科学基础。
-
关键词:
- 浒苔 /
- 顶空固相微萃取(HS-SPME) /
- 气相色谱-质谱联用技术(GC-MS) /
- 挥发性风味化合物 /
- 感官评价
Abstract: In this study, headspace solid phase microextraction (HS-SPME) coupled with gas chromatography-mass spectrometry (GC-MS) was used to determine the volatile flavor compounds of sundried Ulva spp., including U. prolifera collected from Xiamen (sample X), U. linza collected from Yantai (sample Y) and U. clathrata collected from Ningbo (sample N). A total of 61 volatile compounds including 19 aldehydes, 9 ketones, 6 alcohols, 8 acids, 3 esters, 2 sulfur compounds, and 14 other compounds were detected. The content of sulfur compounds was reaching 40.39%~58.09%. Meanwhile, relative odor activity value (ROAV) and sensory evaluation were employed to identify the aroma active components of Ulva spp.. The results revealed that dimethyl sulfide (onion, garlic, sulfur) and β-ionone (violet, floral) were the key aroma active components of dried Ulva spp.. Besides, dimethyl sulfoxide, 4-methyl-3-penten-2-one, benzaldehyde and 5,6,7,7a-tetrahydro-4,4,7a-trimethyl-2(4H)-benzofuranone were the important aroma active components of three Ulva spp.. Among three tested Ulva spp., sample N contained the most abundant volatile compounds especially in aldehydes and ketones, and (E)-2-butenal, (E)-2-octenal, (E)-2,6-nondialdehyde and 1-octene-3-ol were considered as the key volatile substances. Aroma active compounds including 4-ethylbenzaldehyde, (5Z)-1,5-octadiene-3-ol, and 5-methyl furfural were only detected in sample Y, which might correlate to its unique green and fruity flavor. For sample X, the sensory analysis reulst revealed significant fishy smell (P<0.05) as compare to other two Ulva spp., while sample N and sample Y were more inclined to more floral, fruity and fatty green flavor. These obtained results would help to obtain more information of the volatile flavor compounds of Ulva spp. and for further Ulva related product development. -
浒苔(Ulva spp.)是绿藻门(Chlorophyta)石莼纲(Ulvophycea)石莼目(Ulvales)石莼科(Ulvaceae)的大型海洋绿藻,之前被归为浒苔属(Entermorpha),现统一称为石莼属(Ulva),在我国沿海分布广泛[1-2]。近些年,随着工业化的发展,全球气候变暖现象日益突出,导致沿海地区浒苔的富集、暴发、蔓延形成绿潮[3]。绿潮暴发时大量堆积的绿藻易分解产生恶臭,且会引起水体缺氧,造成水生生物死亡,对海洋生态系统产生严重影响,急需治理[4-6]。其实浒苔本身无毒,含有多种有益成分,如矿物质、维生素、必需氨基酸、膳食纤维、多糖、多酚等[7-9],可能有助于开发功能性食品和营养制剂,或作为一种天然医疗资源[10-12]。自古以来,在中国及许多亚洲国家,浒苔作为传统的食用海藻广泛应用于各种各样的食品中,比如生沙拉、汤、饼干、营养膳食补充剂和调味品[11, 13-14]。由于其独特的风味特征和健康营养的功效特点,浒苔作为食品风味及功效成分添加物在全球极受欢迎[1, 15-16]。
浒苔中所含的挥发性成分,是评估浒苔食品风味和质量的一个重要参数[17]。例如,其中的含硫化合物是海藻气味的典型物质,其他挥发性物质(如脂肪醛和萜类)也增加了浒苔香气的丰富度和复杂性[18]。之前浒苔的风味研究报道较为少见,但随着其在食品领域接受度的不断提升,如今国内外浒苔的挥发性风味成分的研究逐渐增多[18-19]。近年来,国内赵莉娟等[20]对黄海绿潮漂移过程中的8个区域新鲜浒苔的挥发性风味成分进行了研究,国外学者报道了新鲜孔石莼(U. rigida)在不同温度储存期间挥发性化合物和感官特征的变化[21]。研究发现,新鲜浒苔中烯类含量较高,主要是8-十七烯、柠檬烯、苯乙烯等[20-22]。在新鲜肠浒苔的研究中发现,其主要特征性风味物质是顺-3-十七烯,含量高达59.54%[22]。然而,新鲜海藻作为食品(原料)在市场上特别是非沿海地区并不常见,更多是以新鲜海藻经晒干、风干和加盐脱水等方法加工后的干制品形式存在。浒苔在加工、储存和烹饪过程中,其芳香化合物可能会受到光照、高温或微生物变化的影响,进而影响其整体感官特征。例如,异戊酸、二甲基硫醚、8-十七烯、二甲基亚砜、二氢猕猴桃内酯、苯甲醛等被认为是炒制浒苔主要的风味化合物[22]。我国常见的食用浒苔以干制品为主,但到目前为止,浒苔风味研究主要集中在新鲜浒苔及其烹煮制品,而对浒苔干制品风味成分的研究尚不多见。
顶空固相微萃取法(Headspace solid phase micro-extraction,HS-SPME)是一种集采样、萃取、富集和进样于一体的样品前处理技术,具有耗时少、易于操作、无需溶剂、对环境友好等特点,在风味分析等方面应用非常广泛[23]。本文采用顶空固相微萃取法(HS-SPME)富集浒苔的挥发性风味物质,通过与气相色谱-质谱(Gas chromatography-mass spectrometer,GC-MS)联用,测定国内常见的3种食用干燥浒苔的挥发性成分,并结合ROAV、感官评价等方法,探究不同浒苔的特征性风味物质及差异,为浒苔风味食品的开发和利用提供依据。
1. 材料与方法
1.1 材料和仪器
浒苔(U. prolifera) 采集自厦门(样品X);缘管浒苔(U. linza) 采集自烟台(样品Y);条浒苔(U. clathrata) 采集自宁波(样品N),样品均采用日晒方式进行干燥,经过24 h日晒后3种浒苔的含水量分别为4.22%±0.45%、2.91%±0.34%和3.75%±0.23%,干制样品密封贮存于-20 ℃冰箱备用。二甲基硫醚(≥99.0%)、叶醛(98%)、β-紫罗兰酮(96%)、三甲胺(≥99.5%)、1-辛烯-3-醇(98%)、正构烷烃C7~C30混标 Sigma-Aldrich公司;己醇(99%) Macklin公司,标准品均为色谱纯;二氯甲烷、甲醇 分析纯,国药集团化学试剂有限公司。
AL-204分析天平 梅特勒-托利多仪器(上海)有限公司;顶空固相微萃取装置57330-U 美国Supelco公司;100 μm PDMS萃取头 美国Supelco公司;ZY-601超级恒温水浴锅 上海森地科学仪器设备有限公司;7890-5975C气相色谱-质谱联用仪 美国Agilent公司。
1.2 实验方法
1.2.1 HS-SPME萃取与GC-MS检测
顶空固相微萃取条件:对样品进行HS-SPME萃取。准确称取0.3 g干燥浒苔样品于20 mL顶空瓶中,60 ℃平衡20 min,将老化好的PDMS萃取头置入顶空瓶上部,60 ℃吸附30 min。20 ℃条件下静置平衡20 min,迅速将萃取头置于GC-MS进样口解吸5 min。
GC-MS条件:色谱柱DB-WAX(30 m×0.25 mm×0.25 μm),进样口温度250 ℃,载气为高纯氦气,柱流速3 mL/min,不分流。程序升温:初始温度35 ℃,保持3 min,以3 ℃/min升至40 ℃,保持3 min,再以5 ℃/min升温至210 ℃,保持25 min。
质谱条件:电离方式为电子轰击(EI)源,电子能量70 eV,离子源温度230 ℃;四极杆温度150 ℃,接口温度250 ℃,质量扫描范围33.00~550.00 m/z,溶剂延迟时间3 min。
1.2.2 挥发性风味物质定性及定量
样品中的挥发性组分经气相色谱-质谱进行解谱分析,获得特征峰的质荷比、保留时间(RT)和峰面积等信息,对匹配度大于80(最大为100)的鉴定结果予以确认。并根据检测到挥发性成分的保留时间与相同色谱条件下正构烷烃(C7~C30)的保留时间,计算保留指数(RI值),并将检测的各组分信息与NIST 14.L谱库进行匹配定性,并结合文献、人工图谱解析等多种方法进行综合分析鉴定。其中RI值公式如下[24]:
RI=100n+100×(RTx−RTn)(RTn+1−RTn) 式中:Tx为待测组分的保留时间(min);n为待测组分之前的正构烷烃的碳原子数;RTn、RTn+1分别为待测组分之前和之后的正构烷烃保留时间(min)。
采用峰面积归一化的方式求得浒苔样品中各挥发性风味物质成分的相对含量,进行相对定量分析。
1.2.3 特征香气成分评价
香气活度值(Odor activity value,OAV)可评价各化合物对风味的贡献。但由于样品中的挥发性化合物往往有几十或上百种,为了方便分析各挥发性风味物质对总体风味的影响,采用相对香气活度值法(Relative odor activity value,ROAV)评价各挥发性成分对样品总体香气的贡献,公式如下[25]:
ROVA≈100×CiCmax×TmaxTi 式中:Ci为各挥发性物质的相对百分含量(%);Cmax为对样品总体风味贡献最大的组分的相对百分含量(%);Ti为各挥发性物质相对应的感觉阈值(mg/kg);Tmax为样品总体风味贡献最大的组分相对应的感觉阈值(mg/kg)。
1.2.4 感官评价
根据ISO 8589–2007指南,浒苔感官评价在上海应用技术大学香料香精化妆品学部所在的感官实验室进行。感官评价小组由经过专业培训的20名志愿者组成(10名男性和10名女性,年龄20~40岁),结合感官小组意见、文献中的浒苔香气及食品风味的相关研究[18-19, 22],最终选择6种气味属性描述词,分别为洋葱味(类似洋葱、大蒜、葱样的香气)、脂肪青香(新鲜青草、叶子香气)、果香(成熟果实香气,例如柑橘、苹果、葡萄等)、花香(令人愉悦的鲜花香气,如玫瑰、兰花等)、海腥味(类似海水、水产、鱼等的气味)和蘑菇味(新鲜蘑菇气味、湿的泥土味),对应标准品分别为二甲基硫醚、叶醛、己醇、β-紫罗兰酮、三甲胺和1-辛烯-3-醇。称取1 g样品于10 mL品评杯中,在0~5分间进行定量打分评价,0表示无嗅闻到该气味,3表示气味强度中等,5表示气味强度很大。
1.3 数据处理
使用Microsoft Excel 2019和IBM SPSS Statistics version 26对数据进行显著性分析、PCA分析等统计处理,并利用GraphPad prism 9对分析结果进行绘图,其分析结果由平均值±标准差表示。
2. 结果与分析
2.1 浒苔挥发性风味成分GC-MS结果
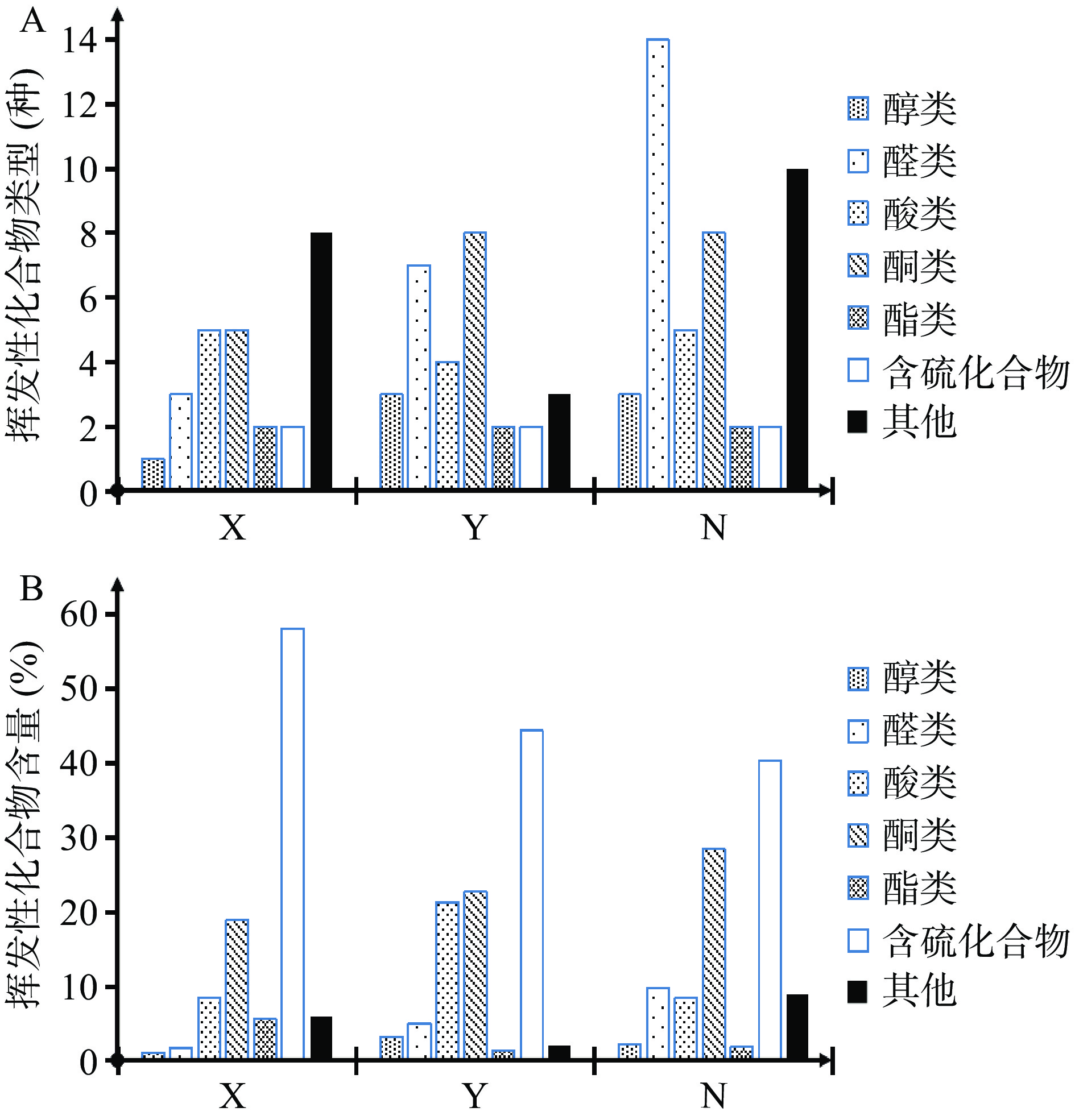
通过HS-SMPE富集和GC-MS,分析3种不同浒苔样品进行挥发性成分。3种样品共鉴定出61种化合物(表1),分别为2种含硫化合物(40.39%~58.09%),28种羰基类化合物(包括19种醛类和9种酮类),其相对含量为20.66%~39.05%,还有酸类8种(8.41%~21.23%),醇类6种(1.12%~3.23%),酯类3种(1.43%~5.61%),以及少量酚类、醚类、烷烯烃类、含氮化合物等(图1)。
表 1 采用HS-SPME-GC-MS检测到的浒苔的挥发性成分Table 1. Volatile components of Ulva detected by HS-SPME-GC-MS序号 化合物 RI值 CAS号 分子式 相对分子量 相对含量(%) 计算值 参考值 X Y N 醇类 1 1-辛烯-3-醇 1454 1456 3391-86-4 C8H16O 128.21 − − 0.58±0.06 2 薄荷醇 1603 1618 15356-70-4 C10H20O 156.27 − − 1.12±0.10 3 (5Z)-1,5-辛二烯-3-醇 1488 − 50306-18-8 C8H14O 126.20 − 0.65±0.07 − 4 2,6-二甲基环己醇 1599 − 5337-72-4 C8H16O 128.21 1.12±0.23 1.98±0.21 − 5 3-癸炔-1-醇 1644 − 51721-39-2 C10H18O 154.25 − − 0.55±0.04 6 3-甲基-3-环己烯-1-醇 1659 − 53783-91-8 C7H12O 112.17 − 0.60±0.02 − 醛类 7 (E)-2-丁烯醛 − 1037 123-73-9 C4H6O 70.09 − − 0.42±0.01 8 己醛 − 1083 66-25-1 C6H12O 100.16 − − 0.47±0.02 9 2-氟-4-(三氟甲基)苯甲醛 − 1209 763-93-9 C6H10O 98.14 − 0.64±0.01 − 10 庚醛 1182 1186 111-71-7 C7H14O 114.19 − − 0.29±0.01 11 (E)-2-己烯醛 − 850 6728-26-3 C6H10O 98.14 − − 0.40±0.02 12 (E)-2-庚烯醛 1336 1334 57266-86-1 C7H12O 112.17 − − 1.13±0.09 13 壬醛 1323 1390 124-19-6 C9H18O 142.24 0.39±0.03 − 0.34±0.03 14 (E,E)-2,4-己二烯醛 − 1414 142-83-6 C6H8O 96.13 − − 0.41±0.02 15 (E)-2-辛烯醛 1443 1434 2548-87-0 C8H14O 126.20 − − 1.07±0.14 16 (E,E)-2,4-庚二烯醛 1472 1497 4313-03-5 C7H10O 110.15 − − 0.55±0.02 17 苯甲醛 1531 1515 100-52-7 C7H6O 106.12 1.03±0.11 1.65±0.26 2.94±0.43 18 5-甲基呋喃醛 − 1570 620-02-0 C6H6O2 110.11 − 0.55±0.11 − 19 (E)-2,6-壬二醛 1732 1715 17587-33-6 C9H14O 138.21 − − 0.29±0.01 20 β-环柠檬醛 1596 1590 432-25-7 C10H16O 152.23 − 0.83±0.13 0.54±0.04 21 2,3-二氢-2,2,6-三甲基苯甲醛 1616 − 116-26-7 C10H14O 150.22 − 0.49±0.03 0.43±0.01 22 间苯二甲醛 2321 2341 626-19-7 C8H6O2 134.13 − − 0.52±0.03 23 4-乙基苯甲醛 1777 1730 4748-78-1 C9H10O 134.18 − 0.35±0.02 − 24 2,5-二甲基苯甲醛 1758 1705 5779-94-2 C9H10O 134.18 − 0.43±0.02 − 25 十六醛 2184 2137 629-80-1 C16H32O 240.42 0.34±0.01 − − 酸类 26 乙酸 − 1460 64-19-7 C2H4O2 60.05 − 0.73±0.04 0.35±0.01 27 丙酸 − 1508 79-09-4 C3H6O2 74.08 − − 0.39±0.02 28 2-丙烯酸 − − 79-10-7 C3H4O2 72.06 5.84±0.37 19.10±2.63 4.45±0.28 29 己酸 − 1849 142-62-1 C6H12O2 116.16 0.29±0.02 − 1.10±0.09 30 十五酸 1412 2819 1002-84-2 C15H30O2 242.40 0.75±0.03 − − 31 十六酸 2849 2899 57-10-3 C16H32O2 256.42 1.31±0.15 0.27±0.10 − 32 棕榈油酸 2922 2960 373-49-9 C16H30O2 254.41 0.29±0.01 − − 33 异戊酸 − 1679 503-74-2 C5H10O2 102.13 − 1.13±0.08 2.12±0.33 酮类 34 丙酮 − 813 67-64-1 C3H6O 58.08 1.65±0.12 0.71±0.13 0.93±0.07 35 4-甲基-3-戊烯-2-酮 − 1131 141-79-7 C6H10O 98.14 14.25±0.53 15.91±1.01 20.26±1.28 36 6-甲基-5-庚烯-2-酮 1352 1341 110-93-0 C8H14O 126.20 − 0.41±0.01 − 37 4-羟基-4-甲基-2-戊酮 − 1351 123-42-2 C6H12O2 116.16 2.36±0.22 2.08±0.18 3.15±0.63 38 (E,E)-3,5-辛二烯-2-酮 1535 1570 30086-02-3 C8H12O 124.18 0.33±0.01 1.27±0.14 1.54±0.23 39 苯乙酮 1642 1627 98-86-2 C8H8O 120.15 − − 0.30±0.01 40 α-紫罗酮 1826 1863 127-41-3 C13H20O 192.30 − 0.40±0.01 0.85±0.03 41 β-紫罗酮 1927 1953 79-77-6 C13H20O 192.30 0.31±0.01 1.41±0.06 1.09±0.51 42 4-[2,2,6-三甲基-7-氧杂二环[4.1.0]
庚-1-基]-3-丁烯-2-酮1932 1967 23267-57-4 C13H20O2 208.30 − 0.54±0.01 1.13±0.24 酯类 43 十四酸甲酯 1487 2028 124-10-7 C15H30O2 242.40 5.11±0.35 0.33±0.01 − 44 二氢猕猴桃内酯 1166 2325 15356-74-8 C11H16O2 180.24 0.50±0.01 1.10±0.14 1.11±0.20 45 1-(1,1-二甲基乙基)-2-甲基-1,3-丙二醇-2-甲基-丙酸酯 2074 − 74381-40-1 C16H30O4 286.41 − − 0.72±0.06 含硫化合物 46 二甲基硫醚 − 777 75-18-3 C2H6S 62.13 57.52±1.23 41.96±2.27 38.66±2.31 47 二甲基亚砜 − 1553 67-68-5 C2H6OS 78.13 0.57±0.02 2.43±0.21 1.73±0.24 含氮化合物 48 2-乙基-3-甲基顺丁烯二酰亚胺 2286 2260 20189-42-8 C7H9NO2 139.15 − − 0.74±0.06 49 N-甲基-1H-咪唑-5-乙酰胺 − − 673-50-7 C6H11N3 125.17 − − 0.30±0.12 其他 50 辛基酚 1692 1600 140-66-9 C14H22O 206.32 0.28±0.01 − − 51 2-(1,1-二甲基乙基)-4-(1-十九烷)-苯酚 2021 − 52184-13-1 C14H22O 206.32 − − 0.46±0.03 52 柏木脑 1719 2127 77-53-2 C15H26O 222.37 − − 0.40±0.01 53 十二烷 1200 − 112-40-3 C12H26 170.33 0.44±0.03 − 0.70±0.01 54 二乙基甲基硼烷 − − 1115-07-7 C5H13B 83.97 0.26±0.01 − − 55 十三烷 1319 − 629-50-5 C13H28 184.36 0.30±0.02 − 0.58±0.02 56 十四烷 1410 236 629-59-4 C14H30 198.39 0.91±0.02 − 0.75±0.06 57 十五烷 1500 − 629-62-9 C15H32 212.41 0.30±0.02 0.27±0.01 − 58 十六烷 1639 − 544-76-3 C16H34 226.44 0.30±0.01 − − 59 8-十七烯 1816 − 16369-12-3 C17H34 238.45 3.25±0.14 0.49±0.02 3.05±0.31 60 环辛二烯 1555 1100 1700-10-3 C8H12 108.18 − − 0.82±0.11 61 角鲨烯 − − 111-02-4 C30H50 410.72 − 1.29±0.12 0.28±0.05 根据挥发性成分的种类和相对含量的结果,可以看出3种样品的挥发性风味成分存在一定差异(图1)。比如,浒苔样品X中烃类物质种类最多,样品Y以酮类化合物最丰富,而样品N中则以醛类化合物最多(图1A)。如图2所示,浒苔样品N检测出的挥发性成分的种类最多,共有44种,其次为样品Y(29种)和样品X(26种)。其中,3种样品共有的挥发性风味化合物为11种,包括二甲基硫醚、2-丙烯酸、4-甲基-3-戊烯-2-酮、二甲基亚砜、8-十七烯、4-羟基-4-甲基-2-戊酮、β-紫罗酮、(E,E)-3,5-辛二烯-2-酮、丙酮、二氢猕猴桃内酯、苯甲醛等(表1)。此外,样品N特有的为21种(图2),明显多于其他两种浒苔样品,差异主要为醛类物质。
2.2 不同浒苔挥发性特征风味物质的分析
浒苔中含有丰富的蛋白质、脂肪和碳水化合物,干制加工后会产生各种具有特殊香味的醛类、内酯类,降解后的产物之间也会相互作用,如氨基酸和还原糖之间的美拉德反应、Strecker降解等[22],因此挥发性成分非常复杂。其中,有一部分香气物质可能对整体风味影响较小,因此筛选关键挥发性风味物质对于系统揭示浒苔香气十分重要。通过对3种浒苔挥发性成分的风味特征、含量、阈值等进行分析,采用相对气味活性值(ROAV值)评价了干制浒苔的特征风味物质(表2)。ROAV值介于0~100之间,当成分的ROAV>1,表明该挥发性物质对样品的总体风味贡献较大;0.1≤ROAV≤1,则表明对样品的总体风味有一定修饰作用;当成分ROAV<0.1,表明该物质对样品的总体风味无实际影响[26]。根据3种浒苔中各挥发性成分的风味特征和ROAV值,筛选出其中37种挥发性风味化合物做进一步风味分析(表2)。其中,有2种物质ROAV>1,为二甲基硫醚和β-紫罗兰酮,表明该2种化合物对浒苔风味贡献较大。此外,有4种挥发性成分0.1≤ROAV≤1,分别为(E)-2-丁烯醛、(E)-2-辛烯醛、(E)-2,6-壬二醛、1-辛烯-3-醇,表明该4种挥发性成分对浒苔特征风味有一定贡献。
表 2 浒苔的部分挥发性成分风味特征及阈值Table 2. Flavor characteristics and thresholds of part volatile components of Ulva序号 中文名 FEMAa 风味特征b 阈值[27]
(mg/kg)ROAV X Y N 含硫化合物 1 二甲基硫醚 2746 熟大蒜、卷心菜、硫磺 0.00012 100 100 100 2 二甲基亚砜 3875 洋葱、牡蛎 − − − − 酮类 3 4-甲基-3-戊烯-2-酮 3368 甜香、土豆、泥土 0.07 0.04 0.07 0.09 4 6-甲基-5-庚烯-2-酮 2707 柑橘、蘑菇、薄荷、草莓 0.068 0 <0.01 0 5 苯乙酮 2009 杏仁、花香、肉香 0.065 0 0 <0.01 6 α-紫罗酮 2594 紫罗兰、木香 0.00378 0 0.03 0.07 7 β-紫罗酮 2595 紫罗兰、花香 0.000007 9.23 57.61 48.33 醛类 8 (E)-2-丁烯醛 2219 香蕉、青香、辛香 0.0003 0 0 0.43 9 己醛 2557 苹果、果青香 0.005 0 0 0.03 10 庚醛 2540 脂肪、柑橘 0.0028 0 0 0.03 11 (E)-2-己烯醛 2560 草香、青香 0.11 0 0 <0.01 12 (E)-2-庚烯醛 3165 肥皂、扁桃仁 0.051 0 0 0.01 13 壬醛 2782 脂肪、柑橘、青香、花香 0.0028 0.03 0 0.04 14 (E,E)-2,4-己二烯醛 3429 甜香、青香、蜡质 0.0018 0 0 0.07 15 (E)-2-辛烯醛 3215 海藻、坚果、脂肪 0.0027 0 0 0.12 16 (E,E)-2,4-庚二烯醛 3164 青香、坚果、脂肪 0.057 0 0 <0.01 17 苯甲醛 2127 苦杏仁、樱桃、甜香 0.75089 <0.01 <0.01 <0.01 18 5-甲基呋喃醛 2702 甜香、谷物 1.11 0 <0.01 0 19 (E)-2,6-壬二醛 3766 青香、黄瓜皮 0.0005 0 0 0.18 20 β-环柠檬醛 3639 薄荷、烟草、酚类 0.005 0 0.05 0.03 21 4-乙基苯甲醛 3756 甜香、苦的 0.013 0 0.01 0 醇类 22 2,6-二甲基环己醇 − 新鲜海水、淡水鱼 − − − − 23 1-辛烯-3-醇 2805 蘑菇、青香、果香 0.0015 0 0 0.12 24 薄荷醇 2665 薄荷、清凉 0.13 0 0 <0.01 25 (5Z)-1,5-辛二烯-3-醇 4732 草香、海洋、蘑菇 0.01 0 0.02 0 酸类 26 2-丙烯酸 − − 0.27 <0.01 0.02 0.01 27 乙酸 2006 酸的、辛香、果香 0.013 0 0.02 0.01 28 丙酸 2924 酸的、辛香、脂肪 2.19 0 0 <0.01 29 己酸 2559 酸的、芝士、果香、脂肪 0.89 <0.01 0 <0.01 30 十五酸 4334 − 10 <0.01 0 0 31 十六酸 2832 脂肪、肥皂、乳制品 >10 <0.01 <0.01 0 32 丙烯酸 − − 0.5 0 <0.01 0 33 异戊酸 3102 酸的、芝士、辛香 0.49 0 <0.01 <0.01 脂类 34 十四酸甲酯 2722 脂肪、鸢尾 − − − − 35 二氢猕猴桃内酯 4020 果香、木香 − − − − 其他 36 8-十七烷烯 − 大型海藻 − − − − 37 柏木脑 4503 木质、琥珀、麝香 − − − − 注:a:FEMA,美国香料和香精制造者协会(Flavor & Extract Manufacturer’ Association)对香料的编号;b:挥发性成分的风味特征,查询途径http://www.thegoodscentscompany.com/search3.php。 2.2.1 含硫化合物
含硫化合物是海洋绿藻非常重要的特征香气化合物[18]。在3种浒苔样品中,共检测到2种含硫化合物,分别是二甲基硫醚和二甲基亚砜,这两种含硫化合物在其他海藻中也被检测出[18]。3种干制浒苔中,对总体风味贡献最大的组分都为二甲基硫醚,其ROAV值都为100,相对含量表现为X>Y>N,分别占57.52%、41.96%、38.66%(表1)。二甲基硫醚是熟大蒜挥发性风味物质的主要香气物质之一[25],此外,还具有卷心菜、硫磺味、浆果、洋葱、甘蓝、蔬菜、土豆、西红柿、鱼、扇贝、奶油香气[18, 22, 28]。另一种含硫化合物二甲基亚砜也具有类似的气味,但其在3种浒苔样品中的含量大小为X<N<Y,相对含量分别为0.57%、1.73%、2.43%。一般含硫化合物非常不稳定,具有很低的气味阈值,如二甲基硫醚的气味阈值为0.00012 mg/kg(表2),因此含硫化合物往往是海藻特征气味的重要贡献者[18],推测可能对浒苔特征风味贡献最大,该结果与之前浒苔风味成分研究报道一致[21-22] 。
2.2.2 羰基类化合物
羰基化合物主要包括醛类和酮类,大多由多不饱和脂肪酸(PUFAs)通过自氧化或脂氧合酶降解而产生,是绿藻中主要的香气特征化合物[18]。在鉴定出的61个化合物中,共有19种醛类和9种酮类化合物。其中,β-紫罗兰酮的ROAV>1,表明其对浒苔样品的总体风贡献较大,是浒苔关键的特征性风味化合物,在样品X、Y、N里的ROAV值分别为9.23、57.61和48.33。β-紫罗酮有类似紫罗兰花香,同时带有柏木、复盆子的香气,还是维生素A的重要合成前体物质,有利于绿潮藻类芳香味产生[28]。另外,同样具有紫罗兰香味并伴有木香的α-紫罗酮也被检测到,但其只存在于样品Y(0.40%)和样品N(0.85%)中(表1)。在前人的研究中,β-紫罗酮和α-紫罗酮也存在于新鲜浒苔中,且同样β-紫罗酮的含量较高,对浒苔风味影响较大[19-20]。另外,相对含量最高且在3种样品中都检测到的酮类物质是4-甲基-3-戊烯-2-酮,该化合物在样品X、样品Y和样品N中相对含量分别为14.25%、15.91%和20.26%(表1)。4-甲基-3-戊烯-2-酮具有生的或烤的土豆味、土腥味等,能给人带来甜香感受(表2),但其ROAV值均小于0.1,对整体风味似乎影响较小。
对于醛类化合物,样品N中有14种醛,样品Y中有7种,而样品X中只有3种。从表1、表2可见样品N中具有的醛种类更丰富且含量更高,ROAV值也更高。一般来说,醛类通常具有草香、青香和典型的海藻香气[18],碳原子数量和不饱和度的差异造成了不同的青香,其中,(E)-2-丁烯醛(草香、辛香、香蕉)、(E)-2-辛烯醛(海藻、坚果、脂肪)、(E)-2,6-壬二醛(青香、黄瓜)对浒苔样品N的总体风味具有很好的修饰作用(0.1≤ROAV≤1),其ROAV值分别为0.43、0.12、0.18(表2),为样品N的关键特征性香气物质。3种浒苔样品共有的醛类化合物只有苯甲醛(苦杏仁气味),相对含量为N(2.94%)>Y(1.65%)>X(1.03%),但ROAV值不高,该风味对总体样品影响较小。在裘迪红等[22]的研究中,新鲜肠浒苔的苯甲醛约占0.38%,而烘焙后提高到2.99%,推测是浒苔中丰富的蛋白质、脂肪和碳水化合物,经过加热后会发生降解,降解后的产物之间也会相互作用,如氨基酸和还原糖之间的美拉德反应、Strecker降解等,产生各种具有特殊香味的醛类。β-环柠檬醛只出现在样品Y和样品N中,可以给人薄荷般的清凉感受,该物质也是合成香料和类胡萝卜素等萜类化合物的重要中间体,在肠浒苔中也曾被检测出来[19]。除此之外,样品Y特有的4-乙基苯甲醛具有微苦感,5-甲基呋喃醛具有谷物气息,也曾在烹制的新鲜浒苔中被检测出[21]。虽然这些醛类化合物的含量占比不高,但阈值普遍较低,在较低浓度下即可被嗅闻感知,可能与其他风味物质协同后,为浒苔样品提供了更丰富的风味,也有助于其他香气的释放(木香、脂肪香、坚果香、花香、柑橘香和甜香)[18]。
2.2.3 醇类化合物
醇类化合物可能是由海藻中的脂肪酸经氧化分解生成的或是有羰基化合物还原而生成的。3种样品中,共检测到6种醇类化合物,在不同浒苔样品中差异较大。样品Y和样品N中各有3种且不尽相同(表1)。醇类化合物一般气味柔和,具有植物香,对绿潮藻整体气味有着有益影响[28]。其中,ROAV值>0.1的为1-辛烯-3-醇,只在样品N中发现,该物质对样品N的风味具有极大的贡献。1-辛烯-3-醇又名蘑菇醇,具有蘑菇香气、青香、果香的特点(表2),在烹制的新鲜浒苔中被广泛发现,且该香气含量会随着烹制时间的增长而略有下降[29]。另外薄荷醇同样也只在样品N中发现,相对含量为1.12%。在样品X中只有1种醇,即2,6-二甲基环己醇,该化合物在样品Y中也存在且相对含量更高,但未查询到其阈值,无法计算ROAV值。但该物质广泛存在水产品中,是海带腥味物质的来源之一,通常与新鲜海水和淡水鱼中的香味物质相关[30]。样品Y中另一种含量较高的醇为(5Z)-1,5-辛二烯-3-醇,使样品Y多了一丝草香、海洋、蘑菇的气息(表2),此前,(5Z)-1,5-辛二烯-3-醇只在新鲜肠浒苔中发现,而不存在于干制浒苔中[22]。
2.2.4 酸类化合物
浒苔中的醛和醇可能会进一步氧化得到有机酸,酸类化合物一般都具有刺激性气味。3种不同浒苔共检测到8种酸,所有样品都存在少量的酸,可能是相关酯发生了水解变为了酸,这些酸可能为浒苔提供了蜡质、乳制品、奶油、发酵味、浆果的气味特点,其中2-丙烯酸是三者共有且含量较高的,在样品Y中相对含量达到了19.10%,远远高于样品X(5.84%)和N(4.45%)。异戊酸具有芝士味的,在样品Y(1.13%)中同样存在但含量低于样品N(2.12%),前人也曾在干制浒苔中发现该物质[22]。样品X中的十五酸、十六酸的香气阈值较高(表2)而相对含量不高(表1),因此对风味的影响相对较小。所有酸类化合物的ROAV值均小于0.1,因此可以认为酸类化合物对干制浒苔的总体风味影响不大。
2.2.5 酯类及其他化合物
不同浒苔所含的酯类挥发性物质较少,其中二氢猕猴桃内酯在3种样品中均有发现,具有果香、木香的气味,在食品工业和卷烟工业中有着重要的应用价值[31],之前有报道该成分是炒制浒苔的挥发性风味物质之一[22]。十四酸甲酯偏脂肪、鸢尾的气息,其只出现在样品X和样品Y中,且在样品X中的相对含量(5.11%)远远高于样品Y(0.33%)。在样品N中检测到柏木脑,可为浒苔增添木香、琥珀、麝香的风味(表2)。此外,8-十七烯是大型海藻共有的特征风味物,在龙须菜、紫菜、红毛菜中都被检测到,其是酶促反应生成的一类化学感应物质,作为生物信息素在愈伤中起到一定的作用[20]。但这些化合物由于未查询阈值等相关信息,需要进行后续研究,对风味的影响需要再做进一步分析。
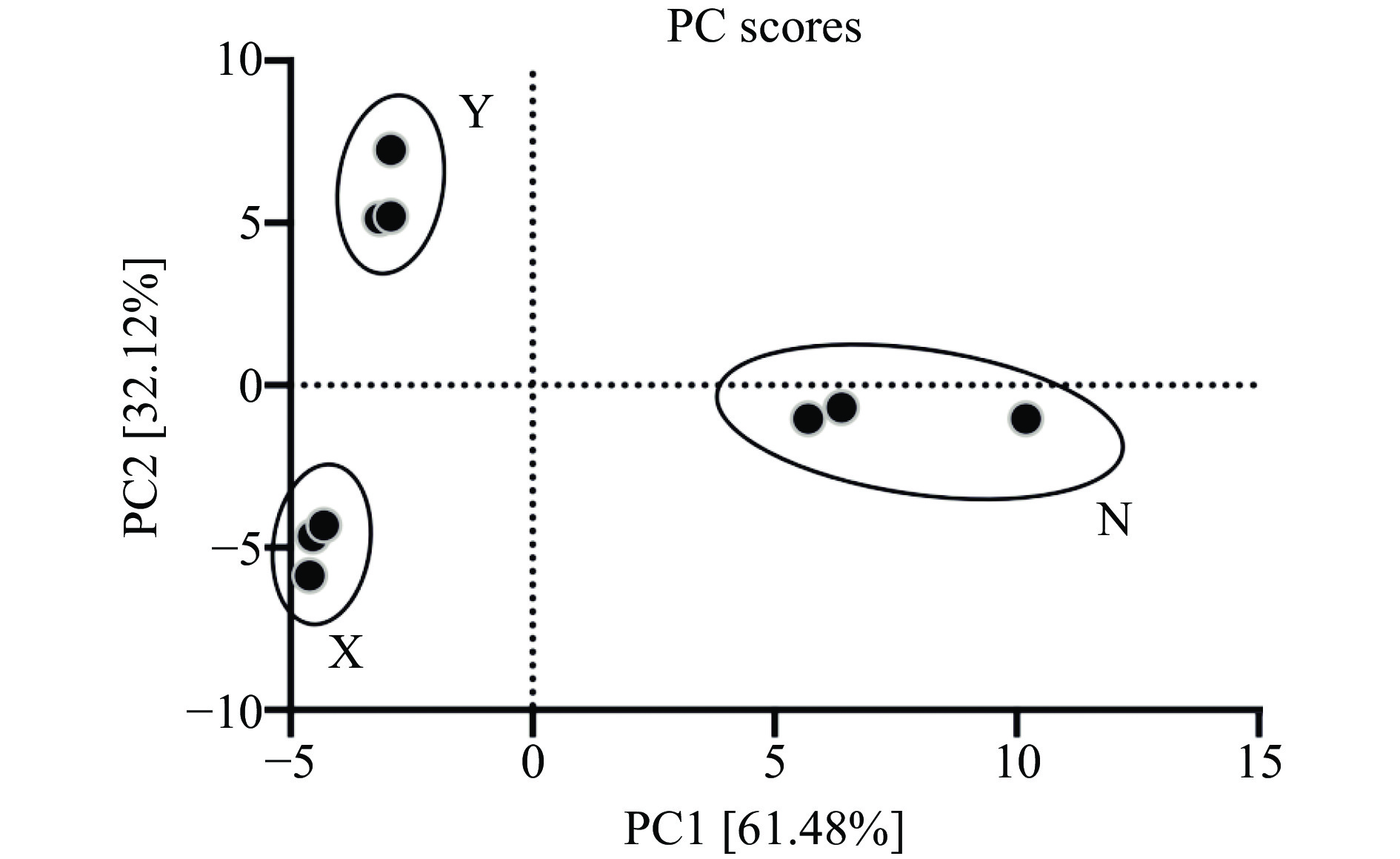
2.3 不同浒苔挥发性成分差异的PCA分析
主成分分析(PCA)是一种多元统计分析技术,可用于提取数据的主要特征分量,在原数据降维简化的同时但尽可能多地保留信息。不同浒苔挥发性成分差异的PCA分析结果见图3,其中PC1贡献率为61.48%,PC2贡献率为32.12%,两者累计贡献率达到93.60%,表明前两个主成分结果足以区分3种不同浒苔样品。从图3可知,X、Y、N具有明显的分离,样本N聚集在右下方区域,样本X聚集在左下方区域,而样本Y分布在左上方区域。结合浒苔中风味成分的种类和含量结果(表1和图1)可以发现,样品X的含硫化合物相对含量较多,高达58.09%,而样品Y和N分别为44.39%和40.39%,主要含硫化合物为二甲基硫醚(X:57.52%,Y:41.96%,N:38.66%),因此不同浒苔中含硫化合物的含量存在一定差异。一般含硫化合物非常不稳定,极易挥发,具有很低的气味阈值,随着浓度升高,散发的香气从“新鲜海水”过渡到“腐烂恶臭”的硫磺样气味,富含硫化物的蔬菜有如洋葱、大蒜、葱等,推测样品X具有更多这类风味。样品Y中含有更高的酸类物质,其相对含量为21.23%,特别是2-丙烯酸达到了19.10%,而酸类物质在样品X和N中相对含量只有8%左右。除2-丙烯酸外,其他酸类包括异戊酸(Y:1.13%,N:2.12%)、己酸(X:0.29%,N:1.10%)、乙酸(Y:0.73%,N:0.35%)、丙酸(N:0.39%)等(表1)。据研究报道,样品中含有少量的酸可能会提供果香、乳制品、奶油、发酵味、浆果的香气特点[28]。样品N中的羰基类化合物(醛类和酮类)较高,比如4-甲基-3-戊烯-2-酮(20.26%)、4-羟基-4-甲基-2-戊酮(3.15%)、苯甲醛(2.94%)等,总含量为39.05%。C6-C9的羰基化合物呈现逐步由青香向脂肪青香过渡的香气,且由于其阈值较低,可能对藻类的香味有显著贡献[18]。基于GC-MS和PCA的分析结果,不同浒苔的挥发性成分存在明显差异,之前研究表明浒苔物种差异、地理来源和环境因素影响等都会造成浒苔挥发性成分的显著变化[21]。
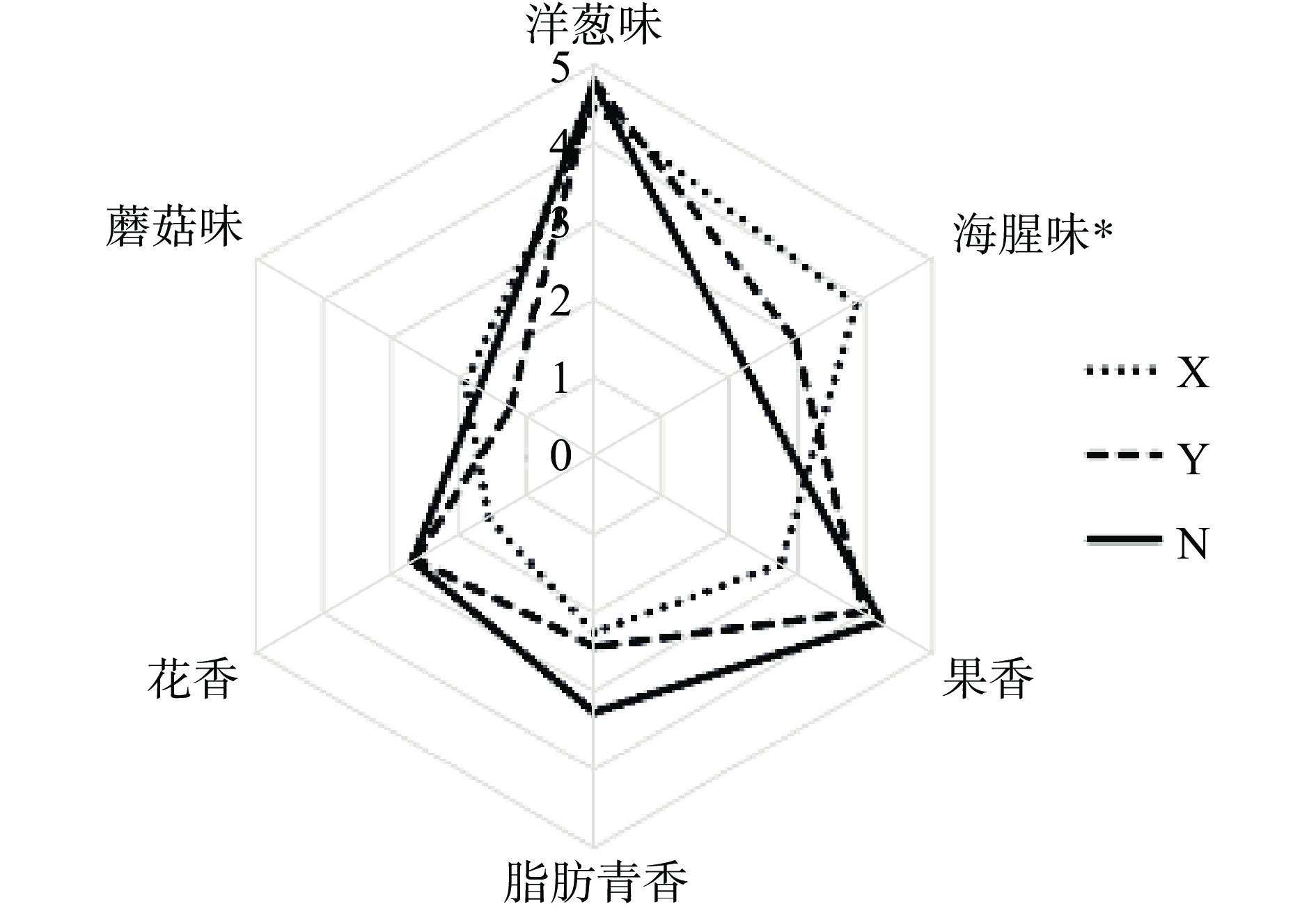
2.4 不同浒苔挥发性风味的感官评价
在浒苔感官评价中,采用洋葱味、海腥味、果香味、脂肪青香、花香和蘑菇味6个感官描述词来评价浒苔香气,并根据感官评价小组的打分(0~5分)绘制香气轮廓图。通过感官评价得出,浒苔主要呈现洋葱味,其次为果香、海腥味、脂肪青香、花香、蘑菇味(图4)。从图4可知,3种浒苔样品的洋葱味都较重,可能与二甲基硫醚、二甲基亚砜相关,与GC-MS结果高度一致。不同浒苔样品的海腥味存在显著性差异(P<0.05),感官评价结果为样品X(3.73)>样品Y(2.82)>样品N(2.19)。2,6-二甲基环己醇、(5Z)-1,5-辛二烯-3-醇等醇类通常与海洋、海水相关(表2),主要存在于样品Y(2.63%)和样品X(1.12%)中,未在样品N中检测到(表1),但这两种醇的ROAV值不明确或较小,推测样品X中也可能有其他未能被仪器检测出的呈海腥味的相关物质,有待进一步研究。同时,感官评价样品X的果香(2.72)、脂肪青香(2.25)、花香(1.52)更少,推测一方面是由于样品Y(分别为3.83、2.38、2.56)和样品N(分别为4.18、3.2、2.63)中的醛类、酮类,种类较多,含量较高(表1),特别是对总体风味起重要作用的β-紫罗酮,在样品X的ROAV值为9.23,而在样品Y和样品N的ROAV值为57.61和48.33(表2)。样品N的脂肪青香(3.2)、花香(2.63)较其他2种浒苔较高(图4),可能是由于对样品起主要修饰作用(0.1≤ROAV≤1)的(E)-2-丁烯醛、(E)-2-辛烯醛、(E)-2,6-壬二醛、1-辛烯-3-醇主要存在于样品N中。浒苔的蘑菇味在所有气味感官评价中的强度分值低,对干制浒苔的整体香气贡献度小。
3. 结论
本研究采用HS-SPME-GC-MS和感官评价对3种不同浒苔的挥发性风味成分进行了分析鉴定。3种浒苔样品中共检测出61种风味物质,通过结合不同的挥发性物质的种类、含量、阈值,计算ROAV值评估其对整体风味的影响。初步确定了干制浒苔关键特征风味化合物为二甲基硫醚(洋葱味、熟大蒜、硫磺)和β-紫罗酮(紫罗兰、花香)。含硫化合物二甲基硫醚的ROAV值为100,呈现洋葱味,可能是对浒苔总体气味最重要的贡献者。此外,3种浒苔共有的挥发性香气成分还包括二甲基亚砜、4-甲基-3-戊烯-2-酮、苯甲醛、二氢猕猴桃内酯等。但3种不同浒苔风味也各有特点,条浒苔(U. clathrata)样品N的关键风味化合物(ROAV≥0.1)的含量和种类都更多,特别是酮醛类羰基化合物,其中(E)-2-丁烯醛、(E)-2-辛烯醛、(E)-2,6-壬二醛和1-辛烯-3-醇等被认为是影响风味的关键性挥发物质,为该样品提供了更多的青香、黄瓜香和海藻特有的香味。同时,还发现了苯乙酮、薄荷醇、柏木脑、己醛、庚醛等特征风味物质,使得浒苔具有花香、木香、薄荷香气等独特的风味感受。缘管浒苔(U. linza)样品Y的其他特征风味化合物主要为(5Z)-1,5-辛二烯-3-醇、4-乙基苯甲醛、5-甲基呋喃醛等,使样品带有独特的青香、果香和谷物香。浒苔(U. prolifera)样品X中,二甲基硫醚含量最高,但海腥味较突出(P<0.05),可能还与其中所含的2,6-二甲基环己醇等其他成分有关。
-
表 1 采用HS-SPME-GC-MS检测到的浒苔的挥发性成分
Table 1 Volatile components of Ulva detected by HS-SPME-GC-MS
序号 化合物 RI值 CAS号 分子式 相对分子量 相对含量(%) 计算值 参考值 X Y N 醇类 1 1-辛烯-3-醇 1454 1456 3391-86-4 C8H16O 128.21 − − 0.58±0.06 2 薄荷醇 1603 1618 15356-70-4 C10H20O 156.27 − − 1.12±0.10 3 (5Z)-1,5-辛二烯-3-醇 1488 − 50306-18-8 C8H14O 126.20 − 0.65±0.07 − 4 2,6-二甲基环己醇 1599 − 5337-72-4 C8H16O 128.21 1.12±0.23 1.98±0.21 − 5 3-癸炔-1-醇 1644 − 51721-39-2 C10H18O 154.25 − − 0.55±0.04 6 3-甲基-3-环己烯-1-醇 1659 − 53783-91-8 C7H12O 112.17 − 0.60±0.02 − 醛类 7 (E)-2-丁烯醛 − 1037 123-73-9 C4H6O 70.09 − − 0.42±0.01 8 己醛 − 1083 66-25-1 C6H12O 100.16 − − 0.47±0.02 9 2-氟-4-(三氟甲基)苯甲醛 − 1209 763-93-9 C6H10O 98.14 − 0.64±0.01 − 10 庚醛 1182 1186 111-71-7 C7H14O 114.19 − − 0.29±0.01 11 (E)-2-己烯醛 − 850 6728-26-3 C6H10O 98.14 − − 0.40±0.02 12 (E)-2-庚烯醛 1336 1334 57266-86-1 C7H12O 112.17 − − 1.13±0.09 13 壬醛 1323 1390 124-19-6 C9H18O 142.24 0.39±0.03 − 0.34±0.03 14 (E,E)-2,4-己二烯醛 − 1414 142-83-6 C6H8O 96.13 − − 0.41±0.02 15 (E)-2-辛烯醛 1443 1434 2548-87-0 C8H14O 126.20 − − 1.07±0.14 16 (E,E)-2,4-庚二烯醛 1472 1497 4313-03-5 C7H10O 110.15 − − 0.55±0.02 17 苯甲醛 1531 1515 100-52-7 C7H6O 106.12 1.03±0.11 1.65±0.26 2.94±0.43 18 5-甲基呋喃醛 − 1570 620-02-0 C6H6O2 110.11 − 0.55±0.11 − 19 (E)-2,6-壬二醛 1732 1715 17587-33-6 C9H14O 138.21 − − 0.29±0.01 20 β-环柠檬醛 1596 1590 432-25-7 C10H16O 152.23 − 0.83±0.13 0.54±0.04 21 2,3-二氢-2,2,6-三甲基苯甲醛 1616 − 116-26-7 C10H14O 150.22 − 0.49±0.03 0.43±0.01 22 间苯二甲醛 2321 2341 626-19-7 C8H6O2 134.13 − − 0.52±0.03 23 4-乙基苯甲醛 1777 1730 4748-78-1 C9H10O 134.18 − 0.35±0.02 − 24 2,5-二甲基苯甲醛 1758 1705 5779-94-2 C9H10O 134.18 − 0.43±0.02 − 25 十六醛 2184 2137 629-80-1 C16H32O 240.42 0.34±0.01 − − 酸类 26 乙酸 − 1460 64-19-7 C2H4O2 60.05 − 0.73±0.04 0.35±0.01 27 丙酸 − 1508 79-09-4 C3H6O2 74.08 − − 0.39±0.02 28 2-丙烯酸 − − 79-10-7 C3H4O2 72.06 5.84±0.37 19.10±2.63 4.45±0.28 29 己酸 − 1849 142-62-1 C6H12O2 116.16 0.29±0.02 − 1.10±0.09 30 十五酸 1412 2819 1002-84-2 C15H30O2 242.40 0.75±0.03 − − 31 十六酸 2849 2899 57-10-3 C16H32O2 256.42 1.31±0.15 0.27±0.10 − 32 棕榈油酸 2922 2960 373-49-9 C16H30O2 254.41 0.29±0.01 − − 33 异戊酸 − 1679 503-74-2 C5H10O2 102.13 − 1.13±0.08 2.12±0.33 酮类 34 丙酮 − 813 67-64-1 C3H6O 58.08 1.65±0.12 0.71±0.13 0.93±0.07 35 4-甲基-3-戊烯-2-酮 − 1131 141-79-7 C6H10O 98.14 14.25±0.53 15.91±1.01 20.26±1.28 36 6-甲基-5-庚烯-2-酮 1352 1341 110-93-0 C8H14O 126.20 − 0.41±0.01 − 37 4-羟基-4-甲基-2-戊酮 − 1351 123-42-2 C6H12O2 116.16 2.36±0.22 2.08±0.18 3.15±0.63 38 (E,E)-3,5-辛二烯-2-酮 1535 1570 30086-02-3 C8H12O 124.18 0.33±0.01 1.27±0.14 1.54±0.23 39 苯乙酮 1642 1627 98-86-2 C8H8O 120.15 − − 0.30±0.01 40 α-紫罗酮 1826 1863 127-41-3 C13H20O 192.30 − 0.40±0.01 0.85±0.03 41 β-紫罗酮 1927 1953 79-77-6 C13H20O 192.30 0.31±0.01 1.41±0.06 1.09±0.51 42 4-[2,2,6-三甲基-7-氧杂二环[4.1.0]
庚-1-基]-3-丁烯-2-酮1932 1967 23267-57-4 C13H20O2 208.30 − 0.54±0.01 1.13±0.24 酯类 43 十四酸甲酯 1487 2028 124-10-7 C15H30O2 242.40 5.11±0.35 0.33±0.01 − 44 二氢猕猴桃内酯 1166 2325 15356-74-8 C11H16O2 180.24 0.50±0.01 1.10±0.14 1.11±0.20 45 1-(1,1-二甲基乙基)-2-甲基-1,3-丙二醇-2-甲基-丙酸酯 2074 − 74381-40-1 C16H30O4 286.41 − − 0.72±0.06 含硫化合物 46 二甲基硫醚 − 777 75-18-3 C2H6S 62.13 57.52±1.23 41.96±2.27 38.66±2.31 47 二甲基亚砜 − 1553 67-68-5 C2H6OS 78.13 0.57±0.02 2.43±0.21 1.73±0.24 含氮化合物 48 2-乙基-3-甲基顺丁烯二酰亚胺 2286 2260 20189-42-8 C7H9NO2 139.15 − − 0.74±0.06 49 N-甲基-1H-咪唑-5-乙酰胺 − − 673-50-7 C6H11N3 125.17 − − 0.30±0.12 其他 50 辛基酚 1692 1600 140-66-9 C14H22O 206.32 0.28±0.01 − − 51 2-(1,1-二甲基乙基)-4-(1-十九烷)-苯酚 2021 − 52184-13-1 C14H22O 206.32 − − 0.46±0.03 52 柏木脑 1719 2127 77-53-2 C15H26O 222.37 − − 0.40±0.01 53 十二烷 1200 − 112-40-3 C12H26 170.33 0.44±0.03 − 0.70±0.01 54 二乙基甲基硼烷 − − 1115-07-7 C5H13B 83.97 0.26±0.01 − − 55 十三烷 1319 − 629-50-5 C13H28 184.36 0.30±0.02 − 0.58±0.02 56 十四烷 1410 236 629-59-4 C14H30 198.39 0.91±0.02 − 0.75±0.06 57 十五烷 1500 − 629-62-9 C15H32 212.41 0.30±0.02 0.27±0.01 − 58 十六烷 1639 − 544-76-3 C16H34 226.44 0.30±0.01 − − 59 8-十七烯 1816 − 16369-12-3 C17H34 238.45 3.25±0.14 0.49±0.02 3.05±0.31 60 环辛二烯 1555 1100 1700-10-3 C8H12 108.18 − − 0.82±0.11 61 角鲨烯 − − 111-02-4 C30H50 410.72 − 1.29±0.12 0.28±0.05 表 2 浒苔的部分挥发性成分风味特征及阈值
Table 2 Flavor characteristics and thresholds of part volatile components of Ulva
序号 中文名 FEMAa 风味特征b 阈值[27]
(mg/kg)ROAV X Y N 含硫化合物 1 二甲基硫醚 2746 熟大蒜、卷心菜、硫磺 0.00012 100 100 100 2 二甲基亚砜 3875 洋葱、牡蛎 − − − − 酮类 3 4-甲基-3-戊烯-2-酮 3368 甜香、土豆、泥土 0.07 0.04 0.07 0.09 4 6-甲基-5-庚烯-2-酮 2707 柑橘、蘑菇、薄荷、草莓 0.068 0 <0.01 0 5 苯乙酮 2009 杏仁、花香、肉香 0.065 0 0 <0.01 6 α-紫罗酮 2594 紫罗兰、木香 0.00378 0 0.03 0.07 7 β-紫罗酮 2595 紫罗兰、花香 0.000007 9.23 57.61 48.33 醛类 8 (E)-2-丁烯醛 2219 香蕉、青香、辛香 0.0003 0 0 0.43 9 己醛 2557 苹果、果青香 0.005 0 0 0.03 10 庚醛 2540 脂肪、柑橘 0.0028 0 0 0.03 11 (E)-2-己烯醛 2560 草香、青香 0.11 0 0 <0.01 12 (E)-2-庚烯醛 3165 肥皂、扁桃仁 0.051 0 0 0.01 13 壬醛 2782 脂肪、柑橘、青香、花香 0.0028 0.03 0 0.04 14 (E,E)-2,4-己二烯醛 3429 甜香、青香、蜡质 0.0018 0 0 0.07 15 (E)-2-辛烯醛 3215 海藻、坚果、脂肪 0.0027 0 0 0.12 16 (E,E)-2,4-庚二烯醛 3164 青香、坚果、脂肪 0.057 0 0 <0.01 17 苯甲醛 2127 苦杏仁、樱桃、甜香 0.75089 <0.01 <0.01 <0.01 18 5-甲基呋喃醛 2702 甜香、谷物 1.11 0 <0.01 0 19 (E)-2,6-壬二醛 3766 青香、黄瓜皮 0.0005 0 0 0.18 20 β-环柠檬醛 3639 薄荷、烟草、酚类 0.005 0 0.05 0.03 21 4-乙基苯甲醛 3756 甜香、苦的 0.013 0 0.01 0 醇类 22 2,6-二甲基环己醇 − 新鲜海水、淡水鱼 − − − − 23 1-辛烯-3-醇 2805 蘑菇、青香、果香 0.0015 0 0 0.12 24 薄荷醇 2665 薄荷、清凉 0.13 0 0 <0.01 25 (5Z)-1,5-辛二烯-3-醇 4732 草香、海洋、蘑菇 0.01 0 0.02 0 酸类 26 2-丙烯酸 − − 0.27 <0.01 0.02 0.01 27 乙酸 2006 酸的、辛香、果香 0.013 0 0.02 0.01 28 丙酸 2924 酸的、辛香、脂肪 2.19 0 0 <0.01 29 己酸 2559 酸的、芝士、果香、脂肪 0.89 <0.01 0 <0.01 30 十五酸 4334 − 10 <0.01 0 0 31 十六酸 2832 脂肪、肥皂、乳制品 >10 <0.01 <0.01 0 32 丙烯酸 − − 0.5 0 <0.01 0 33 异戊酸 3102 酸的、芝士、辛香 0.49 0 <0.01 <0.01 脂类 34 十四酸甲酯 2722 脂肪、鸢尾 − − − − 35 二氢猕猴桃内酯 4020 果香、木香 − − − − 其他 36 8-十七烷烯 − 大型海藻 − − − − 37 柏木脑 4503 木质、琥珀、麝香 − − − − 注:a:FEMA,美国香料和香精制造者协会(Flavor & Extract Manufacturer’ Association)对香料的编号;b:挥发性成分的风味特征,查询途径http://www.thegoodscentscompany.com/search3.php。 -
[1] MELTON J, LOPEZ-BAUTISTA J. Diversity of the green macroalgal genus Ulva (Ulvophyceae, Chlorophyta) from the east and gulf coast of the United States based on molecular data[J]. Phycological Society of America,2021,57(2):551−568.
[2] NIKLAS W, FILIP N, ERIC M, et al. Composition and structure of cell wall ulvans recovered from Ulva spp. along the Swedish west coast[J]. Carbohydrate Polymers,2020,233(1):115852−11560.
[3] 罗佳捷, 肖淑华, 张彬, 等. 浒苔的研究进展及其在动物生产中的应用[J]. 资源开发,2014(2):31−34. [LUO J J, XIAO S H, ZHANG B, et al. Research progress of Enteromorpha prolifer and application in animal production[J]. Resource Development,2014(2):31−34. LUO J J, XIAO S H, ZHANG B, et al. Research progress of Enteromorpha prolifer and application in animal production[J]. Resource Development, 2014(2): 31-34.
[4] GOLUBKOV S, BEREZINA N, GUBELIT Y. A relative contribution of carbon from green tide algae Cladophora glomerata and Ulva intestinalis in the coastal food webs in the Neva Estuary (Baltic Sea)[J]. Marine Pollution Bulletin,2018,126:43−50. doi: 10.1016/j.marpolbul.2017.10.032
[5] ZHANG P, XIN Y, ZHONG X, et al. Integrated effects of Ulva prolifera bloom and decay on nutrients inventory and cycling in marginal sea of China[J]. Chemosphere,2021,264(1):128389.
[6] TRAPASSO G, COPPOLA F, QUEIROS V, et al. How Ulva lactuca can influence the impacts induced by the rare earth element Gadolinium in Mytilus galloprovincialis? The role of macroalgae in water safety towards marine wildlife[J]. Ecotoxicology and Environmental Safety,2021,215:112101. doi: 10.1016/j.ecoenv.2021.112101
[7] OHNO M. Cultivation of Monostroma nitidum (Chlorophyta) in a river estuary, southern Japan[J]. Journal of Applied Phycology,1995,7(2):207−213. doi: 10.1007/BF00693069
[8] TZIVELEKA L, IOANNOU E, ROUSSIS V. Ulvan, a bioactive marine sulphated polysaccharide as a key constituent of hybrid biomaterials: A review[J]. Carbohydrate Polymers,2019,218(1):355−370.
[9] WEKRE M, KASIN K, UNDERHAUG J, et al. Quantification of polyphenols in seaweeds: A case study of Ulva intestinalis[J]. Antioxidants,2019,8(12):612. doi: 10.3390/antiox8120612
[10] YANG J, WANG Y, YIN J, et al. Polysaccharides from Ulva prolifera O. F. Muller inhibit cell proliferation via activating MAPK signaling in A549 and H1650 cells[J]. Food Function,2021,12:6915−6924. doi: 10.1039/D1FO00294E
[11] ROLEDA M, LAGE S, ALUWINI D, et al. Chemical profiling of the Arctic sea lettuce Ulva lactuca (Chlorophyta) mass-cultivated on land under controlled conditions for food applications[J]. Food Chemistry,2021,341(1):127999.
[12] POURHAJIBAGHER M, SALEHI-VAZIRI A, NOROOZIAN M, et al. An orthodontic acrylic resin containing seaweed Ulva lactuca as a photoactive phytocompound in antimicrobial photodynamic therapy: Assessment of anti-biofilm activities and mechanical properties[J]. Photodiagnosis and Photodynamic Therapy,2021,35:102295. doi: 10.1016/j.pdpdt.2021.102295
[13] LÜ M, YUAN M, WANG Y, et al. Allelopathic effects of Ulva linza on marine phytoplankton and identification of the allelochemicals[J]. Environmental Science and Pollution Research,2021,28(33):45714−45723. doi: 10.1007/s11356-021-13734-8
[14] JAYAKODY M, VANNIARACHCHY M, WIJESEKARA W. Development and characterization of a seaweed snack using Ulva fasciata[J]. Journal of Food Science and Technology,2021,58(4):1617−1622. doi: 10.1007/s13197-020-04880-x
[15] CHERRY P, O’HARA C, MAGEE P, et al. Risks and benefits of consuming edible seaweeds[J]. Nutrition Reviews,2019,77(5):307−329. doi: 10.1093/nutrit/nuy066
[16] WAHLSTROM N, NYLANDER F, MALMHALL-BAH E, et al. Composition and structure of cell wall ulvans recovered from Ulva spp. along the Swedish west coast[J]. Carbohydrate Polymers,2020,233:115852. doi: 10.1016/j.carbpol.2020.115852
[17] FINI S, AYTAN M, ANA R, et al. Evolution of volatile compounds and sensory characteristics of edible green seaweed (Ulva rigida) during storage at different temperatures[J]. Journal of the Science of Food and Agriculture,2019,99(12):5475−5482. doi: 10.1002/jsfa.9808
[18] FRANCEZON N, TREMBLAY A, MOUGET J, et al. Algae as a source of natural flavors in innovative foods[J]. Journal of Agricultural and Food Chemistry,2021,69(40):11753−11772. doi: 10.1021/acs.jafc.1c04409
[19] 宋绍华, 裘迪红. 浒苔挥发性风味成分分析[J]. 食品科学,2012,33(12):177−180. [SONG S H, QIU D H. Analysis of volatile flavor compounds from Enteromorpha intestinalis[J]. Food Science,2012,33(12):177−180. SONG S H, QIU D H. Analysis of volatile flavor compounds from Enteromorpha intestinalis[J]. Food Science, 2012, 33(12): 177-180.
[20] 赵莉娟, 李崇翔, 乔桥, 等. 黄海绿潮漂移过程中浒苔挥发性风味物质研究[J]. 天然产物研究与开发,2021,33(8):1356−1370. [ZHAO L J, LI C X, QIAO Q, et al. Volatile flavor compounds of Ulva prolifera during the whole drifting process of green tides in Yellow Sea[J]. Natural Product Research,2021,33(8):1356−1370. doi: 10.16333/j.1001-6880.2021.8.012 ZHAO L J, LI C X, QIAO Q, et al. Volatile flavor compounds of Ulva prolifera during the whole drifting process of green tides in Yellow Sea [J]. Natural Product Research, 2021, 33(8): 1356-1370. doi: 10.16333/j.1001-6880.2021.8.012
[21] SANCHEZ-GARCIA F, MIRZAYEVA A, ROLDAN A, et al. Effect of different cooking methods on sea lettuce (Ulva rigida) volatile compounds and sensory properties[J]. Journal of the Science of Food and Agriculture,2021,101(3):970−980. doi: 10.1002/jsfa.10705
[22] 裘迪红, 宋绍华, 苏秀榕, 等. 浒苔加热过程中挥发性风味成分的变化[J]. 中国食品学报,2013,13(5):250−257. [QIU D H, SONG S H, SU X R, et al. Changes of volatile flavor components in Enteromorpha prolifera during heating[J]. Journal of Chinese Institute of Food Science and Technology,2013,13(5):250−257. QIU D H, SONG S H, SU X R, et al. Changes of volatile flavor components in Enteromorpha prolifera during heating[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(5): 250-257.
[23] 王梦婷. 新型固相微萃取纤维萃取结合气相色谱检测食品和环境样品中的污染物残留[D]. 保定: 河北农业大学, 2019 WANG M T. Determination of some pollutants in food and environmental samples by solid phase microextraction with new fibers combined with gas chromatography[D]. Baoding: Hebei Agricultural University, 2019.
[24] 李慧, 聂枞宁, 熊丙全, 等. 摇青工艺对“崇庆枇杷茶”加工红茶的香气品质的影响[J]. 食品与发酵工业,2021,47(2):188−195. [LI H, NIE C N, XIONG B Q, et al. Shaking green technology on the aroma quality of “Chongqing Pipa tea” processed black tea[J]. Food and Fermentation Industries,2021,47(2):188−195. LI H, NIE C N, XIONG B Q, et al. Shaking green technology on the aroma quality of “Chongqing Pipa tea” processed black tea[J]. Food and Fermentation Industries, 2021, 47(2): 188-195.
[25] 李沅达, 吴婷, 黄刚骅, 等. SPME-GC-MS 技术结合ROAV分析不同加工工艺紫娟白茶的关键香气物质[J]. 食品工业科技,2023,44(9):324−332. [LI Y D, WU T, HUANG G, et al. Analysis of key aroma components in Zijuan white tea by SPME-GC-MS combined with ROAV[J]. Science and Technology of Food Industry,2023,44(9):324−332. LI Y D, WU T, HUANG G, et al. Analysis of key aroma components in Zijuan white tea by SPME-GC-MS combined with rOAV[J]. Science and Technology of Food Industry, 2023, 44(9): 324-332.
[26] 黄丹, 刘有晴, 倪月, 等. 基于ROAV值的四川麸醋主体风味物质研究[J]. 食品工业,2016,37(9):288−292. [HUANG D, LIU Y Q, NI Y, et al. Study of main aroma components of Sichuan bran vinegar based on ROAV value[J]. The Food Industry,2016,37(9):288−292. HUANG D, LIU Y Q, NI Y, et al. Study of main aroma components of Sichuan bran vinegar based on ROAV value[J]. The Food Industry, 2016, 37(9): 288-292.
[27] GEMERT L. 化合物香味阈值[M]. 北京: 科学出版社, 2015. GEMERT L. Aroma threshold of compounds[M]. Beijing: Science Press, 2015.
[28] MOSCIANO G. Organoleptic characteristics of flavor materials[J]. Perfumer & Flavorist, 1998.
[29] GONZALEZ F R, NARDILLO A M. Retention index in temperature-programmed gas chromatography[J]. Journal of Chromatography A,1999,842(1/2):29−49.
[30] 陈婉珠, 芮汉明, 张玲. 海带腥味物质的HS-SPME-GC-MS分析[J]. 食品工业科技,2006(12):71−73, 76. [CHEN W Z, RUI H M, ZHANG L. The characteristic fishy smell of Laminaria detected by HS-SPME-GC-MS analysis[J]. Science and Technology of Food Industry,2006(12):71−73, 76. doi: 10.3969/j.issn.1002-0306.2006.12.020 CHEN W Z, RUI H M, ZHANG L. The characteristic fishy smell of Laminaria detected by HS-SPME-GC-MS analysis[J]. Science and Technology of Food Industry, 2006(12): 71-73, 76. doi: 10.3969/j.issn.1002-0306.2006.12.020
[31] 王忠泽, 杨宇涵, 张红霞, 等. 五个不同产地绞股蓝茶挥发物及香气成分研究[J]. 天然产物研究与开发,2020,32(10):1717−1729. [WANG Z Z, YANG Y H, ZHANG H X, et al. Volatile and aroma components of Gynostemma pentaphyllum (Thunb.) Makino tea from five different origins[J]. Natural Product Research,2020,32(10):1717−1729. WANG Z Z, YANG Y H, ZHANG H X, et al. Volatile and aroma components of Gynostemma pentaphyllum (Thunb. ) Makino tea from five different origins[J]. Natural Product Research, 2020, 32(10): 1717~1729.
-
期刊类型引用(10)
1. 滕琳,闫智慧,郝鹏鹏,郑祉泓. 均匀设计法在枣树皮抑菌活性物提取工艺优化的应用. 天津化工. 2025(01): 103-108 .  百度学术
百度学术
2. 刘坤,付鑫垚,郭彤,张婉月,赵庆生,孔泽娟,程华,宋恒. 桑树桑黄总三萜的提取纯化及其生物活性研究. 广西植物. 2025(02): 217-227 .  百度学术
百度学术
3. 金鑫,马小龙,李萍,熊川,黄文丽,朱宇. 川赤芍总苷提取工艺优化、组成和抗氧化活性分析. 中国食品添加剂. 2024(01): 109-118 .  百度学术
百度学术
4. 吴艳钦,张锶莹,翁馨,黄千慧,魏奇. 响应面法优化蛹虫草猴头菇银耳复合蛋糕加工工艺. 宁德师范学院学报(自然科学版). 2024(02): 174-180 .  百度学术
百度学术
5. 李茂淋,王三,王毅,蒲晗旭,唐仁勇,郭秀兰,王国泽. 葛根素-猴头菇不溶性膳食纤维复合微胶囊的制备及理化性质的研究. 食品工业科技. 2024(14): 71-80 .  本站查看
本站查看
6. 刘泽华,周媛,刘航,胡伦,喻仕瑞,郑华艳. 贵州灵芝三萜提取及其配制酒抗氧化性研究. 农产品加工. 2024(15): 1-4+11 .  百度学术
百度学术
7. 陈林. 液态发酵茯苓菌有机相提取物抗氧化活性研究. 化工设计通讯. 2023(11): 217-219 .  百度学术
百度学术
8. 张鑫,朱青永,徐慧敏,吴梦园,陈小娥,陈启和,刘政捷. 黄绿卷毛菇中原伊鲁烷型倍半萜芳基酯提取工艺优化及活性研究. 浙江大学学报(农业与生命科学版). 2023(06): 813-824 .  百度学术
百度学术
9. 聂健,杨水莲,彭真福,莫美华. 均匀设计法优化灵芝三萜提取工艺. 食品安全导刊. 2022(06): 135-139 .  百度学术
百度学术
10. 么越,荣丹,唐梦瑜,姜明,于莹莹,张越涵,于明航. 羊肚菌药用价值及产品开发现状. 中国食用菌. 2022(07): 13-17+21 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:

 下载:
下载:



