Screening, Identification and Biological Characterization of Weizmannia coagulans BC66
-
摘要: 本研究旨在分离和筛选一株用于微生态制剂的益生菌。根据耐高温和产乳酸特性,从仔猪粪便中筛选到一株芽孢杆菌。通过形态学、生理生化试验和16S rDNA序列分析,该菌株鉴定为凝结魏茨曼氏菌,代号为BC66。在此基础上,通过体外实验考察了凝结魏茨曼氏菌BC66菌株的益生菌潜力,包括对胃肠道条件的耐受性(低pH,胆盐耐受性)、对病原菌的抑菌能力和抗生素敏感性。 实验结果表明,BC66菌株在pH3.0酸性条件下处理2 h,菌株存活率达98%,0.3%胆盐浓度下处理2 h,菌株存活率达79%,在90 ℃水浴中处理10 min菌株芽孢存活率可达92%。而且,BC66菌株对大肠杆菌和沙门氏菌的生长具有较强的抑制能力。对所有测试的抗生素都表现出很好的敏感性,且没有观察到溶血活性。上述结果表明,本研究分离筛选的凝结魏茨曼氏菌BC66具有较强的抗逆性且益生性能良好。该菌株有可能作为饲料添加剂中潜在的候选益生菌,为应用于微生态制剂的研发奠定了基础。Abstract: The objective of this study was to isolate and screen probiotics for application in production of microecological preparation. A bacillus strain was screened from the feces of a healthy piglet based on heat treatment and lactic acid-producing characteristics. This strain was identified to be Weizmannia coagulans assigned as BC66 by means of morphological, physiological, biochemical and molecular identification. The strain Weizmannia coagulans BC66 was evaluated in vitro for its probiotic potential viz., the tolerance to gastrointestinal tract conditions (low pH, bile salt tolerance), antimicrobial activity, antibiotic susceptibility. The strain BC66 showed the resistance to low acidity and high bile salts concentration with the survival rate of 98% at pH3.0 and 79% at bile salt 0.3% respectively. The viability of the strain was 92% after 10 min treatment in 90 ℃ water bath. Moreover, the strain was able to act against Escherichia coli and Salmonella and was sensitive to most of the antibiotics tested. Strain BC66 did not exhibit any hemolytic activity. The results indicated that Weizmannia coagulans BC66 had excellent probiotic properties. This strain could be used as a potential candidate probiotic and eventually be explored further for potential application in feed additives.
-
Keywords:
- Weizmannia coagulans /
- screening /
- antimicrobial activity /
- sensitive /
- microecological preparation
-
凝结魏茨曼氏菌(曾用名凝结芽孢杆菌)是一种既能产乳酸又能产芽孢的革兰氏阳性细菌,最早于1915年由Hammer[1]分离得到。凝结魏茨曼氏菌是美国食品和药物管理局(FDA)和欧盟食品安全局(EFSA)共同认证的可以安全使用的益生菌。同时,凝结魏茨曼氏菌也列入了Generally Recognized As Safe(GRAS 普遍公认安全)和Qualified Presumption of Safety(QPS合格安全推定)菌株名单。此外,美国食品药品监督管理局(FDA)和美国饲料控制官员协会也将凝结魏茨曼氏菌列入到可用于饲料的安全微生物菌种名单[2-3]。
近年来,凝结魏茨曼氏菌作为新型微生态制剂,由于其益生作用和高抗逆特性,在畜牧[4]、水产养殖[5]、农业[6]和环境保护[7]等行业中被广泛应用。刘彬等[8]发现凝结魏茨曼氏菌增加异育银鲫幼鱼血液中髓过氧化物酶和抗超氧阴离子自由基活性,有效缓解宿主重金属中毒反应。苗华彪等[9]研究发现凝结魏茨曼氏菌在生猪养殖应用中具有改善生猪肠道健康、提高机体免疫力和抗病能力、调节肠道菌群平衡和提高动物生产性能等作用。可见凝结魏茨曼氏菌作为一种新的微生态制剂正在成为一种趋势。但是由于菌株的挑选不规范,菌株配伍不科学,是否具有耐药性等依然影响着微生态制剂的应用与发展。本研究对一株从仔猪粪便中分离获得的凝结魏茨曼氏菌进行了形态特征的观察,评价了该菌株的益生特性和安全性,同时,初步考察了与其他饲用益生菌的复配情况,证明其具备开发利用和研究价值,为凝结魏茨曼氏菌进一步的功能评价、应用扩展奠定基础。
1. 材料与方法
1.1 材料与仪器
病原菌:大肠杆菌ATCC25922、金黄色葡萄球菌ATCC25923、肠炎沙门氏菌ATCC14028、福氏志贺氏菌ATCC12022、化脓性链球菌ATCC19615 购于广东微生物菌种保藏中心;干酪乳杆菌W189、乳酸片球菌W172、嗜酸乳杆菌W211、屎肠球菌W362、粪肠球菌W471 武汉微康益生菌研究院实验室分离、编号、保藏;仔猪粪便 采集自湖北省种猪养殖场断奶仔猪;小鼠 购自华中农业大学实验动物中心,实验动物使用许可证号为SYXK(鄂)2020-0084,小鼠实验伦理审批编号为HZAUMO-2023-0140;蛋白胨、酵母粉 安琪酵母股份有限公司;葡萄糖、K2HPO4、MgSO4、MnSO4、NaCl、CaCO3、硫酸铵(均为分析纯试剂)、猪胆盐(胆酸含量≥60%) 国药集团化学试剂有限公司;胃蛋白酶(1:3000) 上海麦克林生化科技有限公司;其他试剂为分析纯试剂。
JY10002型电子天平 上海衡平仪器仪表厂;SW-CJ-2FD型双人单面超净工作台 苏州安泰空气技术有限公司;SPX-250B-2型恒温培养箱 上海福玛实验设备有限公司;CX-23显微镜 奥林巴斯公司;UV-1700紫外分光光度计 上海美析仪器有限公司;pHS-3C型pH计 上海仪电科股份有限公司公司;D(24 L)型高压蒸汽灭菌锅 合肥华泰医疗设备有限公司;DK-8D型水浴加热锅 常州国宇仪器制造有限公司;5415D台式冷冻离心机 德国Eppendorf公司。
1.2 实验方法
1.2.1 培养基和溶液配制
MRS培养基(g/L):蛋白胨10 g,牛肉浸粉10 g,酵母粉5 g,葡萄糖20 g,KH2PO4 2 g,柠檬酸氢二铵2 g,无水乙酸钠5 g,MgSO4 0.2 g,MnSO4 0.6 g,Tween 80 1 mL,蒸馏水1000 mL,pH6.0~6.2,115 ℃,30 min灭菌。
平板筛选培养基参考辛国芹等[10]报道筛选培养基:MRS培养基基础上添加0.25% CaCO3和1.5%琼脂粉。
发酵培养基:蛋白胨10 g,葡萄糖5 g,酵母粉5 g,无水乙酸钠5 g,硫酸锰0.2 g,硫酸镁0.2 g,磷酸氢二钾4 g,水1000 mL,pH6.8~7.0,115 ℃灭菌 30 min。
PCA培养基:葡萄糖1 g,胰蛋白胨5 g,酵母浸粉2.5 g,琼脂粉1.8 g/L,水 1000 mL, pH7.0~7.2,121 ℃灭菌 20 min。
胃液配制[11]:NaCl 0.5%、胃蛋白酶 0.3%,用1 mol/L HCl调节pH至3.0,用0.22 μm微孔滤膜过滤除菌后备用。
胆盐培养基[12]:取一定量的猪胆盐加入含0.2%(w/v)的巯基乙酸钠的MRS培养基中,使胆盐终浓度(g/mL)分别为0%,0.1%,0.3%,0.5%,1.0%,用0.22 μm微孔滤膜过滤除菌后备用。
1.2.2 菌株的筛选与鉴定
1.2.2.1 菌种初筛纯化
采集健康仔猪粪便样品10份,各取样品1 g分别放入装有 9 mL无菌生理盐水50 mL离心管中,振荡15 min,使之充分混匀,静置20~30 s,每个样品吸取2 mL悬液置于80 ℃水浴处理10 min[13],分别取1 mL进行10倍梯度稀释,再选择适宜梯度的悬液涂布于含0.25%碳酸钙的MRS琼脂培养基上,置于37 ℃培养箱恒温培养 48~72 h。挑取初筛平板不同形态的单菌落在PCA培养基平板上反复划线纯化,单菌落形态稳定后,编号保存。
1.2.2.2 菌株形态学观察
平板菌落观察:观察菌落形态、大小、颜色、凸起有无等;菌体形态观察:观察油镜下菌体的形态、大小、排列等;扫描电镜观察:观察扫描电镜下放大20000倍菌体的立体形态、芽孢着生特点等。
1.2.2.3 16S rDNA序列分析及系统发育树构建
使用通用引物27F:AGAGTTTGATCCTGGCTCAG和1492R:GGTTACCTTGTTACGACTT进行PCR扩增。PCR反应体系:2×Buffer MIX 25 μL,引物27F和1492R各2 μL,DNA模板2 μL,ddH2O补足至50 μL。PCR反应条件:94 °C 3 min;94 °C 30 s,55 °C 30 s,72 °C 1.5 min,35个循环;72 ℃ 10 min。将PCR产物通过凝胶电泳检测后,产物送往武汉金开瑞生物工程有限公司测序。将测得基因序列提交至NCBI数据库中进行BLAST分析比对,以16S rDNA序列同源性≥99%为鉴定标准。
1.2.3 生理生化实验
参照《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》进行。
1.2.4 生长特性的初步探究
将凝结魏茨曼氏菌单菌落接种至MRS液体培养基进行二级活化,按照5%接种量接入装有30 mL发酵培养基的250 mL三角瓶中,37 ℃,250 r/min,摇床培养,以pH、OD值为指标,观察菌株24 h的生长特性。
1.2.5 抗逆性实验
1.2.5.1 培养液制备
取BC66甘油管接种至30 mL MRS液体培养基中进行一级活化,37 ℃,250 r/min摇床培养12~15 h,取一级培养液按5%接种量接入装有30 mL发酵培养基的250 mL三角瓶中,37 ℃,250 r/min,摇床培养18~24 h得到所需培养液。
1.2.5.2 耐酸实验
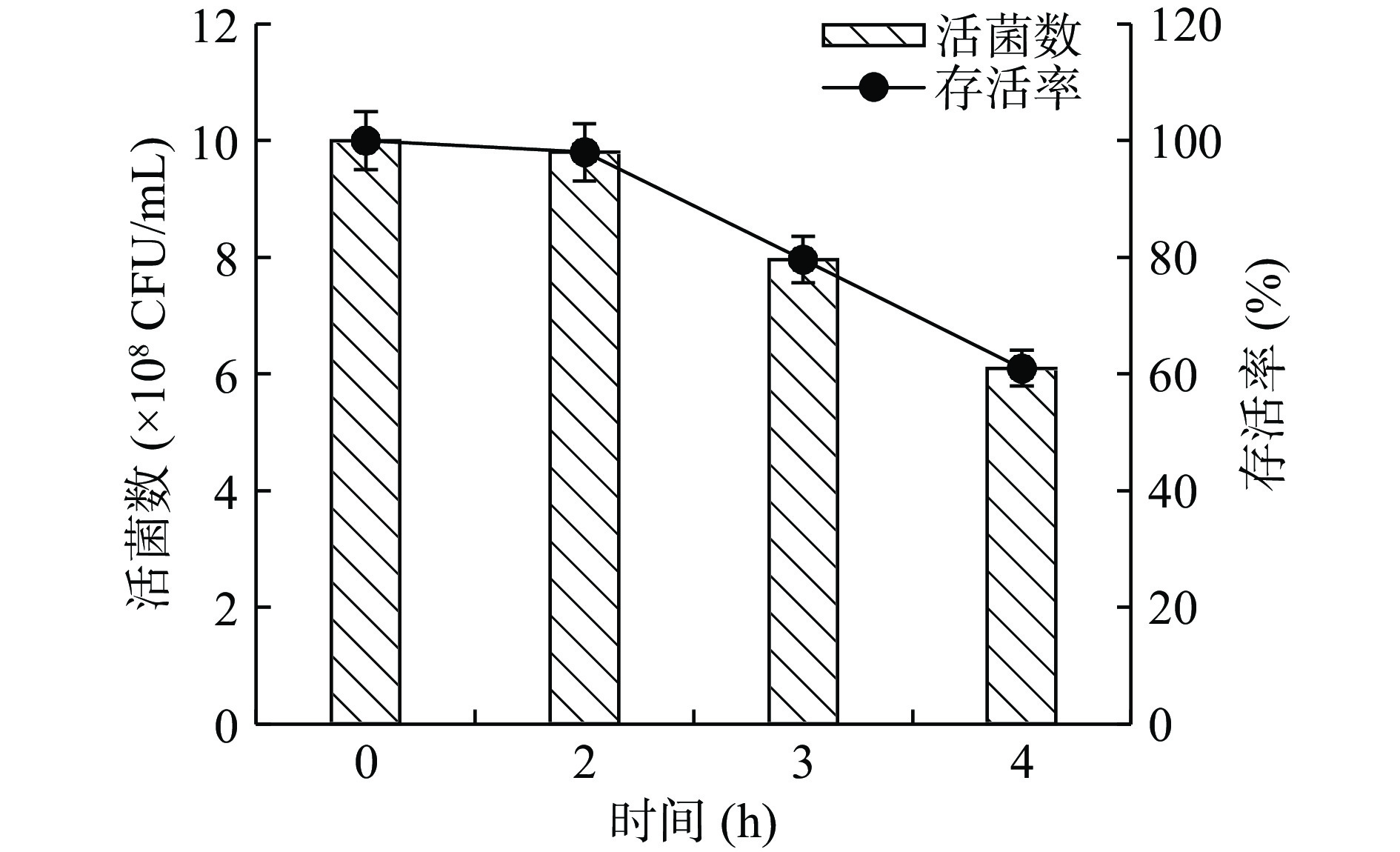
取1 mL培养液10000 r/min离心1 min 后去上清加入10 mL pH3.0的模拟胃液,置于37 °C培养箱恒温孵育,分别于0、2、3、4 h不同耐受时间取样进行活菌计数。以0 h测定值作为空白对照,计算菌株存活率。
菌株存活率 (%)=N1N0×100 其中,N1表示经过处理后菌株体系中的活菌数,CFU/mL;N0表示菌株体系中初始活菌数,即0 h测得的活菌数, CFU/mL。
1.2.5.3 耐胆盐实验
取1 mL培养液10000 r/min离心1 min后去上清分别加入不同胆盐浓度0.1%、0.3%、0.5%、1.0%(w/v)的10 mL 胆盐培养基,置于37 °C恒温培养,分别于0、2 h取样进行活菌计数。以0 h测定值作为空白对照,计算菌株存活率。
菌株存活率 (%)=N1N0×100 其中,N1表示经过处理后菌株体系中的活菌数,CFU/mL;N0表示菌株体系中初始活菌数,即0 h测得的活菌数,CFU/mL。
1.2.5.4 耐高温实验
将凝结魏茨曼氏菌菌株接种至PCA固体斜面培养基上,菌体培养至形成芽孢后,取菌苔制成悬液各2 mL,分别置于70、80、90、100 ℃水浴中处理10 min,处理完后立即冷却,取0.1 mL悬液进行梯度稀释活菌计数,以未水浴菌液为对照,培养48 h后计算存活率[14]。
菌株存活率 (%)=N1N0×100 其中,N1表示水浴中处理10 min后的活菌数,CFU/mL;N0表示未水浴菌液的活菌数,CFU/mL。
1.2.6 体外抑菌实验
采用琼脂扩散法[15],按1.2.5培养液制备方法进行二级活化,二级培养液37 ℃ 250 r/min 摇瓶培养10~15 h,离心收集上清液。指示菌采用LB液体培养基进行培养,在 37 ℃、220 r/min 条件下摇瓶培养 24 h,制成1×108 CFU/mL菌悬液。指示菌悬液按1:100的比例加入LB琼脂培养基溶液中,充分混匀后倾注加到放置牛津杯的平板中,凝固后取出牛津杯。将200 µL上清液加入到7 mm的孔中,以空白LB培养基为阴性对照,37 ℃培养适宜时间后,测量抑菌圈的大小,检测加入培养上清液对指示菌的抑制作用。
1.2.7 凝结魏茨曼氏菌与不同菌株的拮抗关系
参考徐秀伟[16]采用的菌种划线拮抗方法,分别将凝结魏茨曼氏菌、干酪乳杆菌、嗜酸乳杆菌、乳酸片球菌、屎肠球菌,粪肠球菌的甘油管菌种接种至MRS液体培养基过夜培养,取不同菌株菌液离心,留菌体。将凝结魏茨曼氏菌分别和干酪乳杆菌、嗜酸乳杆菌、乳酸片球菌、屎肠球菌,粪肠球菌在平板上两两呈“井”字划线,观察交叉菌线生长状况,是否出现透明圈,以此判断两个菌株间是否存在拮抗作用。 1.2.8 安全性评价
1.2.8.1 溶血性实验
取1.2.5离心后的凝结魏茨曼氏菌菌体以划线的形式接种在含1.5%琼脂和5%脱纤维羊血的血液琼脂(BHI培养基)中37 ℃培养48 h,观察溶血情况。在菌落周围产生绿色带(α-溶血)或在血平板上不产生任何溶血(γ-溶血)的菌株被认为是非溶血的,菌落周围出现溶血带(透明色带)的菌株被归类为具有溶血(β-溶血)特性的微生物,出现透明β-溶血环为溶血表型阳性,使用化脓性链球菌作为阳性质控菌株[17]。
1.2.8.2 抗生素敏感实验
采用纸片扩散试验法[18]。将200 μL含108 CFU/mL的凝结魏茨曼氏菌发酵液均匀涂布于MRS琼脂平板上,待平板表面稍干后,放入常用抗生素药敏纸片,贴在培养基表面中央,轻轻按压纸片使其固定。在37 ℃培养24 h后,测量抑制圈直径大小。
1.2.8.3 急性毒性实验
安全性评价采用急性毒性实验,参照GB15193.9-2014最大耐受剂量法进行。取体重18~22 g 的小鼠雌雄各15只,观察3 d 后,1日内分2次经口给予0.2 mL注菌液(按小鼠体重20 g计算相当于每千克体重20 mL),连续灌胃14 d,观察小鼠是否有中毒和死亡现象。注菌液使用0.85%生理盐水制成含量为1×109 CFU/mL的凝结魏茨曼氏菌悬液[19]。
1.3 数据处理
所有检测实验均重复3次,结果均以平均值±标准差表示。原始数据用Excel 2010整理后采用统计学软件SPSS statistics 21.0进行差异显著性分析,比较实验中不同处理间差异。P<0.05认为有统计学意义。
2. 结果与分析
2.1 菌株筛选与鉴定
2.1.1 菌株的形态学特征及鉴定结果
对获取的10份仔猪粪便样品进行热处理,并利用菌株的耐高温特性获取芽孢杆菌4株,经鉴定分别为凝结魏茨曼氏菌、枯草芽孢杆菌、地衣芽孢杆菌、解淀粉芽孢杆菌,具体结果见表1和图1。
表 1 不同芽孢杆菌菌落形态Table 1. Morphological characteristies of different Bacillus菌株 菌落大小(mm) 菌落
颜色菌落
边缘光滑
度湿润
度凝结魏茨曼氏菌
(Weizmannia coagulans)2~4 米白色 整齐 光滑 湿润 枯草芽孢杆菌
(Bacillus subtilis)1~3 灰白色 不规则 褶皱 干燥 地衣芽孢杆菌
(Bacillus licheniformis)1~3 粉色 整齐 磨砂 湿润 解淀粉芽孢杆菌
(Bacillus amyloliquefaciens)1~5 白色 不规则 褶皱 干燥 2.1.2 形态特征观察
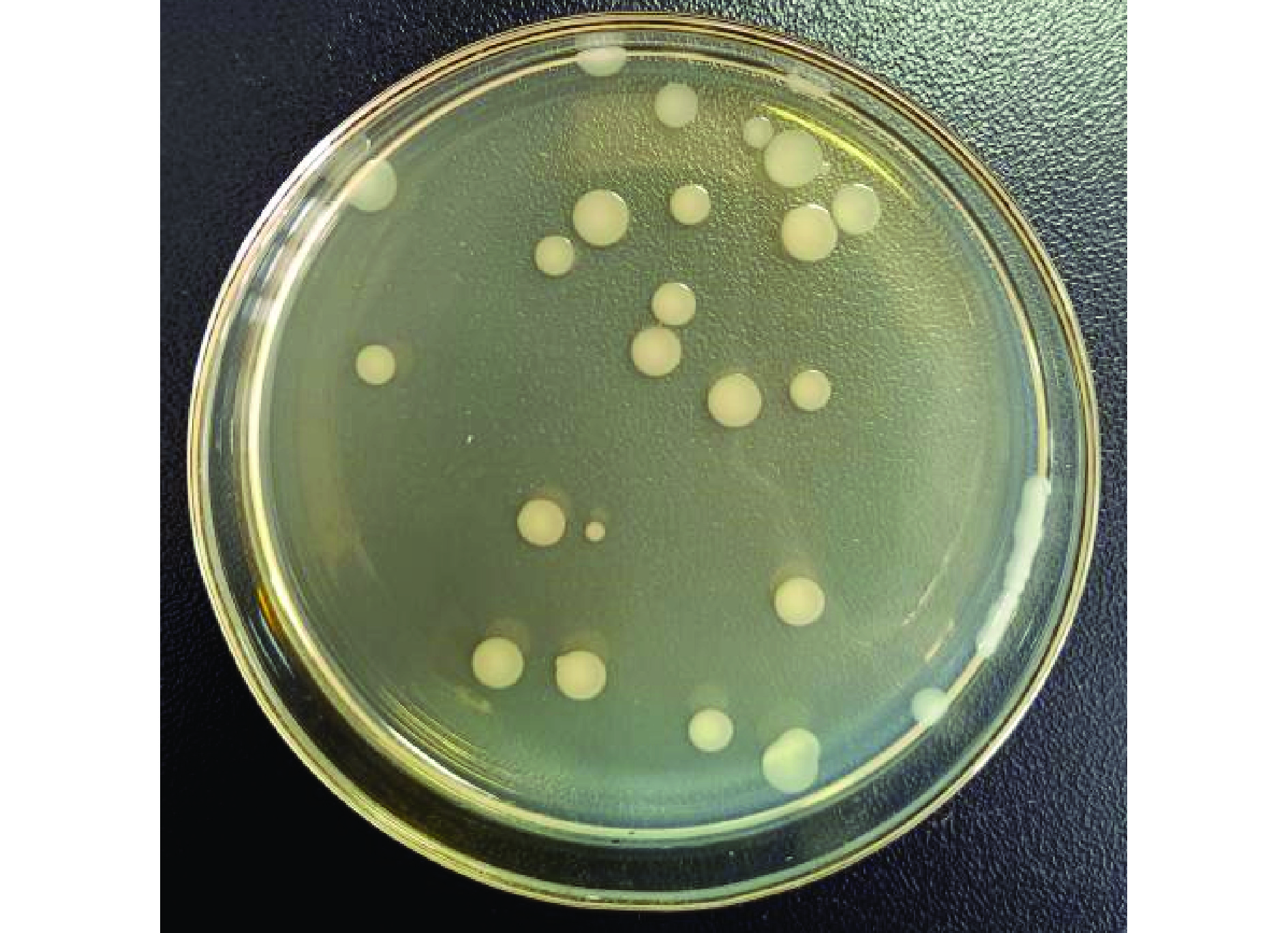
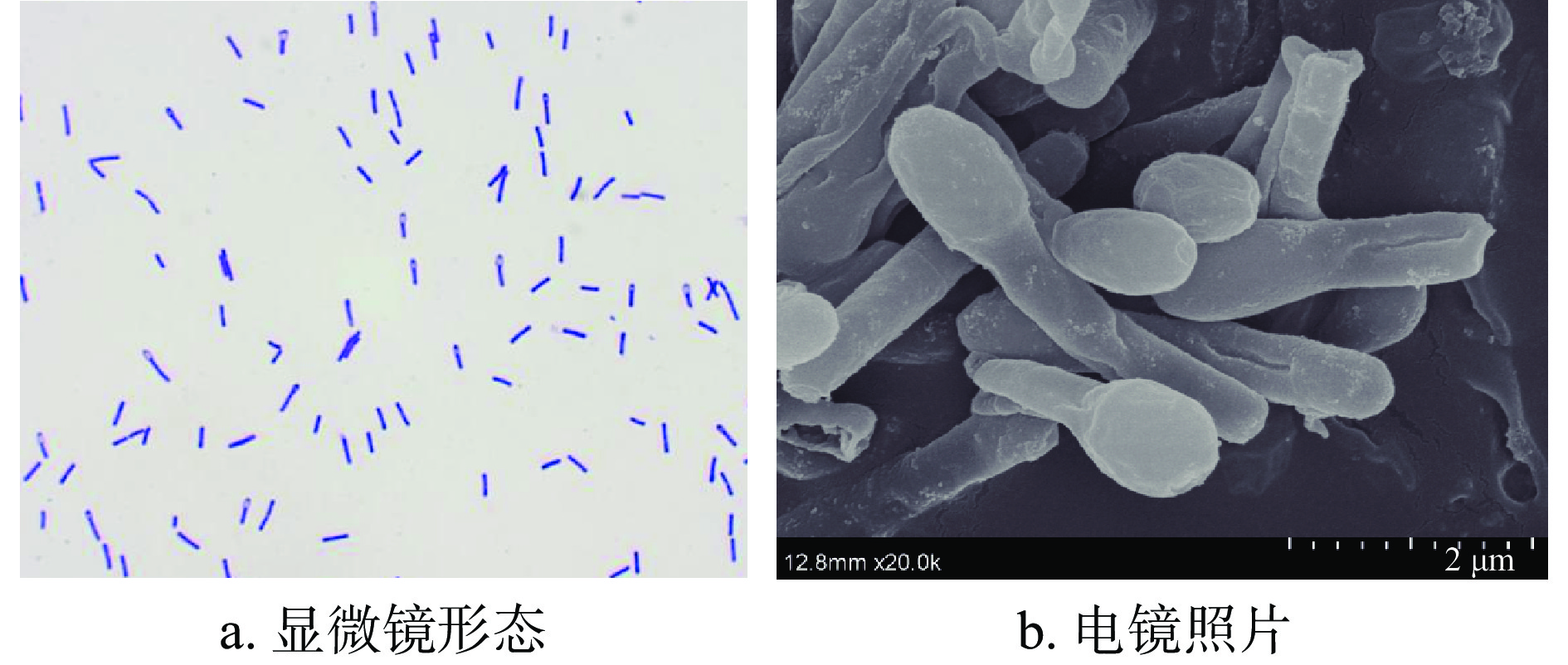
将获得的凝结魏茨曼氏菌在PCA平板上进行稀释涂布,得到纯化后的菌株并编号为BC66,菌落形态如图2所示。对菌落进行革兰氏染色在光学显微镜下观察细胞形态特征,10×100光学显微镜观察菌体形态呈杆状,芽孢端生。20000倍扫描电镜状态下观察,芽孢一端膨大,呈鼓槌状。菌株个体形态如图3所示。
2.1.3 16S rDNA序列分析及系统发育树构建
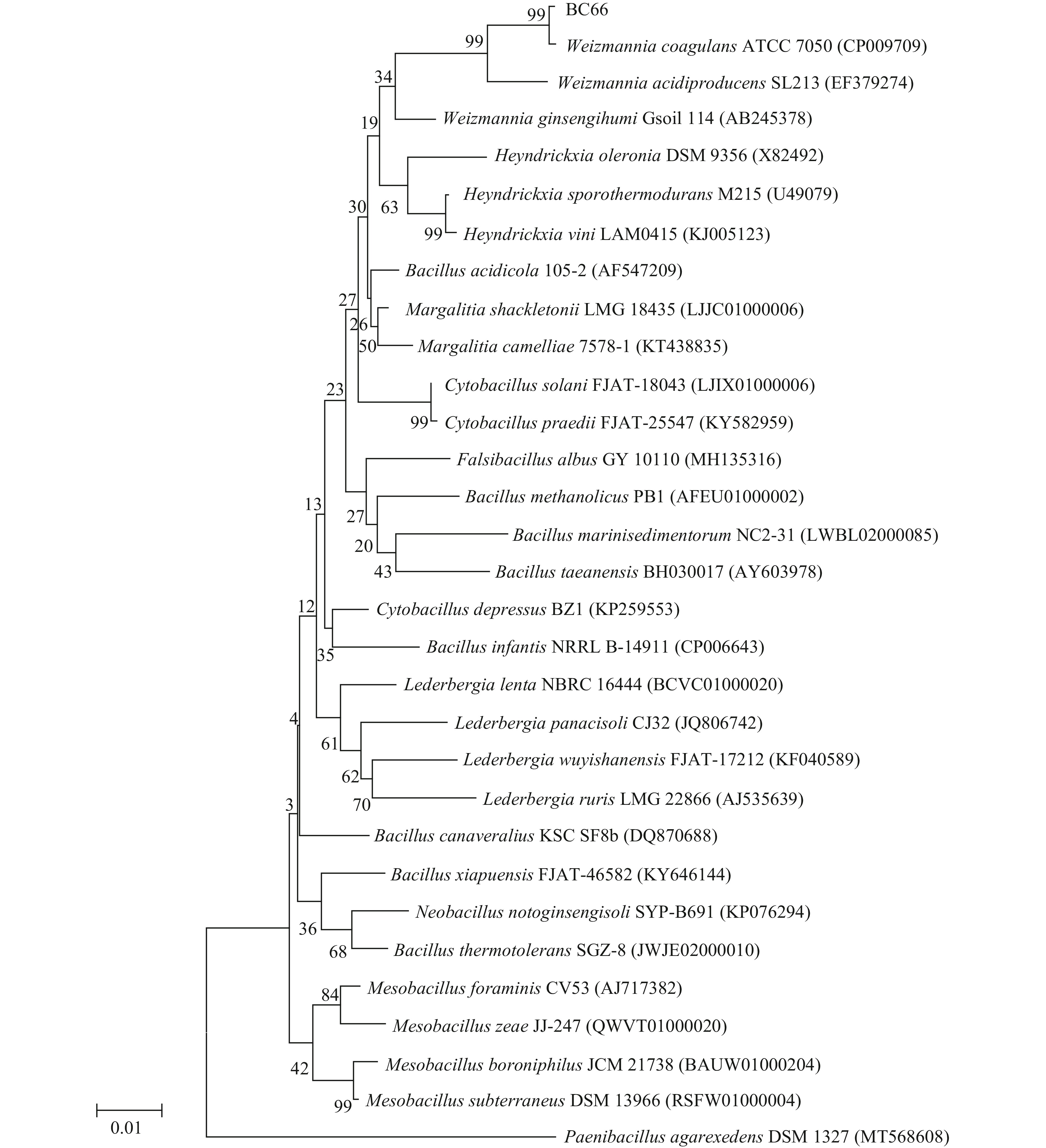
使用通用引物对BC66进行PCR扩增,PCR 产物通过凝胶电泳检测后,产物送往武汉金开瑞生物工程有限公司测序。将测得基因序列提交至NCBI数据库中进行BLAST分析比对,通过比对确定菌株BC66为凝结魏茨曼氏菌(Weizmannia coagulans),曾用名为凝结芽孢杆菌(Bacillus coagulans)。比较分析同源性较高的序列,构建出凝结魏茨曼氏菌的系统发育树,见图4。以Paenibacillus agarexedens DSM 1327(MT568608)为外枝构建的Neighbor-Joining系统发育树,BC66与凝结魏茨曼氏菌标准菌株ATCC7050的16S rDNA序列同源性99.68%,使用MEGA Ⅹ 对菌株与其他菌株进行16S rDNA序列一起构建遗传进化树,可以看到BC66与凝结魏茨曼氏菌标准菌株亲缘关系较近,处于同一分支。
2.1.4 生理生化实验
生理生化指标是进行细菌分类的重要依据,BC66菌株主要依据《伯杰细菌鉴定手册》[20]的分类原则进行,菌株的生理生化特征如表2所示。
表 2 BC66的生理生化特征Table 2. Physiological and biochemical characteristics of BC66生理生化特征 检测结果 邻硝基苯−半乳糖苷 + 精氨酸 − 赖氨酸 − 鸟氨酸 − 柠檬酸钠 − H2S产生 − 尿酶 − 吲哚产生 − 丙酮酸盐 + Kohn明胶 − 葡萄糖 + 果糖 + 甘露糖 + 山梨糖 − 鼠李糖 − 卫茅醇 − 肌醇 − 甘露醇 + 山梨醇 − 注:“+”:表示阳性;“−”:表示阴性。 从表2可以看出菌株BC66能利用葡萄糖产酸,尿酶反应阴性,不产H2S,吲哚实验阴性。
2.2 生长特性初步探究
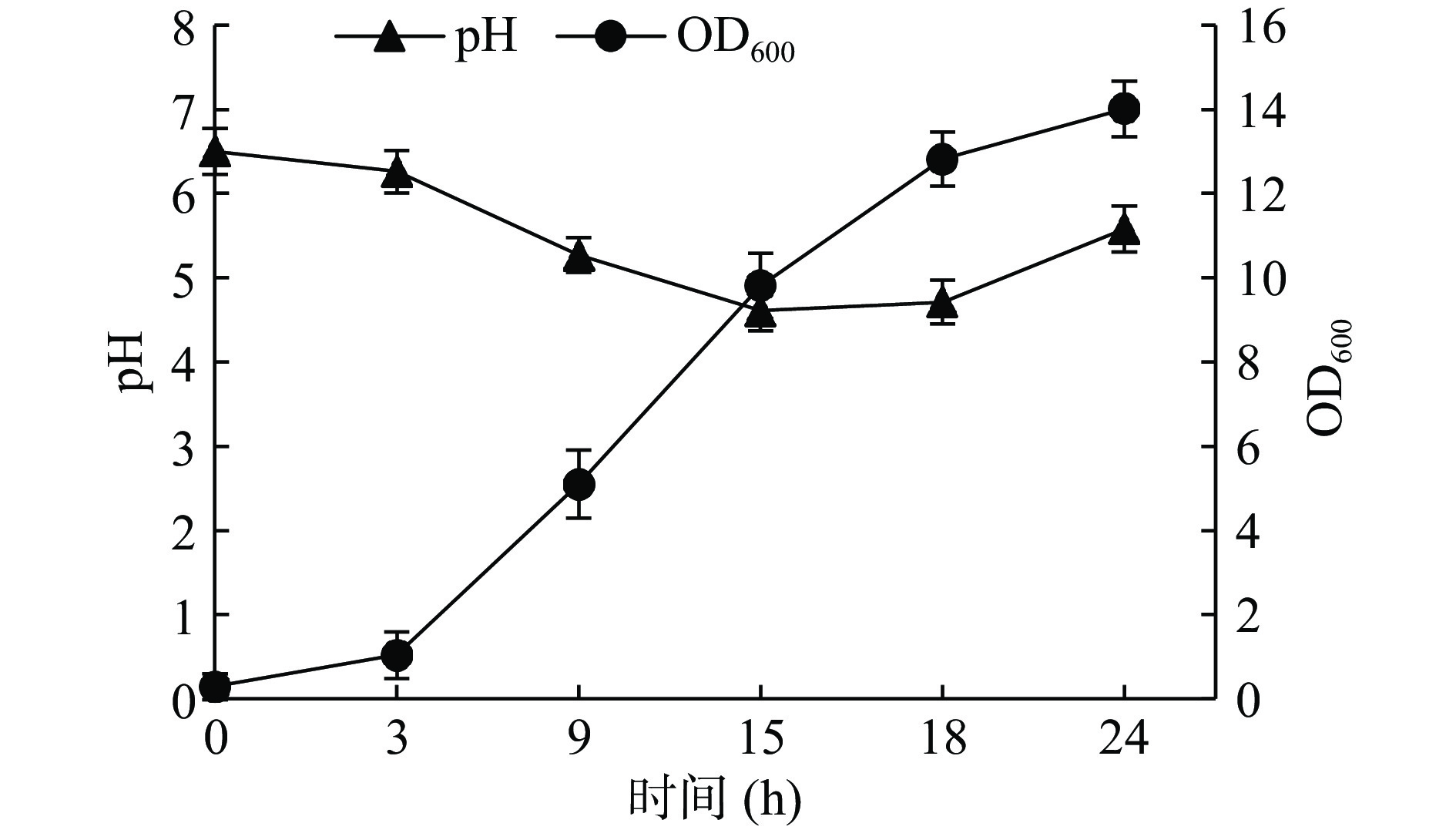
将筛选到的BC66菌株进行初步的生长特性研究,分别在0、3、9、15、18及24 h取样测定OD值和pH,观察菌株培养24 h的生长特性。
微生物的生长繁殖分为4个时期,分别为停滞期、对数期、稳定期、衰亡期[21],从图5可以看出,活化后的菌株转入到新鲜培养基后停滞期较短,18 h达到对数生长末期,之后进入稳定期。从pH变化曲线来看,菌株BC66的发酵液pH在15 h达到最低点4.61,辛国芹等[10]研究发现,凝结魏茨曼氏菌在代谢中产生有机酸,主要为乳酸和乙酸。乳酸和乙酸对于提高饲料消化率,降低胃部及后肠道pH,抑制有害菌及腐败菌的生长繁殖,维持肠道有益微生物的生长,同时抑制肠道致病菌,改善肠道环境具有重要作用[22]。
2.3 抗逆性研究
2.3.1 耐酸特性
菌株的耐酸特征决定其通过胃液在肠道中的存活能力。正常情况下,胃酸 pH2.0~3.0,食物通过胃排空时间一般在2~4 h[23]。实验研究了菌株在pH3.0酸性条件下的存活情况。图6显示了不同耐受时间凝结魏茨曼氏菌BC66菌株生长情况。结果表明,该菌株在pH3.0的模拟胃液中处理2 h时,菌株存活率可达98%;处理4 h时,菌株存活率还保持在60%以上。说明菌株BC66具有较强的耐酸能力,在通过胃液时,能有足够数量的活菌在胃肠道中发挥益生作用。
2.3.2 耐胆盐特性
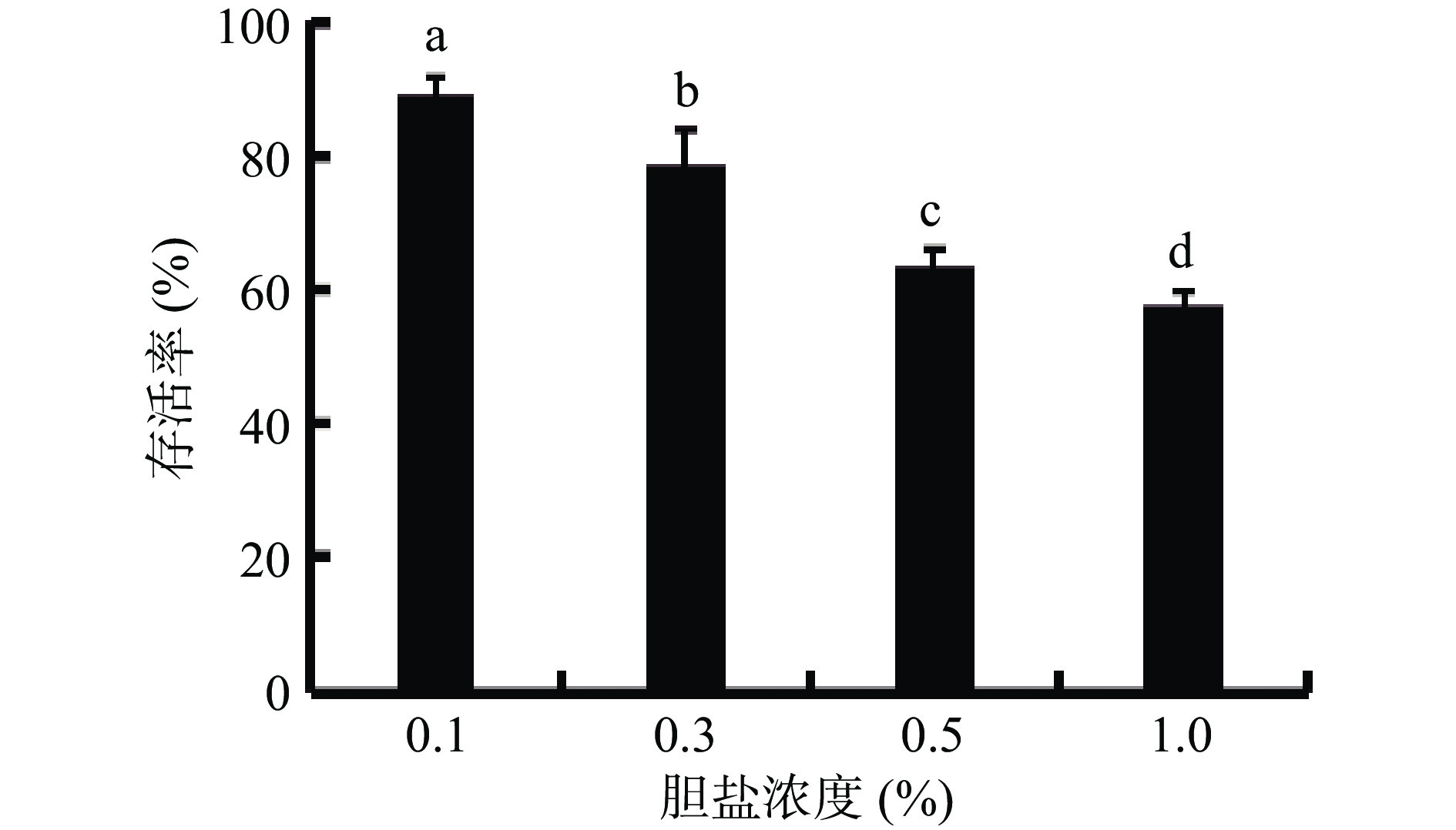
胆盐是肠道中参与机体营养消化和吸收的主要成分。益生菌在肠道中存活和定殖,必须能对小肠中的胆汁有抗性。肠道中的胆盐浓度不是固定不变的,胆盐浓度主要在0.03%~0.3%范围内波动[24]。若菌株在该条件下能存活才有可能正常生长代谢[25],菌株耐胆盐的特性决定了其在肠道中的存活能力。实验研究了菌株对不同浓度胆盐的耐受能力,实验结果如图7所示,在0.3%胆盐浓度下,菌株存活率为79%,在0.5%胆盐浓度下其存活率保持在63%。说明菌株BC66具有较好的胆盐耐受性,能在肠道中生长,并发挥益生作用。
![]() 图 7 BC66在不同胆盐浓度中存活情况注:图中不同小写字母表示差异显著(P<0.05),图8同。Figure 7. Survival of BC66 in different bile salt concentrations
图 7 BC66在不同胆盐浓度中存活情况注:图中不同小写字母表示差异显著(P<0.05),图8同。Figure 7. Survival of BC66 in different bile salt concentrations2.3.3 耐高温实验
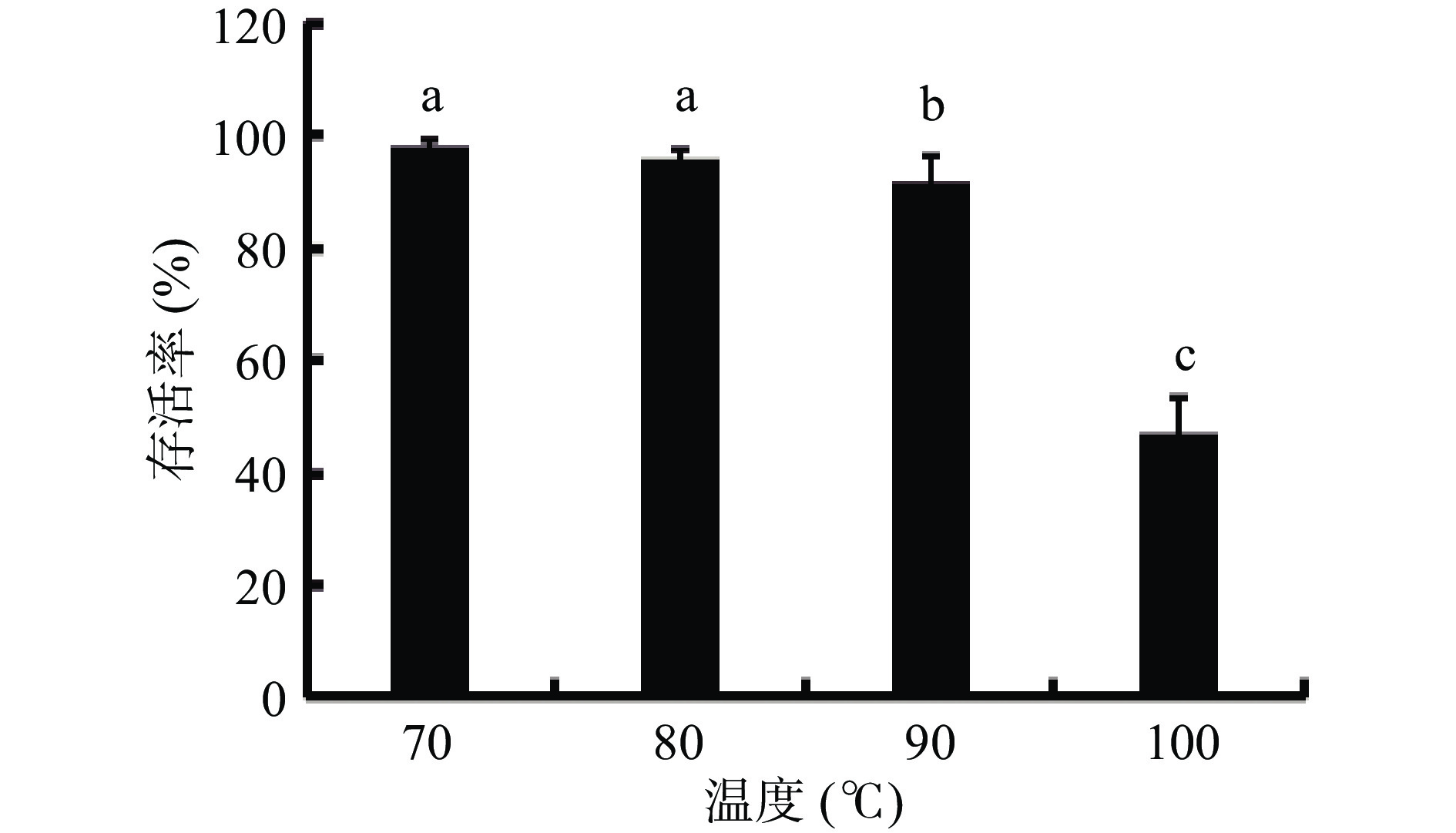
高温在实际生产中会影响产品的活性,同时也是影响产品稳定性的重要因素,凝结魏茨曼氏菌由于其芽孢具有良好的抗逆性,能耐受工业生产中的高温高压等不利环境[26],本研究对BC66的耐高温特性进行考查,将芽孢菌悬液分别置于不同温度水浴中处理10 min后,进行梯度稀释活菌计数,结果见图8,水浴温度90 ℃处理10 min菌体存活率达到92%,水浴温度为100 ℃时,菌体存活率还保持约50%,金迅等[27]研究显示凝结魏茨曼氏菌13002在80 ℃条件下存活率可达到72%,远低于本研究中的80 ℃高温处理后的存活率96%,表明凝结魏茨曼氏菌BC66具有较强的耐高温特性,在益生菌产品加工应用领域具有更大的多样性[28]。
2.4 体外抑菌实验
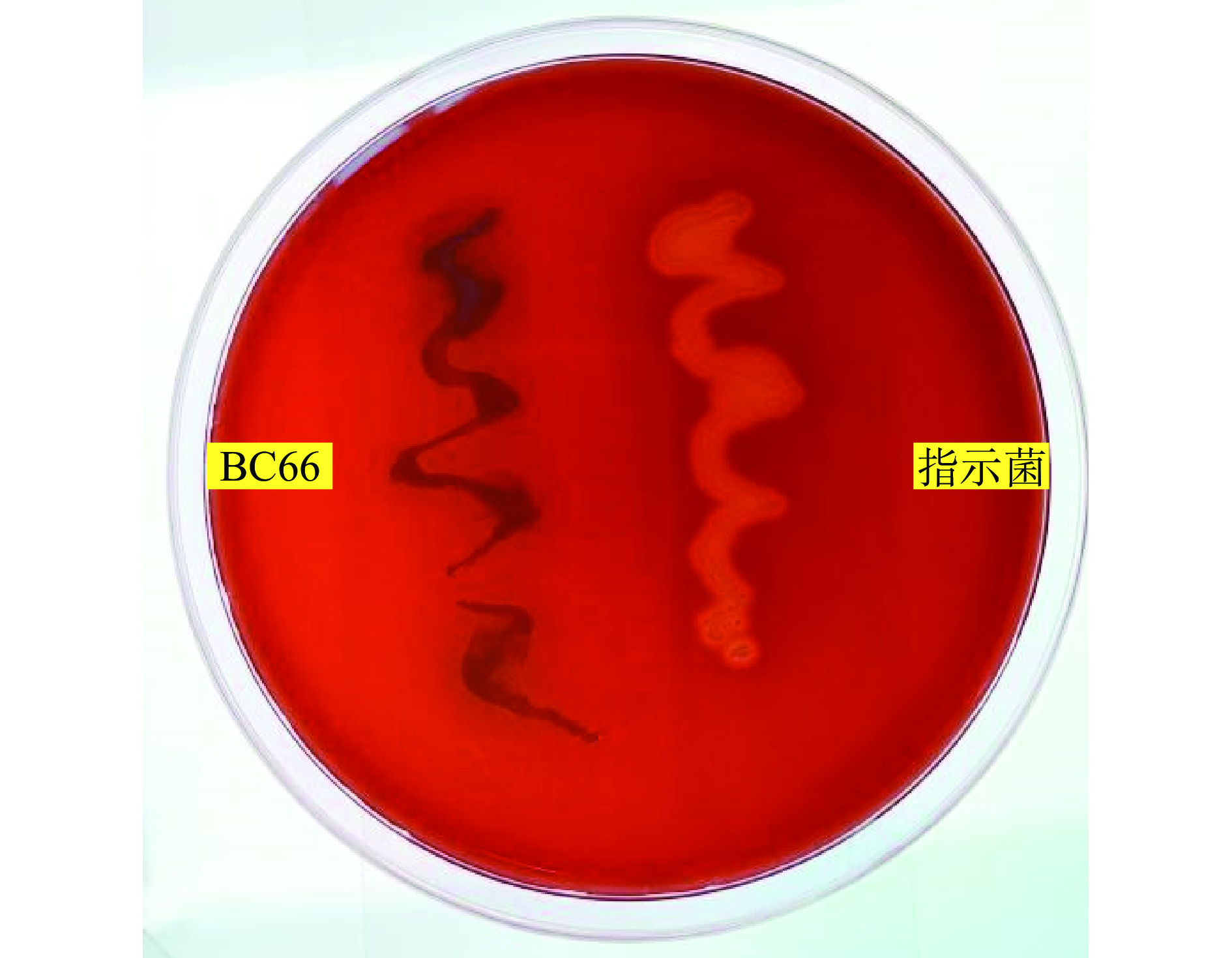
有动物饲养试验显示,饲料中添加凝结魏茨曼氏菌能抑制大肠杆菌、沙门氏菌等肠道主要有害菌,显著改善畜禽生长性能[29-31],本研究对凝结魏茨曼氏菌进行常见病原菌体外抑菌实验,结果见表3,菌株BC66对大肠杆菌,金黄色葡萄球菌,肠炎沙门氏菌,福氏志贺氏菌均表现出不同程度的抑菌能力,与陈宇等[32]报道一致,凝结魏茨曼氏菌可分泌多种凝固素、双乙酰、L-乳酸等抑菌物质,能抑制肠道内大肠杆菌、沙门氏菌、志贺氏菌、变形杆菌等有害菌。
表 3 BC66抑制病原菌作用Table 3. Antigonistic acticity of BC66指示菌 抑菌圈直径(mm) 大肠杆菌(Escherichia coli)ATCC25922 23.13±0.11 金黄色葡萄球菌(Staphyloccocus aureus)ATCC25922 18.64±0.22 肠炎沙门氏菌(Salmonella enteritidis)ATCC14028 23.57±0.12 福氏志贺氏菌(Shigella flexneri)ATCC12022 20.72±0.48 2.5 BC66与其他乳酸菌的拮抗关系
凝结魏茨曼氏菌对肠道有害菌及饲料源有害菌[33]抑制作用的研究较多,对多种商业饲用益生菌的研究报道较少,考虑到商业复合饲用益生菌在凝结魏茨曼氏菌与其他饲用益生菌菌株之间可能的拮抗效应[34],本研究初步考查了BC66和干酪乳杆菌W189、嗜酸乳杆菌W211、乳酸片球菌W172、屎肠球菌W362、粪肠球菌W471的拮抗作用,结果如图9所示,横向划线的菌株为BC66,纵向划线的菌株为不同的益生菌,从图中可以看出BC66与干酪乳杆菌W189、嗜酸乳杆菌W211、乳酸片球菌W172不存在拮抗关系,和粪肠球菌W471、屎肠球菌W362存在较弱拮抗作用。
2.6 安全性评价
2.6.1 溶血性实验
如图10所示,BC66周围未出现透明溶血圈,而作为阳性质控菌株的化脓性链球菌在血琼脂平板上出现了透明的溶血圈,表明凝结魏茨曼氏菌BC66没有溶血活性。
2.6.2 抗生素敏感性评价
抗生素敏感性实验是考察益生菌安全性的重要检查指标,如果菌体对抗生素敏感,说明细菌细胞中不存在抵抗这种抗生素的基因。参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)抗微生物药物敏感实验执行标准[35],对15种抗生素进行了耐抗生素的敏感性实验研究,由表4可知,凝结魏茨曼氏菌BC66对15种抗生素均处于敏感状态,此菌株不具有耐药性,可认为是安全菌株。
表 4 BC66对常用抗生素的敏感程度Table 4. The antibiotic susceptibility of BC66药敏纸片 BC66 抑菌圈直径(mm) 敏感程度 青霉素 36.1 敏感 链霉素 21.2 敏感 多粘菌素B 19.2 敏感 甲氧嘧啶 24.3 敏感 四环素 36.4 敏感 庆大霉素 25.7 敏感 头孢曲松钠(菌必治) 29.2 敏感 克林霉素 36.1 敏感 氯霉素 28.3 敏感 卡那霉素 25.2 敏感 红霉素 31.3 敏感 万古霉素 24.2 敏感 新霉素 26.3 敏感 环丙沙星 24.2 敏感 利福平 23.5 敏感 2.6.3 急性毒性实验
观察饲喂后的小鼠活力情况,所有小鼠生命体征活跃,未见不良反应,均未出现中毒和死亡现象,说明菌株BC66在GB15193.9-2014推荐剂量下进行急性毒性实验无显性致死作用。此外,毒理学实验和大量临床观察表明凝结魏茨曼氏菌是安全菌种,没有致突变性、致畸性和遗传毒性[36]。
3. 结论
本研究从健康仔猪粪便中分离筛选到一株耐高温,产乳酸的凝结魏茨曼氏菌BC66,并对其作为益生菌的潜力和安全性进行了初步研究和评价。结果表明该菌株在胃肠道苛刻条件(pH3.0; 胆盐 0.3%)下具有较强的生存能力,表现出良好的抗病原菌活性和抗生素敏感性,且没有溶血活性。此外,该菌株产生抗逆性很强的芽孢,在90 ℃下处理10 min还能保持较高的活性,能够抵御高温食品和饲料生产的工业化过程,可作为潜在的益生菌产品应用于食品、饲料等领域。综上所述,本研究从自然界分离到的新菌株凝结魏茨曼氏菌BC66具有在饲料工业中应用的明显优势和潜力。然而,进一步的体内实验和相关基因功能分析仍然需要开展,以期对该菌株的优良性状进行全面评价,为芽孢益生菌的开发应用奠定理论基础。
-
图 7 BC66在不同胆盐浓度中存活情况
注:图中不同小写字母表示差异显著(P<0.05),图8同。
Figure 7. Survival of BC66 in different bile salt concentrations
表 1 不同芽孢杆菌菌落形态
Table 1 Morphological characteristies of different Bacillus
菌株 菌落大小(mm) 菌落
颜色菌落
边缘光滑
度湿润
度凝结魏茨曼氏菌
(Weizmannia coagulans)2~4 米白色 整齐 光滑 湿润 枯草芽孢杆菌
(Bacillus subtilis)1~3 灰白色 不规则 褶皱 干燥 地衣芽孢杆菌
(Bacillus licheniformis)1~3 粉色 整齐 磨砂 湿润 解淀粉芽孢杆菌
(Bacillus amyloliquefaciens)1~5 白色 不规则 褶皱 干燥 表 2 BC66的生理生化特征
Table 2 Physiological and biochemical characteristics of BC66
生理生化特征 检测结果 邻硝基苯−半乳糖苷 + 精氨酸 − 赖氨酸 − 鸟氨酸 − 柠檬酸钠 − H2S产生 − 尿酶 − 吲哚产生 − 丙酮酸盐 + Kohn明胶 − 葡萄糖 + 果糖 + 甘露糖 + 山梨糖 − 鼠李糖 − 卫茅醇 − 肌醇 − 甘露醇 + 山梨醇 − 注:“+”:表示阳性;“−”:表示阴性。 表 3 BC66抑制病原菌作用
Table 3 Antigonistic acticity of BC66
指示菌 抑菌圈直径(mm) 大肠杆菌(Escherichia coli)ATCC25922 23.13±0.11 金黄色葡萄球菌(Staphyloccocus aureus)ATCC25922 18.64±0.22 肠炎沙门氏菌(Salmonella enteritidis)ATCC14028 23.57±0.12 福氏志贺氏菌(Shigella flexneri)ATCC12022 20.72±0.48 表 4 BC66对常用抗生素的敏感程度
Table 4 The antibiotic susceptibility of BC66
药敏纸片 BC66 抑菌圈直径(mm) 敏感程度 青霉素 36.1 敏感 链霉素 21.2 敏感 多粘菌素B 19.2 敏感 甲氧嘧啶 24.3 敏感 四环素 36.4 敏感 庆大霉素 25.7 敏感 头孢曲松钠(菌必治) 29.2 敏感 克林霉素 36.1 敏感 氯霉素 28.3 敏感 卡那霉素 25.2 敏感 红霉素 31.3 敏感 万古霉素 24.2 敏感 新霉素 26.3 敏感 环丙沙星 24.2 敏感 利福平 23.5 敏感 -
[1] HAMMER B W. Bacteriological studies on the coagulation of evaporated milk[J]. Iowa Agriculture Experiment Station Research Bulletin,1915(19):119−132.
[2] NYANGALE E, FARMER S, CASH H, et al. Bacillus coagulans GBI-30, 6086 modulates Faecalibacterium prausnitzii in older men and women[J]. The Journal of Nutrition,2015,145(7):1446−1452. doi: 10.3945/jn.114.199802
[3] 陈秀秀, 孙洪浩, 孙小涵, 等. 一株凝结芽孢杆菌的分离鉴定及益生性分析[J]. 饲料博览,2020(11):1−5. [CHEN X X, SUN H H, SUN X H, et al. Analysis of probiotic and isolation, identification of Bacillus coagulans[J]. Feed Review,2020(11):1−5. CHEN X X, SUN H H, SUN X H, et al. Analysis of probiotic and isolation, identification of Bacillus coagulans[J]. Feed Review, 2020(11): 1-5.
[4] ZHOU Y H, ZENG Z H, XU Y B, et al. Application of Bacillus coagulans in animal husbandry and its underlying mechanisms[J]. Animals,2020,10(3):454. doi: 10.3390/ani10030454
[5] JAMES G, DAS B, JOSE S, et al. Bacillus as an aquaculture friendly microbe[J]. Aquaculture International,2021,29:323−353. doi: 10.1007/s10499-020-00630-0
[6] SAXENA A K, KUMAR M, CHAKDAR H, et al. Bacillus species in soil as a natural resource for plant health and nutrition[J]. Journal of Applied Microbiology,2019,128:1583−1594.
[7] WANG J, ZHAO L. Study on the application of Bacillus coagulans to purify aquaculture water[J]. Advanced Materials Research,2012,343-344:988−993.
[8] 刘彬, 粟胜兰, 张雅惠, 等. 饲用凝结芽孢杆菌的菌种特性及作用机制[J]. 饲料工业,2022,43(5):40−44. [LIU B, LI S L, ZHANG Y H, et al. Strain property and action mechanism of Bacillus coagulans in feed[J]. Feed Industry,2022,43(5):40−44. LIU B, LI S L, ZHANG Y H, et al. Strain property and action mechanism of Bacillus coagulans in feed[J]. Feed Industry, 2022, 43(5): 40-44.
[9] 苗华彪, 李正洲, 赵元昊, 等. 凝结芽孢杆菌在生猪养殖中的应用及其作用机理的研究进展[J]. 中国畜牧兽医,2020,47(8):2433−2444. [MIAO H B, LI Z Z, ZHAO Y H, et al. Advance on the application and mechanism of Bacillus coagulans in pig breeding[J]. China Animal Husbandry and Veterinary Medicine,2020,47(8):2433−2444. MIAO H B, LI Z Z, ZHAO Y H, et al. Advance on the application and mechanism of Bacillus coagulans in pig breeding[J]. China Animal Husbandry and Veterinary Medicine, 2020, 47(8): 2433-2444.
[10] 辛国芹, 汪祥燕, 曹斌, 等. 一株产酸凝结芽孢杆菌的筛选及耐受特性研究[J]. 中国酿造,2022,41(4):111−115. [XIN G Q, WANG X Y, CAO B, et al. Screening and tolerance property of an acid-producing Bacillus coagulans[J]. China Brewing,2022,41(4):111−115. XIN G Q, WANG X Y, CAO B, et al. Screening and tolerance property of an acid-producing Bacillus coagulans[J]. China Brewing, 2022, 41(4): 111-115.
[11] 胡鹏钰, 于俊娟, 王鹏, 等. 母乳来源益生菌的筛选及潜在益生特性研究[J]. 食品与发酵工业,2021,47(14):190−195. [HU P Y, YU J J, WANG P, et al. Screening of probiotics from breast milk and its potential probiotic characteristics[J]. Food and Fermentation Industries,2021,47(14):190−195. HU P Y, YU J J, WANG P, et al. Screening of probiotics from breast milk and its potential probiotic characteristics[J]. Food and Fermentation Industries, 2021, 47(14): 190-195.
[12] 吴丹阳. 凝结芽孢杆菌T242益生性及功能特性的研究[D]. 大连: 大连工业大学, 2016. WU D Y. Study on probiotic properties and functionality of Bacillus coagulans T242[D]. Dalian: Dalian Polytechnic University, 2016.
[13] 方曙光, 孔素芬, 刘建明. 一种凝结芽孢杆菌菌粉芽孢的检测方法: 中国, 202010644874.6[P]. 2020-10-30. FANG S G, KONG S F, LIU J M. A method for detecting Bacillus coagulans powder spores: China, 202010644874.6[P]. 2020-10-30.
[14] 董文豪, 宫晓炜, 郑福英, 等. 猪源地衣芽孢杆菌的分离筛选及其特性[J]. 甘肃农业大学学报,2021(5):8−11. [DONG W H, GONG X W, ZHENG F Y, et al. Isolation, screening and biological characteristics of Bacillus licheniformis from pigs[J]. Journal of Gansu Agricultural University,2021(5):8−11. DONG W H, GONG X W, ZHENG F Y, et al. Isolation, screening and biological characteristics of Bacillus licheniformis from pigs[J]. Journal of Gansu Agricultural University, 2021(5): 8-11.
[15] CHIDRE P, REVANASIDDAPPA K C, et al. Probiotic potential of Lactobacilli with antagonistic activity against pathogenic strains: An in vitro validation for the production of inhibitory substances[J]. Biomedical Journal,2017,40(5):270−283. doi: 10.1016/j.bj.2017.06.008
[16] 徐秀伟. 饲用抑菌活性乳酸菌共培养筛选、优化及抗性分析[D]. 合肥: 安徽农业大学, 2016. XU X W. Screening and optimization of fodder antibacterial lactic acid bacteria co-culture and resistance analysis[D]. Hefei: Anhui Agricultural University, 2016.
[17] HALDER D, MANDA M, CHATTERJEE S S, et al. Indigenous probiotic lactobacillus isolates presenting antibiotic like activity against human pathogenic bacteria[J]. Biomedicines,2017,5(31):1−11.
[18] 余祖玲, 余祖华, 贾艳艳, 等. 降解纤维素凝结芽孢杆菌的分离鉴定及生物学特性研究[J]. 河南科技大学学报,2022,43(5):84−91, 99. [YU Z L, YU Z H, JIA Y Y, et al. Isolation, identificationand biological characteristic of acellulase-producing Bacillus coagulans[J]. Journal of Henan University of Science and Technology (Natural Science),2022,43(5):84−91, 99. YU Z L, YU Z H, JIA Y Y, et al. Isolation, identificationand biological characteristic of acellulase-producing Bacillus coagulans[J]. Journal of Henan University of Science and Technology (Natural Science), 2022, 43(5): 84-91, 99.
[19] 严涛, 朱建国, 姜甜, 等. 一株凝结芽孢杆菌的分离筛选及产孢条件优化[J]. 微生物学通报,2018,45(2):238−249. [YAN T, ZHU J G, JIANG T, et al. Isolation and optimization on spore-forming conditions of Bacillus coagulans[J]. Microbiology China,2018,45(2):238−249. YAN T, ZHU J G, JIANG T, et al. Isolation and optimization on spore-forming conditions of Bacillus coagulans[J]. Microbiology China, 2018, 45(2): 238-249.
[20] 布坎南. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译. 北京: 科学出版社, 1984: 744−745. BUCHANAN. Berger bacterial identification manual[M]. Translation Group of "Berger Bacterial Identification Manual", Institute of Microbiology, Chinese Academy of Sciences, trans. Beijing: Science Press, 1984: 744−745.
[21] 余培斌, 杜晶, 陈建新, 等. 高温好氧堆肥过程中芽孢杆菌的筛选、鉴定及应用[J]. 食品与发酵工业,2020,46(12):199−205, 212. [YU P B, DU J, CHEN J X, et al. Study on screening and identificotion of Bacillus in the process of high-temperature aerobic composting and its application[J]. Food and Fermentation Industries,2020,46(12):199−205, 212. YU P B, DU J, CHEN J X, et al. Study on screening and identificotion of Bacillus in the process of high-temperature aerobic composting and its application[J]. Food and Fermentation Industries , 2020 , 46(12): 199– 205, 212.
[22] 柯轲, 方端, 高福, 等. 凝结芽孢杆菌生物学特性、益生机制及其生物学功能[J]. 畜禽业,2021(4):6−9. [KE K, FANG D, GAO F, et al. Biological characteristics, probiotic mechanism and biological functions of Bacillus coagulans[J]. Livestock and Poultry Industry,2021(4):6−9. KE K, FANG D, GAO F, et al. Biological characteristics, probiotic mechanism and biological functions of Bacillus coagulans[J]. Livestock and Poultry Industry, 2021(4): 6-9.
[23] SNOEDK V, COX E, VERDONCK F, et al. Influence of porcine intestinal pH and gastric digestion on antigenicity of F4 fimbriae for oral immunization[J]. Veterinary Microbiology,2004,98(1):45−53. doi: 10.1016/j.vetmic.2003.10.020
[24] HYRONIMUS B, LE M C, HADJ S A, et al. Acid and bile tolerance of spore-forming lactic acid bacteria[J]. International Journal of Food Microbiology,2000(61):193−197.
[25] 高盛, 乔宇, 张宇微, 等. 人母乳源乳酸菌的筛选、鉴定及益生活性的初步研究[J]. 食品工业科技,2017(10):205−210. [GAO S, QIAO Y, ZHANG Y W, et al. Isolation, identification and probiotic characterization of latic acid bacteria in human breast milk[J]. Science and Technology of Food Industry,2017(10):205−210. GAO S, QIAO Y, ZHANG Y W, et al. Isolation, identification and probiotic characterization of latic acid bacteria in human breast milk[J]. Science and Technology of Food Industry, 2017(10): 205-210.
[26] 涂家霖, 赵珊, 周钦育, 等. 凝结芽孢杆菌13002产芽孢条件优化[J]. 食品工业科技,2021,42(6):88−96, 102. [TU J L, ZHAO S, ZHOU Q Y, et al. Optimizing spore-forming conditions of Bacillus coagulans 13002[J]. Science and Technology of Food Industry,2021,42(6):88−96, 102. TU J L, ZHAO S, ZHOU Q Y, et al. Optimizing spore-forming conditions of Bacillus coagulans 13002[J]. Science and Technology of Food Industry, 2021, 42(6): 88-96, 102.
[27] 金迅, 刘冬梅, 阮晖, 等. 凝结芽孢杆菌13002的益生特性[J]. 食品工业与科技,2018,39(6):97−101. [JIN X, LIU D M, RUAN H, et al. Probiotic properties of Bacillus coagulans 13002[J]. Science and Technology of Food Industry,2018,39(6):97−101. JIN X, LIU D M, RUAN H, et al. Probiotic properties of Bacillus coagulans 13002[J]. Science and Technology of Food Industry, 2018, 39(6): 97-101.
[28] GöZDE K, ZERRIN E. Potential use of Bacillus coagulans in the food industry[J]. Foods,2018,7(92):1−10.
[29] 黄遵锡, 程志斌. 饲粮添加凝结芽孢杆菌与枯草芽孢杆菌对断奶仔猪生长性能的影响[J]. 饲料工业,2017,38(21):1−6. [HUANG Z X, CHENG Z B. Effects of Bacillus coagulans and Bacillus subtilis on the growth performance in weaned piglets[J]. Feed Industry,2017,38(21):1−6. HUANG Z X, CHENG Z B. Effects of Bacillus coagulans and Bacillus subtilis on the growth performance in weaned piglets[J]. Feed Industry, 2017, 38(21): 1-6.
[30] ZHEN W, SHAO Y, GONG X, et al. Effect of dietary Bacillus coagulans supplementation on growth performance and immune responses of broiler chickens challenged by Salmonella enteritidis[J]. Poult Sci,2018,97(8):2654−2666. doi: 10.3382/ps/pey119
[31] 黄遵锡, 程志斌. 饲粮不同添加量的凝结芽孢杆菌对仔猪生长性能及肠道健康的影响[J]. 饲料工业,2020,41(15):1−7. [HUANG Z X, CHENG Z B. Effects of dietary supplementation of probiotic Bacillus coagulans at various dosages on the growth performance and gut health in weanling piglets[J]. Feed Industry,2020,41(15):1−7. HUANG Z X, CHENG Z B. Effects of dietary supplementation of probiotic Bacillus coagulans at various dosages on the growth performance and gut health in weanling piglets[J]. Feed Industry, 2020, 41(15): 1-7.
[32] 陈宇, 刘水灵, 高欢, 等. 凝结芽孢杆菌的生物学特性及其在畜禽生产中的应用[J]. 当代畜牧,2020(5):6−9. [CHEN Y, LIU S L, GAO H, et al. Biological characteristics of Bacillus coagulans and its application in livestock production[J]. Contemporary Animal Husbandry,2020(5):6−9. CHEN Y, LIU S L, GAO H, et al. Biological characteristics of Bacillus coagulans and its application in livestock production[J]. Contemporary Animal Husbandry, 2020(5): 6-9.
[33] FU L, WANG C, RUAN X, et al. Preservation of large yellow croaker (Pseudosciaena crocea) by coagulin L1208, a novel bacteriocin produced by Bacillus coagulans L1208[J]. Int J Food Microbiol,2018,266:60−68. doi: 10.1016/j.ijfoodmicro.2017.11.012
[34] 柳成东, 肖明霞, 李琦华, 等. 饲用益生菌凝结芽孢杆菌抑菌性能的研究[J]. 中国畜牧杂志,2021,57(10):236−241. [LIU C D, XIAO M X, LI Q H, et al. Study on the antibacterial activity properties of the feed probiotic Bacillus coagulans[J]. Chinese Journal of Animal Science,2021,57(10):236−241. LIU C D, XIAO M X, LI Q H, et al. Study on the antibacterial activity properties of the feed probiotic Bacillus coagulans[J]. Chinese Journal of Animal Science, 2021, 57(10): 236-241.
[35] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; twenty-second informational supplement[M]. CLSI document M100-S22. Wayne Pennsylvania: Clinical and Laboratory Standards Institute, 2013: 64−65.
[36] MU Y, CONG Y. Bacillus coagulans and its applications in medicine[J]. Beneficial Microbes,2019,10(6):1−10.
-
期刊类型引用(2)
1. 冯明,黄恒,邓福昌,陆俊致,李叶红,梁琼,黄华莉,胡俊杰,蒋慧敏,王金兴,肖鹏,杨小淦,梁兴伟,曾俊. 茉莉花渣对广西黑山羊生长性能及血清生化、抗氧化和免疫指标的影响. 黑龙江畜牧兽医. 2023(10): 109-114 .  百度学术
百度学术
2. 王金兴,黄恒,陆俊致,李叶红,梁琼,黄世洋,黄华莉,曾俊. 茉莉花渣的活性物质、生物学功能及其在畜禽生产中的应用. 饲料研究. 2023(20): 178-181 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:


 下载:
下载:



