Comparative Analysis on Terpenoids of Extraction Process from Stigma Maydis by UPLC Method
-
摘要: 为研究玉米须中萜类成分的提取工艺。本文以玉米须中含有的玉米烯F(1)、3β-羟基-对映-贝壳杉-15-烯-17-酸-18-酯(2)和4α-羟基-19-降-对映贝壳杉烷型-15-烯-17-酸(3)为标准品,建立了玉米须提取物中三种萜类成分含量的测定UPLC分析方法。其色谱条件为:采用Polar C18 100Ȧ(4.6 mm×150 mm,2.6 µm)色谱柱,以甲醇(A)、0.1%磷酸-水溶液(B)为流动相梯度洗脱,流速1.0 mL/min,柱温40 ℃,波长220 nm,进样量5 μL。结果表明,玉米烯F(1)在0.96~192.0 μg/mL范围内,3β-羟基-对映-贝壳杉-15-烯-17-酸-18-酯(2)和4α-羟基-19-降-对映贝壳杉烷型-15-烯-17-酸(3)在5.0~200.0 μg/mL范围内线性关系良好(r>0.9993),定量限(LOQ,S/N=10)均在5.0~10.0 μg/g之间,平均加样回收率为89.1%~105.8%,相对标准偏差(RSD)均小于2%。表明该方法具有较高的准确度和检测灵敏度,能够准确地对玉米须样品中三种萜类成分进行定量分析,为玉米须萜类成分的进一步深化研究提供科学参考。利用该分析方法优化玉米须中三个萜类成分的提取工艺为:采用加热回流提取法,20%甲醇-水溶液作为提取溶剂,料液比为1:25,提取时间1 h。Abstract: An extraction process of terpenoids from stigma maydis was discussed in this paper. Firstly, a UPLC analytical method was established based on the three standard substances tigmene F(1), 3β-hydroxy- ent-kaur-15-en-17-oic acid-18-ester(2), and 4α-hydroxy-19-nor-ent-kaur-15-en-17-oic acid (3) from stigma maydis. The chromatography condition was determined as C18 100Ȧ column (4.6 mm×150 mm, 2.6 µm) eluted with MeOH (A)-0.1% phosphoric acid (B) in gradient with the 1.0 mL/min flow rate. The column temperature was 40 ℃ with a 10 μL injection volume. The detection wavelength was set at 220 nm. Results showed that, three terpenoids had good linearity (r>0.9993) in the concentration range of 0.96~192.0 μg/mL (stigmene F) and 5.0~200.0 μg/mL (3β-hydroxy-ent-kaur-15-en-17-oic acid-18-ester and 4α-hydroxy-19-nor-ent-kaur-15-en-17-oic acid), respectively. They showed the same limits of quantitation (LOQ, S/N=10) ranged from 5.0 μg/g to 10.0 μg/g, similar average recovery rate of 89.1%~105.8%, and with could be used for quantitative analysis and provided research reference for terpenoids in stigma maydis. Finally, guided by the optimized analytical method, the extraction process for the three terpenoids from stigma maydis was determined as follows: The extract solvent was 20% MeOH-H2O, which was 25 times weight of stigma maydis, and with refluxed extraction for 1 h.
-
玉米须(Stigma maydis)为禾本科植物玉米生长过程中的副产物[1],俗称玉麦须,是传统中药材[2],具有保护肠上皮细胞、利尿、抗过敏、抗肥胖、抑制蛋白质排泄、抑制黑色素形成、抑制肝纤维化等作用[3-10],临床上用于治脚气、衄血、乳痈等疾病[11]。同时,玉米须还具有营养保健功能[12-13],可作茶饮,也可用作食品添加剂,改善面条的品质[14]。我国是玉米种植大国,玉米须资源十分丰富。根据相关文献[15-18]可知,玉米须中的萜类化合物具有抑制淀粉蛋白聚集、促进葡萄糖消耗、抗菌以及神经保护等多种生物活性,在食品、药品等领域具有很好的应用开发前景。但由于玉米须中的萜类成分(主要是倍半萜和二萜)的含量较少[17](单个萜类成分占总提取物的质量分数为3.5×10−4~6.4×10−3),提取分离效率低[19-22]、成本高,难以满足更高层次生物活性试验需要,使有关研究受到原料限制。因此,本文以玉米须中相对含量较多的玉米烯F(1)、3β-羟基-对映-贝壳杉-15-烯-17-酸-18-酯(2)和4α-羟基-19-降-对映贝壳杉烷型-15-烯-17-酸(3)为标准品,建立UPLC分析方法,考察使用甲醇或甲醇-水混合溶剂作为提取溶剂,提取方法不同及提取时间对玉米须中萜类成分的提取效果,旨在确定从玉米须中提取富集倍半萜和二萜类成分的提取工艺,为实现更高层次的生物活性实验提供原料,助推玉米须的应用研究。
1. 材料与方法
1.1 材料与仪器
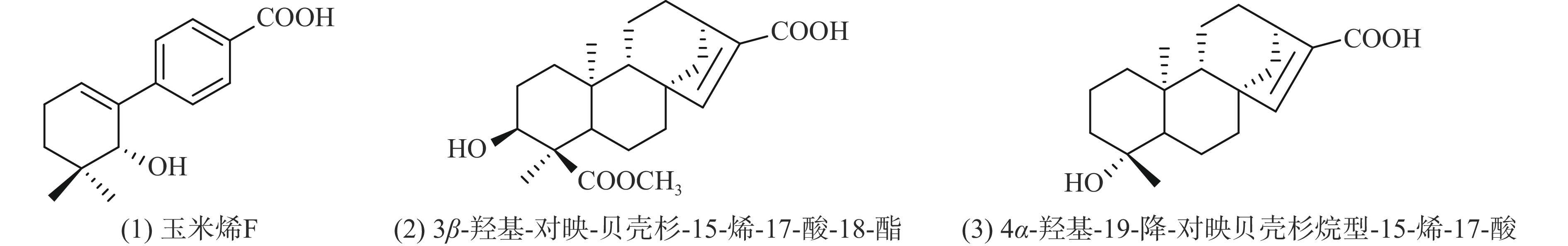
玉米须 在2021年4月于黑龙江省哈尔滨市购买,经齐齐哈尔大学沙伟教授鉴定为禾本科玉蜀黍植物玉米Zea mays L.的花柱和柱头;萜类化合物标准品:玉米烯F、3β-羟基-对映-贝壳杉-15-烯-17-酸-18-酯、4α-羟基-19-降-对映贝壳杉烷型-15-烯-17-酸为本实验室自制,经UPLC检测纯度质量分数均在98%以上,其结构如图1。
Aglient 1290型超高效液相色谱仪 配有DAD检测器,美国安捷伦公司;色谱柱:Polar C18 100 Ȧ(4.6 mm×150 mm,2.6 μm);ZA220 R4电子分析天平 上海赞维衡器有限公司;SHZ-ⅢA型循环水真空泵 巩义予华仪器有限责任公司;KQ3200DE型数据超声波清洗器 昆山市超声仪器有限公司;RE-52型电子旋转蒸发仪 上海亚荣仪器厂;DF-Ⅱ集热式磁力搅拌器 金坛市荣华仪器制造有限公司;提取分离用正己烷(分析纯) 安徽泽升科技有限公司;乙酸乙酯(分析纯) 安徽泽升科技有限公司;正丁醇(分析纯) 天津天力化学试剂有限公司;甲醇(色谱纯)、H3PO4(分析纯,含量≥85%) 上海阿拉丁生化科技股份有限公司;水为屈臣氏蒸馏水 广州屈臣氏食品饮料有限公司。
1.2 实验方法
1.2.1 玉米须中萜类成分的提取
1.2.1.1 室温浸泡提取法
精密称取10.0 g玉米须粉末,置于圆底烧瓶中,按料液比为1:25的比例加入250 mL甲醇,室温下浸泡3 d过滤,重复提取3次,合并提取液,减压浓缩至小体积,加50 mL水混悬,每次用正己烷100 mL萃取3次,水层再用乙酸乙酯(每次100 mL)萃取3次,合并乙酸乙酯萃取液,减压浓缩至恒重,备用。
1.2.1.2 超声提取法
精密称取10.0 g玉米须粉末,置于圆底烧瓶中,按料液比为1:25的比例加入250 mL甲醇,超声提取1 h过滤,重复3次,合并提取液,减压浓缩至小体积,加50 mL水混悬,每次用正己烷100 mL萃取3次,水层再用乙酸乙酯(每次100 mL)萃取3次,合并乙酸乙酯萃取液,减压浓缩至恒重,备用。
1.2.1.3 热回流提取法
精密称取10.0 g玉米须粉末,置于圆底烧瓶中,按料液比为1:25的比例加入250 mL不同浓度(20%、50%、80%)的甲醇水溶液作为提取溶剂,提取时间为1 h过滤,重复3次,合并提取液,减压浓缩至小体积,加水混悬至约为50 mL,每次用正己烷100 mL萃取3次,水层再用乙酸乙酯(每次100 mL)萃取3次,合并乙酸乙酯萃取液,减压浓缩至恒重,备用。
采用热回流提取法,用20%甲醇水溶液为提取溶剂,按上述同样方法制备不同提取时间(0.5、1、1.5、2.0、2.5 h)的提取物,备用。
1.2.1.4 索氏提取法
精密称取10.0 g玉米须粉末,置于圆底烧瓶中,按料液比为1:25的比例加入250 mL甲醇,加热回流提取6 h,倒出提取液,减压浓缩至小体积,加50 mL水混悬,每次用正己烷100 mL萃取3次,水层再用乙酸乙酯(每次100 mL)萃取3次,合并乙酸乙酯萃取液,减压浓缩至恒重,备用。
1.2.2 色谱分析
1.2.2.1 标准品溶液制备
精密称定标准品1、2、3各4.8、5.0、5.0 mg,配制成浓度为192.0、200.0、200.0 μg/mL储备液。将标准品1中的储备液取出适量溶液,稀释成浓度为0.96、3.84、7.68、15.36、75.68、192.0 μg/mL的系列标准曲线,将标准品2、3各取适量溶液,分别稀释成5、10、20、50、100、200 μg/mL的系列标准曲线,使用Aglient 1290超高液相色谱仪进行分析,记录峰面积,建立各标准品的标准曲线。
1.2.2.2 供试品溶液制备
取不同方法制成的提取物用甲醇(色谱纯)溶解,稀释成浓度为10 mg/mL的供试品溶液,置于−20 ℃冰箱中冷藏备用,色谱分析前用0.22 μm有机滤膜过滤至进样瓶中。
1.2.2.3 色谱分析
使用Aglient 1290型超高效液相色谱仪 (美国安捷伦公司),配有DAD检测器,色谱柱:Polar C18 100 Ȧ(4.6mm×150 mm,2.6 μm)色谱柱,进样量5 μL,分别选择不同波长、不同柱温、不同流动相体系、及不同洗脱梯度对标准品进行UPLC分析,建立UPLC法同时测定玉米须中玉米烯F(1)、3β-羟基-对映-贝壳杉-15-烯-17-酸-18-酯(2)和4α-羟基-19-降-对映贝壳杉烷型-15-烯-17-酸(3)的分析方法,并利用该方法对制得的提取物样品进行分析。
1.2.3 含量测定
将不同提取方法得到的提取物用甲醇稀释成浓度为10 mg/mL的样品溶液,使用Aglient 1290型超高效液相色谱仪对样品溶液逐个分析,并将分析结果中目标物的峰面积带入标准曲线方程中,得到目标物的质量分数,再将目标物的质量分数按照公式(1)的方法计算,得到目标物的得率。
(1) 式中:W:目标物的得率;C:目标物的质量分数(%);M1:提取物的质量(g);M2:玉米须的质量(g)。
1.3 数据处理
使用WPS Excel 2017软件对数据进行处理,样品平行检测三次,确保数据准确可靠。样品数据以平均值±标准差形式表示(n=3)。
2. 结果与分析
2.1 色谱条件的优化
2.1.1 检测波长的选择
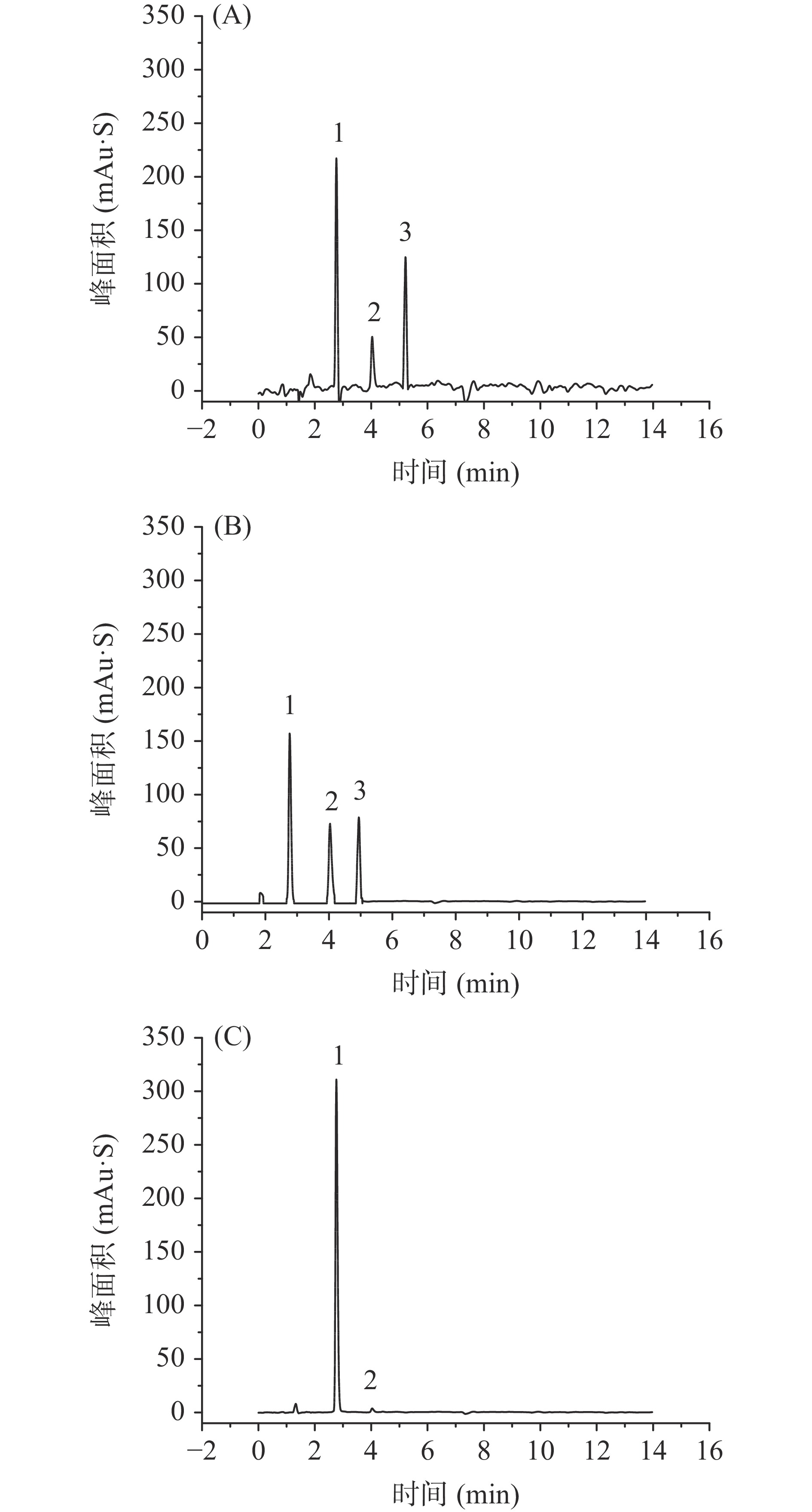
使用Aligent 1290型超高效液相色谱仪,参照文献[23-24]的方法,使用DAD检测器,在210~280 nm范围内检测和确定混合标准品(浓度为1 mg/mL)最佳吸收波长,使干扰对照品的紫外吸收最低,让测定结果更准确。利用该方法,检测波长在210、220、280 nm下,测定玉米须F、3β-羟基-对映-贝壳杉-15-烯-17-酸-18-酯和4α-羟基-19-降-对映贝壳杉烷型-15-烯-17-酸的紫外吸收情况如图2。
由图2中结果可知,倍半萜(峰1)在三种波长下都有较强吸收,但二萜(峰1和峰2)在280 nm波长几乎没有吸收;虽然在210和220 nm下,三种对照品都有较好的吸收,但在210 nm下存在许多杂质吸收峰,产生干扰使基线不平稳;在220 nm下,对照品吸收信号显著,杂质吸收非常弱,基线平稳。因此,为保证实验效果,综合考虑,选择220 nm作为检测波长。
2.1.2 流动相的选择
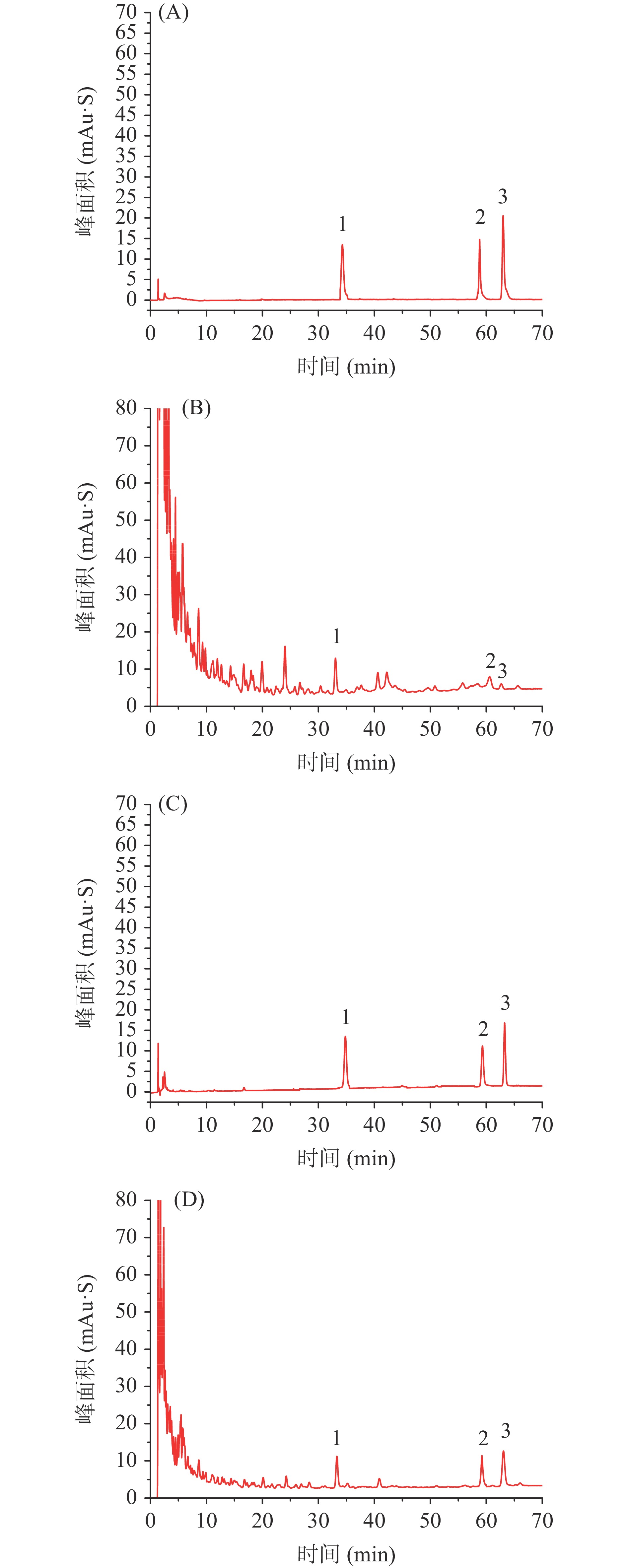
由于三种标准品均含有羧基,属有机酸类。降低流动相的pH能够抑制有机酸电离,可以减少拖尾现象。为考察有机酸和无机酸对色谱分析结果的影响,在polar-C18 100Ȧ (4.6 mm×150 mm, 2.6 μm)型色谱柱、波长220 nm、柱温40 ℃、流速1.0 mL的色谱条件下,分别以甲醇/0.1%甲酸-水和甲醇/0.1%磷酸-水为流动相体系进行梯度洗脱,对三种标准品的混合样品进行色谱分析,结果如图3。
由图3 可知,在流动相体系中加入甲酸,三种标准品的吸收峰产生不同程度的拖尾现象,供试品峰型不稳定,且各吸收峰间没有达到基线分离。而在流动相体系中加入磷酸,不论是标准品还是供试品均得到较好的分析结果,因此选择甲醇/0.1%磷酸-水体系作为流动相。
2.1.3 柱温的选择
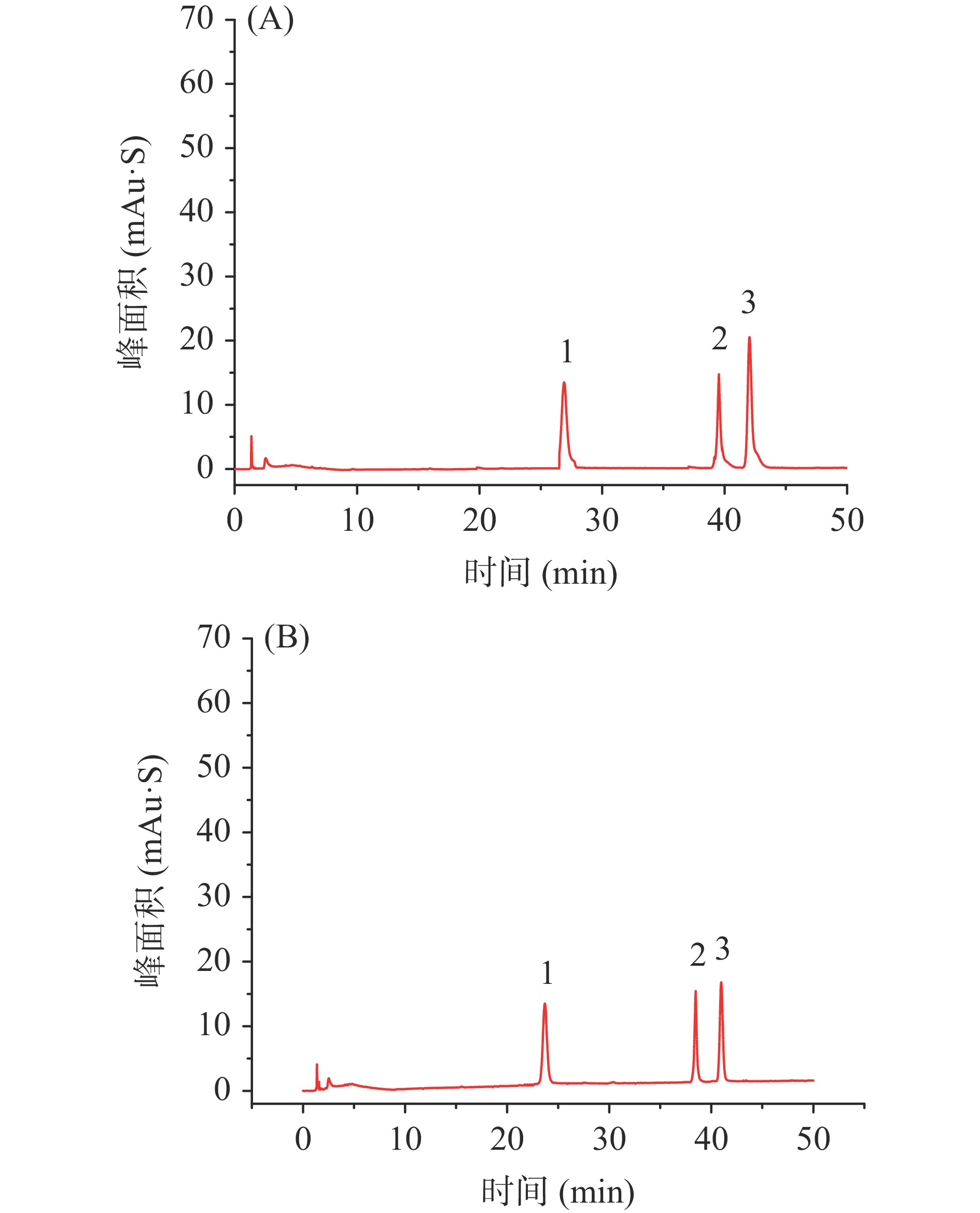
根据文献[25-30],分别选择35和40 ℃两种柱温,在波长为220 nm,用polar-C18 100Ȧ(4.6 mm×150 mm,2.6 μm)型色谱柱,流动相为甲醇/0.1%磷酸-水、流速1.0 mL/min、进样量5 μL条件下对混合标准品溶液进行色谱分析,结果如图4。由图可以看出:在柱温为35 ℃时,吸收峰严重拖尾且保留时间延长2 min;在柱温为40 ℃时,峰型高且尖,两种目标化合物的分离度较好,所以色谱分析的柱温选择40 ℃。
2.1.4 色谱条件
通过以上考察,最终确定色谱条件为:Polar C18 100 Ȧ(4.6 mm×150 mm,2.6 μm) 色谱柱;柱温:40 ℃;进样量:5 μL;检测波长:220 nm;流速:1.0 mL/min;流动相A:甲醇,流动相B:0.1%磷酸-水;梯度洗脱程序:0~7 min,40% A~43% A;7~25 min,43% A~51% A;25~50 min,51% A~55% A。
2.2 方法学考察
2.2.1 线性范围、定量限及检出限
用甲醇分别将1.2项中的标准品储备液配制成不同浓度水平的系列标准工作液,按照选定的色谱条件进样分析,测定峰面积,以峰面积(у,mAu×S)为纵坐标,浓度(x,μg/mL)为横坐标绘制标准工作曲线,在信噪比为3和10下测量定量限与检出限,结果如表1所示。三种标准品的线性范围、回归方程、相关系数、定量限及检出限。
表 1 三种标准品的回归方程、相关系数及定量限、检出限Table 1. Linear equations, correlation coefficients (R2), limits of detection (LODs) and limits of quantification (LOQs) of three standards标准品 线性范围(μg/mL) 线性回归方程 相关系数(r) 检测限(mg/kg) 定量限(mg/kg) 化合物1 0.96~192.00 y=7.3008x+8.3279 0.9993 4.5 10.0 化合物2 5.00~200.00 y=2.5456x+0.8926 0.9996 1.5 5.0 化合物3 5.00~200.00 y=2.5712x+0.8548 0.9997 1.3 5.0 2.2.2 精密度试验
分别精密吸取一定浓度的标准品溶液,在选定的色谱条件下连续进样3次,记录色谱峰面积。标准品1、2、3各峰面积的RSD值分别为1.7%、0.9%、0.5%,均小于2%,表明仪器精密度良好。
2.2.3 稳定性试验
分别精密吸取标准品混合溶液,在选定的色谱条件下进样,在0、12、24、36、48 h进样分析,记录各色谱峰面积。标准品各峰面积的RSD值分别为1.1%、0.7%、1.3%,均小于2.0%,这表明三种标准品在 48 h内稳定性良好。
2.2.4 重复性试验
取同一批供试品溶液,按照选定的色谱条件下连续进样3次,记录色谱峰面积。三种标准品各峰面积的RSD值分别为2.5%、5.1%、1.6%,小于6%,表明该方法重复性良好。
2.2.5 加样回收率试验
平行取9份同一批玉米须粉末样品,每份2.0 g,精密称定,平均分成3组,按供试品处理方法处理后,加入一定量的标准品,使加入量分别约为化合物原始含量的80%(低浓度组)、100%(中浓度组)、120%(高浓度组),在选择的色谱条件下进样,测定其吸光度,记录各峰面积,计算加标回收率及相应的RSD值。如表2所示,三种标准品的平均加样回收率为89.1%~105.8%。其RSD值为0.3%~1.4%,证明重复性和稳定性较好。
表 2 各成分加样回收率及RSD值(n=9)Table 2. Average recoveries and RSDs of terpenoids from stigma maydis (n=9)标准品 含有量
(μg)加入量
(μg)测得量
(μg)回收率
(%)平均回收率
(%)RSD
(%)1 43.6 34.9 77.3 98.5 98.6 0.8 43.6 34.9 76.8 97.8 43.6 34.9 78.0 99.4 43.6 43.6 85.7 98.3 97.5 0.6 43.6 43.6 84.3 96.7 43.6 43.6 85.0 97.5 43.6 52.3 97.8 102.0 101.7 1.1 43.6 52.3 98.8 103.0 43.6 52.3 96.1 100.2 2 112.6 90.1 217.7 107.4 105.8 1.2 112.6 90.1 213.5 105.3 112.6 90.1 212.1 104.6 112.6 112.6 201.3 89.4 90.7 1.3 112.6 112.6 205.4 91.2 112.6 112.6 206.3 91.6 112.6 135.1 222.1 89.7 89.1 1.4 112.6 135.1 218.3 88.1 112.6 135.1 221.4 89.4 3 120.9 96.7 205.5 94.4 93.0 1.3 120.9 96.7 201.3 92.5 120.9 96.7 200.2 92.0 120.9 120.9 247.5 102.3 100.8 0.3 120.9 120.9 242.2 100.2 120.9 120.9 241.7 100.0 120.9 145.1 256.7 96.5 95.6 0.8 120.9 145.1 253.2 95.2 120.9 145.1 252.8 95.0 2.3 提取工艺结果分析
本文以三种萜类成分为分析目标,简单探讨了不同提取条件下目标成分实际收率。在最佳提取条件下得到单个成分得率最高达0.19%,与文献[20]对比提高了33.16%,且工艺简单、操作方便,适用于快速、高效从玉米须中提取富集倍半萜、二萜类成分。
2.3.1 提取方法对提取效果的影响
分别将1.2.1项中10 g玉米须通过室温浸泡提取、超声提取、热回流提取和索氏提取四种提取方法各自制得的提取物总量,及以三种标准品为目标物,在2.1.4项确定的色谱条件下进行色谱分析的结果列表,如表3。
表 3 不同提取方法对三种标准品得率的影响 (n=3)Table 3. Effects of different extraction methods on the yield of three standards (n=3)提取方法 提取物总量 (mg) 目标物含量 (%) 目标物得率 (μg/g) 1 2 3 1 2 3 室温浸泡法 102.5±1.5 0.04 0.06 0.09 3.58±0.03 6.61±0.05 9.10±0.22 超声法 128.1±0.9 0.05 0.07 0.13 6.41±0.08 9.57±0.18 17.06±0.41 加热回流法 106.5±1.6 0.13 0.19 0.19 13.50±0.87 21.54±0.72 23.98±0.15 索氏提取法 125.4±1.7 0.10 0.21 0.19 12.35±0.81 26.26±0.26 23.82±0.06 从表3中结果可以看出,加热回流法的提取效果最好,获得目标物的含量明显优于其它提取方法,其次为索氏提取法,室温浸泡法相对较差。加热回流法主要通过持续不断的加热使天然植物的细胞壁软化破裂,使有效成分从细胞内再扩散到细胞外,再扩散到溶剂中,这种方法有利于目标物的溶出,显著提高提取效率。室温浸泡法与加热回流法恰好相反。而超声法有多因素不固定(温度、超声频率等)。索氏提取法得到的得率较好,但不适用于工业化生产。综合考虑,选择加热回流法。
2.3.2 提取溶剂对提取效果的影响
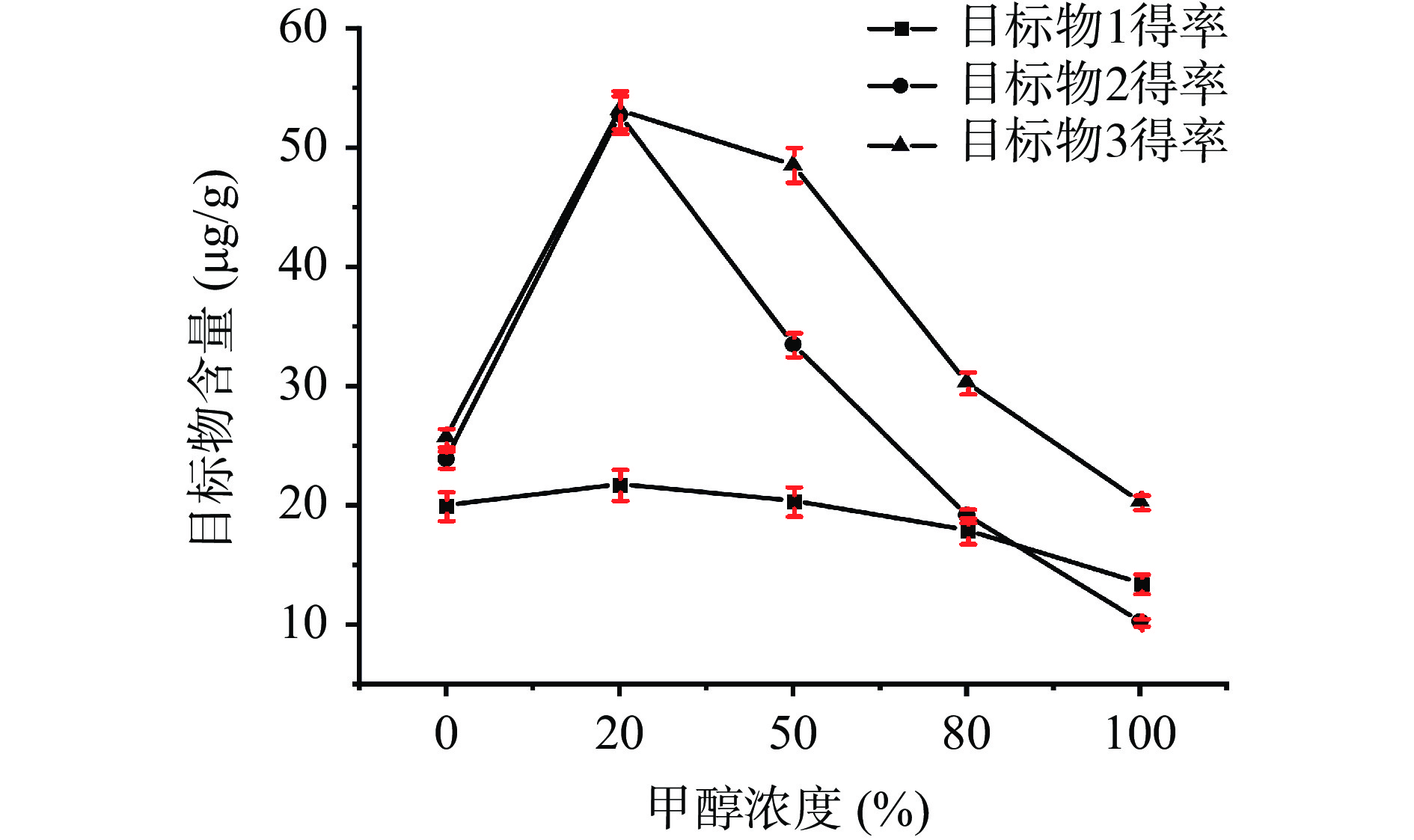
为减少挥发油、油脂以及甾体等小极性成分的溶出,实现富集倍半萜和二萜类成分的目的,采用热回流法,以三种标准品为目标物,通过调整提取溶剂中的甲醇-水体积比,改变提取溶剂的极性,优化提取工艺。以提取溶剂中的醇-水体积比为横坐标,以提取物中目标物的含量为纵坐标作图,如图5。
由图5可以看出,随着提取溶剂中甲醇占比的增加,倍半萜和二萜类成分的含量都有明显增加,特别是二萜类成分的含量增加更为显著,当溶液中甲醇占比达到20%时出现峰值,继续增加提取溶剂中甲醇的比例,倍半萜和二萜类成分的含量都呈下降趋势。可能是由于倍半萜、二萜类化合物为脂溶性成分,易溶于有机溶剂,但随着溶剂中甲醇占比升高,同时也有利于其他脂溶性成分溶出,使萜类成分在总提取物中的占比相对减小。综合考虑,选择20%甲醇水溶液作为提取溶剂。
2.3.3 提取时间对提取效果的影响
提取时间是保证被提取成分能否完全溶出的关键因素,同时加热对多种成分的化学稳定性产生重要影响。为确保玉米须中倍半萜和二萜类成分的充分提取,以20%甲醇水溶液为提取溶剂,料液比为1:25,采用热回流提取法,通过分析不同提取时间获得提取物中三种对照品的含量,考察提取时间对三种目标物提取效果的影响,结果如图6所示。
从图6可以看出,提取时间延长,目标物含量迅速增加,当提取时间在1 h时,三种对照品的含量达到峰值,分别为21.50、51.82、55.43 μg/g,继续延长回流时间,三种目标物的含量都呈现下降趋势。该结果产生的原因一方面可能与目标物化学稳定性有关,另一方面可能主要是由于目标物在提取时间为1 h时大部分已经溶出,随提取时间的加长,其它脂溶性成分的溶出量加大,总提取物量增加,使目标物在提取物中的占比相对减小,导致目标物在1 h后呈下降趋势。因此,选择回流提取时间为1 h。
3. 结论
通过以玉米须中含量相对较多的一种倍半萜和两种二萜作为目标物,建立了UPLC法同时测定玉米须中三种萜类成分含量的分析方法,玉米烯F(1)在0.96~192.0 μg/mL范围内,3β-羟基-对映-贝壳杉-15-烯-17-酸-18-酯(2)和4α-羟基-19-降-对映贝壳杉烷型-15-烯-17-酸(3)在5.0~200.0 μg/mL范围内线性关系良好(r>0.9993),定量限(LOQ,S/N=10)均在5.0~10.0 μg/g之间,平均加样回收率为89.1%~105.8%,相对标准偏差(RSD)均小于2%,表明该方法具有较高的准确度和检测灵敏度,能够准确地对玉米须样品中的萜类成分进行定量分析。通过利用以上建立的UPLC法同时测定玉米须中三种萜类成分含量的分析方法,对不同提取方法及不同提取时间所得提取物中三种萜类成分的含量进行分析比较,确定较佳提取工艺为:以20%甲醇水溶液作为提取溶剂,料液比为1:25,采用加热回流提取法,提取时间1 h。
-
表 1 三种标准品的回归方程、相关系数及定量限、检出限
Table 1 Linear equations, correlation coefficients (R2), limits of detection (LODs) and limits of quantification (LOQs) of three standards
标准品 线性范围(μg/mL) 线性回归方程 相关系数(r) 检测限(mg/kg) 定量限(mg/kg) 化合物1 0.96~192.00 y=7.3008x+8.3279 0.9993 4.5 10.0 化合物2 5.00~200.00 y=2.5456x+0.8926 0.9996 1.5 5.0 化合物3 5.00~200.00 y=2.5712x+0.8548 0.9997 1.3 5.0 表 2 各成分加样回收率及RSD值(n=9)
Table 2 Average recoveries and RSDs of terpenoids from stigma maydis (n=9)
标准品 含有量
(μg)加入量
(μg)测得量
(μg)回收率
(%)平均回收率
(%)RSD
(%)1 43.6 34.9 77.3 98.5 98.6 0.8 43.6 34.9 76.8 97.8 43.6 34.9 78.0 99.4 43.6 43.6 85.7 98.3 97.5 0.6 43.6 43.6 84.3 96.7 43.6 43.6 85.0 97.5 43.6 52.3 97.8 102.0 101.7 1.1 43.6 52.3 98.8 103.0 43.6 52.3 96.1 100.2 2 112.6 90.1 217.7 107.4 105.8 1.2 112.6 90.1 213.5 105.3 112.6 90.1 212.1 104.6 112.6 112.6 201.3 89.4 90.7 1.3 112.6 112.6 205.4 91.2 112.6 112.6 206.3 91.6 112.6 135.1 222.1 89.7 89.1 1.4 112.6 135.1 218.3 88.1 112.6 135.1 221.4 89.4 3 120.9 96.7 205.5 94.4 93.0 1.3 120.9 96.7 201.3 92.5 120.9 96.7 200.2 92.0 120.9 120.9 247.5 102.3 100.8 0.3 120.9 120.9 242.2 100.2 120.9 120.9 241.7 100.0 120.9 145.1 256.7 96.5 95.6 0.8 120.9 145.1 253.2 95.2 120.9 145.1 252.8 95.0 表 3 不同提取方法对三种标准品得率的影响 (n=3)
Table 3 Effects of different extraction methods on the yield of three standards (n=3)
提取方法 提取物总量 (mg) 目标物含量 (%) 目标物得率 (μg/g) 1 2 3 1 2 3 室温浸泡法 102.5±1.5 0.04 0.06 0.09 3.58±0.03 6.61±0.05 9.10±0.22 超声法 128.1±0.9 0.05 0.07 0.13 6.41±0.08 9.57±0.18 17.06±0.41 加热回流法 106.5±1.6 0.13 0.19 0.19 13.50±0.87 21.54±0.72 23.98±0.15 索氏提取法 125.4±1.7 0.10 0.21 0.19 12.35±0.81 26.26±0.26 23.82±0.06 -
[1] 王明华, 石瑞, 赵二劳. 玉米多酚提取工艺及其生物活性研究进展[J]. 中国调味品,2022,47(3):217−220. [WANG M H, SHI R, ZHAO E L. Research progresson extraction technology and bioloactivity of corn polphennols[J]. China Condiment,2022,47(3):217−220. WANG M H, SHI R, ZHAO E L. Research progresson extraction technology and bioloactivity of corn polphennols[J]. China Condiment, 2022, 47(3): 217-220.
[2] 刘羽婷, 宫春宇, 廉雅雯, 等. 不同预处理方式对玉米须多糖提取及抗氧化活性的影响[J]. 食品科技,2022,47(4):209−215. [LIU Y T, GONG C Y, LIAN Y W, et al. Effects of different pretreatment methods on extraction and antioxidant activity of polysacchardes from corn silk[J]. Food Science and Technology,2022,47(4):209−215. LIU Y T, GONG C Y, LIAN Y W, et al. Effects of different pretreatment methods on extraction and antioxidant activity of polysacchardes from corn silk[J]. Food Science and Technology, 2022, 47 (4): 209-215.
[3] JIA Y N, WANG Y J, LI R, et al. The structural characteristic of acidic-hydrolyzed corn silk polysaccharides and its protection on the H2O2-injured intestinal epithelial cells[J]. Food Chemistry,2021,356:129691. doi: 10.1016/j.foodchem.2021.129691
[4] VELAZQUEZ D V O, XAVIERR H S, BATISTA J E M, et al. Zea mays L. extracts modify glomerular function and potassium urinary excretion in conscious rats[J]. Phytomedicine,2005,12(5):363−369. doi: 10.1016/j.phymed.2003.12.010
[5] NAMBA T, XU H, KADOTS, et al. Inhibition of IgE formation in mice by glycoproteins from corn silk[J]. Phytotherapy Research,1993,7(3):227−230. doi: 10.1002/ptr.2650070303
[6] LIU J, WANG C, WANG Z, et al. The antioxidant and free-radical scavenging activities of extract and fractions from corn silk (Zea mays L.) and related flavone glycosides[J]. Food Chemistry,2011,126(1):261−269. doi: 10.1016/j.foodchem.2010.11.014
[7] CHAIITTIANAN R, CHAYOPAS P, RATTANATHONGKOM A, et al. Anti-obesity potential of corn silks: Relationships of phytochemicals and antioxidation, anti-pre-adipocyte proliferation, anti-adipogenesis, and lipolysis induction[J] Journal of Functional Foods, 2016, 23: 497-510.
[8] 刘璐, 廖李, 汪兰, 等. 玉米须无糖饮料加工工艺优化及成分分析[J]. 湖北农业科学,2014,53(16):3870−3873. [LIU L, LIAO L, WANG L, et al. Optimizing process of No-sugar corn silk beverage and analyzing its component[J]. Hubie Agricultureal sciences,2014,53(16):3870−3873. LIU L, LIAO L, WANG L, et al. Optimizing process of No-sugar corn silk beverage and analyzing its component[J]. Hubie Agricultureal sciences, 2014, 53(16): 3870-3873.
[9] CHOI S Y, LEE Y, KIM S S, et al. Inhibitory effect of corn silk on skin pigmentation[J]. Molecules,2014,19(3):2808−2818. doi: 10.3390/molecules19032808
[10] 陈艳军, 高旭珍, 关大勇, 等. 玉米须醇提物对肝纤维化大鼠药效学研究[J]. 中国实验方剂学杂志,2012,18(11):195−199. [CHEN Y J, GAO X Z, et al. Study on the pharmacodynamic of rthanol rxtracts from Lonicera japonica in rats with hepatic fibrosis[J]. Chinese Journal of Experimental Traditional Medical Formulae,2012,18(11):195−199. CHEN Y J, GAO X Z, et al. Study on the pharmacodynamic of rthanol rxtracts from Lonicera japonica in rats with hepatic fibrosis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(11): 195-199.
[11] 张亚亨, 杨雪军. 中药玉米须的现代药理研究及临床应用进展[J]. 上海中医药大学学报,2022,36(S1):287−290. [ZHANG Y H, YANG X J. Progress in modern pharmacological research and clinical application of traditional Chinese medicine corn silk[J]. Academic Journal of Shanghai University of Traditional Chinese Medicine,2022,36(S1):287−290. ZHANG Y H, YANG X J. Progress in modern pharmacological research and clinical application of traditional Chinese medicine corn silk[J]. Academic Journal of Shanghai University of Traditional Chinese Medicine, 2022, 36(S1): 287-290.
[12] 滕蓉. 玉米须玫瑰茄复合保健饮料的研制[J]. 山东化工,2021,50(20):36−37,40. [TENG R. Development of compound health drink with corn silk and hibiscus sabdariffa[J]. Shandong Chemical Industry,2021,50(20):36−37,40. TENG R. Development of compound health drink with corn silk and hibiscus sabdariffa[J]. Shandong Chemical Industry, 2021, 50(20): 36-37, 40.
[13] 江芳, 林菁, 吴晓青. 一种复方藤茶的研制[J]. 食品工业,2021,42(4):47−50. [JIANG F, LIN Q, WU X Q. Preparation of compound ampelopsis grossedentata W. T. Wang Tea[J]. The Food Industry,2021,42(4):47−50. JIANG F, LIN Q, WU X Q. Preparation of compound ampelopsis grossedentata W. T. Wang Tea[J]. The Food Industry, 2021, 42(4): 47-50.
[14] 黄晓梅, 伍兴武, 吴琼峰, 等. 玉米须多糖的提取及其对面条品质的影响[J]. 粮食与油脂,2021,34(6):64−67. [HUANG X M, WU X W, WU Q F, et al. Extraction of corn silk polysaccharides and effect on noodle quality[J]. Cereals & Oils,2021,34(6):64−67. HUANG X M, WU X W, WU Q F, et al. Extraction of corn silk polysaccharides and effect on noodle quality[J]. Cereals & Oils, 2021, 34(6): 64-67.
[15] HUFFAKER A, KAPLAN F, VAUGHAN M M, et al. Novel acidic sesquiterpenoids constitute a dominant class of pathogen-induced phytoalexins in maize[J]. Plant Physiology,2011,156(4):2082−2097. doi: 10.1104/pp.111.179457
[16] 李晓雪, 赵明, 马耀玲, 等. 玉米须化学成分研究[J]. 中草药,2021,52(12):3480−3484. [LI X X, ZHAO M, MA Y L, et al. Chemical constituents from style and stigma of Zea mays[J]. Chinese Traditional and Herbal Drugs,2021,52(12):3480−3484. LI X X, ZHAO M, MA Y L, et al. Chemical constituents from style and stigma of Zea mays[J]. Chinese Traditional and Herbal Drugs, 2021, 52(12): 3480-3484.
[17] ZHOU W L, LIN B, HOU Z L, et al. Isolation of macrocarpene-type sesquiterpenes from Stigma maydis with neuroprotective activities[J]. Fitoterapia, 2020, 141: 104448.
[18] ZHOU W Y, LIN B, HOU Z L, et al. A new monoterpene-lactone with neuroprotective activity from corn silk[J]. Natural Product Research,2019,10(9):1−4.
[19] 徐燕, 邹忠梅, 梁敬钰. 玉米须的化学成分[J]. 中国天然药物,2008(3):237−238. [XU Y, ZOU Z M, LIANG J Y. Chemical constituents from the style Zea mays L J]. China Nat Med May,2008(3):237−238.
[20] QI X L, ZHANG Y, ZHAO P, et al. Ent-Kaurane diterpenoids with neuroprotective properties from corn silk (Zea mays)[J]. Journal of Natural Products,2018,81(5):1225−1234. doi: 10.1021/acs.jnatprod.7b01017
[21] SONG X Y, GUO R, QI X L, et al. Terpenoids from stigma maydis (Zea mays L.) alleviate hydrogen peroxide-induced SH-SY5Y cell injury by activating Nrf2[J]. Bioorganic Chemistry,2020,102:104131. doi: 10.1016/j.bioorg.2020.104131
[22] 袁兴利, 闫利华, 张启伟, 等. HPLC测定冬凌草中迷迭香酸、冬凌草甲素和猫眼草黄素的含量[J]. 中国中药杂志,2013,38(14):2343−2347. [YUAN X L, YAN L H, ZHANG Q W, et al. Simulaneous determination of rosmarinic acid, oridonin and chryoplenin in Isodon rubescens by HLPC[J]. China Journal of Chinese Materia Medica,2013,38(14):2343−2347. YUAN X L, YAN L H, ZHANG Q W, et al. Simulaneous determination of rosmarinic acid, oridonin and chryoplenin in Isodon rubescens by HLPC[J]. China Journal of Chinese Materia Medica, 2013, 38 (14): 2343-2347.
[23] 刘安平, 苏媛, 刘学良, 等. HPLC法同时测定山地虎耳草中5种成分[J]. 中国药师,2022,25(10):1826−1829. [LIU A P, SU Y, LIU X L, et al. Simultaneous determination of five constituents in Saxifraga montana by HPLC[J]. China Pharmacist,2022,25(10):1826−1829. LIU A P, SU Y, LIU X L, et al. Simultaneous determination of five constituents in Saxifraga montana by HPLC[J]. China Pharmacist, 2022, 25(10): 1826-1829.
[24] 王丽荣, 贾文君, 陈明敏, 等. 高效液相色谱法(HPLC)测定芒果多种植物生长调节剂含量[J]. 植物生理学报,2022,58(5):981−988. [WANG L R, JIA W Q, CHEN M M, et al. Determination of contents of several plant growth regulators in mango by high performance liquid chromatography (HPLC)[J]. Plant Physiology Journal,2022,58(5):981−988. doi: 10.13592/j.cnki.ppj.200003 WANG L R, JIA W Q, CHEN M M, et al. Determination of contents of several plant growth regulators in mango by high performance liquid chromatography (HPLC)[J]. Plant Physiology Journal, 2022, 58(5): 981-988. doi: 10.13592/j.cnki.ppj.200003
[25] 毛思浩, 陈碧莲, 李文庭, 等. HPLC测定毛叶香茶菜中迷迭香酸和冬凌草甲素含量[J]. 中国现代应用药学,2016,33(7):922−925. [MAO S H, CHEN B L, LI W T, et al. Determination of rosmarinic acid and oridonin in Rabdosia japonica (Burm. f.)Hara by HPLC[J]. Chinese Journal of Modern Applied Pharmacy,2016,33(7):922−925. MAO S H, CHEN B L, LI W T, et al. Determination of rosmarinic acid and oridonin in Rabdosia japonica (Burm. f. )Hara by HPLC[J]. Chinese Journal of Modern Applied Pharmacy, 2016, 33(7): 922-925.
[26] 李培照, 李春, 梁婉婷, 等. 高效液相色谱法(HPLC)测定保加利亚乳杆菌胞内Acetyl-CoA[J]. 食品工业科技,2013,34(22):58−61,65. [LI P Z, LI C, LIANG W T, et al. Determination of intracellular acetyl CoA in L. bulgaricus by HPLC[J]. Science and Technology of Food Industry,2013,34(22):58−61,65. LI P Z, LI C, LIANG W T. Determination of intracellular acetyl CoA in L. bulgaricus by HPLC[J]. Science and Technology of Food Industry, 2013, 34(22): 58-61, 65.
[27] 丁浩然, 刘峰, 陈艳, 等. 急支糖浆一板多药味HPTLC鉴别和HPLC含量测定方法的研究[J]. 中国药房,2022,33(5):555−562. [DING H R, LIU F, CHEN Y, et al. Study on HPLC identification of one-plate multi-drug and HPLC content determination method for jizhi syrup[J]. China Pharmacy,2022,33(5):555−562. DING H R, LIU F, CHEN Y, et al. Study on HPLC identification of one-plate multi-drug and HPLC content determination method for jizhi syrup[J] China Pharmacy, 2022, 33 (5): 555-562.
[28] 陈两绵, 刘晓谦, 张永欣, 等. 茶藨子叶状层菌中核苷类成分的 UPLC-Q-TOF-MS 定性分析和HPLC含量测定[J]. 中国中药杂志,2021,46(12):2912−2922. [CHEN L M, LIU X Q, ZHANG Y X, et al. Qualitative and quantitatives analysis of nucleobases in phylloporia ribis by UPLC-Q-TQF-MS and HPLC[J]. China Journal of Chinese Materia Medica,2021,46(12):2912−2922. CHEN L M, LIU X Q, ZHANG Y X, et al. Qualitative and quantitatives analysis of nucleobases in phylloporia ribis by UPLC-Q-TQF-MS and HPLC[J]. China Journal of Chinese Materia Medica, 2021, 46 (12): 2912-2922.
[29] 海丽娜, 王鹏飞, 王京辉, 等. 复方苦参注射液UPLC指纹图谱检测及6种成分含量测定[J]. 中国药学杂志,2022,57(14):1198−1204. [HAI L N, WANG P F, WANG J H, et al. Study on the UPLC fingerprint and determination of six components of compound Kushen injection[J]. Chinese Pharmaceutical Journal,2022,57(14):1198−1204. HAI L N, WANG P F, WANG J H, et al. Study on the UPLC fingerprint and determination of six components of compound Kushen injection[J]. Chinese Pharmaceutical Journal, 2022, 57 (14): 1198-1204.
[30] 何民友, 段志文, 杨洁, 等. 基于UPLC指纹图谱及2种化学成分含量测定的月季花质量分析[J]. 天然产物研究与开发,2022,34(9):1455−1464. [[HE M Y, DUAN Z W, YANG J, et al. Quality analysis of Rose Chinesis flos based on UPLC fingerprint and content determination of two chemical components[J]. Natural Product Research and Development,2022,34(9):1455−1464. [HE M Y, DUAN Z W, YANG J, et al. Quality analysis of Rose Chinesis flos based on UPLC fingerprint and content determination of two chemical components[J]. Natural Product Research and Development, 2022, 34 (9): 1455-1464.
-
期刊类型引用(1)
1. 何军波,贾庆超. 模糊数学评价结合响应面法优化黑蒜香菇酱制备工艺及抗氧化活性和储藏分析. 食品工业科技. 2023(19): 47-56 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:

 下载:
下载:



