Research on the Anti-aging Effect of Rosa xanthina Lindl Fruits Based on 1H NMR Metabolomics
-
摘要: 目的:采用1H NMR代谢组学方法,探讨黄刺玫果实对D-半乳糖致衰老模型大鼠的干预作用。方法:皮下注射D-半乳糖(400 mg/kg)致大鼠亚急性衰老,考察黄刺玫果实提取物(1.6、3.2、6.4 g/kg)的抗衰老作用。造模30 d后采集大鼠血清,检测血清生化指标SOD(superoxide dismutase)、LPO(lipid peroxide)及Hyp(hydroxyproline)水平,并进行1H NMR代谢组学检测,结合多元统计分析研究黄刺玫果实提取物高、中、低剂量的抗衰老作用。结果:与模型组相比,黄刺玫果实提取物可显著升高血清SOD(P<0.01)、Hyp(P<0.01)水平,降低LPO(P<0.05,P<0.01)水平。与对照组相比,模型组大鼠血清中13种差异代谢物发生显著(P<0.05,P<0.01)性变化。给予黄刺玫后,高剂量组可显著(P<0.05,P<0.01)回调脂质、精氨酸、甘油酯、氧化三甲胺、甘氨酸、丙氨酸及N-乙酰糖蛋白7种代谢物,中剂量组可显著调节氧化三甲胺、N-乙酰糖蛋白、亮氨酸3种代谢物,而低剂量组仅显著回调磷脂酰胆碱。三组药效指数(EI)由大到小分别为高剂量组、中剂量组、低剂量组,表明高剂量组的抗衰老效果最佳。结论:黄刺玫果实可能通过调节氧化应激、促进胶原蛋白合成,以及调节氨基酸代谢、肠道菌群代谢等途径延缓衰老。Abstract: Objective: The anti-aging effect of the fruits of Rosa xanthina Lindl (RF) was investigated by the 1H NMR based metabolomics using D-galactose-induced aging rats. Methods: Rat subacute senile model was established by subcutaneous injection of D-galactose (400 mg/kg), and the anti-aging effects of RF were studied at three different doses (1.6, 3.2, 6.4 g/kg). On the 30th day, rat serum was collected and the serum superoxide dismutase (SOD), lipid peroxide (LPO) and hydroxyproline (Hyp) were determined. The anti-aging effects of high, middle, low dose of RF were investigated by 1H NMR metabolomics, and combined with multivariate statistical analysis. Results: When compared with the model group, RF extracts could increase serum SOD and Hyp levels (P<0.01) and decrease LPO level (P<0.05, P<0.01) significantly. For the rats in the model group, 13 differential metabolites in serum were changed (P<0.05, P<0.01) significantly. After treatment by RF, seven metabolites including lipid, arginine, glycerol, trimethylamine N-Oxide (TMAO), glycine, alanine and N-acetyl glycoprotein were regulated in the high dose group, and then three metabolites including TMAO, N-acetyl glycoprotein and leucine were altered in the middle dose group, while only phosphatidylcholine (PC) was decreased in the low dose group (P<0.05, P<0.01) significantly. The best ranking of Efficacy index (EI) in three groups was high, middle and low, indicating that the high dose of RF showed the best anti-aging effect. Conclusion: RF exhibited the anti-aging effect probably through regulating oxidative stress, promoting collagen synthesis, and also related with various metabolic pathways, such as amino acid metabolism and gut microbiota metabolism.
-
Keywords:
- Rosa xanthina Lindl fruits extract /
- metabolomics /
- anti-aging /
- D-galactose
-
黄刺玫果是蔷薇科蔷薇属落叶灌木黄刺玫(Rosa xanthina Lindl.)的干燥成熟果实,晋南地区俗称“马茹子”,广泛分布于我国北方各省的山区和丘陵地带[1]。黄刺玫果实中含有种类丰富的化学成分,包括维生素和黄酮类物质等[2-3],不仅可食用、制果酱,而且具有理气活血、调经健脾的功效;现代药理研究表明,黄刺玫具有抗氧化、抗血栓等作用[4-5]。前期研究发现,黄刺玫果汁可以延长果蝇寿命,并可显著提高血液中超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的活力[6]。果蝇为低等动物,与人的基因相似性仅为61%[7],而哺乳动物更接近人类,黄刺玫果实对哺乳动物是否也具有明显的抗衰老作用,以及相应的作用机制是什么,目前未见报道。
代谢组学是系统生物学的分支,能够及时、灵敏、真实地表征在外界因素刺激或病理状态下生物机体功能的整体应答与调节。核磁共振(1H NMR)技术具有分析速度快、灵敏度高、样品无破坏性、无偏向性等优点,目前已广泛运用到药物的药效评价研究,如黄芩素的抗衰老作用[8]、驴胶补血颗粒的补血作用[9]、苦荞水提物的降糖作用[10]、黄芪的抗疲劳作用[11]等。上述研究通过代谢组学技术比较了内源性代谢产物的变化,寻找到差异代谢物后并聚焦相关代谢通路,为药物作用机制的研究提供了一种新的思路。本研究选择D-半乳糖诱导亚急性衰老大鼠模型,采用1H NMR代谢组学技术研究黄刺玫果实的抗衰老作用及相应作用机制。除传统的与衰老相关生化指标评价外,结合代谢组学技术阐释相关机制,为黄刺玫的进一步资源开发提供科学依据。
1. 材料与方法
1.1 材料与仪器
清洁级SD大鼠 50只,雄性,体重180±20 g,由斯贝福(北京)生物技术有限公司提供,合格证号:SCXK(京)2019-0010;动物实验前适应性饲养1周,自由觅食和饮水,在室温(20±2)℃,湿度40%~70%,12 h昼夜节律光照下饲养。实验在山西省医药与生命科学研究院清洁级动物实验室开展,设施使用许可证号SYXK(晋)2017-0001。
黄刺玫果 采自山西省左权县,经王进东教授鉴定为黄刺玫果实;无水乙醇(分析纯) 天津市申泰化学有限公司;D-半乳糖 sigma公司;羟脯氨酸(Hyp)、超氧化物歧化酶(SOD)活性、过氧化脂质(LPO)试剂盒 南京建成生物研究所;重水(99.9%) 青岛腾龙微波科技有限公司。
电热恒温水浴锅 北京科伟永兴仪器有限公司;92SM-202A-DR电子分析天平 瑞士Precisa;Allegra 64R台式高速冷冻离心机 美国贝克库曼尔特有限公司;全自动酶免生化分析仪 美国AWARENES公司;Bruker 600 MHz Avance Ⅲ型核磁共振仪(质子频率600.13 MHz) 德国Bruker公司。
1.2 实验方法
1.2.1 黄刺玫提取物的制备
参照本课题组文献[12]提取,将黄刺玫干果粉碎后,加入10倍量70%乙醇,回流提取3次,每次1.5 h,提取液减压浓缩至干燥,所得干燥品即为实验所需样品。
1.2.2 实验分组
SD大鼠适应性饲养一周后,随机分为空白对照组(K)、模型组(M)、黄刺玫提取物低剂量组(D)、中剂量组(Z)及高剂量组(G),每组10只。除空白组外,其余大鼠每天按照400 mg/kg[13]皮下注射D-半乳糖,连续注射30 d,空白组注射同体积生理盐水。同时,除空白组与模型组按照1 mL、100 g灌胃给予生理盐水,黄刺玫提取物低、中、高剂量组分别按照1.6、3.2、6.4 g/kg剂量灌胃给予黄刺玫提取物,连续给药30 d。给药结束后,以5%水合氯醛腹腔注射麻醉(0.75 mL/100 g),腹主动脉取血,3500 r/min离心10 min,取上层血清,分装,冻存于−80 ℃冰箱中,待用。分离大鼠各脏器并称重,计算脏器指数。
1.2.3 指标观察与检测
1.2.3.1 一般形态学观察
自造模开始后,密切观察大鼠的毛色情况、精神状态、呼吸情况及存活情况。并记录第0、7、13、21、30 d体重。
1.2.3.2 生化指标测定
按照试剂盒说明书,进行大鼠血清羟脯氨酸(Hyp)、超氧化物歧化酶(SOD)、过氧化脂质(LPO)的测定。
1.2.3.3 1H NMR代谢组学检测及图谱处理分析
血清样品在冰水中解冻,精密吸取450 μL置于EP管中,加入350 μL D2O,涡旋30 s,于4 ℃、13000 r/min离心20 min,取上清液600 μL转移至5 mm核磁管中,以布鲁克公司600 MHz核磁仪进行核磁分析[14]。血清样品采用Carr-Purcell-Meiboom Gill(CPMG)脉冲序列,测定频率600.13 MHz,扫描次数为64,其他具体参数设置为:谱宽12019.2 Hz,采样时间2.7263 s,弛豫时间1.0 s,采样数据点65536。通过MestReNova(version 6.1.0,Mestrelab Research,Santiago de Compostella,Spain)软件对图谱以肌酐的化学位移δ3.04定标,调整基线、相位。根据HMDB(the Human Metabolome Database,http://www.hmdb.ca/)和BMRB(Biological Magnetic Resonance Data Bank,http://www.bmrb.wisc.edu/)数据库以及文献[15-17]中的化学位移、偶合常数、峰型等数据对图谱进行化合物结构鉴定。
核磁图谱以0.01为步长对δ 0.60~δ 9.00分段积分,同时去除血清图谱中残余水峰(δ 4.56~δ 5.00),得到各组核磁积分数据,将数据归一化后导入SIMCA-P14.1(Umetrics,Sweden)软件,首先进行PCA分析(Principal Component Analysis,主成分分析),判断各样品的聚集情况以及是否有异常点存在;然后采用PLS-DA(Partial Least Squares Discriminant Analysis,偏最小二乘法判别分析)对模型进行验证,判断模型是否成立;最后用OPLS-DA(Orthogonal PLS-DA,正交偏最小二乘法判别分析)对各样品进行分类后,通过S-plot图及VIP值>1筛选对分类有显著贡献的变量,即样品间潜在的差异代谢物。选择化合物在1H NMR图谱中信号未完全重叠区域作为特征位移,对积分面积归一化后的数据进行单变量分析,将结果导入GraphPad Prism 6.01软件中作柱状图。
为进一步定量比较不同处理组的药效强弱,本研究引入药效指数EI(Efficacy index)[18-19],其计算方式如下:
EI=∑ni=1|Xi−MiMi−Ci|×100 式中:Ci表示某一代谢物在空白组(K组)中相对含量的平均值;Mi表示相应代谢物在模型组(M组)中相对含量的平均值;Xi表示此代谢物在不同给药组中相对含量的平均值。
1.3 数据处理
所有数据采用SPSS21.0进行分析,两组数据对比,符合正态分布采用t检验;非正态分布采用非参数(Mann-Whitney U)检验。数据以
ˉx ±s表示,P<0.05表示有显著性差异,P<0.01则表示极显著性差异。2. 结果与分析
2.1 一般形态学观察
随着造模时间的延长,除空白组外,其余各组大鼠开始出现背部皮毛发黄、粗燥、极不顺滑、松弛且无光泽;反应较迟缓,皮下注射及灌胃时抓捕的挣扎感不强;同时有拱背、眯眼、扎堆现象。随着给药时间增加,发现黄刺玫中、高剂量组在给药第3~4周对大鼠的毛发及行为活动有所改善。
2.2 黄刺玫提取物对大鼠体重的影响
各组大鼠体重变化如下表1所示,随着造模和给药时间的延长,各组大鼠体重均有所增加。实验21 d后,与空白组相比,模型组大鼠体重显著降低(P<0.05),给予3个剂量的黄刺玫后,虽然大鼠体重变化无统计学差异(P>0.05),但与模型组大鼠相比均呈现升高趋势。
表 1 各组大鼠体重变化(n=12,ˉx ±s)Table 1. Changes of body weight of rats in each group (n=12,ˉx ±s)时间(d) K组(g) M组(g) D组(g) Z组(g) G组(g) 0 197.65±5.72 195.51±6.33 200.87±7.38 198.62±7.30 195.96±7.74 7 261.60±7.72 255.84±8.19 263.45±12.21 261.08±11.74 262.11±9.29 13 320.93±8.99 310.78±16.86 324.50±17.88 319.06±21.26 323.56±14.92 21 371.78±14.44 355.73±20.48* 374.98±25.72 359.84±27.28 369.23±17.94 30 425.39±20.62 403.82±27.00* 422.42±30.65 412.38±29.20 420.30±26.51 注:与空白组相比,*P<0.05。 2.3 大鼠血清生化指标分析
大鼠血清生化指标分析结果如图1与表2所示。SOD是机体中重要的抗氧化酶,能减少具有毒性的羟基自由基产生,保护细胞和组织[20]。与空白组相比,模型组大鼠血清SOD活性极显著降低(P<0.01);与模型组相比,黄刺玫提取物中、高剂量组可极显著提升大鼠血清SOD水平(P<0.01),但低剂量组与模型组之间无显著性差异(P>0.05)。自由基是一类具有高度活性的物质,可使核酸蛋白变性,氧化体内不饱和脂肪酸形成LPO,从而对生物膜、中枢神经等产生损害作用,自由基引起的损害不断积累,导致生物体逐渐衰老[21-22]。与空白组相比,模型组大鼠血清LPO水平极显著升高(P<0.01);与模型组相比,3个剂量黄刺玫给药组均可显著降低LPO水平(P<0.05,P<0.01)。羟脯氨酸是胶原蛋白中的特异性氨基酸,是合成胶原蛋白的重要前体材料,胶原蛋白能维持机体正常生活状态以及年轻态[23]。与空白组相比,模型组大鼠血清Hyp含量极显著降低(P<0.01);与模型组相比,黄刺玫提取物中、高剂量组可极显著升高大鼠血清Hyp水平(P<0.01),而低剂量组与模型组相比无显著性差异(P>0.05)。综上,推测黄刺玫中高剂量组可能通过减少自由基产生或由自由基引发的反应,及促进胶原蛋白合成来减缓衰老。
表 2 各组大鼠血清中SOD、LPO、Hyp含量(n=12,ˉx ±s)Table 2. Contents of SOD, LPO and Hyp in rat serum (n=12,ˉx ±s)分组 SOD(U/mL) LPO(nmol/mL) Hyp(ng/mL) K组 2.18±0.23 15.20±1.54 202.38±18.33 M组 1.60±0.15** 19.12±1.71** 147.07±8.91** D组 1.76±0.20 17.44±1.74# 158.53±12.99 Z组 1.84±0.19## 16.84±2.14## 181.06±15.74## G组 1.98±0.24## 15.70±1.63## 175.41±19.08## 注:与空白组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。 2.4 代谢组学分析
2.4.1 大鼠血清1 H NMR图谱的指认分析
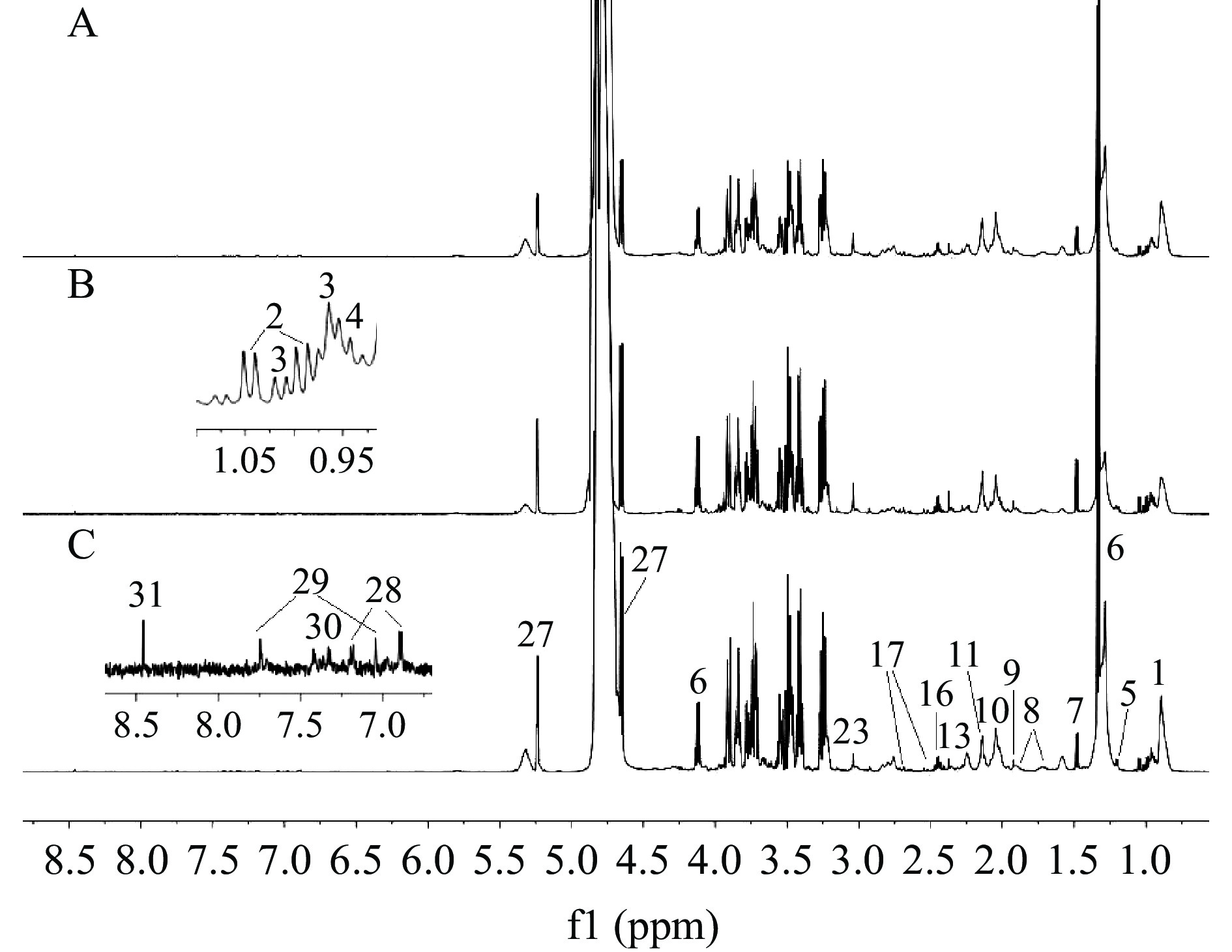
空白组、模型组及高剂量组大鼠血清的核磁图谱如图1,共指认出氨基酸、有机酸、碳水化合物等31种内源性化合物(表3)。
表 3 大鼠血清1 H NMR图谱主要代谢物指认结果Table 3. Identification of main metabolites in rat serum from 1H NMR spectrum编号 代谢物 化学位移a 1 脂质片段 0.89(m), 1.28(m), 2.76(m), 5.32(m) 2 valine 0.99(d, 6.9Hz), 1.04(d, 6.9Hz) 3 isoleucine 0.94(t, 7.2Hz), 1.01(d, 7.2Hz) 4 leucine 0.96(d, 6.6Hz), 0.97(d, 6.6Hz) 5 3-hydroxybutyrate 1.20(d, 6.0Hz) 6 lactate 1.33(d, 6.6Hz), 4.12(q, 6.6Hz) 7 alanine 1.48(d, 7.2Hz) 8 arginine 1.90(m), 1.73(m), 1.58(m) 9 acetate 1.92(s) 10 NAGb 2.04(s) 11 OAGb 2.14(s) 12 acetoacetate 2.28(s) 13 pyruvate 2.37(s) 14 succinate 2.41(s) 15 glutamate 2.06(m), 2.35(m) 16 glutamine 2.14(m), 2.44(m) 17 citrate 2.53(d, 15.9Hz), 2.70(d, 15.9Hz) 18 dimethylglycine 2.92(s) 19 choline 3.20(s) 20 PCb 3.22(s) 21 GPCb 3.21(s) 22 TMAOb 3.28(s) 23 creatine 3.04(s), 3.94(s) 24 glycerol 3.66(dd, 4.2Hz, 11.4Hz), 3.59(dd, 4.8Hz, 11.4Hz) 25 scyllo-inositol 3.35(s) 26 glycine 3.56(s) 27 glucose 5.24(d, 3.6Hz), 4.65(d, 8.4Hz) 28 tyrosine 6.89(d, 7.8Hz), 7.19(d, 7.8Hz) 29 histidine 7.75(s), 7.04(s) 30 phenylalanine 7.32(m), 7.37(m), 7.42(m) 31 formate 8.46(s) 注:a. s:singlet,d:doublet,t:triplet,q:quartet,m:multiplet,dd:doublet of doublet。b. NAG:N-乙酰糖蛋白;OAG:O-乙酰糖蛋白;PC:磷脂酰胆碱;GPC:甘油磷酰胆碱;TMAO:氧化三甲胺。 2.4.2 差异代谢物分析
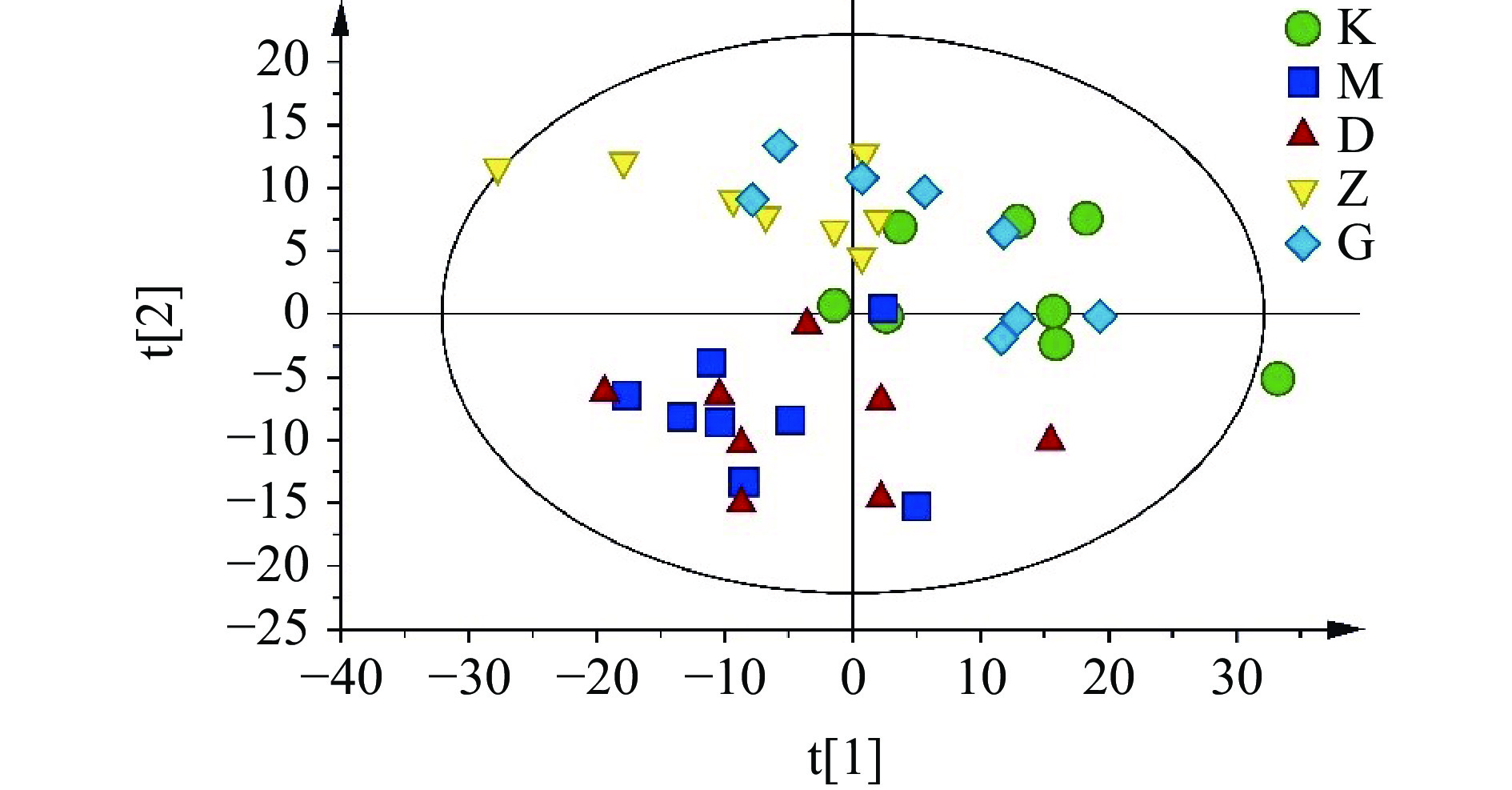
由于直观分析NMR图谱很难看出各组之间血清代谢谱的差异,因此借助多元统计分析进一步比较。首先进行非监督模式的PCA分析(图2),图中每一种颜色代表一个组别,每一个点代表一个样本,可以看出空白组与模型组明显分离,表明D-半乳糖诱导亚急性衰老模型复制成功;低剂量组接近模型组,而中、高剂量组更接近正常组,提示黄刺玫提取物对血清内源性代谢物具有明显回调作用。
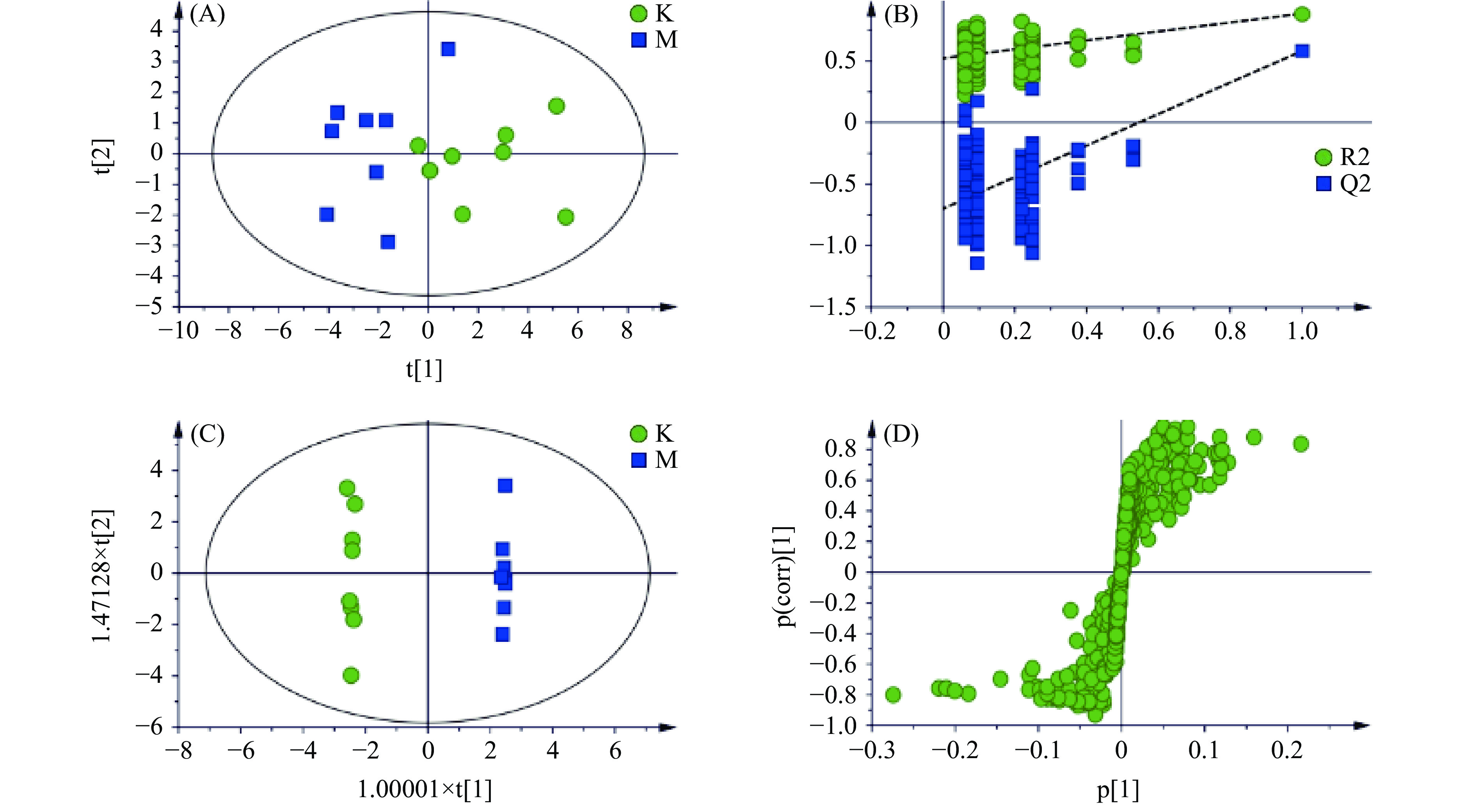
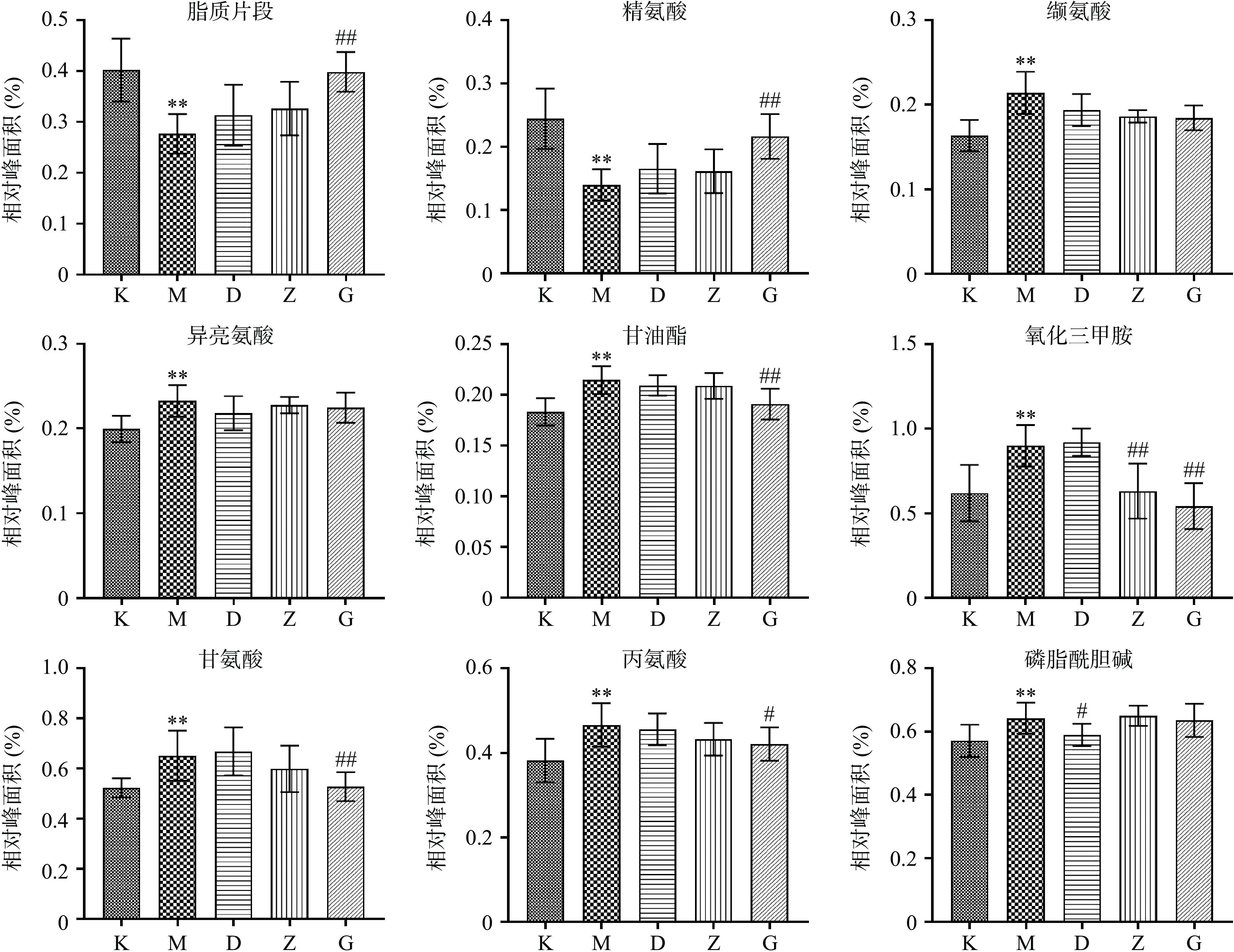
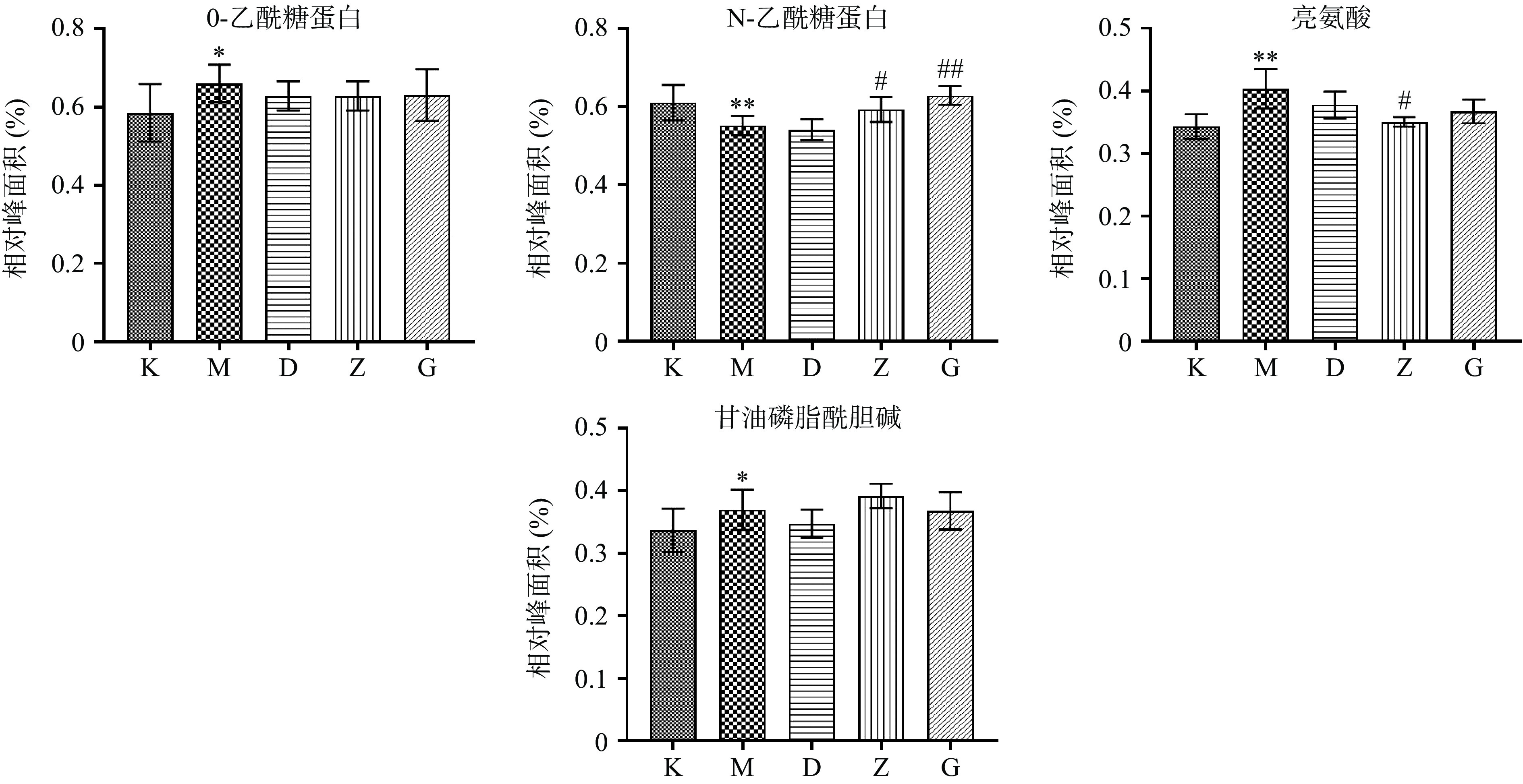
进一步分析模型组与空白组之间的代谢差异,首先采用PCA分析(图3A)观察两组样本的分离趋势,可以看出模型组与空白组明显分离;有监督的PLS-DA模型的排列实验表明随机变量y产生的R2、Q2均小于原始值(其中,R2和Q2值分别表示对数据的解释程度和对模型的预测能力)证明模型有效可靠(图3B);最后通过有监督的OPLS-DA分析模型(图3C)及其S-plot图(图3D)确定两组之间的差异代谢物。S-plot图每个点表示一个核磁数据,离原点越远表示该数据对样本的分组贡献越大。通过S-plot图,结合VIP值>1及t检验(P<0.05),共得到空白组与模型组之间显著性变化的13个差异代谢物,与空白组相比,模型组中的缬氨酸、异亮氨酸、甘油酯、氧化三甲胺、甘氨酸、丙氨酸、磷脂酰胆碱、O-乙酰糖蛋白、亮氨酸、甘油磷酰胆碱显著(P<0.05,P<0.01)升高,脂质片段、精氨酸、N-乙酰糖蛋白显著降低。差异代谢物在各组中的相对含量见图4,其中低剂量组显著(P<0.05,P<0.01)回调1个,中剂量组显著(P<0.05,P<0.01)回调3个,高剂量组显著(P<0.05,P<0.01)回调7个。从差异代谢物回调的代谢物数目可以看出,高剂量组调节的个数最多,表明黄刺玫高剂量组的抗衰老效果最优,与前期生化指标的结果相一致。
EI指数的计算结果见下表4,EI指数越大,表明药物抗衰老效果越好,可知黄刺玫提取物低、中、高剂量组的EI值分别为394.61、526.75、845.90,表明高剂量组抗衰老效果最佳。
表 4 差异代谢物在各组含量均值以及药效指数统计结果Table 4. Mean contents of different metabolites and efficacy index in each group物质 相对峰面积(×100) 回调率(%) K组 M组 D组 Z组 G组 D组 Z组 G组 脂质片段 40.15 27.64 31.30 32.58 39.78 29.25 39.52 97.03** 精氨酸 24.42 14.00 16.55 16.15 21.64 24.51 20.61 73.27** 缬氨酸 16.35 21.40 19.36 18.61 18.44 40.34 55.14 58.53 异亮氨酸 19.95 23.26 21.79 22.74 22.45 44.35 15.46 24.35 甘油脂 18.33 21.44 20.92 20.88 19.08 16.84 18.11 75.76** TMAO 61.98 89.98 92.05 63.15 54.31 − 95.86** 127.41** 甘氨酸 52.23 65.07 66.77 59.82 52.72 − 40.89 96.15* 丙氨酸 38.23 46.62 45.60 43.23 42.10 12.22 40.37 53.87* PC 57.07 64.20 58.96 64.96 63.51 73.51* − 9.70 OAG 58.53 66.05 62.87 62.87 63.06 42.35 42.35 39.82 NAG 61.07 55.17 54.12 59.30 62.83 − 70.04* 129.75** 亮氨酸 34.33 40.34 37.75 35.03 36.72 43.01 88.42* 60.24 GPC 33.68 36.95 34.71 39.17 36.76 68.25 − − EI指数 394.61 526.75 845.90 注:与模型组相比,*P<0.05,**P<0.01。 2.4.3 生化指标与差异代谢物相关分析
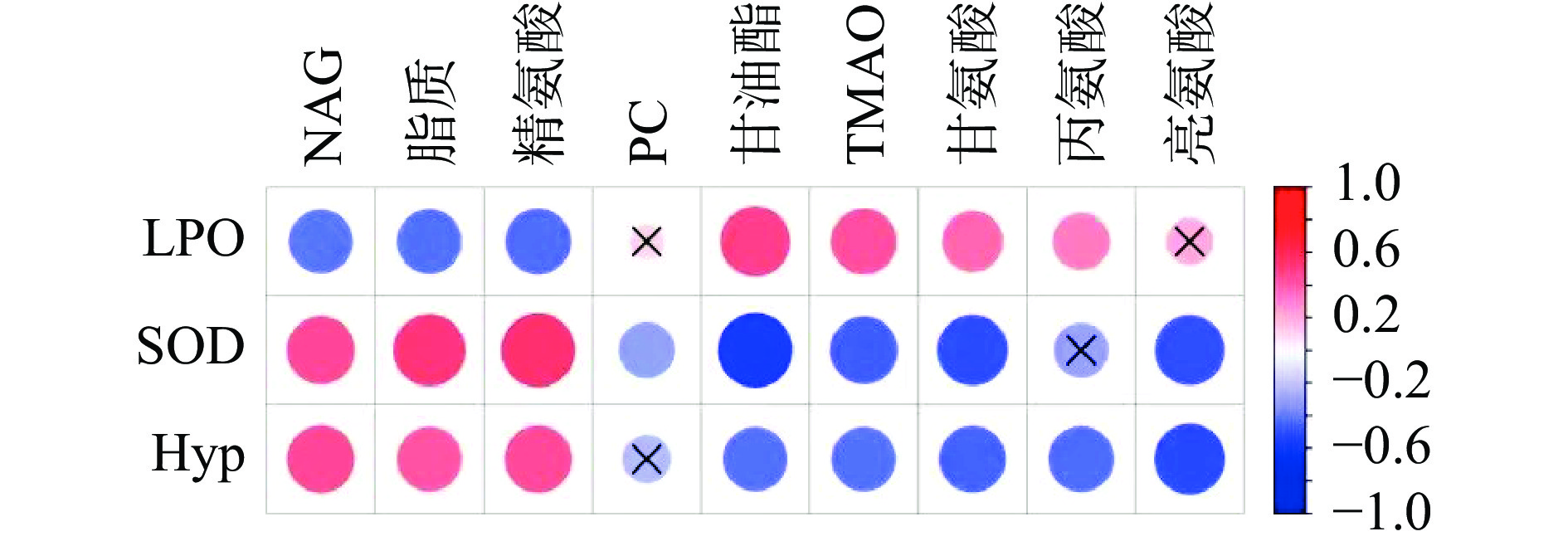
将SOD、LPO、Hyp三个血清生化指标测定结果与黄刺玫显著调节的9个差异代谢物进行Pearson相关分析,结果如图5所示,共存在27种代谢物-生化指标相关对,除LPO与PC、LPO与亮氨酸、SOD与丙氨酸、Hyp与PC之间的相关外,其余相关均具有显著性(P<0.05)。NAG、脂质、精氨酸与三个生化指标相关趋势一致,PC、甘油、TMAO、甘氨酸、丙氨酸及亮氨酸与三个生化指标相关趋势一致。以上结果显示,黄刺玫调节的差异代谢物与生化指标之间相互关联、相互影响。但是,代谢物与生化指标的相关仅为数学相关,其内在的生物学机制尚未有文献报道,还需进一步的实验验证。
2.4.4 代谢通路分析
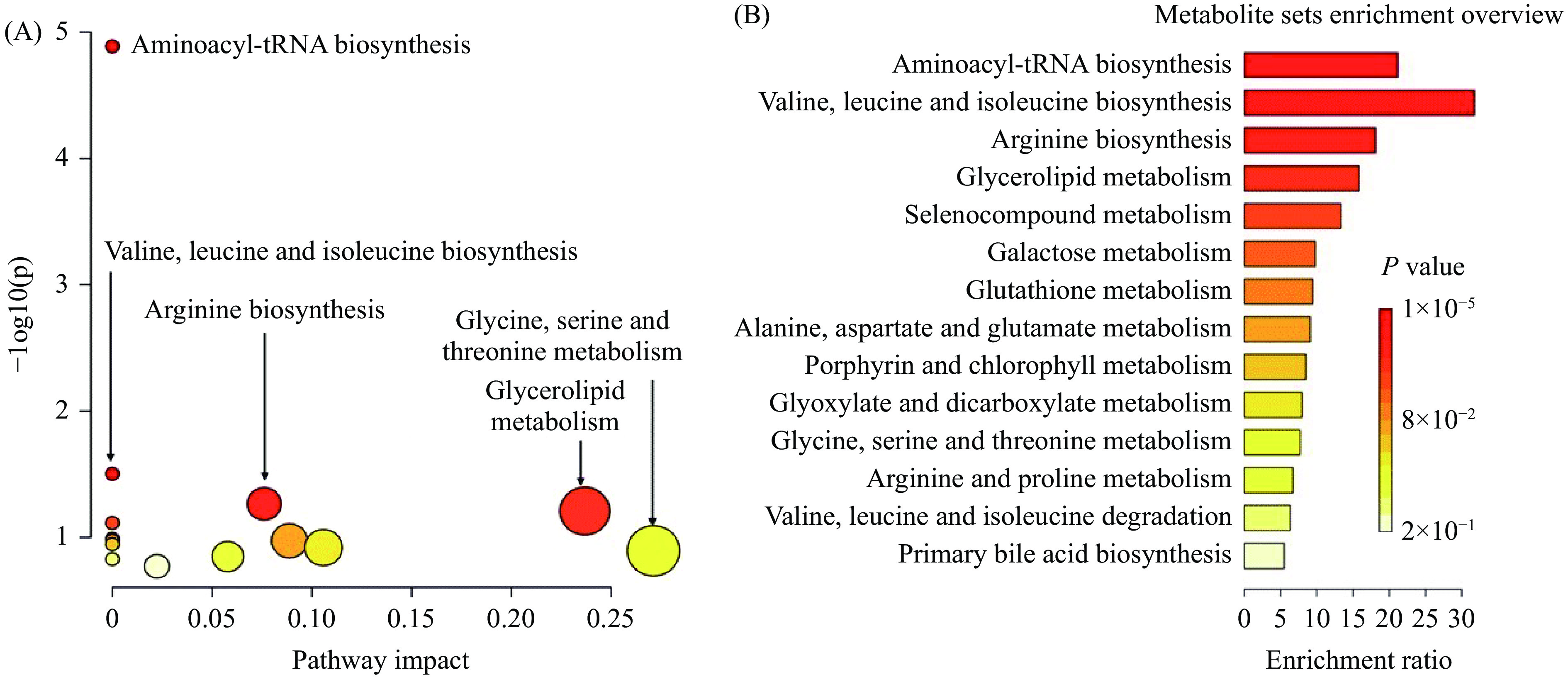
将上表中黄刺玫显著回调的9种差异代谢物输入metaboanalyst网站中进行MetPA分析,结果见图6A所示,圆点颜色越深表示参与此通路的代谢物越多,圆点越大表明此代谢通路在机体代谢中的占比较大,作用越明显;通路富集分析结果见图6B,其中富集倍数越大说明参与此条通路的代谢物越多,P值越大(颜色越深),表示此代谢通路发生的变化越明显。通路富集分析结果与MetPA分析一致,可知黄刺玫果实通过调节多种代谢途径来发挥抗衰老作用。
精氨酸是体内的一种非必需氨基酸,在体内一氧化氮合酶(NOS)的作用下生成瓜氨酸(citrulline)和NO。有研究表明,精氨酸能够有效增强NOS的活性,激活PI3K/Akt/eNOS通路,提高细胞内NO含量,从而缓解高糖诱导的衰老表型[24]。本研究中,模型组大鼠血清中精氨酸含量显著降低,给予黄刺玫提取物后血清中精氨酸含量增加,推测黄刺玫提取物可能通过调节精氨酸NO代谢通路发挥抗衰老作用。支链氨基酸(BCAAs)属于体内的必需氨基酸,主要通过哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)关键靶点调控多种信号通路,从而影响蛋白质的合成与分解[25]。文献报道,减少支链氨基酸的摄入,能够延长寿命,减缓衰老进程[26]。本研究与空白组比较,模型组中的缬氨酸,亮氨酸,异亮氨酸含量均极显著(P<0.01)上升,给药后亮氨酸显著降低(P<0.05),缬氨酸和异亮氨酸呈下降趋势(P>0.05),推测黄刺玫可能通过降低支链氨基酸的水平延缓衰老。氧化三甲胺(Trimethylamine N-oxide,TMAO)是一种肠源性菌群代谢产物,与心血管系统疾病密切相关[27],已有研究表明,TMAO可以诱导小鼠脑衰老和认知功能障碍[28],通过调节氧化应激,激活p53-p21-Rb途径使内皮细胞衰老,导致血管老化[29]。相较于空白组,模型组中TMAO含量水平增加,给药后TMAO含量水平下降。推测黄刺玫能够调节肠道菌群相关的代谢物发挥抗衰老作用。
本研究中MetPA及通路富集分析均得到甘氨酸、丝氨酸和苏氨酸代谢。已有研究通过多组学技术表明,甘氨酸、丝氨酸和苏氨酸代谢为与衰老和寿命密切相关的关键代谢轴,相关联其他多种通路,如叶酸循环、甲硫氨酸循环、转硫作用等,主要参与细胞代谢及机体的保护、修复[30]。本研究给予黄刺玫后甘氨酸水平降低,推测黄刺玫可能通过调节甘氨酸、丝氨酸和苏氨酸代谢轴发挥抗衰老作用。
3. 结论
本研究采用D-半乳糖诱导亚急性衰老大鼠模型,结果表明,黄刺玫提取物可以升高SOD、Hyp,降低LPO水平,可能通过调节氧化应激及促进胶原蛋白合成来发挥抗衰老作用。血清1H NMR代谢组学表明,黄刺玫主要通过调节氨基酸代谢及肠道代谢物TMAO等来发挥抗衰老作用,其延缓衰老的作用具有多环节、多层次、多靶点综合作用的特点。然而,黄刺玫对氨基酸及相关通路的调节,涉及到的关键蛋白靶点还需要通过Western blot、RT-PCR等技术进一步验证;此外,黄刺玫对肠道菌群及肠道代谢物的具体调节作用及机制需要通过16s rRNA或宏基因组测序技术进一步分析。
-
表 1 各组大鼠体重变化(n=12,
Table 1 Changes of body weight of rats in each group (n=12,
时间(d) K组(g) M组(g) D组(g) Z组(g) G组(g) 0 197.65±5.72 195.51±6.33 200.87±7.38 198.62±7.30 195.96±7.74 7 261.60±7.72 255.84±8.19 263.45±12.21 261.08±11.74 262.11±9.29 13 320.93±8.99 310.78±16.86 324.50±17.88 319.06±21.26 323.56±14.92 21 371.78±14.44 355.73±20.48* 374.98±25.72 359.84±27.28 369.23±17.94 30 425.39±20.62 403.82±27.00* 422.42±30.65 412.38±29.20 420.30±26.51 注:与空白组相比,*P<0.05。 表 2 各组大鼠血清中SOD、LPO、Hyp含量(n=12,
Table 2 Contents of SOD, LPO and Hyp in rat serum (n=12,
分组 SOD(U/mL) LPO(nmol/mL) Hyp(ng/mL) K组 2.18±0.23 15.20±1.54 202.38±18.33 M组 1.60±0.15** 19.12±1.71** 147.07±8.91** D组 1.76±0.20 17.44±1.74# 158.53±12.99 Z组 1.84±0.19## 16.84±2.14## 181.06±15.74## G组 1.98±0.24## 15.70±1.63## 175.41±19.08## 注:与空白组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。 表 3 大鼠血清1 H NMR图谱主要代谢物指认结果
Table 3 Identification of main metabolites in rat serum from 1H NMR spectrum
编号 代谢物 化学位移a 1 脂质片段 0.89(m), 1.28(m), 2.76(m), 5.32(m) 2 valine 0.99(d, 6.9Hz), 1.04(d, 6.9Hz) 3 isoleucine 0.94(t, 7.2Hz), 1.01(d, 7.2Hz) 4 leucine 0.96(d, 6.6Hz), 0.97(d, 6.6Hz) 5 3-hydroxybutyrate 1.20(d, 6.0Hz) 6 lactate 1.33(d, 6.6Hz), 4.12(q, 6.6Hz) 7 alanine 1.48(d, 7.2Hz) 8 arginine 1.90(m), 1.73(m), 1.58(m) 9 acetate 1.92(s) 10 NAGb 2.04(s) 11 OAGb 2.14(s) 12 acetoacetate 2.28(s) 13 pyruvate 2.37(s) 14 succinate 2.41(s) 15 glutamate 2.06(m), 2.35(m) 16 glutamine 2.14(m), 2.44(m) 17 citrate 2.53(d, 15.9Hz), 2.70(d, 15.9Hz) 18 dimethylglycine 2.92(s) 19 choline 3.20(s) 20 PCb 3.22(s) 21 GPCb 3.21(s) 22 TMAOb 3.28(s) 23 creatine 3.04(s), 3.94(s) 24 glycerol 3.66(dd, 4.2Hz, 11.4Hz), 3.59(dd, 4.8Hz, 11.4Hz) 25 scyllo-inositol 3.35(s) 26 glycine 3.56(s) 27 glucose 5.24(d, 3.6Hz), 4.65(d, 8.4Hz) 28 tyrosine 6.89(d, 7.8Hz), 7.19(d, 7.8Hz) 29 histidine 7.75(s), 7.04(s) 30 phenylalanine 7.32(m), 7.37(m), 7.42(m) 31 formate 8.46(s) 注:a. s:singlet,d:doublet,t:triplet,q:quartet,m:multiplet,dd:doublet of doublet。b. NAG:N-乙酰糖蛋白;OAG:O-乙酰糖蛋白;PC:磷脂酰胆碱;GPC:甘油磷酰胆碱;TMAO:氧化三甲胺。 表 4 差异代谢物在各组含量均值以及药效指数统计结果
Table 4 Mean contents of different metabolites and efficacy index in each group
物质 相对峰面积(×100) 回调率(%) K组 M组 D组 Z组 G组 D组 Z组 G组 脂质片段 40.15 27.64 31.30 32.58 39.78 29.25 39.52 97.03** 精氨酸 24.42 14.00 16.55 16.15 21.64 24.51 20.61 73.27** 缬氨酸 16.35 21.40 19.36 18.61 18.44 40.34 55.14 58.53 异亮氨酸 19.95 23.26 21.79 22.74 22.45 44.35 15.46 24.35 甘油脂 18.33 21.44 20.92 20.88 19.08 16.84 18.11 75.76** TMAO 61.98 89.98 92.05 63.15 54.31 − 95.86** 127.41** 甘氨酸 52.23 65.07 66.77 59.82 52.72 − 40.89 96.15* 丙氨酸 38.23 46.62 45.60 43.23 42.10 12.22 40.37 53.87* PC 57.07 64.20 58.96 64.96 63.51 73.51* − 9.70 OAG 58.53 66.05 62.87 62.87 63.06 42.35 42.35 39.82 NAG 61.07 55.17 54.12 59.30 62.83 − 70.04* 129.75** 亮氨酸 34.33 40.34 37.75 35.03 36.72 43.01 88.42* 60.24 GPC 33.68 36.95 34.71 39.17 36.76 68.25 − − EI指数 394.61 526.75 845.90 注:与模型组相比,*P<0.05,**P<0.01。 -
[1] 山西植物志编委会. 山西植物志[M]. 北京: 中国科学技术出版社, 1998 ( 4 ) : 335−337 Editorial Committee of Shanxi Flora. Flora Shanxiensis[M]. Beijing: China Science and Technology Press, 1998 ( 4 ) : 335−337.
[2] 王晓燕, 李雪琴. 应县野生刺玫果营养成分分析及评价[J]. 科技情报开发与经济,2004,14(5):140−141. [WANG X Y, LI X Q. Analysis and evaluation on the nutritional ingredients of wild rose hip[J]. Sci-Tech Information Development & Economy,2004,14(5):140−141. WANG X Y, LI X Q. Analysis and evaluation on the nutritional ingredients of wild rose hip[J]. Sci-Tech Information Development & Economy, 2004, 14(5): 140-141.
[3] 任婧, 王晓燕, 宋高林, 等. 响应面法优化黄刺玫果总黄酮索氏提取工艺[J]. 食品工业,2021,42(4):30−33. [REN J, WANG X Y, SONG G L, et al. Optimization for soxhlet extraction of total flavonoids from Rosa xanthina Lindl. fruit by response surface methodology[J]. The Food Industry,2021,42(4):30−33. REN J, WANG X Y, SONG G L, et al. Optimization for soxhlet extraction of total flavonoids from Rosa xanthina Lindl. fruit by response surface methodology[J]. The Food Industry, 2021, 42(4): 30-33.
[4] 任婧, 王进东, 柴秋彦, 等. 黄刺玫果实醇提物抗血栓作用及其机制研究[J]. 山西医科大学学报,2017,48(6):539−542. [REN J, WANG J D, CHAI Q Y, et al. Study on antithrombotic effects of Rosa xanthina Lindl. fruit and its mechanism[J]. Journal of Shanxi Medical University,2017,48(6):539−542. REN J, WANG J D, CHAI Q Y, et al. Study on antithrombotic effects of Rosa xanthina Lindl. fruit and its mechanism[J]. Journal of Shanxi Medical University, 2017, 48(6): 539-542.
[5] 任婧, 杨官娥, 柴秋彦, 等. 黄刺玫果提取物体外抗氧化活性研究[J]. 食品研究与开发,2017,38(18):11−15. [REN J, YANG G E, CHAI Q Y, et al. Study on the antioxidant activity of extract of Rose xanthina Lindl. fruit in vitro[J]. Food Research and Development,2017,38(18):11−15. REN J, YANG G E, CHAI Q Y, et al. Study on the antioxidant activity of extract of Rose xanthina Lindl. fruit in vitro[J]. Food Research and Development, 2017, 38(18): 11-15.
[6] 王常青, 张义贤. 黄刺玫果汁抗衰老作用的实验研究[J]. 中国老年学杂志,1996,16(1):30−31,64. [WANG C Q, ZHANG Y X. Antiaging action of Rose xanthina Lindl. juice[J]. Chinese Journal of Gerontology,1996,16(1):30−31,64. WANG C Q, ZHANG Y X. Antiaging action of Rose xanthina Lindl. juice[J]. Chinese Journal of Gerontology, 1996, 16(1): 30-31, 64.
[7] AGRAWAL N, LAWLER K, DAVIDSON C M, et al. Predicting novel candidate human obesity genes and their site of action by systematic functional screening in drosophila[J]. PLoS Biol,2021,19(11):e3001255. doi: 10.1371/journal.pbio.3001255
[8] 王珂欣, 高丽, 段丹丹, 等. 基于1H-NMR代谢组学的黄芩素干预D-半乳糖致衰老大鼠作用研究[J]. 中草药,2017,48(3):511−518. [WANG K X, GAO L, DUAN D D, et al. Effects of baicalein on D-galactose-induced aging rats based on 1H-NMR metabonomics[J]. Chinese Traditional and Herbal Drugs,2017,48(3):511−518. WANG K X, GAO L, DUAN D D, et al. Effects of baicalein on D-galactose-induced aging rats based on 1H-NMR metabonomics[J]. Chinese Traditional and Herbal Drugs, 2017, 48(3): 511-518.
[9] 刘彩春, 刘欢, 谷陟欣, 等. 基于1H-NMR代谢组学的驴胶补血颗粒补血作用机制研究[J]. 中草药,2016,47(7):1142−1148. [LIU C C, LIU H, GU Z X, et al. Mechanisms of tonifying blood with Lvjiao Buxue Granules studied by 1H-NMR metabolomics[J]. Chinese Traditional and Herbal Drugs,2016,47(7):1142−1148. LIU C C, LIU H, GU Z X, et al. Mechanisms of tonifying blood with Lvjiao Buxue Granules studied by 1H-NMR metabolomics[J]. Chinese Traditional and Herbal Drugs, 2016, 47(7): 1142-1148.
[10] 贾岩, 赵思俊, 秦雪梅, 等. 苦荞水提取物对糖尿病模型大鼠降糖作用的代谢组学研究[J]. 营养学报,2017,39(2):177−182. [JIA Y, ZHAO S J, QIN X M, et al. Hypoglycemic effect of tartarian buckwheat water extracts in diabetic rats by metabolomics approach[J]. Acta Nutrimenta Sinica,2017,39(2):177−182. doi: 10.3969/j.issn.0512-7955.2017.02.014 JIA Y, ZHAO S J, QIN X M, et al. Hypoglycemic effect of tartarian buckwheat water extracts in diabetic rats by metabolomics approach[J]. Acta Nutrimenta Sinica, 2017, 39(2): 177-182. doi: 10.3969/j.issn.0512-7955.2017.02.014
[11] LI Z Y, HE P, SUN H F, et al. 1H NMR based metabolomic study of the antifatigue effect of Astragali radix[J]. Mol Biosyst,2014,10(11):3022−3030. doi: 10.1039/C4MB00370E
[12] 叶松华, 王晓燕, 杨莹莹, 等. 黄刺玫果中总黄酮的提取工艺研究[J]. 山西医科大学学报,2013,44(7):535−538. [YE S H, WANG X Y, YANG Y Y, et al. Study on extraction process of flavonoids from fruit of Rosa xanthina Lindl doi: 10.3969/J.ISSN.1007-6611.2013.07.008 J]. Journal of Shanxi Medical University,2013,44(7):535−538. doi: 10.3969/J.ISSN.1007-6611.2013.07.008
[13] 陈宁园. 火麻仁提取液对D-半乳糖致衰老大鼠空间学习和记忆的干预作用及其机制研究[D]. 南宁: 广西医科大学, 2017 CHEN N Y. Effect of extract of Fructus Cannabis on spatial learning and memory in an aging rats model induced by D-galactose and its mechanism[D]. Nanning: Guangxi Medical University, 2017.
[14] ZHAO S J, LIU X J, TIAN J S, et al. Effects of Guilingji on aging rats and its underlying mechanisms[J]. Rejuvenation Res,2020,23(2):138−149. doi: 10.1089/rej.2018.2118
[15] WANG K X, DU G H, QIN X M, et al. Compound Kushen injection intervenes metabolic reprogramming and epithelial-mesenchymal transition of HCC via regulating β-catenin/c-Myc signaling[J]. Phytomedicine,2021,93:153781. doi: 10.1016/j.phymed.2021.153781
[16] FENG Q, TONG L, LU Q, et al. 1H NMR serum metabolomics and its endogenous network pharmacological analysis of Gushudan on kidney-yang-deficiency-syndrome rats[J]. Anal Biochem,2022,643:114580. doi: 10.1016/j.ab.2022.114580
[17] LI Z, LI J, ZHANG Z, et al. NMR-based metabolomic analyses for the componential differences and the corresponding metabolic responses of three batches of Farfarae Flos[J]. Chemometrics and Intelligent Laboratory Systems,2017,165:1−10. doi: 10.1016/j.chemolab.2017.03.010
[18] XING J, SUN H M, JIA J P, et al. Integrative hepatoprotective efficacy comparison of raw and vinegar-baked Radix Bupleuri using nuclear magnetic resonance-based metabolomics[J]. J Pharm Biomed Anal,2017,138:215−222. doi: 10.1016/j.jpba.2017.02.015
[19] ZHANG Z Z, FAN M L, HAO X, et al. Integrative drug efficacy assessment of Danggui and European Danggui using NMR-based metabolomics[J]. J Pharm Biomed Anal,2016,120:1−9. doi: 10.1016/j.jpba.2015.12.001
[20] 朱秀敏. 超氧化物歧化酶的生理活性[J]. 当代医学,2011,17(15):26−27. [ZHU X M. Physiological activity of superoxide dismutase[J]. Contemporary Medicine,2011,17(15):26−27. doi: 10.3969/j.issn.1009-4393.2011.15.017 ZHU X M. Physiological activity of superoxide dismutase[J]. Contemporary Medicine, 2011, 17(15): 26-27. doi: 10.3969/j.issn.1009-4393.2011.15.017
[21] AL-HARBI LN, PANDURANGAN SB, AL-DOSSARI AM, et al. Beta vulgaris rubra L. (Beetroot) peel methanol extract reduces oxidative stress and stimulates cell proliferation via increasing VEGF expression in H2O2 induced oxidative stressed human umbilical vein endothelial cells[J]. Genes (Basel),2021,12(9):1380. doi: 10.3390/genes12091380
[22] 梁光宇, 赵树森. 益寿还童丹对大鼠血清睾酮、过氧化脂质、超氧化物歧化酶的影响[J]. 中国中医急症,2008(7):967−968. [LIANG G Y, ZHAO S S. The effect of Yishouhuantongdan on T, SOD, LPO in rats[J]. Journal of Emergency in Traditional Chinese Medicine,2008(7):967−968. doi: 10.3969/j.issn.1004-745X.2008.07.050 LIANG G Y, ZHAO S S. The effect of Yishouhuantongdan on T, SOD, LPO in rats[J]. Journal of Emergency in Traditional Chinese Medicine, 2008(7): 967-968. doi: 10.3969/j.issn.1004-745X.2008.07.050
[23] 张英杰, 刘岩, 路芳, 等. 益胃汤延缓初老雌性SD大鼠皮肤衰老的研究[J]. 中医学报,2019,34(7):1483−1487. [ZHANG Y J, LIU Y, LU F, et al. Study of Yiwei decoction on delaying skin aging in aging female SD rats[J]. Acta Chinese Medicine,2019,34(7):1483−1487. doi: 10.16368/j.issn.1674-8999.2019.07.351 ZHANG Y J, LIU Y, LU F, et al. Study of Yiwei decoction on delaying skin aging in aging female SD rats[J]. Acta Chinese Medicine, 2019, 34(7): 1483-1487. doi: 10.16368/j.issn.1674-8999.2019.07.351
[24] 邢姝丽. 氨基酸和部分糖类对细胞衰老的影响[D]. 上海: 华东理工大学, 2018 XING S L. The effects of amino acids and selected sugar on cellular senescence[D]. Shanghai: East China University of Science and Technology, 2018.
[25] LE COUTEUR DG, SOLON-BIET SM, COGGER VC, et al. Branched chain amino acids, aging and age-related health[J]. Ageing Res Rev,2020,64:101198. doi: 10.1016/j.arr.2020.101198
[26] RICHARDSON N E, KONON E N, SCHUSTER H S, et al. Lifelong restriction of dietary branched-chain amino acids has sex-specific benefits for frailty and lifespan in mice[J]. Nat Aging,2021,1(1):73−86. doi: 10.1038/s43587-020-00006-2
[27] ZHANG Y, WANG Y, KE B, et al. TMAO: How gut microbiota contributes to heart failure[J]. Transl Res,2021,228:109−125. doi: 10.1016/j.trsl.2020.08.007
[28] LI D, KE Y, ZHAN R, et al. Trimethylamine-N-oxide promotes brain aging and cognitive impairment in mice[J]. Aging Cell,2018,17(4):e12768. doi: 10.1111/acel.12768
[29] KE Y, LI D, ZHAO M, et al. Gut flora-dependent metabolite trimethylamine-N-oxide accelerates endothelial cell senescence and vascular aging through oxidative stress[J]. Free Radic Biol Med,2018,116:88−100. doi: 10.1016/j.freeradbiomed.2018.01.007
[30] AON M A, BERNIER M, MITCHELL S J, et al. Untangling determinants of enhanced health and lifespan through a multi-omics approach in mice[J]. Cell Metabolism,2020,32(1):100−116. doi: 10.1016/j.cmet.2020.04.018
-
期刊类型引用(1)
1. 陈磊,杨莹莹,连让平,但春凤,刘海江,李爱平,杨文彬. 基于核磁共振代谢组学揭示黄精通过调控苯丙氨酸、酪氨酸及色氨酸的生物合成发挥抗疲劳作用机制. 山西中医药大学学报. 2025(01): 27-34 .  百度学术
百度学术
其他类型引用(1)









 下载:
下载:


 下载:
下载:



