A Review of the Mechanism of Probiotics Controlling Obesity through Intestinal Flora
-
摘要: 肥胖是由于新陈代谢功能失调而引起的体内脂肪过量堆积,可能会导致机体动脉粥样硬化、胰岛素抵抗和血脂异常等各种代谢综合征的出现。肥胖是威胁现代社会健康与经济发展的一个重要因素,预防与治疗肥胖一直以来都是研究热点。目前,已经有一些肠道菌群抑制肥胖症的机制被报道。然而,由于肠道微生物组成的复杂性,哪一种微生物群落与肥胖直接相关仍然是有待研究的。本综述中,以肥胖患者肠道菌群结构组成的改变为切入点,进一步阐述肠道菌群的生理功能与肥胖发生机制的密切联系。对国内外相关研究进展归纳,总结得出益生菌可直接影响肥胖患者肠道中炎症细胞因子水平与代谢产物,或调节肠道菌群平衡达到重塑肥胖宿主代谢的目的。因此,采用益生菌与益生元治疗将成为预防与治疗肥胖的新方向。Abstract: Obesity is an abnormal accumulation of fat caused by metabolic dysfunction, which can lead to various metabolic syndromes such as atherosclerosis, insulin resistance, and dyslipidemia. Obesity threatens modern society's health and economic development and has always been a research focus. Currently, some mechanisms of intestinal flora inhibiting obesity have been reported. However, due to the complexities of intestinal microbial composition, it is unclear which microbial community is directly related to obesity. The structural changes of intestinal flora in obese patients are used as a starting point in this review to elaborate further on the close relationship between the physiological function of intestinal flora and the pathogenesis of obesity. Based on the summary of relevant research progress at home and abroad, it is concluded that probiotics can directly affect the level of inflammatory cytokines and metabolites in the intestine of obese patients, or regulate the balance of intestinal flora to reshape the metabolism of obese hosts. Thus, probiotics and prebiotics would become new avenues for preventing and treating obesity.
-
Keywords:
- probiotics /
- intestinal flora /
- obesity /
- fat /
- mechanism
-
近年来,全球的肥胖发生率呈直线上升趋势,其引发许多其他慢性非传染性疾病。糖尿病、心血管疾病、非酒精性脂肪性肝病以及多种癌症如乳腺癌、肝癌、胆囊癌、肾癌、前列腺癌等都是肥胖的并发疾病[1]。治疗肥胖及其相关慢性疾病的费用对社会带来经济负担,且肥胖人群劳动能力降低不利于社会经济发展[2]。大量的动物实验和人体试验研究表明,肠道微生物在机体代谢脂肪过程中起到重要作用,脂肪含量不同的机体其肠道菌群存在显著差异[3]。肠道菌群可以促进肥胖患者对营养物质的消化吸收,菌群在代谢过程中产生的活性物质可以调节脂肪和营养素代谢途径的基因表达过程,提升宿主在饮食中获取能量的能力从而维持宿主体内的能量平衡[4]。维持肠道菌群的平衡对控制肥胖具有重要意义,一些益生元和益生菌可以共同维护宿主的肠道菌群生态环境稳定,益生元包括低聚木糖、低聚果糖、抗性糊精等功能性低聚糖,其不能直接被宿主肠道直接吸收,但可以作为益生菌的发酵底物,促进益生菌的繁殖与代谢[5]。益生菌在协同作用下可通过增加神经递质和减少促炎细胞因子来缓解肥胖带来的慢性炎症[6]。然而,在肠道菌群中不同微生物之间及其与宿主间的相互作用等方面的认识还不够深入,在实际应用益生菌治疗肥胖仍然困难险阻。本综述主要是阐述了肠道菌群与肥胖的关系以及概述了益生菌如何调节肠道菌群来预防或治疗肥胖的机制,为益生菌更广泛地应用到预防和治疗肥胖及其相关疾病中提供参考。
1. 肠道菌群和肥胖
1.1 肠道菌群结构组成与肥胖
大量微生物定殖在人体肠道中,肠道中微生物组成为人类细菌种群的主要组成部分,已知种类已经有1000余种[7]。人类内源性肠道菌群在宿主消化、营养吸收、新陈代谢、免疫反应等生理过程中承担主要角色,被誉为先天免疫的重要“器官”[8]。作为调控人体健康的“第二基因组”,肠道微生物的组成特别复杂。但是人类肠道菌群在初生儿时期人类的肠道存在的菌群接近于零,肠道经过3年左右时间生长发育,肠道内环境微生物种类会趋于稳定,菌群数量超过100万亿个[9]。目前,已初步把肠道菌群分为六大门,包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、疣微球菌门(Verrucomicrobia)、梭杆菌门(Fusobacteria)[10]。从门的水平上看,肥胖人群的肠道菌群与健康人群相比差异非常显著。方圆圆等[11]研究表明小鼠在高糖高油的饮食条件下,小鼠体内血脂含量增加、脂代谢系统破坏。为证明其肠道菌群组成发生改变,对实验小鼠的粪便菌群进行分析,发现属于厚壁菌门的菌群明显增加。Ley等[12]对瘦OB(Lepob/ob,OB)小鼠与野生型小鼠的肠道菌群的分析中发现,遗传性肥胖小鼠对比于瘦OB小鼠肠道微生物种类数有下滑迹象,厚壁菌门的菌群所占比例却有了明显增高。对肥胖儿童的肠道菌群组成进行分析,发现其厚壁菌门的占比增加的同时,拟杆菌门的占比却下降[13]。拟杆菌门的主要能量来源于多糖物质,对于宿主的免疫调节具有一定的正面影响,但是肥胖患者的短链脂肪酸含量增加,导致机体的pH降低[14],在弱酸环境中属于拟杆菌门的菌群生长繁殖会受到一定的抑制,导致厚壁菌门菌群与拟杆菌门菌群在菌群中的占比发生改变。
1.2 肠道菌群功能与肥胖机制
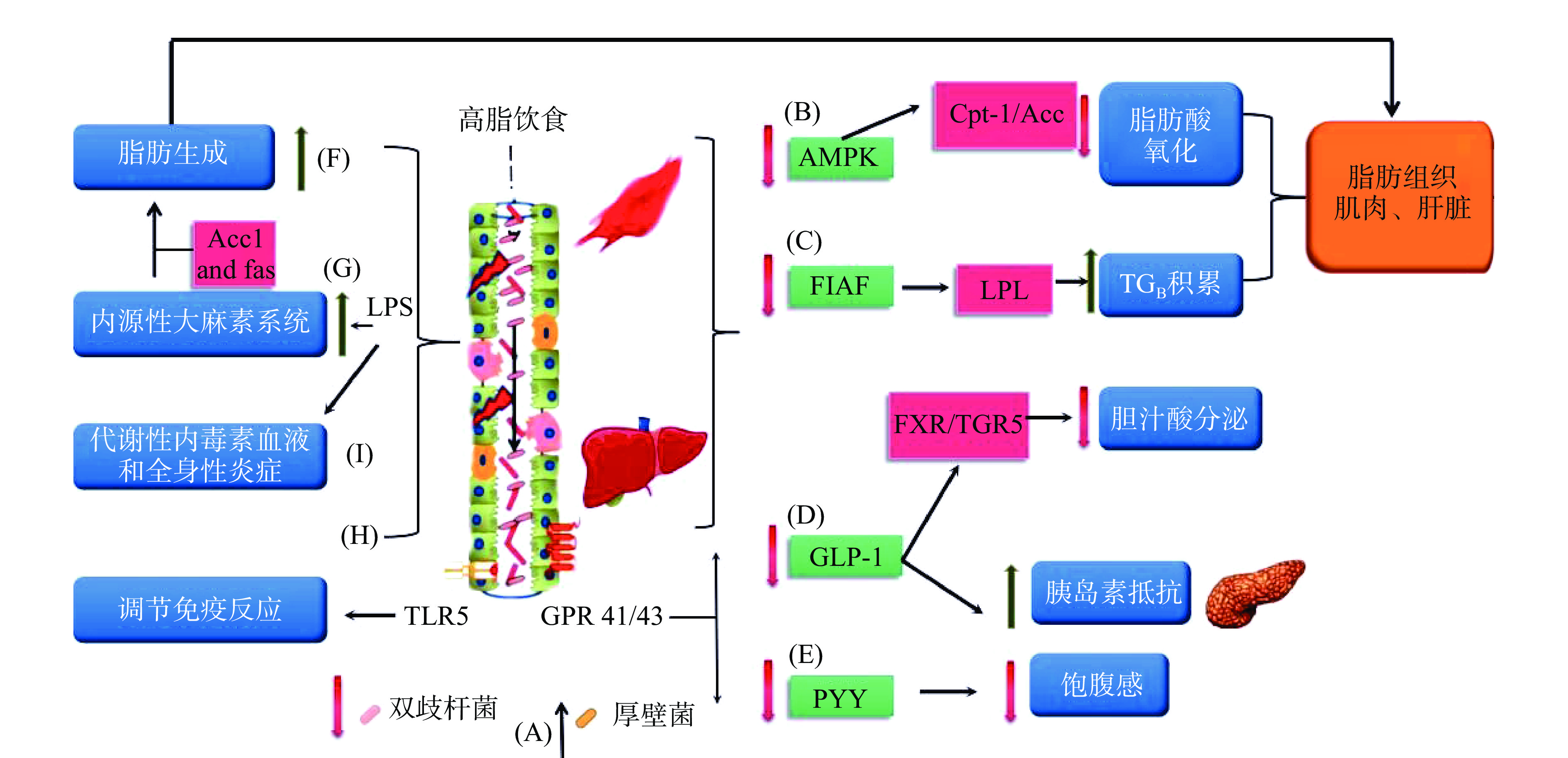
肠道菌群定植在肠道中,具有重要的生理功能。肠道菌群具备调节能量平衡、抑制炎症因子和影响脂代谢与胆汁酸合成速率的能力,且在TOLL样受体(Toll-like receptors,TLR)活化、遗传、免疫以及整合性调控TLR中均表现出色[15]。为了更好展示肠道菌群功能与肥胖发生机制的关系,以图示方式表示,如图1所示。
![]() 注:(A)肥胖宿主肠道菌群双歧杆菌占比下降与厚壁菌占比上升;(B)单磷酸腺苷激酶(AMPK)的低表达导致脂肪酸氧化降低;(C)脂肪细胞因子(FIAF)表达导致甘油三酯(TGB)积累的脂蛋白脂肪酶(LPL)激活;(D)低胰高糖素样肽-1(GLP-1)导致胰岛素抵抗增加,肝脏胆汁酸分泌降低;(E)血浆酪酪肽(PYY)减少导致宿主饱腹感降低;(F)通过上调的乙酰辅酶A羧酶(Acc1)和脂肪酸合酶(Fas)增加脂肪生成;(G)由于肠上皮细胞损伤引起细菌脂多糖(LPS)释放内毒素大麻素环;(H)通过Toll样受体5(TLR-5)下游信号传导调节肠道免疫反应;(I)由炎性细胞因子和细菌LPS引起的全身性炎症。
注:(A)肥胖宿主肠道菌群双歧杆菌占比下降与厚壁菌占比上升;(B)单磷酸腺苷激酶(AMPK)的低表达导致脂肪酸氧化降低;(C)脂肪细胞因子(FIAF)表达导致甘油三酯(TGB)积累的脂蛋白脂肪酶(LPL)激活;(D)低胰高糖素样肽-1(GLP-1)导致胰岛素抵抗增加,肝脏胆汁酸分泌降低;(E)血浆酪酪肽(PYY)减少导致宿主饱腹感降低;(F)通过上调的乙酰辅酶A羧酶(Acc1)和脂肪酸合酶(Fas)增加脂肪生成;(G)由于肠上皮细胞损伤引起细菌脂多糖(LPS)释放内毒素大麻素环;(H)通过Toll样受体5(TLR-5)下游信号传导调节肠道免疫反应;(I)由炎性细胞因子和细菌LPS引起的全身性炎症。1.2.1 肠道菌群影响能量调节
人体的消化系统因缺乏高分子多糖水解酶,无法消化高分子多糖,如纤维素、木聚糖和果胶,所以在摄食后必须经过肠道菌群对高分子多糖发酵利用。位于回肠末端和结肠的拟杆菌为消化高分子多糖主要的厌氧菌,它可以发酵利用多糖,把多糖降解为寡糖及短链脂肪酸(Short-chain fatty acids,SCFAs)。Koh等[20]研究发现SCFAs主要包含乙酸、丙酸和丁酸,通过被动扩散和单羧酸转运体(Monocarboxylate Transporte,MCT)的作用进入细胞内。SCFAs满足细胞呼吸每日70%以上的能量需求。其中,丁酸是结肠上皮细胞最重要的能量来源,宿主结肠上皮细胞每天10%能量需求来源于丁酸,从SCFAs持续获取能量会导致身体中脂肪积累过多而导致肥胖[21]。人类饮食在纤维组成上差异很大,并且显著改变了SCFAs的产生。对肥胖动物模型的研究表明粪便物质中存在SCFAs的增加[22],并且在人类受试者中也观察到类似的结果,通过记录肥胖受试者的粪便中丁酸盐的水平,与其饮食中碳水化合物含量相匹配,发现肠道菌群能把未消化的膳食纤维直接发酵成乙酸盐,乙酸盐经血液循环后通过控制乙酰辅酶A羧酶ACC1(Acetyl—CoAcarboXylase,ACC1)及脂肪酸合酶(Fatty acid synthase,FAS)的表达参与肝脏脂肪形成[23]。而且ACC1和FAS的表达受碳水化合物反应元件结合蛋白(Carbohydrate response element binding protein,Ch REBP)及胆固醇调节元件结合蛋白(Sterol-regulatory element binding proteins,SREBP)的控制[24]。SCFAs除了有提供能量方面的作用,还可调控肠道pH,从而改变肠道菌群的组成。pH从5.5增至6.5时可减少丁酸盐的水平,同时增加丙酸盐的水平;在pH5.5以下,丁酸盐的比例占主导地位;而在升高到pH6.5时,人类肠道菌群以丙酸盐作为发酵产物为主[25]。这些研究结果表明,菌群在不同的pH下能对碳水化合物进行特定的利用。然而,具体的调节机制仍有待进一步研究。
1.2.2 肠道菌群影响脂肪代谢
单磷酸腺苷激酶(Adenosine monophosphate-activated protein kinase,AMPK)是一种能够调节细胞物质和能量代谢的蛋白酶,主要存在肝脏和骨骼肌中[16]。Kim等[26]研究发现AMPK通过酰基辅酶A羧化酶触发肉碱棕榈酰转移酶-1(Carnitine palmitoyltransferase-1,Cpt-1)激活,AMPK表达药物增加也会伴随着肝脏和肌肉组织中脂肪酸氧化的增加,造成能量损失从而减轻体重。空腹诱导脂肪因子(Fasting induced adipose factor,FIAF)也称为促血管生成素4蛋白(Angiopoietin-like protein 4,ANGPTL4),是脂肪组织、肝脏、骨骼肌和肠在空腹反应下所产生,是一种强大的肥胖调节剂以及过氧化物酶体增殖物激活受体蛋白(Peroxisome proliferator-activated receptor,PPAR)的主要作用位点[27],其主要作用是抑制脂蛋白脂肪酶(Lipoprteinlipase,LPL),从而限制脂肪细胞中的甘油三酯(Triglyceride,TG)积累。Bäckhed等[28]发现当常规生长小鼠的远端肠道的肠道菌群被移入无菌(Germ-free,GF)小鼠中肠道时,检定GF小鼠附睾体脂肪增加60%。他们认为转移的肠道菌群抑制肠上皮细胞中FIAF表达,反过来又增加LPL活性引起脂肪细胞脂肪酸摄入增加。因此,确定肠道菌群可抑制FIAF的表达,从而增加脂肪细胞中的LPL活性和附睾体脂肪储存。
肠道菌群不能证明抵抗肥胖症发生与空腹诱导因子调节相关。对GF小鼠和常规小鼠采取高脂型饮食或野生型饮食饲养方法,发现与同种饲养条件的常规小鼠相比,两种饮食中的GF小鼠中观察到更多的体重增加。值得一提的是,在高脂型饮食和野生型饮食喂养的常规小鼠中发现肠道菌群的变化[29]。GF小鼠的体重增加与空腹诱导因子mRNA水平升高相关,而与空腹诱导因子不相关[30]。因此,肠道菌群能否通过脂肪代谢水平进而影响肥胖症发生还存在争议。
1.2.3 肠道菌群影响胆汁酸合成
胆汁酸(Bile Acids,BAs)作为胆汁主要成分之一,与胆固醇的吸收、代谢与调节都有密切的关系[30]。Swann等[31]研究表明小鼠肠内不同微生物结构,使其具备不同的胆汁酸代谢物与不同的能量代谢能力。虽然胆汁酸分子反馈抑制肥胖的内在发生机制尚不明确,但目前已提出法尼醇X受体(Farnesoid X receptor,FXR)能抑制胆固醇转化为胆汁酸,从而在抑制肥胖炎症因子、缓解过度炎症引起的反应起关键作用的说法。FXR负调节两个关键基因,即胆固醇7a-羟化酶(Cholesterol 7-alpha hydroxy-lase,CYP7A1)和甾醇27α-羟化酶(Sterol 27-hydroxylase,CYP27A1)的表达[32]。胆固醇通过两种途径合成初级胆汁酸,一是由CYP7A1启动的典型途径,因其中间产物生成中性胆固醇又被称为中性途径,二是由CYP27A1启动的代替途径[33]。Zimmer等[34]研究表明肠内FXR通过成纤维细胞生长因子15(FGF15)依赖机制调控肝CYP7A1。Sayin等[35]在GF小鼠对FXR研究中显示,肠道菌群通过FXR依赖机制调节FGF15和CYP7A1的表达,该研究的结果表明肠道微生物群通过去共轭、差向异构化、脱硫等反应生物修饰初级胆汁酸,来抑制肝脏中的胆汁酸合成。
1.2.4 肠道菌群影响免疫调节作用
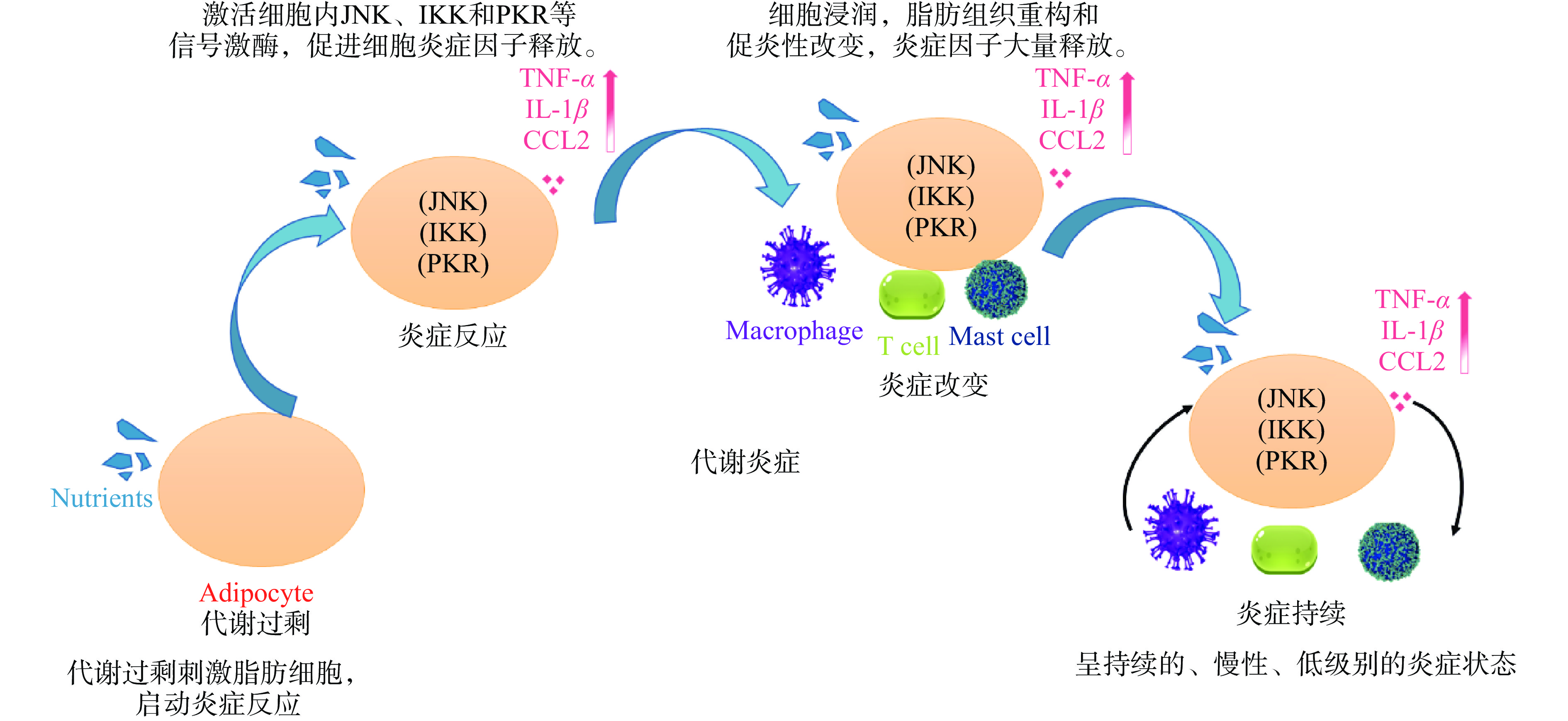
炎症是身体组织受损后作出的应激性反应,起到维护机体稳态的作用。目前,肥胖及肥胖相关疾病被医学界公认为是一种系统性的慢性低炎症。如图2所示,肥胖所引起的炎症源于体内脂肪积聚过多,长期积聚的脂肪被巨噬细胞浸润,触发固有免疫反应系统[36]。进而产生并释放促炎症因子,使机体呈现长期慢性炎症状态。肥胖性炎症是发生在脂肪的一种的局部慢性炎症,通过运动、改善饮食习惯,体重恢复正常水平,脂肪细胞功能恢复常规运作代谢脂肪,慢性代谢炎症得以舒缓甚至自我疗愈[37]。
肠道菌群中一些菌群会导致机体产生免疫耐受,在toll受体影响下造成一系列因炎症反应引起的非机械性组织损伤。TLR为跨膜且非催化性受体,通常表达于前哨淋巴细胞上,其可识别病原体分子(Pathogen-associated molecular patterns,PAMPS)微生物结构保守区域。TLRs在以肠道菌群为导引的炎症反应中起着重要的连接作用[19],通过模式识别TLRs能够激活核转录因子(Nuclear factor kappa-B,NF-κB)、丝裂原活化蛋白激酶等炎症相关信号通路。PAMPS与宿主TLR相互作用通过激活免疫应答所必需的炎症信号传导途径,肠道菌群与腔界面上皮细胞TLR相互作用从而维持免疫稳态[38]。鞭毛蛋白是菌体鞭毛重要组成成分,一般情况下不会引起炎症反应,然而TLR5能识别肠道菌群中一些特殊的菌种的鞭毛蛋白,激活NF-κB通路使细胞分泌大量炎症因子,引起严重的免疫疾病[39]。Vijay-Kumar等[40]阐明TLR5受体在肥胖和相关代谢综合征中的作用,他们发现与正常小鼠对照相比,TLR5缺陷小鼠表现出许多代谢综合征,如食欲不振、高脂血症、高血压、高胆固醇血症等,并证明这些变化与脂肪细胞分泌的促炎细胞因子IL-1β和INF-γ增加有关[41]。脂多糖(Lipopolysaccharides,LPS)是肠道内革兰氏阴性菌的组成部分,而脂磷壁酸(Lipoteichoic acid,LTA)则为与革兰氏阳性菌胞壁的组成部分,它们都含有抗原决定簇,具有一定抗原性[42]。贾军峰等[43]通过间接注射小鼠低浓度脂多糖发现血清中炎性细胞因子水平变化显著,说明脂多糖可改变肠胃黏膜商上皮组织细胞的通透性。TLR4是革兰阴性细菌脂多糖的重要结合配体,刺激活化后的TLR4在肥胖鼠肠黏膜上皮细胞中呈现过度表达状态;可诱导多种促炎症细胞因子的产生,引起并维持机体肥胖型低水平炎症[44]。
1.2.5 肠道菌群影响内源性大麻素系统
内源性大麻素系统是一种脂质信号系统,由内源性大麻素及其受体、合成酶、降解酶、转运蛋白等组成[45]。其受体存在于巨噬细胞中主要有2种,分别为大麻素受体1(Cannabinoid Receptor 1,CB1R)和大麻素受体2(Cannabinoid Receptor 2,CB2R),大麻素受体1主要位于它中枢与外周神经系统,大麻素受体2位于骨细胞及其体细胞中,对于抑制炎症因子、传递疼痛信号、降低食欲有着广泛的生理作用[46]。Mehrpouya-Bahrami等[47]在高脂饮食小鼠体内注射CB1R拮抗剂,观察其代谢情况发现,CB1R负责调控小鼠能量平衡,调节了其代谢紊乱。内源性大麻素是一组特异性化合物,主要包括N-花生四烯酰乙醇胺(N-arachidonoylethanolamine, AEA)和2-花生四烯酰甘油(2-Arachidonoylglycerol,2-AG)2种。实验显示,不同类型的运动、运动强度、运动时间可以使受试者血浆中AEA水平显著变化,而AEA可以促进脂肪组织中CB1R的表达,这为如何利用运动促进减肥最佳效果提供新的视角和研究思路[47]。Muccioli等[48]发现内源性大麻素系统能调节肠道渗透性和血浆LPS水平,而LPS在体内和体外通过阻断大麻素驱动的脂肪形成在脂肪组织代谢中起着重要作用。
2. 益生菌与肥胖
2.1 益生菌概述
益生菌是具生物活性的微生物,通常通过宿主摄食过程进入体内并在肠道定殖,调节了肠道内环境菌群结构的平衡,打造优良的肠道微生态,对人及动物产生有益影响[49]。人体、动物体内益生菌组成中乳酸菌类成分所占比例非常高。乳酸菌的发酵被成功应用于多种生物食品工业技术中,在一些乳制品、饮料、果蔬制品加工、天然防腐剂制作、调味品生产等生产工艺中不可或缺。乳酸菌(Lactobacillus)是可以产生乳酸的革兰氏阳性菌,属于厚壁菌门,包括乳酸杆菌属、链球菌属、片球菌属等18个属。如其中,乳杆菌属具有很多生物学效应,其代谢过程中能够产生有机酸、细菌素和过氧化氢等天然抑菌物质,有选择性地干扰到人类肠道菌群,利用自身非特异性有效地激活人和一些其他的动物宿主肠道固有免疫系统,具有显著的抗炎作用[50]。
2.2 益生菌通过肠道菌群控制肥胖的作用机制
如表1,肥胖发生与肠道微生物种类、数量、比例具有密切的关系,研究调节肠道菌群及其代谢产物成为肥胖及肥胖相关慢性病治疗防控的热点。肠道菌群可以影响内源性大麻素系统,对宿主能量系统与免疫系统调节进而控制脂肪代谢速度。而益生菌的摄入通常对肠道菌群的组成有所改变,并且它的摄入会给机体代谢及炎症带来有益影响。在健康肠道细胞内,益生菌能够与体内营养物质,代谢中间产物蛋白及肠道抑菌蛋白发生竞争,通过多种免疫途径有效促进对肠道营养物质的吸收与有益菌的生长繁殖,增加健康肠道菌群数量的多样性。研究证明,多糖、肽聚糖、DNA、磷壁酸及一些细胞表面结合、分泌的蛋白和有机酸、细菌素、聚磷酸盐和脂肪酸等与益生菌的益生作用相关的组成成分密切联系,其可调节宿主反应,抑制病原体,并且与肠道菌群发生交互作用[58]。
表 1 益生菌对动物肠道微生物的影响及其生理结果Table 1. Effects of probiotics on intestinal microbes in animals and their physiological results益生菌 动物模型 对肠道菌群的影响 代谢结果 参考文献 乳酸菌VSL#3 C57J/B67 HFD和ob/ob小鼠 ↓厚壁菌属;↑拟杆菌属;双歧杆菌属;
NC乳酸菌属↓体重,食物摄入和肥胖,↑胰岛素敏感性,葡萄糖耐量,GLP-1和SCFA丁酸盐的产生 [51] 弯曲乳杆菌HY7601 和植物乳杆菌KY1034 C57BL/6J HFD小鼠 NC 厚壁菌属和拟杆菌属;无门疣微菌属;
↓变形杆菌属;↑龙胆科的四种梭菌属和
厚壁菌属;↑内源性假单胞菌属↓体重、脂肪积累,血浆胰岛素;总胆固醇(TC)和肝脏毒性;↓脂肪组织中的促炎基因;
↑肝脏脂肪酸氧化基因[52] 唾液乳杆菌UCC118 C57BL/J6 HFD小鼠 NC厚壁菌属;↑拟杆菌和变形杆菌属;
↓放线菌属代谢无变化 [53] 唾液乳杆菌UCC118 C57BL/J6 HFD小鼠 ↑拟杆菌属和变形杆菌属;
↓荔枝科卟啉单胞菌属↓体重 [54] 棒状杆菌CECT5711 C57BL/6J HFD小鼠 ↑乳酸菌属 ↓血浆血糖,胰岛素抵抗和LPS水平,肠道渗透性 [55] 干酪乳杆菌NCDC 19 C57BL/6J HFD小鼠 NC直肠杆菌属、梭菌属、乳酸菌属;
↑双歧杆菌属↓体重,附睾脂肪,血糖,血浆脂质和瘦素;
↑脂联素[55] 鼠李糖乳杆菌NCDC17 HBD大鼠和链脲佐菌素喂养的Wistar大鼠 ↑双歧杆菌属和乳酸菌属 ↑葡萄糖耐量,血糖,血浆胰岛素,血红蛋白,FFA,TG,血清脂质和胆固醇;↑GLP1和脂连蛋白,↓盲肠中的促炎细胞因子和丙酸酯 [56] 植物乳杆菌HAC01 C57BL/6J HFD小鼠 ↑毛螺菌属;↓脱铁杆菌属、穆齐螺旋菌属、
乳酸菌属;NC厚壁菌属和拟杆菌属↓体重增加和肠膜脂肪重量,血糖,TC和三酰基甘油;↑脂质氧化基因 [57] 注:↑表示增加/升高/上调;↓表示减少/降低/下调;NC表示未检测到。 2.2.1 益生菌影响肠道中的炎症细胞因子
肥胖具备长期慢性的低度炎症特征,其肠道中诱导T细胞活化参与炎症反应发生的细胞因子比健康肠道更加活跃[15]。这与脂肪中脂肪细胞明显增加使脂肪因子的分泌能力下降,脂肪组织增多相关。而炎症细胞因子中肿瘤坏死因子(tumor necrosis factor, TNF)、白细胞介素-6(interleukin,IL-6)大多在肠道脂肪组织中产生[59]。Skuratovskaia等[60]对142名肥胖患者和34名健康捐赠者外周静脉血进行采集,并对哺乳动物线粒体DNA(Mitochondrial DNA,mtDNA)的拷贝基因组数量进行测定。结果表明与健康捐赠者相比,肥胖患者的TNF-α产生的增加,并且在肥胖患者中,体重指数(Body Mass Index,BMI),mtDNA的拷贝基因组数量也随之降低。益生菌干预炎症因子能有效治疗由肥胖引起的炎症性肠道疾病。研究发现,短乳杆菌OK56帮助HFD小鼠消除了饮食对肠道菌群的不利影响,尽管短乳杆菌数量增多,但短乳杆菌OK56补充剂抑制结肠中浆细胞LPS,并减CO2的产生[54]。因而短乳杆菌OK56发挥的抗肥胖作用是通过调节肠道菌群和产生LPS抑制其他炎症途径。Bamola等[61]对炎症性肠道疾病的患者给予凝结芽孢杆菌Unique IS-2,发现凝结芽孢杆菌Unique IS-2在胃肠道中的存活率良好,宏基因组分析还显示,在治疗组的干预后样本中,观察到细菌属芽孢杆菌、乳酸杆菌、双歧杆菌、粪杆菌、拟杆菌、巨单胞菌、拉希诺螺旋体、蓝藻、阿利斯提普斯的丰度增加,并观察到沙嘴菌、罗斯布里亚和巨噬菌体的减少。
2.2.2 益生菌影响肠道内代谢产物
由表1可知,乳杆菌和双歧杆菌是两种被广泛应用在利用动物模型研究抗肥胖效应的益生菌。然而,具体的机制尚不明确,还有待研究。目前推测可能的机制包括肠道微生物群落的改变与益生菌的生物活性能影响肠道菌群的代谢产物[62]。肠道菌群能产生特定的代谢化合物,例如胆汁酸、短链脂肪酸(SCFAs)、谷氨酸(Glutamate,Glu)、γ-氨基丁酸(γ-aminobutyric acid,GABA)、多巴胺(Dopamine,DA)、5-羟色胺(5-hydroxytryptamine,5-HT)与中枢神经系统进行通信[63]。益生菌作为靶向调节肠道菌群,可以直接调节肠道代谢重要产物神经递质的水平。通过小鼠实验发现,齿双歧杆菌可以增加通过增加肠道5-HT受体及5-HT转运蛋白的表达从而增加小鼠5-HT的浓度[64]。Aleti等[65]利用质谱分析显示,在抑郁症状、肥胖和共病肥胖-抑郁患者中,益生菌群或膳食来源的信号肽和芳香族氨基酸的信号分子水平发生了显著变化,一些益生菌可以与5-HT、多巴胺等神经递质共存。
2.3 益生元辅助益生菌调控肥胖
益生元能够促进益生菌的生长代谢,从而缓解因为肥胖引起的肠道菌群失衡[66]。低聚糖与植物多糖都具备益生元功效,其具备不容易被机体肠道消化的特征[67]。在饮食治疗肥胖的过程中,益生元常常被当作膳食补充剂,成为益生菌能够发酵的底物。在治疗肥胖中,常常会通过添加特定的益生元,从而提高在益生菌肠道菌群中的竞争力。Saleh-Ghadimi等[68]研究证明在肥胖2型糖尿病女性中发现,患者摄入耐药糊精益生元降低血液中炎症因子TNF-α的水平。Kondapalli等[69]对大鼠补充低聚果糖益生元,发现大鼠盲肠中的乳酸杆菌、双歧杆菌都有不同程度的增加。在所有补充益生元的大鼠中炎症标志物与脂质水平都有显著下降。益生元的种类繁多,但是哪一种益生元能够更好促进可调控肥胖的益生菌生长还有待深挖。李树森等[70]通过体外肠道微生态模拟,发现低聚木糖能够显著提升菌群中双歧杆菌的比例,而低聚半乳糖组对乳杆菌在肠道菌群中比例提升更为明显。因此,为了益生元更好辅助益生菌调控肥胖及其相关疾病,还需要对益生元与益生菌的组合进行筛选。
3. 结论与展望
肠道菌群能在预防或治疗肥胖中发挥作用已经被专家证实。益生菌补充剂给人们预防或治疗肥胖症带来了一个全新的途径,其具有解决肥胖及肥胖相关病症引起的代谢紊乱问题,从而改变了消化道的菌群状态潜力。然而,想要实现益生菌通过肠道菌群控制肥胖还需要完成以下深入研究,首先,明确肠道中特定菌群在肥胖中起到的作用,并确定哪一种类型的益生菌对预防或治疗肥胖有更好的效果等。其次,延长益生菌对代谢紊乱引起疾病的临床研究,从而具体探究益生菌对宿主脑-肠-轴的影响,有针对性选择优势益生菌作为益生菌补充剂的基础原材料,接下来还要确定这些益生菌补充剂是如何改善健康的;是否对所有年龄组别肥胖患者都是一样的效果;是否不同菌株在抗肥胖能力方面存在差异。益生元作为未来医药学研究的热门,需要确保益生元与益生菌的组合在应用于人体肥胖治疗是安全可靠的。因此未来还需要分析益生菌与肠道菌群之间的作用、了解益生菌如何通过遗传物质交换与肠道菌群进行遗传交流、更深入探讨益生菌的作用机制。
-
注:(A)肥胖宿主肠道菌群双歧杆菌占比下降与厚壁菌占比上升;(B)单磷酸腺苷激酶(AMPK)的低表达导致脂肪酸氧化降低;(C)脂肪细胞因子(FIAF)表达导致甘油三酯(TGB)积累的脂蛋白脂肪酶(LPL)激活;(D)低胰高糖素样肽-1(GLP-1)导致胰岛素抵抗增加,肝脏胆汁酸分泌降低;(E)血浆酪酪肽(PYY)减少导致宿主饱腹感降低;(F)通过上调的乙酰辅酶A羧酶(Acc1)和脂肪酸合酶(Fas)增加脂肪生成;(G)由于肠上皮细胞损伤引起细菌脂多糖(LPS)释放内毒素大麻素环;(H)通过Toll样受体5(TLR-5)下游信号传导调节肠道免疫反应;(I)由炎性细胞因子和细菌LPS引起的全身性炎症。
Figure 1. Intestinal flora and obesity-related mechanisms[16-19]
表 1 益生菌对动物肠道微生物的影响及其生理结果
Table 1 Effects of probiotics on intestinal microbes in animals and their physiological results
益生菌 动物模型 对肠道菌群的影响 代谢结果 参考文献 乳酸菌VSL#3 C57J/B67 HFD和ob/ob小鼠 ↓厚壁菌属;↑拟杆菌属;双歧杆菌属;
NC乳酸菌属↓体重,食物摄入和肥胖,↑胰岛素敏感性,葡萄糖耐量,GLP-1和SCFA丁酸盐的产生 [51] 弯曲乳杆菌HY7601 和植物乳杆菌KY1034 C57BL/6J HFD小鼠 NC 厚壁菌属和拟杆菌属;无门疣微菌属;
↓变形杆菌属;↑龙胆科的四种梭菌属和
厚壁菌属;↑内源性假单胞菌属↓体重、脂肪积累,血浆胰岛素;总胆固醇(TC)和肝脏毒性;↓脂肪组织中的促炎基因;
↑肝脏脂肪酸氧化基因[52] 唾液乳杆菌UCC118 C57BL/J6 HFD小鼠 NC厚壁菌属;↑拟杆菌和变形杆菌属;
↓放线菌属代谢无变化 [53] 唾液乳杆菌UCC118 C57BL/J6 HFD小鼠 ↑拟杆菌属和变形杆菌属;
↓荔枝科卟啉单胞菌属↓体重 [54] 棒状杆菌CECT5711 C57BL/6J HFD小鼠 ↑乳酸菌属 ↓血浆血糖,胰岛素抵抗和LPS水平,肠道渗透性 [55] 干酪乳杆菌NCDC 19 C57BL/6J HFD小鼠 NC直肠杆菌属、梭菌属、乳酸菌属;
↑双歧杆菌属↓体重,附睾脂肪,血糖,血浆脂质和瘦素;
↑脂联素[55] 鼠李糖乳杆菌NCDC17 HBD大鼠和链脲佐菌素喂养的Wistar大鼠 ↑双歧杆菌属和乳酸菌属 ↑葡萄糖耐量,血糖,血浆胰岛素,血红蛋白,FFA,TG,血清脂质和胆固醇;↑GLP1和脂连蛋白,↓盲肠中的促炎细胞因子和丙酸酯 [56] 植物乳杆菌HAC01 C57BL/6J HFD小鼠 ↑毛螺菌属;↓脱铁杆菌属、穆齐螺旋菌属、
乳酸菌属;NC厚壁菌属和拟杆菌属↓体重增加和肠膜脂肪重量,血糖,TC和三酰基甘油;↑脂质氧化基因 [57] 注:↑表示增加/升高/上调;↓表示减少/降低/下调;NC表示未检测到。 -
[1] DETTONI R, BAHAMONDES C, YEVENES C, et al. The effect of obesity on chronic diseases in USA: A flexible copula approach[J]. Scientific Reports,2023,13(1):1831. doi: 10.1038/s41598-023-28920-6
[2] LAUDISIO D, MUSCOGIURI G, BARREA L, et al. Obesity and breast cancer in premenopausal women: Current evidence and future perspectives[J]. European Journal of Obstetrics and Gynecology and Reproductive Biology,2018,230:217−221. doi: 10.1016/j.ejogrb.2018.03.050
[3] 高鹏, 张旭光, 刘雪来. 肠道黏膜屏障功能评估的研究进展[J]. 发育医学电子杂志,2019,7(1):70−74. [GAO P, ZHANG X G, LIU X L. Research progress in evaluation of intestinal mucosal barrier function[J]. Journal of Developmental Medicine Electronics,2019,7(1):70−74. doi: 10.3969/j.issn.2095-5340.2019.01.016 [4] HE X, JI G, JIA W, et al. Gut microbiota and nonalcoholic fatty liver disease: Insights on mechanism and application of metabolomics[J]. International Journal of Molecular Sciences,2016,17(3):300. doi: 10.3390/ijms17030300
[5] 王新, 王利, 王青云, 等. 益生元对益生菌生长代谢的研究[J]. 食品安全导刊,2022(7):76−79. [WANG X, WANG L, WANG Q Y, et al. Study on the growth and metabolism of probiotics by prebiotics[J]. Food Safety Guide,2022(7):76−79. doi: 10.3969/j.issn.1674-0270.2022.7.spaqdk202207030 [6] CRISTOFORI F, DARGENIO V N, DARGENIO C, et al. Anti-inflammatory and immunomodulatory effects of probiotics in gut inflammation: A door to the body[J]. Frontiers in Immunology,2021,12:578386. doi: 10.3389/fimmu.2021.578386
[7] FANG F C, VAZQUEZ-TORRES A. Reactive nitrogen species in host-bacterial interactions[J]. Current Opinion in Immunology,2019,60:96−102. doi: 10.1016/j.coi.2019.05.008
[8] ZHOU B, YUAN Y, ZHANG S, et al. Intestinal flora and disease mutually shape the regional immune system in the intestinal tract[J]. Frontiers in Immunology,2020,11:575. doi: 10.3389/fimmu.2020.00575
[9] 陈玉艳, 王荣, 张娟红, 等. 肠道菌群对药物代谢影响的研究进展[J]. 中国药理学通报,2019,35(2):168−172. [CHEN Y Y, WANG R, ZHANG J H, et al. Research progress on the effect of intestinal flora on drug metabolism[J]. China Pharmacology Bulletin,2019,35(2):168−172. doi: 10.3969/j.issn.1001-1978.2019.02.005 [10] MOBEEN F, SHARMA V, TULIKA P. Enterotype variations of the healthy human gut microbiome in different geographical regions[J]. Bioinformation,2018,14(9):560. doi: 10.6026/97320630014560
[11] 方圆圆, 吴亚, 陈彦辉, 等. 不同益生菌干预对高脂饮食诱导肥胖小鼠脂代谢及脂多糖影响的研究[J]. 中国实验诊断学,2019,23(4):692−695. [FANG Y Y, WU Y, CHEN Y H, et al. Studies on the effects of different probiotics interventions on lipid metabolism and lipopolysaccharide in high-fat diet-induced obese mice[J]. Experimental Diagnostics of China,2019,23(4):692−695. doi: 10.3969/j.issn.1007-4287.2019.04.040 [12] LEY R E, BACKHED F, TURNBAUGH P, et al. Obesity alters gut microbial ecology[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(31):11070−11075. doi: 10.1073/pnas.0504978102
[13] DOS SANTOS PEREIRA INDIANI C M, RIZZARDI K F, CASTELO P M, et al. Childhood obesity and firmicutes/bacteroidetes ratio in the gut microbiota: A systematic review[J]. Childhood Obesity,2018,14(8):501−509. doi: 10.1089/chi.2018.0040
[14] CHENG J, HU J, GENG F, et al. Bacteroides utilization for dietary polysaccharides and their beneficial effects on gut health[J]. Food Science and Human Wellness,2022,11(5):1101−1110. doi: 10.1016/j.fshw.2022.04.002
[15] CAI Z, HUANG Y, HE B. New insights into adipose tissue macrophages in obesity and insulin resistance[J]. Cells,2022,11(9):1424. doi: 10.3390/cells11091424
[16] 张宸崧, 王子涵, 陈燕雯, 等. 单磷酸腺苷激活的蛋白激酶(AMPK): 能量、葡萄糖感受器和代谢性疾病治疗靶标[J]. 厦门大学学报(自然科学版),2022,61(3):325−345. [ZHANG C S, WANG Z H, CHEN Y W, et al. AMPK: Energy, glucose receptor and therapeutic target of metabolic diseases[J]. Journal of Xiamen University (Natural Science Edition),2022,61(3):325−345. [17] HARDARDÓTTIR I, DOERRLER W, FEINGOLD K R, et al. Cytokines stimulate lipolysis and decrease lipoprotein lipase activity in cultured fat cells by a prostaglandin independent mechanism[J]. Biochemical and Biophysical Research Communications,1992,186(1):237−243. doi: 10.1016/S0006-291X(05)80798-3
[18] GORMAN A, GOLOVANOV A P. Lipopolysaccharide structure and the phenomenon of low endotoxin recovery[J]. European Journal of Pharmaceutics and Biopharmaceutics,2022,180:289−307. doi: 10.1016/j.ejpb.2022.10.006
[19] BLOODGOOD M A, CHOWDARY S A, DAIBER E J, et al. A balancing act: Optimizing free chlorine contact time to minimize iodo-DBPs, NDMA, and regulated DBPs in chloraminated drinking water[J]. Journal of Environmental Sciences,2022,117:315−325. doi: 10.1016/j.jes.2022.05.024
[20] KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology: Short-chain fatty acids as key bacterial metabolites[J]. Cell,2016,165(6):1332−1345. doi: 10.1016/j.cell.2016.05.041
[21] MIRZAEI R, DEHKHODAIE E, BOUZARI B, et al. Dual role of microbiota-derived short-chain fatty acids on host and pathogen[J]. Biomedicine & Pharmacotherapy,2022,145:112352.
[22] LUO Q, CHENG D, HUANG C, et al. Improvement of colonic immune function with soy isoflavones in high-fat diet-induced obese rats[J]. Molecules,2019,24(6):1139. doi: 10.3390/molecules24061139
[23] LYU J, PIROOZNIA M, LI Y, et al. The short-chain fatty acid acetate modulates epithelial-to-mesenchymal transition[J]. Molecular Biology of the Cell,2022,33(8):br13. doi: 10.1091/mbc.E22-02-0066
[24] FUNES A K, SIMÓN L, COLOMBO R, et al. Impact of high fat diet on the sterol regulatory element-binding protein 2 cholesterol pathway in the testicle[J]. Molecular Human Reproduction,2021,27(5):gaab023. doi: 10.1093/molehr/gaab023
[25] DUNCAN S H, BELENGUER A, HOLTROP G, et al. Reduced dietary intake of carbohydrates by obese subjects results in decreased concentrations of butyrate and butyrate-producing bacteria in feces[J]. Applied and Environmental Microbiology,2007,73(4):1073−1078. doi: 10.1128/AEM.02340-06
[26] KIM J, YANG G, HA J. Targeting of AMP-activated protein kinase: Prospects for computer-aided drug design[J]. Expert Opinion on Drug Discovery,2017,12(1):47−59. doi: 10.1080/17460441.2017.1255194
[27] CONWAY G D, BUZZA M S, MARTIN E W, et al. PRSS21/testisin inhibits ovarian tumor metastasis and antagonizes proangiogenic angiopoietins ANG2 and ANGPTL4[J]. Journal of Molecular Medicine,2019,97:691−709. doi: 10.1007/s00109-019-01763-3
[28] BACKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(44):15718−15723. doi: 10.1073/pnas.0407076101
[29] PEARSON J A, DING H, HU C, et al. IgM-associated gut bacteria in obesity and type 2 diabetes in C57BL/6 mice and humans[J]. Diabetologia,2022,65(8):1398−1411. doi: 10.1007/s00125-022-05711-8
[30] FRANCISCO V, PINO J, CAMPOS-CABALEIRO V, et al. Obesity, fat mass and immune system: Role for leptin[J]. Frontiers in Physiology,2018,9:640. doi: 10.3389/fphys.2018.00640
[31] SWANN J R, WANT E J, GEIER F M, et al. Systemic gut microbial modulation of bile acid metabolism in host tissue compartments[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108:4523−4530. doi: 10.1073/pnas.1006734107
[32] KAWASAKI M, ARATA N, MIYAZAKI C, et al. Obesity and abnormal glucose tolerance in offspring of diabetic mothers: A systematic review and meta-analysis[J]. PLoS One,2018,13(1):e0190676. doi: 10.1371/journal.pone.0190676
[33] DALTON G D, OH S-H, TANG L, et al. Hepatocyte activity of the cholesterol sensor smoothened regulates cholesterol and bile acid homeostasis in mice[J]. Iscience,2021,24(9):103089. doi: 10.1016/j.isci.2021.103089
[34] ZIMMER J, LANGE B, FRICK J S, et al. A vegan or vegetarian diet substantially alters the human colonic faecal microbiota[J]. European Journal of Clinical Nutrition,2012,66(1):53−60. doi: 10.1038/ejcn.2011.141
[35] SAYIN S I, WAHLSTROM A, FELIN J, et al. Gut microbiota regulates bile acid metabolism by reducing the levels of tauro-beta-muricholic acid, a naturally occurring FXR antagonist[J]. Cell Metabolism,2013,17(2):225−235. doi: 10.1016/j.cmet.2013.01.003
[36] BEZERRA DA SILVA R A, FERNANDES FERREIRA P D, DE ROSSI A, et al. Toll-like receptor 2 knockout mice showed increased periapical lesion size and osteoclast number[J]. Journal of Endodontics,2012,38(6):803−813. doi: 10.1016/j.joen.2012.03.017
[37] WAN X, YIN J, CHEN J. Characteristics of intestinal myoelectrical and motor activities in diet-induced obese rats: Obesity and motility[J]. Digestive Diseases and Sciences,2019,64:1478−1485. doi: 10.1007/s10620-019-5458-4
[38] ABUELEZZ S A, HENDAWY N. HMGB1/RAGE/TLR4 axis and glutamate as novel targets for PCSK9 inhibitor in high fat cholesterol diet induced cognitive impairment and amyloidosis[J]. Life Sciences,2021,273:119310. doi: 10.1016/j.lfs.2021.119310
[39] TAHOUN A, JENSEN K, CORRIPIO-MIYAR Y, et al. Host species adaptation of TLR5 signaling and flagellin recognition[J]. Scientific Reports,2017,7(1):17677. doi: 10.1038/s41598-017-17935-5
[40] VIJAY-KUMAR M, AITKEN J D, CARVALHO F A, et al. Metabolic syndrome and altered gut microbiota in mice lacking toll-like receptor 5[J]. Science,2010,328(5975):228−231. doi: 10.1126/science.1179721
[41] STAROBOVA H, MONTELEONE M, ADOLPHE C, et al. Vincristine-induced peripheral neuropathy is driven by canonical NLRP3 activation and IL-1 beta release[J]. Journal of Experimental Medicine,2021,218(5):e20201452. doi: 10.1084/jem.20201452
[42] IWATA A, SHIMIZU K, KAWASAKI H, et al. Lipopolysaccharide and lipoteichoic acid enhance serum amyloid A3 mRNA expression in murine alveolar epithelial cells[J]. Journal of Veterinary Medical Science,2019,81(10):1409−1412. doi: 10.1292/jvms.19-0154
[43] 贾军峰, 王梦竹, 崔一喆, 等. 脂多糖致炎时间对小鼠血液免疫与肠道组织形态的影响[J]. 动物营养学报,2018,30(9):3609−3616. [JIA J F, WANG M Z, CUI Y Z, et al. Effects of inflammatory time induced by lipopolysaccharide on blood immunity and intestinal morphology of mice[J]. Acta Animal Nutrition,2018,30(9):3609−3616. doi: 10.3969/j.issn.1006-267x.2018.09.031 [44] Soltani N, Esmaeil N, Marandi S M, et al. Assessment of the effect of short-term combined high-intensity interval training on TLR4, NF-κB and IRF3 expression in young overweight and obese girls[J]. Public Health Genomics,2020,23(1−2):26−36. doi: 10.1159/000506057
[45] ROHBECK E, ECKEL J, ROMACHO T. Cannabinoid receptors in metabolic regulation and diabetes[J]. Physiology,2021,36(2):102−113. doi: 10.1152/physiol.00029.2020
[46] XIN Y, TANG A, PAN S, et al. Components of the endocannabinoid system and effects of cannabinoids against bone diseases: A mini-review[J]. Frontiers in Pharmacology,2022,12:4042.
[47] MEHRPOUYA-BAHRAMI P, CHITRALA K N, GANEWATTA M S, et al. Blockade of CB1 cannabinoid receptor alters gut microbiota and attenuates inflammation and diet-induced obesity[J]. Rep,2017,7(1):15645.
[48] MUCCIOLI G G, NASLAIN D, BACKHED F, et al. The endocannabinoid system links gut microbiota to adipogenesis[J]. Molecular Systems Biology,2010,6:392. doi: 10.1038/msb.2010.46
[49] WANG X, ZHANG P, ZHANG X. Probiotics regulate gut microbiota: An effective method to improve immunity[J]. Molecules,2021,26(19):6076. doi: 10.3390/molecules26196076
[50] SIVAMARUTHI B S, KESIKA P, SUGANTHY N, et al. A review on role of microbiome in obesity and antiobesity properties of probiotic supplements[J]. Biomed Research International,2019,2019:3291367.
[51] YADAV H, LEE J H, LLOYD J, et al. Beneficial metabolic effects of a probiotic via butyrate-induced GLP-1 hormone secretion[J]. Journal of Biological Chemistry,2013,288(35):25088−25097. doi: 10.1074/jbc.M113.452516
[52] MO S J, LEE K, HONG H J, et al. Effects of Lactobacillus curvatus HY7601 and Lactobacillus plantarum KY1032 on overweight and the gut microbiota in humans: Randomized, double-blinded, placebo-controlled clinical trial[J]. Nutrients,2022,14(12):2484. doi: 10.3390/nu14122484
[53] MURPHY E F, COTTER P D, HOGAN A, et al. Divergent metabolic outcomes arising from targeted manipulation of the gut microbiota in diet-induced obesity[J]. Gut,2013,62(2):220−226. doi: 10.1136/gutjnl-2011-300705
[54] CLARKE S F, MURPHY E F, O'SULLIVAN O, et al. Targeting the microbiota to address diet-induced obesity: A time dependent challenge[J]. PLoS One,2013,8(6):e65790. doi: 10.1371/journal.pone.0065790
[55] RATHER S A, POTHURAJU R, SHARMA R K, et al. Anti-obesity effect of feeding probiotic dahi containing Lactobacillus casei NCDC19 in high fat diet-induced obese mice[J]. International Journal of Dairy Technology,2014,67(4):504−509. doi: 10.1111/1471-0307.12154
[56] SINGH S, SHARMA R K, MALHOTRA S, et al. Lactobacillus rhamnosus NCDC17 ameliorates type-2 diabetes by improving gut function, oxidative stress and inflammation in high-fat-diet fed and streptozotocin-treated rats[J]. Beneficial Microbes,2017,8(2):243−255. doi: 10.3920/BM2016.0090
[57] PARK S, JI Y, JUNG H Y, et al. Lactobacillus plantarum HAC01 regulates gut microbiota and adipose tissue accumulation in a diet-induced obesity murine model[J]. Applied Microbiology and Biotechnology,2017,101(4):1605−1614. doi: 10.1007/s00253-016-7953-2
[58] HORI T, MATSUDA K, OISHI K. Probiotics: A dietary factor to modulate the gut microbiome, host immune system, and gut-brain interaction[J]. Microorganisms,2020,8(9):1401. doi: 10.3390/microorganisms8091401
[59] RYU R, KWON E Y, CHOI J Y, et al. Chrysanthemum leaf ethanol extract prevents obesity and metabolic disease in diet-induced obese mice via lipid mobilization in white adipose tissue[J]. Nutrients,2019,11(6):1347. doi: 10.3390/nu11061347
[60] SKURATOVSKAIA D, ZATOLOKIN P, VULF M, et al. Interrelation of chemerin and TNF-α with mtDNA copy number in adipose tissues and blood cells in obese patients with and without type 2 diabetes[J]. BMC Medical Genomics,2019,12(2):45−55.
[61] BAMOLA V D, DUBEY D, SAMANTA P, et al. Effect of Bacillus coagulans unique IS-2 in inflammatory bowel disease (IBD): A randomized controlled trial[J]. Cold Spring Harbor Laboratory Press, 2021.
[62] DAHIYA D K, PUNIYA A K. Evaluation of survival, free radical scavenging and human enterocyte adherence potential of Lactobacilli with anti-obesity and anti-inflammatory CLA isomer-producing attributes[J]. Journal of Food Processing and Preservation,2015,39(6):2866−2877. doi: 10.1111/jfpp.12538
[63] VERNOCCHI P, DEL CHIERICO F, PUTIGNANI L. Gut microbiota profiling: Metabolomics based approach to unravel compounds affecting human health[J]. Frontiers in Microbiology,2016,7:1144.
[64] ENGEVIK M A, LUCK B, VISUTHRANUKUL C, et al. Human-derived Bifidobacterium dentium modulates the mammalian serotonergic system and gut-brain axis[J]. Cellular and Molecular Gastroenterology and Hepatology,2021,11(1):221−248. doi: 10.1016/j.jcmgh.2020.08.002
[65] ALETI G, KOHN J N, TROYER E A, et al. Salivary bacterial signatures in depression-obesity comorbidity are associated with neurotransmitters and neuroactive dipeptides[J]. BMC Microbiology,2022,22(1):75. doi: 10.1186/s12866-022-02483-4
[66] CUNNINGHAM M, AZCARATE-PERIL M A, BARNARD A, et al. Shaping the future of probiotics and prebiotics[J]. Trends in Microbiology,2021,29(8):667−685. doi: 10.1016/j.tim.2021.01.003
[67] VEIGA P, SUEZ J, DERRIEN M, et al. Moving from probiotics to precision probiotics[J]. Nature Microbiology,2020,5(7):878−880. doi: 10.1038/s41564-020-0721-1
[68] SALEH-GHADIMI S, DEHGHAN P, SARMADI B, et al. Improvement of sleep by resistant dextrin prebiotic in type 2 diabetic women coincides with attenuation of metabolic endotoxemia: Involvement of gut-brain axis[J]. Journal of the Science of Food and Agriculture,2022,102(12):5229−5237. doi: 10.1002/jsfa.11876
[69] KONDAPALLI N B, HEMALATHA R, UPPALA S, et al. Ocimum sanctum, Zingiber officinale, and Piper nigrum extracts and their effects on gut microbiota modulations (Prebiotic potential), basal inflammatory markers and lipid levels: Oral supplementation study in healthy rats[J]. Pharmaceutical Biology,2022,60(1):437−450. doi: 10.1080/13880209.2022.2033797
[70] 李树森, 肖然, 孙二娜, 等. 基于体外模拟肠道微生态系统的乳双歧杆菌MN-Gup益生元筛选及其发酵特性研究[J]. 中国奶牛,2022(8):1−4. [LI S S, XIAO R, SUN E N, et al. Screening of probiotics of Bifidobacterium lactis MN-Gup based on in vitro simulation of intestinal microecosystem and study on its fermentation characteristics[J]. China Dairy Cow,2022(8):1−4. -
期刊类型引用(8)
1. 许天月,张俊杰,魏家乐,成永之,段蕊. 叶酸形式、稳定性及天然化叶酸的研究进展. 食品安全质量检测学报. 2024(02): 266-274 .  百度学术
百度学术
2. 毕晨,游清徽. 雷公藤红素-氨基葡萄糖酰胺偶联物的合成及其减毒调脂作用. 中草药. 2024(04): 1158-1166 .  百度学术
百度学术
3. 林伟明,廖红兴,孙剑光,梁传兴,黄略,李惠民,李灏. 氨基葡萄糖联合膝关节腔注射富血小板血浆治疗膝骨关节炎的临床效果. 中国医药. 2024(03): 420-425 .  百度学术
百度学术
4. 但晓梦,刘晓锋,郭江红,姜红. 氨基葡萄糖类药物的来源、结构及其鉴别技术研究. 中国药师. 2024(04): 551-556 .  百度学术
百度学术
5. 吕昊坤,杨腾辉,吴启赐,潘裕添,薛钰. 利用斑马鱼肝癌模型探究氨基葡萄糖盐酸盐对肝癌的影响. 食品工业科技. 2024(20): 332-340 .  本站查看
本站查看
6. 王锴,林剑浩. 氨基葡萄糖治疗骨关节炎的药理作用及其临床应用研究进展. 中华医学杂志. 2024(43): 4005-4010 .  百度学术
百度学术
7. 张倩如,吴启赐,薛钰,林志超,黄家福,吕昊坤,彭伟,潘裕添,林进妹. 杏鲍菇废弃菌渣中D-氨基葡萄糖盐酸盐的制备工艺及生物学活性分析. 食品工业科技. 2023(17): 263-271 .  本站查看
本站查看
8. 殷光玲,贤欢,肖义然,黄远英. 氨糖软骨素钙片安全性毒理学试验研究. 现代食品. 2023(19): 160-164+172 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:
 下载:
下载:



