Optimization of Preparing Technology of Clam Peptide and Its Enhanced Immunomodulatory Effect
-
摘要: 目的:以菲律宾蛤仔(Ruditapes philippinarum)为原料,研究蛋白肽制备工艺及其增强免疫活性。方法:以蛋白水解度为评价指标,筛选最适蛋白酶,采用单因素实验和响应面试验确定最佳酶解条件;氨基酸分析仪分析蛤蜊肽氨基酸组成;通过小鼠器官/体重比值、小鼠脾淋巴细胞转化实验、血清溶血素实验、小鼠腹腔巨噬细胞吞噬鸡红细胞实验、NK细胞活性实验评价蛤蜊肽的增强免疫活性。结果:菲律宾蛤仔蛋白肽制备的最适蛋白酶为胰蛋白酶,最佳酶解条件为温度48.4 ℃,pH8.0,加酶量3795 U/g,料液比1:2,水解时间4 h,该工艺下蛋白水解度达到15.33%,蛋白肽重均分子量为418 Da;其氨基酸组成合理,必需氨基酸占比达到41.48%;经口给予小鼠不同剂量的蛤蜊肽30 d,与空白对照组比较,小鼠的脏器比值无显著影响(P>0.05),低剂量(700 mg/(kg·d))与高剂量(2800 mg/(kg·d))下能显著提高血清溶血素水平(P<0.05),低剂量(700 mg/(kg·d))与中剂量(1400 mg/(kg·d))下能显著提高小鼠腹腔巨噬细胞吞噬鸡红细胞吞噬率(P<0.01),具有较好的增强免疫活性。结论:该方法下制备的蛤蜊肽水解程度较高、分子量低且分布集中,并具有一定增强免疫活性,具有开发成保健食品或特殊膳食食品的潜能。Abstract: Objective: Ruditapes philippinarum was used as raw material to investigate the preparation process of peptide and its enhanced immunomodulatory effect. Methods: The hydrolysis degree of protein was used as an evaluation index to screen the optimal protease. The single factor experiment and response surface test were used to determine the best enzymatic hydrolysis condition. The amino acid composition was analyzed using amino acid analyzer. And organ/body weight ratio, spleen lymphocyte transformation test, serum hemolysin experiment, peritoneal macrophage swallowing chicken red blood cell test, and NK cell activation experiment were used to assess the clam peptide enhanced immune activity. Results: Trypsin was the most suitable protease in the preparation of protein peptides from Ruditapes philippinarum. The optimal enzymatic conditions were temperature 48.4 ℃, pH8.0, enzyme concentration 3795 U/g, solid-liquid ratio 1:2, and hydrolysis time 4 hours. The average molecular weight of protein-peptide was 418 Da with 15.33% hydrolysis degree under optimal enzymatic conditions. The amino acid composition of the clam peptide was reasonable and the proportion of essential amino acids reached 41.48%. The organ ratio of BALB/c mice did not change significantly as compared to the control group after receiving various doses of oral clam peptides for 30 days. Furthermore, the serum hemolysin levels were significantly (P<0.05) increased of low dose (700 mg/(kg·d)) and high dose (2800 mg/(kg·d)) groups and the phagocytic rate of peritoneal macrophage swallowing chicken red blood cells was significantly (P<0.01) increased of low dose (700 mg/(kg·d)) and middle dose (1400 mg/(kg·d)) groups, which indicated the enhanced immunomodulatory effect of the clam peptide. Conclusions: The clam peptide produced using this process shows a high degree of hydrolysis, a low molecular weight, and a concentrated distribution with enhanced immune function. It has the potential to produce healthy foods or foods for special dietary uses.
-
菲律宾蛤仔(Ruditapes philippinarum),又称花蛤、杂色蛤,广泛分布于中国、韩国、日本及西班牙沿海地区[1],在我国辽宁、山东、福建等南北海区均有分布[2],是重要的海洋渔业资源。菲律宾蛤仔肉质鲜美、营养价值丰富,高蛋白且低脂肪[3]。研究表明,蛤蜊肉中含有丰富的多糖、多肽、糖胺聚糖等生理活性物质[4],蛋白质含量在17%左右,氨基酸组成合理,能够满足人体对20种必需氨基酸的需求[5]。蛤蜊肉还含有多种风味成分,如呈味核苷酸、有机酸和甜菜碱等[6]。
海洋生物活性肽是从海洋生物中提取得到的一类结构多样、具备多重生理活性的肽类[7]。目前,制备海洋生物活性肽的主要方法有合成法、萃取法、酶解法、发酵法等[8],其中酶解法因简单高效,运用最为广泛。免疫力是指人体对外界致病因素的抵抗能力,当免疫功能下降时,机体抵抗病原体、排除异物的能力下降,最终导致感染[9]。研究表明,多种海洋肽类具有免疫调节作用。贝类多肽如扇贝多肽、贻贝多肽、牡蛎多肽等在体外和动物实验中均具有免疫增强作用[10];鱼类多肽如金枪鱼、沙丁鱼多肽、鳕鱼骨肽等均可刺激小鼠免疫应答[11];海参肽可在多方面调节机体免疫功能[12]。
近年来多项研究表明,蛤蜊提取物具有抗氧化[13-14]、调节血糖及血脂[15-16]、抗肿瘤[17]等生物活性。Yang等[18]的研究表明菲律宾蛤仔提取的蛋白肽具有抑菌活性;付金霞等[19]的研究表明,杂色蛤酶解得到的肽段具有血管紧张素转化酶抑制作用,从而具有降血压功效;曹廷锋等[5]的研究同样证实从红岛蛤蜊肉中酶解得到的肽段具有降血压功效。然而,关于蛤蜊多肽的免疫调节功能研究却鲜见报道。本研究以菲律宾蛤仔为原料,通过筛选最适蛋白酶,优化确定了适用于产业化生产的酶解工艺条件和参数,得到小分子蛤蜊多肽粉,研究了其对小鼠免疫功能的调节作用,为蛤蜊高附加值产品开发提供了理论依据。
1. 材料与方法
1.1 材料与仪器
新鲜菲律宾蛤仔肉 市售;碱性蛋白酶(220000 U/g)、中性蛋白酶(130000 U/g)、胰酶(350000 U/g)、复合蛋白酶(木瓜蛋白酶50%,中性蛋白酶30%,米曲霉20%)(52000 U/g)、风味蛋白酶(130000 U/g)、木瓜蛋白酶(230000 U/g) 食品级,南宁庞博生物工程有限公司;色谱用标准品及试剂 国家标准物质研究中心;雄性BALB/c小鼠(18~20 g) SPF级,济南朋悦实验动物繁育有限公司[许可证号:SCXK(鲁)20190003];RPMI-1640细胞培养液、胎牛血清 美国GIBCO公司;刀豆蛋白A(ConA)、噻唑蓝(MTT) 美国Sigma公司;绵阳红细胞、鸡红细胞、姬姆萨染色液、LDH基质液 北京索莱宝科技有限公司;YAC-1细胞 中科院上海生科院细胞资源中心;其他试剂均为国产分析纯。
Agilent 1260高效液相色谱仪 安捷伦科技有限公司;L-8900型氨基酸自动分析仪 日本日立公司;CCL-170B-8型CO2培养箱 新加坡ESCO有限公司;CKX53显微镜 日本奥林巴斯公司;340PC型酶标仪 美国Molecular Devices公司。
1.2 实验方法
1.2.1 蛤蜊肽制备工艺
新鲜蛤蜊肉洗净后,组织匀浆机搅碎,按照一定料液比加入蒸馏水,调节最适pH,按照最适加酶量加入蛋白酶,在一定温度和时间下进行酶解,酶解结束后将酶解液置于90~100 ℃下灭酶15 min,冷却后经双层滤纸抽真空过滤得到上清,酶种类筛选、单因素实验、响应面试验中的水解度使用该上清测定,分子量使用该上清的冻干粉测定;蛤蜊肽的纯化工艺:加入1%活性炭于70 ℃下搅拌1 h,脱腥脱苦以及去除异味,离心去除活性炭得到液体蛤蜊肽,经冷冻干燥后得到固体蛤蜊肽,用于后续氨基酸分析及动物实验。
1.2.2 蛋白酶的筛选
以分子量和水解度为考察指标,比较六种酶类对蛤蜊肽酶解效果的影响,蛋白酶种类及酶解条件如表1所示。
表 1 六种蛋白酶酶解参数Table 1. Enzymatic parameters of six proteases酶种类 pH 温度(℃) 时间(h) 加酶量(U/g) 料液比 碱性蛋白酶 10 45 4 3000 1:3 中性蛋白酶 7 45 4 3000 1:3 胰酶 8 50 4 3000 1:3 复合蛋白酶 7 50 4 3000 1:3 风味蛋白酶 7 50 4 3000 1:3 木瓜蛋白酶 6.5 45 4 3000 1:3 1.2.3 蛤蜊肽制备单因素实验
确定最适水解酶后,分别考察酶解温度(℃)、pH、加酶量(U/g)、料液比、酶解时间(h)对蛋白质水解度的影响,其中固定条件为酶解温度50 ℃,pH8.0,加酶量3000 U/g,酶解时间6 h,料液比1:2,几种因素的考察条件分别为酶解温度40、45、50、55、60 ℃,pH6.5、7.0、7.5、8.0、8.5、9.0,加酶量500、1000、2000、3000、4000、5000 U/g,料液比1:1、1:2、1:3、1:4、1:5,酶解时间1、2、3、4、5、6、7 h,平行3次实验。
1.2.4 蛤蜊肽制备响应面试验
根据单因素实验结果,采用Design-Expert 8.0.6软件进行响应面试验设计。因水解时间和料液比对酶活力产生间接影响,而加酶量、酶解温度和pH三个因素直接影响酶活力,因此固定酶解液水解时间为4 h,料液比1:2,选择加酶量、酶解温度、pH进行优化,共设计17个反应,响应面试验设计因素水平表如表2所示。完成酶解后测定上清水解度,确定最佳酶解条件。
表 2 响应面设计因素水平表Table 2. Response surface design factor level table水平 因素 A pH B 温度(℃) C 加酶量(U/g) −1 7 40 2000 0 8 50 3000 +1 9 60 4000 1.2.5 分子量测定
参照GB31645-2018进行测定。高效液相色谱法,柱温30 ℃,TSK gel G2000SWXL色谱柱,体积流量0.8 mL/min,流动相为乙腈与0.05%三氟乙酸混合溶液,体积比3:7,检测波长220 nm。
1.2.6 水解度测定
采用茚三酮比色法检测水解度[20]。取水解蛋白液1 mL定容到50 mL,取1 mL稀释液于试管中并加入1 mL蒸馏水和1 mL茚三酮显色剂混匀后置于沸水浴中加热15 min,同时作空白实验。标准曲线回归方程为y=0.0231x−0.0076,R2=0.9994,利用标准曲线计算水解蛋白液中肽键的含量(mmol/g),采用下式计算DH的大小。其计算公式如下:
DH(%)=hhtot×100 式中:DH为水解度(%);h为水解后每克蛋白质被裂解的肽键数(mmol/g);htot为每克原料蛋白质的肽键数(mmol/g),蛤蜊肽取8.0。
1.2.7 氨基酸分析
参照GB/T5009.124-2016食品中氨基酸的测定。氨基酸自动分析仪测定,855-4506型离子交换柱(4.6 mm×60 mm),柱温57 ℃,泵流速0.4 mL/min,进样体积20 μL,分析时间50 min。
1.2.8 蛤蜊肽增强免疫力功能实验
1.2.8.1 动物分组及处理
本实验动物伦理审查批文号为OUC-AE-2022-090。BALB/c小鼠适应性喂养3 d后,每批小鼠随机分为5组(n=8),空白对照组(NC)、阳性对照组(牛初乳粉,160 mg/(kg·d),PC)、蛤蜊肽低剂量组(700 mg/(kg·d),GL)、蛤蜊肽中剂量组(1400 mg/(kg·d),GM)、蛤蜊肽高剂量组(2800 mg/(kg·d),GH),其中蛤蜊肽的剂量按照人体推荐摄入量的5、10、20倍确定。以蒸馏水配制受试样品,每日进行灌胃,空白对照组给予等体积蒸馏水,连续灌胃30 d后进行免疫增强活性实验。
1.2.8.2 免疫脏器体重比测定
于灌胃期间每周测定一次体重,末次灌胃后称量小鼠体重,脱颈椎方法处死,取小鼠肝脏、肾脏、脾脏称重并计算脏器体重比值。
1.2.8.3 免疫功能及指标测定
参照《保健食品功能评价方法(2022年版)》中“有助于增强免疫力功能检验方法”规定的方法进行实验[21],分别选择小鼠脾淋巴细胞转化实验、小鼠血清溶血素实验、小鼠巨噬细胞吞噬鸡红细胞实验、NK细胞活性测定进行蛤蜊肽增强免疫能力综合评价,若两个以上剂量表现出增强免疫显著性,则判定该方面结果为阳性,四个方面任两个方面结果阳性,可判定该受试样品具有有助于增强免疫力功能作用。
1.3 数据处理
统计结果以平均值±标准差(mean±SD)表示。利用SPSS21.0软件进行统计分析,采用单因素方差分析数据之间统计学差异,以P<0.05认为差异显著,P<0.01认为差异极显著,P>0.05认为差异不显著。
2. 结果与分析
2.1 酶种类筛选
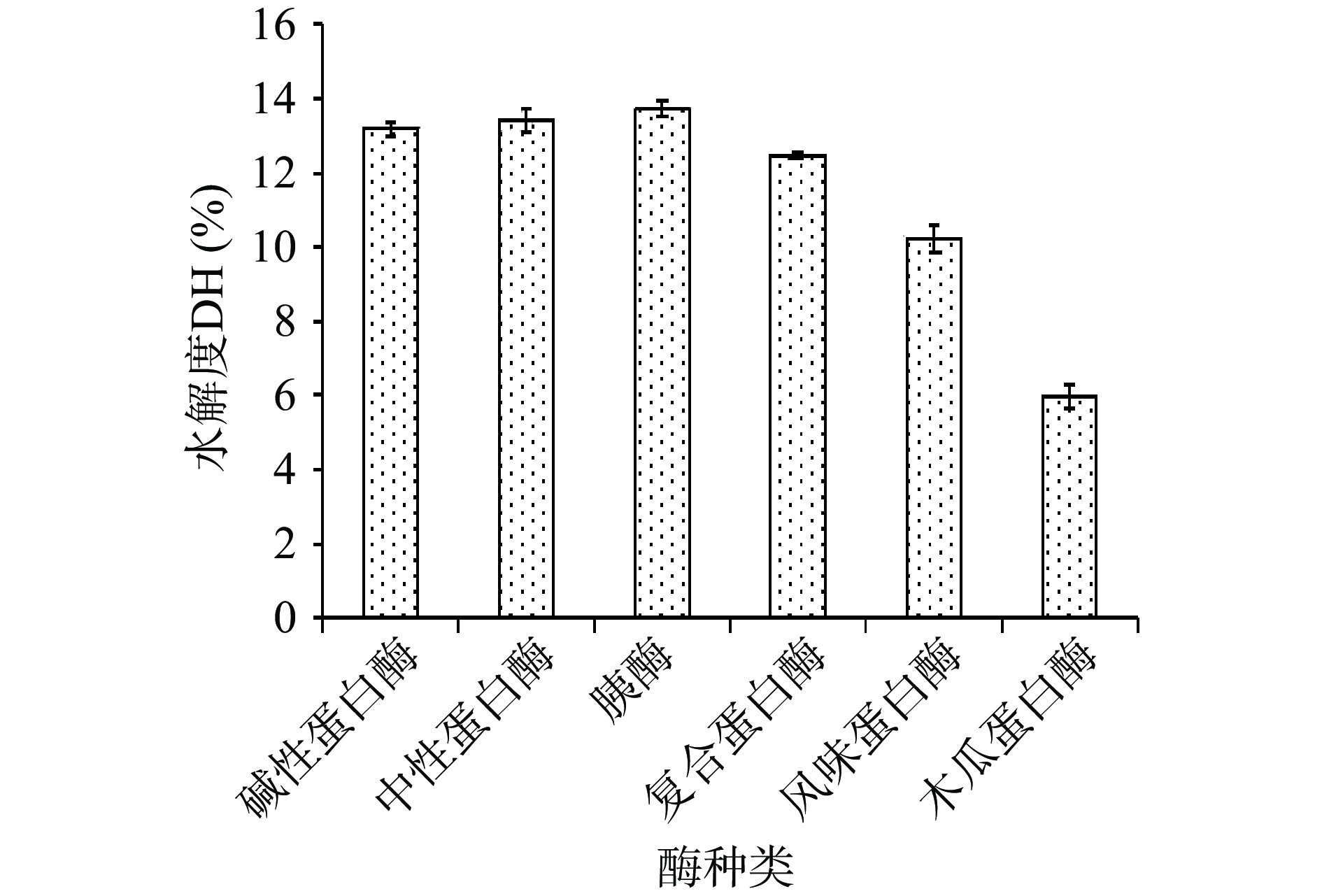
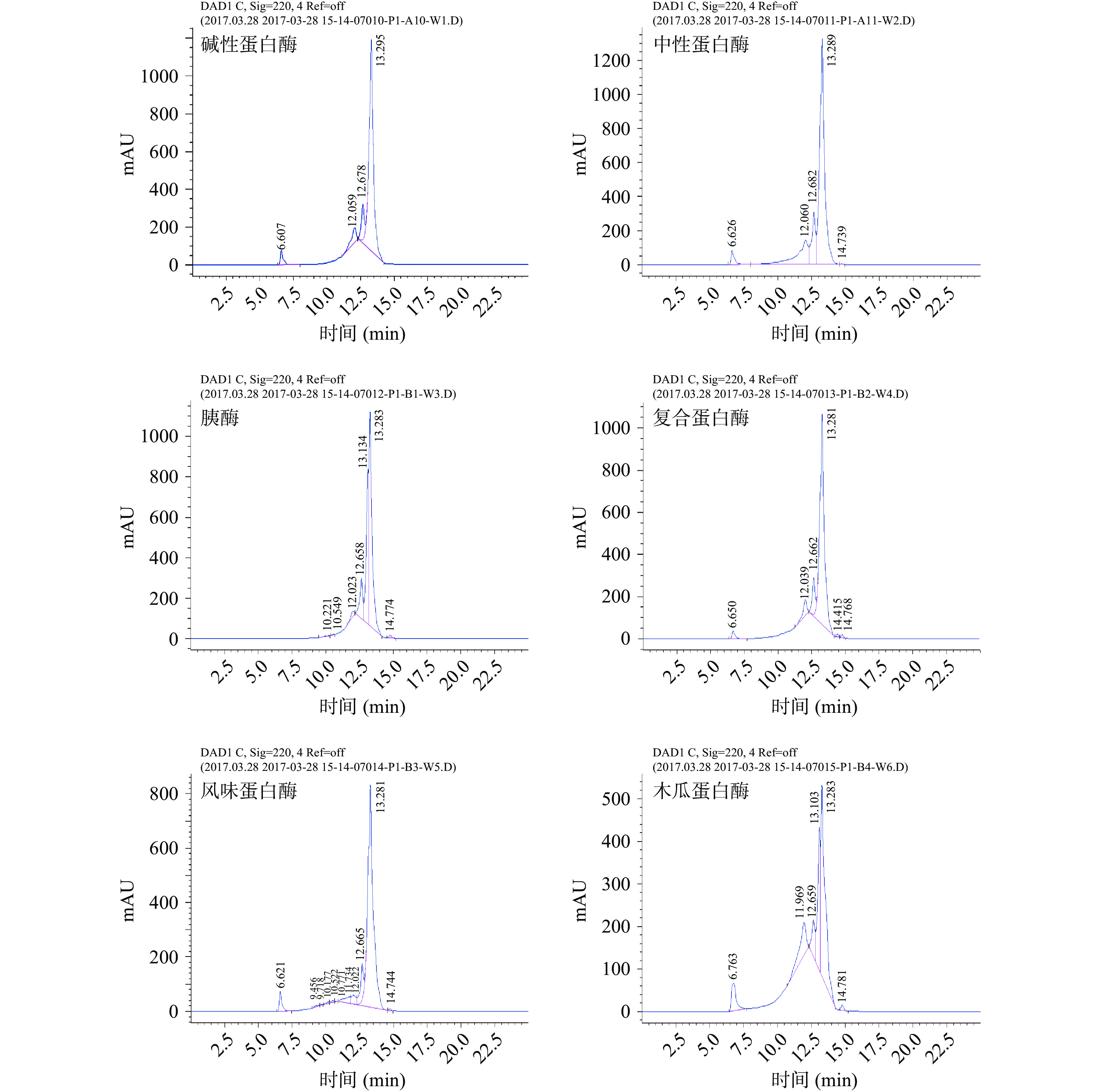
六种蛋白酶的水解度如图1所示,分子量分布如图2所示。胰酶酶解蛤蜊匀浆液效果最好,重均分子量为493 Da、水解度为13.71%,中性蛋白酶其次,水解度为13.41%,碱性蛋白酶和复合蛋白酶酶解后水解度分别为13.18%和12.48%,风味蛋白酶水解度为10.23%,木瓜蛋白酶水解度最低,为5.97%,重均分子量为3417 Da。从分子量分布图可以看出,使用胰酶所得的蛋白肽中分子量在10000 Da以上的含量较少,重均分子量低且分布集中,说明胰酶将大部分蛋白质水解为小分子肽,因此选择胰酶作为蛤蜊肽制备的最适蛋白酶。
2.2 蛤蜊肽制备单因素实验
2.2.1 不同酶解温度对水解度的影响
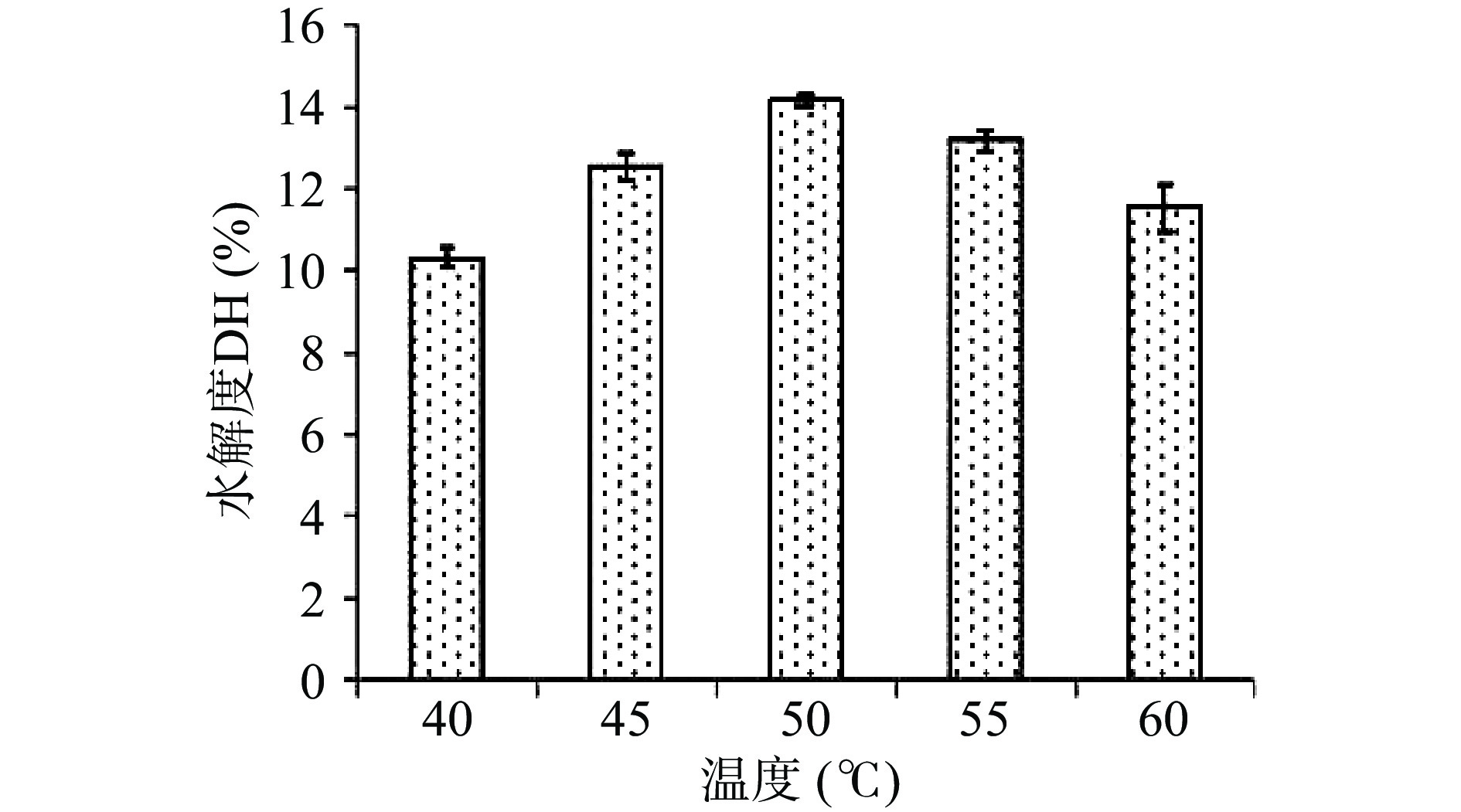
如图3所示,蛋白水解度随温度上升不断增加,到50 ℃时达到14.18%,酶解温度继续升高,水解度下降。过高的酶解温度会破坏酶活性中心,水解能力下降[22],因此选择50 ℃作为响应面试验的0水平。
2.2.2 不同pH对水解度的影响
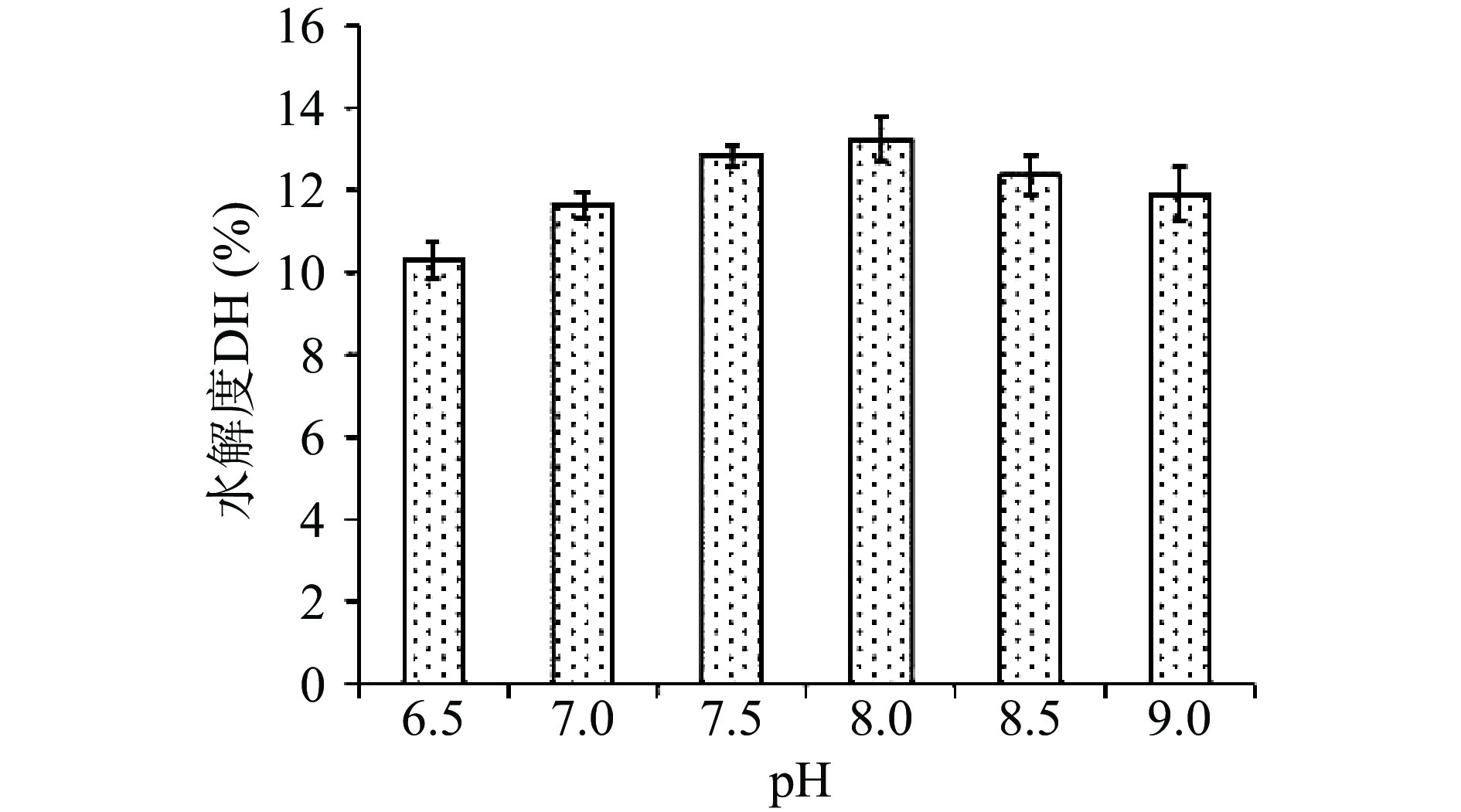
如图4所示,随着pH升高,蛋白水解度持续增加,到pH达到8时水解度达到13.25%,pH继续升高后水解度持续下降。pH影响酶分子侧链上极性基团的解离,改变其带电状态,从而使酶活性中心结构发生变化,在最适pH下,酶活性中心的基团解离状态最适与底物结合,从而提高酶解效率[22],因此选择pH8.0作为响应面试验的0水平。
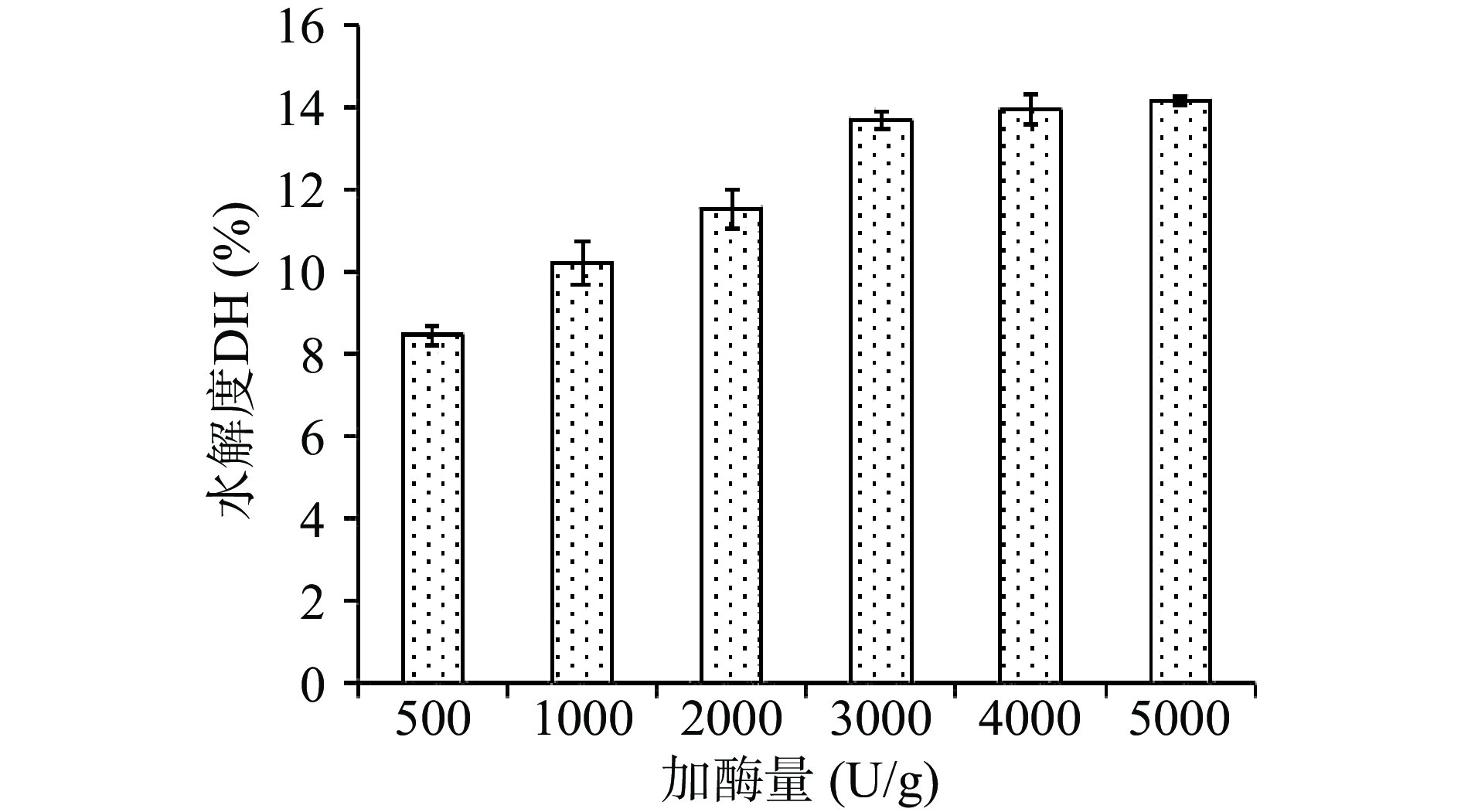
2.2.3 不同加酶量对水解度的影响
如图5所示,水解度随着加酶量增加而升高。加酶量达到3000 U/g以上时,水解度升高缓慢。当加酶量升高时,溶液中酶活性基团增加,可充分与底物结合,增加酶解效率,继续增加时,底物与酶结合已经饱和,因此不会再提高酶解效率[22],故选择3000 U/g作为响应面试验的0水平。
2.2.4 不同料液比对水解度的影响
如图6所示,在料液比为1:2时,水解度达到最高水平,为13.71%。在料液比1:2~1:5范围内,水解度随着料液比升高呈降低趋势,当水解液中酶的有效浓度降低时,无法充分与靶点接触,酶解效率降低[22]。因此选择料液比为1:2作为酶解提取的适宜条件。
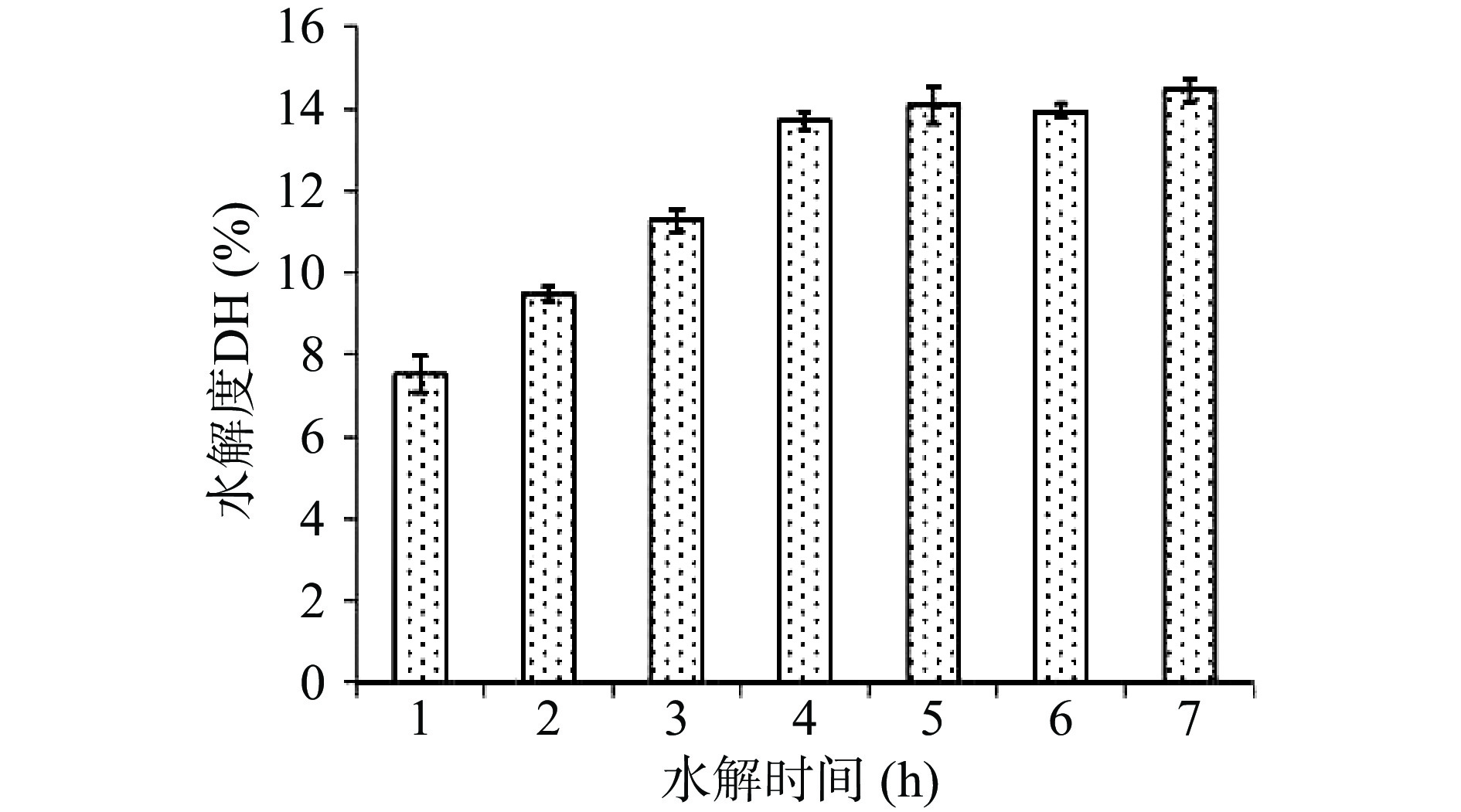
2.2.5 不同酶解时间对水解度的影响
如图7所示,水解度随着酶解时间的延长不断上升,4 h时水解度达到13.7%。4 h以后水解度趋于平缓,酶解时间决定了酶解是否充分,时间过短则酶不能充分发挥作用,时间过长会造成过度酶解[22],因此选择4 h作为最佳酶解时间。
2.3 蛤蜊肽制备响应面试验
使用胰酶进行酶解,固定料液比为1:2,酶解时间为4 h,以pH、酶解温度、加酶量为因素设计响应面试验。响应面结果与方差分析如表3和表4所示,结果表明模型显著(P<0.05),失拟项不显著(P>0.05),说明模型合理;其中温度(B)对应的响应值影响显著(P<0.05),加酶量(C)、温度的二次项(B2)对应的响应值影响极显著(P<0.01);各影响因素的影响性排序为加酶量(C)>温度(B)>pH(A)。
表 3 响应面试验结果Table 3. Results of response surface experiment试验号 A pH B 温度(℃) C 加酶量(U/g) D 水解度DH(%) 1 9 50 2000 9.41 2 7 50 2000 11.04 3 8 40 2000 6.64 4 8 50 3000 12.67 5 7 40 3000 9.41 6 8 60 4000 8.2 7 8 50 3000 12.79 8 8 50 3000 12.3 9 8 50 3000 14.6 10 8 60 2000 7.54 11 9 50 4000 12.79 12 7 50 4000 13.95 13 8 50 3000 14.11 14 9 40 3000 9.35 15 9 60 3000 8.57 16 7 60 3000 6.27 17 8 40 4000 13.93 表 4 回归模型的方差分析Table 4. Analysis of variance of regression equation来源 平方和 自由度 均方 F值 P值 显著 模型 133.26 9 14.81 5.35 0.0189 * A-pH 1.05 1 1.05 0.38 0.557 B-温度 21.62 1 21.62 7.82 0.0267 * C-加酶量 38.75 1 38.76 14.02 0.0072 ** AB 1.04 1 1.04 0.38 0.559 AC 0.058 1 0.058 0.021 0.8893 BC 10.99 1 10.99 3.97 0.0865 A2 0.056 1 0.056 0.02 0.8905 B2 56.97 1 56.97 20.6 0.0027 ** C2 1.22 1 1.22 0.44 0.5279 残差项 19.36 7 2.77 -- -- 失拟项 15.36 3 5.12 5.11 0.0744 纯误差 4.00 4 1.00 -- -- 总离差 152.62 16 -- -- -- 注:*表示显著P<0.05;**表示极显著P<0.01。 图8为以水解度为响应值的趋势图,各因素交互作用排序为BC>AB>AC。最终得出胰酶酶解蛤蜊最佳水解条件:pH7.97,温度48.43 ℃,加酶量3795 U/g,料液比1:2,水解时间4 h,水解度预测值为14.9913%。采用优化条件进行验证,其中pH与温度考虑现实仪器设备可操控性,设置pH8.0,温度为48.4 ℃,此时水解度可达到15.33%,与预测值相差2.25%,基本与预测值一致,此条件下蛤蜊肽重均分子量为418 Da,分子量分布集中。
2.4 蛤蜊肽氨基酸组成分析
对纯化后的固体蛤蜊肽进行检测,分析其多肽含量及氨基酸组成。该蛤蜊肽中多肽含量为59.65%,氨基酸组成结果如表5所示。其必需氨基酸占总氨基酸含量为41.48%,氨基酸组成合理,营养价值较高,可满足人体需求;疏水性氨基酸占总氨基酸含量为43.98%,正电荷氨基酸占总氨基酸含量为18.26%。疏水性氨基酸如Ala、Val、Met、Ile、Leu、Tyr、Phe、Pro是具有免疫调节作用的食源性蛋白肽的常见氨基酸残基,带正电荷的氨基酸Lys、His和Arg与多肽免疫调节功能呈正相关,提示该工艺下所得的蛤蜊肽可能具备一定的增强免疫活性。
表 5 蛤蜊肽氨基酸分析Table 5. The amino acid analysis of clam peptide氨基酸种类 含量(%) 天门冬氨酸Asp 3.97 谷氨酸Glu 7.27 丙氨酸Ala# 3.88 甘氨酸Gly 4.73 胱氨酸Cys 0.74 脯氨酸Pro# 2.26 丝氨酸Ser 2.16 酪氨酸Tyr# 2.52 非必需氨基酸总量(NEAA) 27.53 组氨酸His* 1.28 精氨酸Arg* 4.15 半必需氨基酸总量(SEAA) 5.43 缬氨酸Val# 3.08 蛋氨酸Met# 1.32 苯丙氨酸Phe# 4.93 异亮氨酸Ile# 2.57 亮氨酸Leu# 4.21 赖氨酸Lys* 4.86 苏氨酸Thr 2.40 色氨酸Trp# 0.00 必需氨基酸总量(EAA) 23.37 疏水氨基酸总量(HAA) 24.77 正电荷氨基酸总量(PCAA) 10.29 氨基酸总量(TAA) 56.33 EAA/TAA 41.48 HAA/TAA 43.98 PCAA/TAA 18.26 注:#为疏水氨基酸,*为正电荷氨基酸。 2.5 蛤蜊肽增强免疫力功能实验
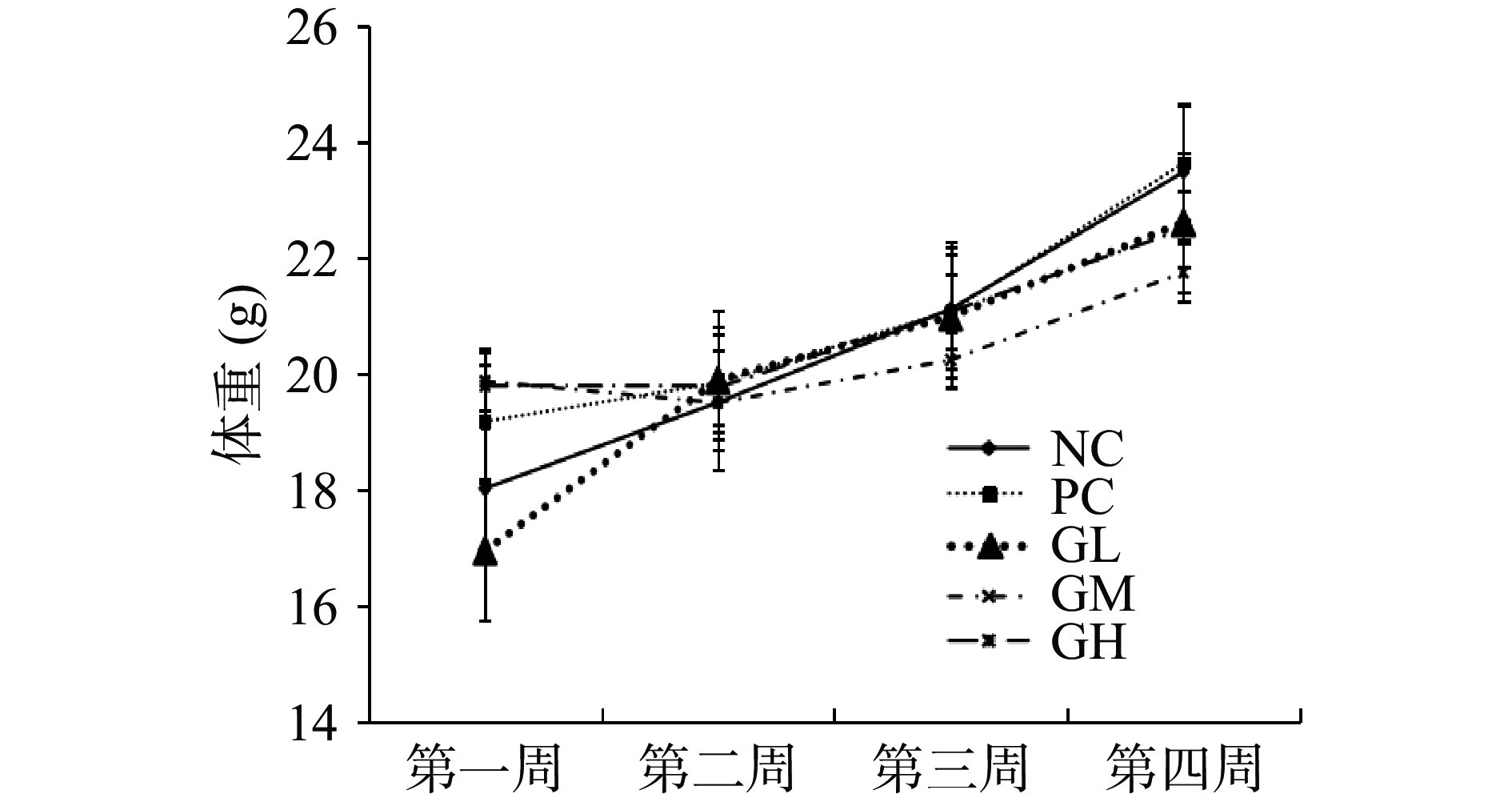
2.5.1 蛤蜊肽对小鼠体重及脏器指数的影响
由图9可知,在给予受试物期间,各组小鼠体重呈总体上升趋势,其中蛤蜊肽低剂量组体重增加幅度最大,各组小鼠体重均在正常范围内增加且无显著性差异(P>0.05),说明蛤蜊肽对小鼠正常生长发育无明显影响。各组小鼠脏器指数结果如表6所示,从中可以看出,阳性对照组可以提高脾脏、肾脏脏器指数,但无显著性差异(P>0.05);蛤蜊肽低、中剂量组可增加免疫器官脾脏脏器指数,但无显著性差异(P>0.05)。脾脏作为外周免疫器官,是参与免疫反应的主要场所,免疫器官指数的变化反映受试物对免疫器官及免疫调节是否有影响[23],实验结果表明蛤蜊肽对小鼠免疫器官无明显刺激效果。有研究表明,松花粉鳕鱼皮胶原肽复合物对小鼠脾脏脏器指数无明显影响[24],牡蛎低分子肽可恢复免疫抑制小鼠免疫脏器水平[25],对比之下蛤蜊肽的刺激效果并不显著,提示其对脾脏T淋巴细胞、B淋巴细胞等免疫细胞的增殖促进作用不明显,并需进一步探索其在体液免疫、非特异性免疫等方面的作用。
表 6 蛤蜊肽对小鼠脏器指数的影响Table 6. Effect of clam peptide on organ indices in mice组别 脏器指数(%) 肝脏 脾 左肾 右肾 NC 4.36±0.33 0.44±0.05 0.76±0.05 0.78±0.05 PC 4.31±0.35 0.46±0.09 0.79±0.07 0.84±0.07 GL 4.08±0.29 0.46±0.04 0.80±0.05 0.81±0.05 GM 4.33±0.29 0.49±0.07 0.85±0.06 0.84±0.05 GH 4.41±0.38 0.43±0.06 0.85±0.07 0.85±0.08 2.5.2 蛤蜊肽对小鼠免疫功能指标的影响
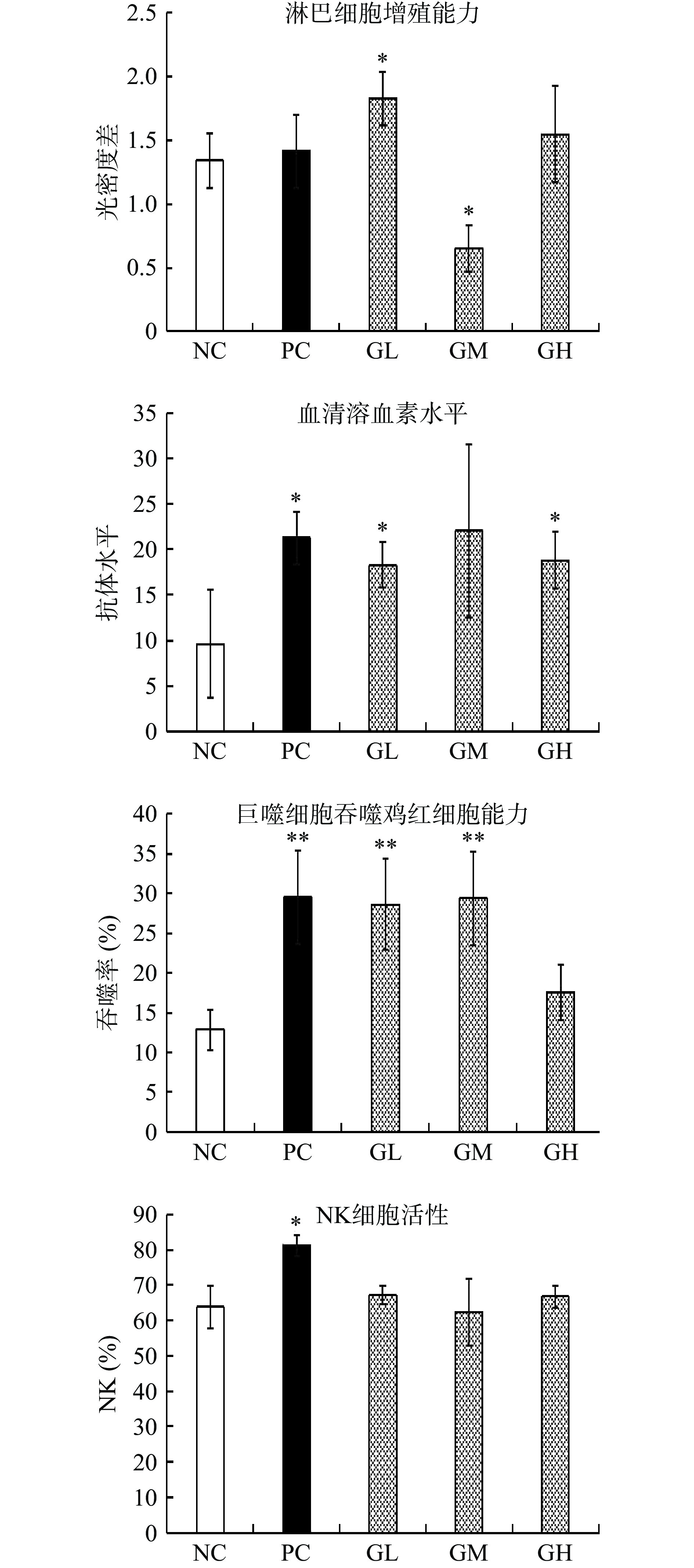
不同剂量的蛤蜊肽对小鼠免疫功能影响如图10所示。脾细胞中含有多种免疫细胞,如巨噬细胞、淋巴细胞等,对机体免疫调节起到重要作用[26],T细胞受ConA刺激后即向淋巴母细胞转化,转化率的高低可以反映机体的细胞免疫水平[27]。相对比空白对照组,低剂量组蛤蜊肽可显著增加脾淋巴细胞增殖能力(P<0.05)。研究表明,大马哈鱼肽、海参肽[28-29]等海洋多肽可通过促进脾淋巴细胞增殖和转化增强免疫力,而富含Asp、Ala、Glu的红藻多肽[30]对大鼠脾淋巴细胞有促分裂作用,本实验所得蛤蜊肽中富含Glu、Asp等氨基酸,因此推测低剂量蛤蜊肽通过对脾淋巴细胞促分裂而诱导其增殖转化。中剂量组则表现出显著降低的作用(P<0.05),其具体原因有待深入探究。根据《增强免疫力功能评价方法》中的结果判定,当两个以上剂量显著时,可判定受试物在此方面具有增强免疫效果,因此蛤蜊肽在脾淋巴细胞转化方面未能表现出增强免疫活性。
当绵阳红细胞免疫小鼠后,可产生溶血素抗体,其水平可反映体液免疫能力[31]。相对比空白对照组,阳性对照组可显著增加抗体水平(P<0.05),同时蛤蜊肽低、高剂量组可显著增加抗体水平(P<0.05),中剂量组因组内个体差异明显,不具备显著性(P>0.05)。说明受试样品具有提高血清溶血素水平的作用,并在体液免疫方面发挥增强免疫作用。研究表明,牡蛎低分子肽[25]可提高模型小鼠血清溶血素水平,提示海洋活性肽类可能通过改善血清中补体的溶血活性,从而增强体液免疫。
巨噬细胞在人体组织中分布较广,是一类能吞噬和杀伤病原体的免疫细胞,在特异性和非特异性免疫中起重要作用[32],小鼠巨噬细胞对鸡红细胞吞噬能力反映其免疫能力。实验结果显示,相对比空白对照组,阳性对照组可极显著增加鸡红细胞吞噬率(P<0.01),同时蛤蜊肽低、中剂量组可极显著增加鸡红细胞吞噬率(P<0.01),高剂量组无法显著增加吞噬率(P>0.05),原因可能是蛤蜊肽在血液中的吸收已经达到峰值,过高剂量的蛤蜊肽虽未表现出明显的脏器毒副作用,但可能会加重脏器及机体代谢负担,影响各方面机能,从而无法发挥最佳效果。该实验表明受试样品在单核巨噬细胞功能方面可发挥免疫作用。研究证实,贻贝肽、青蛤多肽[33-34]可增强巨噬细胞吞噬功能,促吞噬肽是一种非特异性免疫调节四肽[35],由本研究得到的蛤蜊肽分子量得出其主要成分为三肽或四肽,因此推测其可能与促吞噬肽发挥类似的非特异性免疫调节作用。
NK细胞能够识别病毒、炎症、肿瘤等靶标,从而起到抗肿瘤、抗病毒感染等免疫作用[36],NK细胞对靶细胞YAC-1具有细胞毒性,其杀伤力反映非特异性免疫应答强度[37]。从结果来看,相对比空白对照组,阳性对照组可显著增加NK细胞活性(P<0.05),但蛤蜊肽无法显著加强NK细胞活性(P>0.05),说明受试样品在NK细胞活性方面无法发挥增强免疫作用。
3. 讨论与结论
本实验以菲律宾蛤仔(Ruditapes philippinarum)为原料,以蛋白水解度为评价指标,筛选最适蛋白酶,采用单因素实验和响应面试验确定最佳酶解条件。其最优条件为采用胰酶酶解,反应温度48.43 ℃、pH7.97,加酶量3795 U/g,料液比1:2,水解时间4 h,实际操作中采用温度48.4 ℃,pH8.0,加酶量3795 U/g,料液比1:2,水解时间4 h,该工艺下蛤蜊肽水解度为15.33%,高于预测值,蛋白肽重均分子量为418 Da,分子量分布均一,其主要肽段为小分子三肽及四肽,酶解程度较高;通过分析氨基酸组成发现其必需氨基酸含量较高,氨基酸组成合理,是一种优质的海洋蛋白肽。
对所得酶解液进一步脱腥脱苦、冷冻干燥后得到固体蛤蜊肽,评价其免疫增强活性。该活性肽对小鼠的脏器比值无显著影响(P>0.05),但低剂量与高剂量蛤蜊肽能显著提高血清溶血素水平、低剂量与中剂量蛤蜊肽能显著提高小鼠腹腔巨噬细胞吞噬鸡红细胞吞噬率(P<0.05),提示在体液免疫和非特异性细胞免疫中发挥作用,根据《增强免疫力功能评价方法》中的结果判定,认为该方法制备的蛤蜊肽具有一定的增强免疫功能。由蛤蜊肽分子量推断,其多肽组成主要为三肽和四肽等小分子肽,其氨基酸组成可能与免疫调节活性有关;研究表明,具有免疫调节作用的食源性蛋白肽常见的残基是疏水性氨基酸,如Ala、Val、Met、Ile、Leu、Tyr、Phe、Pro等[38],本研究中所得蛤蜊肽中必需氨基酸占总氨基酸含量的41.48%,其中Ala、Val、Met、Ile、Leu、Tyr、Phe、Pro等疏水性氨基酸占总氨基酸含量为43.98%。也有研究进一步表明,带正电荷的氨基酸含量与多肽免疫调节功能呈正相关[39],蛤蜊肽的Lys、His和Arg等带正电荷的氨基酸占氨基酸总量为18.26%。因此,本研究中蛤蜊肽的免疫活性可能与这些疏水性氨基酸和带正电荷的氨基酸组成及其含量有关,但其构效关系和作用机制方面还有待深入研究。综上所述,本研究对蛤蜊肽生产具有一定指导意义,并为相关免疫功能食品开发提供了理论依据。
-
表 1 六种蛋白酶酶解参数
Table 1 Enzymatic parameters of six proteases
酶种类 pH 温度(℃) 时间(h) 加酶量(U/g) 料液比 碱性蛋白酶 10 45 4 3000 1:3 中性蛋白酶 7 45 4 3000 1:3 胰酶 8 50 4 3000 1:3 复合蛋白酶 7 50 4 3000 1:3 风味蛋白酶 7 50 4 3000 1:3 木瓜蛋白酶 6.5 45 4 3000 1:3 表 2 响应面设计因素水平表
Table 2 Response surface design factor level table
水平 因素 A pH B 温度(℃) C 加酶量(U/g) −1 7 40 2000 0 8 50 3000 +1 9 60 4000 表 3 响应面试验结果
Table 3 Results of response surface experiment
试验号 A pH B 温度(℃) C 加酶量(U/g) D 水解度DH(%) 1 9 50 2000 9.41 2 7 50 2000 11.04 3 8 40 2000 6.64 4 8 50 3000 12.67 5 7 40 3000 9.41 6 8 60 4000 8.2 7 8 50 3000 12.79 8 8 50 3000 12.3 9 8 50 3000 14.6 10 8 60 2000 7.54 11 9 50 4000 12.79 12 7 50 4000 13.95 13 8 50 3000 14.11 14 9 40 3000 9.35 15 9 60 3000 8.57 16 7 60 3000 6.27 17 8 40 4000 13.93 表 4 回归模型的方差分析
Table 4 Analysis of variance of regression equation
来源 平方和 自由度 均方 F值 P值 显著 模型 133.26 9 14.81 5.35 0.0189 * A-pH 1.05 1 1.05 0.38 0.557 B-温度 21.62 1 21.62 7.82 0.0267 * C-加酶量 38.75 1 38.76 14.02 0.0072 ** AB 1.04 1 1.04 0.38 0.559 AC 0.058 1 0.058 0.021 0.8893 BC 10.99 1 10.99 3.97 0.0865 A2 0.056 1 0.056 0.02 0.8905 B2 56.97 1 56.97 20.6 0.0027 ** C2 1.22 1 1.22 0.44 0.5279 残差项 19.36 7 2.77 -- -- 失拟项 15.36 3 5.12 5.11 0.0744 纯误差 4.00 4 1.00 -- -- 总离差 152.62 16 -- -- -- 注:*表示显著P<0.05;**表示极显著P<0.01。 表 5 蛤蜊肽氨基酸分析
Table 5 The amino acid analysis of clam peptide
氨基酸种类 含量(%) 天门冬氨酸Asp 3.97 谷氨酸Glu 7.27 丙氨酸Ala# 3.88 甘氨酸Gly 4.73 胱氨酸Cys 0.74 脯氨酸Pro# 2.26 丝氨酸Ser 2.16 酪氨酸Tyr# 2.52 非必需氨基酸总量(NEAA) 27.53 组氨酸His* 1.28 精氨酸Arg* 4.15 半必需氨基酸总量(SEAA) 5.43 缬氨酸Val# 3.08 蛋氨酸Met# 1.32 苯丙氨酸Phe# 4.93 异亮氨酸Ile# 2.57 亮氨酸Leu# 4.21 赖氨酸Lys* 4.86 苏氨酸Thr 2.40 色氨酸Trp# 0.00 必需氨基酸总量(EAA) 23.37 疏水氨基酸总量(HAA) 24.77 正电荷氨基酸总量(PCAA) 10.29 氨基酸总量(TAA) 56.33 EAA/TAA 41.48 HAA/TAA 43.98 PCAA/TAA 18.26 注:#为疏水氨基酸,*为正电荷氨基酸。 表 6 蛤蜊肽对小鼠脏器指数的影响
Table 6 Effect of clam peptide on organ indices in mice
组别 脏器指数(%) 肝脏 脾 左肾 右肾 NC 4.36±0.33 0.44±0.05 0.76±0.05 0.78±0.05 PC 4.31±0.35 0.46±0.09 0.79±0.07 0.84±0.07 GL 4.08±0.29 0.46±0.04 0.80±0.05 0.81±0.05 GM 4.33±0.29 0.49±0.07 0.85±0.06 0.84±0.05 GH 4.41±0.38 0.43±0.06 0.85±0.07 0.85±0.08 -
[1] YAMASAKI Y, TAGA S, KISHIOKA M, et al. A metabolic profile in Ruditapes philippinarum associated with growth-promoting effects of alginate hydrolysates[J]. Scientific Reports,2016,6:23−29. doi: 10.1038/s41598-016-0029-9
[2] TAN Y, FANG L, QIU M, et al. Population genetics of the Manila clam (Ruditapes philippinarum) in East Asia[J]. Scientific Reports,2020,10(1):21890. doi: 10.1038/s41598-020-78923-w
[3] 孙晓东, 谭书明. 木瓜蛋白酶酶解制备红岛蛤蜊肉多肽工艺的研究[J]. 贵州农业科学,2017,45(2):146−149. [SUN Xiaodong, TAN Shuming. Optimization of papain enzymolysis process for polypeptide preparation from clam meat[J]. Guizhou Agricultural Sciences,2017,45(2):146−149. doi: 10.3969/j.issn.1001-3601.2017.02.035 [4] YU Y, LIU H W, TU M L, et al. Mass spectrometry analysis and in silico prediction of allergenicity of peptides in tryptic hydrolysates of the proteins from Ruditapes philippinarum[J]. Journal of the Science of Food and Agriculture,2017,97(15):5114−5122. doi: 10.1002/jsfa.8389
[5] 曹廷锋, 刘金丽, 樊芳, 等. 红岛蛤蜊肉酶解工艺优化及其产物降血压功能研究[J]. 食品工业科技,2021,42(7):216−222. [CAO Tingfeng, LIU Jinli, FAN Fang, et al. Optimization of enzymatic hydrolysis of Hongdao clam and anti-hypertensive activity of the resulted products[J]. Science and Technology of Food Industry,2021,42(7):216−222. [6] 饶梦微, 章超桦, 林海生, 等. 菲律宾蛤仔肉不同提取物呈味特性[J]. 广东海洋大学学报,2022,42(1):90−97. [RAO Mengwei, ZHANG Chaohua, LIN Haisheng, et al. Sensory characteristic of different extracts from Ruditapes philippinarum[J]. Journal of Guangdong Ocean University,2022,42(1):90−97. [7] CHEUNG R C, NG T B, WONG J H. Marine peptides: Bioactivities and applications[J]. Marine Drugs,2015,13(7):4006−4043. doi: 10.3390/md13074006
[8] 杨贵兰, 秦松, 李文军, 等. 海洋生物活性肽的功能、制备技术与作用机制研究进展[J]. 海洋科学,2021,45(10):123−132. [YANG Guilan, QIN Song, LI Wenjun, et al. Function, preparation technology, and mechanism of marine biological active peptides[J]. Marine Sciences,2021,45(10):123−132. [9] RANASINGHE C, OZEMEK C, ARENA R. Exercise and well-be-ing during COVID 19-time to boost your immunit[J]. Expert Review of Anti-infective Therapy,2020,18(12):1195−1200. doi: 10.1080/14787210.2020.1794818
[10] 杨志艳, 惠婷婷, 李燕, 等. 海洋生物来源免疫调节活性肽的研究进展[J]. 食品与发酵工业,2022,48(8):289−295. [YANG Zhiyan, HUI Tingting, LI Yan, et al. Research progress of immunomodulatory peptides derived from marine organisms[J]. Food and Fermentation Industries,2022,48(8):289−295. [11] 袁学文, 王炎冰. 远东拟沙丁鱼低聚肽化学组成及其增强免疫力功能评价[J]. 食品与发酵工业,2018,44(4):104−110. [YUAN Xuewen, WANG Yanbing. Chemical composition of oligopeptide from Sardinops agax and its immunoregulatory activity evaluation[J]. Food and Fermentation Industries,2018,44(4):104−110. [12] 何丽霞, 陈启贺, 刘睿, 等. 海参寡肽免疫调节作用及机制研究[J]. 科技导报,2016,34(11):42−47. [HE Lixia, CHEN Qihe, LIU Rui, et al. Sea cucumber oligopeptides: Immunomodulatory effects and its mechanism[J]. Science & Techology Review,2016,34(11):42−47. [13] MOU J J, WANG C, LI Q, et al. Preparation and antioxidant properties of low molecular holothurian glycosaminoglycans by H2O2/ascorbic acid degradation[J]. International Journal of Biological Macromo-lecules,2018,107:1339−1347. doi: 10.1016/j.ijbiomac.2017.10.161
[14] YU Y, FAN F, WU D, et al. Antioxidant and ACE inhibitory activity of enzymatic hydrolysates from Ruditapes philippinarum[J]. Molecules,2018,23(5):1189. doi: 10.3390/molecules23051189
[15] YUAN C Y, LIU P, HAN X, et al. Hypoglycemic effects of glycosaminoglycan from Urechis unicinctus in diabetic mice[J]. Journal of Medicinal Food,2015,18(2):190−194. doi: 10.1089/jmf.2013.3139
[16] PANDIAN V, ARAVINDAN N, SUBRAMANIAN S, et al. Lipid-lowering effect of molluscan (Katelysia opima) glycosaminoglycan (GAG) in hypercholesterolemic induced rats[J]. Biological Chemistry,2014,395(3):355−364. doi: 10.1515/hsz-2013-0214
[17] 史倩, 王晓洁, 蒋绍霞, 等. 中国蛤蜊精对小鼠体内外抗肿瘤作用的研究[J]. 时珍国医国药,2014,25(12):2877−2879. [SHI Qian, WANG Xiaojie, JIANG Shaoxia, et al. Antitumor effects of Chinese clam extract on mice in vitro and in vivo[J]. Lishizhen Medicine and Materia Medical Research,2014,25(12):2877−2879. [18] YANG D L, ZHANG Q Q, WANG Q, et al. A defensin-like antimicrobial peptide from the manila clam Ruditapes philippinarum: Investigation of the antibacterial activities and mode of action[J]. Fish and Shellfish Immunology,2018,80:274−280. doi: 10.1016/j.fsi.2018.06.019
[19] 付金霞, 赵隽, 李智博, 等. 杂色蛤酶解制备ACE抑制肽的工艺优化[J]. 农产品加工,2014(21):36−38, 41. [FU Jinxia, ZHAO Jun, LI Zhibo, et al. Hydrolyzation conditions of ACE inhibitory peptide from Ruditapes philippinarum[J]. Farm Products Processing,2014(21):36−38, 41. [20] 李皖光, 汪桃花, 王新文, 等. 4种大米蛋白水解度测定方法比较[J]. 粮食科技与经济,2017,42(5):35−37. [LI Wanguang, WANG Taohua, WANG Xinwen, et al. The comparison of four methods in testing degree of hydrolysis[J]. Grain Science and Technology and Economy,2017,42(5):35−37. [21] 国家市场监管总局. 关于公开征求《关于发布允许保健食品声称的保健功能目录 非营养素补充剂(2022年版)及配套文件的公告(征求意见稿)》意见的公告[EB/OL]. (2022-01-13). https://www.samr.gov.cn/hd/zjdc/202201/t20220113_339092.html. State Administration for Market Regulation. Notice for public solicitation of comments on the publication of supporting documents in the list of health functions that health food is allowed to claim, non-nutrient supplements (2022 edition) and supportive documents (draft for comment)[EB/OL]. (2022-01-13). https://www.samr.gov.cn/hd/zjdc/202201/t20220113_339092.html.
[22] 赵峻露, 李春楠, 尹馨雪, 等. 响应面法优化鹿鞭肽酶解工艺及体外补肾健骨活性分析[J]. 食品工业科技,2023,44(2):213−221. [ZHAO Junlu, LI Chunnan, YIN Xinxue, et al. Optimization of the enzymatic hydrolysis process of Penis et Testis Cervi peptides by response surface methodology and analysis on the activity of tonifying kidney and strengthing bone in vitro[J]. Science and Technology of Food Industry,2023,44(2):213−221. [23] 李睿珺, 秦勇, 周雅琳, 等. 鹰嘴豆肽对免疫低下小鼠免疫功能的影响[J]. 食品科学,2020,41(21):133−139. [LI Ruijun, QIN Yong, ZHOU Yalin, et al. Effect of chickpea peptide on immune function of immunocompromised mice[J]. Food Science,2020,41(21):133−139. doi: 10.7506/spkx1002-6630-20191102-016 [24] 尹利端, 刘楚怡, 乔强, 等. 松花粉鳕鱼皮胶原肽复合物对小鼠免疫及抗氧化功能的影响[J]. 中国食品添加剂,2022,33(7):30−36. [YIN Liduan, LIU Chuyi, QIAO Qiang, et al. Effects of pine pollen combined with cod skin collagen peptides on immunity and antioxidant activity in mice[J]. China Food Additives,2022,33(7):30−36. [25] 李晋祯, 郑惠娜, 任鼎鼎, 等. 牡蛎低分子肽LOPs对短期免疫抑制小鼠的免疫调节作用[J/OL]. 中国食品学报, 2022-09-15. https://kns.cnki.net/kcms/detail/11.4528.TS.20220825.1613.002.html. LI Jinzhen, ZHENG Huina, REN Dingding, et al. Immunomodulatory effects of low molecular weight oyster peptides in short-term immunosuppressed mice[J/OL]. Journal of Chinese Institute of Food Science and Technology, 2022-09-15. https://kns.cnki.net/kcms/detail/11.4528.TS.20220825.1613.002.html.
[26] 钟静诗, 王共明, 张健, 等. 仿刺参雌性生殖腺皂苷的免疫增强活性研究[J/OL]. 食品工业科技, 2022-06-23. DOI: 10.13386/j.issn1002-0306.2022030289. ZHONG Jingshi, WANG Gongming, ZHANG Jian, et al. Study on immune-enhancing activity of gonad saponins from female of Apostichopus japonicus[J/OL]. Science and Technology of Food Industry, 2022-06-23. DOI: 10.13386/j.issn1002-0306.2022030289.
[27] LEE H E, YANG G, CHOI J S, et al. Suppression of primary splenocyte proliferation by Artemisia capillaris and its components[J]. Toxicology Research,2017,33(4):283−290. doi: 10.5487/TR.2017.33.4.283
[28] YANG R Y, PEI X R, WANG J B, et al. Protective effect of a marine oligopeptide preparation from Chum Salmon (Oncorhynchus keta) on radiation-induced immune suppression in mice[J]. Journal of the Science of Food Agriculture,2010,90(13):2241−2248. doi: 10.1002/jsfa.4077
[29] 乐卿清, 廖翼江, 汤桂秋, 等. 海参肽提高免疫力的功效评价[J]. 现代食品,2021(10):111−114. [LE Qinqing, LIAO Yijiang, TANG Guiqiu, et al. Evaluation of the efficacy of sea cucumber peptides in improving immunity[J]. Modern Food,2021(10):111−114. [30] CIAN R E, LÓPEZ-POSADAS R, DRAGO S R, et al. A porphyra columbina hydrolysate upregulates IL-10 production in rat macrophages and lymphocytes through an NF-κB, and p38 and JNK dependent mechanism[J]. Food Chemistry,2012,134(4):1982−1990. doi: 10.1016/j.foodchem.2012.03.134
[31] ZANG X X, QIAN B C, LIU J. Effects of immunoagents on circulating serum hemolysin formation in bone marrow and spleen[J]. Zhongguo Yao Li Xue Bao,1990,11(5):477−80.
[32] 陈金龙, 张月巧, 袁娅, 等. 植物多糖通过 NF-κB信号通路对巨噬细胞的免疫调节作用研究进展[J]. 食品科学,2015,36(23):288−294. [CHEN Jinlong, ZHANG Yueqiao, YUAN Ya, et al. Progress in research on immune-regulatory effects of plant polysaccharides on macrophages through NF-κB signaling pathway[J]. Food Science,2015,36(23):288−294. doi: 10.7506/spkx1002-6630-201523053 [33] KIM Y S, AHN C B, JE J Y. Anti-inflammatory action of high molecular weight Mytilus edulis hydrolysates fraction in LPS-induced RAW264.7 macrophage via NF-κB and MAPK pathways[J]. Food Chemistry,2016,202:9−14. doi: 10.1016/j.foodchem.2016.01.114
[34] 叶盛旺, 杨最素, 李维, 等. 青蛤酶解多肽对RAW264.7巨噬细胞的免疫调节作用[J]. 食品科学,2019,40(7):185−191. [YE Shengwang, YANG Zuisu, LI Wei, et al. Immunomodulatory effects of peptides from enzymatic hydrolysate of Cyclina sinensis on RAW264.7 macrophages[J]. Food Science,2019,40(7):185−191. doi: 10.7506/spkx1002-6630-20171214-163 [35] 孙佳鑫, 侯明星. 促吞噬肽免疫学机制的研究进展[J]. 世界最新医学信息文摘,2018,18(16):53−54, 57. [SUN Jiaxin, HOU Mingxing. The advances of tuftsin on immunological mechanisms[J]. World Latest Medicine Information,2018,18(16):53−54, 57. [36] TERRÉN I, ORRANTIA A, VITALLÉ J, et al. NK cell metabolism and tumor microenvironment[J]. Frontiers in Immunology,2019,10:2278. doi: 10.3389/fimmu.2019.02278
[37] BIGGER J E, THOMAS C A, ATHERTON S S. NK cell modulation of murine cytomegalovirus retinitis[J]. Journal of Immunology,1998,160(12):5826−5831. doi: 10.4049/jimmunol.160.12.5826
[38] 刁静静. 绿豆肽对小鼠巨噬细胞免疫活性的影响及其作用机制[D]. 大庆: 黑龙江八一农垦大学, 2019. DIAO Jingjing. Immunomdulatory activity and mechanism of mung bean peptides on macrophage[D]. Daqing: Heilongjiang Bayi Agricultural University, 2019.
[39] 李富强, 张廷新, 朱丽萍, 等. 食物蛋白源免疫调节肽研究进展[J]. 食品与发酵工业,2021,48(1):308−314. [LI Fuqiang, ZHANG Tingxin, ZHU Liping, et al. Advance of immunomodulatory peptides from dietary-protein source[J]. Food and Fermentation Industries,2021,48(1):308−314.





 下载:
下载:



 下载:
下载:



