Effects of Mussel Polysaccharides on Glucose Metabolism in Insulin-resistant HepG2 Cells
-
摘要: 为了探究贻贝多糖对胰岛素抵抗(Insulin resistance,IR)HepG2细胞糖代谢影响的潜在分子机制,以贻贝多糖(Mussel polysaccharides,MP)为研究材料,采用CCK8法检测HepG2细胞的增殖情况,同时筛选不同浓度胰岛素构建细胞胰岛素抵抗模型,检测MP对胰岛素抵抗HepG2细胞葡萄糖消耗的影响。结果显示:当胰岛素浓度处于10−6 mol/L时,HepG2细胞的葡萄糖含量最高,对葡萄糖的消耗能力最弱,是构建胰岛素抵抗模型的最佳浓度。此外,MP(100~1000 μg/mL)对HepG2细胞无毒性,能促进细胞增殖。与IR-HepG2细胞相比,200、400、600 μg/mL的MP能明显提升糖原含量,分别为17.20%、22.95%和32.50%。同时,高剂量MP能显著上调PI3K和GLUT2的相对基因表达量,并能降低GSK-3β的表达量。为后续MP降血糖提供实验基础,同时有助于促进MP的开发利用。Abstract: This study aimed to evaluate the effects of mussel polysaccharides on glucose metabolism in insulin resistance HepG2 cells. Using the mussel polysaccharide (MP) as the research material, the CCK8 method was used to detect the proliferation of HepG2 cells, and different concentrations of insulin were screened to construct a cellular insulin resistance model to detect the effect of mussel polysaccharide on glucose consumption of insulin-resistant HepG2 cells. The results showed that when the insulin concentration was 10−6 mol/L, the glucose content of HepG2 cells was the highest and the ability to consume glucose was the weakest, and it was the best concentration for constructing the insulin resistance model. MP (100-1000 μg/mL) were non-toxic to HepG2 cells, could promote cell proliferation. Compared with IR-HepG2 cells, 200, 400 and 600 μg/mL of MP significantly elevated glycogen content by 17.20%, 22.95% and 32.50%, respectively. Meanwhile, high-dose MP significantly up-regulated the relative gene expression of PI3K and GLUT2, decreased the expression of GSK-3β. It provides an experimental basis for the subsequent hypoglycemia of MP, and also helps to promote the exploitation and potential application of MP.
-
Keywords:
- mussels /
- polysaccharides /
- insulin resistance /
- HepG2 cells /
- glucose metabolism
-
糖尿病的发生主要与遗传因素或者后天城市化行为(高脂饮食导致的肥胖)等环境因素有关[1-2]。1型糖尿病(Type 1 diabetes mellitus,T1DM),是由自身免疫反应引起的,机体的防御机制错误的对负责产生胰岛素的胰岛β细胞发起攻击,导致胰岛素分泌的绝对不足。2型糖尿病(Type 2 diabetes mellitus,T2DM)是一种代谢性疾病,主要表现为身体对胰岛素敏感性降低,产生了胰岛素抵抗[3],导致糖代谢紊乱,血糖上升[4]。此外,胰岛素抵抗还会导致脂质异常积累和脂质合成改变,诱发慢性肝病,包括非酒精性脂肪肝、非酒精性脂肪性肝炎,甚至肝硬化[5]。根据糖尿病联盟(International diabetes federation,IDF)统计,2021年中国糖尿病患者超1.4亿,预估到2045年将超过1.74亿,居全球第一位[6]。
目前用于改善糖尿病的药物包括二甲双胍、磺脲类和吡格列酮,这些药物依赖性较强,长期使用会伴随一定的副作用,如头晕、恶心、腹泻等[7-8]。因此,探寻无副作用且具有降血糖的物质,对改善糖尿病具有重要意义。贻贝是一种双壳类软体动物,富含不饱和脂肪酸、蛋白质、碳水化合物和微量矿物质元素[9]。大量研究结果表明,从贻贝中提取的多糖具有免疫抑制,抗氧化和炎症等一系列生物活性[10-12]。多糖是生物体内的主要活性成分,在改善胰岛素抵抗方面具有很大潜力,如海参多糖[13],褐藻糖胶[14]和海藻多糖[15]等。重要的是这些多糖具有低毒性和高效性,已经被提议作为预防和治疗糖尿病的潜在治疗剂。
在之前的研究工作中,本团队从贻贝中分离出一种新型贻贝多糖(Mussel polysaccharides,MP),平均分子量为4.25×103 Da,发现其对于抗氧化、抗炎症具有很好的改善效果[11-12],但对肝细胞胰岛素抵抗的保护作用尚不清楚。因此,鉴于人体试验开展的局限性,本研究在体外建立了胰岛素抵抗的HepG2细胞模型,可在细胞水平探讨胰岛素抵抗形成的机制和葡萄糖代谢障碍[16],同时便于筛选改善胰岛素抵抗的活性物质,为贻贝产业的高值化利用提供一定依据。
1. 材料与方法
1.1 材料与仪器
MP采用先前方法提取制备,平均分子量为4.25×103 Da,主链连接为→4)-α-D-Glcp-(1→糖苷键,端基α-D-Glcp-(1→和α-D-Glcp-(1→6)-α-D-Glcp-(1→pass→4,6)-α-D-Glcp-(1→.O-6键与主链相连[11]。HepG2肝癌细胞 浙江省立同德医院惠赠;高糖DMEM培养基、二甲基亚砜(Dimethyl sulfoxide,DMSO)、磷酸盐缓冲液(Phosphate buffered saline,PBS)、噻唑兰(3-[4, 5-dimethylthiazol-2-yl]-2, 5-diphenylterazolium bromide,MTT)和BeyoAOFTM重组胰酶细胞消化液 杭州浩克生物有限公司;胎牛血清和双抗(含100 U/mL青霉素和100 mg/mL链霉素) Thermo Scientific(Gibco);人源胰岛素 北京沃凯生物科技有限公司;糖原试剂盒 南京建成有限公司;RIPA裂解液、Fasting gDNA Dispelling RT SuperMix试剂盒、Cell Kit RNA Easy Fast试剂盒 碧云天生物技术研究所;Hieff®qPCR SYBR Green Master Mix(High Rox Plus) 翌圣生物科技(上海)股份有限公司。
TE2000倒置荧光显微镜 日本Nikon公司;3111型CO2培养箱和酶标仪 Thermo Scientific(Gibco);ABI ViiA™ 7实时荧光定量PCR仪 Applied Biosystems;Micro21R高速冷冻离心机 赛默飞世尔科技公司。
1.2 实验方法
1.2.1 HepG2细胞的体外培养
1.2.1.1 HepG2细胞的复苏
用含10%胎牛血清的DMEM高糖培养基培养HepG2细胞,培养条件为37 ℃,5% CO2,当细胞密度到达80%~90%时进行传代和种板[17]。将培养瓶中指数生长期的HepG2细胞的培养基弃去,用37 ℃预热的PBS洗3次后,吹落瓶底细胞,收集悬液,稀释后计数,根据不同实验取不同细胞数进行种板。
1.2.1.2 HepG2细胞的传代
将细胞从培养箱中取出后,使用倒置显微镜在4倍镜下观察细胞的密度,当细胞的密度达到对数生长期(80%~90%)时候,细胞活力最好,即为最佳传代时间。传代过程如下:吸弃原有培养基,用PBS清洗两次,加入1 mL胰酶细胞消化液消化2 min,观察细胞状态。随后加入2 mL完全培养基终止反应,将瓶壁的细胞吹落,离心弃去上清液,加入1 mL完全培养基将细胞沉淀吹散至细胞悬液,随即转移至预先含有5 mL完全培养基的培养瓶中继续培养。
1.2.2 细胞胰岛素抵抗模型的建立
1.2.2.1 不同浓度贻贝多糖对HepG2细胞增殖的影响
将对数生长期HepG2细胞每孔4×103个接种到96孔板中,培养箱孵育24 h后,弃去上清液。除空白组只加入完全培养基外,其余组则加入含有不同浓度MP(100、200、400、600、800、1000 μg/mL)的完全培养基,每个复孔为6。采用CCK8法检测MP对HepG2细胞活性的影响[18]。简而言之,在37 ℃下孵育24 h,吸弃培养基,PBS洗3次,每孔加入90 μL完全培养基后加10 μg/mL CCK8溶液。将96孔板于37 ℃培养箱中放置1 h后,在450 nm波长下检测OD值。试验每隔1 h测定一次OD值,重复三次以上步骤即可。
1.2.2.2 胰岛素最佳造模浓度筛选
将处于对数期的HepG2细胞制成细胞悬液,计数后用完全培养基调整细胞密度为5×104(个/mL)接种于96孔板,每孔150 µL,分别设置不含细胞的空白对照组,正常组(NC)和模型组(IR)。孵育24 h后细胞单层贴壁,此时弃去旧的培养基,使用PBS 清洗3次后,正常组加入含10% FBS的正常完全培养液,模型组加入含胰岛素浓度分别为1×10−4、1×10−5、1×10−6、1×10−7、1×10−8(mol/L)的完全培养基,每个浓度设5个复孔,于37 ℃,5% CO2培养箱中培养24 h,PBS清洗三次后收集细胞上清液,用葡萄糖检测试剂盒在505 nm波长下测定各组细胞培养液上清的葡萄糖含量,计算葡萄糖消耗量,计算公式如下[19]:
式中:18为mg/dL和mmol/L的转换系数。
1.2.2.3 不同浓度贻贝多糖对HepG2胰岛素抵抗模型细胞增殖的影响
设置正常培养的细胞(简称NC)、模型组(简称IR)、阳性对照组(IR+3.5 mg/L的二甲双胍[20],简称Met)以及不同浓度(100、200、400、600、800、1000 μg/mL)贻贝多糖干预组(简称MP)。取对数生长期的HepG2细胞调整细胞密度为5×104(个/mL),按上述方法分组,每组设6个平行孔,每孔150 µL接种在96孔板中。待细胞单层贴壁后,弃去原培养液,PBS清洗2次,NC组加入正常培养液,其他各组均按最佳造模条件诱导胰岛素抵抗模型。用完全培养液分别配制不同浓度的MP溶液以及35 mg/L的二甲双胍溶液,分别干预胰岛素抵抗模型细胞24 h后,每孔均加入10 µL的CCK8溶液,于37 ℃,5% CO2培养箱中孵育1 h后取出,置于酶标仪上450 nm波长处测定OD值。
1.2.3 贻贝多糖对HepG2细胞糖原分泌的影响
取对数生长期的HepG2细胞每孔2.5×104接种于6孔板,放入培养箱,孵育24 h。除NC组外,各组加入1×10−6 mol/L的胰岛素处理24 h。然后,除NC和IR组以外,Met组更换为含有35 mg/L二甲双胍的完全培养基,试验组分别添加200、400、600 μg/mL的MP的完全培养基孵育24 h。最后,收集培养基上清液,根据试剂盒说明书,测定细胞糖原的分泌水平。
1.2.4 贻贝多糖对HepG2细胞糖代谢相关基因表达的影响
使用1.2.3方法处理HepG2细胞,24 h后取出六孔板,去除上清液,用PBS吹六孔板底部,收集细胞悬液,用PBS洗3遍后,弃去PBS,转移至无RNA酶的5 mL离心管中,加入1 mL预冷TRIzol试剂,反复吹打裂解细胞,室温放置15 min,将离心管放入−80 ℃冰箱待用。按照TRIzol法提取细胞总RNA,2 μg总RNA根据Fasting gDNA Dispelling RT SuperMix试剂盒说明书逆转录为cDNA。反应体系:含有10 µL SYBR Green混合液, 1 μL cDNA样品,上游引物和下游引物各0.4 µL,用ddH2O补足至20 µL,并在 95 ℃,5 s;60 ℃,34 s条件下循环40次。以β-actin为内参基因,通过RT-PCR系统测定靶基因的相对表达水平,计算公式为2−△△Ct。测定的目标基因为磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(Protein kinase B,AKT)、糖原合成酶激酶-3(Glycogen synthase kinase-3β,GSK-3β)、葡萄糖转运蛋白2(Glucose transporter 2,GLUT-2)和β-肌动蛋白(β-actin)。(表1)。
表 1 引物序列Table 1. Primer sequence基因 引物序列(5′—3′) 正向引物 bp 反向引物 bp PI3K ACAGGCACAACGACAACATC 20 TAAGCCCTAACGCAGACATC 20 AKT TTTGGGAAGGTGATCCTGGTG 21 GGTCGTGGGTCTGGAATGAGT 21 GSK-3β TAGTCCGATTGCGGTATTT 19 GGAATGGATATAGGCTAGACT 21 GLUT-2 ATGAACCCAAAACCAACCCCT 21 GGCCTGAAATTAGCCCTTCCA 21 β-actin AGTGTGACGTTGACATCCGT 20 GCAGCTCAGTAACAGTCCGC 20 1.3 数据处理
采用SPSS 23.0软件对数据进行单因素方差分析(One-way ANOVA),各组间釆用Duncan法进行多重比较检验,数值以均值±标准差(Mean±SEM)表示,P<0.05判定差异具有统计学意义。
2. 结果与分析
2.1 不同浓度贻贝多糖对HepG2细胞增殖的影响
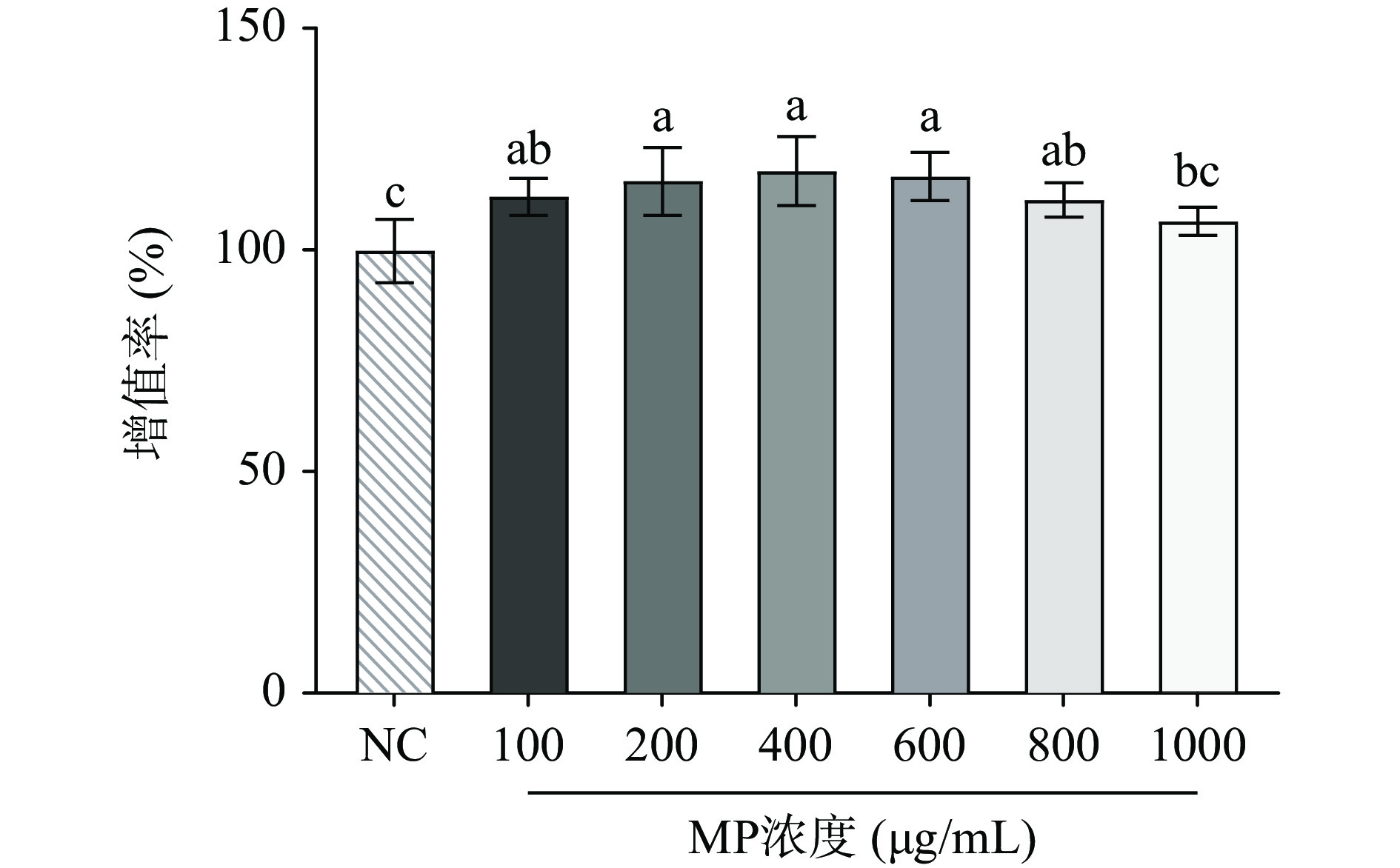
本实验采用CCK8评价MP对HepG2细胞增殖的影响,以筛选合适的MP浓度。由图1可知,与正常组相比,MP浓度在100~1000 μg/mL范围以内能促进HepG2细胞增殖,且在100~800 μg/mL浓度时呈显著性(P<0.05)。表明在一定范围内,MP对HepG2细胞增殖没有毒性影响,可以用于后续实验。
![]() 图 1 贻贝多糖对HepG2细胞增殖的影响注:不同小写字母表示差异显著(P<0.05),同字母表示差异不显著(P>0.05);图2同。Figure 1. Effect of mussel polysaccharide on the proliferation of HepG2 cells
图 1 贻贝多糖对HepG2细胞增殖的影响注:不同小写字母表示差异显著(P<0.05),同字母表示差异不显著(P>0.05);图2同。Figure 1. Effect of mussel polysaccharide on the proliferation of HepG2 cells2.2 不同浓度胰岛素对构建IR-HepG2模型的影响
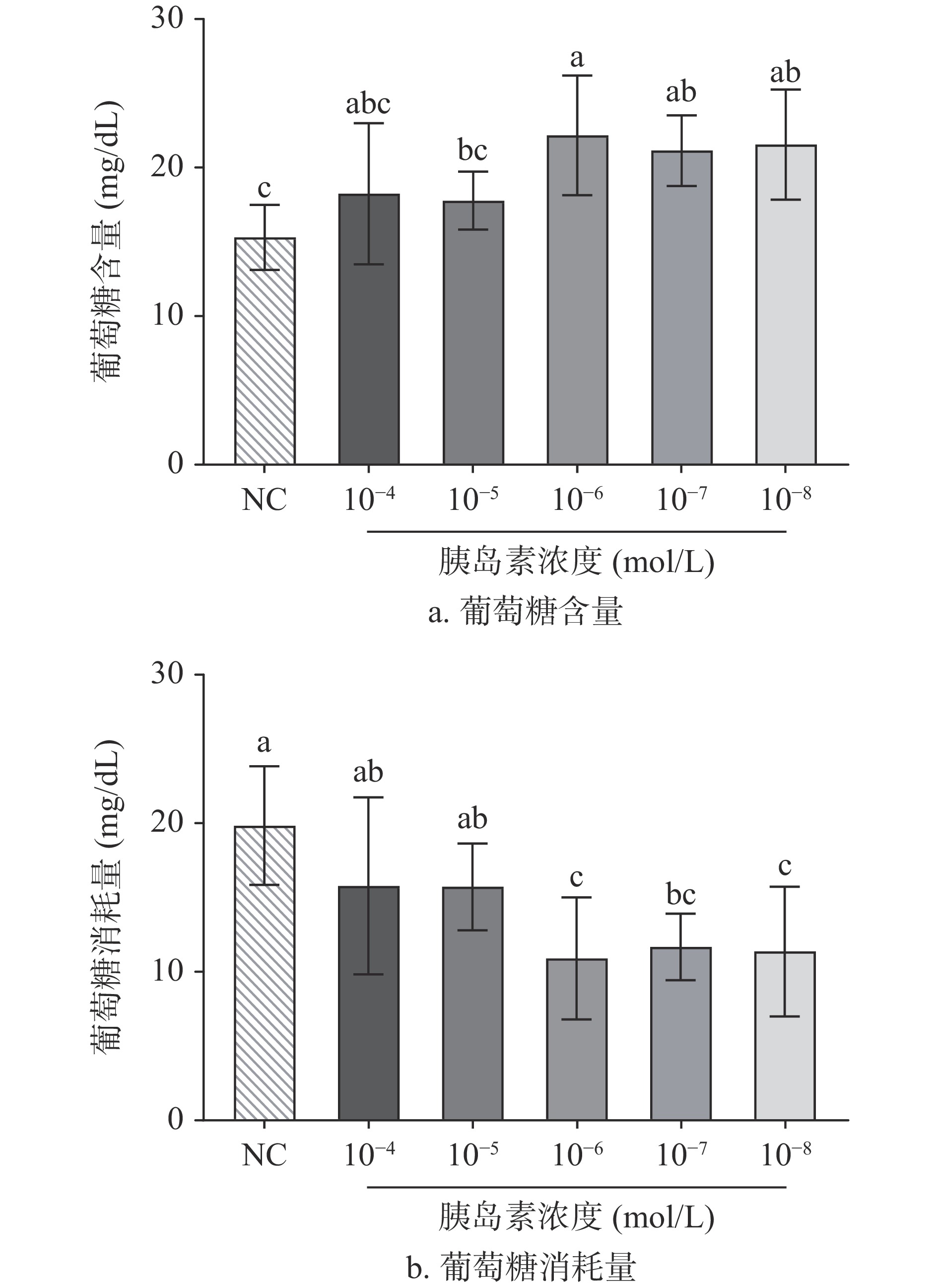
由图2所示,不同浓度胰岛素干扰HepG2细胞后,上清液葡萄糖含量均高于正常组,尤其以1×10−6 mol/L胰岛素干预后含量最多。表明通过胰岛素干预后,HepG2细胞对于葡萄糖的敏感性降低,产生了胰岛素抵抗,导致葡萄糖消耗量降低。因此,当对HepG2细胞施用1×10−6 mol/L的胰岛素时,HepG2细胞胰岛素抵抗最强,对葡萄糖的消耗能力最弱。这Wang等试验结果一致[21],由此后续实验将统一采用此浓度进行操作。
2.3 不同浓度贻贝多糖对IR-HepG2模型的影响
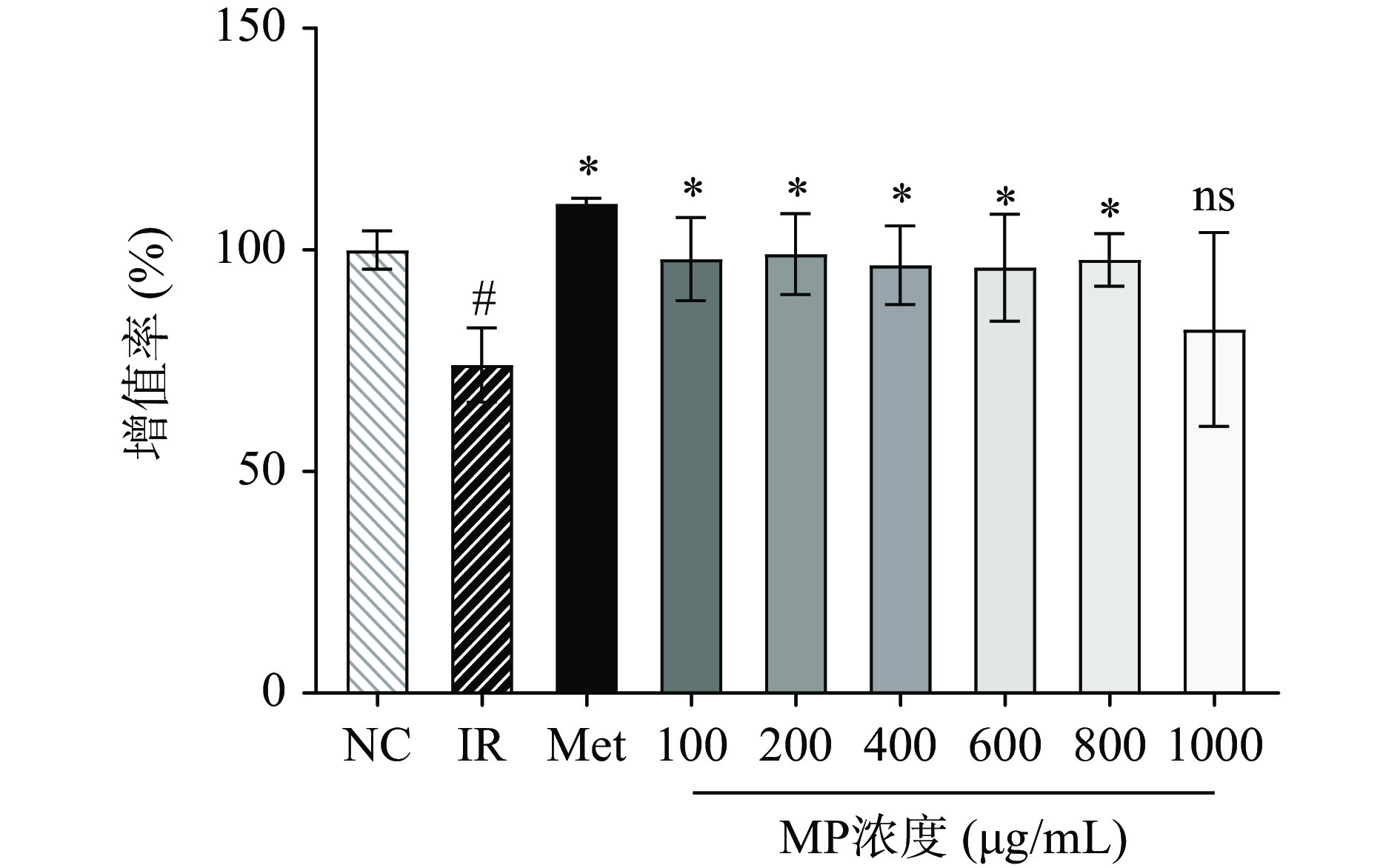
确定以1×10−6 mol/L为造模浓度后,考察了6个不同浓度的MP在此模型刺激下的细胞活力情况。目的在于确定后续种板的多糖浓度,方便后续开展分子学和酶联免疫实验。由图3所示IR组的细胞活力与NC组相比显著下降(P<0.05),Met组对细胞活力的恢复能力最强。MP组6个浓度对IR-HepG2细胞增殖均有促进作用,且在一定范围内(100~800 μg/mL)与正常组无显著差异。结合之前研究结果(图1),试验选取200、400、600 μg/mL浓度的MP进行下一步实验。
2.4 贻贝多糖对HepG2细胞糖原含量的影响
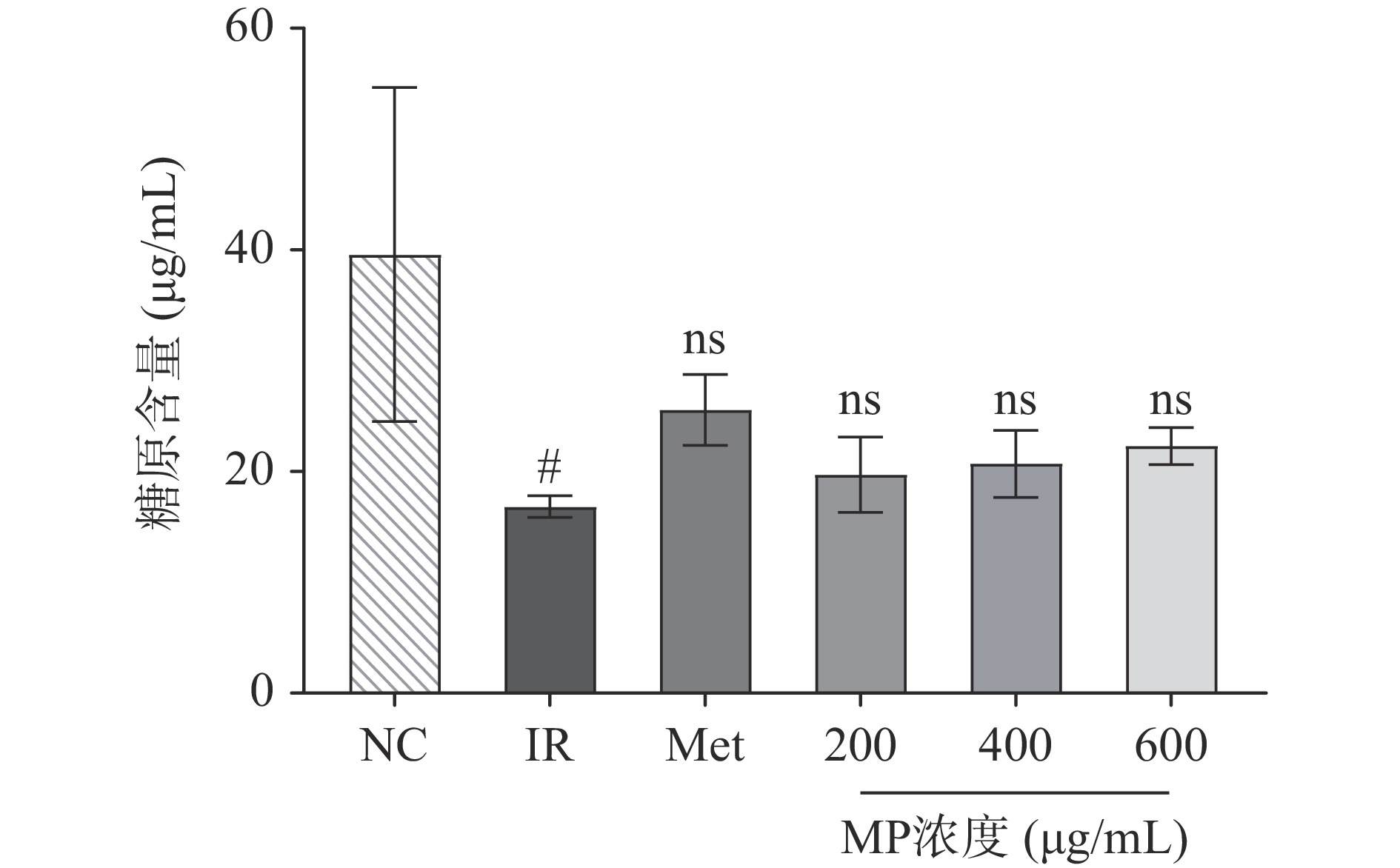
糖原合成、分解过程是肝糖代谢的主要途径之一[22],当人体血糖过低时,会促进肝糖原分解为葡萄糖。相反,当血糖过高时,会促使葡萄糖转化为肝糖原,调控血糖水平[23]。如图4所示,不同剂量的MP干预可以使IR-HepG2细胞内糖原合成量增加,作用效果略微低于二甲双胍。相比于NC组,IR模型组的糖原含量则显著降低(P<0.05),说明高浓度胰岛素不利于正常HepG2细胞糖原合成作用,而二甲双胍和MP都能提高IR-HepG2细胞的糖原相对含量,分别增加了51.78%、17.20%、22.95%和32.50%。这主要是由于MP提高了细胞对于葡萄糖的摄入,在各种酶的作用下促进糖原合成。由此可以得出贻贝多糖能改善IR-HepG2细胞中糖代谢,提高糖原含量。马二兰等采用1×10−6 mol/L胰岛素建立胰岛素抵抗细胞模型,其糖原含量与正常组相比显著下降,而荔浦芋球蛋白剂量依赖性地增加了IR-HepG2细胞中的糖原含量[24]。此外,赵可心等指出松花粉提取物能通过PI3K/AKT途径,增强胰岛素敏感性,抑制IR-HepG2细胞的糖原含量下降[25]。这些活性物质对肝糖原合成的促进作用主要通过调节胰岛素信号通路实现。
2.5 贻贝多糖对HepG2细胞转录因子的影响
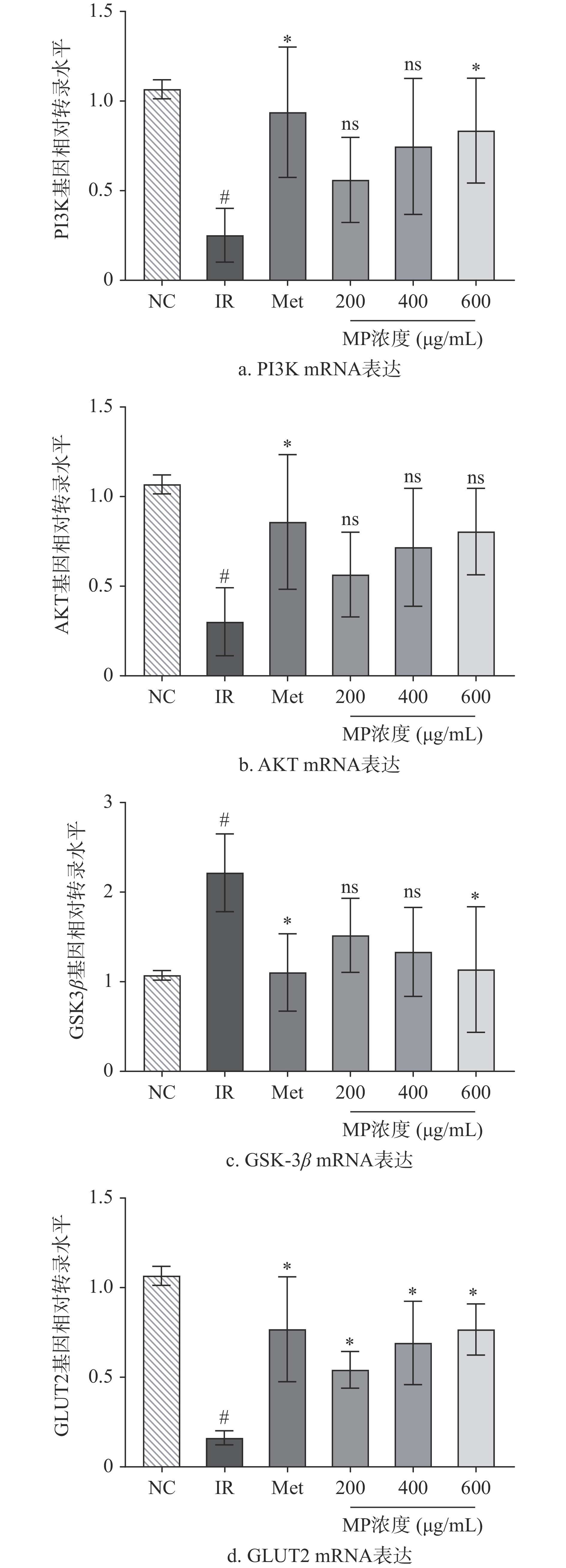
为更进一步分析MP增强IR-HepG2细胞糖原合成的分子机制,测定了与糖代谢相关基因AKT、PI3K、GSK-3β和GLUT2表达情况。由图5的RT-PCR结果可知,相较于空白对照组,模型组IR-HepG2细胞中的GSK3β基因表达水平上调,增长了107.53%(P<0.05),而AKT、PI3K和GLUT2基因表达水平下调(P<0.05)。IR-HepG2细胞表现出葡萄糖消耗量和糖原合成量减少的症状,通过MP干预后,显著下调了GSK3β的基因表达(P<0.05),并上调了AKT、PI3K和GLUT2的相对表达量(P<0.05),且高剂量MP作用效果与二甲双胍相当。PI3K/AKT/通路是研究最多的胰岛素抵抗信号转导通路之一[26],其表达的变化与葡萄糖代谢密切相关[27]。PI3K/AKT/GSK-3β信号通路参与胰岛素信号转导,而GSK-3β在该信号通路中受胰岛素的调控,与糖原合成调控有关[28]。GLUT2是肝细胞质膜中的主要葡萄糖转运蛋白,在葡萄糖摄取中起到关键作用[29]。Chen等发现牛磺酸能提高IR-HepG2细胞中PI3K和AKT基因表达,减轻HepG2细胞中高糖诱导的胰岛素抵抗,增加葡萄糖消耗量[30]。Yang等试验结果表明,鲟鱼蛋白衍生肽KIWHHTF能通过调节HepG2细胞中的IRS-1/PI3K/AKT信号通路来预防胰岛素抵抗[31]。综上所述,MP改善IR-HepG2细胞葡萄糖代谢异常,可能是通过激活PI3K/AKT信号通路及下游基因表达实现。
3. 结论
文章以HepG2细胞为载体,通过建立最佳的IR-HepG2细胞模型,探究MP对IR-HepG2细胞的影响。试验结果表明,胰岛素浓度为1×10−6 mol/L时可以建立效果最佳的IR-HepG2细胞模型。当MP质量浓度在200~600 mg/mL时可以提高IR-HepG2细胞肝糖原的合成,对促进葡萄糖的摄取和利用具有积极作用。此外,糖代谢相关基因结果表明,高剂量MP组能显著上调PI3K和GLUT2基因的表达量(P<0.05),并能下调GSK-3β的表达量(P<0.05)。这些结果表明MP能有效激活PI3K/AKT途径,促进糖原合成,提高葡萄糖利用率,进而改善IR-HepG2细胞胰岛素抵抗。本研究弥补了MP在胰岛素抵抗细胞层面上的空缺,为开发贻贝多糖预防胰岛素抵抗功能食品提供实验依据。
-
图 1 贻贝多糖对HepG2细胞增殖的影响
注:不同小写字母表示差异显著(P<0.05),同字母表示差异不显著(P>0.05);图2同。
Figure 1. Effect of mussel polysaccharide on the proliferation of HepG2 cells
表 1 引物序列
Table 1 Primer sequence
基因 引物序列(5′—3′) 正向引物 bp 反向引物 bp PI3K ACAGGCACAACGACAACATC 20 TAAGCCCTAACGCAGACATC 20 AKT TTTGGGAAGGTGATCCTGGTG 21 GGTCGTGGGTCTGGAATGAGT 21 GSK-3β TAGTCCGATTGCGGTATTT 19 GGAATGGATATAGGCTAGACT 21 GLUT-2 ATGAACCCAAAACCAACCCCT 21 GGCCTGAAATTAGCCCTTCCA 21 β-actin AGTGTGACGTTGACATCCGT 20 GCAGCTCAGTAACAGTCCGC 20 -
[1] YANG G, WEI J, LIU P, et al. Role of the gut microbiota in type 2 diabetes and related diseases[J]. Metabolism,2021,117:154712. doi: 10.1016/j.metabol.2021.154712
[2] 林宝旺, 黄小珂, 陈芳琼, 等. 2型糖尿病发病因素和生活节奏快慢的关系[J]. 当代医学,2010,16(4):156−157, 27. [LIN Baowang, HUANG Xiaoke, CHEN Fangqiong, et al. The relation between the risk factors of type 2 diabetes and the speed of life's rhythm[J]. Contemporary Medicine,2010,16(4):156−157, 27. LIN Baowang, HUANG Xiaoke, CHEN Fangqiong, et al. The relation between the risk factors of type 2 diabetes and the speed of life's rhythm[J]. Contemporary Medicine, 2010, 16(4): 156-157, 27.
[3] DING Y, XIA S, FANG H, et al. Loureirin B attenuates insulin resistance in HepG2 cells by regulating gluconeogenesis signaling pathway[J]. Eur J Pharmacol,2021,910:174481. doi: 10.1016/j.ejphar.2021.174481
[4] 周雯, 庄蕾, 吴森. 植物多糖在Ⅱ型糖尿病降血糖作用方面的研究进展[J]. 食品与发酵工业,2021,47(8):290−296. [ZHOU Wen, ZHUANG Lei, WU Sen. Research progress of plant polysaccharides in hypoglycemic effect of type2 diabetes melli-tus[J]. Food and Fermentation Industries,2021,47(8):290−296. ZHOU Wen, ZHUANG Lei, WU Sen. Research progress of plant polysaccharides in hypoglycemic effect of type2 diabetes melli-tus[J]. Food and Fermentation Industries, 2021, 47(8): 290-296.
[5] SUN Y, WANG J, GUO X, et al. Oleic acid and eicosapentaenoic acid reverse palmitic acid-induced insulin resistance in human HepG2 cells via the reactive oxygen species/JUN pathway[J]. Genomics Proteomics Bioinformatics,2021,19(5):754−771. doi: 10.1016/j.gpb.2019.06.005
[6] SUN H, SAEEDI P, KARURANGA S, et al. IDF diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J]. Diabetes Res Clin Pract,2021:109119.
[7] TAHRANI A A, BARNETT A H, BAILEY C J. Pharmacology and therapeutic implications of current drugs for type 2 diabetes mellitus[J]. Nature Reviews Endocrinology,2016,12(10):566−592. doi: 10.1038/nrendo.2016.86
[8] KE C, MORGAN S, SMOLINA K, et al. Mortality and cardiovascular risk of sulfonylureas in South Asian, Chinese and other Canadians with diabetes[J]. Canadian Journal of Diabetes,2017,41(2):150−5. doi: 10.1016/j.jcjd.2016.08.218
[9] MA L X, HUANG X H, ZHENG J, et al. Free amino acid, 5′-Nucleotide, and lipid distribution in different tissues of blue mussel (Mytilis edulis L.) determined by mass spectrometry based metabolomics[J]. Food Chem,2022,373:131435. doi: 10.1016/j.foodchem.2021.131435
[10] WU J, SHAO H, ZHANG J, et al. Mussel polysaccharide α-D-glucan (MP-A) protects against non-alcoholic fatty liver disease via maintaining the homeostasis of gut microbiota and regulating related gut-liver axis signaling pathways[J]. Int J Biol Macromol,2019,130:68−78. doi: 10.1016/j.ijbiomac.2019.02.097
[11] XIANG X W, WANG R, CHEN H, et al. Structural characterization of a novel marine polysaccharide from mussel and its antioxidant activity in RAW264.7 cells induced by H2O2[J]. Food Bioscience,2022,47:101659. doi: 10.1016/j.fbio.2022.101659
[12] XIANG X W, WANG R, YAO L W, et al. Anti-inflammatory effects of Mytilus coruscus polysaccharide on RAW264.7 cells and DSS-induced colitis in mice[J]. Mar Drugs,2021,19:468. doi: 10.3390/md19080468
[13] ZHU Q, LIN L, ZHAO M. Sulfated fucan/fucosylated chondroitin sulfate-dominated polysaccharide fraction from low-edible-value sea cucumber ameliorates type 2 diabetes in rats: New prospects for sea cucumber polysaccharide based-hypoglycemic functional food[J]. Int J Biol Macromol,2020,159:34−45. doi: 10.1016/j.ijbiomac.2020.05.043
[14] LIU Y, XU Z, HUANG H, et al. Fucoidan ameliorates glucose metabolism by the improvement of intestinal barrier and inflammatory damage in type 2 diabetic rats[J]. Int J Biol Macromol,2022,201:616−629. doi: 10.1016/j.ijbiomac.2022.01.102
[15] JIA R B, WU J, LI Z R, et al. Comparison of physicochemical properties and antidiabetic effects of polysaccharides extracted from three seaweed species[J]. Int J Biol Macromol,2020,149:81−92. doi: 10.1016/j.ijbiomac.2020.01.111
[16] MOKASHI P, KHANNA A, PANDITA N. Flavonoids from Enicostema littorale Blume enhances glucose uptake of cells in insulin resistant human liver cancer (HepG2) cell line via IRS-1/PI3K/Akt pathway[J]. Biomed Pharmacother,2017,90:268−277. doi: 10.1016/j.biopha.2017.03.047
[17] 王瑞雪, 张筠, 崔艳伟, 等. 柠檬皮多酚成分分析及其对胰岛素抵抗HepG2细胞糖代谢的影响[J]. 食品工业科技,2022,43(23):310−317. [WANG Ruixue, ZHANG Jun, CUI Yanwei, et al. Analysis of polyphenols from lemon peel and its effect on glucose metabolism in insulin-resistant HepG2 cells[J]. Science and Technology of Food Industry,2022,43(23):310−317. WANG Ruixue, ZHANG Jun, CUI Yanwei, et al. Analysis of polyphenols from lemon peel and its effect on glucose metabolism in insulin-resistant HepG2 cells[J]. Science and Technology of Food Industry, 2022, 43(23): 310−317.
[18] 张彩平, 袁育林, 李博洁, 等. 驱动蛋白16B在姜黄素影响HepG2细胞脂质摄取中的作用[J]. 中国动脉硬化杂志,2021,29(11):949−954. [ZHANG Caiping, YUAN Yulin, LI Bojie, et al. Role of kinesin family member 16B in the effect of curcumin on lipid uptake of HepG2 cells[J]. Chinese Journal of Arteriosclerosis,2021,29(11):949−954. ZHANG Caiping, YUAN Yulin, LI Bojie, et al. Role of kinesin family member 16B in the effect of curcumin on lipid uptake of HepG2 cells[J]. Chinese Journal of Arteriosclerosis, 2021, 29(11): 949-954.
[19] 符群, 郐滨, 钟明旭, 等. 超声波辅助酶解法提取北虫草菌素及其降血糖活性研究[J]. 食品与发酵工业,2021,47(9):120−127. [FU Q, KUAI B, ZHONG M X, et al. Extraction of cordycepin with ultrasound-assisted enzymatic hydrolysis and its hypoglycemic activity[J]. Food and Fermentation Industries,2021,47(9):120−127. FU Q, KUAI B, ZHONG M X, et al. Extraction of cordycepin with ultrasound-assisted enzymatic hydrolysis and its hypoglycemic activity[J]. Food and Fermentation Industries, 2021, 47(9): 120-127.
[20] REN B, CHEN C, LI C, et al. Optimization of microwave-assisted extraction of Sargassum thunbergii polysaccharides and its antioxidant and hypoglycemic activities[J]. Carbohydr Polym,2017,173:192−201. doi: 10.1016/j.carbpol.2017.05.094
[21] WANG J, WU T, FANG L, et al. Anti-diabetic effect by walnut (Juglans mandshurica Maxim. )-derived peptide LPLLR through inhibiting α-glucosidase and α-amylase, and alleviating insulin resistance of hepatic HepG2 cells[J]. J Funct Foods,2020,69:103944. doi: 10.1016/j.jff.2020.103944
[22] DING Q, ZHANG B, ZHENG W, et al. Liupao tea extract alleviates diabetes mellitus and modulates gut microbiota in rats induced by streptozotocin and high-fat, high-sugar diet[J]. Biomed Pharmacother,2019,118:109262. doi: 10.1016/j.biopha.2019.109262
[23] WU G, BAI Z, WAN Y, et al. Antidiabetic effects of polysaccharide from azuki bean (Vigna angularis) in type 2 diabetic rats via insulin/PI3K/AKT signaling pathway[J]. Food Hydrocolloids,2020,101:105456. doi: 10.1016/j.foodhyd.2019.105456
[24] 马二兰, 张帆, 吕春秋, 等. 荔浦芋球蛋白结构表征及其对HepG2细胞糖代谢的影响[J]. 食品工业科技,2022,43(15):359−365. [MA Erlan, ZHANG Fan, LÜ Chunqiu, et al. Structural characterization of Lipu taro globulin and its glucose metabolism activity on HepG2 cells[J]. Science and Technology of Food Industry,2022,43(15):359−365. MA Erlan, ZHANG Fan, LÜ Chunqiu, et al. Structural characterization of Lipu taro globulin and its glucose metabolism activity on HepG2 cells[J]. Science and Technology of Food Industry, 2022, 43(15): 359−365.
[25] 赵可心, 夏凯, 苑鹏, 等. 松花粉提取物对胰岛素抵抗HepG2细胞糖脂代谢的影响[J]. 食品与发酵工业,2019,45(6):83−90. [ZHAO Kexin, XIA Kai, YUAN Peng, et al. Effects of pine pollen extracts on insulin resisted glycolipid metabolism in HepG2 cells[J]. Food and Fermentation Industries,2019,45(6):83−90. ZHAO Kexin, XIA Kai, YUAN Peng, et al. Effects of pine pollen extracts on insulin resisted glycolipid metabolism in HepG2 cells[J]. Food and Fermentation Industries, 2019, 45(6): 83-90.
[26] 陈梦霞, 汪妮, 孟凡强, 等. 生姜姜辣素的分离及对HepG2细胞胰岛素抵抗的预防作用[J]. 食品工业科技,2022,43(22):387−395. [CHEN Mengxia, WANG Ni, MENG Fanqiang, et al. Isolation of gingerols and its preventive effect on insulin resistance of HepG2 cells[J]. Science and Technology of Food Industry,2022,43(22):387−395. CHEN Mengxia, WANG Ni, MENG Fanqiang, et al. Isolation of gingerols and its preventive effect on insulin resistance of HepG2 cells[J]. Science and Technology of Food Industry, 2022, 43(22): 387−395.
[27] ZHU J, WU M, ZHOU H, et al. Liubao brick tea activates the PI3K-Akt signaling pathway to lower blood glucose, metabolic disorders and insulin resistance via altering the intestinal flora[J]. Food Res Int,2021,148:110594. doi: 10.1016/j.foodres.2021.110594
[28] ZHANG Y, HUANG N Q, YAN F, et al. Diabetes mellitus and Alzheimer’s disease: GSK-3β as a potential link[J]. Behav Brain Res,2018,339:57−65. doi: 10.1016/j.bbr.2017.11.015
[29] THORENS B. GLUT2, glucose sensing and glucose homeostasis[J]. Diabetologia,2015,58(2):221−232. doi: 10.1007/s00125-014-3451-1
[30] CHEN B, ABAYDULA Y, LI D, et al. Taurine ameliorates oxidative stress by regulating PI3K/Akt/GLUT4 pathway in HepG2 cells and diabetic rats[J]. J Funct Foods,2021,85:104629. doi: 10.1016/j.jff.2021.104629
[31] YANG B, YUAN L, ZHANG W, et al. Sturgeon protein-derived peptide KIWHHTF prevents insulin resistance via modulation of IRS-1/PI3K/AKT signaling pathways in HepG2 cells[J]. J Funct Foods,2022,94:105126. doi: 10.1016/j.jff.2022.105126
-
期刊类型引用(2)
1. 冯明,黄恒,邓福昌,陆俊致,李叶红,梁琼,黄华莉,胡俊杰,蒋慧敏,王金兴,肖鹏,杨小淦,梁兴伟,曾俊. 茉莉花渣对广西黑山羊生长性能及血清生化、抗氧化和免疫指标的影响. 黑龙江畜牧兽医. 2023(10): 109-114 .  百度学术
百度学术
2. 王金兴,黄恒,陆俊致,李叶红,梁琼,黄世洋,黄华莉,曾俊. 茉莉花渣的活性物质、生物学功能及其在畜禽生产中的应用. 饲料研究. 2023(20): 178-181 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:
 下载:
下载:



