Optimization of Extraction Process of Prune Dietary Fiber and Its Laxative Effect
-
摘要: 目的:探究西梅可溶性膳食纤维(Soluble dietary fiber,SDF)的最优提取工艺及其通便作用。方法:采用酶法提取西梅中的SDF,通过单因素实验和响应面分析优化提取条件,再对西梅SDF进行体内试验,小鼠先灌胃7 d盐酸洛哌丁胺,建立便秘模型,随后分为低、中、高剂量组灌胃西梅SDF 14 d,观察小鼠体重、脏器系数、首粒黑便排出时间、6 h内排便粒数、粪便含水量、小肠推进率、胃排空率及胃肠组织形态学描述等指标。结果:西梅SDF最佳提取条件为:混合酶水浴时间2.9 h,纤维素酶添加量1%,纤维素酶水浴温度41 ℃,纤维素酶水浴时间3.8 h,此时得率为13.238%±0.07%,SDF含量为85.91%±0.46%。灌胃西梅SDF后,对小鼠体重和脏器系数无显著影响(P>0.05),中、高剂量组可以显著缩短排便时间、增加排便粒数、增加粪便含水量、升高小肠推进率和胃排空率(P<0.05),降低了便秘对小鼠胃肠组织的损伤,显著增加胃肠组织的厚度(P<0.05)。结论:西梅SDF对便秘小鼠具有通便作用,能够不同程度的改善便秘对胃肠屏障损伤,并对胃肠屏障起到一定的保护作用。Abstract: Objective: Study the optimal extraction technology and the cathartic mechanism of soluble dietary fibers of prunes. Methods: The enzymatic method was adopted to extract SDF from prunes. Single factor experiment and response surface analysis were performed to optimize extracting conditions, and then in vivo test was conducted with the prune SDF. First of all, 7 d loperamide hydrochloride was offered to mice by intragastric administration, a constipation model was built. Prune SDF 14 d was grouped into low dose, medium dose and high dose, and then offered to the mice by intragastric administration. The mice was observed to record following indexes: The weight of the mice, organ coefficients, first black stool excreting time, the number of stool grains excreting in 6 hours, water content in stool, intestinal propulsive rate, gastric emptying rate and the morphological description of gastrointestinal tissue. Results: The optimal conditions for extracting prune SDF were listed as follows: The bath time of mixed prune was 2.9 h. The additive amount of cellulase was 1%. The bath temperature of cellulase was 41 ℃. The bath time of cellulase was 3.8 h, and the yield was 13.238%±0.07% at the moment, and the SDF content was 85.91%±0.46%. After intragastric administration of prunes, there's no obvious impact made on the weight of mice and organ coefficients (P>0.05). The impact on the medium dose group and the high dose group was obvious: The stool excreting time was reduced. The stool grains and water content in stool were increased. The intestinal propulsive rate and gastric emptying rate were raised (P<0.05). The damage to gastrointestinal tissue of mice due to constipation was reduced. The thickness of gastrointestinal tissue was increased (P<0.05). Conclusion: Prune SDF had a function of relaxing bowels for constipation mice, and also could improve the gastrointestinal barrier injury caused by constipation, which played a protective role on the gastrointestinal barrier.
-
Keywords:
- prunes /
- soluble dietary fiber /
- extraction /
- laxative
-
西梅(European plum)是蔷薇科李属欧洲李种的植物[1],在20世纪被我国引入正式栽培,目前在我国新疆、陕西、河北、河南等地种植[2-3]。种植西梅对环境气候的要求高,新疆的气候条件与美国加州很相似,其土地资源辽阔、干旱少雨、温差优势都使得西梅的种植具有了得天独厚的条件[3-4]。研究表明西梅具有抗氧化[5]、通便、改善心血管疾病、改善认知[6-7]、有益骨骼健康[8]等功能。
便秘是一种会表现出排便次数降低、排便困难、排出的便干硬并且一周排便次数低于3次等症状的胃肠疾病[9],便秘会使肠道内积累大量的宿便,宿便上的细菌或毒物与肠道长时间接触,被肠壁所吸收,最终可能会引起痔疮、大肠癌和结肠癌等。所以越来越多的研究针对便秘这一问题,但药物治疗具有一定的副作用,开发功能性食品成为热点[10]。已有研究表明西梅具有通便作用,这归因于其高纤维含量,还含有木糖醇和山梨糖醇,这些物质都可以促进肠道蠕动、胃排空及改善肠道菌群,所以西梅和西梅汁被用来改善肠道功能,通过影响饱腹感来降低食欲和超重[11-12]。Attaluri等[13]发现食用西梅可以治疗轻度至中度便秘的患者。同样Cheskin等[14]发现患有慢性便秘的成年人在饭前每天喝西梅汁能够有效软化大便和立即缓解便秘症状。Piiraine等[15]使受试者每天喝125 mL的试验西梅汁两次,为期4周,研究发现饮用西梅汁可减少排便困难的发生,甚至在轻度便秘的情况下,西梅汁可以替代泻药。目前针对西梅通便作用这一研究主要集中在利用西梅整果,因此提取西梅中具有通便作用的膳食纤维这一功能因子具有重要意义。
西梅中富含丰富的膳食纤维,提取膳食纤维常用的方法有物理法[16]、化学法[17]、酶法等、发酵法等,其中本研究采取的酶法提取反应温和、无污染、纯度高。目前已有多种食品提取出膳食纤维,但从西梅中提取膳食纤维还鲜有报道。本研究以西梅为原料,采用酶法提取西梅可溶性膳食纤维并进行工艺优化,探究西梅可溶性膳食纤维的通便作用及保护胃肠屏障的功能,为西梅膳食纤维的通便作用提供理论依据,提高西梅附加值并促进综合利用。
1. 材料与方法
1.1 材料与仪器
西梅 采摘于新疆阿拉尔市十一团西梅种植基地,所采西梅均为新鲜西梅(次级果),品种为法兰西,正常无病虫害;SPF级雄性昆明小鼠 80只,4周龄(体重:20±2 g),购自塔里木大学动物科学学院(试验动物质量合格证:11400700307064;试验动物生产许可证号:SCXK(京)2016-0006);纤维素酶(酶活力50000 U/g)、木瓜蛋白酶(酶活力800000 U/g)、α-淀粉酶(酶活力40000 U/g) 北京索莱宝科技有限公司;盐酸、氢氧化钠、95%乙醇、无水乙醇、二甲苯 均为分析纯,天津市致远化学试剂有限公司;盐酸洛哌丁胺胶囊 西安杨森制药有限公司;活性炭 麦克林试剂上海有限公司;阿拉伯胶 阿拉丁试剂有限公司;磷酸盐缓冲液 分析纯,天津灏洋华科生物科技有限公司;甲醛 分析纯,成都市科隆化学有限公司;磷酸二氢钠、磷酸氢二钠 均为分析纯,福晨(天津)化学试剂有限公司;中性树胶 Biosharp生物公司;苏木素染液、伊红染液 武汉塞维尔生物科技有限公司。
EMS-20数显恒温磁力搅拌水浴锅 金坛市科顺仪器厂;TGL-20br高速冷冻离心机 北京时代北利离心机有限公司;101-1ABE电热鼓风干燥箱 上海坤天试验室仪器有限公司;FWJ-05粉碎机 浙江省永康市敏业工贸有限公司;RE-3000A旋转蒸发仪 上海亚荣生化仪器厂;FD-1B-80真空冷冻干燥机 上海继谱电子科技有限公司;JK9830A自动凯式定氮仪 深圳市华德维康科技有限;徕卡-2016转轮式切片机 德国莱卡;JT-12S自动组织脱水机 武汉俊杰电子有限公司;BMJ-A包埋机 常州郊区中威电子仪器厂;RS36全自动染色机 常州派斯杰医疗设备有限公司;PHY-Ⅲ病理组织漂烘仪 常州市中威电子仪器有限公司;BA210Digital 数码三目摄像显微镜 麦克奥迪实业集团有限公司。
1.2 实验方法
1.2.1 西梅可溶性膳食纤维(SDF)提取
西梅切半去核,榨汁成西梅渣,平铺于托盘中放置鼓风干燥箱中,温度调至70 ℃烘干,粉碎机磨粉,过60目筛,得到的西梅粉。按照料液比1:15 g/mL加入蒸馏水,调节pH到4,添加混合酶(木瓜蛋白酶0.6%和α-淀粉酶1.0%),在40 ℃下水浴一定时间,煮沸10 min进行灭酶,灭酶后将溶液放凉至室温。调节pH到6,添加一定量纤维素酶,在一定温度下水浴一定时间,再次灭酶,在8000 r/min条件下,离心15 min,将离心完的溶液用真空泵抽滤,取上清液。上清液用旋转蒸发仪,在70 ℃条件下旋蒸至原液的1/4,将浓缩完的液体加4倍体积95%乙醇,在4 ℃条件下静置12 h醇沉,醇沉完的溶液用真空泵抽滤,取沉淀物,真空冷冻干燥后得到西梅SDF。
1.2.2 单因素实验
以料液比为1:15 g/mL,混合酶水浴时间3 h,纤维素酶加酶量1.0%,纤维素酶水浴温度40 ℃,纤维素酶水浴时间4 h为固定条件,考察混合酶水浴时间(2、2.5、3、3.5、4 h)、纤维素酶加酶量(0.6%、0.8%、1.0%、1.2%、1.4%)、纤维素酶水浴温度(30、40、50、60、70 ℃)、纤维素酶水浴时间为(2、3、4、5、6 h)对西梅SDF得率的影响。
1.2.3 响应面试验设计
在单因素实验结果的基础上,确定了各单因素的水平,选择混合酶水浴时间、纤维素酶添加量、纤维素酶水浴温度、纤维素酶水浴时间进行响应面优化试验。以SDF得率为响应值,设计四因素三水平响应面优化试验,如表1所示。
表 1 Box-Behnken试验设计因素水平表Table 1. Factors and levels of Box-behnken test design水平 因素 A混合酶水浴时间(h) B纤维素酶添加量(%) C纤维素酶水浴温度(℃) D纤维素酶水浴时间(h) −1 2.5 0.8 30 3 0 3 1 40 4 1 3.5 1.2 50 5 1.2.4 西梅SDF得率的计算
(1) 式中:m为干燥后西梅SDF的质量,g;M为西梅粉的质量,g。
1.2.5 西梅SDF基本成分的测定
水分含量的测定:参照GB 5009.3-2016测定;蛋白质含量的测定:参照GB 5009.5-2016测定;粗脂肪含量的测定:参照索氏提取法SL 391.2-2007测定;灰分含量的测定:参照GB 5009.4-2016测定;SDF含量的测定:参照AOAC 985.29测定[18]。
1.2.6 动物分组及给药
所有小鼠自由饮水进食,小鼠试验操作按照中国试验动物协会指导方针进行并符合动物伦理规范,所有实验均符合现行法律。健康昆明小鼠80只适应性喂养一周后,将小鼠随机平均分为5组,每组16只,空白对照组和模型对照组灌胃生理盐水,除空白对照组外,其余各组均1次/d灌胃10 mg/kg·bw盐酸洛哌丁胺,连续灌胃7 d,建立便秘模型。低、中、高剂量组灌胃西梅SDF溶液,分别按照0.15、0.3、0.6 g/kg·bw,空白对照组和模型对照组灌胃同等剂量的生理盐水,连续灌胃14 d,每只小鼠灌胃溶液体积为10 mL/kg·bw。
试验期间每隔2 d称量一次小鼠体重,每天观察小鼠一般生理状态有无异常情况。在动物试验结束时,将小鼠解剖,取出胃、小肠、大肠、肝脏、肾脏、胸腺、脾脏,所有组织用0.9%生理盐水冲洗,滤纸吸干生理盐水和血液,最后称重。脏器系数按下式计算:
(2) 式中:M1为脏器质量,g;M2为小鼠体重,g。
1.2.7 排便试验和粪便中水分的测定
在连续灌胃相应的受试物14 d后,将各组小鼠分别置于干净的笼子内,收集1 h内的新鲜粪便,小鼠排出后立即置于称量皿中称重,后放入105 ℃干燥箱进行烘干至恒重。从灌胃受试物14 d后,各组小鼠禁食不禁水16 h,每组随机取8只小鼠,灌胃10 mL/kg·bw墨汁后小鼠进行单笼饲养,可以自由进食进水,观察记录6 h内小鼠的首粒黑便排便时间、排便粒数。粪便含水量按下式计算:
(3) 式中:M3为烘干后粪便质量,g;M4为新鲜粪便质量,g。
1.2.8 胃排空及小肠推进试验
从灌胃受试物14 d后,各组小鼠禁食不禁水16 h,每组随机取8只小鼠,灌胃10 mL/kg·bw墨汁25 min后,脱颈处死小鼠,立即剖开腹部,将胃和小肠(幽门至回盲瓣)迅速全部取出。整胃称重后沿胃大弯剪开,用磷酸盐缓冲液冲洗,用滤纸吸干溶液,称量空胃重量。同时,将小肠取出拉直铺在白纸上,测量小肠总长及墨汁前沿推进距离。胃排空率和小肠推进率按公式下式计算:
(4) (5) 式中:M5为整胃重量,g;M6为空胃重量,g;L1为墨汁推进长度,cm;L2为小肠总长度,cm。
1.2.9 组织形态学描述及测定
将解剖取出的五个分组小鼠的胃、大肠及小肠片段固定于10%中性甲醛固定液中,固定组织用全自动脱水机脱水,石蜡包埋切片,再用二甲苯脱蜡,用分级乙醇复水,按照病理检验标准操作规程进行苏木精-伊红染色,用BA210Digital数码三目摄像显微摄像系统对切片进行100和400倍图像的采集,观察病理状态。用分析软件Motic Images Advanced 3.2的直线和折线工具,测量胃和大肠的黏膜层厚度及肌层厚度,小肠的肠绒毛高度、绒毛宽度、隐窝深度及肌层厚度。
1.3 数据处理
试验数据采用Origin 2021进行结果的绘图制作,采用SPSS软件进行数据方差分析(ANOVA),采用Design-Expert V8.0.6中Box-Behnken进行模型建立和方差分析,所有试验均做三次平行,试验结果以平均值±标准差表示。
2. 结果与分析
2.1 单因素实验结果
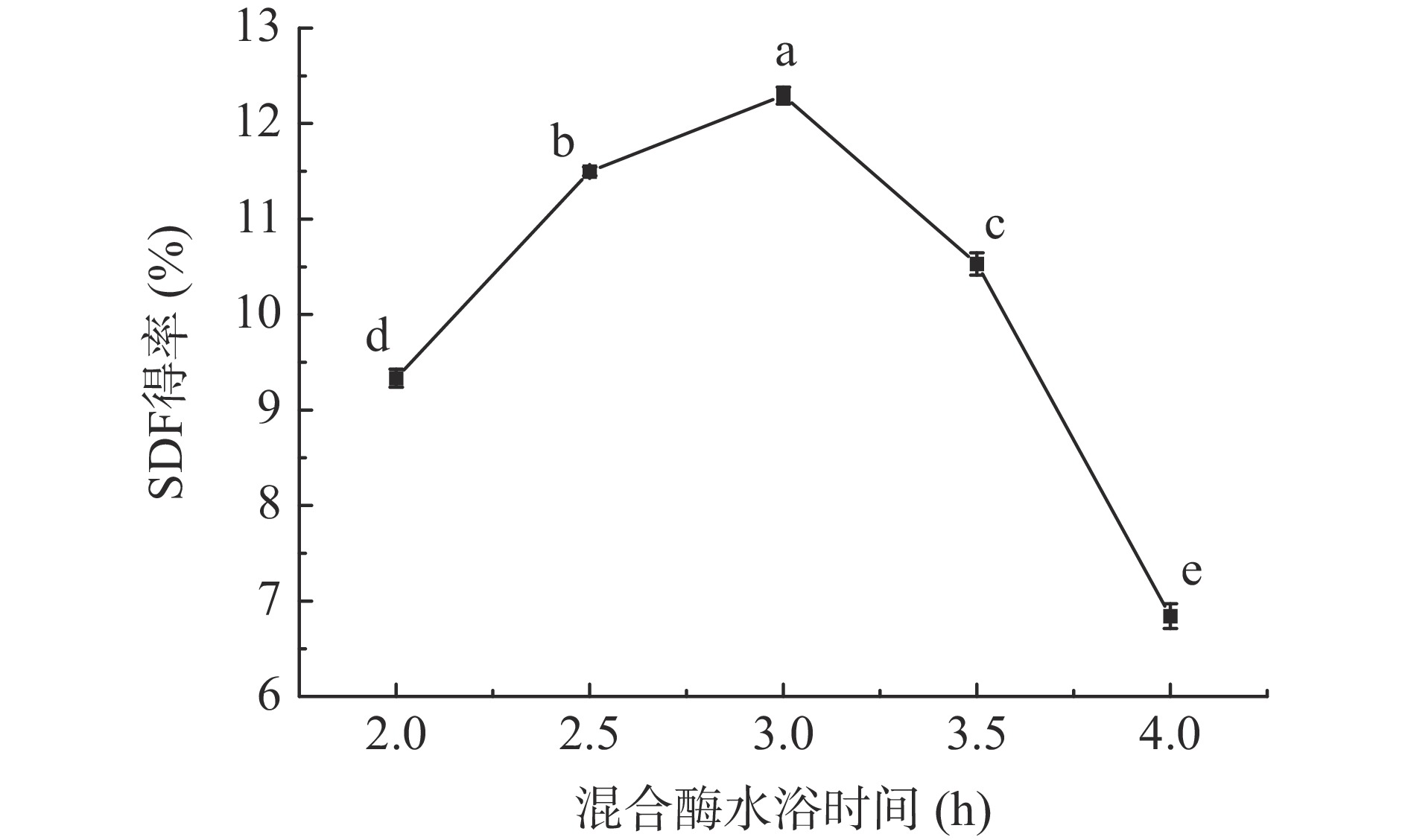
2.1.1 混合酶水浴时间对西梅SDF得率的影响
由图1可知,随着混合酶水浴时间延长,SDF得率逐渐增加,在3 h时SDF得率最大,随后SDF得率逐渐下降。水浴时间短,酶与底物反应不完全,此时SDF主要成分为果胶[19];适当的酶解时间可促进纤维素将不溶性大分子水解为可溶性小分子物质;超过3 h后可能溶液黏度升高,导致得率降低。因此混合酶水浴时间为3 h最适。
2.1.2 纤维素酶添加量对西梅SDF得率的影响
由图2可知,随着纤维素酶添加量由0.6%增加到1%,SDF得率呈先升高后下降趋势,当纤维素酶添加量为1%时,SDF得率达到最高。纤维素酶加入后使细胞壁破裂,将西梅中IDF大分子降解为小分子,增加其溶解度,从而部分IDF转化为SDF,增加SDF得率[20]。酶量过多时,酶可能将小分子降解为更小的低聚糖甚至单糖,在醇沉时不能被沉淀出来,最终得率降低[21-22]。所以纤维素酶添加量为1%时最佳。
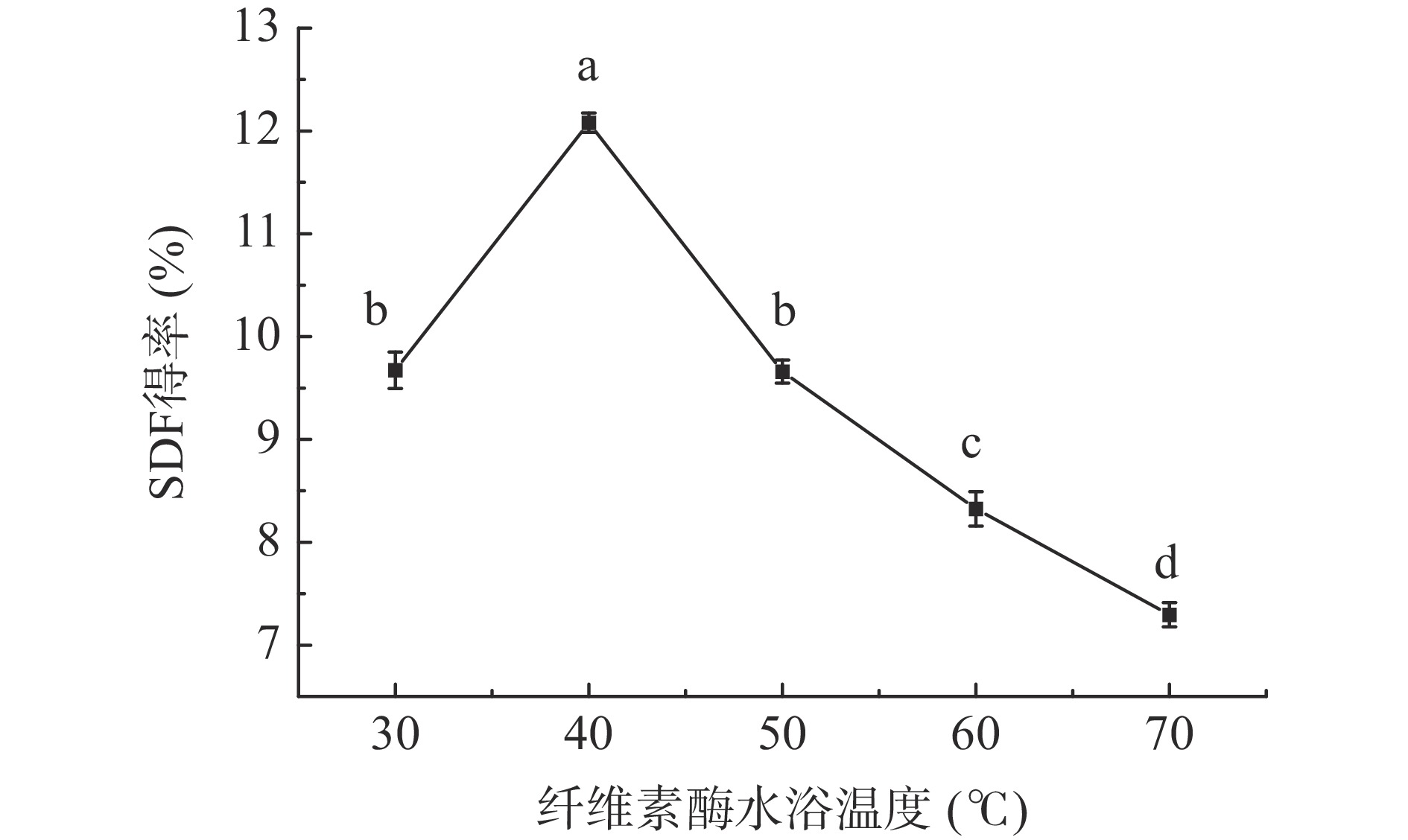
2.1.3 纤维素酶水浴温度对西梅SDF得率的影响
由图3可知,随着纤维素酶水浴温度升高,SDF得率先升高,当纤维素酶水浴温度到40 ℃时SDF得率最大,继续升温,得率开始逐渐降低。温度低时纤维素酶活性较低,在适宜温度下酶促反应速度最大[23],温度过高会使纤维素酶分子结构遭到破坏,甚至导致酶变性失活,从而使得率下降[24]。因此纤维素酶水浴温度为40 ℃时最佳。
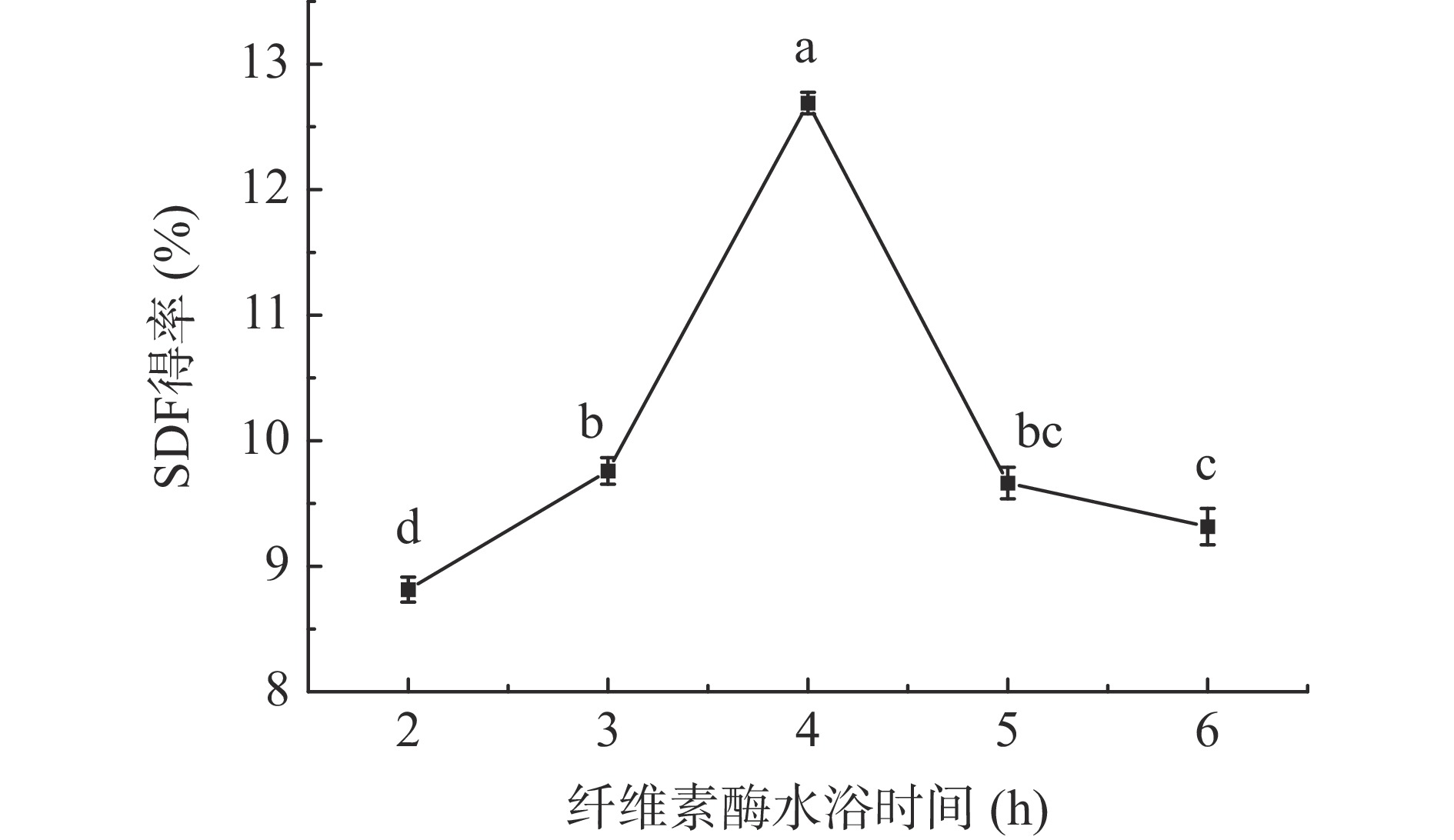
2.1.4 纤维素酶水浴时间对西梅SDF得率的影响
由图4可知,随着纤维素酶水浴时间从2 h延长至4 h时,SDF得率先逐渐上升后开始降低,当时间为4 h时SDF得率达到最高。水浴时间太短,纤维素酶未反应完全,但时间过长会使SDF中的果胶被降解为低聚糖和单糖,由于太小而不能被醇沉析出,最终降低得率[25]。所以纤维素酶水浴时间为4 h时最佳。
2.2 响应面试验优化结果分析
2.2.1 响应面优化试验设计与结果
在单因素实验结果上分析,选择影响西梅SDF得率主要的四个因素,混合酶水浴时间(A)、纤维素酶添加量(B)、纤维素酶水浴温度(C)、纤维素酶水浴时间(D)为自变量,以SDF得率为响应值,根据Box-Behnken设计原理,设定四因素三水平试验,试验设计与结果见表2。
表 2 响应面优化试验结果Table 2. Response surface optimization test results实验号 A B C D SDF得率(%) 1 0 0 0 0 13.067 2 −1 0 0 1 10.951 3 0 0 −1 −1 11.755 4 0 0 0 0 13.127 5 1 0 −1 0 12.085 6 0 1 1 0 12.196 7 1 1 0 0 11.576 8 0 0 0 0 12.944 9 0 0 0 0 13.163 10 0 −1 0 −1 11.658 11 0 0 1 1 11.373 12 0 0 1 −1 12.234 13 0 0 −1 1 12.088 14 0 −1 0 1 11.804 15 0 1 0 1 11.574 16 −1 0 −1 0 10.982 17 −1 1 0 0 11.511 18 1 0 0 1 11.791 19 0 1 −1 0 12.083 20 1 0 0 −1 11.216 21 0 0 0 0 13.002 22 −1 0 0 −1 12.193 23 0 1 0 −1 12.271 24 −1 0 1 0 12.053 25 0 −1 −1 0 11.35 26 1 −1 0 0 10.911 27 −1 −1 0 0 11.44 28 0 −1 1 0 10.913 29 1 0 1 0 10.569 2.2.2 回归模型的方差分析
使用Design Expert软件对表2西梅可溶性膳食纤维酶法提取工艺试验数据进行二次多项回归拟合方程为:
Y=13.0606−0.0818333A+0.26125B−0.08375C−0.1455D+0.1485AB−0.64675AC+0.45425AD+0.1375BC−0.21075BD−0.2985CD−0.977925A2−0.7268B2−0.67755C2−0.524175D2。
试验结果方差分析结果见表3,西梅提取SDF的回归模拟方程F值为32.64,P<0.0001极显著,失拟项P=0.0679>0.05不显著,说明试验模型拟合度良好,能较好的反应SDF得率(Y)与四个因素的关系,可以用于优化西梅SDF的提取工艺。决定系数R2=0.9703,校正RAdj2=0.9405,说明此模型方程误差小,比较精确。同时一次项B、D,交互项AC、AD、BD、CD和平方项A2、B2、C2和D2均显著。方差分析结果中F值绝对值大小可知对西梅SDF得率影响大小为:B>D>C>A,即纤维素酶添加量的影响最大,其次为纤维素酶水浴时间和纤维素酶水浴温度,最后混合酶水浴时间影响最小。
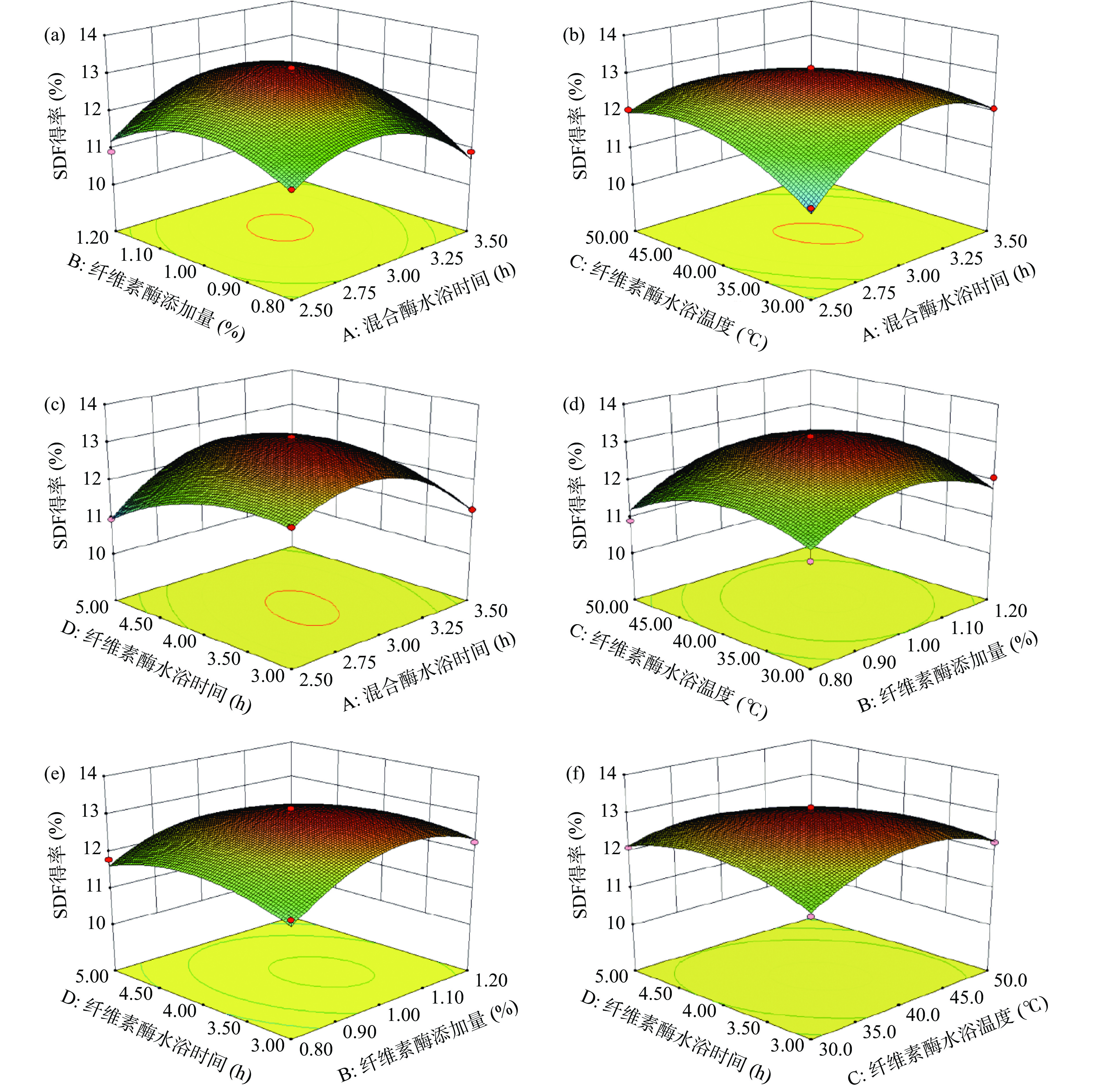
表 3 响应面优化结果方差分析Table 3. Analysis of variance for response surface optimization results方差来源 平方和 自由度 方差 F值 P值 显著性 回归模型 14.03 14 1.00 32.64 <0.0001 ** A 0.080 1 0.080 2.62 0.1280 B 0.82 1 0.82 26.68 0.0001 ** C 0.084 1 0.084 2.74 0.1200 D 0.25 1 0.25 8.28 0.0122 * AB 0.088 1 0.088 2.87 0.1122 AC 1.67 1 1.67 54.51 <0.0001 ** AD 0.83 1 0.83 26.89 0.0001 ** BC 0.076 1 0.076 2.46 0.1388 BD 0.18 1 0.18 5.79 0.0305 * CD 0.36 1 0.36 11.61 0.0042 ** A2 6.20 1 6.20 202.09 <0.0001 ** B2 3.43 1 3.43 111.63 <0.0001 ** C2 2.98 1 2.98 97.01 <0.0001 ** D2 1.78 1 1.78 58.06 <0.0001 ** 残差 0.43 14 0.031 失拟项 0.40 10 0.040 4.98 0.0679 不显著 纯误差 0.032 4 7.991E-003 R2 0.9703 R2Adj 0.9405 合计 14.45 28 通过Design Expert软件分析,得到响应面交互图,如图5所示。因素对响应值的影响越大,交互图的曲线越陡峭,反之影响小。由图5可以看出,四个因素对SDF得率的影响均为抛物线,并且每两个因素交互作用均存在最高点,说明两个因素中间交互作用明显,且回归分析可以得到最佳提取点,模型具有预测价值。
2.2.3 最优提取工艺验证
经响应面分析,得到SDF得率最佳条件为:混合酶水浴时间2.949 h、纤维素酶添加量1.042%、纤维素酶水浴温度40.627 ℃、纤维素酶水浴时间3.756 h,在此条件下理论SDF最大得率为13.107%。
为了方便试验实际操作,将响应面分析得到的最佳提取条件调整为:混合酶水浴时间2.9 h、纤维素酶添加量1%、纤维素酶水浴温度41 ℃、纤维素酶水浴时间3.8 h。在最佳提取条件下重复三次试验,试验结果所得的西梅SDF得率的平均值为13.238%±0.07%,与预测值13.107%接近。表明试验得到模型预测性能较好,优化工艺有效,可将此试验方案作为提取西梅SDF的最佳条件。
2.3 西梅SDF基本化学组成分析
由表4可知,西梅SDF中水溶性膳食纤维的含量为85.91%,本试验酶法提取的西梅SDF纯度较高。西梅SDF中测定的基本成分结果表明,SDF中还存在其他物质,可能为不溶性膳食纤维。
表 4 西梅SDF基本化学组成Table 4. Basic chemical composition of prune SDF成分 含量(%) 水分 4.26±0.09 蛋白质 2.32±0.18 粗脂肪 0 灰分 2.73±0.09 可溶性膳食纤维 85.91±0.46 2.4 西梅SDF对小鼠体重的影响
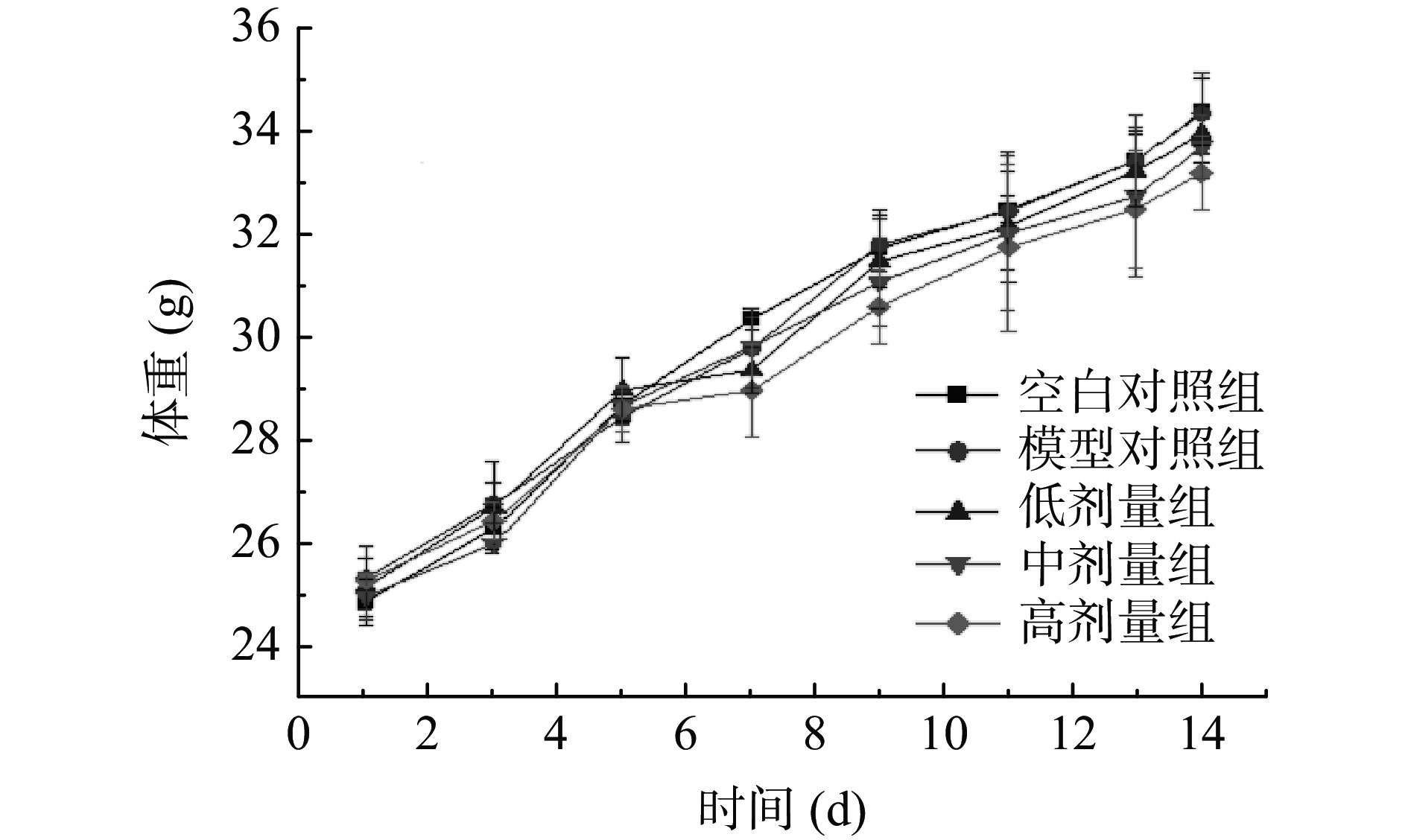
由图6可知,各组小鼠体重呈均匀上升趋势,并且各组体重之间都无显著性差异(P>0.05)。说明被盐酸洛哌丁胺诱导的便秘组不会受药物严重的影响,可以正常生长,灌胃14 d西梅SDF不会对小鼠产生副作用,所以小鼠体重并未因此出现异常变化。但从图中可以看出灌胃西梅SDF组的小鼠体重稍有降低,增加灌胃SDF量体重是否会显著降低,即达到一定的减肥效果,有待进一步研究[26]。
2.5 西梅SDF对小鼠排便及粪便含水量的影响
由表5可知,模型对照组与空白对照组小鼠相比,首粒黑便排出时间、6 h内排便粒数和粪便含水量都有极显著差异(P<0.01),模型对照组小鼠出现排便困难,排便少和便干燥的现象,说明被盐酸洛哌丁胺诱导的小鼠建模成功。与模型对照组相比,首粒黑便排出时间中、高剂量组显著缩短(P<0.05);中、高剂量组对6 h内排便粒数都极显著增加(P<0.01);中、高剂量组显著增加了粪便含水量(P<0.05)。膳食纤维有很强的膨胀功能和吸水作用,其在肠道中吸收大量水分,增加了粪便的水分和体积,使排便速度增加,从而缩短粪便在肠道内的停留时间,防止粪便失去水分而形成便秘[27-28]。说明便秘小鼠在灌胃西梅SDF 14 d后,排便频率、排便粒数和粪便含水量都有一定程度的改善和增加,虽然与空白对照组相比还有显著性差异(P<0.05),但与模型对照组相比已有效改变排便困难、便干结的便秘状况。其中灌胃高剂量组西梅SDF的通便效果最佳。
表 5 西梅SDF对小鼠排便及粪便含水量的影响Table 5. Effects of prune SDF on defecation and fecal water content in mice组别 首粒黑便排出时间(min) 6 h内排便粒数(粒) 粪便含水量(%) 空白对照组 125.3±14.6∆∆ 17.4±2.1∆∆ 33.57±2.28∆∆ 模型对照组 251.4±7.2** 3.2±1.3** 25.43±1.53** 低剂量组 228.1±12.7** 5.7±1.1** 27.84±1.49* 中剂量组 214.8±15.2**∆ 9.1±1.7**∆∆ 28.86±1.38*∆ 高剂量组 208.2±13.3**∆∆ 11.4±1.2*∆∆ 30.28±2.07*∆ 注:与空白对照组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与模型对照组相比,△表示差异显著(P<0.05),△△表示差异极显著(P<0.01);表7~表8同。 2.6 西梅SDF对小鼠脏器指数的影响
解剖小鼠发现胸腺、肝脏、肾脏和脾脏位置和形状都无明显差异。脏器指数能够间接的了解小鼠是否存在疾病隐患、生长情况是否健康和内脏功能正常与否的重要指标[29]。由表6可知,对各试验组小鼠的脏器进行称重计算,发现各试验组间脏器系数无显著差异(P>0.05),说明盐酸洛哌丁胺和西梅SDF都不会对小鼠健康产生损害。
表 6 西梅SDF对小鼠脏器指数的影响Table 6. Effects of prune SDF on viscera index in mice组别 胸腺(%) 肝脏(%) 肾脏(%) 脾脏(%) 空白对照组 0.57±0.09 6.21±0.16 1.84±0.13 0.33±0.26 模型对照组 0.59±0.08 6.14±0.13 1.83±0.2 0.34±0.12 低剂量组 0.61±0.03 6.18±0.36 1.78±0.26 0.33±0.14 中剂量组 0.55±0.04 5.99±0.02 1.8±0.17 0.35±0.07 高剂量组 0.61±0.07 6.11±0.23 1.94±0.24 0.34±0.05 2.7 西梅SDF对小鼠胃排空及小肠推进的影响
由表7可知,墨汁前沿长度、小肠推进率和胃排空率,模型对照组与空白对照组相比都极显著降低(P<0.01),说明便秘模型成功,模型可用;低、中、高剂量组与空白对照组相比都显著降低(P<0.05),表明小肠推动和胃排空功能比健康小鼠要弱。各试验组小肠长度无显著差异(P>0.05),证明盐酸洛哌丁胺和西梅SDF均不会对小肠长度产生影响。与模型对照组相比墨汁前沿长度和小肠推进率结果相同,低剂量组都显著增加(P<0.05),中、高剂量组都极显著增加(P<0.01);低、中、高剂量组的胃排空率都极显著增加(P<0.01)。膳食纤维中存在大量氢键来使多糖链形成多孔结构及亲水基团,使其有良好的水合性质[30],膳食纤维吸水会增加粪便体积和润滑度,从而肠道加速蠕动;并且其溶于水中后通过物理作用使食物具有黏性,容易形成凝胶,从而延缓食物中的淀粉产生葡萄糖、延迟胃排空,还具有润滑作用可以加快粪便排出[31]。说明西梅SDF能够促进小肠的蠕动推进墨汁和加快胃排空,具有改善小鼠便秘的效果。
表 7 西梅SDF对小鼠胃排空及小肠推进的影响Table 7. Effects of prune SDF on gastric emptying and small intestinal propulsion in mice组别 小肠长度(cm) 墨汁前沿长度(cm) 小肠推进率(%) 胃排空率(%) 空白对照组 51.4±1.3 42.5±0.8∆∆ 83.5±2.2∆∆ 70.11±0.32∆∆ 模型对照组 51.3±1.4 24.6±1.4** 47.5±2.6** 43.69±0.18** 低剂量组 52.1±0.9 30.9±1.7**∆ 60.3±3.1**∆ 55.08±0.24**∆∆ 中剂量组 51.9±1.7 34.6±0.9**∆∆ 67.4±2.5**∆∆ 62.71±0.44**∆∆ 高剂量组 51.5±1.5 38.7±1.6*∆∆ 75.1±3.3*∆∆ 65.22±0.72**∆∆ 表 8 西梅SDF对小鼠胃肠组织切片测量指标的影响Table 8. Effects of prune SDF on the measurement indexes of mouse gastrointestinal tissue slices组织 测量指标 组别 空白对照组 模型对照组 低剂量组 中剂量组 高剂量组 胃 黏膜层厚度(μm) 589.12±14.29∆∆ 436.81±19.57** 471.04±18.21** 507.24±21.42**∆ 552.32±17.53*∆∆ 肌层厚度(μm) 191.69±11.62∆∆ 35.51±5.61** 103.54±14.67**∆∆ 145.80±10.84**∆∆ 171.35±15.31∆∆ 小肠 绒毛高度(μm) 421.19±13.75∆∆ 242.71±18.57** 266.75±7.51** 325.30±15.82**∆∆ 357.40±16.78**∆∆ 绒毛宽度(μm) 112.89±5.68∆∆ 73.18±3.46** 78.58±4.98** 85.17±6.23**∆ 92.95±4.12**∆∆ 隐窝深度(μm) 185.40±13.14∆∆ 91.82±5.24** 104.03±7.63** 112.52±9.26**∆ 130.65±7.17**∆∆ 肌层厚度(μm) 83.37±4.37∆∆ 25.41±5.68** 37.19±3.27**∆ 48.90±4.56**∆∆ 73.70±7.71∆∆ 大肠 黏膜层厚度(μm) 295.60±10.45∆∆ 181.24±7.87** 208.63±6.74**∆ 258.59±3.68**∆∆ 271.44±11.16∆∆ 肌层厚度(μm) 285.64±17.99∆∆ 115.40±4.72** 146.53±10.38**∆ 184.7±15.55**∆∆ 239.75±12.21*∆∆ 2.8 西梅SDF对胃肠机械屏障功能的影响
2.8.1 西梅SDF对小鼠胃肠组织形态的影响
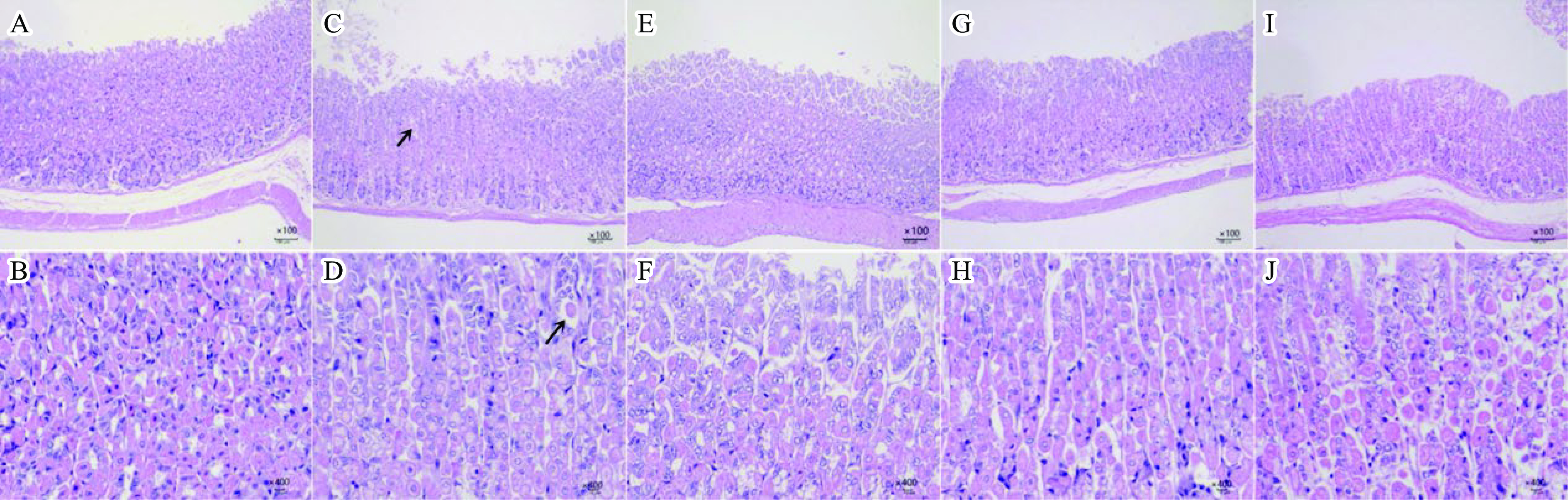
根据图7分析小鼠胃组织,可以看出在显微镜100倍下各个试验组小鼠胃的黏膜层、黏膜下层、肌层、浆膜层4层结构清晰完整[32]。模型对照组胃的黏膜层部分区域有少量炎细胞浸润;空白对照组和低中高剂量组的黏膜层、肌层及外膜无炎性细胞浸润,显微镜400倍下,黏膜层的主细胞和壁细胞形态无异常,腺体排列整齐,未见明显病理变化,说明灌胃西梅SDF降低了胃组织的损伤。
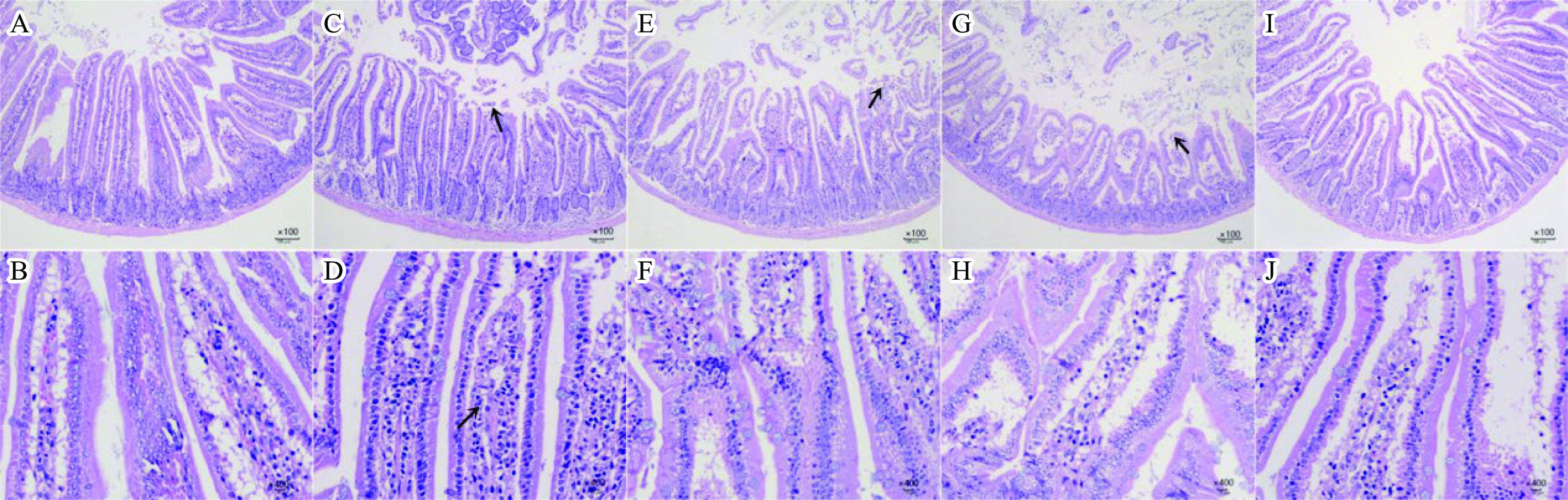
根据图8分析小鼠小肠组织,可以看出各个试验组小鼠黏膜层、黏膜下层、肌层及外膜结构较完整。肠绒毛黏膜表面被覆单层柱状上皮细胞,其中模型对照组、低剂量组和中剂量组有少量黏膜层上皮细胞脱落,绒毛排列紊乱。黏膜固有层内可见管状肠腺,结缔组织内细胞排列较紧密,模型对照组固有层有少量炎性细胞浸润。黏膜下层为疏松结缔组织,其内分布血管和神经等,空白对照组和低中高剂量组黏膜下层、肌层和浆膜层未见明显炎性细胞浸润和增生,没有明显病理改变,说明西梅SDF降低了小肠组织的损伤。
根据图9分析小鼠大肠组织,可以看出在显微镜100倍下各个试验组小鼠黏膜层、黏膜下层、肌层及浆膜层4层结构清晰完整。模型对照组大肠的黏膜固有层部分区域有少量炎细胞浸润;空白对照组和低中高剂量组黏膜层上皮细胞形态完整正常,杯状细胞及肠腺丰富,腺上皮细胞排列较为紧密且正常,说明灌胃西梅SDF降低了大肠组织的损伤。
2.8.2 西梅SDF对小鼠胃肠组织切片测量指标的影响
胃肠道组织切片在显微镜100倍下的图片测量结果见表。由表8可知,小鼠胃黏膜层厚度的模型对照组与空白对照组相比极显著降低(P<0.01);与模型对照组的黏膜层厚度相比,中、高剂量组显著升高(P<0.05)。小鼠肌层厚度结果与黏膜层结果相似,与空白对照组相比,模型对照组肌层厚度极显著降低(P<0.01);与模型对照组的肌层厚度相比,低、中、高剂量组都极显著升高肌层厚度(P<0.01)。
整体来看小肠的绒毛高度、绒毛宽度、隐窝深度、肌层厚度结果,发现模型对照组与空白对照组相比,便秘模型使四组指标数值都极显著下降(P<0.01);与模型对照组相比,低剂量组只有肌层厚度具有显著性(P<0.05),其他三组无显著性(P>0.05),中剂量与高剂量组都在一定程度上增加了绒毛高度、绒毛宽度、隐窝深度和肌层厚度。
模型对照组与空白对照组相比,大肠的黏膜层和肌层厚度被极显著降低了(P<0.01);与模型对照组相比,低剂量组缓解了便秘模型对黏膜层和肌层的损伤,厚度显著增加(P<0.05),中、高剂量组比低剂量组效果更好,都极显著增加了厚度(P<0.01)。
综合分析表8中胃、小肠和大肠的组织切片测量结果,可以看出西梅SDF的摄入可以不同程度的改善模型对照组的胃肠屏障损伤,能够起到保护胃肠屏障的作用。
3. 结论
对西梅进行前处理,用酶法提取西梅中的SDF,以西梅SDF得率为指标,通过响应面对提取工艺优化后,得到最佳提取条件为:混合酶水浴时间2.9 h、纤维素酶添加量1%、纤维素酶水浴温度41 ℃、纤维素酶水浴时间3.8 h,在此条件下西梅SDF得率为13.238%±0.07%,并且西梅SDF中可溶性膳食纤维含量可达85.91%。此工艺提取的西梅SDF纯度较高,提取时间较短。
将提取得到的西梅SDF进行体内试验,实验表明与便秘模型对照组相比,灌胃西梅SDF的小鼠首粒黑便排出时间、6 h内排便粒数、粪便含水量、墨汁前沿长度、小肠推进率和胃排空率都有显著差异(P<0.05);通过胃肠道组织切片结果,发现灌胃西梅SDF后,降低了便秘对胃、小肠和大肠组织的损伤,组织形态都有了一定程度的改善。结果说明提取的西梅SDF能够改善小鼠便秘,提高胃肠动力,对胃肠道起到一定程度的保护的作用,并且发现灌胃高剂量的西梅SDF对小鼠便秘的改善效果最好。
本实验为西梅膳食纤维的提取提供理论基础,拓宽了西梅深加工和综合利用的思路,为后续开发西梅膳食纤维功能性产品的提供理论依据。西梅膳食纤维含量高,可以作为开发通便功能性食品的良好资源,也可继续研究西梅SDF的其他功能性。本试验仍需对西梅SDF进行纯化,并对组分进行鉴定,从而深入探究通便的机制。
-
表 1 Box-Behnken试验设计因素水平表
Table 1 Factors and levels of Box-behnken test design
水平 因素 A混合酶水浴时间(h) B纤维素酶添加量(%) C纤维素酶水浴温度(℃) D纤维素酶水浴时间(h) −1 2.5 0.8 30 3 0 3 1 40 4 1 3.5 1.2 50 5 表 2 响应面优化试验结果
Table 2 Response surface optimization test results
实验号 A B C D SDF得率(%) 1 0 0 0 0 13.067 2 −1 0 0 1 10.951 3 0 0 −1 −1 11.755 4 0 0 0 0 13.127 5 1 0 −1 0 12.085 6 0 1 1 0 12.196 7 1 1 0 0 11.576 8 0 0 0 0 12.944 9 0 0 0 0 13.163 10 0 −1 0 −1 11.658 11 0 0 1 1 11.373 12 0 0 1 −1 12.234 13 0 0 −1 1 12.088 14 0 −1 0 1 11.804 15 0 1 0 1 11.574 16 −1 0 −1 0 10.982 17 −1 1 0 0 11.511 18 1 0 0 1 11.791 19 0 1 −1 0 12.083 20 1 0 0 −1 11.216 21 0 0 0 0 13.002 22 −1 0 0 −1 12.193 23 0 1 0 −1 12.271 24 −1 0 1 0 12.053 25 0 −1 −1 0 11.35 26 1 −1 0 0 10.911 27 −1 −1 0 0 11.44 28 0 −1 1 0 10.913 29 1 0 1 0 10.569 表 3 响应面优化结果方差分析
Table 3 Analysis of variance for response surface optimization results
方差来源 平方和 自由度 方差 F值 P值 显著性 回归模型 14.03 14 1.00 32.64 <0.0001 ** A 0.080 1 0.080 2.62 0.1280 B 0.82 1 0.82 26.68 0.0001 ** C 0.084 1 0.084 2.74 0.1200 D 0.25 1 0.25 8.28 0.0122 * AB 0.088 1 0.088 2.87 0.1122 AC 1.67 1 1.67 54.51 <0.0001 ** AD 0.83 1 0.83 26.89 0.0001 ** BC 0.076 1 0.076 2.46 0.1388 BD 0.18 1 0.18 5.79 0.0305 * CD 0.36 1 0.36 11.61 0.0042 ** A2 6.20 1 6.20 202.09 <0.0001 ** B2 3.43 1 3.43 111.63 <0.0001 ** C2 2.98 1 2.98 97.01 <0.0001 ** D2 1.78 1 1.78 58.06 <0.0001 ** 残差 0.43 14 0.031 失拟项 0.40 10 0.040 4.98 0.0679 不显著 纯误差 0.032 4 7.991E-003 R2 0.9703 R2Adj 0.9405 合计 14.45 28 表 4 西梅SDF基本化学组成
Table 4 Basic chemical composition of prune SDF
成分 含量(%) 水分 4.26±0.09 蛋白质 2.32±0.18 粗脂肪 0 灰分 2.73±0.09 可溶性膳食纤维 85.91±0.46 表 5 西梅SDF对小鼠排便及粪便含水量的影响
Table 5 Effects of prune SDF on defecation and fecal water content in mice
组别 首粒黑便排出时间(min) 6 h内排便粒数(粒) 粪便含水量(%) 空白对照组 125.3±14.6∆∆ 17.4±2.1∆∆ 33.57±2.28∆∆ 模型对照组 251.4±7.2** 3.2±1.3** 25.43±1.53** 低剂量组 228.1±12.7** 5.7±1.1** 27.84±1.49* 中剂量组 214.8±15.2**∆ 9.1±1.7**∆∆ 28.86±1.38*∆ 高剂量组 208.2±13.3**∆∆ 11.4±1.2*∆∆ 30.28±2.07*∆ 注:与空白对照组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与模型对照组相比,△表示差异显著(P<0.05),△△表示差异极显著(P<0.01);表7~表8同。 表 6 西梅SDF对小鼠脏器指数的影响
Table 6 Effects of prune SDF on viscera index in mice
组别 胸腺(%) 肝脏(%) 肾脏(%) 脾脏(%) 空白对照组 0.57±0.09 6.21±0.16 1.84±0.13 0.33±0.26 模型对照组 0.59±0.08 6.14±0.13 1.83±0.2 0.34±0.12 低剂量组 0.61±0.03 6.18±0.36 1.78±0.26 0.33±0.14 中剂量组 0.55±0.04 5.99±0.02 1.8±0.17 0.35±0.07 高剂量组 0.61±0.07 6.11±0.23 1.94±0.24 0.34±0.05 表 7 西梅SDF对小鼠胃排空及小肠推进的影响
Table 7 Effects of prune SDF on gastric emptying and small intestinal propulsion in mice
组别 小肠长度(cm) 墨汁前沿长度(cm) 小肠推进率(%) 胃排空率(%) 空白对照组 51.4±1.3 42.5±0.8∆∆ 83.5±2.2∆∆ 70.11±0.32∆∆ 模型对照组 51.3±1.4 24.6±1.4** 47.5±2.6** 43.69±0.18** 低剂量组 52.1±0.9 30.9±1.7**∆ 60.3±3.1**∆ 55.08±0.24**∆∆ 中剂量组 51.9±1.7 34.6±0.9**∆∆ 67.4±2.5**∆∆ 62.71±0.44**∆∆ 高剂量组 51.5±1.5 38.7±1.6*∆∆ 75.1±3.3*∆∆ 65.22±0.72**∆∆ 表 8 西梅SDF对小鼠胃肠组织切片测量指标的影响
Table 8 Effects of prune SDF on the measurement indexes of mouse gastrointestinal tissue slices
组织 测量指标 组别 空白对照组 模型对照组 低剂量组 中剂量组 高剂量组 胃 黏膜层厚度(μm) 589.12±14.29∆∆ 436.81±19.57** 471.04±18.21** 507.24±21.42**∆ 552.32±17.53*∆∆ 肌层厚度(μm) 191.69±11.62∆∆ 35.51±5.61** 103.54±14.67**∆∆ 145.80±10.84**∆∆ 171.35±15.31∆∆ 小肠 绒毛高度(μm) 421.19±13.75∆∆ 242.71±18.57** 266.75±7.51** 325.30±15.82**∆∆ 357.40±16.78**∆∆ 绒毛宽度(μm) 112.89±5.68∆∆ 73.18±3.46** 78.58±4.98** 85.17±6.23**∆ 92.95±4.12**∆∆ 隐窝深度(μm) 185.40±13.14∆∆ 91.82±5.24** 104.03±7.63** 112.52±9.26**∆ 130.65±7.17**∆∆ 肌层厚度(μm) 83.37±4.37∆∆ 25.41±5.68** 37.19±3.27**∆ 48.90±4.56**∆∆ 73.70±7.71∆∆ 大肠 黏膜层厚度(μm) 295.60±10.45∆∆ 181.24±7.87** 208.63±6.74**∆ 258.59±3.68**∆∆ 271.44±11.16∆∆ 肌层厚度(μm) 285.64±17.99∆∆ 115.40±4.72** 146.53±10.38**∆ 184.7±15.55**∆∆ 239.75±12.21*∆∆ -
[1] 木合塔尔·扎热, 阿卜杜许库尔·牙合甫, 马合木提·阿不来提, 等. 西梅法兰西采前落果相关影响因子研究[J]. 西北农林科技大学学报(自然科学版),2021,49(9):137−143. [MUHTAR Z, ABDUXUKUR Y, MAHMUT A, et al. Factors affecting preharvest fruit drop of C prune (Prunus domestica L. cv. Prune)[J]. Journal of Northwest A& F Univerity (Natural Science Edition),2021,49(9):137−143. [2] 张俊秀, 胡桃花, 孙俊宝, 等. 西梅栽培管理研究进展[J]. 果树资源学报,2020,1(2):52−55. [ZHANG J, HU T H, FANG J B, et al. Advances in research on cultivation and management of prunus[J]. Journal of Fruit Resources,2020,1(2):52−55. [3] 王艺菡, 王永刚, 王剑瑞, 等. 欧洲李(西梅)的原产地与保护利用[J]. 新疆林业,2021(4):29−31. [WANG Y H, WANG Y G, WANG J R, et al. The origin and protection and utilization of European plum (prune)[J]. Forestry of Xinjiang,2021(4):29−31. doi: 10.3969/j.issn.1005-3522.2021.04.012 [4] 马科儒. 西梅在新疆及类似生态区域的开发前景[J]. 西北园艺(果树),2005(1):8−9. [MA K R. The development prospect of prunes in Xinjiang and similar ecological regions[J]. Northwest Horticulture,2005(1):8−9. [5] KO S H, CHOI S W, YE S K, et al. Comparison of the antioxidant activities of nine different fruits in human plasma[J]. Journal of Medicinal Food,2005,8(1):41−46. doi: 10.1089/jmf.2005.8.41
[6] CHIU H F, HUANG Y C, LU Y Y, et al. Regulatory/modulatory effect of prune essence concentrate on intestinal function and blood lipids[J]. Pharmaceutical Biology,2017,55(1):974−979. doi: 10.1080/13880209.2017.1285323
[7] SHAHIDI S, SETAREYE S, MAHMOODI M. Effect of Prunus domestica L. (mirabelle) on learning and memory in mice[J]. Ancient Science of Life,2013,32(2):139−143.
[8] SMITH B J, BU S Y, WANG Y, et al. A comparative study of the bone metabolic response to dried plum supplementation and PTH treatment in adult, osteopenic ovariectomized rat[J]. Bone,2014,58:151−159. doi: 10.1016/j.bone.2013.10.005
[9] SCHIANO D V M, PASQUALI A, CIPOLAT M T, et al. Sacral nerve stimulation in slow-transit constipation: Effectiveness at 5-year follow-up[J]. International Journal of Colorectal Disease,2019,34(9):1529−1540. doi: 10.1007/s00384-019-03351-w
[10] SCHUBERT C M, ROGERS N L, REMSBERG K E, et al. Lipids, lipoproteins, lifestyle, adiposity and fat-free mass during middle age: The Fels lon-gitudinal study[J]. International Journal of Obesity,2006,30(2):251−260. doi: 10.1038/sj.ijo.0803129
[11] STACEWICZ-SAPUNTZKIS M, BOWEN P E, HUSSAIN E A, et al. Chemical composition and potential health effects of prunes: A functional food?[J]. Critical Reviews in Food Science and Nutrition,2001,41(4):251−286. doi: 10.1080/20014091091814
[12] ISLAMS M S, SAKAGUCHI E, KASHIMA N, et al. Effect of sugar alcohols on gut function and body composition in normal and cecectomized rats[J]. Experimental Animals,2004,53(4):361−371. doi: 10.1538/expanim.53.361
[13] ATTALURI A, DONAHOE R, VALESTIN J, et al. Randomised clinical trial: Dried plums (prunes) vs. Psyllium for constipation[J]. Alimentary Pharmacology & Therapeutics,2011,33(7):822−828.
[14] CHESKIN L J, MITOLA A H, RIDORA M, et al. A naturalistic, controlled, crossover trial of plum juice versus psyllium versus control for improving bowel function[J]. Internet Journal of Nutrition Wellness,2009,7(2):1−11.
[15] PIIRAINEN L, PEUHKURI K, BACKSTROM K, et al. Prune juice has a mild laxative effect in adults with certain gas-trointestinal symptoms[J]. Nutrition Research,2007,27(8):511−513. doi: 10.1016/j.nutres.2007.06.008
[16] MATEOS-APARICIO I, MATEOS-PEINADO C, RUPÉREZ P. High hydrostatic pressure improves the functionality of dietary fibre in okara by-product from soybean[J]. Innovative Food Science & Emerging Technologies,2010,11(3):445−450.
[17] BELMIRO R H, OLIVEIRA L, GERALDI M V, et al. Modification of coffee coproducts by-products by dynamic high pressure, acetylation and hydrolysis by cellulase: A potential functional and sustainable food ingredient[J]. Innovative Food Science & Emerging Technologies,2021,68(6):102608.
[18] 王文欣. 双孢菇可溶性膳食纤维的提取及其在曲奇中的应用[D]. 上海: 上海应用技术大学, 2018 WANG W X. Extraction of soluble dietary fiber from Agaricus bisporus and its application in cookies[D]. Shanghai: Shanghai Institute of Technology, 2018.
[19] 陈小举, 吴学凤, 姜绍通, 等. 响应面法优化半纤维素酶提取梨渣中可溶性膳食纤维工艺[J]. 食品科学,2015,36(6):18−23. [CHEN X J, WU X F, JIANG S T, et al. Applying response surface methodology to optimize extraction of soluble dietary fiber from pear residue using hemicellulase[J]. Food Science,2015,36(6):18−23. doi: 10.7506/spkx1002-6630-201506004 [20] 切吉卓玛, 李军乔, 李积雲. 藏药蕨麻可溶性膳食纤维酶法提取工艺优化[J]. 食品工业,2020,41(1):42−46. [QIE J Z M, LI J Q, LI J Y. Optimization of enzymatic extraction for preparing soluble dietary fiber from Tibetan medicinal Potentilla anserina[J]. The Food Industry,2020,41(1):42−46. [21] 赵明慧, 吕春茂, 孟宪军, 等. 苹果渣水溶性膳食纤维提取及其对自由基的清除作用[J]. 食品科学,2013,34(22):75−80. [ZHAO M H, LÜ C M, MENG X J, et al. Extraction of soluble dietary fiber from apple pomace and its scavenging capacity against free radicals[J]. Food Science,2013,34(22):75−80. [22] 李雄. 咖啡果皮水溶性膳食纤维的制备及特性研究[D]. 海口: 海南大学, 2018 LI X. Preparation and characteristics of water-soluble dietary fiber from coffee peel[J]. Haikou: Hainan University, 2018.
[23] 王在贵, 张莉, 张宏福, 等. 纤维素酶的酶学性质研究[J]. 中国饲料,2006(1):12−14,17. [WANG Z G, ZHANG L, ZHANG H F, et al. Study on the enzymatic properties of cellulase[J]. China Feed,2006(1):12−14,17. doi: 10.3969/j.issn.1004-3314.2006.01.007 [24] 蔡沙, 何建军, 施建斌, 等. 葛渣可溶性膳食纤维酶法制备工艺的研究[J]. 湖北农业科学,2017,56(24):4863−4868, 4874. [CAI S, HE J J, SHI J B, et al. Studies on the enzymatic extraction of soluble dietary fiber from pueraia roots residues[J]. Hubei Agricultural Sciences,2017,56(24):4863−4868, 4874. doi: 10.14088/j.cnki.issn0439-8114.2017.24.052 [25] HUANG H R, CHEN J J, CHEN Y, et al. Modification of tea residue dietary fiber by high-temperature cooking assisted enzymatic method: Structural, physicochemical and functional properties[J]. LWT-Food Science and Technology,2021(1):111314.
[26] 梁文康. 黄秋葵可溶性膳食纤维提取及通便作用研究[D]. 杭州: 浙江大学, 2020 LIANG W K. Study on the extraction and laxative function of soluble dietary fiber from okra[D]. Hangzhou: Zhejiang University, 2020.
[27] 刘楠, 孙永, 李月欣, 等. 膳食纤维的理化性质、生理功能及其应用[J]. 食品安全质量检测学报,2015,6(10):3959−3963. [LIU N, SUN Y, LI X Y, et al. Properties, physiological function and application of dietary fiber[J]. Journal of Food Safety and Quality,2015,6(10):3959−3963. doi: 10.19812/j.cnki.jfsq11-5956/ts.2015.10.032 [28] 张想, 李立郎, 杨娟, 等. 发酵刺梨果渣膳食纤维润肠通便功能研究[J]. 食品与发酵科技,2021,57(2):30−34. [ZHANG X, LI L L, YANG J, et al. Study on the moistening and laxative function of dietary fiber from fermented roxburgh rose pomace[J]. Food and Fermentation Sciences & Technology,2021,57(2):30−34. [29] LAN X Y, YU H, CHEN Q J, et al. Effect of liquiritin on neuroendocrine-immune network in menopausal rat model[J]. Phytotherapy Research,2020,34(10):2665−2674. doi: 10.1002/ptr.6696
[30] MA Q, MA Z, WANG W, et al. The effects of enzymatic modifica-tion on the functional ingredient: Dietary fiber extracted from po-tato residue[J]. LWT,2022,153:112511. doi: 10.1016/j.lwt.2021.112511
[31] 张祥梅, 王桂玲, 芦波, 等. 膳食纤维治疗老年慢性功能性便秘症状、疗效评分观察[J]. 新疆医科大学学报,2009,32(6):721−722. [ZHANG X M, WANG G L, LU B, et al. Dietary fiber function on the treatment of senile chronic constipation symptoms and the effects[J]. Journal of Xinjiang Medical University,2009,32(6):721−722. doi: 10.3969/j.issn.1009-5551.2009.06.019 [32] 张琪. 基于胃肠全段魔芋葡甘露聚糖改善便秘小鼠通便作用机理[D]. 重庆: 西南大学, 2021 ZHANG Q. Mechanism of improving the laxative effect on constipated mice in the whole gastrointestinal segment of konjac glucomannan[D]. Chongqing: Southwest University, 2021.
-
期刊类型引用(4)
1. 路静,白术群,郑学玲,杨佳,杨凯. 低温胁迫萌芽对青稞γ-氨基丁酸合成的调控作用研究. 食品研究与开发. 2024(11): 72-79 .  百度学术
百度学术
2. 路静,白术群,郑学玲. 萌芽谷物中γ-氨基丁酸代谢及应激积累机制的研究进展. 食品与发酵工业. 2024(17): 380-386 .  百度学术
百度学术
3. 迟燕平,苗新宇,王景会,苏颖,牛红红,孙慕白,李达,华梅,代永刚. 产γ-氨基丁酸贝莱斯芽孢杆菌CLYB1的鉴定及基因组改组选育研究. 食品工业科技. 2023(19): 167-173 .  本站查看
本站查看
4. 主港伟,韩世豪,许永杰,张晓顺,孟晓静,王斌,车霄. 植物乳杆菌(WSJ-06)缓解低剂量甲基汞诱导的斑马鱼焦虑样行为及机制. 现代消化及介入诊疗. 2022(10): 1245-1252 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:







 下载:
下载:



