The Alleviating Effect of Lactobacillus plantarum 1201 on DSS Induced Colitis
-
摘要: 结肠炎是一种具有复发特性的炎症性肠病,近几十年来发病率不断上升。越来越多的研究表明益生菌可缓解结肠炎。本研究通过建立葡聚糖硫酸钠(Dextran sulfate sodium, DSS)诱导的结肠炎小鼠模型,探究植物乳杆菌1201(Lactobacillus plantarum 1201)对DSS诱导结肠炎的缓解作用。将实验小鼠分为正常组、模型组、1201组,对除正常组外其余组小鼠诱导结肠炎,同时对1201组小鼠每日灌胃0.2 mL的1×109 CFU/mL 植物乳杆菌1201,持续12 d。通过H&E染色观察小鼠结肠形态,采用荧光定量PCR技术检测小鼠结肠组织NF-κB、炎症因子(TNF-α、IL-6、IL-22、IFN-γ、IL-17A、TGF-β1)和结肠紧密连接蛋白(ZO-1、Ocludin和Claudin-3)的mRNA表达水平;此外,使用16S rRNA高测序技术检测小鼠肠道菌群的变化,采用代谢组学分析肠道代谢物的变化。结果表明,植物乳杆菌1201通过降低肠道Firmicutes/Bacteroidetes的比率,增加乳酸杆菌Bifidobacterium、Lactobacilluse和Akkermansia的相对丰度,减少Escherichia的相对丰度,改善了肠道菌群的平衡。同时,植物乳杆菌1201可以抑制NF-κB和炎症因子(TNF-α、IL-6、IL-22、IFN-γ)mRNA水平的上调,增加结肠紧密连接蛋白(ZO-1、Ocludin和Claudin-3)的mRNA表达水平,并增加有益代谢物的血清水平,包括α-生育酚(α-Tocopherol)和L-岩藻糖(L-Fucose)。本研究结果表明植物乳杆菌1201具有缓解结肠炎的潜在能力。Abstract: Colitis is an inflammatory bowel disease with relapsing properties and the incidence has been increased in recent decades. More and more studies show that probiotics can be used to alleviate colitis. In this study, a mouse model of colitis induced by dextran sulfate sodium (DSS) was constructed to explore the alleviating effect of Lactobacillus plantarum 1201 on DSS-induced colitis. The experimental mice were divided into normal group, model group and 1201 group. Colitis was induced in the other groups except the normal group. At the same time, mice in the 1201 group were given 0.2 mL of 1×109 CFU/mL L. plantarum 1201 by gavage daily for 12 days. Then, the colon morphology of mice was observed by H&E staining, the fecal albumin content of mice was detected, and the mRNA level of NF-κB, inflammatory factors (TNF-α, IL-6, IL-22, IFN-γ, IL-17A, TGF-β1) and tight junction proteins (ZO-1, Ocludin and Claudin-3) in colon were detected by fluorescence quantitative PCR technology. In addition, 16S rRNA high sequencing technology was used to detect the changes of intestinal flora in mice, and metabolomics was used to analyze the changes of intestinal metabolites. The results showed that L. plantarum 1201 increased the relative abundance of Bifidobacterium, Lactobacillus and Akkermansia, reduced the relative abundance of Escherichia, and reduced the ratio of Firmicutes/Bacteroidetes, to improve the balance of intestinal flora. Meanwhile, L. plantarum 1201 also inhibited NF-κB and the inflammatory factors (TNF-α, IL-6, IL-22, IFN-γ). In addition, it increased the mRNA expression of colon tight junction proteins (ZO-1, Ocludin and Claudin-3) and the serum level of beneficial metabolites, including α-Tocopherol and L-Fucose. In conclusion, the results show that L. plantarum 1201 has the potential to alleviate colitis.
-
炎症性肠病(Inflammatory bowel disease,IBD),包括溃疡性结肠炎(Ulcerative colitis,UC)和克罗恩病(Crohn's disease),是一种以肠道内的慢性炎症和组织破坏为特征的疾病[1],近50年发病率持续增加[2]。虽然目前确切的发病机制尚不清楚,但最近的研究表明,IBD可能与遗传成分、环境因素、肠道微生物菌群和免疫反应有关[3]。此外,Chu等[4]研究表明,缺乏肠道微生物保护信号会促进IBD易感基因的表达,从而增加炎症反应。结肠炎可以用多种药物治疗,包括5-氨基水杨酸药物、类固醇和免疫抑制剂。然而,药物治疗具有治疗周期长、有不良反应以及成本高等缺点[5]。因此,找到一种健康有效的方法来治疗结肠炎是医务工作者和患者共同关注的焦点问题。
平衡的肠道微生物群和保护性抗炎反应在改善患者溃疡性结肠炎方面起着关键作用。由于益生菌可改善肠道菌群失调,增强肠粘膜屏障完整性,减少病原体定植,减轻炎症反应,增加短链脂肪酸和维生素等的产生,因此益生菌补充可能是治疗结肠炎的有效措施[6-7]。其中植物乳杆菌作为益生菌,已被广泛用于促进肠道健康。Wang等[8]研究发现植物乳杆菌ZS2058补充可维持结肠粘膜完整,并显著降低促炎细胞因子(TNF-α、IL-1β、IL-6)的表达,同时上调结肠抗炎细胞因子IL-10和核受体PPARγ的表达,进而改善DSS诱导的小鼠急性结肠炎。Ding等[9]研究结果显示,植物乳杆菌GIM17增加了有益放线菌的相对丰度,并提高了有益血清代谢物的水平,进而改善结肠炎症。Khan等[10]研究发现植物乳杆菌菌株(C2、C3、P8)可以通过增加与短链脂肪酸(SCFAs)产生相关有益菌的丰度,降低促炎细胞因子(IL-17A、IL-6、IL-22和TNF-α)的水平,并增加抗炎细胞因子(TGF-β、IL-10)的水平,来改善小鼠的DSS结肠炎。此外,Ma等[11]研究发现戊糖乳杆菌可以增加肠道中阿克曼菌的丰度,保护肠道结构的完整性,增加吲哚丙酮酸和泛酸水平的产生,从而减轻DSS诱导的溃疡性结肠炎症。
植物乳杆菌1201(Lactobacillus plantarum 1201)是从抚州菜梗中分离获得的。前期研究表明,植物乳杆菌1201可以改善小鼠肠道菌群,降低肠道通透性,减轻肠道炎症[12],但未对其具体机理进行分析。16S rRNA基因测序和GC-MS 非靶向代谢组学双平台的运用,可以比较完整地阐释植物乳杆菌1201治疗结肠炎的潜在机制,可以为治疗结肠炎提供新的思路。因此,本研究联合使用16S rRNA测序和代谢组学技术分析结肠炎小鼠的肠道菌群和代谢物之间的变化,来探究植物乳杆菌1201对葡聚糖硫酸钠(Dextran Sulfate Sodium,DSS)诱导的结肠炎的缓解作用及具体机制,为今后将植物乳杆菌应用于缓解结肠炎提供基础数据,为利用益生菌缓解结肠炎提供候选菌株。
1. 材料与方法
1.1 材料与仪器
植物乳杆菌1201(Lactobacillus plantarum 1201) 保藏于中国典型培养物保藏中心,保藏号CCTCC编号:M2021050;动物饲料 购自南通特洛菲饲料科技有限公司;MRS培养基(称取MRS粉末48.0 g,加蒸馏水定容至1000 mL,调节pH至6.5左右,固体培养基需加入琼脂粉末15.0 g,121 ℃高压灭菌20 min) 购自美国索莱宝;无菌1×PBS缓冲液(磷酸二氢钾(KH2PO4)0.27 g,磷酸氢二钠(Na2HPO4)1.42 g,氯化钠(NaCl)8.0 g,氯化钠(KCl)0.2 g,加蒸馏水溶解,定容至1 L,pH7.4,121 ℃高压蒸汽灭菌20 min备用),2.5% DSS、分析纯、分子量50万(称取2.5 g DSS溶于100 mL无菌水,本溶液置于4 ℃可稳定保存1周,现配现用最佳) 购自南京都莱生物技术有限公司;10%福尔马林组织固定液 购自武汉赛维尔生物科技有限公司;酶免ELISA试剂盒 购自上海研生实业有限公司;cDNA反转录试剂盒 购自北京宝日医生物技术有限公司;4周龄的雄性C57BL/6小鼠18只,体重17±2 g,SPF级 北京维通利华实验动物技术有限公司提供,饲养于南昌乐悠生物科技有限公司动物实验室,实验动物使用许可证:SYXK(赣)2017-0002,实验动物伦理审查批准文号:RYE202060101。
Anaerobox IV型厌氧培养箱 美国Gene Science公司;Legend Micro 17R型台式离心机、702型超低温冰箱 美国赛默飞世尔科技公司;K960型PCR仪 上海力新仪器有限公司;GI54TR型立式压力蒸汽灭菌锅 上海博迅仪器有限公司。
1.2 实验方法
1.2.1 菌株培养
菌株活化:将-80 ℃冻存的植物乳杆菌1201用接种环挑取,于MRS固体平板上划线活化。再将单菌落接入MRS液体培养基中,在37 ℃厌氧条件下培养24 h,传代培养两次;制备菌悬液:植物乳杆菌1201按1%接种于无菌MRS液态培养基中,37 ℃厌氧培养24 h后,4000×g,4 ℃离心10 min去除上清液,收集菌体沉淀。用无菌1×PBS缓冲液洗涤菌体沉淀3次,重悬于1×PBS缓冲液中,混匀,制得菌悬液;计算菌数:采用稀释涂布平板法计算此时的菌液浓度(CFU/mL);稀释:将确定浓度的菌液进行稀释或浓缩制得浓度1×109 CFU/mL的植物乳杆菌1201菌悬液。
1.2.2 动物实验与分组
18只4周龄的无特定病原体(SPF)C57BL/6J小鼠饲养在南昌乐悠生物科技有限公司动物实验室,室温23~25 ℃,相对湿度50%~60%,光/暗循环12 h。给予自由饮水和自由饮食适应一周后,将小鼠随机分成3组,每组6只,分别是正常组、模型组、植物乳杆菌1201干预组。正常组(ND组)每天灌胃0.2 mL无菌1×PBS,模型组(MD组)给予0.2 mL 2.5% DSS 5 d[13],植物乳杆菌1201干预组(1201组)给予2.5% DSS 5 d并每天灌胃0.2 mL 1×109 CFU/mL植物乳杆菌1201[14-15],期间各组小鼠均给予普通饲料和自由饮水。小鼠每天称重一次,且每天使用溃疡性结肠炎疾病活动指数(Disease Activity Index,DAI)检测小鼠体重和疾病严重程度,并记录数据,DAI评分细则如表1所示。在植物乳杆菌1201灌胃小鼠12 d后,眼球取血,收集血清,放置于−80 ℃冷冻保存。处死小鼠并取小肠、结肠、盲肠内容物等于无菌离心管中,液氮快速冷冻后转移到−80 ℃冰箱保存。
1.2.3 H&E染色组织形态学检测
收集结肠组织,浸泡入10%福尔马林组织固定液,送至塞维尔生物技术有限公司进行H&E染色用于检测结肠组织炎症情况。
1.2.4 小鼠肠道通透性测定
样品制备:取小鼠粪便,加入试剂盒中样品稀释液振荡混匀,制成浓度为10 ng/µL的粪液,4 ℃,12000 r/min离心5 min,取上清,使用样品稀释液将样品稀释1000倍备用。按照ELISA试剂盒操作指南操作检测小鼠粪菌白蛋白浓度变化。
1.2.5 小鼠结肠相关基因表达水平测定
使用Trizol法从结肠和肝脏中提取总RNA[17],再使用cDNA反转录试剂盒进行cDNA合成。三步法Real-time PCR反应程序:5 µL SYBR Green,0.8 µL引物(10 μmol/L),1 µL cDNA(1000 ng/μL)加ddH2O补充10 µL系统。反应条件为:95 ℃预热30 s,循环阶段:95 ℃变性5 s;59 ℃,1 min;72 ℃延长30 s,40个循环,熔化曲线:65 ℃,5 s,95 ℃,5 s。采用2(−ΔΔCt)法,以β-actin为内参对照,检测结肠和肝组织中炎症相关基因以及肝脏中脂肪合成相关基因的mRNA水平。引物序列如表2所示。
表 2 引物序列Table 2. Primer sequence基因名称 序列 β-actin[18] Forward GCTCCTCCTGAGCGCAAGTA Reverse CAGCTCAGTAACAGTCCGCC NF-κB[19] Forward ACGATCTGTTTCCCCTCATC Reverse TGCTTCTCTCCCCAGGAATA IL-6[20] Forward CTGCAAGAGACTTCCATCCAG Reverse AGTGGTATAGACAGGTCTGTTGG TGF-β1[18] Forward GTCACTGGAGTTGTACGGCA Reverse TCATGTCATGGATGGTGCCC IFN-γ[18] Forward TGATTGCGGGGTTGTATCTG Reverse CTGTCTGGCCTGCTGTTAAA TNF-α[21] Forward CCCTCACACTCAGATCATCTTCT Reverse GCTACGACGTGGGCTACAG IL-17A[22] Forward CTCCAGAAGGCCCTCAGACTA Reverse AGCTTTCCCTCCGCATTGACA IL-22[23] Forward AGCGGTGACGACCAGAACATC Reverse TCCAGTTCCCCAATCGCCT ZO-1[24] Forward GATCCCTGTAAGTCACCCAGA Reverse CTCCCTGCTTGCACTCCTATC Occludin[18] Forward GGACTGTCAACTCTTTCCGC Reverse CATTTATGATGAACAGCCCC Claudin-3[18] Forward CTGTCTGTCCTCTTCCAGCC Reverse CCACTACCAGCAGTCGATGA 1.2.6 小鼠肠道菌群分析
收集小鼠盲肠内容物,冻存于−80 ℃,送至上海中科新生命有限公司提取DNA并测序。测序使用高保真DNA聚合酶的特异性引物为16S rRNA基因V4区通用引物:515F:5'-GTGCCAGCMGCCGCGGTAA-3',806R:5'-GGACTACHVGGGTWTCTAAT-3'。16S rRNA基因扩增子测序技术是采用Illumina HiSeq测序平台得到的原始数据(Raw data),对原始数据进行一系列处理后得到用于后续分析的有效数据(Effective data)。为了研究物种组成多样性,对所有样品的有效数据进行聚类分析,以97%的一致性将序列聚类成为OTUs,再进行物种注释。α多样性分析使用Qiime软件计算Shannon指数、Simpson指数,R软件绘制稀释曲线。β多样性分析是利用OTU间的系统发生关系,计算Unifrac距离,进行主坐标分析(Principal co-ordinates analysis,PCoA)、UPGMA聚类分析及组间差异分析,从中发现不同样品(组)间的差异。
1.2.7 小鼠血清非靶向代谢组学分析
将收集到的小鼠血清送至上海中科新生命有限公司,进行血清非靶向代谢组学分析,每个实验组8个样品。非靶向代谢组学是基于LC-MS色谱-质谱联用技术,尽可能对生物样本中的代谢物进行定性和定量分析,利用多维统计分析OPLS-DA的VIP值和单变量统计分析的P值找出各组间丰度变化差异显著的代谢物。实验采用UHPLC-Q-TOF MS技术对样本进行全谱分析,获得谱数据后采用XCMS对数据进行代谢物的鉴定[25]。提取样本中的代谢物进行上机测试。获得原始数据之后,进一步对数据进行整理和定量分析,筛选组间显著性差异的代谢物(VIP>1以及t-test P<0.05),然后对筛选到的显著性差异物进行定性分析。
1.2.8 16S rDNA-代谢多组学联合分析
基于16S rDNA扩增子测序数据与代谢组学数据进行多组学联合性分析。利用Spearman统计方法分析实验样本中筛选到的显著性差异菌群与显著性差异代谢物之间的相关性系数,并结合R语言和Cytoscape软件进行矩阵热图、层次聚类、相关性网络等分析,多角度挖掘菌群-代谢物之间的相互作用关系。
1.3 数据处理
每个实验样品设置三个重复,数据均以平均值±标准偏差(mean±SD)方式表示。采用GraphPad Prism version 9.0和Hem I制作软件进行数据分析和作图,采用SPSS 19.0软件进行统计分析,并通过独立的单因素方差分析法(AVOVA)分析组间显著性差异。
2. 结果与分析
2.1 植物乳杆菌1201对DSS诱导的结肠炎小鼠炎症症状的缓解和肠道屏障破坏的修护
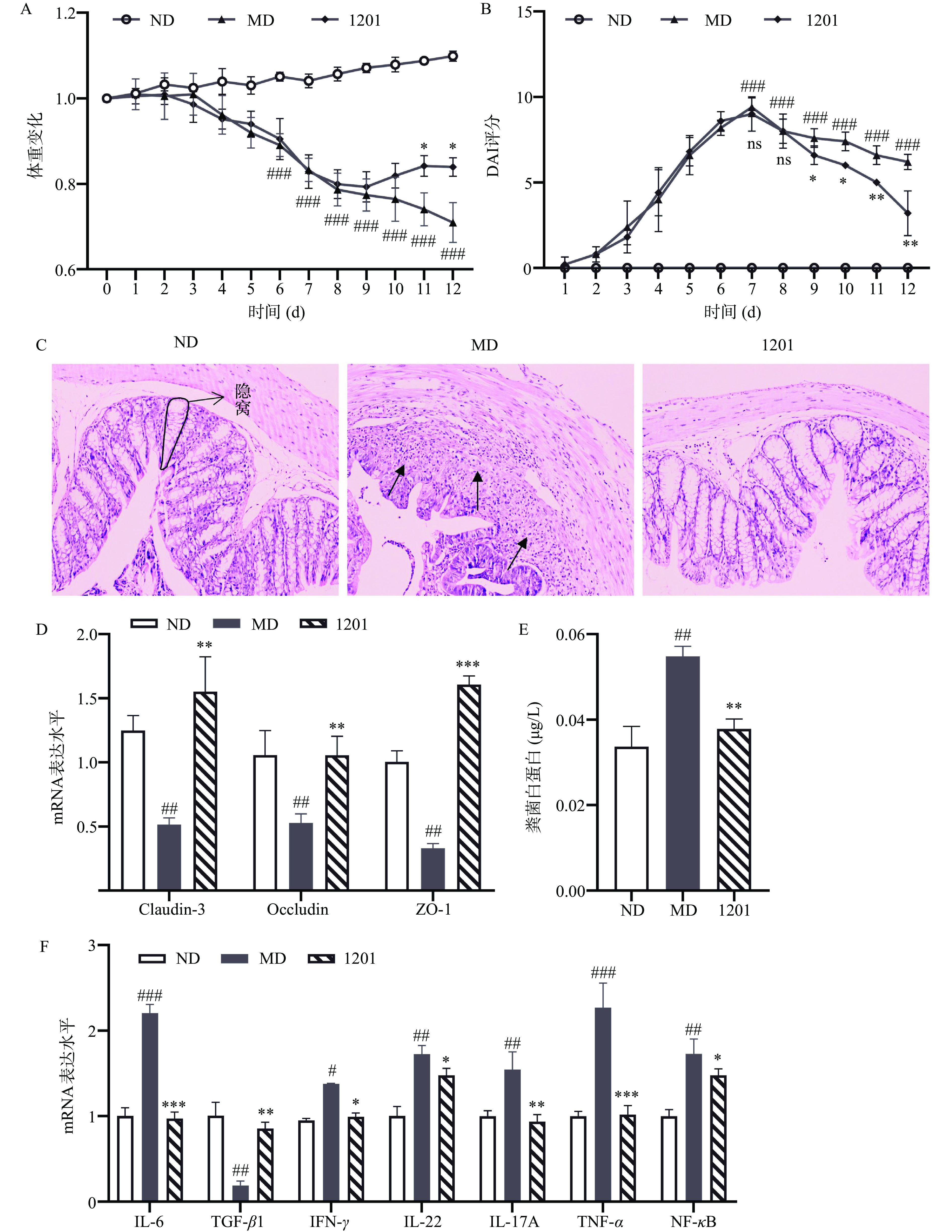
与ND组相比,MD组小鼠DSS处理5 d后体重高度显著下降(P<0.001),而1201组小鼠(补充植物乳杆菌1201)处理10 d后体重降低趋势有所缓解(P<0.05)(图1A)。DSS处理后,MD小鼠的结肠炎评分高度显著增加(P<0.001),而与MD组比较,1201组处理8 d后结肠炎评分显著降低(P<0.05)(图1B)。通过结肠组织H&E染色可知,与ND组相比,MD组小鼠的结肠粘膜和隐窝明显受损,出现大量炎性细胞浸润,然而,补充植物乳杆菌1201后,小鼠结肠粘膜缺损减轻,炎性细胞减少(图1C)。
![]() 图 1 植物乳杆菌1201对DSS诱导的结肠炎小鼠炎症症状的缓解和肠道屏障破坏的修护注:(A)小鼠体重变化;(B)小鼠结肠炎评分;(C)小鼠结肠HE染色(200×);(D)紧密连接蛋白相关基因mRNA表达水平;(E)粪便白蛋白含量;(F)炎症相关基因mRNA表达水平;注:n≥4;与MD组比较,*P<0.05、**P<0.01、***P<0.001;与ND组比较,# P<0.05;##P<0.01;### P<0.001。图2、图5同。Figure 1. Relief of inflammatory symptoms and repair of intestinal barrier damage in mice with DSS-induced colitis by Lactobacillus plantarum 1201
图 1 植物乳杆菌1201对DSS诱导的结肠炎小鼠炎症症状的缓解和肠道屏障破坏的修护注:(A)小鼠体重变化;(B)小鼠结肠炎评分;(C)小鼠结肠HE染色(200×);(D)紧密连接蛋白相关基因mRNA表达水平;(E)粪便白蛋白含量;(F)炎症相关基因mRNA表达水平;注:n≥4;与MD组比较,*P<0.05、**P<0.01、***P<0.001;与ND组比较,# P<0.05;##P<0.01;### P<0.001。图2、图5同。Figure 1. Relief of inflammatory symptoms and repair of intestinal barrier damage in mice with DSS-induced colitis by Lactobacillus plantarum 1201肠道屏障对小鼠健康至关重要,其可以防止毒素和其他有害物质从肠道进入[26]。为了检测小鼠的肠道屏障功能,本文测量了粪便白蛋白浓度和肠道紧密连接蛋白ZO-1、Occludin和Claudin-3的mRNA表达水平。与ND组相比,在MD组中,紧密连接蛋白的mRNA表达水平显著降低(P<0.01);但与MD组相比1201组中紧密连接蛋白的mRNA表达水平显著增加(P<0.01)(图1D)。与ND组相比MD组的粪便白蛋白浓度显著升高(P<0.01);但与MD组相比1201组的粪便白蛋白浓度显著降低(P<0.01)(图1E)。由此可见,DSS处理可诱导小鼠肠道通透性增加[27],而植物乳杆菌1201干预可降低肠道通透性。
为了探究植物乳杆菌对肠道炎症的影响,本文检测了结肠炎性细胞因子和NF-κB信号通路的mRNA表达水平。如图1F所示,MD组小鼠促炎细胞因子IL-6、IL-22、IL-17A和IFN-γ的mRNA表达水平显著高于ND组(P<0.05),转化生长因子(TGF-β1)的mRNA水平显著降低(P<0.01)。然而,植物乳杆菌1201干预后,降低了促炎因子的mRNA表达水平,增加了TGF-β1的表达水平。此外,与ND组相比,MD组中TNF-α和NF-κB的mRNA表达极显著增加(P<0.01),而与MD组相比,1201组中TNF-α和NF-κB的mRNA表达显著降低(P<0.05)。综上可知,植物乳杆菌1201抑制了NF-κB途径的激活,减轻了DSS诱导的结肠炎症。
2.2 植物乳杆菌1201对DSS诱导的结肠炎小鼠肠道菌群的影响
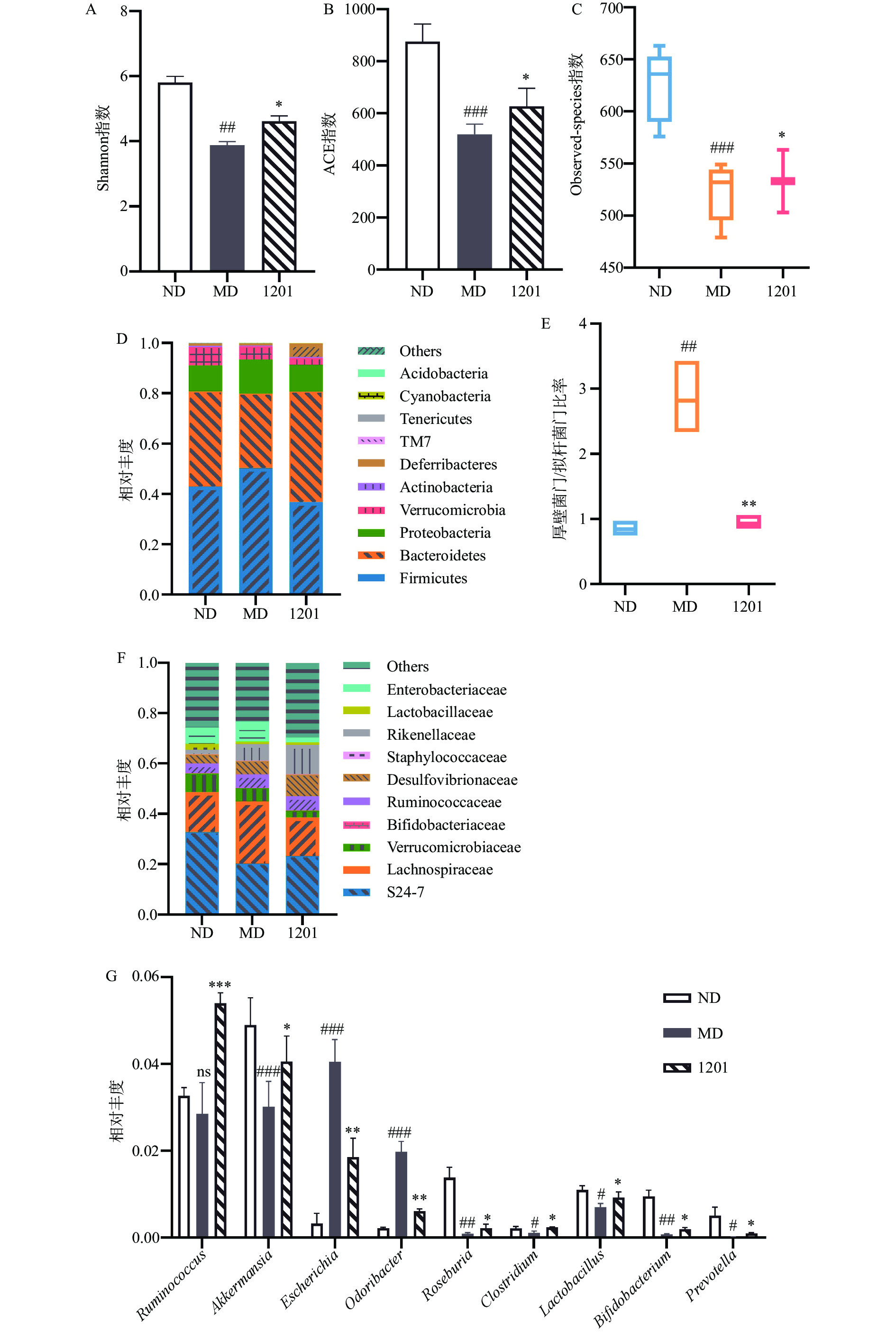
ACE指数、Shannon指数和Observed-species指数反映了肠道微生物种群的α多样性。研究结果显示,与ND组相比,MD组的ACE指数、Shannon指数和Observed-species指数极显著降低(P<0.01),而植物乳杆菌1201干预后显著增加了ACE指数、Shannon指数和Observed-species指数(P<0.05),即增加了肠道菌群的α多样性(图2A、B)。结肠中的主要细菌门是Bacteroidetes、Firmicutes、Verrucomicrobia和Proteobacteria,占结肠总细菌的96%以上。从图2E中可知,与ND相比,MD组小鼠的厚壁菌门/拟杆菌门比率(Firmicutes/Bacteroidetes,F/B)极显著增加(P<0.01),而1201组小鼠的F/B比率极显著降低(P<0.01)。在科水平上,与ND组相比,MD组中Enterobacteriaceae、Rikenellaceae、Lachnospiraceae的相对丰度增加,S24-7的相对丰度减少,而经过植物乳杆菌1201干预后,Enterobacteriaceae、Verrucomicrobiaceae、Lachnospiraceae的相对丰度减少,而S24-7的相对丰度增加(图2F)。在属水平上,与ND组相比,MD组中Roseburia、Akkermansia、Lactobacillus、Bifidobacterium、Prevotella和Clostridium的相对丰度显著或极显著降低(P<0.05或P<0.01),而Escherichia和Odoribacter的相对丰度高度极显著增加(P<0.001)。然而,经过植物乳杆菌1201干预后,Ruminococcus、Akkermansia、Roseburia、Lactobacillus、Bifidobacterium、Prevotella和Clostridium的相对丰度增加,而Escherichia和Odoribacter的相对丰度减少(图2G)。
2.3 植物乳杆菌1201对DSS诱导的结肠炎小鼠血清代谢物的影响
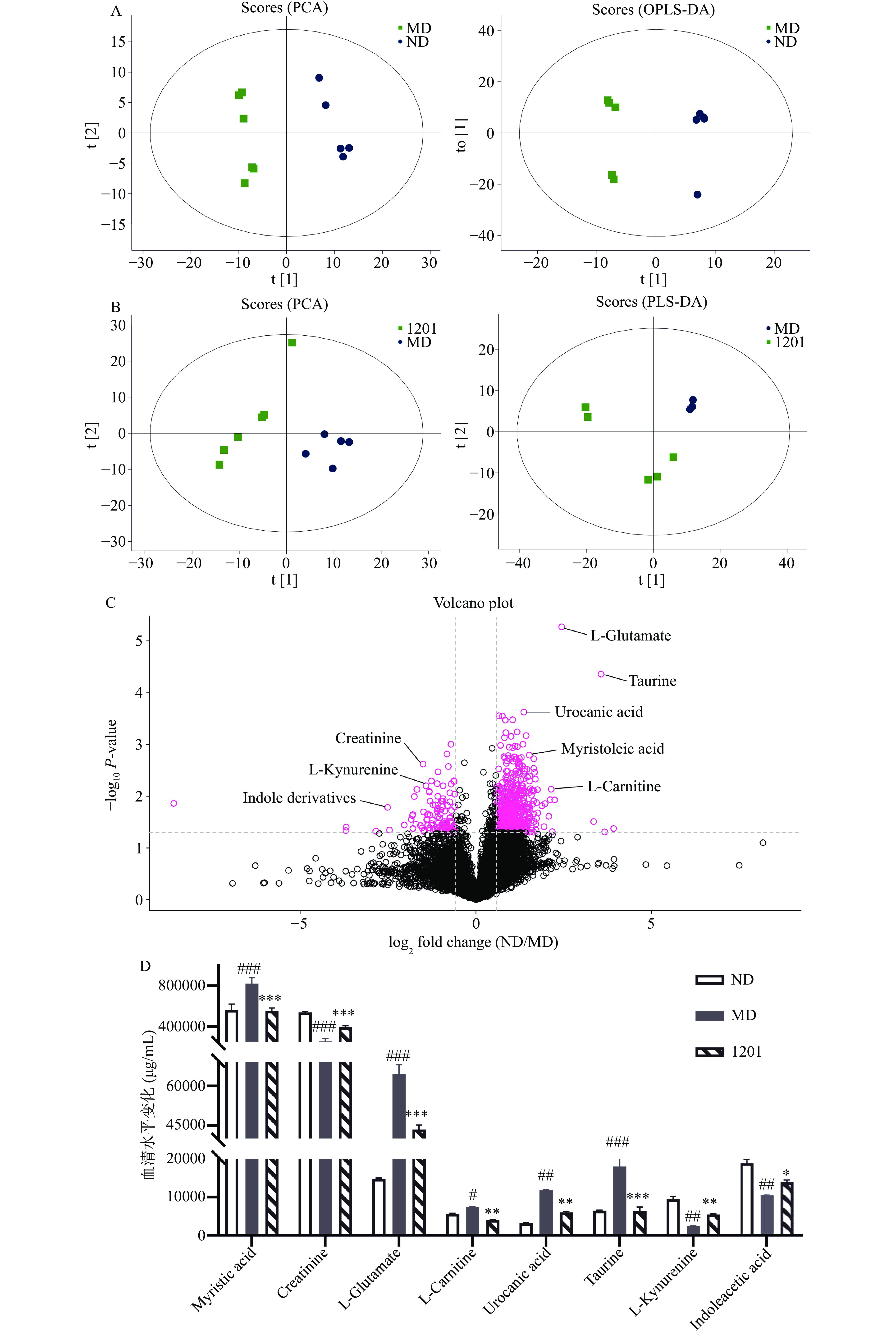
UHPLC-Q-TOF MS分析可用于检测血清代谢物,主成分分析(Principal component analysis,PCA)可用于鉴定具有高相似性的样品的异常值,偏最小二乘判别分析(Partial least squares discrimination analysis,PLS-DA)可对每个组分进行分类,以便于识别组间的相似性和差异性。PCA和PLS-DA分析的结果(图3A、B)显示,各组内的差异较小,但组间的差异较大,表明实验建模是稳定可靠的。这些结果表明,DSS诱导改变了小鼠血清代谢物的组成,而植物乳杆菌1201干预缓解了这些变化,最终血清代谢物含量接近ND组。火山图(Volcano plot)利用单变量分析可以直观地显示两样本间代谢物变化的显著性,从而筛选出潜在的生物标志物。由火山图可知,DSS诱导的IBD小鼠血清中显著上调(P<0.05)的代谢产物为牛磺酸(Taurine)、肉豆蔻酸(Myristoleic acid)、L-肉碱(L-Carnitine)、尿苷酸(Urocanic acid)和L-谷氨酸(L-Glutamate);显著下调(P<0.05)的代谢物主要包括肌酐(Creatinine)、L-犬尿氨酸(L-Kynurenine)和吲哚乙酸(Indoleacetic acid),这些代谢物的变化可能有助于IBD疾病的发展,并可能成为IBD诊断的血清生物标记物。由图3D可知,与ND组相比,MD组的血清代谢物肌酐和L-犬尿氨酸的浓度显著降低(P<0.01),L-肉碱和尿苷酸的浓度显著增加(P<0.05)。然而,与MD组相比,1201组的血清代谢产物肌酐和L-犬尿氨酸等的浓度极显著增加(P<0.01),而L-肉碱和尿苷酸等的浓度显著减少(P<0.01)。
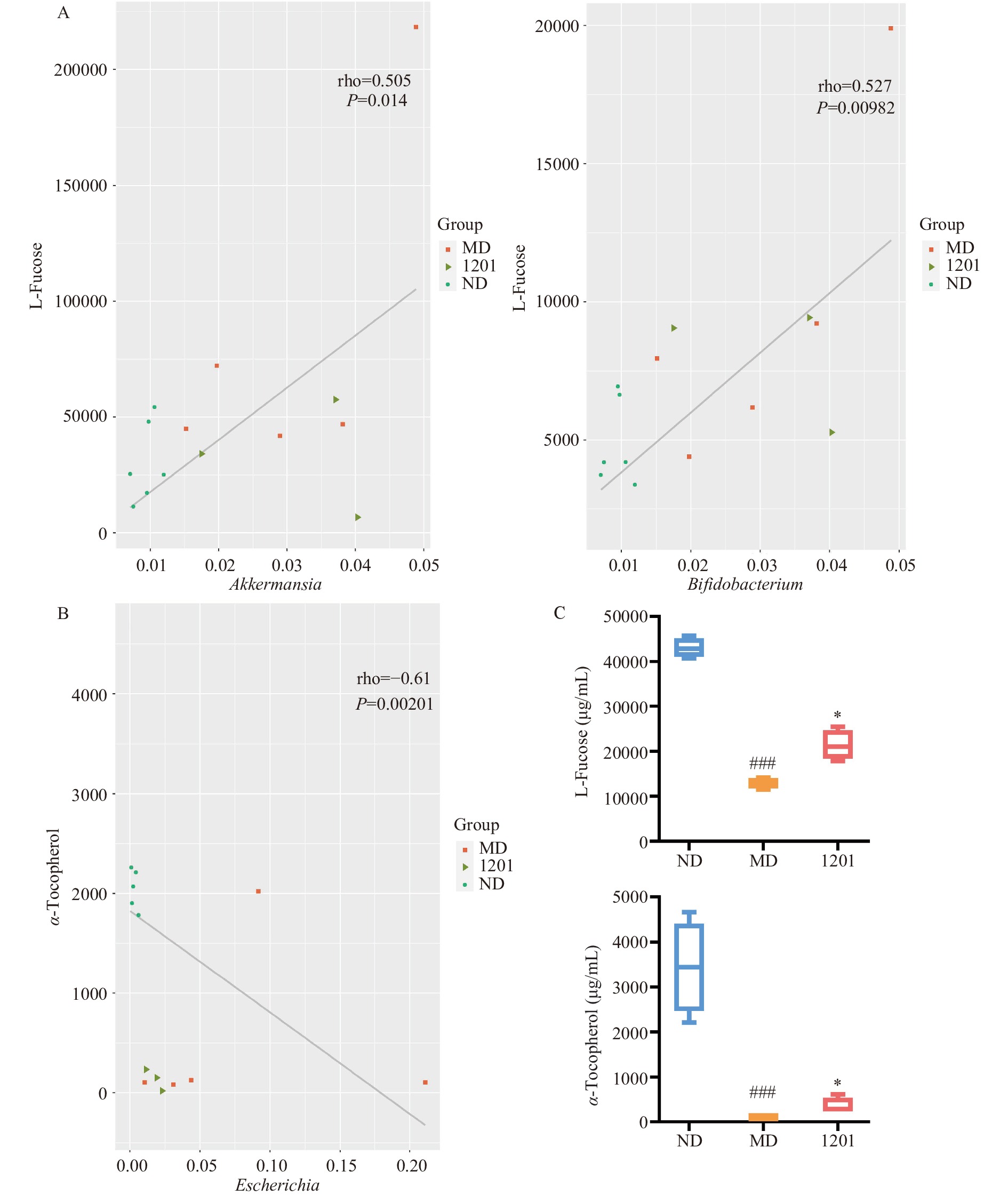
2.4 结肠炎小鼠血清代谢物和肠道菌群的相关性分析
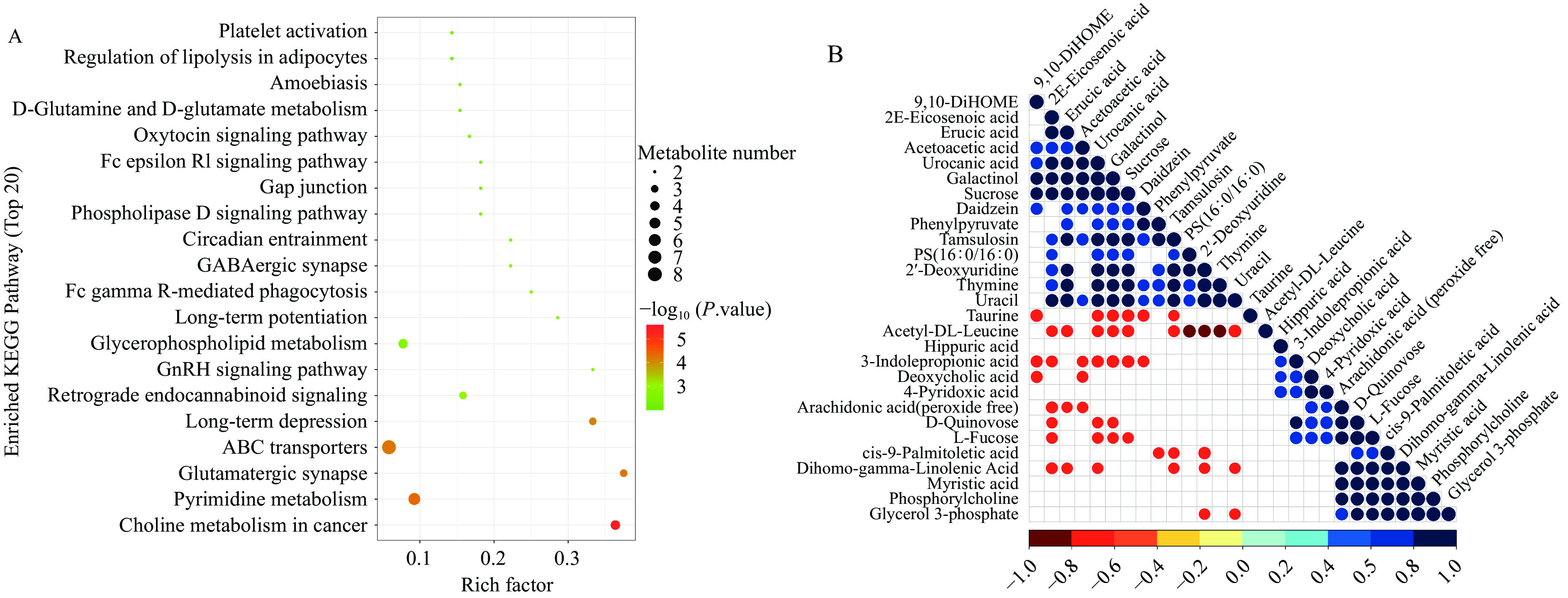
为了进一步探索植物乳杆菌1201如何调节血清代谢组学,本文对血清代谢物和肠道菌群进行了组学联合分析。首先,分析了KEGG(Kyoto Encyclopedia of Genes and Genomes)的代谢途径。KEGG途径富集分析表明,MD组和1201组的差异代谢物主要与甘油磷脂代谢(Glycerophospholipid metabolism)、反向内源性大麻素信号(Retrograde endocannabinoid signaling)、ABC转运体(ABC transporters)、谷氨酸能突触(Glutamatergic synapse)、嘧啶代谢(Pyrimidine metabolism)和癌症中的胆碱代谢(Choline metabolism in cancer)等代谢途径相关(图4A)。从显著性差异代谢物相关性分析结果中可知,L-岩藻糖(L-Fucose)与3-吲哚丙酸、4-吡哆酸、花生四烯酸和肉豆蔻酸等代谢物呈正相关,与2(E)-二十碳烯酸、尿苷酸、半乳醇和蔗糖等代谢物呈负相关(图4B)。进一步联合肠道菌群分析,L-岩藻糖与Bifidobacterium和Akkermansia显著正相关,α-Tocopherol与Escherichia显著负相关(图5A、B)。此外,DSS诱导的结肠炎小鼠的L-岩藻糖和α-Tocopherol浓度显著降低(P <0.001),而1201组小鼠的L-岩藻糖和α-Tocopherol浓度显著上调(P<0.05)(图5C)。值得注意的是,对肠道菌群的分析表明植物乳杆菌1201干预增加了肠道Bifidobacterium和Akkermansia的相对丰度,降低了Escherichia的相对丰度。因此,肠道中Escherichia的相对丰度降低可能伴随着代谢产物(如α-Tocopherol)的消耗减少,同时,肠道中Bifidobacterium和Akkermansia的相对丰度增加可能伴随着有益代谢产物(如L-岩藻糖)的增加。基于以上结果,推测植物乳杆菌1201可能通过调节肠道菌群来调节L-岩藻糖的产生和α-Tocopherol的消耗,以达到缓解结肠炎的目的。
3. 讨论
炎症性肠病(Inflammatory bowel disease,IBD)是一种慢性全身性炎症性疾病,与全球发病率增加有关。益生菌可调节肠道菌群平衡,减轻肠道炎症,因此,益生菌补充已成为治疗结肠炎的研究热点。其中植物乳杆菌作为益生菌,已被广泛使用,以促进肠道健康。一些与结肠炎高度相关的微生物,包括肠球菌、类杆菌、玫瑰杆菌、直肠真杆菌、大肠杆菌/志贺氏菌、梭杆菌和白色念珠菌,其变化在IBD的发病和进展中发挥了重要作用[28]。有多个研究结果表明植物乳杆菌可以通过增加有益肠道菌群(如Akkermansia、Lactobacillus和Bifidobacterium),减少有害肠道菌群(如Escherichia),进而改善结肠炎[8, 11]。本研究首先探究了植物乳杆菌1201对DSS诱导的结肠炎小鼠的肠道菌群的影响。多数研究结果表明,IBD与宿主结肠中拟杆菌丰度的显著降低有关[29-30]。Chu等[4]研究发现拟杆菌作为肠道共生体中唯一确定的鞘脂生产者,可以通过外膜囊泡将免疫活性代谢物运输到免疫细胞。Lactobacillus、Akkermansia和Bifidobacterium相对丰度的减少与IBD密切相关[31-32];Lactobacillus和Bifidobacterium作为益生菌有助于维持肠道菌群的平衡,改善宿主的健康[33];且Akkermansia与肠上皮细胞的相互作用可以促进IL-8的表达,减轻肠道炎症反应[34]。此外,Prevotella可以产生短链脂肪酸,可改善肠道屏障完整性,缓解局部和全身炎症[35]。相反,Escherichia的相对丰度的增加会破坏肠上皮紧密连接,导致血液LPS水平升高,增加炎症因子的产生,进而加重结肠炎[36]。在本文的研究结果中,与MD组相比,植物乳杆菌1201显著增加肠道菌群的多样性和拟杆菌门的相对丰度以及有益肠道细菌的相对丰度,如Bifidobacterium、Prevotella、Akkermansia和Lactobacillus,并减少了有害菌群的相对丰度如Escherichia,从而缓解了DSS诱导的结肠炎小鼠的肠道菌群紊乱。
肠道微生物群落的变化会破坏结肠的稳态,导致肠道上皮免疫功能丧失,肠道通透性增加[37]。菌群中的病原菌(如Escherichia)可通过Th1和Th17效应细胞激活炎症应答,而加剧炎症反应,并导致肠黏膜的损伤[38]。TNF-α可以激活I-κB激酶(IκK)复合物,释放NF-κB转移到细胞核,从而增加促炎因子的mRNA表达,已被证明在IBD的发病机制中发挥着重要作用[39-40]。而植物乳杆菌TIFN101可调节紧密连接蛋白和粘附蛋白的转录途径,包括α-肌动蛋白和金属蛋白酶-2,从而改善肠道屏障功能[41]。此外,植物乳杆菌菌株WCFS1激活Toll样受体2(TLR2)信号传导以促进闭塞素的表达并保护肠道上皮细胞屏障[42]。本研究发现DSS处理后激活了小鼠肠道中的NF-κB,并增加了炎症因子的产生,最终导致机体的炎症反应以及肠道屏障的破坏,而植物乳杆菌1201干预后抑制了NF-κB,减少了炎症因子,进而减轻肠道炎症反应并且降低肠道通透性。
肠道屏障的破坏导致肠道中的衍生代谢物可以进入血液,且越来越多的证据表明,进入血液中的肠道菌群代谢物对宿主的生理和行为,如免疫、内分泌、神经元和代谢成分,都产生了重要影响[43-44]。本研究中,与MD组相比,经植物乳杆菌1201干预后小鼠血清中L-岩藻糖和α-Tocopherol的含量显著增加。L-岩藻糖可以通过抑制巨噬细胞M1极化、抑制NLRP3炎症小体和NF-κB激活以及下调促炎细胞因子来减轻结肠炎[45]。此外,共生细菌如长双歧杆菌、鼠李糖乳杆菌和阿克曼氏菌等能够利用岩藻糖作为碳源,因此,岩藻糖可以通过改变其结构或为其提供额外的能量来源来促进这些微生物的生长[46-49]。维生素E,包括α、γ和δ-生育酚(α-T、γ-T和δ-T),具有抗氧化和抗炎作用[50-51],并且可以保护肠道健康[52]。最近的一项研究指出,α-Tocopherol可以保护肠道屏障功能,缓解结肠炎症状,并引起肠道微生物群的有益变化[53]。因此,推测1201组中L-岩藻糖的增加可能促进了Bifidobacterium和Akkermansia的生长,α-Tocopherol的增加则可能抑制了Escherichia的生长,从而进一步维持了肠道菌群的平衡,减轻肠道炎症。
4. 结论
本研究通过建立DSS诱导的结肠炎小鼠模型,探究了植物乳杆菌对小鼠结肠炎的缓解作用及其可能机制。实验结果显示,植物乳杆菌1201通过提高有益细菌的相对丰度,如Akkermansia、Lactobacillus和Bifidobacterium等,抑制具有较高促炎活性的有害菌群如Escherichia等,改善了肠道菌群平衡,从而提高了血清中有益代谢物(α-Tocopherol和L-Fucose)水平进一步维持了肠道菌群的平衡、抑制炎症反应而保护肠道屏障来缓解DSS诱导的结肠炎。本研究为临床上应用益生菌缓解结肠炎提供了理论数据,为开发新型微生物制药提供了候选菌株。
-
图 1 植物乳杆菌1201对DSS诱导的结肠炎小鼠炎症症状的缓解和肠道屏障破坏的修护
注:(A)小鼠体重变化;(B)小鼠结肠炎评分;(C)小鼠结肠HE染色(200×);(D)紧密连接蛋白相关基因mRNA表达水平;(E)粪便白蛋白含量;(F)炎症相关基因mRNA表达水平;注:n≥4;与MD组比较,*P<0.05、**P<0.01、***P<0.001;与ND组比较,# P<0.05;##P<0.01;### P<0.001。图2、图5同。
Figure 1. Relief of inflammatory symptoms and repair of intestinal barrier damage in mice with DSS-induced colitis by Lactobacillus plantarum 1201
评分 体重下降百分比 粪便粘稠度 粪便潜血 0 0% 正常 正常 1 1%~5% 软便 − 2 6%~10% 粘液样便 隐血阳性 3 10%~20% 稀液状便 − 4 >20% − 肉眼血便 表 2 引物序列
Table 2 Primer sequence
基因名称 序列 β-actin[18] Forward GCTCCTCCTGAGCGCAAGTA Reverse CAGCTCAGTAACAGTCCGCC NF-κB[19] Forward ACGATCTGTTTCCCCTCATC Reverse TGCTTCTCTCCCCAGGAATA IL-6[20] Forward CTGCAAGAGACTTCCATCCAG Reverse AGTGGTATAGACAGGTCTGTTGG TGF-β1[18] Forward GTCACTGGAGTTGTACGGCA Reverse TCATGTCATGGATGGTGCCC IFN-γ[18] Forward TGATTGCGGGGTTGTATCTG Reverse CTGTCTGGCCTGCTGTTAAA TNF-α[21] Forward CCCTCACACTCAGATCATCTTCT Reverse GCTACGACGTGGGCTACAG IL-17A[22] Forward CTCCAGAAGGCCCTCAGACTA Reverse AGCTTTCCCTCCGCATTGACA IL-22[23] Forward AGCGGTGACGACCAGAACATC Reverse TCCAGTTCCCCAATCGCCT ZO-1[24] Forward GATCCCTGTAAGTCACCCAGA Reverse CTCCCTGCTTGCACTCCTATC Occludin[18] Forward GGACTGTCAACTCTTTCCGC Reverse CATTTATGATGAACAGCCCC Claudin-3[18] Forward CTGTCTGTCCTCTTCCAGCC Reverse CCACTACCAGCAGTCGATGA -
[1] BACH J. Mechanisms of disease: The effect of infections on the susceptibility to autoimmune and allergic diseases[J]. The New England Journal of Medicine,2002,347(12):911−920. doi: 10.1056/NEJMra020100
[2] OKADA H, KUHN C, FEILLET H, et al. The 'hygiene hypothesis' for autoimmune and allergic diseases: An update[J]. Clinical and Experimental Immunology,2010,160(1):1−9. doi: 10.1111/j.1365-2249.2010.04139.x
[3] NG S C, BERNSTEIN C N, VATN M H, et al. Geographical variability and environmental risk factors in inflammatory bowel disease[J]. Gut,2013,62(4):630−649. doi: 10.1136/gutjnl-2012-303661
[4] CHU H, KHOSRAVI A, KUSUMAWARDHANI I P, et al. Gene-microbiota interactions contribute to the pathogenesis of inflammatory bowel disease[J]. Science,2016,352(6289):1116−1120. doi: 10.1126/science.aad9948
[5] MATSUOKA K, SAITO E, FUJII T, et al. Tacrolimus for the treatment of ulcerative colitis[J]. Intestinal Research,2015,13(3):219−226. doi: 10.5217/ir.2015.13.3.219
[6] ZHAO M, BURISCH J. Impact of genes and the environment on the pathogenesis and disease course of inflammatory bowel disease[J]. Digestive Diseases and Sciences,2019,64(7):1759−1769. doi: 10.1007/s10620-019-05648-w
[7] LEBLANC J G, CHAIN F, MARTÍN R, et al. Beneficial effects on host energy metabolism of short-chain fatty acids and vitamins produced by commensal and probiotic bacteria[J]. Microbial Cell Factories,2017,16(1):79. doi: 10.1186/s12934-017-0691-z
[8] WANG J, CHEN H, YANG B, et al. Lactobacillus plantarum ZS2058 produces CLA to ameliorate DSS-induced acute colitis in mice[J]. RSC Advances,2016,6(18):14457−14464. doi: 10.1039/C5RA24491A
[9] DING S, YAN W, FANG J, et al. Potential role of Lactobacillus plantarum in colitis induced by dextran sulfate sodium through altering gut microbiota and host metabolism in murine model[J]. Science China Life Sciences 2021, 64(11): 1906-1916.
[10] KHAN I, WEI J, LI A, et al. Lactobacillus plantarum strains attenuated DSS-induced colitis in mice by modulating the gut microbiota and immune response[J]. International Microbiology,2022,25(3):587−603. doi: 10.1007/s10123-022-00243-y
[11] MA Y, HU C, YAN W, et al. Lactobacillus pentosus increases the abundance of Akkermansia and affects the serum metabolome to alleviate DSS-induced colitis in a murine model[J]. Frontiers in Cell and Developmental Biology,2020,8:591408. doi: 10.3389/fcell.2020.591408
[12] REN Z, HUO Y, ZHANG Q, et al. Protective effect of Lactiplantibacillus plantarum 1201 combined with galactooligosaccharide on carbon tetrachloride-induced acute liver injury in mice[J]. Nutrients,2021,13(12):4441. doi: 10.3390/nu13124441
[13] 孟祥辰. 益生菌及法尼酯X受体对结肠炎的影响及机制研究[D]. 北京: 北京协和医学院, 2019 MENG X C. Effects of probiotics and farnesyl X receptors on colitis and their mechanisms[D]. Beijing: Peking Union Medical College, 2019.
[14] ZHAO J, YAN T, WANG Y, et al. Lactobacillus plantarum BC299 can alleviate dextran sulphate sodium-induced colitis by regulating immune response and modulating gut microbiota[J]. International Journal of Food Science & Technology,2021,56(11):5698−5707.
[15] WANG Y, GUO Y, XIE Q, et al. Potential of Lactobacillus plantarum ZDY2013 and Bifidobacterium bifidum WBIN03 in relieving colitis by gut microbiota, immune, and anti-oxidative stress[J]. Canadian Journal of Microbiology,2018,64(999):327−337.
[16] VEENSTRA J P, VEMU B, TOCMO R, et al. Pharmacokinetic analysis of carnosic acid and carnosol in standardized rosemary extract and the effect on the disease activity index of DSS-Induced colitis[J]. Nutrients,2021,13(3):773. doi: 10.3390/nu13030773
[17] RAHA S, MERANTE F, PROTEAU G, et al. Simultaneous isolation of total cellular RNA and DNA from tissue culture cells using phenol and lithium chloride[J]. Genet Anal Tech Appl,1990,7(7):173−177. doi: 10.1016/0735-0651(90)90022-8
[18] WAN C, CHEN S, ZHAO K, et al. Serum untargeted metabolism reveals the mechanism of L. plantarum ZDY2013 in alleviating kidney injury induced by high-salt diet[J]. Nutrients,2021,13(11):3920. doi: 10.3390/nu13113920
[19] 潘登, 贾宝全, 曹农. 还原性谷胱甘肽对急性坏死性胰腺炎肺损伤的影响[J]. 第四军医大学学报,2007,28(5):407−410. [PAN D, JIA B Q, CAO N. Effect of reduced glutathione on lung injury in rats with acute necrotizing pancreatitis[J]. Journal of Air Force Medical University,2007,28(5):407−410. doi: 10.3321/j.issn:1000-2790.2007.05.007 [20] BALSA E, PERRY E A, BENNETT C F, et al. Defective NADPH production in mitochondrial disease complex I causes inflammation and cell death[J]. Nature Communications,2020,11(1):2714. doi: 10.1038/s41467-020-16423-1
[21] MELTON A C, BAILEY-BUCKTROUT, SAMANTHA L, et al. Expression of αvβ8 integrin on dendritic cells regulates Th17 cell development and experimental autoimmune encephalomyelitis in mice[J]. Journal of Clinical Investigation,2010,120(12):4436−4444. doi: 10.1172/JCI43786
[22] 夏思思, 王丽凤, 许江南, 等. 利用基因敲除小鼠研究咪喹莫特诱导银屑病模型中转录因子RORγt的作用[J]. 免疫学杂志,2015(7):4. [XIA S S, WANG L F, XU J N, et al. Analysis of the roles of RORγt in imiquimod-induced psoriasiform skin inflammation using knockout mice[J]. Immunological Journal,2015(7):4. [23] 韩杨. IL-22在TNBS诱导的小鼠早期溃疡性结肠炎中的表达[D]. 武汉: 华中科技大学, 2011 HAN Y. The expression of IL-22 in the early stage of murine TNBS colitis[D]. Wuhan: Huazhong University of Science and Technology, 2011.
[24] TAO X, TIAN L, ZHAN H, et al. In vitro and in vivo assessments of Artemisia argyi fermented with Lactobacillus plantarum WLPL01 as an alternative anti-Salmonella agent[J]. Food Control,2021,126:108079. doi: 10.1016/j.foodcont.2021.108079
[25] BENTON H P, IVANISEVIC J, MAHIEU N G, et al. Autonomous metabolomics for rapid metabolite identification in global profiling[J]. Analytical Chemistry,2015,87(2):884−891. doi: 10.1021/ac5025649
[26] MIYAUCHI E, MORITA H, TANABE S. Lactobacillus rhamnosus alleviates intestinal barrier dysfunction in part by increasing expression of zonula occludens-1 and myosin light-chain kinase in vivo[J]. Journal of Dairy Science,2009,92(6):2400−2408. doi: 10.3168/jds.2008-1698
[27] 黄循铷, 王承党, 王瑞幸, 等. 溃疡性结肠炎小鼠肠道通透性改变与TNF-α及NF-κB p65的关系[J]. 中国应用生理学杂志,2016,32(2):5. [HUANG X R, WANG C D, WANG R X, et al. Changes of colonic permeability and its correlation with TNF-α, NF-κB p65 in ulceration colitis mice[J]. Chinese Journal of Applied Physiology,2016,32(2):5. [28] LIU Y, YIN F, HUANG L, et al. Long-term and continuous administration of Bacillus subtilis during remission effectively maintains the remission of inflammatory bowel disease by protecting intestinal integrity, regulating epithelial proliferation, and reshaping microbial structure and function[J]. Food & Function,2021,12(5):2201−2210.
[29] NISHINO K, NISHIDA A, INOUE R, et al. Analysis of endoscopic brush samples identified mucosa-associated dysbiosis in inflammatory bowel disease[J]. Journal of Gastroenterology,2018,53(1):95−106. doi: 10.1007/s00535-017-1384-4
[30] BLANDFORD L E, JOHNSTON E L, SANDERSON J D, et al. Promoter orientation of the immunomodulatory Bacteroides fragilis capsular polysaccharide A (PSA) is off in individuals with inflammatory bowel disease (IBD)[J]. Gut Microbes,2019,10(5):569−577. doi: 10.1080/19490976.2018.1560755
[31] PNG C W, LINDÉN S K, GILSHENAN K S, et al. Mucolytic bacteria with increased prevalence in IBD mucosa augmentIn vitro utilization of mucin by other bacteria[J]. Official Journal of the American College of Gastroenterology,2010,105(11):2420−2428. doi: 10.1038/ajg.2010.281
[32] RAJILIĆ-STOJANOVIĆ M, SHANAHAN F, GUARNER F, et al. Phylogenetic analysis of dysbiosis in ulcerative colitis during remission[J]. Inflammatory Bowel Diseases,2013,19(3):481−488. doi: 10.1097/MIB.0b013e31827fec6d
[33] DEL PIANO M, MORELLI L, STROZZI G P, et al. Probiotics: From research to consumer[J]. Digestive and Liver Disease,2006,38:248−255. doi: 10.1016/S1590-8658(07)60004-8
[34] DRELL T, LARIONOVA A, VOOR T, et al. Differences in gut microbiota between atopic and healthy children[J]. Current Microbiology,2015,71(2):177−183. doi: 10.1007/s00284-015-0815-9
[35] WOZNIAK H, BECKMANN T S, FRÖHLICH L, et al. The central and biodynamic role of gut microbiota in critically ill patients[J]. Critical Care,2022,26(1):250. doi: 10.1186/s13054-022-04127-5
[36] KONG C, YAN X, LIU Y, et al. Ketogenic diet alleviates colitis by reduction of colonic group 3 innate lymphoid cells through altering gut microbiome[J]. Signal Transduction and Targeted Therapy,2021,6(1):154. doi: 10.1038/s41392-021-00549-9
[37] BYNDLOSS M X, BÄUMLER A J. The germ-organ theory of non-communicable diseases[J]. Nature Reviews Microbiology,2018,16(2):103−110. doi: 10.1038/nrmicro.2017.158
[38] NI J, WU G D, ALBENBERG L, et al. Gut microbiota and IBD: Causation or correlation?[J]. Nature Reviews Gastroenterology & Hepatology,2017,14(10):573−584.
[39] ZHOU X, LIU H, ZHANG J, et al. Protective effect of Lactobacillus fermentum CQPC04 on dextran sulfate sodium-induced colitis in mice is associated with modulation of the nuclear factor-κB signaling pathway[J]. Journal of Dairy Science,2019,102(11):9570−9585. doi: 10.3168/jds.2019-16840
[40] LIN J C, WU J Q, WANG F, et al. Qingbai decoction regulates intestinal permeability of dextran sulphate sodium-induced colitis through the modulation of notch and NF-κB signalling[J]. Cell Proliferation,2019,52(2):e12547. doi: 10.1111/cpr.12547
[41] MUJAGIC Z, DE VOS P, BOEKSCHOTEN M V, et al. The effects of Lactobacillus plantarum on small intestinal barrier function and mucosal gene transcription: A randomized double-blind placebo controlled trial[J]. Scientific Reports,2017,7(1):40128. doi: 10.1038/srep40128
[42] KARCZEWSKI J, TROOST F J, KONINGS I, et al. Regulation of human epithelial tight junction proteins by Lactobacillus plantarum in vivo and protective effects on the epithelial barrier[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology,2010,298(6):G851−G859. doi: 10.1152/ajpgi.00327.2009
[43] YANG H, DUAN Z. The local defender and functional mediator: gut microbiome[J]. Digestion,2018,97(2):137−145. doi: 10.1159/000484687
[44] DEY P, CHAUDHURI S R, EFFERTH T, et al. The intestinal 3M (microbiota, metabolism, metabolome) zeitgeist-from fundamentals to future challenges[J]. Free Radical Biology and Medicine,2021,176:265−285. doi: 10.1016/j.freeradbiomed.2021.09.026
[45] HE R, LI Y, HAN C, et al. L-Fucose ameliorates DSS-induced acute colitis via inhibiting macrophage M1 polarization and inhibiting NLRP3 inflammasome and NF-κB activation[J]. International Immunopharmacology,2019,73:379−388. doi: 10.1016/j.intimp.2019.05.013
[46] BECERRA J E, YEBRA M J, MONEDERO V, et al. An l-Fucose operon in the probiotic Lactobacillus rhamnosus GG is involved in adaptation to gastrointestinal conditions[J]. Applied and Environmental Microbiology,2015,81(11):3880−3888. doi: 10.1128/AEM.00260-15
[47] BUNESOVA V, LACROIX C, SCHWAB C. Fucosyllactose and L-fucose utilization of infant Bifidobacterium longum and Bifidobacterium kashiwanohense[J]. BMC Microbiology,2016,16(1):248. doi: 10.1186/s12866-016-0867-4
[48] OTTMAN N, DAVIDS M, SUAREZ-DIEZ M, et al. Genome-scale model and omics analysis of metabolic capacities of Akkermansia muciniphila reveal a preferential mucin-degrading lifestyle[J]. Applied and Environmental Microbiology,2017,83(18):1014−1017.
[49] WANG L, AI C, WEN C, et al. Fucoidan isolated from Ascophyllum nodosum alleviates gut microbiota dysbiosis and colonic inflammation in antibiotic-treated mice[J]. Food & Function,2020,11(6):5595−5606.
[50] JIANG Q. Natural forms of vitamin E: Metabolism, antioxidant, and anti-inflammatory activities and their role in disease prevention and therapy[J]. Free Radical Biology and Medicine,2014,72:76−90. doi: 10.1016/j.freeradbiomed.2014.03.035
[51] LI G, LEE M J, LIU A B, et al. The antioxidant and anti-inflammatory activities of tocopherols are independent of Nrf2 in mice[J]. Free Radical Biology and Medicine,2012,52(7):1151−1158. doi: 10.1016/j.freeradbiomed.2011.12.005
[52] CHOI Y, LEE S, KIM S, et al. Vitamin E (α-tocopherol) consumption influences gut microbiota composition[J]. International Journal of Food Sciences and Nutrition,2020,71(2):221−225. doi: 10.1080/09637486.2019.1639637
[53] LIU K Y, NAKATSU C H, JONES-HALL Y, et al. Vitamin E alpha- and gamma-tocopherol mitigate colitis, protect intestinal barrier function and modulate the gut microbiota in mice[J]. Free Radical Biology and Medicine,2021,163:180−189. doi: 10.1016/j.freeradbiomed.2020.12.017
-
期刊类型引用(4)
1. 郭少莉,张林奕,谢立梅,张宁宁. 牡丹籽油-枇杷汁爆珠的工艺优化研究. 食品科技. 2024(01): 64-71 .  百度学术
百度学术
2. 王远利,康心蕊,陶亮,张权,王紫琳,田洋. 蛋白质与多酚的互作机制及其应用. 中国食品学报. 2024(02): 357-372 .  百度学术
百度学术
3. 石长波,徐朔,赵钜阳,陈逸玉,顾丽雅,李玉奇. 食品中自微乳体系的组成、制备及促进生物活性物质生物利用的研究进展. 食品工业科技. 2024(17): 426-435 .  本站查看
本站查看
4. 王菲,车思彤,赵晓. 乳化剂与乳清蛋白包埋壁材对透明质酸微胶囊溶解性的影响. 中国乳品工业. 2024(11): 38-44 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:
 下载:
下载:



