Optimization of Extraction Process and Decolorization of Pectin from Wine Mud
-
摘要: 葡萄酒泥是葡萄酒在发酵、贮存期间产生的沉淀物,含有果胶、蛋白质、多酚等物质。为将酒泥中的有效成分分离提取,实现葡萄酒泥的增值利用,本研究以生产干白葡萄酒中的酒泥为原料,通过单因素实验探讨了料液比、pH、提取温度以及提取时间对果胶得率的影响,采用响应面法优化了果胶的提取工艺条件,并使用大孔树脂对果胶进行脱色,最后用红外光谱和HNMR进行结构表征。结果表明,在料液比(葡萄酒泥:水)为1:14 g/mL、pH为2.0、提取温度65 ℃、提取时间90 min时,果胶得率为6.48%,与响应面模型预测值6.50%相近,各因素对果胶得率的影响大小为:料液比>提取温度>提取时间>pH。选用D101大孔树脂对提取的果胶进行脱色,最佳脱色条件为脱色温度25 ℃、pH为2.0、脱色流速为3 BV/h,解吸液为60%(v/v)乙醇、解吸流速3 BV/h,在此条件下,脱色率可达91.75%。红外光谱和HNMR分析表明提取的果胶为α-半乳糖醛酸。研究为葡萄酒泥的成分分析和分离利用提供参考依据。Abstract: Wine mud is the precipitate produced during fermentation and storage, which contains pectin, protein, polyphenols and other substances. To realize the value-added utilization by separating and extracting the effective components of the mud in white wine production, in this study, the effects of material-liquid ratio, pH, extraction temperature and extraction time on the yield of pectin were investigated by the single-factor test, the extraction condition was optimized by the response surface method, the decolorization of pectin was carried out using macroporous resin, and the structure was characterized by infrared spectroscopy and HNMR. The results showed that the yield of pectin was 6.48% on the condition of wine mud:water=1:14 g/mL, pH was 2.0, extraction temperature was 65 ℃ and extraction time was 90 min, which was near to the predicted value of 6.50% by the response surface model. The factors on the yield followed as material-liquid ratio>extraction temperature>extraction time>pH. Decolorized by D101 macroporous resin under the condition that decolorization temperature was 25 ℃, pH was 2.0, decolorization flow rate was 3 BV/h and desorption solution was 60% (v/v) ethanol, desorption flow rate was 3 BV/h, the decolorization rate could reach 91.75%. IR and HNMR analysis showed that pectin extracted was α-galacturonic acid. This study would provide a reference for the separation and utilization of wine mud.
-
葡萄酒泥是葡萄酒在发酵、贮存期间倒罐后得到的沉淀物[1]。葡萄酒泥主要以酵母菌残体为主,含有果胶、蛋白质、多酚等物质。目前对葡萄酒泥的研究主要集中在酒精的回收、活性成分的提取以及作为动物饲料和吸附剂使用[2]。果胶属于多糖类高分子化合物,以原果胶、水溶性果胶、果胶酸的形态广泛分布于植物的果实、根、茎、叶中[3-4]。果胶因其具有增稠的特性而被广泛应用于食品工业,还具有降低胆固醇和降低血糖的功能,可用作防治糖尿病和高血脂的保健品[5-6]。随着人们对果胶的需求不断增长,使得果胶的来源也不断地扩大,例如从百香果皮[7-8]、西兰花茎[9-10]、甜菜[11-12]等生物质废弃物中提取果胶。葡萄皮渣中也含有比较丰富的果胶成分,张慧芳等[13]使用超声辅助提取法确定了从葡萄皮渣中提取果胶的工艺条件,在料水比1:10 g/mL、温度35 ℃、超声波功率80 W、提取时间为89.86 min时,果胶提取率最高;李力[14]通过酸提法从葡萄皮渣中提取果胶,在最佳提取条件下提取率为2.99%。由于葡萄酒泥的成分比较复杂,从葡萄酒泥中提取果胶的研究相对较少。
果胶的提取方法主要有酸提法、超声辅助提取法、微波辅助提取法、微生物法等。超声法和微波法在应用于工业化生产时受设备的限制成本较高,微生物法提取条件苛刻且提取时间较长。相比而言,酸提取法简便易行,更适合工业化生产。王雅婷等[15]采用酸提醇析法从籽瓜瓜瓤提取果胶,最终产率可达18.7%,让凤菊等[16]通过盐酸提取西兰花茎中的果胶,最终得率为9.42%。酸提后的果胶提取液中含有大量杂质和色素,需要对其进行脱色,常见的脱色法有吸附脱色和氧化脱色[17]。双氧水脱色时间较长且容易破坏果胶分子结构,活性炭脱色效果较强,但其造成的损失率较高,并且会影响产品的色泽;大孔吸附树脂因其极性差异,具有较好的吸附选择性,同时洗脱相对容易,可循环使用,常常被应用在天然产物的分离及其脱色[18-20]。安仕豪[21]使用HZ-801大孔吸附树脂对籽瓜果胶提取液进行脱色,在最佳工艺条件下脱色率可达到81.65%;游新侠[22]使用X-5大孔吸附树脂对苹果渣中果胶提取液进行脱色处理,最终脱色率可得81.26%。由于不同提取原料成分不同,如何选择合适的脱色方法,特别是根据果胶提取液性质选择合适的大孔树脂优化脱色工艺值得研究。
本研究采用酸提法对葡萄酒泥中果胶进行提取,考察了料液比、pH、提取温度以及提取时间对果胶得率的影响,通过单因素实验,结合响应面分析法优化确定最佳提取工艺条件,并通过静态吸附实验和动态吸附实验筛选最佳树脂以及确定最佳脱色条件。通过对葡萄酒泥中果胶的提取,实现酒泥的综合开发利用,提高其附加价值,为相关研究提供参考。
1. 材料与方法
1.1 材料与仪器
白葡萄酒泥 甘肃红桥庄园葡萄酒有限公司提供;浓硫酸 分析纯,白银良友化学试剂有限公司;无水乙醇 分析纯,国药集团化学试剂有限公司;咔唑、D-半乳糖醛酸 均为分析纯,麦克林试剂有限公司;AB-8型大孔吸附树脂 麦克林试剂有限公司;S-8、X-5、NKA-9型大孔吸附树脂 郑州和成新材料科技有限公司;D101型大孔吸附树脂 东鸿化工有限公司。
UV 8453A紫外-可见分光光度计 美国Agilent公司;NW 10超纯水机 净肤水科技有限公司;Digilab-FTS 3000傅里叶变换红外光谱仪 美国DIGILLAB公司;HN101-1A电热数显鼓风干燥箱 鹤壁市华能电子科技有限公司;Neofuge 15R台式高速离心机 上海力申科学仪器有限公司;HH-2J恒温磁力搅拌水浴锅 常州朗越仪器制造有限公司;BS-224S电子分析天平 北京赛多利斯仪器有限公司;AVANCE NEO 400MHz液体超导核磁共振谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 果胶的提取
将葡萄酒泥在5000 r/min离心分离,40 ℃干燥,粉碎后过60目筛。在上述处理过的酒泥中按一定比例加入蒸馏水,搅拌混合,调节混合物pH,恒温搅拌提取一定时间后离心分离。离心分离液减压旋蒸至原液体积的1/3后加入浓缩液1倍体积的无水乙醇进行醇沉,醇沉提取液在5000 r/min下离心分离,固体在40 ℃干燥即得果胶[23]。
1.2.2 单因素实验
1.2.2.1 料液比的选择
称取葡萄酒泥粉末1.00 g,固定溶液pH为2.0,提取时间90 min,提取温度65 ℃,调节料液比分别为1:10、1:15、1:20、1:25、1:30,考察料液比对果胶得率的影响。
1.2.2.2 pH的选择
称取葡萄酒泥粉末1.00 g,固定料液比为1:15,提取时间90 min,提取温度65 ℃,调节pH分别为1.5、2.0、2.5、3.0、3.5,考察pH对果胶得率的影响。
1.2.2.3 提取温度的选择
称取葡萄酒泥粉末1.00 g,固定料液比为1:15,pH为2.0,提取时间90 min,调节提取温度分别为60、65、70、75、80 ℃,考察提取温度对果胶得率的影响。
1.2.2.4 提取时间的选择
称取葡萄酒泥粉末1.00 g,固定料液比为1:15,pH为2.0,提取温度为65 ℃,调节提取时间分别为30、60、90、120、150 min,考察提取时间对果胶得率的影响。
1.2.3 响应面法试验设计
采用响应面法(BBD)优化果胶提取工艺,以料液比(A)、pH(B)、提取温度(C)以及提取时间(D)为自变量,响应面因素水平表见表1。
表 1 响应面因素水平设计Table 1. Factor level design of response surface因素 水平 −1 0 1 A料液比(g/mL) 1:10 1:15 1:20 B pH 1 2 3 C提取温度(℃) 60 65 70 D提取时间(min) 60 90 120 1.2.4 果胶含量的测定
果胶含量采用分光光度法测定,以半乳糖醛酸作为基准物质作标准曲线。取6支具塞试管,分别加入浓度为0、20、40、60、80、100 mg/L的D-半乳糖醛酸溶液1 mL,再依次加入6 mL浓硫酸,沸水浴加热15 min,冷却至室温后加入0.15%的咔唑乙醇溶液0.5 mL,避光反应30 min,在波长530 nm处测定其吸光度[24]。半乳糖醛酸浓度C与吸光度A的线性回归方程见式(1)。
A530=0.7002C+0.0002 (1) 式中:A为吸光度;C为半乳糖醛酸浓度,mg·mL−1;决定系数
R2=0.996 。根据公式(2)计算果胶的得率。
w(%)=C×V×Dm×1000×100 (2) 式中:w为果胶得率,%;D为溶液稀释倍数;C为对照半乳糖醛酸标准曲线测得的果胶浓度,mg·mL−1;V为提取液体积,mL;m为原料干重,g。
1.2.5 树脂的预处理
将树脂用95%乙醇浸泡24 h后用蒸馏水冲洗至无白色浑浊,再用5%盐酸溶液浸泡12 h,然后用蒸馏水冲洗至中性,最后用5%氢氧化钠溶液浸泡12 h,再用蒸馏水洗至中性[25]。
1.2.6 静态吸附实验
称取相同质量的不同树脂,加入到相同体积的果胶酸提取液中,在室温下100 r/min恒速搅拌,每隔2 h取上清液测定吸光度,计算其脱色率。
1.2.7 动态吸附实验
将预处理后的树脂以湿法装柱方法进行填装,分别探究最佳吸附和解吸条件。
1.2.7.1 脱色pH的选择
在流速为3 BV/h,温度为25 ℃下进行D101大孔吸附树脂动态脱色实验,考察上柱液pH分别为1.0、2.0、3.0、4.0时脱色率的动态变化。
1.2.7.2 脱色温度的选择
在流速为3 BV/h,pH为2.0下进行D101大孔吸附树脂动态脱色实验,考察上柱液温度分别为25、35、45、55 ℃时脱色率的动态变化。
1.2.7.3 上柱液流速的选择
在pH为2.0,温度为25 ℃下进行D101大孔吸附树脂动态脱色实验,考察上柱液流速分别为3、6、9、12 BV/h时脱色率的动态变化。
1.2.7.4 乙醇浓度的选择
在流速为3 BV/h,室温下进行D101大孔吸附树脂解吸实验,考察乙醇浓度分别为10%~100%时吸光度值的变化。
1.2.7.5 解吸流速的选择
在乙醇浓度为60%,室温下进行D101大孔吸附树脂解吸实验,考察解吸流速分别为3、6、9、12 BV/h时吸光度值的变化。
1.2.8 脱色率的计算
果胶脱色率按公式(3)计算:
D(%)=(A1−A2)/A1×100 (3) 式中,D为脱色率,%;A1为原果胶提取液的吸光度;A2为脱色后果胶提取液的吸光度。
1.2.9 果胶的表征
1.2.9.1 果胶的红外光谱分析
参考文献[26]的方法,将干燥后的果胶粉末和溴化钾按1:100比例进行研磨,压片制样,在4000~400 cm−1范围内进行扫描,对谱图进行分析。
1.2.9.2 果胶的NMR分析
将15 mg样品用D2O溶解后加入核磁管中,用Brucker AV-400型超导核磁共振波谱仪测定。
1.3 数据处理
采用Excel和Origin 2021对3组平行实验数据进行数据处理,数据以平均值±标准误差来表示。使用 Design-Expert 13软件进行Box-Behnken试验设计及响应面试验数据处理,并对实验数据进行方差分析及二次多项式回归拟合。
2. 结果与分析
2.1 影响果胶提取的因素
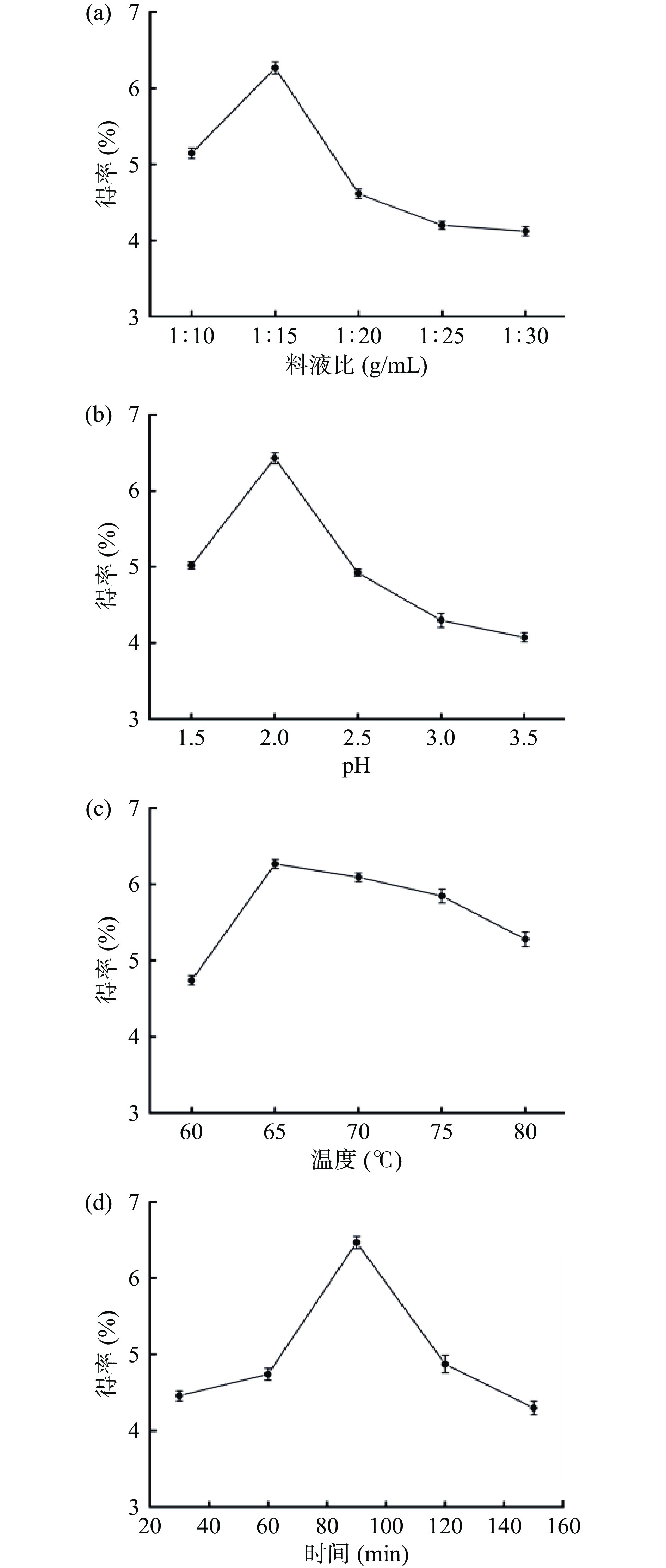
系统探讨了料液比、pH、提取温度以及提取时间对果胶得率的影响,分别讨论如下。由图1(a)可知,在料液比小于1:15时,果胶的得率随着料液比的增大而提高,可能是在较小料液比时,提取液的黏度较大,导致葡萄酒泥中果胶难以扩散,果胶不能完全水解[27];当料液比为1:15时,果胶的得率达到最大;当料液比大于1:15时,料液比的增加会导致果胶得率的逐渐降低,溶剂体积的增加使果胶在溶液中浓度下降,从而导致得率降低,并且在料液比较大时,可能会导致其它物质被溶出,带入杂质,而且较大的料液比会增加后续处理成本[28]。综合考虑,以料液比为1:15为最佳料液比。由图1(b)可知,当pH<2.0时,果胶的得率较低,这可能是由于在酸性较强的环境下,果胶会发生脱脂反应二降解,使得果胶得率降低[5];当 pH 为 2.0 时,果胶得率达到最大;当 pH>2.0时,pH的增加会导致果胶的得率降低,这可能由于随着酸性的减弱,将非水溶性原果胶转化为水溶性果胶的能力也明显降低,因此得率下降[29-30]。因此,采用pH2.0为最佳提取条件。由图1(c)可知,随着温度的逐渐升高,果胶的得率也会有所增加,当温度达到65 ℃时,果胶得率为最大,继续升高温度,果胶得率略有下降。温度过低时,原果胶水解速度会变慢,导致不能完全水解;温度较高时,果胶分子结构较容易破坏,使其发生降解[31]。因此,选用65 ℃为最佳提取条件。由图1(d)可知,随着提取时间的增加,果胶得率逐渐增大,当提取时间为90 min时,果胶得率达到最大,继续增加提取时间,果胶得率反而有下降的趋势。可能的原因是当提取时间较短时,原果胶还未完全溶出;提取时间过长时,原果胶可能会受热降解而使果胶得率下降[32]。因此,选用90 min为最佳提取时间。
在上述最优条件下,即:料液比(葡萄酒泥:水)为1:15 g/mL、pH为2.0、提取温度65 ℃、提取时间90 min时,果胶提取液浓度为4.3 mg·mL−1,果胶得率为6.46%。
2.2 响应面法优化果胶的提取条件
在上述实验基础上,以果胶得率(Y)为响应值,以料液比(A)、pH(B)、提取温度(C)及提取时间(D)为自变量共设计了29组试验,BBD试验设计及测试结果见表2。
表 2 响应面试验设计条件及结果Table 2. Design conditions and results of response surface experiment试验号 A B C D Y(%) 1 0 −1 −1 0 4.28 2 −1 1 0 0 5.05 3 0 0 1 1 4.09 4 −1 0 1 0 4.31 5 1 1 0 0 3.05 6 0 0 1 −1 4.29 7 0 0 0 0 6.42 8 0 1 1 0 3.88 9 0 −1 0 1 4.45 10 0 1 0 −1 4.22 11 1 −1 0 0 3.71 12 1 0 −1 0 3.08 13 0 0 0 0 6.47 14 1 0 0 −1 3.29 15 0 −1 0 −1 4.76 16 −1 0 0 1 4.99 17 1 0 0 1 3.33 18 0 0 0 0 6.31 19 1 0 1 0 2.89 20 0 1 0 1 4.81 21 0 0 0 0 6.43 22 0 0 −1 −1 4.11 23 0 0 −1 1 4.77 24 0 1 −1 0 4.15 25 −1 0 −1 0 4.47 26 −1 −1 0 0 4.59 27 0 −1 1 0 4.08 28 0 0 0 0 6.45 29 −1 0 0 −1 4.83 按照 Design Expert 13软件中的BBD模型对试验获得的果胶得率响应值进行回归,建立二次回归模型,回归方程为:
Y=6.42−0.7408A−0.0592B−0.11C+0.0783D−0.28AB−0.0075AC−0.03AD−0.0175BC+0.225BD−0.215CD−1.4A2−0.9742B2−1.3C2−0.8605D2
对回归方程模型进行方差分析和显著性检验,其结果如表3所示。由表3可看出该试验所建立的模型具有高度显著性(P<0.01),失拟项不显著(P>0.05),因此该模型对实验拟合较好。模型R2=0.9967,R2adj=0.9934,预测值与实际值具有高度相关性,试验误差小,因此可利用此模型对果胶得率进行预测。各因素对果胶得率的影响大小为:料液比>提取温度>提取时间>pH。
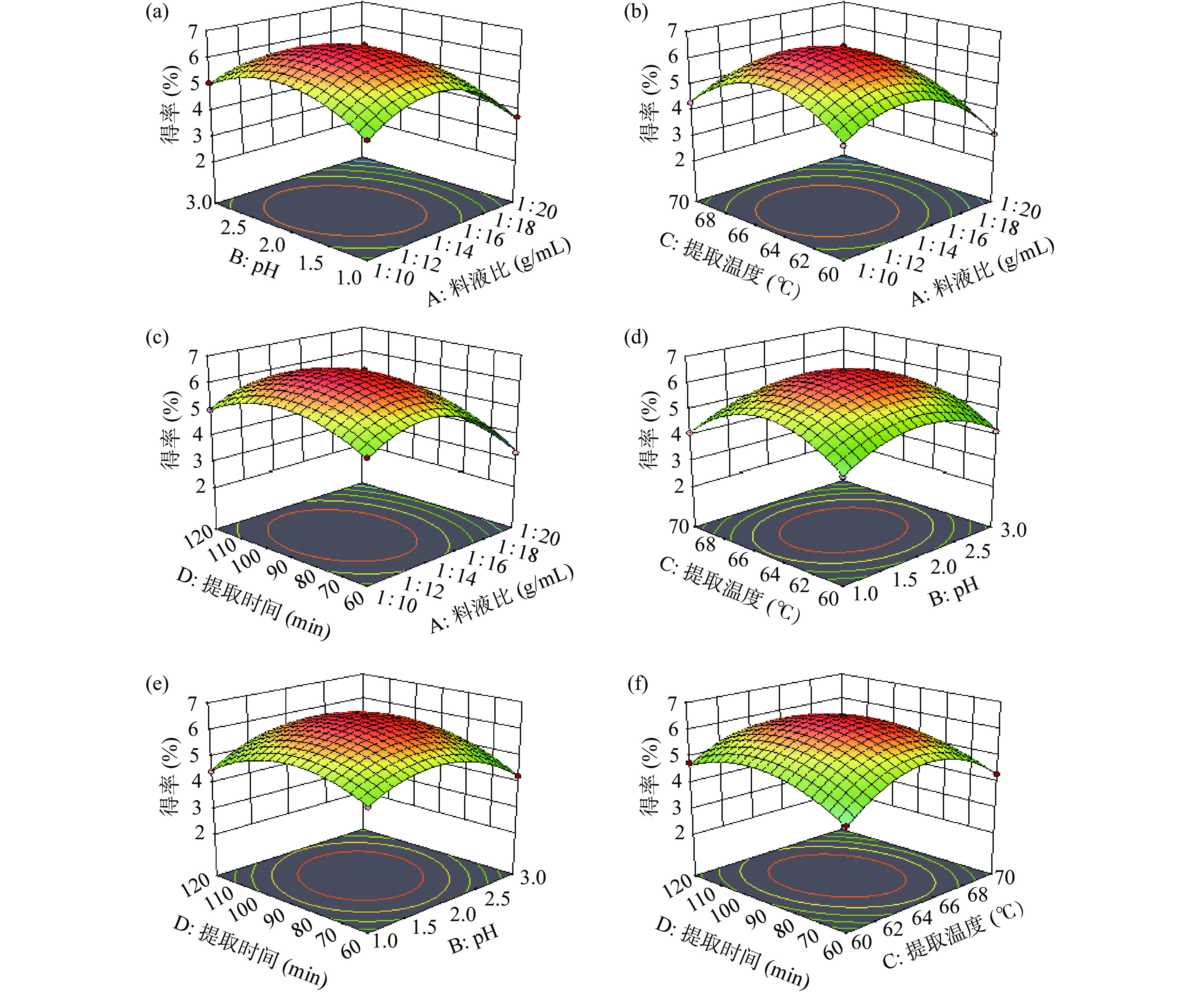
表 3 回归方程的方差分析Table 3. Variance analysis of regression equation方差来源 平方和 自由度 均方 F值 P值 显著性 模型 30.51 14 2.18 302.24 <0.0001 ** A 6.59 1 6.59 913.41 <0.0001 ** B 0.042 1 0.042 5.83 0.0301 * C 0.1452 1 0.1452 20.14 0.0005 ** D 0.0736 1 0.0736 10.21 0.0065 ** AB 0.3136 1 0.3136 43.49 <0.0001 ** AC 0.0002 1 0.0002 0.0312 0.8623 AD 0.0036 1 0.0036 0.4993 0.4914 BC 0.0012 1 0.0012 0.1699 0.6864 BD 0.2025 1 0.2025 28.08 0.0001 ** CD 0.1849 1 0.1849 25.64 0.0002 ** A2 12.79 1 12.79 1773.95 <0.0001 ** B2 6.16 1 6.16 853.87 <0.0001 ** C2 11.01 1 11.01 1527.36 <0.0001 ** D2 4.8 1 4.8 666.12 <0.0001 ** 残差 0.1009 14 0.0072 失拟项 0.0854 10 0.0085 2.2 0.2323 不显著 纯误差 0.0155 4 0.0039 总和 30.61 28 R2 0.9967 R2adj 0.9934 注:*:差异显著,P<0.05;**:差异高度显著,P<0.01。 图2为A(料液比)、B(pH)、C(提取温度)以及D(提取时间)四个因素两两交互对果胶得率影响的曲面图。料液比与pH、pH与提取时间和提取温度与提取时间之间交互作用比较显著,而pH与提取温度、料液比与提取时间、提取温度与料液比之间交互作用不显著。各个因素之间交互作用响应曲面开口均朝下,说明果胶得率存在极大值。
通过响应面回归方程预测果胶的最佳提取工艺为料液比1:13.83 g/mL、pH为1.96、提取温度65.18 ℃、提取时间89.85 min。在此条件下的果胶得率预测值为6.50%。结合实验操作的便利性,确定提取工艺的最优条件为:料液比1:14 g/mL、pH为2.0、提取温度65 ℃、提取时间90 min,在此条件下进行3次平行实验,果胶得率的平均值为6.48%,与预测理论值6.50%接近。
2.3 果胶的脱色
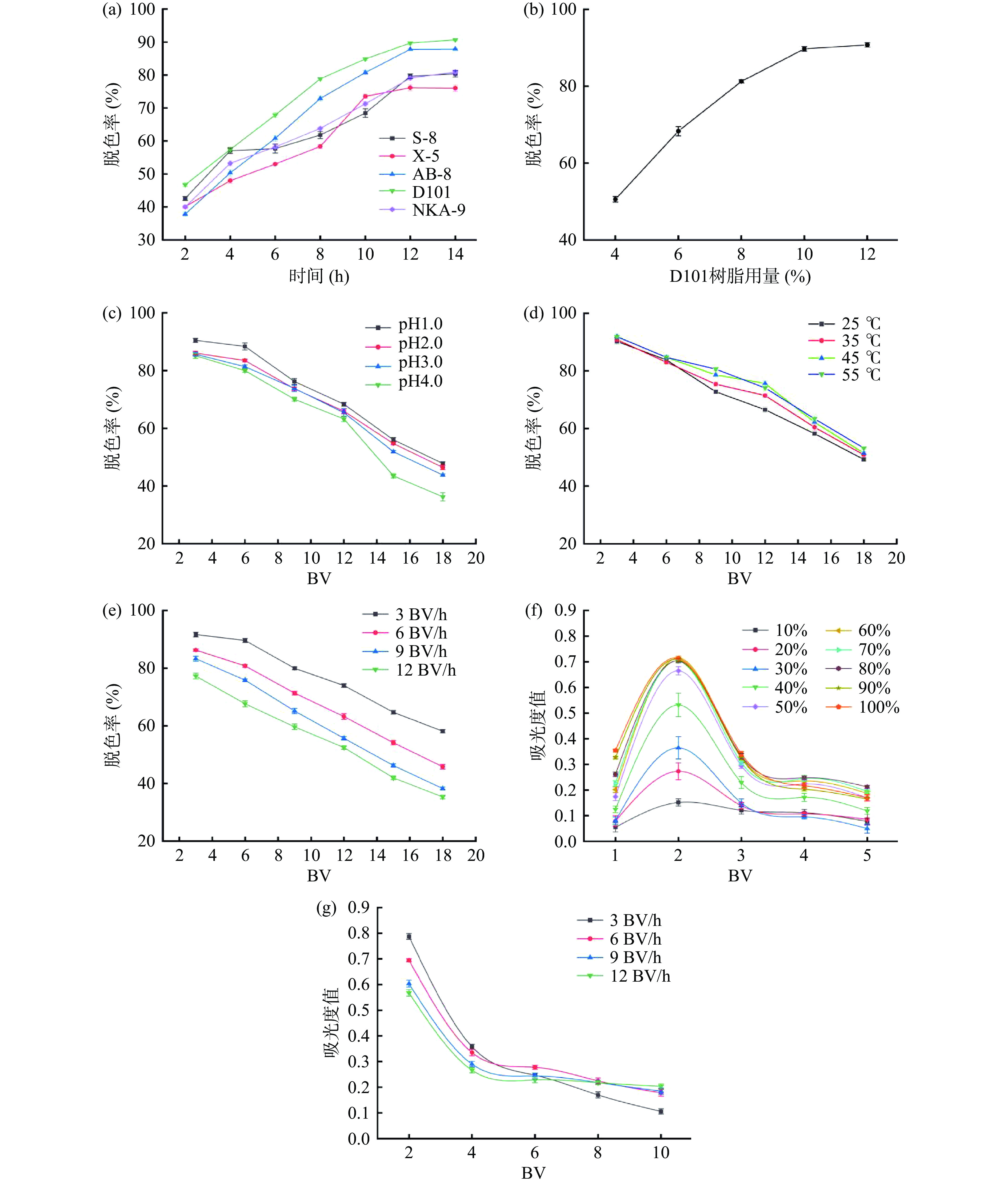
为了去除果胶提取液中的色素等,在室温下,选取S-8、X-5、D101、NKA-9和AB-8五种树脂进行静态脱色效果的比较。由图3(a)可知,五种树脂中D101的脱色率比其它树脂效果要好,这可能是由于D101树脂的极性与色素分子极性相似[33]。因此,采用D101树脂对果胶进行脱色,研究影响脱色的因素条件和洗脱条件。在温度25 ℃、100 r/min的搅拌下,调节树脂用量为4%、6%、8%、10%、12%,考察树脂用量对脱色效果的影响。由图3(b)可知,脱色率随着树脂用量的增加而提高,树脂用量大于10%其脱色率基本趋于恒定,因此,确定树脂用量为10%。
分别探讨了pH、温度以及脱色流速对果胶脱色效果的影响,分别讨论如下。在脱色流速为3 BV/h,温度为25 ℃时考察不同pH下果胶的脱色效果,由图3(c)可以看出,在较低pH时,色素被吸附,氢键-氢键之间的相互作用在大孔树脂吸附过程中起着重要的作用[34],pH的增加会使脱色率降低,由于酸性的减弱可能会导致果胶稳定性变差,容易增加果胶的损失,且提取时pH为2.0,为了节约成本,因此选择pH为2.0。固定脱色流速为3 BV/h和pH为2.0,考察不同温度下果胶的脱色效果,由图3(d)可以看出,温度的升高会使脱色率有所提高,可能是由于在吸附过程中,也存在着解吸过程,一方面,温度的升高会使加速分子的热运动,从而会增大其与树脂的接触,使吸附容量有所增加,另一方面,温度升高也会加速分子从吸附树脂上解吸下来,吸附容量的降低,使得整体处于动态平衡中[35],但温度在提高过程中,脱色率相差不大,因此采用 25 ℃ 为脱色温度。在 pH 为2.0和温度为25 ℃时,考察脱色流速对果胶脱色效果的影响,由图3(e)可以看出,脱色流速的大小对脱色效果的影响较大,这主要是由于脱色流速慢,使得上柱液中色素成分在树脂床中充分进行粒扩散和膜扩散,加大提取液在柱内的停留时间,使其可被充分吸收[36]。因此,将选用3 BV/h作为最佳脱色流速。
选择乙醇为洗脱剂,分别探讨了乙醇浓度和解吸流速对解吸效果的影响。在乙醇流速为3 BV/h时研究不同乙醇浓度下的解吸效果,由图3(f)可以看出,在乙醇浓度10%~60%时,随着乙醇浓度的升高,解吸效果增长比较快,而在60%~100%时,乙醇浓度对解吸效果影响不再明显,这可能由于色素分为水溶性色素和醇溶性色素,所以会存在最佳乙醇浓度[37]。因此,采用60%乙醇浓度为最佳解吸浓度。在乙醇浓度为60%的条件下考察不同解吸流速下的解吸效果,由图3(g)可以看出,解吸流速越小解吸效果越好,因此,将选用3 BV/h作为解吸流速。果胶溶液动态吸附脱色条件为:10%的D101大孔吸附树脂,25 ℃,pH为2.0的提取液以3 BV/h的脱色流速,脱色率达91.75%,最佳解吸条件为:60%乙醇溶液在3 BV/h的流速下进行解吸,在此最佳条件下平行进行了三次验证性实验,证明该工艺条件的稳定性。
2.4 果胶的结构表征
2.4.1 红外光谱分析
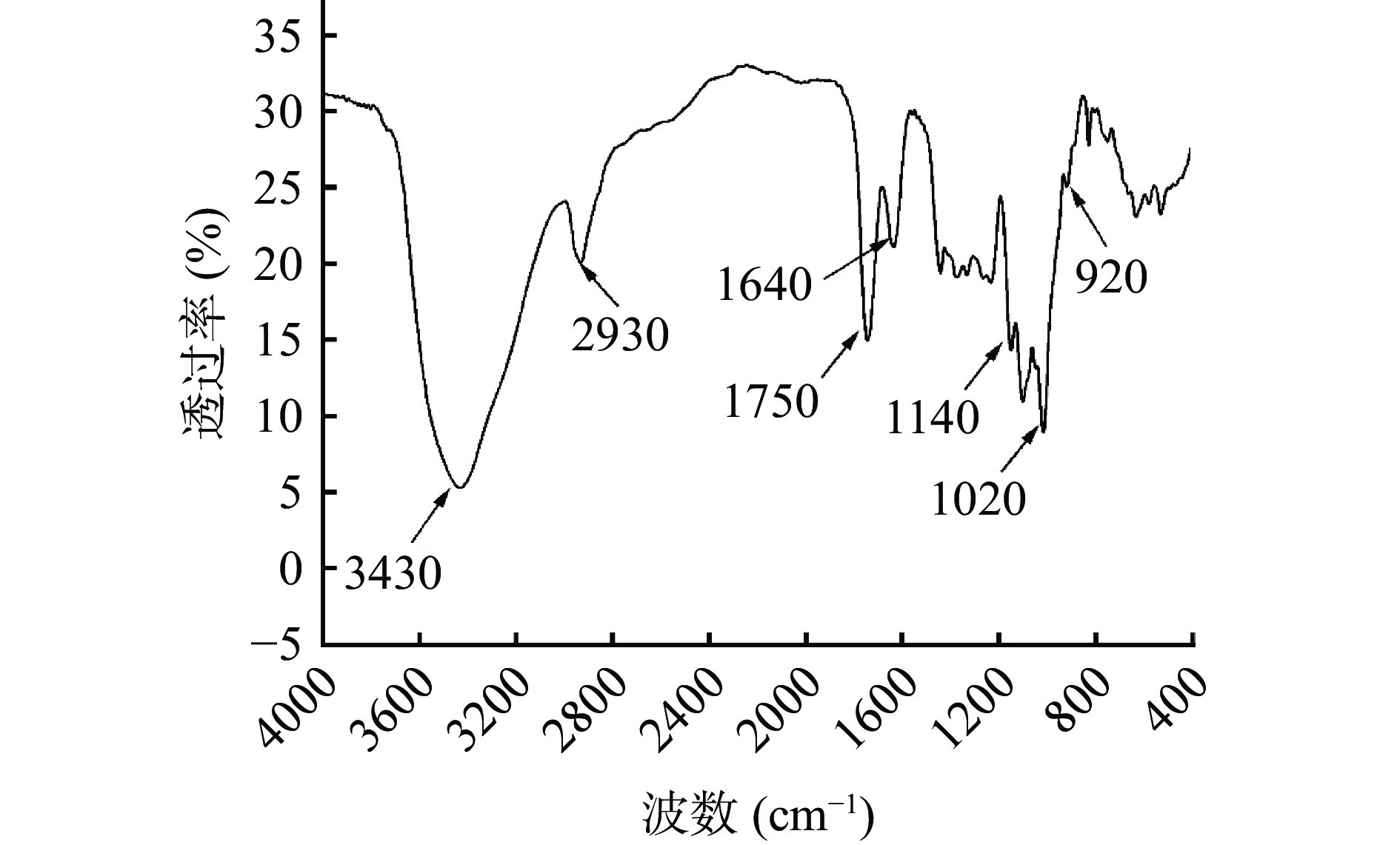
果胶在4000~400 cm−1范围内的红外光谱如图4所示。3430 cm−1附近的宽峰是由O-H的伸缩振动引起的[38];2930 cm−1附近的峰为CH2中C-H吸收峰[39];1750 cm−1和1640 cm−1附近的峰分别为C=O的不对称伸缩振动的吸收峰和游离羧基的吸收峰[40];1400~1200 cm−1之间的吸收峰为C-H的变角振动[41];1140 cm−1和1020 cm−1附近的峰表明含有吡喃糖[42];920 cm−1附近为D-吡喃型糖的吸收峰[43]。1750 cm−1和1640 cm−1两个特征峰的存在,可说明得到的产物为果胶[44]。
2.4.2 HNMR分析
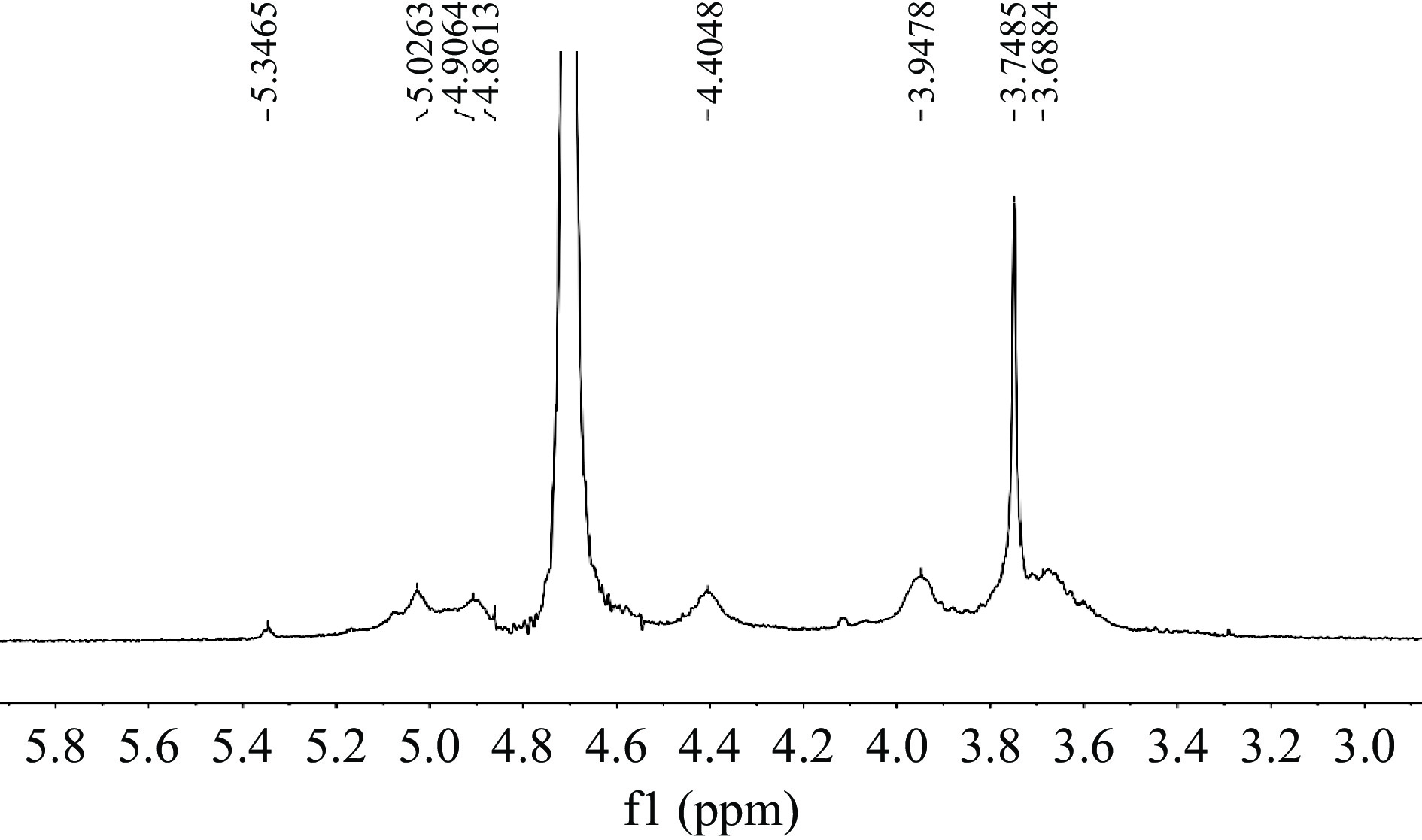
图5为果胶的核磁共振氢谱。在4.70 ppm附近处的信号峰为溶剂D2O的[45];在3.70 ppm附近处的信号峰较宽,可能是因为大分子的偶极相互作用从而影响了大分子的活动性而导致的[44];在5.30 ppm附近处的信号峰对应着α-半乳糖醛酸,从而确定果胶里含有半乳糖醛酸结构[9]。
3. 结论
对白葡萄酒酒泥中的果胶通过酸提、醇沉和大孔树脂脱色,成功提取了酒泥中果胶,最佳提取工艺条件为:料液比1:14 g/mL、pH为2.0、提取温度65 ℃、提取时间90 min,在此条件下进果胶得率为6.48%,影响果胶提取工艺的因素顺序为:料液比>提取温度>提取时间>pH。D101树脂对酒泥中果胶提取液脱色效果最佳,在温度25 ℃、pH为2.0、脱色流速3 BV/h,解吸液为60%(v/v)乙醇,流速3 BV/h的条件下进行脱色处理,在此条件脱色率可达91.75%。
采用酸提醇沉法可以实现对葡萄酒酒泥中果胶的提取,使用D101树脂对果胶进行脱色可以明显提高果胶质量。上述研究为葡萄酒泥资源的高值化利用提供了方向,为工业化生产工艺设计提供了基础数据。
-
表 1 响应面因素水平设计
Table 1 Factor level design of response surface
因素 水平 −1 0 1 A料液比(g/mL) 1:10 1:15 1:20 B pH 1 2 3 C提取温度(℃) 60 65 70 D提取时间(min) 60 90 120 表 2 响应面试验设计条件及结果
Table 2 Design conditions and results of response surface experiment
试验号 A B C D Y(%) 1 0 −1 −1 0 4.28 2 −1 1 0 0 5.05 3 0 0 1 1 4.09 4 −1 0 1 0 4.31 5 1 1 0 0 3.05 6 0 0 1 −1 4.29 7 0 0 0 0 6.42 8 0 1 1 0 3.88 9 0 −1 0 1 4.45 10 0 1 0 −1 4.22 11 1 −1 0 0 3.71 12 1 0 −1 0 3.08 13 0 0 0 0 6.47 14 1 0 0 −1 3.29 15 0 −1 0 −1 4.76 16 −1 0 0 1 4.99 17 1 0 0 1 3.33 18 0 0 0 0 6.31 19 1 0 1 0 2.89 20 0 1 0 1 4.81 21 0 0 0 0 6.43 22 0 0 −1 −1 4.11 23 0 0 −1 1 4.77 24 0 1 −1 0 4.15 25 −1 0 −1 0 4.47 26 −1 −1 0 0 4.59 27 0 −1 1 0 4.08 28 0 0 0 0 6.45 29 −1 0 0 −1 4.83 表 3 回归方程的方差分析
Table 3 Variance analysis of regression equation
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 30.51 14 2.18 302.24 <0.0001 ** A 6.59 1 6.59 913.41 <0.0001 ** B 0.042 1 0.042 5.83 0.0301 * C 0.1452 1 0.1452 20.14 0.0005 ** D 0.0736 1 0.0736 10.21 0.0065 ** AB 0.3136 1 0.3136 43.49 <0.0001 ** AC 0.0002 1 0.0002 0.0312 0.8623 AD 0.0036 1 0.0036 0.4993 0.4914 BC 0.0012 1 0.0012 0.1699 0.6864 BD 0.2025 1 0.2025 28.08 0.0001 ** CD 0.1849 1 0.1849 25.64 0.0002 ** A2 12.79 1 12.79 1773.95 <0.0001 ** B2 6.16 1 6.16 853.87 <0.0001 ** C2 11.01 1 11.01 1527.36 <0.0001 ** D2 4.8 1 4.8 666.12 <0.0001 ** 残差 0.1009 14 0.0072 失拟项 0.0854 10 0.0085 2.2 0.2323 不显著 纯误差 0.0155 4 0.0039 总和 30.61 28 R2 0.9967 R2adj 0.9934 注:*:差异显著,P<0.05;**:差异高度显著,P<0.01。 -
[1] 郭志君, 张王飞, 江璐, 等. 葡萄酒泥高价值产物开发及生物炼制研究概况[J]. 食品与机械,2021,37(5):221−226. [GUO Zhijun, ZHANG Wangfei, JIANG Lu, et al. Development of high value products of wine puree and research on biorefinery[J]. Food and Machinery,2021,37(5):221−226. doi: 10.13652/j.issn.1003-5788.2021.05.039 [2] 袁佳璐, 王志磊, 袁春龙. 赤霞珠葡萄酒泥的改性处理及性能研究[J]. 食品科技,2022,47(3):71−76. [YUAN Jialu, WANG Zhilei, YUAN Chunlong. Study on modification and properties of cabernet sauvignon wine mud[J]. Food Technology,2022,47(3):71−76. doi: 10.3969/j.issn.1005-9989.2022.3.spkj202203011 [3] MASKEY B, DHAKAL D, PRADHANANGA M, et al. Extraction and process optimization of bael fruit pectin[J]. Food Science & Nutrition,2018,6(7):1927−1932.
[4] 韩瑞, 邓红, 周文珊, 等. 苹果渣果胶树脂吸附静态与动态脱色工艺研究[J]. 食品工业科技,2010,31(6):254−258. [HAN Rui, DENG Hong, ZHOU Wenshan, et al. Study on static and dynamic decoloration of apple pomace by pectin resin[J]. Food Industry Technology,2010,31(6):254−258. doi: 10.13386/j.issn1002-0306.2010.06.007 [5] 杨宇华, 徐晓斌, 黄佳艳. 响应面法优化超声波辅助提取沃柑皮中果胶工艺研究[J]. 中国食品添加剂,2022,33(4):55−62. [YANG Yuhua, XU Xiaobin, HUANG Jiayan. Optimization of ultrasonic assisted extraction of pectin from citrus peel by response surface methodology[J]. Chinese Food Additives,2022,33(4):55−62. doi: 10.19804/j.issn1006-2513.2022.04.008 [6] 白小东, 程超, 牛黎莉, 等. 响应面法优化超声波辅助提取南瓜皮中果胶的工艺[J]. 中国食品添加剂,2021,32(4):50−56. [BAI Xiaodong, CHENG Chao, NIU Lili, et al. Optimization of ultrasonic assisted extraction of pectin from pumpkin peel by response surface methodology[J]. Chinese Food Additives,2021,32(4):50−56. doi: 10.19804/j.issn1006-2513.2021.04.009 [7] FREITAS C, SOUSA R, DIAS M, et al. Extraction of pectin from passion fruit peel[J]. Food Engineering Reviews,2020,12(4):460−472. doi: 10.1007/s12393-020-09254-9
[8] KAMAL M M, ALI M R, HOSSAIN A, et al. Optimization of microwave-assisted extraction of pectin from dillenia indica fruit and its preliminary characterization[J]. Journal of Food Processing and Preservation,2020,44(6):e14466.
[9] PETKOWICZ C, WILLIAMS P A. Pectins from food waste: Characterization and functional properties of a pectin extracted from broccoli stalk[J]. Food Hydrocolloids,2020,107:105930. doi: 10.1016/j.foodhyd.2020.105930
[10] 冯李院, 刘经伦, 杨梅福, 等. 响应面微波辅助酸法优化提取西兰花茎果胶多糖[J]. 食品研究与开发,2022,43(8):124−132. [FENG Liyuan, LIU Jinglun, YANG Meifu, et al. Optimization of extracting pectin polysaccharides from broccoli stems by response surface methodology and microwave-assisted acid extraction[J]. Food Research and Development,2022,43(8):124−132. doi: 10.12161/j.issn.1005-6521.2022.08.017 [11] 杜国军, 孟凡龙, 田英华, 等. 柠檬酸-纤维素酶法提取甜菜果胶的研究[J]. 中国调味品,2019,44(1):54−57. [DU Guojun, MENG Fanlong, TIAN Yinghua, et al. Study on extracting sugar beet pectin by citric acid cellulase method[J]. China Condiment,2019,44(1):54−57. doi: 10.3969/j.issn.1000-9973.2019.01.012 [12] JAFARZADEH-MOGHADDAM M, SHADDEL R, PEIGHAMBARDOUST S H. Sugar beet pectin extracted by ultrasound or conventional heating: A comparison[J]. Journal of Food Science and Technology,2021,58(7):2567−2578. doi: 10.1007/s13197-020-04763-1
[13] 张慧芳, 贾梦梦, 王君, 等. 超声波辅助提取葡萄皮渣果胶工艺研究[J]. 大众标准化,2022(5):175−177. [ZHANG Huifang, JIA Mengmeng, WANG Jun, et al. Study on ultrasonic assisted extraction of pectin from grape skin residue[J]. Mass Standardization,2022(5):175−177. doi: 10.3969/j.issn.1007-1350.2022.05.060 [14] 李力. 酿酒葡萄皮渣果胶提取的最佳工艺研究[J]. 食品工业,2013,34(11):84−86. [LI Li. Study on the best technology of extracting pectin from grape skin residue[J]. Food Industry,2013,34(11):84−86. [15] 王雅婷, 陈国刚, 刘娅, 等. 籽瓜瓜瓤中提取果胶的工艺研究[J]. 食品工业,2013,34(3):30−33. [WANG Yating, CHEN Guogang, LIU Ya, et al. Study on extracting pectin from seed melon[J]. Food Industry,2013,34(3):30−33. [16] 让凤菊, 王俊龙, 刘伟, 等. 西兰花茎果胶的提取及理化性质研究[J]. 食品研究与开发,2022,43(16):104−110. [RANG Fengju, WANG Junlong, LIU Wei, et al. Study on extraction and physicochemical properties of pectin from broccoli stems[J]. Food Research and Development,2022,43(16):104−110. doi: 10.12161/j.issn.1005-6521.2022.16.013 [17] 石然然. 豆腐柴果胶的提取纯化及其在凝固型酸奶中的应用[D]. 合肥: 安徽农业大学, 2018 SHI Ranran. Extraction and purification of tofu wood pectin and its application in coagulated yoghurt[D]. Hefei: Anhui Agricultural University, 2018.
[18] 胡迎丽, 夏璐, 雷福厚. 大孔吸附树脂在天然产物的分离纯化中的应用进展[J]. 化工技术与开发,2021,50(11):29−34. [HU Yingli, XIA Lu, LEI Fuhou. Progress in the application of macroporous adsorption resins in the separation and purification of natural products[J]. Chemical Technology and Development,2021,50(11):29−34. doi: 10.3969/j.issn.1671-9905.2021.11.009 [19] 吴娜. 响应面优化大孔树脂纯化金兰柚果胶[J]. 食品工业,2017,38(2):132−134. [WU Na. Response surface optimization of macropore resin for purification of golden orchid pectin[J]. Food Industry,2017,38(2):132−134. [20] 张沛, 吴楠, 宋志军, 等. 响应面法优化大孔树脂纯化黄芪毛蕊异黄酮工艺[J]. 食品工业科技,2021,42(10):209−214. [ZHANG Pei, WU Nan, SONG Zhijun, et al. Optimization of purification process of astragalus trichotil isoflavones with macroporous resin by response surface methodology[J]. Food Industry Technology,2021,42(10):209−214. doi: 10.13386/j.issn1002-0306.2020110048 [21] 安仕豪. 籽瓜中果胶和L-瓜氨酸提取工艺的研究[D]. 乌鲁木齐: 新疆农业大学, 2017 AN Shihao. Study on the extraction technology of pectin and L-citrulline from seed melon[D]. Wulumuqi: Xinjiang Agricultural University, 2017.
[22] 游新侠. 苹果渣中果胶提取、纯化及不同分子量果胶特性的研究[D]. 西安: 陕西师范大学, 2007 YOU Xinxia. Study on extraction and purification of pectin from apple pomace and characteristics of pectin with different molecular weight[D]. Xian: Shaanxi Normal University, 2007.
[23] 赵俭波, 姜建辉, 秦少伟, 等. 响应面法优化慕萨莱思酒泥果胶超声辅助提取工艺[J]. 食品科技,2016,41(10):171−176. [ZHAO Jianbo, JIANG Jianhui, QIN Shaowei, et al. Optimization of ultrasonic assisted extraction of pectin from musales wine puree by response surface methodology[J]. Food Technology,2016,41(10):171−176. doi: 10.13684/j.cnki.spkj.2016.10.037 [24] 孙彦妮. 葡萄皮果胶的提取及在制剂中的应用[D]. 青岛: 青岛科技大学, 2018 SUN Yanni. Extraction of grape peel pectin and its application in preparation[D]. Qingdao: Qingdao University of Science and Technology, 2018.
[25] 金科旭, 戴小华, 谷虹霏, 等. 大孔树脂纯化野山杏总黄酮工艺[J]. 新疆农业科学,2022,59(4):900−907. [JIN Kexu, DAI Xiaohua, GU Hongfei, et al. Purification of total flavonoids from wild apricot by macroporous resin[J]. Xinjiang Agricultural Sciences,2022,59(4):900−907. doi: 10.6048/j.issn.1001-4330.2022.04.014 [26] 张雪丹, 杨娟侠, 王丹, 等. 柿果胶提取工艺优化及理化性质研究[J]. 食品工业科技,2018,39(8):147−153. [ZHANG Xuedan, YANG Juanxia, WANG Dan, et al. Study on the extraction process optimization and physicochemical properties of persimmon pectin[J]. Food Industry Technology,2018,39(8):147−153. doi: 10.13386/j.issn1002-0306.2018.08.027 [27] 夏天添, 梁瑞红, 刘成梅, 等. 橙皮果胶的提取及性质研究[J]. 食品工业科技,2011,32(11):234−236, 240. [XIA Tiantian, LIANG Ruihong, LIU Chengmei, et al. Study on the extraction and properties of orange peel pectin[J]. Food Industry Technology,2011,32(11):234−236, 240. doi: 10.13386/j.issn1002-0306.2011.11.093 [28] KORISH M. Potential utilization of Citrullus lanatus var. colocynthoides waste as a novel source of pectin[J]. Journal of Food Science and Technology,2015,52(4):2401−2407. doi: 10.1007/s13197-014-1277-y
[29] LIU S, SHI X, XU L, et al. Optimization of pectin extraction and antioxidant activities from Jerusalem artichoke[J]. Chinese Journal of Oceanology and Limnology,2016,34(2):372−381. doi: 10.1007/s00343-015-4314-4
[30] KORISH M. Faba bean hulls as a potential source of pectin[J]. Journal of Food Science and Technology,2015,52(9):6061−6066. doi: 10.1007/s13197-014-1688-9
[31] MÜLLER-MAATSCH J, BENCIVENNI M, CALIGIANI A, et al. Pectin content and composition from different food waste streams[J]. Food Chemistry,2016,201:37−45. doi: 10.1016/j.foodchem.2016.01.012
[32] 李靓, 朱涵彬, 李长滨, 等. 正交法优化超声波提取橘皮果胶的工艺研究[J]. 中国调味品,2022,47(2):173−176. [LI Liang, ZHU Hanbin, LI Changbin, et al. Optimization of ultrasonic extraction of pectin from orange peel by orthogonal design[J]. China Condiment,2022,47(2):173−176. doi: 10.3969/j.issn.1000-9973.2022.02.035 [33] 王巍, 李丹丹, 牟德华. 山楂果胶树脂脱色工艺优化[J]. 中国食品添加剂,2016(12):175−181. [WANG Wei, LI Dandan, MOU Dehua. Optimization of decolorization process of hawthorn pectin resin[J]. Chinese Food Additives,2016(12):175−181. doi: 10.3969/j.issn.1006-2513.2016.12.021 [34] OLIVEIRA T Í S, ROSA M F, CAVALCANTE F L, et al. Optimization of pectin extraction from banana peels with citric acid by using response surface methodology[J]. Food Chemistry,2016,198:113−118. doi: 10.1016/j.foodchem.2015.08.080
[35] HADAVIFAR M, YOUNESI H, ZINATIZADEH A A, et al. Application of integrated ozone and granular activated carbon for decolorization and chemical oxygen demand reduction of vinasse from alcohol distilleries[J]. Journal of Environmental Management,2016,170:28−36. doi: 10.1016/j.jenvman.2016.01.009
[36] 吴国利. 甜菜粕果胶树脂脱色工艺及不同分子量脱色果胶的特性研究[D]. 广州: 华南理工大学, 2013 WU Guoli. Study on decolorization technology of beet pulp pectin resin and characteristics of decolorized pectin with different molecular weight[D]. Guangzhou: South China University of Technology, 2013.
[37] 周尽花, 周春山. 大孔吸附树脂法柚皮果胶脱色工艺研究[J]. 离子交换与吸附,2005(6):542−550. [ZHOU Jinhua, ZHOU Chunshan. Study on decolorization of pomelo peel pectin by macroporous adsorption resin[J]. Ion Exchange and Adsorption,2005(6):542−550. doi: 10.3321/j.issn:1001-5493.2005.06.010 [38] 张璇. 柚子皮果胶的提取及其复合材料的制备及性能研究[D]. 上海: 东华大学, 2013 ZHANG Xuan. Study on the extraction of pectin from pomelo peel and the preparation and properties of its composites[D]. Shanghai: Donghua University, 2013.
[39] 庄虎. 石榴皮渣果胶乳化特性及其应用研究[D]. 武汉: 湖北工业大学, 2019 ZHUANG Hu. Study on the emulsifying characteristics and application of pomegranate peel residue pectin[D]. Wuhan: Hubei University of Technology, 2019.
[40] LU J, LI J, JIN R, et al. Extraction and characterization of pectin from Premna microphylla Turcz. leaves[J]. International Journal of Biological Macromolecules,2019,131:323−328. doi: 10.1016/j.ijbiomac.2019.03.056
[41] 庄远红, 刘静娜, 费鹏, 等. 模拟胃环境下柚皮果胶对亚硝酸根的吸附动力学[J]. 西南大学学报(自然科学版),2018,40(12):65−72. [ZHUANG Yuanhong, LIU Jingna, FEI Peng, et al. Adsorption kinetics of nitrite by pomelo peel pectin in simulated gastric environment[J]. Journal of Southwest University (Natural Science Edition),2018,40(12):65−72. [42] YU M, XIA Y, ZHOU M, et al. Effects of different extraction methods on structural and physicochemical properties of pectins from finger citron pomace[J]. Carbohydrate Polymers,2021,258:117662. doi: 10.1016/j.carbpol.2021.117662
[43] 李萍, 闫静坤, 汪青青, 等. 陈皮果胶的提取与纯化[J]. 河南工业大学学报(自然科学版),2017,38(3):67−72. [LI Ping, YAN Jingkun, WANG Qingqing, et al. Extraction and purification of orange peel pectin[J]. Journal of Henan University of Technology (Natural Science Edition),2017,38(3):67−72. doi: 10.3969/j.issn.1673-2383.2017.03.012 [44] 郭祖锋. 甘薯渣中果胶提取纯化及物化特性研究[D]. 新乡: 河南科技学院, 2012 GUO Zufeng. Study on extraction, purification and physicochemical characteristics of pectin from sweet potato residue[D]. Xinxiang: Henan University of Science and Technology, 2012.
[45] 熊宝仪. 黄秋葵酸溶性果胶的制备及其抗氧化、抗胰腺炎活性研究[D]. 合肥: 合肥工业大学, 2021 XIONG Baoyi. Preparation of acid-soluble pectin from okra and study on its antioxidant and anti-pancreatitis activities[D]. Hefei: Hefei Polytechnic University, 2021.
-
期刊类型引用(1)
1. 林瑾,谢勇,叶倩倩. 正交试验优化橄榄渣果胶酸法提取工艺. 福建农业科技. 2023(06): 68-72 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:




 下载:
下载:



