Optimization of Enzymatic Transformation Process for Different Forms of Polyphenols from Blueberry Pulp and Its Antioxidant Activity Analysis
-
摘要: 本研究以蓝莓果浆为材料,利用酶法转化促进结合态多酚释放为游离态多酚,并研究不同形态多酚抗氧化活性。利用不同酶制剂酶解,以游离态多酚转化率为指标,筛选最适复合酶组合,并采用单因素实验和Box-Behnken响应面试验确定最优酶解条件;以FRAP抗氧化能力和ABTS抗氧化能力进行抗氧化活性分析。结果表明最优酶解条件为:以果胶酶和纤维素酶作为复合酶(配比为4:6),复合酶用量2.8%、酶解温度50 ℃、酶解时间124 min。在此条件下,与对照组相比,酶解蓝莓果浆游离态多酚转化率可达83.47%,提高了9.96%;酶解蓝莓果浆游离态多酚含量(343.58 mg GAE/100 g FW)提高27.67%,结合态多酚含量(68.03 mg GAE/100 g FW)降低29.84%。体外抗氧化活性结果表明,酶解蓝莓果浆游离态多酚提取物的FRAP抗氧化能力和ABTS抗氧化能力分别提高了15.45%和27.25%,总酚提取物的FRAP抗氧化能力和ABTS抗氧化能力分别提高了6.81%和15.62%。本研究表明,酶解促进了蓝莓果浆游离态多酚的转化,并增强了蓝莓果浆的抗氧化能力,为蓝莓功能活性产品研发与加工工艺提供了理论依据。Abstract: In this study, blueberry pulp was used as the material to promote the release of bound polyphenols into free polyphenols by enzymatic transformation. The antioxidant activities of different forms of polyphenols were investigated. With the conversion rate of free polyphenols as the index, the optimal combination of different enzymes was screened. The single-factor test and the Box-Behnken response surface test were used to determine the optimal enzymatic hydrolysis parameters. The antioxidant activity was measured by FRAP and ABTS assays. The results showed that the optimal enzymatic hydrolysis conditions were as follows: Complex enzyme was composed of pectinase and cellulase with a ratio of 4:6, the dosage of complex enzyme was 2.8%, the hydrolysis temperature was 50 ℃, and the hydrolysis time was 124 min. Compared with the control group, the conversion rate of free polyphenols in enzymatic blueberry pulp was 83.47%, which was increased by 9.96%. The content of free polyphenols in enzymatic blueberry pulp (343.58 mg GAE/100 g FW) was increased by 27.67%, and the content of bound polyphenols (68.03 mg GAE/100 g FW) was decreased by 29.84%. The results of antioxidant activity revealed that the FRAP and ABTS antioxidant capacity of free polyphenols extract in enzymatic blueberry pulp was elevated by 15.45% and 27.25%, respectively. The FRAP and ABTS antioxidant capacity of total polyphenols in enzymatic blueberry pulp was increased by 6.81% and 15.62%, respectively. These results indicates that enzymatic hydrolysis promotes the transformation of free polyphenols in blueberry pulp and enhanced the antioxidant capacity of blueberry pulp, which provides a theoretical basis for the development and processing of functional activity for blueberry products.
-
蓝莓(Blueberry)为杜鹃花科(Ericaceae)越橘属(Vaccinium)多年生落叶或常绿灌木[1]。蓝莓作为第三代世界水果,丰富的多酚成分赋予其抗氧化防衰老[2]、抑菌消炎[3]、调节血脂[4]、缓解视疲劳[5]等功效。越来越多的研究表明,多酚的健康功效不仅与其种类和数量相关,还与其在植物基质中的存在形态密切相关[6]。根据多酚的存在形态将其分为游离态多酚和结合态多酚。游离态多酚以单体形式被物理吸附或截留于植物基质中,其游离形态表现出良好的溶解性,易溶于水或有机溶剂。结合态多酚通过共价键与植物细胞壁物质(如:纤维素、木聚糖、果胶等)相结合,具有难萃取和难利用的特点[7]。研究显示,许多植物中游离态多酚的抗氧化活性和生物利用率高于结合态多酚,如蓝莓[8]、葡萄皮籽[9]、龙眼[10]、树莓渣[11]、红枣[12]、燕麦[13]等。因此越来越多的研究集中于生物转化促进结合态多酚的释放,即利用酶制剂水解或微生物发酵过程中产生的水解酶破坏细胞壁成分和结合态多酚糖苷键,从而将结合态多酚释放为游离态多酚[14]。与碱水解和酸水解相比,生物转化的条件更温和,避免了极端pH和高温导致的酚类物质损失[15-16]。
目前,关于蓝莓多酚生物转化的研究主要集中在乳酸菌发酵方面。如王储炎等[17]发现,嗜酸乳杆菌、干酪乳杆菌和副干酪乳杆菌均能不同程度提高蓝莓游离态酚酸含量,其中副干酪乳杆菌转化游离态多酚能力最强,并显著提高了蓝莓DPPH自由基清除能力和ABTS自由基清除能力。Gao等[8]报道,乳酸菌发酵过程中分泌的酶物质促进蓝莓游离态多酚的转化,且DPPH自由基清除能力和ABTS自由基清除能力分别提高了18.38%和10.63%。酶解促进多酚转化的研究多见于燕麦[13]、米糠[18]、藜麦[19]等谷物类,在蓝莓中鲜见报道。与微生物发酵相比,酶法转化的可控性更强、处理时间更短、效率更高。因此,本研究利用不同酶制剂酶解制备蓝莓果浆,以游离态多酚转化率为指标,筛选释放结合态多酚效果最好的两种酶,并采用单因素实验和Box-Behnken响应面试验设计确定最优酶解条件,以期为富含多酚和高生物活性的蓝莓功能性产品开发利用提供数据和理论支撑。
1. 材料与方法
1.1 材料与仪器
蓝莓冻果 贵州蓝瑞农业科技有限公司;果胶酶(500 U/mg)、纤维素酶(400 U/mg)、木聚糖酶(6000 U/mg)、葡聚糖酶(40 U/mg)、β-葡萄糖苷酶(12 U/mg) 上海源叶生物科技有限公司;无水乙醇、乙酸乙酯、浓盐酸 天津市富宇精细化工有限公司;氢氧化钠、碳酸钠 国药集团化学试剂有限公司;福林酚、没食子酸标准品、总抗氧化能力检测试剂盒(FRAP法) 北京索莱宝科技有限公司;总抗氧化能力检测试剂盒(ABTS法) 南京建成生物工程研究所。
FA2004分析天平 上海精密科学仪器有限公司;Varioskan LUX多功能酶标仪 美国Thermo Fisher Sientific公司;H1850R台式高速冷冻离心机 湖南湘仪实验室仪器开发公司;KQ2200DA超声波清洗机 昆山市超声仪器有限公司;HB-10-S096旋转蒸发仪 德国IKA公司。
1.2 实验方法
1.2.1 酶解果浆制备
工艺流程[20]:蓝莓冻果→清洗→4 ℃解冻→打浆→酶解→灭酶。
蓝莓冻果经清洗、解冻、打浆后制成蓝莓果浆,取100 g蓝莓果浆,在一定的温度、加酶量为1000 U/g条件下酶解一定时间,酶解结束后100 ℃水浴5 min灭酶[21]。
1.2.2 蓝莓果浆多酚提取
1.2.2.1 游离态多酚提取
参考Gao等[8]的方法,并略作修改。称取100 g果浆,加入200 mL 60%乙醇溶液,超声提取10 min,频率为400 Hz,温度为45 ℃。然后5000 r/min 离心10 min,收集上清液。对沉淀重复以上操作3次,合并上清液。在45 ℃条件下旋蒸至无水状态,用蒸馏水溶解残余物,定容至50 mL,分装到10 mL离心管后冻存。
1.2.2.2 结合态多酚提取
参考Gao等[8]的方法,并略作修改。提取游离态多酚产生的沉淀物加入40 mL浓度为4 mol/L的NaOH溶液,水解3 h,再用6 mol/L HCl溶液调节pH至2.0,接着用乙酸乙酯(1:2,v/v)萃取5次,合并乙酸乙酯萃取相,在45 ℃条件下旋蒸至无水状态,用蒸馏水溶解残余物并定容至50 mL,分装至10 mL离心管后冻存。
1.2.3 酶制剂的筛选
根据1.2.1的方法,以不同酶制剂(果胶酶、木聚糖酶、纤维素酶、β-葡萄糖苷酶、β-葡聚糖酶)对蓝莓果浆进行酶解处理,酶量均为1000 U/g,研究不同酶制剂对游离态多酚转化率的影响。
1.2.4 复合酶比例确定
由酶制剂筛选结果得知,在相同酶解条件下,纤维素酶和果胶酶处理的蓝莓果浆游离态多酚转化率较高,且纤维素酶酶解效果优于果胶酶。因此,复合酶配比以纤维素酶为主,在固定总加酶量1000 U/g、温度55 ℃、酶解时间120 min条件下,以纤维素酶、果胶酶质量比为9:1、8:2、7:3、6:4、5:5的复配比例,向蓝莓果浆中加入复合酶,测定各处理组的游离态多酚转化率,以确定最佳复合酶比例。
1.2.5 单因素实验
根据预实验研究,固定考察因素为酶解时间120 min、酶解温度50 ℃、复合酶用量2.0%,分别研究酶解时间(60、90、120、150、180 min)、酶解温度(30、40、50、60、70 ℃)、复合酶用量(1.0%、1.5%、2.0%、2.5%、3.0%)三个单因素对蓝莓果浆游离态多酚转化率的影响,以确定各因素条件的最适范围[21]。
1.2.6 响应面试验设计
根据单因素实验结果,以游离态多酚转化率为响应值,采用Design Expert 8.0.6软件进行三因素三水平Box-Behnken响应面优化设计。试验因素与水平见表1。
表 1 响应面试验因素与水平Table 1. Factors and levels of response surface test水平 因素 A酶解温度(℃) B酶解时间(min) C复合酶用量(%) −1 40 90 2.0 0 50 120 2.5 1 60 150 3.0 1.2.7 多酚含量测定
参考王储炎等[17]方法,并略作修改。将提取液(游离态多酚提取液或结合态多酚提取液)于8000 r/min 4 ℃下离心15 min,吸取0.25 mL上清液于试管中,加入1.00 mL蒸馏水稀释5倍。取125 µL稀释液,加入0.5 mL去离子水和125 µL福林酚试剂,振荡均匀后在室温下静置6 min,然后加入1.25 mL 7.5%(m/v)的Na2CO3溶液和1 mL去离子水,振荡均匀后在室温下避光反应90 min,在760 nm波长下测定吸光值。以没食子酸为标准品,测得不同浓度下的吸光值;以没食子酸质量浓度为横坐标,吸光值为纵坐标,绘制标准曲线,得到没食子酸标准曲线:y=0.0016x+0.0344(R2=0.9991)。多酚含量结果以每100g果浆中所含的没食子酸当量表示,单位简写为mg GAE/100 g FW。总酚含量即为游离态多酚和结合态多酚含量的总和。多酚含量通过以下公式计算:
式中:C为通过标准曲线计算得到的质量浓度,mg/g;T为多酚提取液稀释倍数;m为蓝莓果浆提取液的总质量,g。
1.2.8 游离态多酚转化率计算
通过以下公式计算各样品中游离态多酚转化率[22]:
式中:T1为蓝莓果浆游离态多酚吸光值;T2为蓝莓果浆结合态多酚吸光值。
1.2.9 ABTS抗氧化能力测定
对蓝莓果浆酶解前后的游离态多酚提取物、结合态多酚提取物和总酚提取物进行ABTS抗氧化能力测定。测定方法参考总抗氧化能力检测试剂盒(ABTS法)提供的使用说明进行操作。
1.2.10 FRAP抗氧化能力测定
对蓝莓果浆酶解前后的游离态多酚提取物、结合态多酚提取物和总酚提取物进行FRAP抗氧化能力测定。测定方法参考总抗氧化能力检测试剂盒(FRAP法)提供的使用说明进行操作。
1.3 数据处理
以上处理均做3次平行实验,图表中数据为3次实验数据的平均值。利用软件Design-Expert8.0.6.1进行试验设计,软件Origin 2019进行绘图,软件SPSS19.0统计软件进行差异显著性分析(P<0.05)。
2. 结果与分析
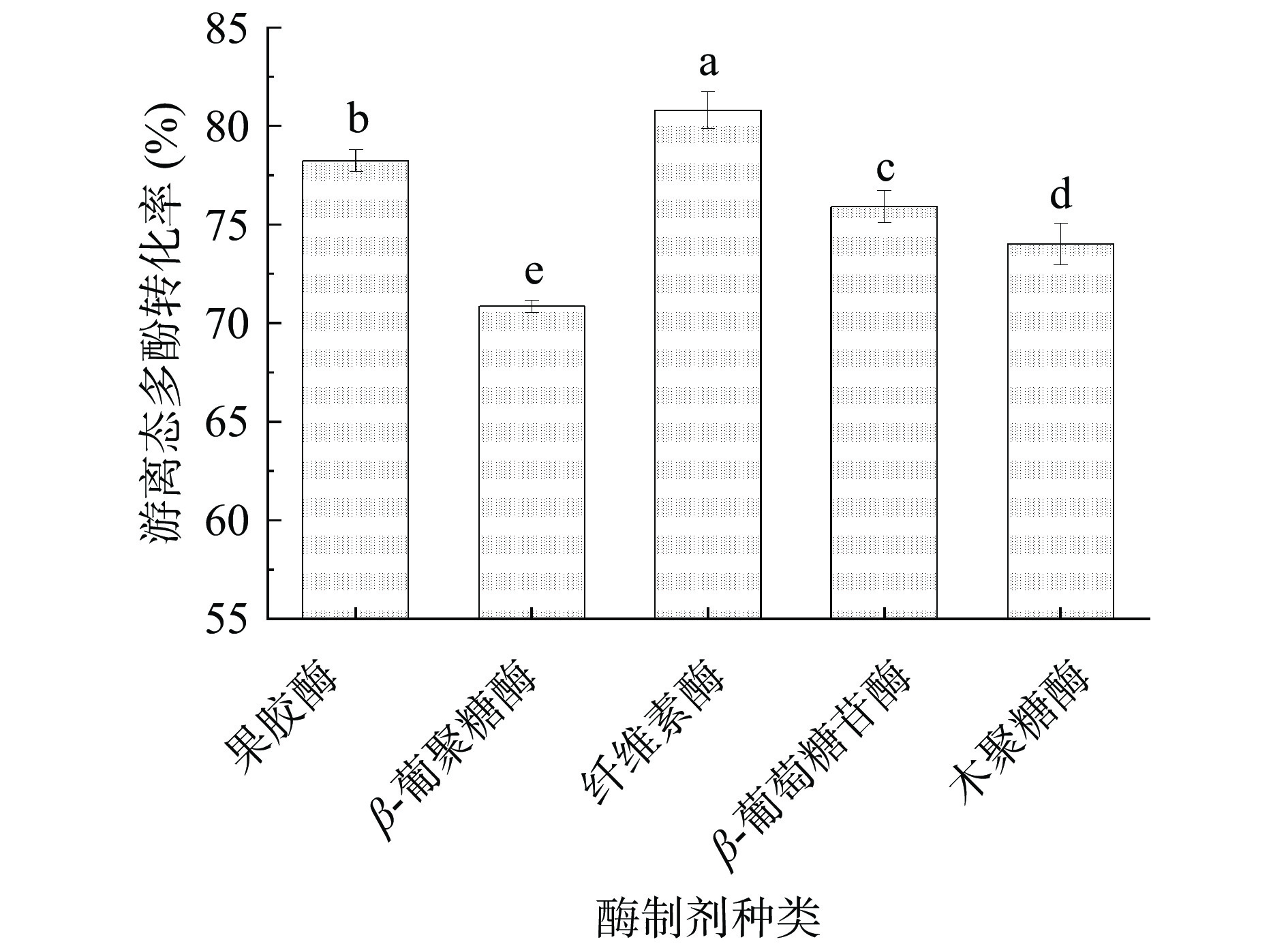
2.1 酶制剂筛选结果
由图1可知,纤维素酶转化游离态多酚的能力最好,显著高于其它酶(P<0.05),游离态多酚转化率为80.78%。说明纤维素酶水解结合态多酚糖苷键的能力更好,能够更多地释放出结合态多酚,获得更多的游离态多酚。这可能是因为纤维素酶是一种复合酶,能够内切或者外切细胞壁间连接的还原性或者非还原性纤维多糖链的末端,从而将更多的结合态多酚释放到基质中转化为易于提取的游离态多酚,使游离态多酚转化率提高[23-24]。除此之外,经果胶酶水解处理的样品游离态多酚转化率也高于其它三种酶制剂,其游离态多酚转化率可达78.23%。因此,选择纤维素酶和果胶酶复配,进行单因素实验和Box-Behnken响应面试验。
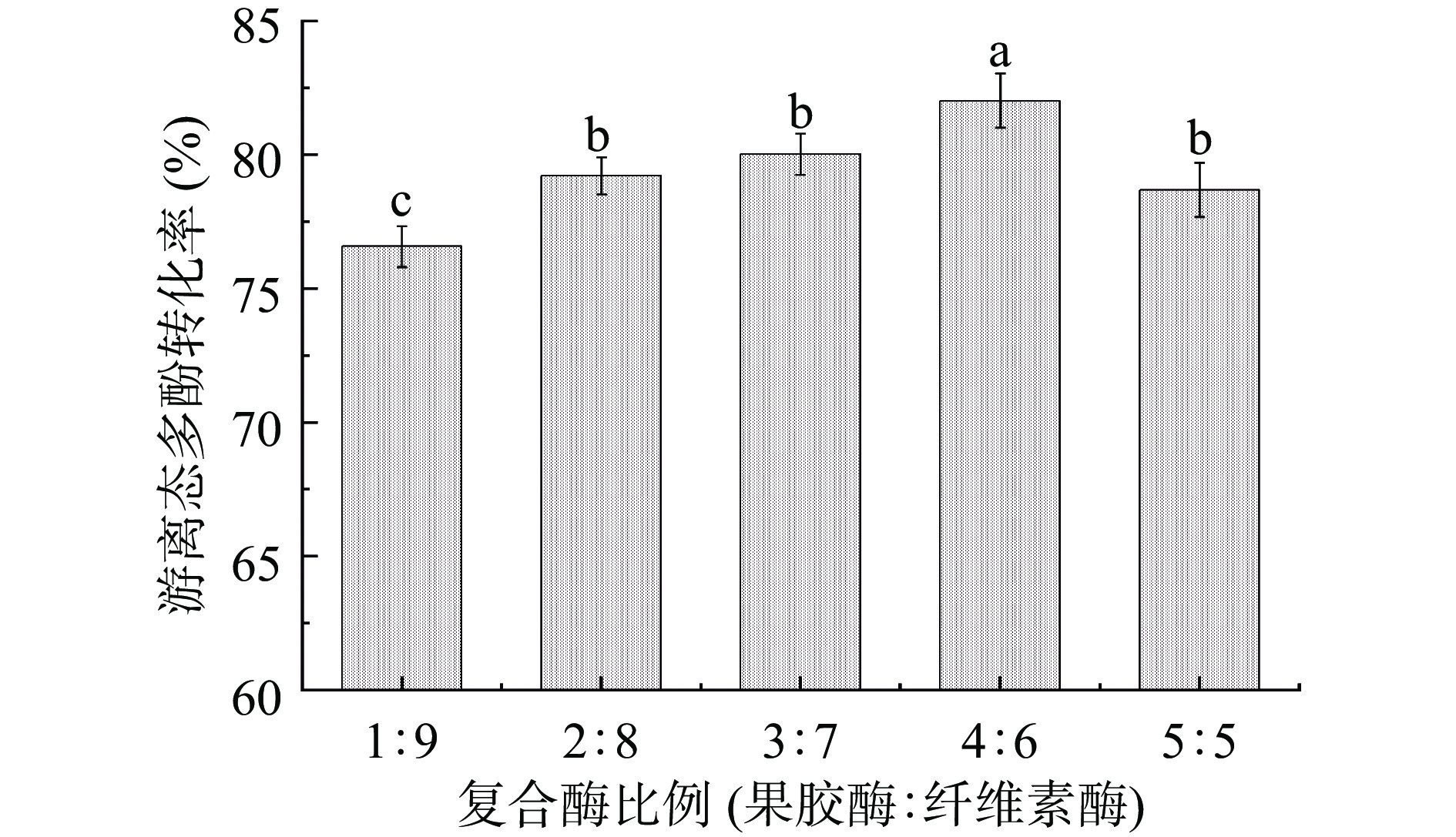
2.2 复合酶比例的确定
由图2可知,随着果胶酶的含量升高,游离态多酚转化率不断增加,在果胶酶与纤维素酶比例为4:6时,游离态多酚转化率达到最大,为82.01%。可能是因为蓝莓果浆细胞壁中果胶含量较高,较多的果胶酶可以促进果胶的裂解和细胞壁的破坏,从而转化更多游离态多酚[25]。当果胶酶与纤维素酶比例为5:5时,游离态多酚转化率反而下降,这可能是因为果胶酶在复合酶中的比例过大,导致复合酶的专一性过高,仅对果胶质间的α-1,4 糖苷键作用,而纤维素酶量过低,会影响其他成分的降解,使复合酶酶解效果下降[26]。若果胶酶添加比例过低,会导致胶质酶解不完全,降低酶解效果。因此,选择4:6为最适复合酶比例进行后续实验。
2.3 单因素实验结果
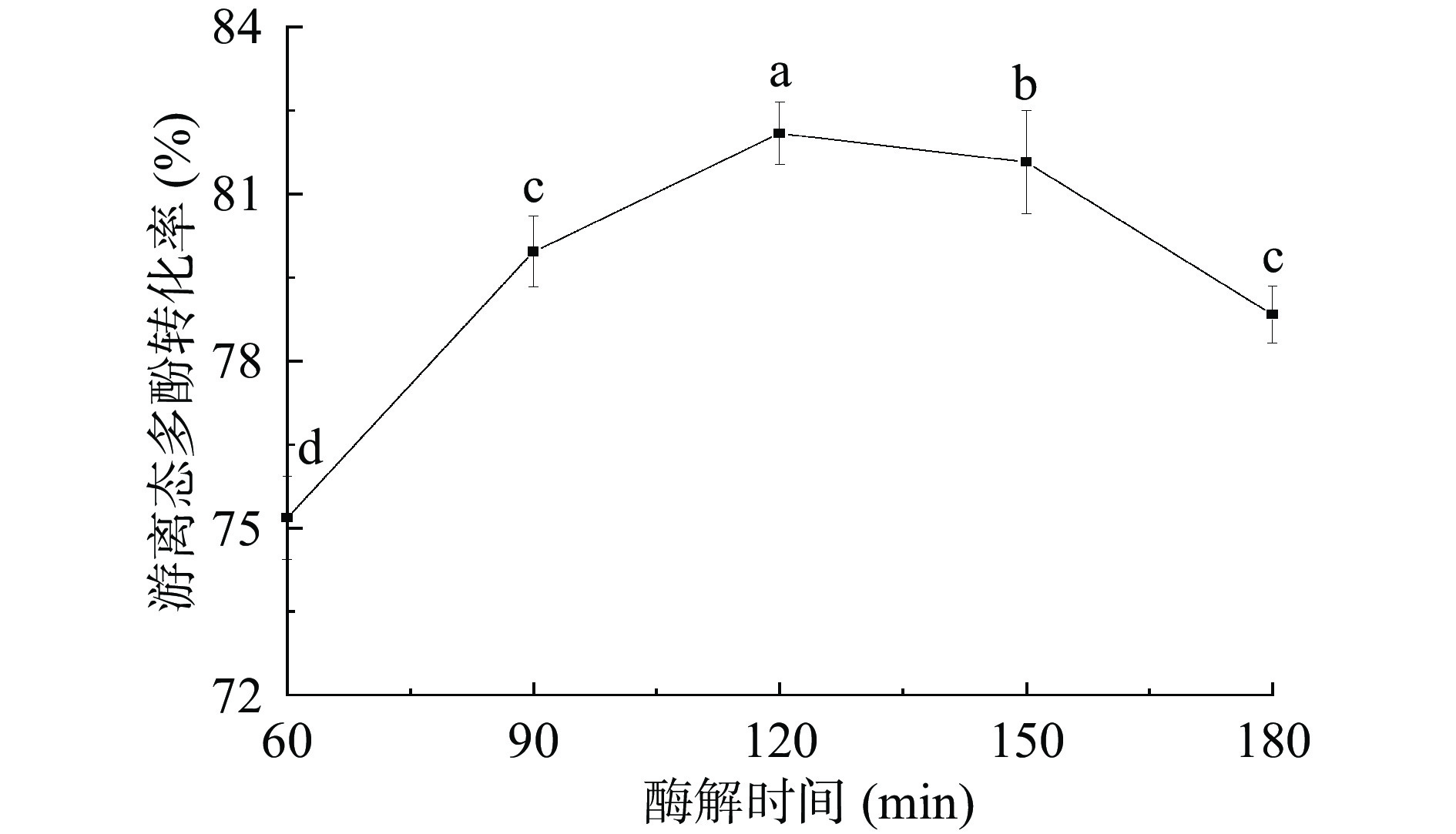
2.3.1 酶解时间对游离态多酚转化率的影响
由图3可知,游离态多酚转化率随着酶解时间的延长,呈现先上升后下降趋势。当酶解时间为120 min时,游离态多酚转化率达到最大,为82.09%。这与杨明静等[27]的研究结果类似,发酵过程中微生物产生的碳水化合物水解酶能够促进不可溶键合多酚的释放,随着时间的延长,不可溶键合多酚含量呈现先增加后减少的趋势。这可能是由于随着酶解时间延长,结合态多酚基本释放完全,导致含量不再增加。同时,由于多酚类物质不稳定,样品长期处于高温条件下,容易对多酚类物质造成不良破坏,最终导致转化率下降[28]。因此选择最佳酶解时间为120 min。
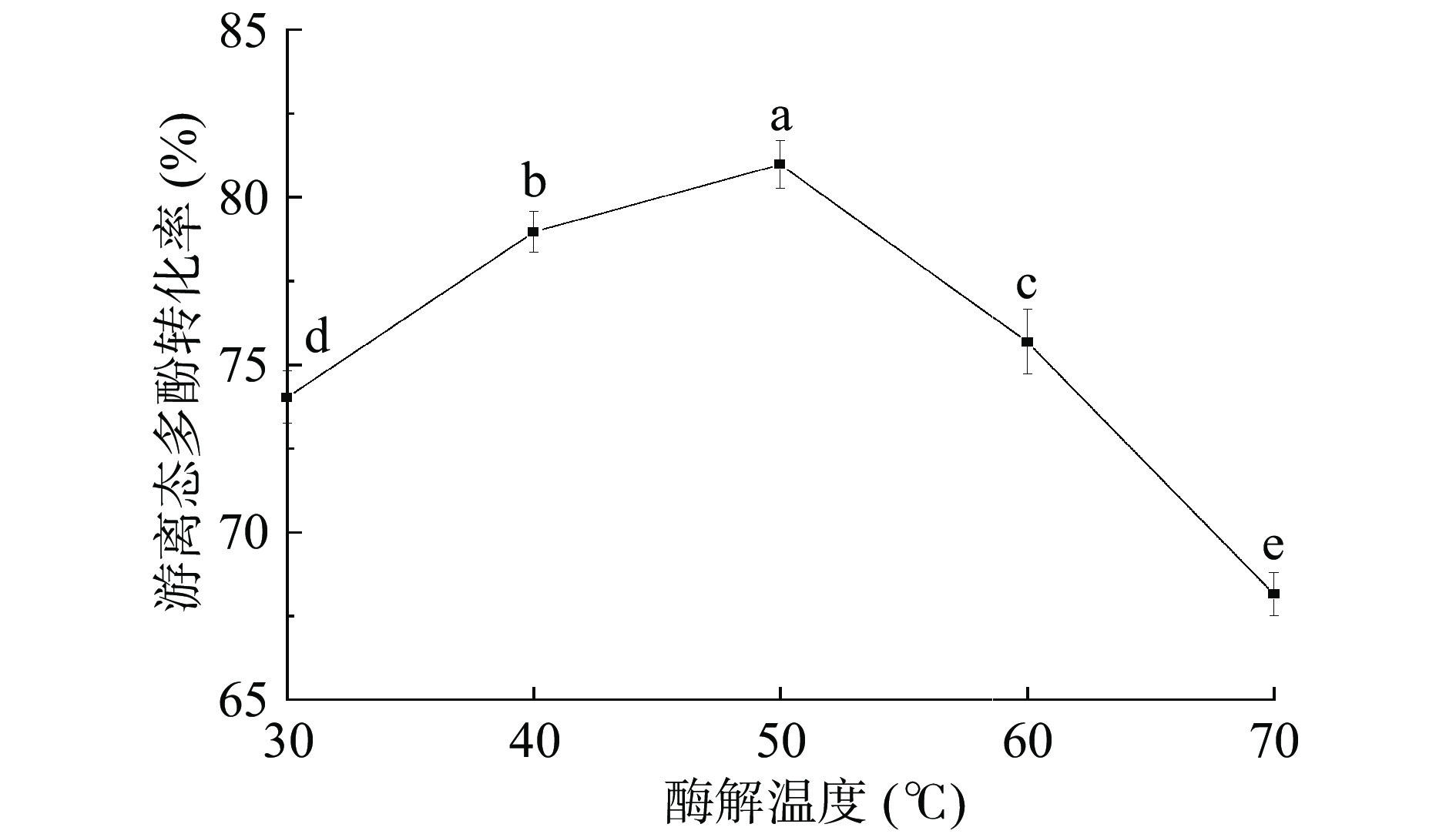
2.3.2 酶解温度对游离态多酚转化率的影响
由图4可知,游离态多酚转化率随着酶解温度的升高而增加,当温度升至50 ℃时,游离态多酚转化率达到最大值80.98%。当温度超过50 ℃后,游离态多酚转化率显著下降(P<0.05)。类似地,高阳等[29]的研究显示,随着酶解温度升高至55 ℃,结合态多酚的提取量达到最高;随着温度继续升高,提取量则出现下降。这主要是因为酶活力受温度影响较大,当温度接近酶活最佳温度时,酶解作用更高效,而温度过高或者过低都会显著影响酶的活性,进而影响游离态多酚转化率[30]。因此选择最佳酶解温度为50 ℃。
2.3.3 复合酶用量对游离态多酚转化率的影响
由图5可知,当复合酶用量较低时,随着加酶量的增加,游离态多酚转化率显著提高。当复合酶用量大于2.0%时,游离态多酚转化率的增幅逐渐趋缓;复合酶用量为2.5%时,游离态多酚转化率达到最大,为82.45%。因为反应体系中酚类物质的量一定,过多的酶用量只能加快酶解速度,而不能提高产量,并且会造成成本浪费[31]。因此,选择最佳复合酶用量为2.5%。
2.4 响应面试验结果
2.4.1 回归方程与检验
在单因素实验的基础上,以A酶解温度、B酶解时间、C复合酶用量为考察对象,游离态多酚转化率为响应值,利用Box-Behnken试验进行三因素三水平响应面优化分析,响应面试验设计及结果见表2所示。
表 2 Box-Behnken 实验设计及结果Table 2. Experimental design and results for Box-Behnken试验号 A酶解温度 B酶解时间 C复合酶用量 游离态多酚转化率(%) 1 0 0 0 83.59±0.46 2 1 0 −1 78.65±0.54 3 1 −1 0 75.03±0.35 4 −1 1 0 78.21±0.59 5 0 0 0 84.08±1.18 6 0 1 −1 79.39±1.09 7 −1 0 1 80.23±0.63 8 0 0 0 83.13±0.57 9 0 −1 1 80.31±0.85 10 0 1 1 80.66±0.61 11 0 −1 −1 72.96±0.79 12 −1 0 −1 76.85±1.04 13 0 0 0 83.39±0.48 14 0 0 0 83.98±0.41 15 −1 −1 0 73.39±0.68 16 1 1 0 79.02±0.54 17 1 0 1 80.33±0.75 利用Design-Expert 8.0.6.1软件进行多元回归拟合,得到二次多项式回归模型为:
Y=83.63+0.54A+1.95B+1.71C−0.21AB−0.43AC−1.52BC−3.27A2−3.95B2−1.35C2
回归模型分析如表3所示,模型F值=55.04(P<0.01),说明该模型极显著。失拟项(P=0.0903>0.05)不显著,表明模型拟合程度良好。其中,多元相关系数R2=0.9848,意味着所测单因素变量可以解释98.48%的模型响应值变化。模型校正系数R2Adj=0.9653,表明总变异度仅有3.47%不能由该模型解释。R2与R2Adj二者之差小于0.2,进一步表明该回归模型与实际情况拟合度较高,能很好地预测蓝莓果浆酶解工艺的结果。
表 3 回归模型分析Table 3. Regression model analysis方差来源 平方和 自由度 均方 F值 P值 显著性 模型 196.10 9 21.79 55.04 <0.0001 ** A 2.37 1 2.37 5.97 0.0445 * B 30.38 1 30.38 76.74 <0.0001 ** C 23.39 1 23.39 59.09 0.0001 ** AB 0.17 1 0.17 0.44 0.5306 AC 0.72 1 0.72 1.82 0.2188 BC 9.24 1 9.24 23.34 0.0019 ** A² 44.97 1 44.97 113.6 <0.0001 ** B² 65.80 1 65.80 166.21 <0.0001 ** C² 7.68 1 7.68 19.40 0.0031 ** 残差 2.77 7 0.40 失拟误差 2.14 3 0.71 4.49 0.0903 不显著 纯误差 0.63 4 0.16 总和 198.87 16 R2=0.9848 R2Adj=0.9653 注: *表示影响显著(P<0.05),**表示影响极显著(P<0.01)。 在该模型中,一次项因素B(酶解时间)和C(复合酶用量),交互项因素BC,二次项因素A2、B2、C2对游离态多酚转化率的影响均极显著(P<0.01) ;一次项因素A(酶解温度)对游离态多酚转化率的影响为显著(P<0.05);交互项因素AC、AB对游离态多酚转化率的影响均不显著(P>0.05)。根据F值大小可知,三个一次项因素对游离态多酚转化率的影响依次为:酶解时间>复合酶用量>酶解温度。这与高阳等[29]对甘薯结合酚的研究结果一致,即采用酶解法释放甘薯结合酚时,料液比用量和酶解时间对提取效率的影响程度大于酶解温度。
2.4.2 响应面分析与条件优化
图6是三维立体图和等高线图,可以直观地反映各个因素之间的交互影响程度。三维曲面越陡峭,等高线图越接近椭圆形,说明交互作用对游离态多酚转化率的影响越显著[32]。由图6B可知,三维立体图的抛物面较陡峭,弧顶有最大值;等高线图近似椭圆形,说明酶解时间和复合酶用量的交互作用能够显著影响游离态多酚转化率。
通过Design-Expert 8.0.6.1软件分析得到最佳的酶解条件为复合酶用量2.77%、酶解温度50.43 ℃、酶解时间124.20 min,在此条件下蓝莓果浆游离态多酚转化率的理论预测值为84.25%。考虑实际可操作性,调整最佳的酶解条件为:复合酶用量2.8%、酶解温度50 ℃、酶解时间124 min。在此条件下,进行3次平行实验后,所得游离态多酚转化率的平均值为83.47%,与模型预测值接近,表明优化后的酶解条件较为可靠,验证了该模型具有实际可行性。
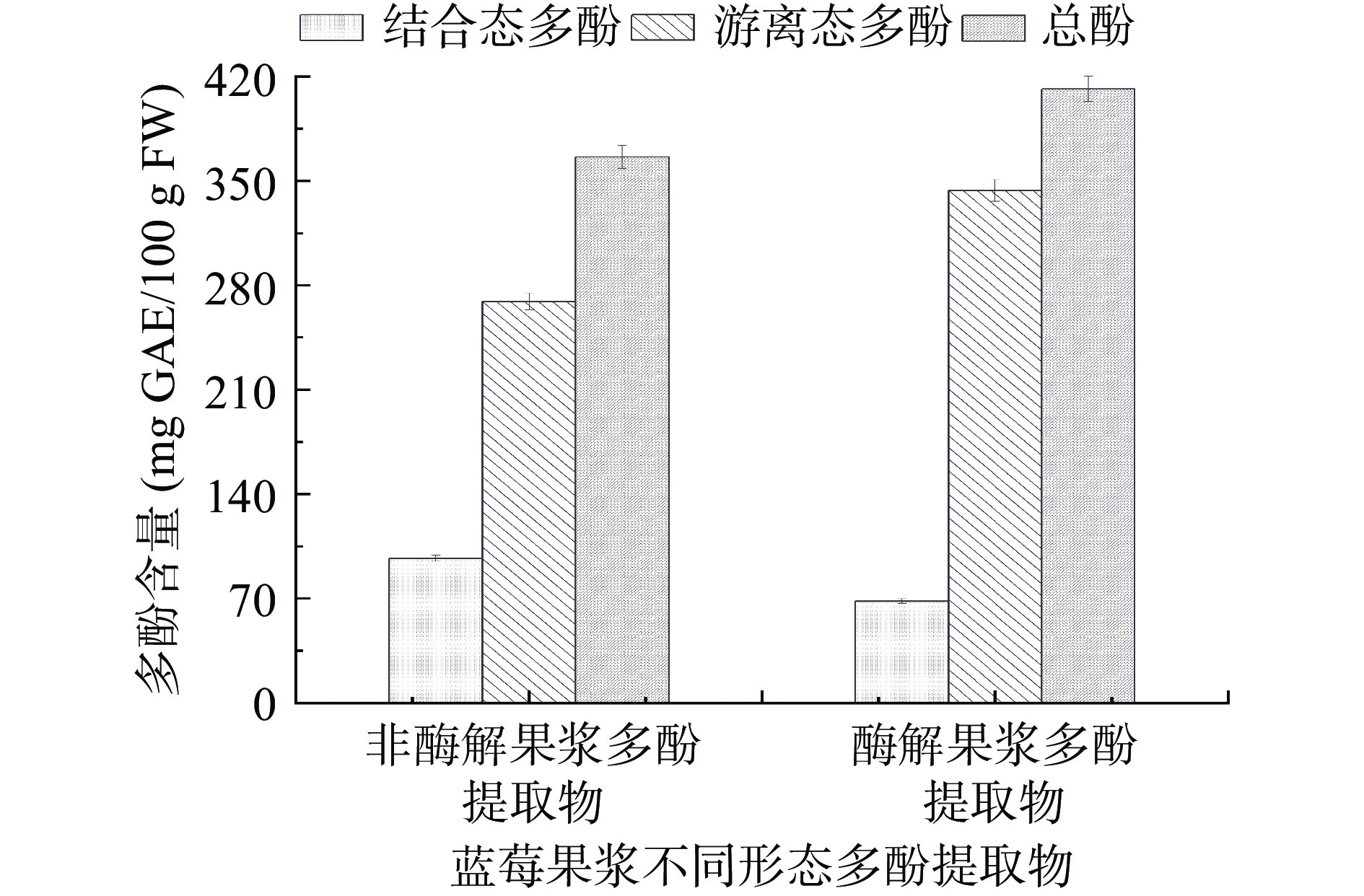
2.5 酶解处理对蓝莓果浆不同形态多酚含量的影响
由图7可知,蓝莓果浆经复合酶水解后,游离态多酚含量由原来的269.12 mg GAE/100 g FW上升至343.58 mg GAE/100 g FW,总酚含量由366.09 mg GAE/100 g FW增加至411.61 mg GAE/100 g FW,两者分别提高了27.67%和12.43%;结合态多酚含量由96.97 mg GAE/100 g FW减少至68.03 mg GAE/100 g FW,降低了29.84%。此外,由图中数据计算可知,非酶解果浆游离态多酚转化率为73.51%,酶解果浆游离态多酚转化率为83.47%;酶解处理使游离态多酚转化率提高了9.96%。这是因为果胶酶可以将细胞间的果胶质降解,纤维素酶将纤维素水解成水溶性糖,使细胞壁结构水解破裂,进一步使结合态多酚释放出来转化为游离态多酚,从而导致游离态多酚和总酚含量上升,结合态多酚含量下降[33-34]。与本研究结果类似,田怀香等[33]研究显示,萱草花经酶解处理后,游离态多酚含量提高15.56%,结合态多酚降低23.50%。Bei等[13]发现,与单纯固态发酵相比,纤维素酶结合固态发酵使燕麦游离态多酚含量增加了59.1%,总酚含量增加了69.21%。
2.6 酶解处理对蓝莓果浆不同形态多酚体外抗氧化活性的影响
2.6.1 酶解处理对蓝莓果浆不同形态多酚FRAP抗氧化能力的影响
由图8可知,与非酶解果浆相比,酶解果浆的游离态多酚提取物和总酚提取物的FRAP抗氧化能力分别增加了30.49 μmol/mL和16.56 μmol/mL,提高了15.45%和6.81%;结合态多酚提取物FRAP抗氧化能力减少了13.93 μmol/mL,下降了30.49%。类似地,Wang等[35]研究显示,番石榴叶经纤维素酶处理后,游离态多酚提取物和总酚提取物的FRAP抗氧化能力分别增加13.2%和13.5%,结合酚FRAP抗氧化能力下降10.62%。Liu等[36]发现,与单纯乳酸菌发酵相比,复合酶水解(糖化酶、蛋白酶和纤维素酶)进一步将发酵米糠游离态多酚提取物FRAP抗氧化能力提高了93.2%。FRAP抗氧化能力的提高可能与酶解促进果浆游离态多酚中的咖啡酸和芦丁释放量增加有关[37]。由此可见,酶解处理是提高游离态多酚提取物FRAP抗氧化能力的重要手段之一。
2.6.2 酶解处理对蓝莓果浆不同形态多酚ABTS抗氧化能力的影响
由图9可知,酶解处理使蓝莓果浆游离态多酚提取物和总酚提取物的ABTS抗氧化能力分别增加了11.95 μmol TE/g FW和10.06 μmol TE/g FW,提高了27.25%和15.62%;结合态多酚提取物ABTS抗氧化能力下降了1.89 μmol TE/g FW,降低了9.20%。该结果与多酚含量变化和FRAP抗氧化能力变化一致。崔梦情[15]研究也表明,纤维素酶和β-葡萄糖苷酶复合酶解处理,可以使葡萄籽游离态多酚提取物ABTS抗氧化能力提高1倍。同样地,Wang等[35]研究显示,番石榴叶经纤维素酶处理后,游离态多酚提取物和总酚提取物的ABTS抗氧化能力分别增加13.9%和21.7%,结合态多酚提取物ABTS抗氧化能力下降20.24%。游离态多酚提取物ABTS抗氧化能力的提高可能与酶解促进果浆中儿茶素、阿魏酸、飞燕草素-3-O-半乳糖苷、锦葵素-3-O-半乳糖苷的释放量增加有关;总酚ABTS抗氧化能力的提高可能与酶解促进果浆中绿原酸和丁香酸的释放量增加有关[8]。
3. 结论
本研究以蓝莓果浆为原料,以游离态多酚转化率为考察指标,筛选获得促进蓝莓果浆游离态多酚转化的最适复合酶组合为纤维素酶与果胶酶。在此基础上,采用单因素实验和响应面优化法对酶解条件进行优化,获得最优酶解条件为:以果浆酶和纤维素酶作为复合酶,酶制剂配比为4:6,复合酶用量2.8%、酶解温度50 ℃、酶解时间124 min。在此条件下,蓝莓果浆游离态多酚转化率可达83.47%,比非酶解果浆游离态多酚转化率提高了9.96%。与非酶解果浆相比,酶解蓝莓果浆游离态多酚含量提高27.67%,结合态多酚含量降低29.84%,分别为343.58 mg GAE/100 g FW和68.03 mg GAE/100 g FW。体外抗氧化活性结果表明,酶解蓝莓果浆游离态多酚提取物的FRAP抗氧化能力和ABTS抗氧化能力分别提高了15.45%、27.25%,总酚提取物的FRAP抗氧化能力和ABTS抗氧化能力分别提高了6.81%、15.62%。本研究表明,通过酶法处理达到了促进蓝莓果浆结合态多酚向游离态多酚转化的目的,提高了蓝莓果浆游离态多酚含量,增强了蓝莓果浆体外抗氧化能力。本研究为蓝莓资源的综合利用和功能性产品开发提供了理论依据与技术支撑。
在接下来的研究中,还需要进一步定性定量分析酶解过程中游离态单体酚和结合态单体酚的变化情况,明确单体酚与抗氧化活性之间的相关性,揭示具体是哪些单体酚物质引起的抗氧化活性增强,解析多酚类化合物生物转化的酶作用机制。
-
表 1 响应面试验因素与水平
Table 1 Factors and levels of response surface test
水平 因素 A酶解温度(℃) B酶解时间(min) C复合酶用量(%) −1 40 90 2.0 0 50 120 2.5 1 60 150 3.0 表 2 Box-Behnken 实验设计及结果
Table 2 Experimental design and results for Box-Behnken
试验号 A酶解温度 B酶解时间 C复合酶用量 游离态多酚转化率(%) 1 0 0 0 83.59±0.46 2 1 0 −1 78.65±0.54 3 1 −1 0 75.03±0.35 4 −1 1 0 78.21±0.59 5 0 0 0 84.08±1.18 6 0 1 −1 79.39±1.09 7 −1 0 1 80.23±0.63 8 0 0 0 83.13±0.57 9 0 −1 1 80.31±0.85 10 0 1 1 80.66±0.61 11 0 −1 −1 72.96±0.79 12 −1 0 −1 76.85±1.04 13 0 0 0 83.39±0.48 14 0 0 0 83.98±0.41 15 −1 −1 0 73.39±0.68 16 1 1 0 79.02±0.54 17 1 0 1 80.33±0.75 表 3 回归模型分析
Table 3 Regression model analysis
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 196.10 9 21.79 55.04 <0.0001 ** A 2.37 1 2.37 5.97 0.0445 * B 30.38 1 30.38 76.74 <0.0001 ** C 23.39 1 23.39 59.09 0.0001 ** AB 0.17 1 0.17 0.44 0.5306 AC 0.72 1 0.72 1.82 0.2188 BC 9.24 1 9.24 23.34 0.0019 ** A² 44.97 1 44.97 113.6 <0.0001 ** B² 65.80 1 65.80 166.21 <0.0001 ** C² 7.68 1 7.68 19.40 0.0031 ** 残差 2.77 7 0.40 失拟误差 2.14 3 0.71 4.49 0.0903 不显著 纯误差 0.63 4 0.16 总和 198.87 16 R2=0.9848 R2Adj=0.9653 注: *表示影响显著(P<0.05),**表示影响极显著(P<0.01)。 -
[1] 韩彩静, 王文亮, 陈相艳, 等. 应面法优化超声波提取蓝莓多酚工艺[J]. 南方农业学报,2014,45(2):285−290. [HAN C J, WANG W L, CHEN X Y, et al. Optimization of ultrasonic-assisted extraction process of blueberry polyphenols using response surface methodology[J]. Journal of Southern,2014,45(2):285−290. [2] 熊颖, 禹霖, 柏文富, 等. 不同品种蓝莓果实品质特征和抗氧化能力及多酚组成的比较[J]. 中南林业科技大学学报,2022,42(2):119−128. [XIONG Y, YU L, BAI W F, et al. Evaluation of quality characteristics, antioxidant ability and polyphenol composition of different blueberry cultivars[J]. Journal of Central South University of Forestry & Technology,2022,42(2):119−128. doi: 10.14067/j.cnki.1673-923x.2022.02.013 [3] 王怀玲. 蓝莓多酚化合物抗衰老活性及作用机制研究[D]. 广州: 华南理工大学, 2018. WANG H L. Research on antiaging activity and mechanism of blueberry polyphenols[D]. Guangzhou: South China University of Technology, 2018.
[4] 王馨悦. 几种富含花青素果蔬的 HPLC 特征图谱构建及其生物活性研究[D]. 贵阳: 贵州师范大学, 2018. WANG X Y. Construction of HPLC characteristic maps of several anthocyanin rich fruits and vegetables and their biological activities[D]. Guiyang: Guizhou Normal University, 2018.
[5] NORTON C, KALEA A Z, HARRIS P D, et al. Wild blueberry-rich diets affect the contractile machinery of the vascular smooth muscle in the Sprague-Dawley rat[J]. Journal of Medicinal Food,2005,8(1):8−13. doi: 10.1089/jmf.2005.8.8
[6] MATTILA P, HELLSTIOM J, TORRONEN R. Phenolic acids in berries, fruits, and beverages[J]. Journal of Agriculture and Food Chemistry,2006,54(19):7193−7199. doi: 10.1021/jf0615247
[7] 颜才植, 叶发银, 赵国华. 食品中多酚形态的研究进展[J]. 食品科学,2015,36(15):249−254. [YAN C Z, YE F Y, ZHAO G H. A review of studies on free and bound polyphenols in foods[J]. Food Science and Technology,2015,36(15):249−254. doi: 10.7506/spkx1002-6630-201515046 [8] GAO B H, WANG J W, WANG Y H, et al. Influence of fermentation by lactic acid bacteria and in vitro digestion on the biotransformations of blueberry juice phenolics[J]. Food Control,2022,133:108603. doi: 10.1016/j.foodcont.2021.108603
[9] 齐岩, 檀昕, 程安玮, 等. 葡萄皮和籽中游离酚和结合酚组成及抗氧化活性比较[J]. 核农学报,2017,31(1):104−109. [QI Y, TAN X, CHEN A W, et al. Free and bound phenolic contents and antioxidant activity in grape peel and seed[J]. Journal of Nuclear Agricultural Sciences,2017,31(1):104−109. doi: 10.11869/j.issn.100-8551.2017.01.0104 [10] KHAN S A, LIU L, LAI T, et al. Phenolic profile, free amino acids composition and antioxidant potential of dried longan fermented by lactic acid bacteria[J]. Journal of Food Science and Technology,2018,55(12):4782−4791. doi: 10.1007/s13197-018-3411-8
[11] YAO J Y, CHEN J X, YANG J, et al. Free, soluble-bound and insoluble-bound phenolics and their bioactivity in raspberry pomace[J]. LWT,2021:135.
[12] 韩雪. 乳酸菌增强红枣多酚抗氧化活性的研究[D]. 西安: 陕西师范大学, 2018. HAN X. Study on the antioxidative activity of jujube polyphenols enhanced by lactic acid bacteria[D]. Xi’an: Shaanxi Normal University, 2018.
[13] BEI Q, WU Z, CHEN G. Dynamic changes in the phenolic composition and antioxidant activity of oats during simultaneous hydrolysis and fermentation[J]. Food Chemistry,2019,305:125−269.
[14] KHOSRAVI A, RAZAVI S H. The role of bioconversion processes to enhance bioaccessibility of polyphenols in rice[J]. Food Bioscience,2020,35:100605. doi: 10.1016/j.fbio.2020.100605
[15] 崔梦情. 真菌固态发酵释放葡萄籽多酚及其机制研究[D]. 咸阳: 西北农林科技大学, 2021. CUI M Q. The mechanism and the release of grape seed polyphenols by solid-state fermentation of fungi[D]. Xianyang: Northwest Sci-Tech University of Agriculture and Forestry, 2021.
[16] BELWAL T, EZZAT S M, RASTRELLI L, et al. A critical analysis of extraction techniques used for botanicals: Trends, priorities, industrial uses and optimization strategies[J]. Trends in Analytical Chemistry,2018,100:82−102. doi: 10.1016/j.trac.2017.12.018
[17] 王储炎, 张继刚, 杨柳青, 等. 3种乳酸菌发酵对蓝莓多酚、原花青素含量及抗氧化活性的影响[J]. 食品科学,2020,41(24):87−94. [WANG C Y, ZHANG J G, YANG L Q, et al. Comparative effects of fermentation with three species of lactic acid bacteria on polyphenol and proanthocyanidin contents and antioxidant activity of blueberry fruit[J]. Food Science and Technology,2020,41(24):87−94. doi: 10.7506/spkx1002-6630-20200326-387 [18] LIU L, WEN W, ZHANG R, et al. Complex enzyme hydrolysis releases antioxidative phenolics from rice bran[J]. Food Chemistry,2017,214:1−8. doi: 10.1016/j.foodchem.2016.07.038
[19] TANG Y, ZHANG B, LI X, et al. Bound phenolics of quinoa seeds released by acid, alkaline, and enzymatic treatments and their antioxidant and α-glucosidase and pancreatic lipase inhibitory effects[J]. Journal of Agricultural and Food Chemistry,2016,64(8):1712−1719. doi: 10.1021/acs.jafc.5b05761
[20] 徐杰, 李新光, 王建中, 等. 黑果腺肋花楸果汁的酶解制备工艺优化及其功能性质[J]. 食品工业科技,2020,41(1):125−131. [XU J, LI X G, WANG J Z, et al. Optimization of enzymatic hydrolysis for production of Aronia melanocarpa juice and its functional properties[J]. Science and Technology of Food Industry,2020,41(1):125−131. doi: 10.13386/j.issn1002-0306.2020.01.021 [21] 刘媛洁, 张良. 响应面法优化复合酶辅助超声波提取柚子皮总黄酮工艺[J]. 食品工业科技,2019,40(23):143−150. [LIU Y J, ZHANG L. Optimization of enzymatic assisted ultrasonic extraction of total flavonoids from grapefruit peel by response surface methodology[J]. Science and Technology of Food Industry,2019,40(23):143−150. doi: 10.13386/j.issn1002-0306.2019.23.024 [22] 穆婷婷, 张福耀, 李志华, 等. 不同时期施硒对谷子硒含量、有机硒转化率及谷子品质的影响[J]. 华北农学报,2018,33(6):193−198. [MU T T, ZHANG F Y, LI Z H, et al. Effects of spraying selenium on selenium content, conversion rate of organic selenium and quality of foxtail millet in different stages[J]. Acta Agriculturae Boreali-Sinica,2018,33(6):193−198. doi: 10.7668/hbnxb.2018.06.026 [23] 王露. 番石榴叶活性多酚组分快速鉴别及发酵释放与转化机制[D]. 广州: 华南理工大学, 2018. WANG L. Quick identification and the mechanism in the release and transformation by fermentation of active phenolics components in guava leaves[D]. Guangzhou: South China University of Technology, 2018.
[24] WANG L, LUO Y, WU Y N, et al. Fermentation plus enzymatic hydrolysis on improving the soluble phenolics and flavonoid aglycone contents from Psidium guajava L. leaves and their bioactivites[J]. Food Chemistry,2018,264:189−198. doi: 10.1016/j.foodchem.2018.05.035
[25] 李亚辉, 马艳弘, 黄开红, 等. 响应面法优化复合酶提取芦荟多糖工艺及其抗氧化活性分析[J]. 食品科学,2014,35(18):63−68. [LI Y H, MA Y H, HUANG K H, et al. Optimization of enzymatic hydrolysis conditions for the extraction of aloe polysaccharides using response surface methodology and assessment of their antioxidant activity[J]. Food Science and Technology,2014,35(18):63−68. doi: 10.7506/spkx1002-6630-201418012 [26] 林英男. 复合酶法制备发酵型山药酒及其澄清工艺的研究[D]. 济南: 齐鲁工业大学, 2014. LIN Y N. Study on the fermented Chinese yam wine via compound enzymatic hypothesis and its clarification process[D]. Jinan: Qilu University of Technology, 2014.
[27] 杨明静, 邹青飞, 黄勇桦, 等. 基于改善辣木多酚生物有效性的发酵菌株筛选[J]. 食品科技,2022,47(6):30−36. [YANG M H, ZOU Q F, HUANG Y H, et al. Screening the fermentation strains for improving the bioaccessibility of polyphenols from Moringa oleifera[J]. Food Science and Technology,2022,47(6):30−36. doi: 10.3969/j.issn.1005-9989.2022.6.spkj202206005 [28] GLIGOR O, MOCAN A, MOLDOVAN C, et al. Enzyme-assisted extractions of polyphenols-A comprehensive review[J]. Trends in Food Science & Technology,2019,88:302−315.
[29] 高阳, 冯悦, 吕姝锦, 等. 酶水解法释放甘薯结合酚[J]. 食品研究与开发,2022,43(11):118−1125. [GAO Y, FENG Y, LÜ S J, et al. Release of bound phenol from sweet potato under enzymolysis[J]. Food Research and Development,2022,43(11):118−1125. doi: 10.12161/j.issn.1005-6521.2022.11.015 [30] 刘璇璇, 武莹敏, 朱振宝. 水酶法联产核桃油和核桃多肽工艺优化及油脂脂肪酸分析[J/OL]. 食品工业科技: 1−11 [2022-07-22]. DOI: 10.13386/j.issn1002-0306.2021120102. LIU X X, WU Y M, ZHU Z B. Optimization of synchronous extraction process of oil and polypeptide from walnut by aqueous enzymatic method and the fatty acid composition analysis of its oil[J/OL]. Science and Technology of Food Industry: 1−11 [2022-07-22]. DOI: 10.13386/j.issn1002-0306.2021120102.
[31] 程红, 隋秀芳. 酶解法提取蓝莓果汁的研究[J]. 中国酿造,2017,36(4):5. [CHENG H, SUI X F. Research on the extraction of blueberry juice by enzymolysis method[J]. China Brewing,2017,36(4):5. [32] 毕晓娟, 魏亮, 杨慧莹, 等. 响应面法优化元宝枫籽粕酶解工艺及多肽功能特性研究[J]. 食品工业科技,2022,43(14):204−214. [BI X J, WEI L, YANG H Y, et al. Optimization of the enzymatic hydrolysis process of Acer truncatum seed meal by response surface methodology and study of the functional characteristics of the polypeptide obtained[J]. Science and Technology of Food Industry,2022,43(14):204−214. doi: 10.13386/j.issn1002-0306.2021100138 [33] 田怀香, 陈霜, 陈小燕, 等. 不同提取方式对萱草花中酚类物质及抗氧化活性的影响[J]. 农业工程学报,2021,37(20):303−312. [TIAN H X, CHEN S, CHEN X, et al. Effects of different extraction methods on phenolic compounds and antioxidant activity in Hemerocallis flower[J]. Transactions of the CSAE,2021,37(20):303−312. doi: 10.11975/j.issn.1002-6819.2021.20.034 [34] 王悦, 徐元元, 杨二林, 等. 酶解结合高剪切破壁技术对蜂花粉酚类物质及抗氧化活性的影响[J]. 农业工程学报,2021,37(2):313−320. [WANG Y, XU Y Y, YANG E L, et al. Effects of enzymatic hydrolysis combined with high-shear wall breaking technology on phenolic compounds and antioxidant activity of bee pollen[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE),2021,37(2):313−320. doi: 10.11975/j.issn.1002-6819.2021.2.036 [35] WANG L, WU Y, YAN L, et al. Complex enzyme-assisted extraction releases antioxidative phenolic compositions from guava leaves[J]. Molecules,2017,22(10):1648. doi: 10.3390/molecules22101648
[36] LIU L, ZHANG R, DENG Y, et al. Fermentation and complex enzyme hydrolysis enhance total phenolics and antioxidant activity of aqueous solution from rice bran pretreated by steaming with α-amylase[J]. Food Chemistry,2017,221(APR.15):636−643.
[37] LI T, JIANG T, LIU N, et al. Biotransformation of phenolic profiles and improvement of antioxidant capacities in jujube juice by select lactic acid bacteria[J]. Food Chemistry,2021,339:127−859.





 下载:
下载:






 下载:
下载:



