Separation, Purification and Enzymatic Property of Cellulase Produced by Thermostable Bacillus amyloliquefaciens BA-DES4
-
摘要: 目的:本研究以一株产纤维素酶的解淀粉芽孢杆菌BA-DES4为材料,纯化并研究了其纤维素酶的酶学性质。方法:研究采用硫酸铵分级沉淀及SephadexG-75凝胶过滤层析方式对其所产纤维素酶进行分离纯化,通过聚丙烯酰胺凝胶电泳(SDS-PAGE)确定其分子量,并对纯化后纤维素酶的酶液进行酶学性质研究。结果表明:发酵液中分离纯化获得纤维素酶系组分(内切葡聚糖酶),对纯化的电泳内切葡聚糖酶进行酶活测定,其比活力为51.08 U/mg。发现其分子量为22.4 kDa;初步酶学性质研究表明:该酶的最适反应温度和最适pH分别为65 ℃和6.0,且在pH5.0~7.0和温度55~65 ℃下稳定性较高;Mn2+对纤维素酶活力激活作用较为显著,Cu2+的抑制作用最大。结论:该菌株可作为产内切葡聚糖酶的潜在菌株,内切葡聚糖酶可在Mn2+、Fe2+的作用下促进酶活力,同时在高温及酸性环境中发挥作用,能够参与高效降解高温酸性环境中的纤维素,提高生产率,同时将分解成的葡萄糖供发酵使用,具有应用高温大曲发酵酒生产的潜力,为该酶的进一步研究奠定了基础。Abstract: Objects: This research was performed based on taking one Bacillus amyloliquefaciens BA-DES4 producing the cellulose as the material, and the enzymatic property of its cellulose was researched upon the purification. Methods: This research applied the ammonium sulfate fractional precipitation and SephadexG-75 gel filtration chromatography method to carry out the separation and purification to the cellulose it produced. Determined its molecular weight by means of polyacrylamide gel electrophoresis (SDS-PAGE), and carried out the research of enzymatic property to enzyme solution of cellulase upon purification. Results: The cellulase system components could be obtained in zymotic fluid upon separation and purification (endoglucanase), and its specific activity was 51.08 U/mg through carrying out the measurement of enzyme activity to purified electrophoresis endoglucanase. It was identified that its molecular weight was 22.4 kDa. The primary research of enzymatic property indicated that the optimal reaction temperature and optimal pH for this enzyme were 65 ℃ and 6.0 respectively with a high stability when pH was 5.0~7.0 and temperature was 55~65 ℃. The activation of Mn2+ to cellulase activities was significant with the highest inhibiting effect of Cu2+. Conclusion: This bacterial strain can be used as the potential strain for producing the endoglucanase with the enzymatic activities of endoglucanase can be promoted under the effects of Mn2+, Fe2+. Meanwhile, it can work under the high temperature and acid environment along with participating in the cellulose of high effective degradation and high-temperature acid environment so as to improve the production efficiency. The glucose to be decomposed can be used for fermentation with a potential of producing the fermented wine by applying the high-temperature Daqu, which has laid a foundation for further studying this cellulase.
-
Keywords:
- Bacillus amyloliquefaciens /
- cellulase /
- purification /
- enzymatic property
-
近年来,利用纤维素酶高效分解植物纤维原料产糖生产燃料乙醇已成为国内外研究的热点,但是工业生产菌株产酶活性不高仍然是目前纤维素酶生产和实际应用中存在的难题[1-2]。因此,选育高产纤维素酶菌株是纤维素资源的生物转化和拓展纤维素酶应用范围的重要环节。纤维素酶是将纤维素降解为葡萄糖的酶,由内切酶、外切酶和β-葡萄糖苷酶组成。纤维素酶一般由多种水解酶组成,这些水解酶构成了一个复杂的纤维素酶家族,若要研究单一组分酶的蛋白结构,结构组成和生物化学性质,就必须对纤维素酶系进行分离纯化[3]。然而,目前工业应用的内切葡聚糖酶大多数来自植物与真菌,存在酶表达量低、酶活力偏低、热稳定性差等问题,生产使用成本较高[4]。随着生物技术发展,基因克隆与异源表达成为获得高效内切葡聚糖酶的有效途径[5]。解淀粉芽孢杆菌BA-DES4作为安全级菌株,具有非致病性、培养简单快速、蛋白分泌能力强、兼性厌氧、产物不易形成包涵体等优点,是理想的内切葡聚糖酶的生产表达宿主,然而,我们前期对解淀粉芽孢杆菌产纤维素酶进行了较多研究,目前有关内切葡聚糖酶解淀粉芽孢杆菌表达的研究报道并不多见。
对耐热解淀粉芽孢杆菌内切葡聚糖苷酶进行分离纯化和酶学性质的研究,不仅为纤维素酶的食品应用提供依据,同时为构建高效表达的内切葡聚糖苷酶的基因工程菌提供了参考,还可以为蛋白质工程提供研究的前提,用于研究不同的食品工业化生产和应用需求。因此,本试验对解淀粉芽孢杆菌BA-DES4发酵液中纤维素酶系进行分离纯化,并对其酶学性质进行研究。采用硫酸铵分级沉淀法和SephadexG-75凝胶过滤层析纯化出单一组分的纯蛋白酶,通过聚丙烯酰胺凝胶电泳(SDS-PAGE)确定其分子量。并对纯化获得的酶进行酶学性质的研究,通过设置不同温度,不同酸碱条件,确定纤维素酶最适温度和最适pH,并对纤维素酶进行稳定性试验,在不同温度、不同酸碱条件下验证酶活是否稳定。以期推动解淀粉芽孢杆菌表达系统以及内切葡聚糖酶在食品工业上的应用,为进一步研究开发提供理论基础。
1. 材料与方法
1.1 材料与仪器
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)BA-2、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)诱变菌株BA-DES4 东北林业大学发酵实验室保藏。发酵产酶培养基:蛋白胨3.0 g,酵母粉5.0 g,硫酸铵2.0 g,磷酸二氢钾 4.0 g,氯化钠 3.0 g,硫酸镁 0.3 g,羧甲基纤维素钠(CMC-Na)20.0 g,蒸馏水1000 mL。121 ℃灭菌20 min。牛血清蛋白、葡聚糖凝胶G-75、考马斯亮蓝R-250、十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)、三羟甲基氨基甲烷盐酸盐、羧甲基纤维素钠(CMC-Na) 购于上海源叶生物科技有限公司;甲醇、正己烷、乙酸钠、硫酸铵、蛋白胨、酵母粉、氯化钠 购于天津市天力试剂有限公司;丙烯酰胺、3,5-二硝基水杨酸(DNS试剂)、微晶纤维素、水杨酸 购于麦克林试剂公司;其他试剂均为国产分析纯 购于天津市福晨试剂厂。
JA2003分析天平 上海良平仪器仪表有限公司;DHG-9240电热鼓风干燥箱 上海一恒科学仪器有限公司;TGL-16 G台式离心机 上海科雳仪器设备有限公司;RT-6000酶标仪 深圳雷杜生命科学有限公司;UV-5500 PC紫外可见分光光度计 上海元析仪器有限公司;DYY-70电泳仪 北京六一仪器厂;DK-98-Ⅱ A电热恒温水浴锅 天津市泰斯特仪器有限公司;KQ-300 DE数控超声波清洗器 昆山市超声仪器有限公司;BSZ-160 自动部分收集器、HL-2B恒流泵 上海青浦沪西仪器厂。
1.2 实验方法
1.2.1 粗酶液制备
将解淀粉芽孢杆菌BA-2、解淀粉芽孢杆菌 BA-DES4 经 50 ℃ 液态发酵培育 4 d后,将培养液4 ℃,10000 r/min离心10 min,上清液即是粗酶液。将粗酶液置于−20 ℃冰箱中冻存过夜,隔日4 ℃解冻,10000 r/min离心收集上清液[6]。
1.2.2 纤维素酶分离纯化
1.2.2.1 硫酸铵分级沉淀与透析
将硫酸铵饱和度设定为8个梯度,分别为0%、20%、30%、40%、50%、60%、70%、80%,取粗酶液5 mL,冰水浴条件下,粗酶液中加入研磨过的硫酸铵粉末,使其达到事先预定的硫酸铵饱和度,溶解后在冰箱(4 ℃)中放置4 h,通过离心收集上清液待用,0.05 mol/L柠檬酸缓冲液(pH4.8)对沉淀进行复溶,测定沉淀中蛋白质含量及上清液的酶活力大小[7-8]。循环以上操作,根据比活力与蛋白沉淀率的计算确定最适饱和区间N1~N2。
通过上述获得的饱和区间,首先将粗酶液的硫酸铵饱和度达到N1,离心后保留上清液,再将上清液中硫酸铵饱和度达到N2,舍弃上清液,将收集的沉淀,进行复溶,再将盐析后的蛋白装入透析袋(使用前用水反复冲洗干净)中,12 h换一次缓冲溶液,反复3次后,将透析袋放入30%聚乙二醇溶液中浓缩至适当浓度,4 ℃冰箱保存备用。
1.2.2.2 硫酸铵分级沉淀及SephadexG-75凝胶过滤层析
在使用硫酸铵进行盐析蛋白质后,往往需要脱盐处理,本试验采用凝胶过滤层析脱盐及下一步的纯化,优点是脱盐速度快,不易引起蛋白变质[9]。
称取SephadexG-75干粉15 g于500 mL烧杯中,蒸馏水浸泡48 h,将不易沉淀的细小颗粒去除,脱气。层析柱(1.6 cm×60 cm)中加少量的0.05 mol/L柠檬酸缓冲液(pH4.8)湿润,上样量5 mL,上样结束后,用柠檬酸缓冲液(pH4.8)洗脱,恒流泵流速0.25 mL/min,每10 min收集一管。280 nm紫外分光光度计对收集的洗脱液进行检测,绘制洗脱曲线,测量各组分的蛋白含量和酶活力,对酶活力较高的组分进行SDS-PAGE检测,确定该组分酶的纯度及分子量[10-11]。
1.2.2.3 SDS-PAGE电泳分析
选用4%的浓缩胶,12%的分离胶,完成分离胶配制后,将层析获得峰Ⅲ收集的纯蛋白酶液与上样缓冲液混合,100 ℃下煮沸5 min,使其变性,上样量10~15 μL,恒压80 V电泳,等样品到达浓缩胶和分离胶的分界处,需电压调至120 V,染料到达底部时,关掉电源。把凝胶置于1%的考马斯亮蓝染色液中,染色30 min后转移到脱色液中,过夜脱色,直至蓝色完全褪去[12-13]。以标准蛋白质(14400~97400)作为参照。
1.2.3 酶活力的测定
a. 通常由滤纸酶活力(Filter Paper Activity,FPA)来反映纤维素酶的总活力[14]。吸取0.5 mL酶液来测定纤维素酶活力,以滤纸50 mg作为底物,取4支20 mL具塞试管,分别加入酶液0.5 mL和pH为4.8的柠檬酸-磷酸氢二钠缓冲液1.5 mL。在其中一个试管内加入1.5 mL 3,5-二硝基水杨酸(DNS试剂)作为对照组。将4支试管分别放入到50 ℃的水浴锅中,预热处理10 min后,加入滤纸50 mg,并于该温度下反应60 min,取出样品后在每个样品内立即加入2.0 mL DNS试剂,进行沸水浴5 min,取出后立即将其冷却至室温,补充蒸馏水定容至15 mL,并通过分光光度计测出每个样品的吸光度。每个样品平行测3次,取平均值。测得的OD值,通过绘制的葡萄糖标准曲线进行比对,换算成葡萄糖浓度。每小时底物产生1 μmoL葡萄糖所需酶量为一个酶活力单位(U),FPA(U/mL)公式如下:
FPA=M×V×5.56A×B×T (1) 式中:M:葡萄糖含量,mg;V:定容体积,mL;T:反应时间,h;A:加酶量,mL;B:底物质量,mg;5.56为1 mg葡萄糖底物物质的量,μmol。
b. 内切葡聚糖酶(羧甲基纤维素酶(CMCase))酶活测定:将1%羧甲基纤维素钠(CMC-Na)作为底物其余操作与a相同(1%羧甲基纤维素钠(CMC-Na):将1 g羧甲基纤维素钠溶解于100 mL、pH为4.8的柠檬酸-磷酸氢二钠缓冲液)。
c. 外切葡聚糖酶酶活测定:将1%微晶纤维素作为底物,其余操作与a相同(1%微晶纤维素:pH为4.8的柠檬酸-磷酸氢二钠缓冲液所配制)。
d. β-葡聚糖苷酶(β-Gase)酶活测定:将1%水杨苷溶液作为底物,其余操作与a相同(1%水杨苷溶液:将1 g水杨苷溶解于100 mL、pH为4.8的缓冲液)。
1.2.4 蛋白质标准曲线的绘制及菌株蛋白含量测定
1.2.4.1 蛋白质标准曲线的绘制
通过考马斯亮蓝G-250染色法,测定经过纯化后的纤维素酶的蛋白质含量,设立6个梯度,编号为1~6(表1),每个梯度3个平行,牛血清蛋白浓度分别为0、0.2、0.4、0.6、0.8、1.0 mg/mL加入到6支试管中,用蒸馏水再次定容补充到1 mL,加入5 mL考马斯亮蓝G-250染色液,设置反应时间5 min,于595 nm处测定吸光值[15-16]。根据蛋白质标准曲线计算样品中蛋白质含量,每个样品平行测定3次,取平均值。
表 1 蛋白质标准曲线不同溶液含量配制表Table 1. Protein standard curve different solution content configuration table试剂 编号 1 2 3 4 5 6 牛血清蛋白(mL) 0 0.2 0.4 0.6 0.8 1.0 蒸馏水(mL) 1.0 0.8 0.6 0.4 0.2 0 考马斯亮蓝G-250染色液(mL) 5 5 5 5 5 5 蛋白含量(mg) 0 0.02 0.04 0.06 0.08 0.10 纵坐标为吸光值OD595,横坐标为蛋白浓度(mg/mL),绘制蛋白标准曲线,并拟合回归方程,其方程为y=3.7614x+0.0068,其中拟合系数为R2=0.9986。
1.2.4.2 出发菌株与诱变菌株蛋白质含量测定
本试验选取出发菌株BA-2作为对照菌株,测定出发菌株BA-2与诱变获得菌株BA-DES4蛋白质含量,比较诱变前后蛋白质含量变化,初步验证蛋白表达量是否增加,酶活是否提高。
1.2.5 酶的比活力
酶的比活力以公式计算,计算公式如下:
比活力=酶活蛋白质量 (2) 式中:比活力单位:U/mg;酶活单位:U;蛋白质量单位:mg。
1.2.6 纤维素酶酶学性质的研究
1.2.6.1 纤维素酶最适温度
对纯化后的纤维素酶的酶液,通过设置电热恒温水浴锅不同梯度酶的反应温度(45、55、65、75、85 ℃)确定酶促反应最佳温度[17-18],以最高酶活力为100%,计算其他温度下的相对酶活力。
1.2.6.2 纤维素酶最适pH
在最适酶促反应温度条件下,使用50 mol/L的pH4.0甘氨酸-盐酸缓冲液、pH4.5~6.0醋酸-醋酸钠缓冲液、pH6.5~8.5磷酸盐缓冲溶液配制底物溶液,设置不同酸碱条件(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5),以最高酶活力为100%,计算其他pH下的相对酶活力[19],探究不同pH对酶活力的影响。
1.2.6.3 纤维素酶的温度稳定性
将酶液分别置于电热恒温水浴锅中45、55、65、75和85 ℃条件下保温60 min,测定纤维素酶活力[20],探究酶的温度稳定性。
1.2.6.4 纤维素酶pH稳定性
将酶液与pH为2、3、4、5、6、7、8、9的缓冲液混匀,55 ℃保温60 min测定纤维素酶活力[21],探究纤维素酶pH稳定性。
1.2.6.5 金属离子对酶活力的影响
酶液中加入不同类型的金属离子(Mg2+、Zn2+、Cu2+、Na+、Fe2+、Mn2+、K+、Ca2+)至终浓度为10 mmol/L,常温静置60 min,以未加金属离子的酶液活性为100%,测定添加金属离子后的相对酶活[22],探究金属离子对酶活力的影响。
1.3 数据处理
试验中的数据均平行测定3次,以平均值±标准差(
ˉx ±s)表示,基础数据统计采用Excel软件,作图采用Origin 8.5软件,显著性分析采用SPSS19.0软件完成。2. 结果与分析
2.1 纤维素酶分离纯化
2.1.1 硫酸铵分级沉淀及SephadexG-75凝胶过滤层析
2.1.1.1 硫酸铵分级沉淀
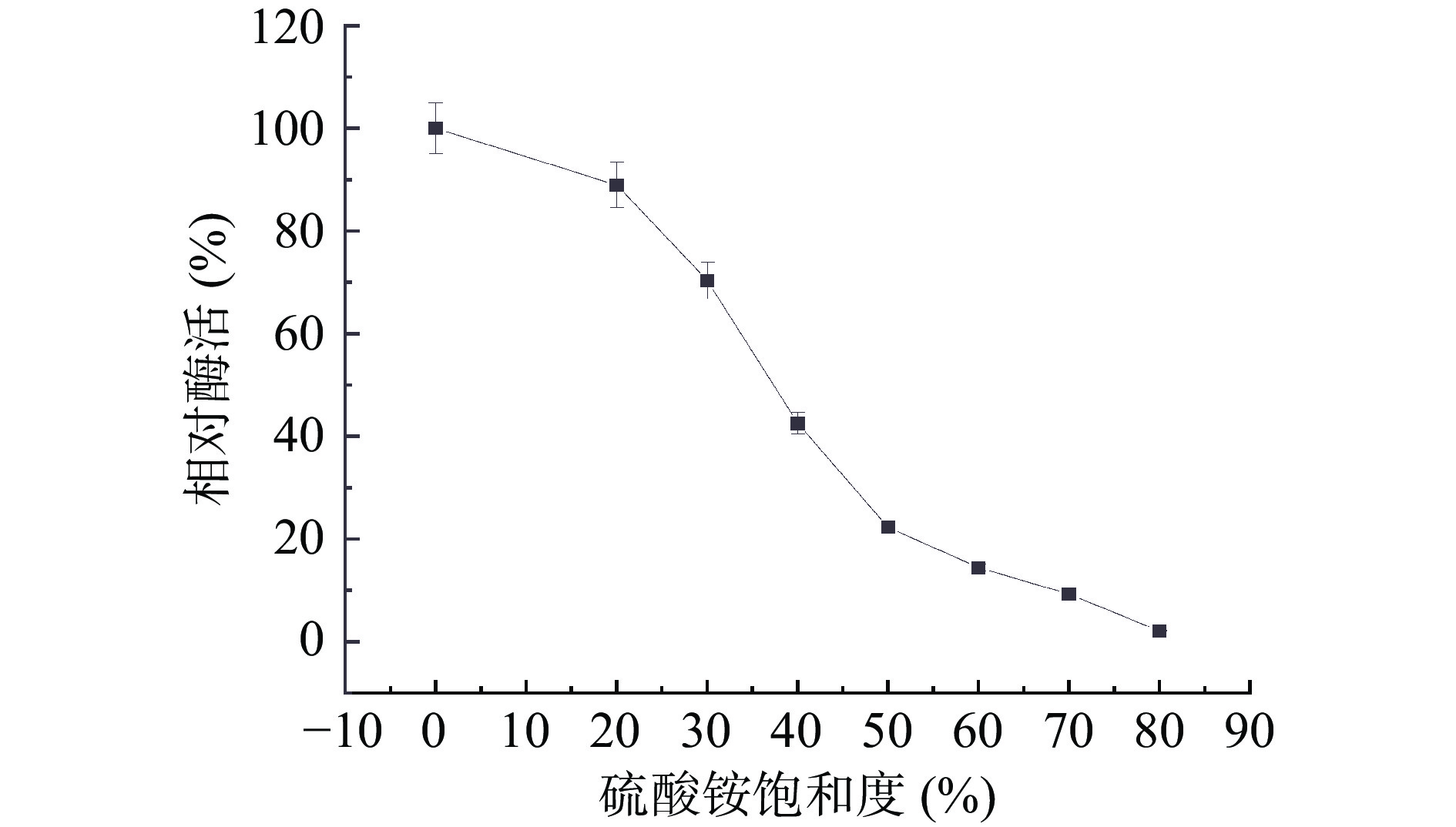
硫酸铵分级沉淀法是能够将部分蛋白纯化的一种简单且低成本的技术。如图1 所示,当硫酸铵饱和度为20%~70%时,上清液酶活急剧下降,当饱和度达到70%左右时,上清液中的酶活力下降到粗酶液酶活的9.3%,表明此时大部分纤维素酶已经被析出进入沉淀中。据上综合考虑,确定硫酸铵盐析方案为:20%饱和度的(NH4)2SO4盐析除杂、70%饱和度的(NH4)2SO4沉淀纤维素酶。试验结果显示:菌株BA-DES4经过硫酸铵分级沉淀处理后,本研究所确定的沉淀区间获得的酶回收率为28.18%,纯化倍数为1.88倍。
2.1.1.2 SephadexG-75凝胶过滤层析
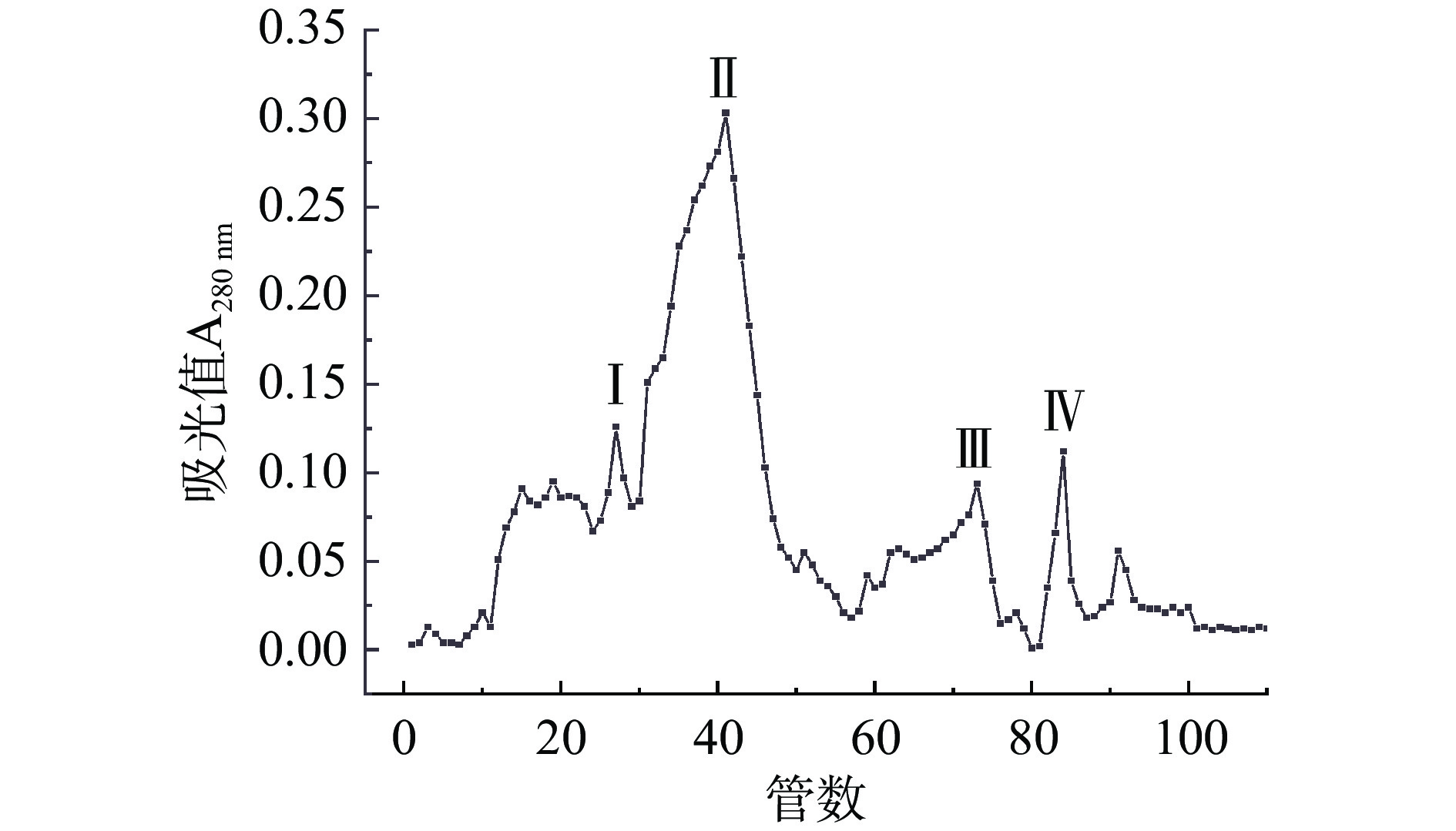
经过SephadexG-75凝胶过滤层析后,进行收集管中酶活力和蛋白含量的测定,如图2可知,出现较为明显的蛋白峰在20~95管之间,通过对收集管进行纤维素酶活的测定,表明在60~80管之间有较高的内切葡聚糖酶。纯化之后,突变菌株BADES-4纯化倍数达到3.73倍,酶活力回收率为10.62%,高于王婷婷等[23]从文蛤(Meretrix meretrix L.)中分离纯化获得的一种纤维素酶,结果表明,纯化后纤维素酶比活力为40.33 U/mg,蛋白回收率为4.82%。
经分离纯化之后,硫酸铵分级沉淀得到的蛋白液,进行后续试验,将蛋白液缓慢上样,经过SephadexG-75凝胶过滤层析后,分析其结果可得,一共出现4个洗脱蛋白峰。结果如图2所示,测定三种酶活,分析其结果,峰Ⅰ、Ⅳ没有纤维素酶活,表明蛋白峰Ⅲ为非目标蛋白,蛋白峰Ⅱ、Ⅲ有纤维素酶活,其中峰Ⅱ包含内切葡聚糖酶,外切葡聚糖酶和β-葡聚糖苷酶,峰Ⅲ具有较高的内切葡聚糖酶,收集峰Ⅲ进行浓缩,浓缩后进行聚丙烯酰胺凝胶电泳。
2.1.2 菌株BA-2、BA-DES4分离纯化过程中纤维素酶总蛋白含量及酶活变化
如表2所示,BA-2粗酶液的比活力达到10.59 U/mg,经硫酸铵分级沉淀处理比活力达到13.78 U/mg,纯化倍数为1.31。经过SephadexG-75 凝胶过滤层析后,比活力达到26.63 U/mg,纯化倍数是2.52。
表 2 菌株BA-2纤维素酶分离纯化结果Table 2. Separation and purification results of cellulase from strain BA-2指标 总酶活
(U)总蛋白
(mg)比酶活
(U/mg)纯化
倍数回收率
(%)粗酶液(BA-2) 196.62±0.23a 18.57±0.12a 10.59±0.07c 1 100 硫酸铵沉淀 102.74±0.41b 7.46±0.09b 13.78±0.11b 1.31 40.17 SephadexG-75 75.38±0.36c 2.83±0.06c 26.63±0.08a 2.52 15.24 注:表中数据为平均值±标准差;同列不同小写字母表示差异显著(P<0.05),表3同。 如表3所示,BA-DES4粗酶液的比活力(13.68 U/mg)比出发菌株BA-2比活力(10.59 U/mg)高,说明诱变株BA-DES4酶活力有所提高。将上述分离纯化得到的纤维素酶进行SDS-PAGE检测。
表 3 菌株BA-DES4纤维素酶分离纯化结果Table 3. Separation and purification results of cellulase from strain BA-DES4指标 总酶活
(U)总蛋白
(mg)比酶活
(U/mg)纯化
倍数回收率
(%)粗酶液(BA-DES4) 319.51±0.25a 23.35±0.11a 13.68±0.06c 1 100 硫酸铵沉淀 168.84±0.39b 6.58±0.08b 25.66±0.12b 1.88 28.18 SephadexG-75 126.69±0.28b 2.49±0.10c 51.08±0.09a 3.73 10.62 2.1.3 纯化纤维素酶的SDS-PAGE检测
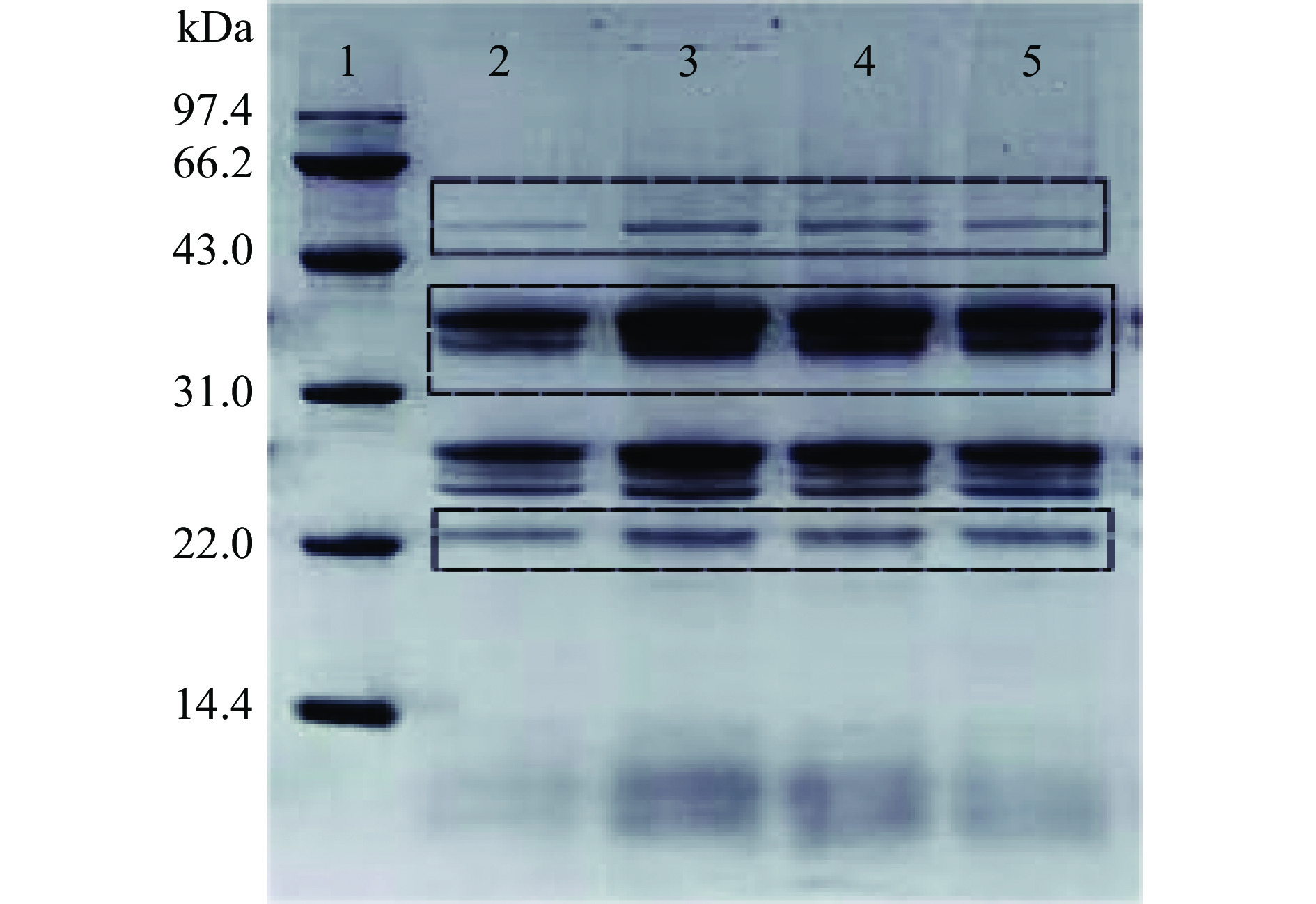
如图3所示为硫酸铵分级沉淀粗制纤维素酶,纯化纤维素酶的SDS-PAGE检测结果,方框内为目标蛋白条带,获得目标蛋白条带三条谱带较为明显,且突变菌株(泳道3,4,5)条带颜色相较于出发株(泳道2)较深,说明在蛋白表达量上,BA-DES4相较BA-2多一些,纯化后的三种纤维素酶分子量大小为50.8、36.6、22.4 kDa,根据蛋白大小及NCBI纤维素酶推测分别为外切葡聚糖酶、β-葡聚糖苷酶和内切葡聚糖酶。
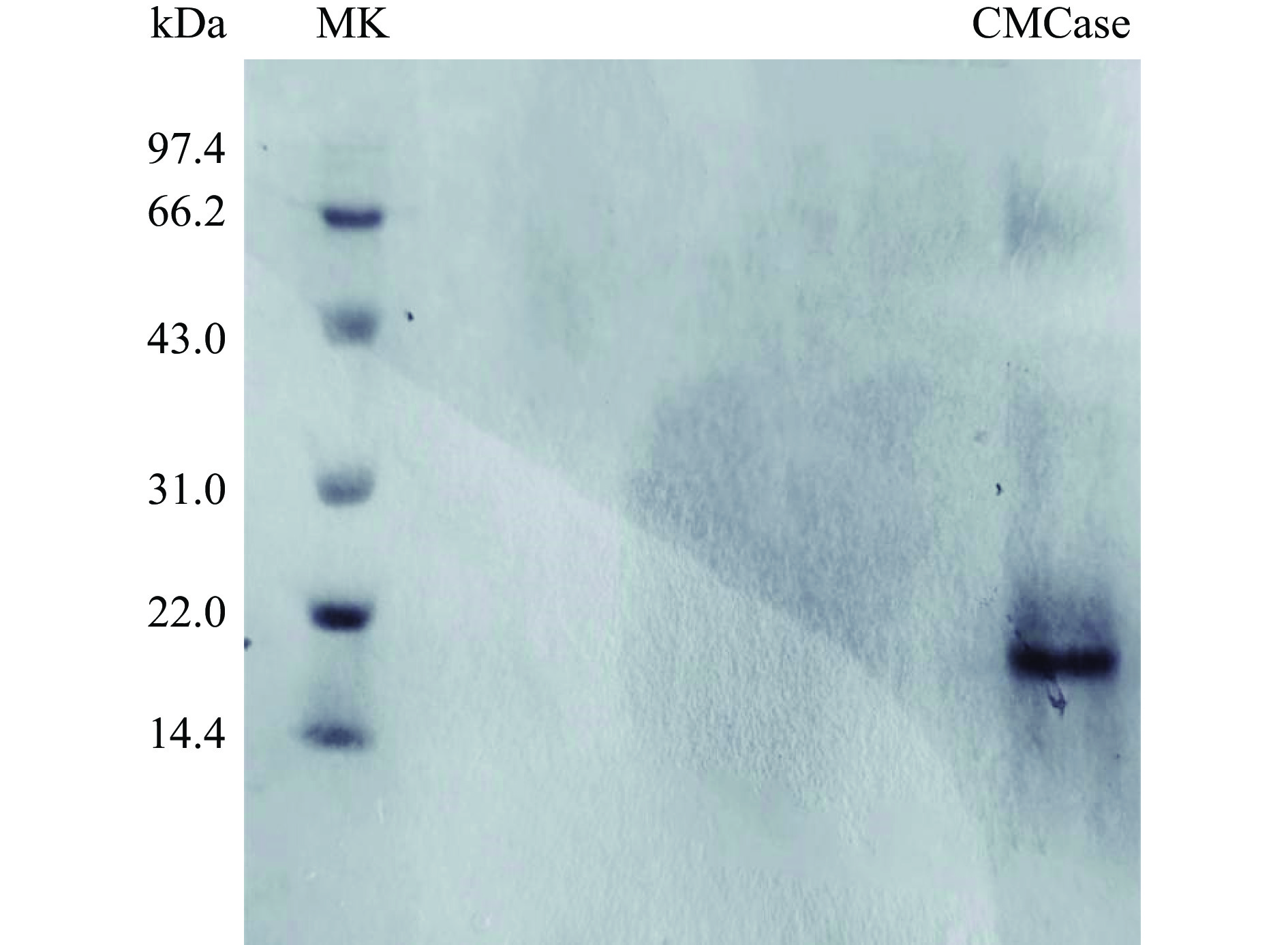
将纯化得到的酶液进行SDS-PAGE检测,由图4可知,经过考马斯亮蓝R-250染色后,显示出清晰的单一条带,没有出现拖带与弥散现象,表明纯化得到的酶蛋白为单一组分的纯蛋白酶。通过低分子量标准蛋白Marker为参照,酶的分子量约为22.4 kDa。本文由解淀粉芽孢杆菌BA-DES4产酶发酵液分离纯化获得的内切葡聚糖苷酶与报道的内切葡聚糖酶23 kDa相近。葛飞等[24]对康氏木霉诱变菌株SG0026 10L发酵罐发酵液中纤维素酶系进行分离纯化,获得3个电泳纯的纤维素酶系组分,其中内切葡聚糖酶确定其分子量为78.1 kDa。戴圻霏[25]从莓实假单胞菌(Pseudomonas fragi)分离获得内切葡聚糖酶,其相对分子量为31.2 kDa。上述结果均大于本文获得内切葡聚糖酶的分子量22.4 kDa。与相关文献对比我们发现,本文分离获得的解淀粉芽孢杆菌诱变菌株BA-DES4产生的纤维素酶系的分子量偏小,不同于其它微生物来源的纤维素酶系,这为更好地对纤维素酶系开展理论和应用基础研究提供了实验和理论依据。
2.2 内切葡聚糖酶酶学性质分析
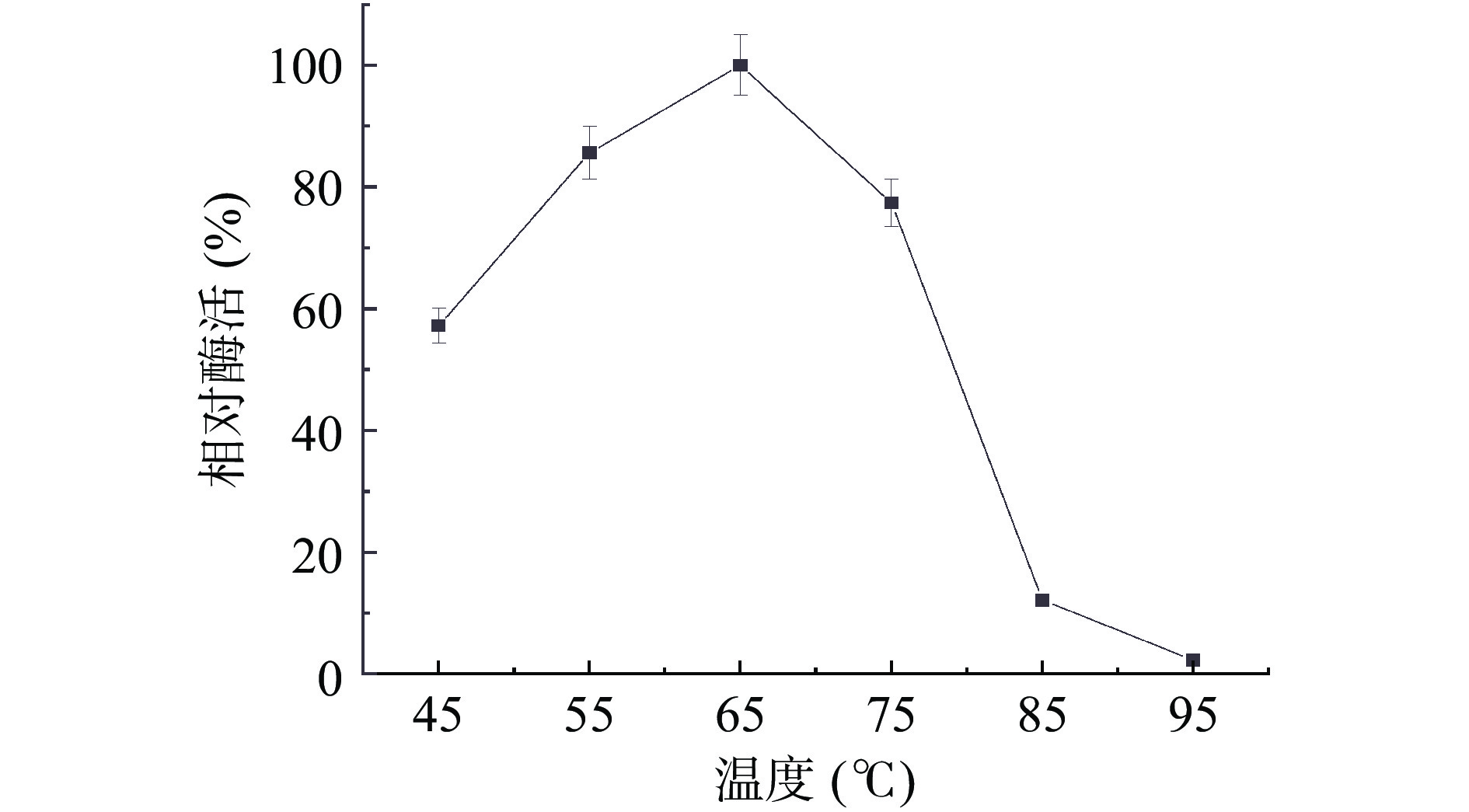
2.2.1 内切葡聚糖酶的最适温度
在不同温度下测定菌株BS-DES4内切葡聚糖酶的酶活。结果如图5 所示,当温度从45 ℃逐渐增加到95 ℃时,酶的活性呈现出先上升后下降的变化。在65 ℃下,酶的活性最高,65 ℃以后,随着温度的增加,酶活性明显下降。所以该纤维素酶最适反应温度65 ℃,高于董明杰等[26]从Alicyclobacillus D-1中得到的内切葡聚糖酶的最适反应温度(55 ℃)。
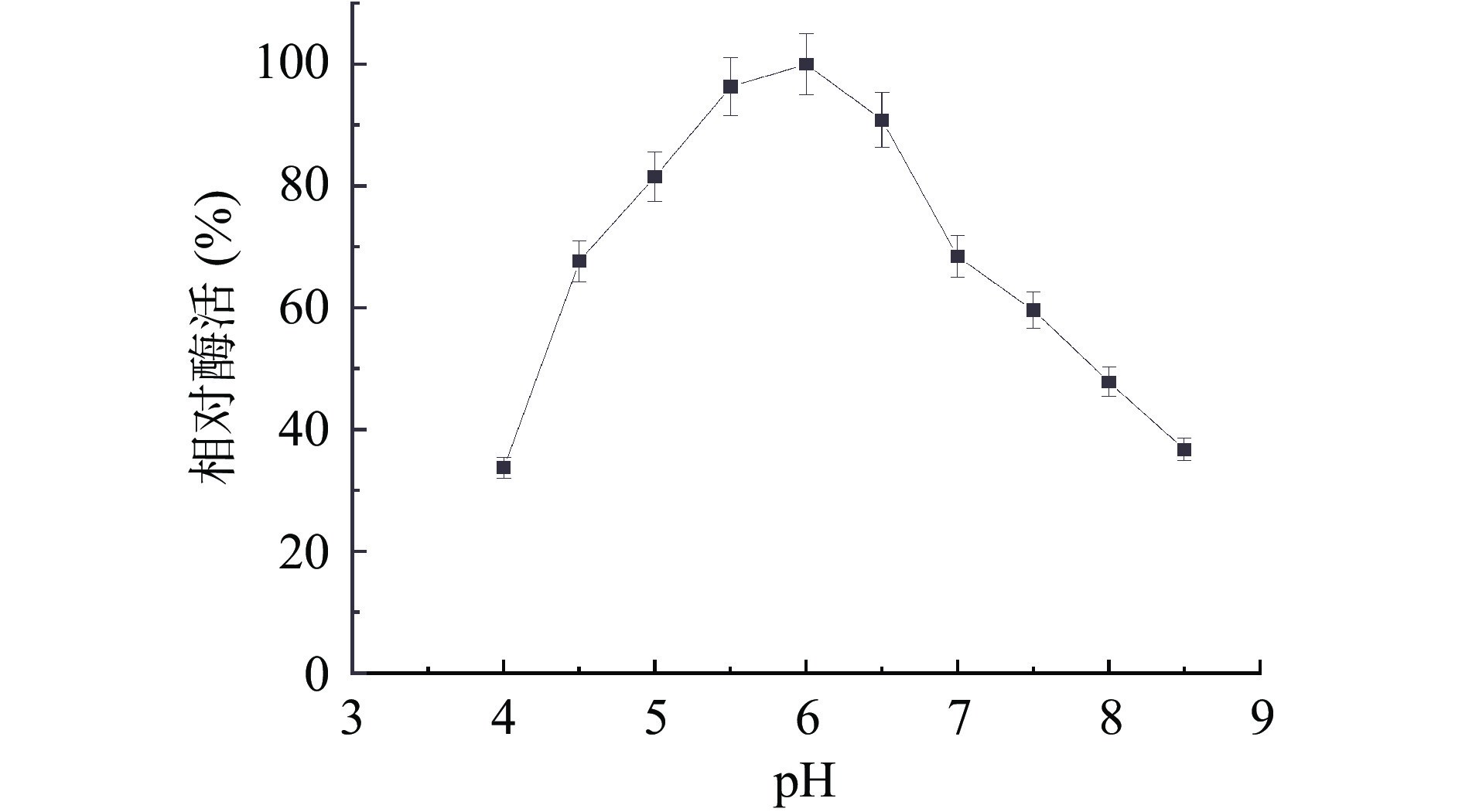
2.2.2 内切葡聚糖酶的最适pH
将酶液分别在不同pH(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5)条件下,测定其相对酶活,以最高值作为100%的标准。如图6 所示,该菌产纤维素酶反应的最适 pH 为6.0,纤维素酶在 pH5.0~6.5时相对酶活高于80%。一般来自细菌的内切葡聚糖酶最适pH 在中性范围,如镰刀菌Q7-31T的最适pH为6.0[27],与本研究结果相似;但同是芽胞杆菌属,其内切葡聚糖酶最适pH仍存在很大差异,如Bacillus amyloliquefaciens B16最适pH为8.0[28]。
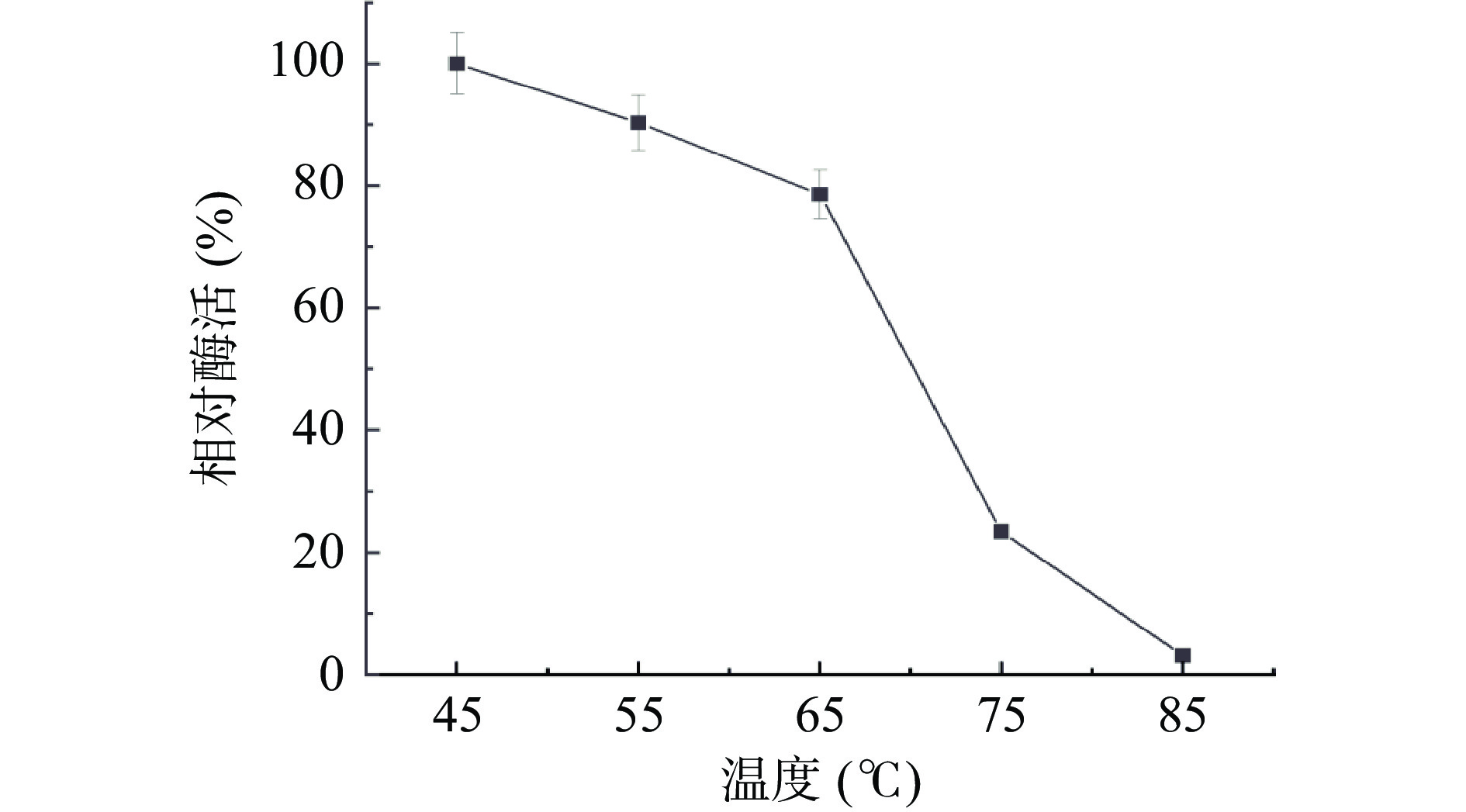
2.2.3 内切葡聚糖酶温度稳定性
将酶液分别置于45、55、65、75和85 ℃条件下进行稳定性试验,如图7所示,当温度处于低于55 ℃时,酶活具有较高的稳定性,在55 ℃保温60 min时,相对酶活保持在85%以上,但当温度达到75 ℃保温60 min时,酶活骤降,相对酶活仅为23.4%,在最高温度85 ℃下保温60 min,酶活性几乎完全丧失。由此证明,该酶具有一定的温度耐受性,使其在工业生产中对环境温度的适应力较强。
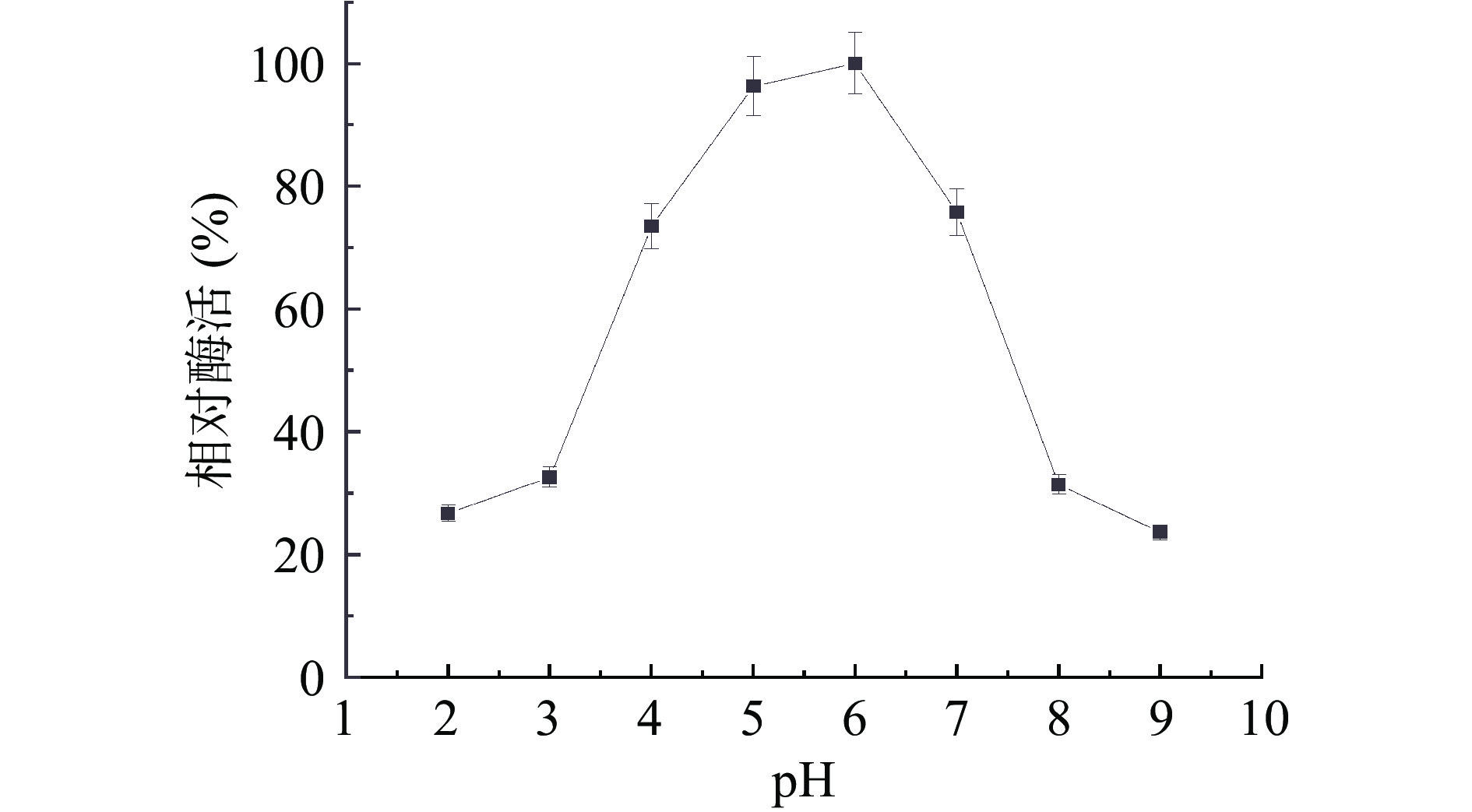
2.2.4 内切葡聚糖酶在不同pH下稳定性
pH对酶活性的影响并不是因为作用于整个酶分子,从而影响酶分子的解离状态,而是由于酶的活性中心或与之有关的基团的解离状态被改变,从而使酶的活性状态发生改变,因此过酸和过碱都会大大降低酶的活性。如图8为纤维素酶在不同pH条件下稳定性研究,结果表明,酶液在pH5.0、6.0的酸性条件下酶活有一定的稳定性,在pH4.0处理60 min后仍有70%的酶活性,试验结果表明,在条件为(pH4.0~7.0)菌株所产纤维素酶稳定性较高,表明该酶在酸性环境下酶活保持相对稳定。因此该酶最适酶促反应pH为6.0。
2.2.5 金属离子对内切葡聚糖酶酶促反应的影响
部分金属元素能促进酶的反应,而有些金属元素能抑制酶的反应,因此,金属离子对酶促反应的调控是相对的。不同类型浓度为10 mmol的金属离子,缓慢添加到酶促反应过程中,设定标准为以不添加金属离子纤维素酶活力,即为100%。分析图9可知,对于纤维素酶有着明显激活作用的是Fe2+、Mn2+,激活作用较为明显的是Mn2+,相对酶活能够达到156%±1.24%。孙会刚等[29]探究贝莱斯芽孢杆菌(Bacillus velezensis)酶学性质,金属离子Mn2+和Fe2+对纤维素酶有促进作用。对纤维素酶没有明显促进影响的是Ca2+,相对酶活仅达到111%±1.02%。Mg2+、Zn2+、Cu2+这几种离子的加入,酶活力下降明显,其中的抑制效果最大的是Cu2+,使得相对酶活达到45%,推测抑制酶活性的金属离子可能与酶活性部位的氨基酸残基结合,引起酶构象的改变,阻碍了酶与底物结合。对纤维素酶的抑制效果不明显的为Na+、K+。因此,在应用过程中或酶制剂制备时适当添加Fe2+或Mn2+有助于提高酶活性。
3. 结论
本试验从解淀粉芽孢杆菌诱变菌株BA-DES4发酵液中分离纯化得到纤维素酶系组分(内切葡聚糖酶),对纯化的电泳内切葡聚糖酶进行酶活测定,其比活力为51.08 U/mg。采用聚丙烯酰胺凝胶电泳(SDS-PAGE)确定其分子量,相对分子量约为22.4 kDa;在此基础上,对其酶学性质进行研究,发现纤维素酶的最适反应温度65 ℃,最适pH6.0;55~65 ℃、pH在5.0~7.0条件下相对酶活力保持在75%以上;金属离子中Mn2+对纤维素酶活力促进作用较为显著,相对酶活能够达到156%±1.24%,Cu2+的抑制作用最大。稳定性实验研究表明内切葡聚糖酶具有较好的热稳定性和酸碱稳定性。由此可见对粗酶液进行纯化可大幅提高内切葡聚糖酶稳定性,这对于提高工业生产中内切葡聚糖酶的作用效率具有非常积极的意义。综上分析,该菌株所产纤维素酶在一定温度条件下能够保持较好的稳定性,在较为苛刻的工业环境中将具有非常大的潜在应用前景。未来可在调控蛋白基因方面进行深度研究。
-
表 1 蛋白质标准曲线不同溶液含量配制表
Table 1 Protein standard curve different solution content configuration table
试剂 编号 1 2 3 4 5 6 牛血清蛋白(mL) 0 0.2 0.4 0.6 0.8 1.0 蒸馏水(mL) 1.0 0.8 0.6 0.4 0.2 0 考马斯亮蓝G-250染色液(mL) 5 5 5 5 5 5 蛋白含量(mg) 0 0.02 0.04 0.06 0.08 0.10 表 2 菌株BA-2纤维素酶分离纯化结果
Table 2 Separation and purification results of cellulase from strain BA-2
指标 总酶活
(U)总蛋白
(mg)比酶活
(U/mg)纯化
倍数回收率
(%)粗酶液(BA-2) 196.62±0.23a 18.57±0.12a 10.59±0.07c 1 100 硫酸铵沉淀 102.74±0.41b 7.46±0.09b 13.78±0.11b 1.31 40.17 SephadexG-75 75.38±0.36c 2.83±0.06c 26.63±0.08a 2.52 15.24 注:表中数据为平均值±标准差;同列不同小写字母表示差异显著(P<0.05),表3同。 表 3 菌株BA-DES4纤维素酶分离纯化结果
Table 3 Separation and purification results of cellulase from strain BA-DES4
指标 总酶活
(U)总蛋白
(mg)比酶活
(U/mg)纯化
倍数回收率
(%)粗酶液(BA-DES4) 319.51±0.25a 23.35±0.11a 13.68±0.06c 1 100 硫酸铵沉淀 168.84±0.39b 6.58±0.08b 25.66±0.12b 1.88 28.18 SephadexG-75 126.69±0.28b 2.49±0.10c 51.08±0.09a 3.73 10.62 -
[1] 宫秀杰, 钱春荣, 于洋, 等. 近年纤维素降解菌株筛选研究进展[J]. 纤维素科学与技术,2021,29(2):68−77. [GONG X J, QIAN C R, YU Y, et al. Progress on screening of cellulose degrading strains in recent years[J]. Journal of Cellulose Science and Technology,2021,29(2):68−77. doi: 10.16561/j.cnki.xws.2021.02.07 [2] 徐忠, 冯昕宁, 高阳, 等. 改性纤维素在食品和调味品加工中应用进展[J]. 中国调味品,2021,46(1):177−179. [XU Z, FENG X N, GAO Y, et al. Application progress of modified cellulose in food and condiment processing[J]. China Condiment,2021,46(1):177−179. doi: 10.3969/j.issn.1000-9973.2021.01.036 [3] 邢飞, 钱嘉君, 刘慧, 等. 食品接触用再生纤维素薄膜的应用进展与法规研究[J]. 食品安全质量检测学报,2021,12(7):2607−2612. [XING F, QIAN J J, LIU H, et al. Research on the application progress and regulations of regenerated cellulose film for food contact[J]. Journal of Food Safety & Quality,2021,12(7):2607−2612. [4] 章沙沙, 徐健峰, 柳增善. 纤维素降解菌的研究与应用进展[J]. 工业微生物,2021,51(2):46−52. [ZHANG S S, XU J F, LIU Z S. Progress in research and application of cellulose-degrading microorganisms[J]. Industrial Microbiology,2021,51(2):46−52. doi: 10.3969/j.issn.1001-6678.2021.02.007 [5] 江小妹, 林春伟, 王魁云, 等. 团头鲂肠道菌株MA35产纤维素酶分离纯化及性质分析[J]. 上海海洋大学学报,2020,29(2):313−320. [JIANG X M, LIN C W, WANG K Y, et al. Isolation, purification and characterization of cellulase produced from Aspergillus niveus MA35 in the gut of the Megalobrama amblycephala[J]. Joumal of Shanghai Oceam University,2020,29(2):313−320. doi: 10.12024/jsou.20190302564 [6] 王世伟, 王卿惠, 马兆魁, 等. Fusarium oxysporim M1菌株的rDNA ITS鉴定及其纤维素酶活性及纯化研究[J]. 微生物学杂志,2018,38(2):55−62. [WANG S W, WANG Q H, MA Z K, et al. rDNA its identification, its cellulase activity and purification of Fusarium oxysporum strain M1[J]. Journal of Microbiology,2018,38(2):55−62. [7] FAN X, LIANG Y, LI F, et al. Integrated purification of a nanobody using ammonium sulfate precipitation and capto MMC[J]. Journal of Chemical Technology & Biotechnology,2020,95(1):246−254.
[8] 张轶群, 林洪, 李振兴, 等. 虾过敏原蛋白纯化中硫酸铵沉淀法的改进[J]. 食品与药品,2008(11):50−52. [ZHANG Y Q, LIN H, LI Z X, et al. Improvement of shrimp (Penaeus vannamei) allergens purification by ammonium sulfate precipitation[J]. Food and Drug,2008(11):50−52. doi: 10.3969/j.issn.1672-979X.2008.06.017 [9] 吴静. 高产纤维素酶霉菌的筛选及纤维素酶系的分离纯化[D]. 贵阳: 贵州大学, 2020 WU J. Isolation of molds with high-activity of cellulase and the purification of cellulase system[D]. Guiyang: Guizhou University, 2020.
[10] 纪莹莹. 高温降解纤维素菌株的筛选及酶学性质的研究[D]. 沈阳: 沈阳农业大学, 2019 JI Y Y. Cellulase-producing actinomycetes with the capacity of high-temperature tolerance and characterization of the enzymatic properties of its cellulase[D]. Shenyang: Shenyang Agricultural University, 2019.
[11] OKAWARAY, HIRANO H, KIMURA A, et al. Phos-tag diagonal electrophoresis precisely detects the mobility change of phosphoproteins in phos-tag SDS-PAGE[J]. Journal of Proteomics,2021,231:104005. doi: 10.1016/j.jprot.2020.104005
[12] 徐亚军, 李珂, 刘珂珂, 等. 大豆根瘤内生菌全细胞可溶性蛋白SDS-PAGE电泳图谱分析[J]. 食品研究与开发,2019,40(11):159−165. [XU Y J, LI K, LIU K K, et al. Analysis on whole cell soluble protein electrophoresis of SDS-PAGE electrophoresis profiles of endophytic bacteria from soybean nodules[J]. Food Research and Development,2019,40(11):159−165. [13] 郑斌, 王舒, 王子迎, 等. 蓝莓酵素中蛋白质和蛋白酶含量测定[J]. 吉林农业,2018(19):68−70. [ZHENG B, WANG S, WANG Z Y, et al. Determination of protein and protease content in blueberry enzyme[J]. Agriculture of Jilin,2018(19):68−70. [14] 温冬灼, 张智, 魏罡, 等. 纤维素降解芽孢杆菌筛选及产酶条件优化[J]. 中南林业科技大学学报,2022,42(2):169−180. [WEN D Z, ZHI Z, WEI G, et al. Screening of cellulose-degrading bacillus and optimization of enzyme production conditions[J]. Journal of Central South University of Forestry & Technology,2022,42(2):169−180. doi: 10.14067/j.cnki.1673-923x.2022.02.018 [15] 黄婉玉, 曹炜, 李菁, 等. 考马斯亮蓝法测定果汁中蛋白质的含量[J]. 食品与发酵工业,2009,35(5):160−162. [HUANG W Y, CAO W, LI J, et al. Determination of protein in fruit juices by kormas brilliant blue method[J]. Food and Fermentation Industries,2009,35(5):160−162. doi: 10.13995/j.cnki.11-1802/ts.2009.05.015 [16] ZHANG T, ZHANG H, WEI M, et al. Effects of enzymatic treatment on the physicochemical properties and antioxidant activity of hawthorn pectin[J]. Materials Today Communications,2022,30:103225. doi: 10.1016/j.mtcomm.2022.103225
[17] CUI L, MEDDEB-MOUEIHI F, LAFRAMBOISE F, et al. Effect of commercial cellulases and refining on kraft pulp properties: Correlations between treatment impacts and enzymatic activity components[J]. Carbohydrate Polymers,2015,115:193−199. doi: 10.1016/j.carbpol.2014.08.076
[18] GENG D H, LIN Z, LIU L, et al. Effects of ultrasound-assisted cellulase enzymatic treatment on the textural properties and in vitro starch digestibility of brown rice noodles[J]. LWT,2021,146:111543. doi: 10.1016/j.lwt.2021.111543
[19] KIELISZEK M, POBIEGA K, PIWOWAREK K, et al. Characteristics of the proteolytic enzymes produced by lactic acid bacteria[J]. Molecules,2021,26(7):1858. doi: 10.3390/molecules26071858
[20] 蔡正安, 刘素纯, 刘仲华, 等. 茯砖茶中冠突散囊菌纤维素酶的酶学性质研究[J]. 茶叶科学,2010,30(1):57−62. [CAI Z A, LIU S C, LIU Z H, et al. Cellulase enzymatic property of Eurotium cristatum from brick tea[J]. Journal of Tea Science,2010,30(1):57−62. doi: 10.3969/j.issn.1000-369X.2010.01.009 [21] SUI M, LI C, LI G, et al. Study on enzyme properties of Bacillus subtilis LC-9 multifunction cellulose[C]//IOP Conference Series: Earth and Environmental Science. IOP Publishing, 2018, 170(2): 022106.
[22] 韩硕, 赵岩, 宋天顺, 等. 纤维素分解菌的筛选和酶学性质分析[J]. 西北农业学报,2013,22(4):172−177. [HAN S, ZHAO Y, SONG T S, et al. Isolation of cellulose-decomposing strains and analysis of enzymatic characteristics of cellulase[J]. Acta Agriculturae Boreali-occidentalis Sinica,2013,22(4):172−177. doi: 10.7606/j.issn.1004-1389.2013.04.030 [23] 王婷婷, 宋星, 李燕. 文蛤纤维素酶分离纯化及性质[J]. 食品与生物技术学报,2018,37(12):1324−1329. [WANG T T, SONG X, LI Y. Isolation, purification and characterization of cellulase from Meretrix meretrix L doi: 10.3969/j.issn.1673-1689.2018.12.015 J]. Journal of Food Science and Biotechnology,2018,37(12):1324−1329. doi: 10.3969/j.issn.1673-1689.2018.12.015
[24] 葛飞, 石贝杰, 唐尧, 等. 康氏木霉诱变菌株纤维素酶系的分离纯化与酶学特性研究[J]. 现代食品科技,2015,31(12):149−155, 184. [GE F, SHI B J, TANG X, et al. Isolation, purification, and enzymatic properties of cellulase system in mutant strain Trichoderma koningii SG0026[J]. Modern Food Science and Technology,2015,31(12):149−155, 184. [25] 戴圻霏. 低温纤维素酶高产菌筛选和酶学性质研究[D]. 长春: 吉林农业大学, 2020 DAI K F. Breeding of low-temperature cellulase high-producing bacteria and study on its properties[D]. Changchun: Jilin Agricultural University, 2020.
[26] 董明杰, 杨云娟, 唐湘华, 等. 脂环酸芽孢杆菌D-1的耐盐内切葡聚糖酶基因克隆、表达与酶学性质[J]. 微生物学报,2016,56(10):1626−1637. [DONG M J, YANG Y J, TANG X H, et al. Gene cloning, heterologous expression and enzyme characterizations of halo-tolerant endoglucanase from Alicyclobacillus D-1[J]. Acta Microbiologica Sinica,2016,56(10):1626−1637. [27] 常鑫园, 谢占玲, 张凤梅, 等. 镰刀菌Q7-31T内切葡聚糖酶Egn21的分离纯化及酶学性质[J]. 微生物学报,2017,57(1):33−42. [CHANG X Y, XIE Z L, ZHANG F M, et al. Purification and characterization of endoglucanase Egn21 from Fusarium sp. Q7-31T[J]. Acta Microbiologica Sinica,2017,57(1):33−42. [28] 崔海洋, 程仕伟, 黄田红, 等. 产纤维素酶的解淀粉芽孢杆菌分离鉴定及酶学性质研究[J]. 食品科学技术学报,2014,32(3):43−47, 53. [CUI H Y, CHENG S W, HUANG T H, et al. Screening and identifying of Bacillus amyloliquefaciens for cellulase production and its enzymatic characters[J]. Journal of Food Science and Technology,2014,32(3):43−47, 53. doi: 10.3969/j.issn.2095-6002.2014.03.008 [29] 孙会刚, 徐慧敏, 黄天姿, 等. 产酸性纤维素酶细菌的筛选鉴定及其酶学性质[J]. 食品科技,2021,46(7):55−59. [SUN H G, XU H M, HUANG T Z, et al. Screening, isolating and enzymatic properties of bacterium producing acidic cellulase[J]. Food Science and Technology,2021,46(7):55−59. -
期刊类型引用(3)
1. 陈思柳,容舒婷,陈丽艳,郭松,陈碧. 发酵温度对甘蔗茶酒的品质影响. 食品工业. 2024(10): 16-22 .  百度学术
百度学术
2. 邓乔允,夏爽,韩小雨,游义琳,黄卫东,战吉宬. 梨酒中酵母的研究进展. 食品与发酵工业. 2024(21): 349-356 .  百度学术
百度学术
3. 曾朝珍,慕钰文,袁晶,宋娟,张海燕,康三江. 不同发酵温度对苹果酒理化性质及香气成分的影响. 中国酿造. 2023(12): 192-197 .  百度学术
百度学术
其他类型引用(3)






 下载:
下载:



 下载:
下载:



