Effect of Arginine Combined with Chitosan on Quality of Postmortem Yak Meat during Maturing
-
摘要: 为了明确不同浓度精氨酸(Arginine,Arg)与壳聚糖(Chitosan,CH)的协同作用对宰后牦牛肉成熟过程中品质的影响及潜在作用机制。本研究将不同浓度的Arg和CH复配注射到牦牛肉中,测定其对牦牛肉成熟过程中品质的影响。结果表明,0.4%~0.8% Arg和1.0% CH复配可以显著提高牦牛肉的pH,降低牦牛肉成熟期间的L*、b*值、高铁肌红蛋白含量和蒸煮损失,并显著提高a*值和氧合肌红蛋白含量(P<0.05);同时,复配处理组肌原纤维小片化指数、硬度、咀嚼性、胶着性在成熟期间显著高于空白组,黏性和弹性则显著低于空白组(P<0.05);复配处理提高了牦牛肉过氧化值和硫代巴比妥酸值;同时,0.8% Arg和1.0% CH复配显著降低了成熟5 d前的羰基含量(P<0.05),但复配处理对巯基含量则没有显著影响(P>0.05);组织学观察显示,复配处理更有利于肌细胞的完整性和饱满度,且减少了水分通道。综上,不同浓度Arg和不同浓度CH复配处理在一定程度上改善了宰后牦牛肉成熟过程中的品质,提高其肉色稳定性并降低蒸煮损失,促进嫩化,使肌细胞更加完整饱满,但对脂肪氧化和蛋白氧化整体上呈现促进作用,具体原因和相关机理有待进一步探究。Abstract: In order to clarify the synergistic effect of different concentrations of arginine and different concentrations of chitosan on the quality of yak meat during postmortem aging and its potential mechanism, in this study, different concentrations of arginine and different concentrations of chitosan were injected into yak meat to determine their effects on the quality of yak meat during postmortem aging. The results showed that the combination of 0.4%~0.8% arginine and 1.0% chitosan could significantly increase the pH value, reduce the L*, b* values, metmyoglobin and cooking loss of yak meat during postmortem aging, and increase a* value and oxymyoglobin (P<0.05). Meanwhile, the myofibril fragmentation index, hardness, chewiness and adhesiveness of the compound treatment group were significantly higher than those of the control group during postmortem aging, while the viscosity and elasticity were significantly lower than those of the control group (P<0.05). The compound treatment increased the peroxide value and thiobarbituric acid reactive substances of yak meat. At the same time, the combination of 0.8% arginine and 1.0% chitosan significantly reduced the carbonyl content before maturation 5 day (P<0.05), but the compound treatment had no significant effect on the thiol content (P>0.05). Histological observation showed that the compound treatment was more conducive to the integrity and fullness of muscle cells, and reduced the water channel. In summary, the combination of different concentrations of arginine and different concentrations of chitosan improved the quality of postmortem yak meat during aging to a certain extent, improved its meat color stability and reduced cooking loss, promoted tenderization, and made muscle cells more complete and fuller, but it promoted fat oxidation and protein oxidation as a whole. The specific reasons and related mechanisms need to be further explored.
-
牦牛由于其高寒的生长环境而具有独特的食用品质和较高的营养价值,深受消费者青睐。然而,牦牛肉的宰后成熟过程则会导致其品质下降。研究表明,随着成熟时间的延长,其蒸煮损失逐渐增加,保水性下降[1],Z线断裂导致其嫩度显著改变[2]以及蛋白氧化的发生[3],最终导致牦牛肉品质及营养价值降低,而肉制品的色泽、嫩度、风味等品质是决定消费者购买意愿的直接因素,因此,改善肉品的品质特性是促进其销售的必要条件。
精氨酸(Arginine,Arg)是碱性氨基酸之一,被广泛应用于肉类加工行业,以改善肉类成熟过程中的色泽和风味[4]。Chen等[5]向猪腰长肌中注射Arg和Lys并成熟一段时间后发现,猪肉品质得以改善。Zhu等[6]研究表明,在乳化鸡肉香肠体系中,Arg/Lys通过增加乳化液滴的静电斥力和降低大豆油-水的界面张力提高了乳化香肠的稳定性。他们的进一步研究还表明,Arg/Lys显著增加了香肠的硬度,使其内部形成了规则、均匀的油滴包围整合膜[7]。微观构象发现,Arg有助于肌原纤维蛋白形成致密、均匀的三维网络结构,从而改善肉品的保水性,提高水合能力[8]。Xu等[9]的研究则发现,Arg和Lys可以抑制香肠的脂质和蛋白氧化。以上研究表明,添加Arg对提高肌肉及其制品品质具有重要作用,因此,有必要开展Arg对宰后牦牛肉成熟过程中食用品质及氧化特性等方面的系统研究。
壳聚糖(Chitosan,CH)是甲壳素脱乙酰化制备的多糖。在酸性环境中,CH侧链氨基与氢质子结合使自身携带正电荷[10]。研究发现,带正电的CH在肉糜体系中能够与带负电的蛋白质缔合,并主要依靠静电作用力和氢键,改变蛋白凝胶特性[11-12]。CH涂膜处理还可以延长肉制品保鲜期,抑制微生物生长[13-14]。此外,Suman等[15]在牛肉糜中添加了CH后发现,肉糜a*值增加,并伴随较低的脂质氧化。同样,Kanatt等[16]在即煮肉制品表面涂抹CH后,脂肪氧化降低,延长了肉制品货架期,可能是CH中的大量官能团聚合,形成了氧气屏障。近年来,CH的应用领域不断扩大[17],但在牦牛肉中却鲜有报道,其对牦牛肉的品质、蛋白氧化、脂肪氧化机理也未见系统研究。
综上所述,Arg和CH在肉制品加工中都具有潜在优势,然而关于Arg协同CH对牦牛肉品质及氧化特性影响的相互作用机理尚不清晰。因此,本研究旨在向牦牛肉中注射不同浓度Arg和不同浓度CH的复配溶液,探索两者的协同作用对牦牛肉成熟过程中食用品质、脂肪氧化以及蛋白氧化、组织学特性的影响情况,并尝试揭示影响其变化的内部机理及相关性,为Arg、CH在牦牛肉中的应用探寻一种新研究及开发思路,为牦牛肉制品行业提供一个健康可行的理论依据。
1. 材料与方法
1.1 材料与仪器
牦牛肉 采自广汉向阳江南屠宰场;L-精氨酸、壳聚糖(脱乙酰度90%) 上海源叶生物科技有限公司;三氯甲烷、碘化钾、三氯乙酸、EDTA、EGTA、2,4-二硝基苯肼(DNPH)、盐酸胍、尿素、十二烷基硫酸钠(SDS)、2-硝基苯甲酸(DTNB) 成都市科龙化工试剂厂,以上试剂均为分析纯。
UV-6100紫外分光光度计 上海美谱达仪器有限公司;CR-400型色差仪 日本Konica Minolta公司;pH-STAR 型 pH 测定仪 德国 HATTMUS 公司;TA.XT.Plus型质构分析仪 英国Stable Micro System公司;XHF-DY高速分散器 宁波新芝生物科技有限公司;Centrifuge 5810 R型冷冻离心机 成都锦世昌祥科技有限公司;PHY-Ⅲ型病理组织漂烘仪 常州市中威电子仪器有限公司;BA400 Digital数码三目摄像显微镜 麦克奥迪实业集团有限公司。
1.2 实验方法
1.2.1 样品处理
选自屠宰场平均年龄3.5岁、生长发育良好、体重相近的牦牛6头,屠宰后立即取牦牛中部背最长肌,剔除表面脂肪和结缔组织。修剪好的牦牛肉样沿着肌原纤维方向被随机分配成7个处理(每组约500 g),根据大量相关研究的浓度筛选,并扩大一定浓度范围后,分别用Arg1(0.0% Arg+1.0% CH)、Arg2(0.4% Arg+1.0% CH)、Arg3(0.8% Arg+1.0% CH)、CH1(0.0% CH+0.8% Arg)、CH2(0.5% CH+0.8% Arg)、CH3(1.0% CH+0.8% Arg)等复配溶液注射处理,其中Arg和CH复配比为1:1(v/v),置于封口袋中,并于4 ℃条件下成熟1、3、5、7 d后测定相应指标。其中,CON(空白组)注射等量水和1%乙酸的混合溶液,沿肌肉纤维方向相距约0.5 cm的位置进行注射,注射速度为5 mL/min,溶液总注射量为肉重的10%。
1.2.2 pH
使用pH计测量肉样的pH。将探针直接插入样品6个随机位置约1.5 cm的深度,并在pH计读数稳定后记录pH。
1.2.3 肉色稳定性
肉色:用滤纸吸干肉块表面水分,选取样品的6个随机位置作为测量点,将校准好的色差仪光源对准肉块表面,并读数。
肌红蛋白(Myoglobin,Mb)氧化状态:参考马国源[18]方法并稍作修改。称取5.00 g肉样,加入25 mL磷酸缓冲液(PB,0.04 mol/L,pH6.8),室温下匀浆(20 s,5000 r/min),将匀浆液于冰箱中储存1 h,离心(4 ℃,3300 r/min,30 min),过滤上清液,并定容到25 mL。于525、545、565、572 nm波长处测定滤液吸光值,以PB调零。氧合MP(Oxymyoglobin,OMb)以及高铁MP(Metmyoglobin,MMb)所占比例的计算公式如下:
OMb(%)=(0.882R1−1.267R2+0.809R3−0.361)×100 (1) MMb(%)=(−2.514R1+0.777R2+0.800R3+1.098)×100 (2) 式中:R1、R2、R3分别表示吸光度比值:A572/A525、A565/A525、A545/A525。
1.2.4 蒸煮损失(Cooking Loss,CL)
取肉块20 g(约3 cm×2 cm×2 cm)密封在自封袋中,并在80 ℃下使用水浴加热,用电子温度计测温,当中心温度达到75 ℃后保持15 min。蒸煮损失按下式计算:
蒸煮损失(%)=M1−M2M1×100 (3) 式中:M1、M2分别为加热前、后擦除表面水分后的肉样重量,g。
1.2.5 肌原纤维小片化指数(Myofibril Fragmentation Index,MFI)
参考张坤等[19]的方法并稍作修改。整个过程在4 ℃下进行。取5 g肉样,加入10倍体积的MFI缓冲液混合,匀浆30 s(5000 r/min)×3次,每次间隔30 s,离心(4 ℃,1000×g,15 min),弃上清。再重复以上步骤。最后沉淀用3倍体积的MFI缓冲液萃取10 min,200目尼龙网过滤去除结缔组织。用双缩脲法测量蛋白浓度。用MFI缓冲液将蛋白溶液稀释至0.5 mg/mL,并在540 nm处测量吸光值。MFI表示如下:
MFI=A540×200 (4) 式中:A540是540 nm处的吸光值。
1.2.6 质构特性
取煮熟后的样品,用平行刀沿肌原纤维方向将其切成约2 cm×2 cm×1 cm形状,切面要平整垂直,质构探头垂直于肉样中心。质构探头为P/50,测定参数为:测试前速度为2 mm/s,测试速度为5 mm/s,测试后速度为5 mm/s,压缩比为50%,触发力5.0 g。
1.2.7 脂质氧化
1.2.7.1 过氧化值(Peroxide Value,POV)
参照《GB 5009.277-2016 食品中过氧化值的测定》中的第一滴定法。准确称取3.000 g肉样,加入30 mL有机溶剂(氯仿:乙酸=2:3),均质混匀后,置于具塞三角瓶中,并加入1 mL饱和碘化钾溶液,具塞,立即振荡1 min后于暗处反应5 min,后依次加入75 mL蒸馏水及1 mL 1.0%淀粉溶液,混匀后用0.002 mol/L硫代硫酸钠标准溶液进行滴定。
1.2.7.2 硫代巴比妥酸反应物(Thiobarbituric Acid Reactive Substances,TBARS)
参考许鹏[20]的方法,并稍作修改。准确称取5 g肉样,加入25 mL 7.5%(w/v)三氯乙酸(含0.1% EDTA),冰浴条件下匀浆(3000 r/min,60 s),离心(4 °C,5000 r/min,5 min),过滤,取滤液5 mL加入等体积0.2 mol/L硫代巴比妥酸溶液,涡旋混匀,沸水浴中保持40 min,取出样品冷却至室温,在波长532 nm和600 nm处测定样品吸光值。TBARS结果以丙二醛含量mg/kg表示。
1.2.8 蛋白氧化
1.2.8.1 肌原纤维蛋白提取
根据Chen等[5]的方法并稍作修改。称取5 g肉样,加入4倍体积的标准盐溶液(10 mmol/L磷酸钠缓冲液,0.1 mol/L NaCl,1 mmol/L EGTA,2 mmol/L MgCl2,pH7.0),均质30 s,离心(4 ℃,2000×g,15 min),弃上清。重复上述步骤,共3次。此后,所得沉淀用4倍体积0.1 mol/L NaCl溶液溶解,匀浆,4层纱布过滤去除结缔组织,离心(4 ℃,2000×g,15 min),弃上清,收集沉淀即为肌原纤维蛋白溶液。用双缩脲法定蛋白浓度。
1.2.8.2 羰基含量
参照王琳琳等[21]的方法。取1 mL 5 mg/mL蛋白溶液加入1 mL溶解于4 mol/L HCl的0.02 mol/L DNPH溶液,空白对照组加入1 mL 2 mol/L HCl溶液(不含DNPH),混匀后在25 ℃下反应40 min,再加入4 mL 20%三氯乙酸(w/v),涡旋后离心(4 ℃,11000×g,5 min),弃上清,取2 mL乙醇:乙酸乙酯溶液(v/v=1:1)洗涤沉淀3次,并加入6 mL 6.0 mol/L盐酸胍溶液溶解沉淀,于37 ℃下水浴保温30 min,以空白组为对照。在370 nm波长处测定吸光值。
1.2.8.3 巯基含量
参照王琳琳等[21]的方法。取0.5 mL稀释后的蛋白溶液加入2 mL尿素SDS溶液(含8.0 mol/L尿素,30 g/L SDS,0.1 mol/L PBS缓冲液,pH7.4)和0.5 mL 10 mmol/L DTNB试剂(溶解在0.1 mol/L PB中,pH7.4),空白组不含DTNB,室温反应15 min,测定412 nm吸光值。
1.2.9 肌肉显微结构HE染色
取不同处理组肉样,切成1 cm的立方体,并用2.5%戊二醛固定、乙醇脱水和石蜡包埋处理。用切片机切成8 μm的切片,用苏木精-伊红染色并固定在玻片上。用光学显微镜对肌肉组织放大400倍的微观结构进行拍照。
1.3 数据处理
采用Microsoft 2016 Excel对数据进行整理,用SPSS 26软件对试验数据进行方差分析和Duncan’s多重比较,用Origin 2017软件作图。每个试验重复测定3次,取平均值。
2. 结果与分析
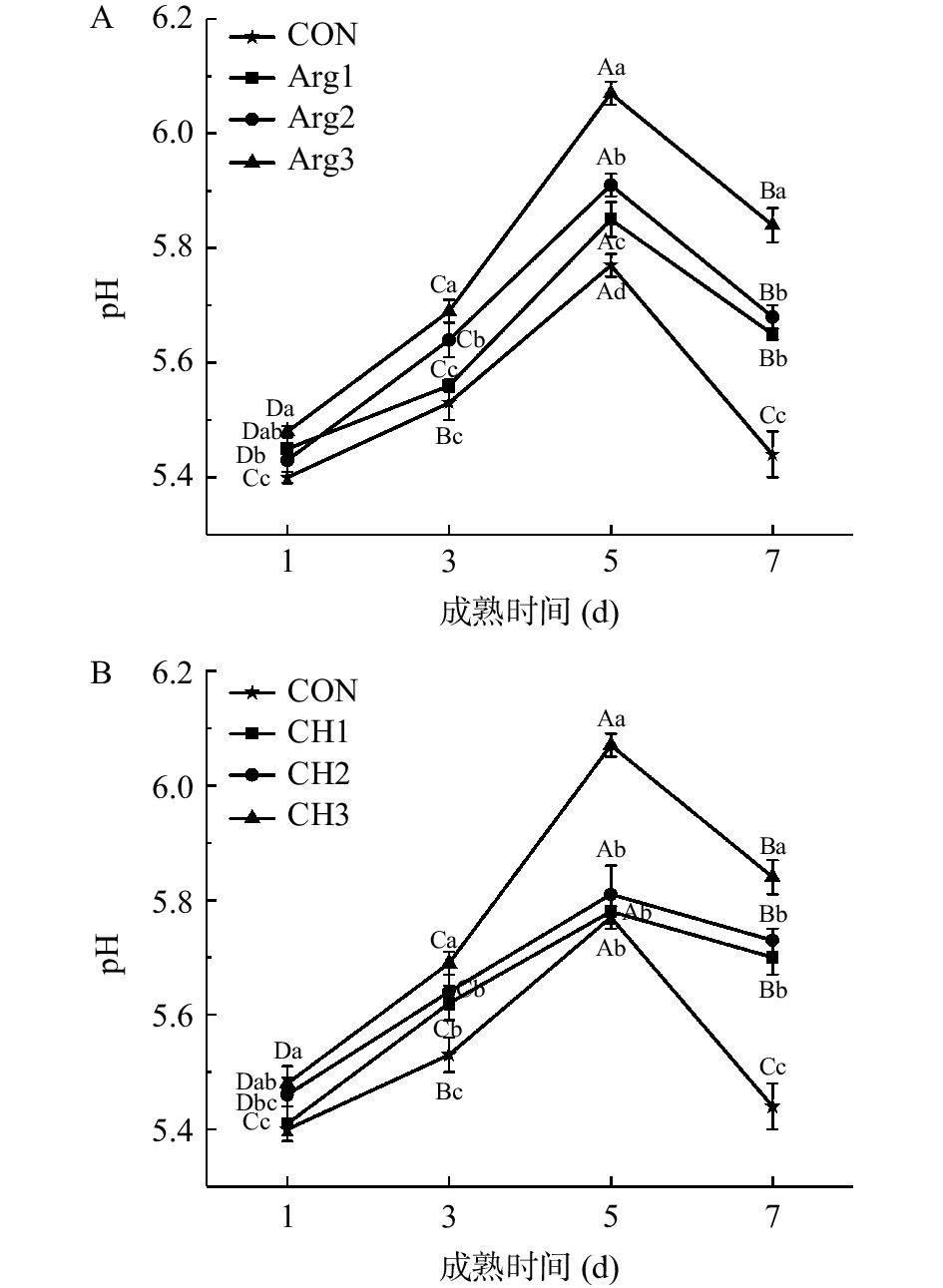
2.1 Arg与CH复配对宰后牦牛肉成熟过程中pH的影响
由图1(A、B)可知,随着成熟时间的延长,所有处理组pH均呈现先增加后降低的趋势,5 d时达到最高值(P<0.05)。肉品成熟初期,微生物和蛋白水解酶的作用促进肉中胺类物质的积累,导致肉品pH升高[22];而成熟后期,由于内源性氨基酸的分解作用,产生了胺、羧酸、酮酸等物质[23],羧酸和酮酸则会降低体系pH。此外,随着Arg浓度增加,不同成熟时间pH也逐渐增加,且显著高于CON组(P<0.05),由于Arg和CH均为碱性物质,浓度越大,体系pH增加越明显。成熟后期,复配处理组pH依旧高于CON组,可能在于CH对腐败菌的抑制作用[24],并有利于延长肉品储藏期。体系较高的pH则有利于延缓成熟过程中pH的快速下降,从而稳定品质。
2.2 Arg与CH复配对宰后牦牛肉成熟过程中肉色稳定性的影响
2.2.1 Arg与CH复配对宰后牦牛肉成熟过程中色度的影响
表1和表2表征了牦牛肉色度的变化情况。随着成熟时间的延长,CON组与所有处理组的L*值表现出相反的变化趋势,CON组L*值由最初的38.20增加到41.04,复配处理组则整体呈下降趋势,且显著低于CON组(P<0.05),其中,L*值与肉品中水分含量呈负相关,水分含量越低,L*值越高[25],因此Arg和CH的复配添加降低了L*值,提高了牦牛肉的含水量。
表 1 不同Arg处理组对牦牛肉成熟过程中色度的影响Table 1. Effect of different arginine treatments on color of yak meat during maturation肉色指标 组别 成熟时间(d) 1 3 5 7 L*值 CON 38.20±1.64Aa 38.31±2.01Aa 39.63±0.29Aa 41.04±2.03Aa Arg1 37.87±2.32Aa 33.01±0.46Bb 33.61±1.74Bb 37.08±0.41Ab Arg2 39.31±0.75Aa 38.80±0.64ABa 35.42±0.56Cb 37.20±1.11Bb Arg3 37.52±0.73Aa 32.45±0.37BCb 33.58±1.46Bb 30.81±0.47Cc a*值 CON 11.45±0.24Ac 11.20±0.44Ab 10.26±0.23Ba 8.84±0.25Ca Arg1 11.37±0.38Ac 11.61±0.21Aab 10.65±0.18Ba 9.21±0.51Ca Arg2 13.32±1.02Ab 11.99±0.51Aa 10.71±0.46Ba 8.45±0.55Ca Arg3 15.12±1.13Aa 12.16±0.33Ba 10.54±0.27Ca 8.60±0.45Da b*值 CON 12.12±0.73Aa 10.85±0.64ABa 10.57±1.09Ba 9.86±0.59Ba Arg1 11.37±0.76Aa 8.17±0.09Bb 7.93±0.82Bb 7.81±0.30Bb Arg2 11.58±0.82Aa 10.74±0.49Aa 9.27±0.42Bab 7.47±0.30Cb Arg3 13.28±0.96Aa 8.60±0.54Bb 8.48±0.98Bb 7.13±0.25Cb 注:不同小写字母表示同一成熟时间不同处理组间差异显著(P<0.05);不同大写字母表示同一处理组内不同成熟时间差异显著(P<0.05);表2~表6同。 表 2 不同CH处理对牦牛肉成熟过程中色度的影响Table 2. Effects of different CH treatments on color of yak meat during maturation肉色指标 组别 成熟时间(d) 1 3 5 7 L*值 CON 38.20±1.64Aa 38.31±2.01Aa 39.63±0.29Aa 41.04±2.03Aa CH1 34.27±0.89Ab 32.59±0.28Bc 32.36±0.48Bb 29.56±0.16Cc CH2 36.64±0.91Aa 34.94±1.31ABb 33.18±0.36Bb 34.42±1.11Bb CH3 37.52±0.73Aa 32.45±0.37BCc 33.58±1.46Bb 30.81±0.47Cc a*值 CON 11.45±0.24Ac 11.20±0.44Ab 10.26±0.23Bb 8.84±0.25Cb CH1 13.88±0.32Aa 12.57±0.72Ba 11.64±0.50Ca 10.12±0.19Da CH2 12.74±0.64Ab 11.71±0.27Bab 10.65±0.19Cb 9.59±0.31Da CH3 15.12±1.13Aa 12.16±0.33Ba 10.54±0.27Cb 8.60±0.45Db b*值 CON 12.12±0.73Aab 10.85±0.64ABa 10.57±1.09Ba 9.86±0.59Ba CH1 9.85±0.25Ac 9.73±0.39Ab 9.63±0.37Aab 6.96±0.37Bc CH2 11.20±0.14Ab 10.29±0.27Bab 8.82±0.12Cb 8.22±0.42Db CH3 13.28±0.96Aa 8.60±0.54Bc 8.48±0.98Bb 7.13±0.25Cc a*值在整个成熟期间则呈现下降趋势,且差异显著(P<0.05)。与CON组相比,复配处理组基本上提高了牦牛肉的a*值。其中,成熟3 d时复配处理组整体上高于CON组,之后则略高于CON组,但差异不显著(P>0.05)。其中,Arg处理组在成熟前期还表现出浓度依赖性。以上结果说明,Arg和CH复配处理提高了不同成熟时间点牦牛肉的a*值,这可能在于Arg和CH的抗氧化和金属离子螯合能力[4,26]。同样,b*值在成熟期间显著下降(P<0.05),但复配处理组整体上低于CON组,到了成熟后期则显著低于CON组(P < 0.05)。较大的b*值可能是由于MP的氧化程度提高造成的[27]。
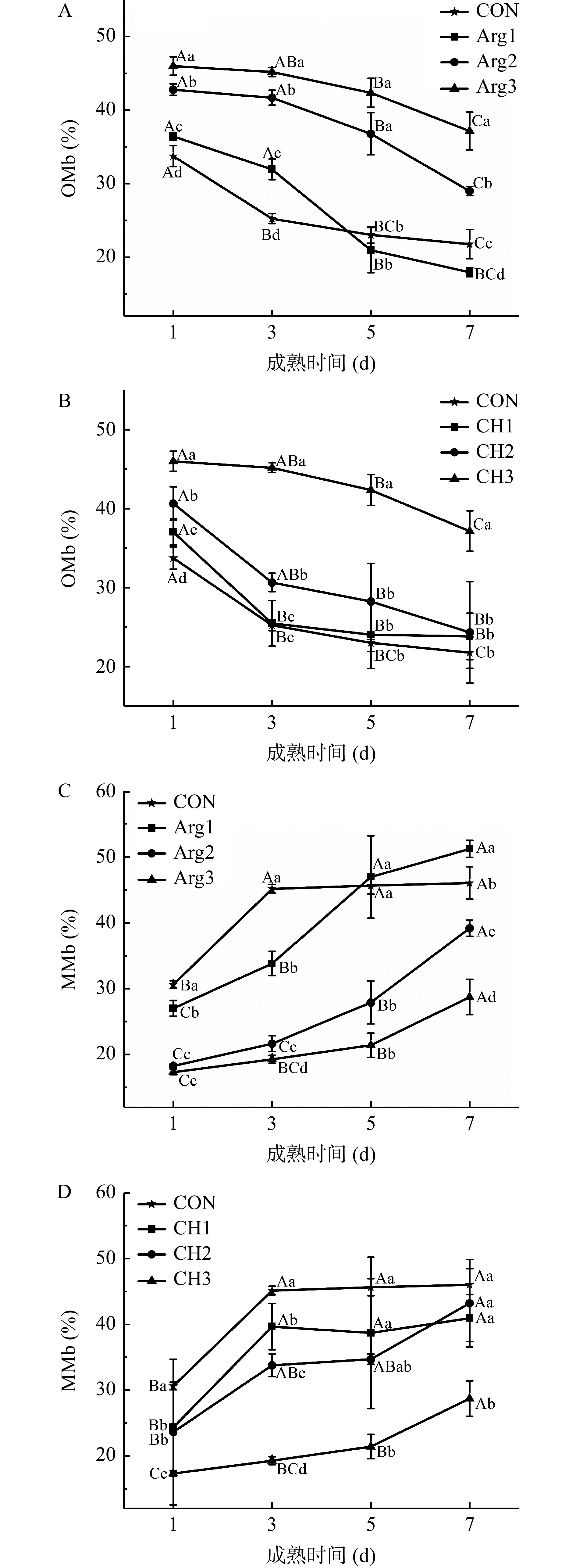
2.2.2 Arg与CH复配对宰后牦牛肉成熟过程中MP氧化状态的影响
由图2(A、B)可知。成熟期间,牦牛肉中OMb含量呈现下降趋势,3 d后开始显著下降(P<0.05)。其中,成熟前期,所有复配处理组OMb含量显著高于CON组(P<0.05),OMb含量的增加与Arg或CH的添加量成正比,呈浓度依赖性,添加量越大(Arg3、CH3)OMb含量越大,说明Arg和CH复配添加能够减缓MP的氧化速率。这可能是由于Arg和CH的抗氧化性,使得MP内部二价铁离子不被氧化[16,28]。成熟后期,OMb含量均显著下降(P<0.05),但处理组OMb含量整体上高于CON组,只有Arg1组略低于CON组,CH1略高于CON组。这表明单独添加CH或Arg对MP的保护作用并不明显,这与Ning等[4]报道的结果一致,且当它们与其他物质复配时,效果明显。因此可以说明,Arg和CH的复配确实增加了两者的协同作用,共同促进了对MP的保护作用,使其在有氧体系更加稳定。
图2(C、D)中,当MMb含量越多时,肉品氧化越严重。从图中可以看到,MMb的变化与OMb呈完全相反的趋势,进一步证明,在成熟期间,OMb不断被氧化为MMb,MP中铁卟啉环二价铁不断被氧化为三价铁。而Arg和CH复配处理后,这种转化明显下降,且高浓度组显著低于CON组(P<0.05)。综上所述,当 Arg 添加 0.4% 和 0.8% 且与 1.0%CH复配时,降低了L*、b*值,增加了a*值及OMb含量,延缓了OMb向MMb的转化,显著提高了牦牛肉成熟期间的肉色稳定性。
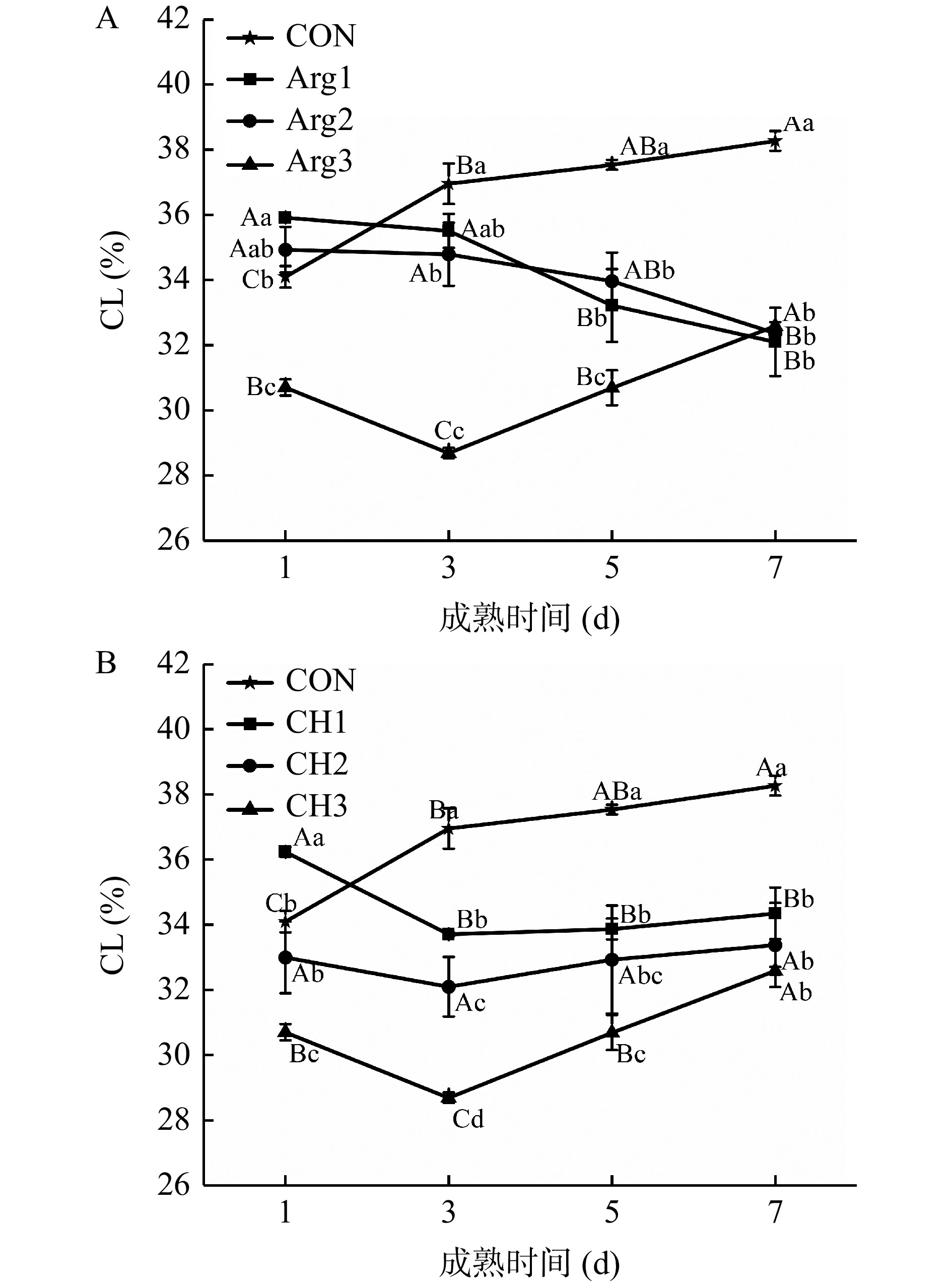
2.3 Arg与CH复配对宰后牦牛肉成熟过程中CL的影响
图3(A、B)中,在成熟期间,CON组CL随时间显著增加(P<0.05),复配处理组则表现出不同的变化趋势,成熟中后期,其CL整体上显著低于CON组(P<0.05)。其中,Arg3、CH1、CH2、CH3组CL随时间先下降后缓慢增加;Arg1和Arg2组则随时间不断下降,且两组差异不显著(P>0.05),而此时Arg的添加量增加,CH添加量不变,说明此时添加Arg对CL的影响并非主要原因,可能是CH起主导作用。但当Arg浓度增加时(Arg3),CL显著下降(P<0.05),且第3 d达到最低值,说明高浓度的Arg(0.8%)与CH协同效果更加明显,其复配显著降低了CL。此外,图3B中,随CH浓度的不断增加,CL不断下降,表现出浓度依赖性,且显著低于CON组(P<0.05)。说明高浓度的CH(0.5%~1.0%)与Arg复配,同样能够更好保持牦牛肉中的水分。Zheng[8]、Zhou等[25]的研究结果也表明,当添加了Arg后,体系的CL也明显下降,而这可能是因为Arg改变了肌球蛋白的溶解性,降低蛋白的α-螺旋含量,内部的疏水基团暴露[29]以及形成了连续、均匀的凝胶网络结构[30],从而保留了水分。与Arg类似,CH则可能通过改变肉品pH,使肌球蛋白偏离其等电点而改变溶解性。
2.4 Arg与CH复配对宰后牦牛肉成熟过程中MFI的影响
图4(A、B)中,在成熟期间,所有处理组的MFI均呈现先增加后下降,然后显著增加的趋势(P<0.05)。与CON组相比,Arg和CH复配处理组整体上增加了MFI,其中,在第3、5 d时增加较为显著,且Arg1和CH2组MFI在整个成熟期均表现出显著增加的优势(P<0.05)。MFI是肉制品嫩化程度的表征,牦牛肉中MFI的增加说明添加Arg和CH,可能通过影响了肌原纤维内部降解骨架蛋白的酶活性,如钙激活酶等,从而促进了牦牛肉的嫩化[31]。然而到成熟第5 d时,MFI出现下降趋势,这与Clausen等[32]的研究发现一致。嫩度的改善依赖于机体自身的内源酶体系。Huang等[33]研究则表明,caspase-6的专一性抑制在成熟前3 d会抑制骨骼肌蛋白的降解。第5 d出现的下降可能是因为蛋白的降解不再受专一性抑制的影响,使蛋白降解为小分子的氨基酸而无法被检测出。此外,由于牦牛肉生活在高寒地区,肌纤维较粗,嫩度较差,由于影响嫩度改善的内源酶对肌原纤维蛋白成熟初期的有限降解[34],到了后期降解不再受到影响,从而导致了成熟后期MFI值的回升。
2.5 Arg与CH复配对宰后牦牛肉成熟过程中质构特性的影响
表3、表4结果显示,在成熟过程中,硬度值逐渐增加,且差异显著(P<0.05)。其中,添加了Arg和CH后,各复配处理组的硬度值均显著高于CON组(P<0.05),这与Zhou等[25]、Chattopadhyay等[35]的研究结果相一致,复配物质的添加,促进了肌原纤维蛋白凝胶的形成,从而导致凝胶强度的提升。同样的,随着成熟时间的延长,样品的弹性、粘聚性、咀嚼性等质构特性整体上表现出相同的趋势,且均高于CON组。肉样中质构特性的改变可能受蛋白凝胶特性的影响。研究表明,肉样体系的pH会影响蛋白的凝胶特性,当其靠近蛋白等电点时,导致蛋白聚集[25],不利于形成凝胶结构。因此,添加的Arg和CH碱性物质,使pH偏离等电点,有利于形成更加紧密的凝胶结构,并截留大量水分,最终获得产量更大,抗压能力更强的肉制品。此外,Kachanechai等[11]研究也表明,CH会促进形成了更加强的凝胶结构,且CH和蛋白之间的结合最终由共价和非共价相互作用形成。
表 3 不同Arg处理组对牦牛肉成熟过程中TPA的影响Table 3. Effects of different arginine treatment groups on texture of yak meat during maturation质构特性 组别 成熟时间(d) 1 3 5 7 硬度(g) CON 1126.8±4.59Cd 1207.5±16.68Cc 1300.2±3.37Bd 1469.6±57.98Ab Arg1 1362.4±30.23BCc 1338.2±139.58Cbc 1553.2±8.96Ac 1579±22.03Ab Arg2 1715.7±21.51Cb 1472.8±11.79Db 1931.9±33.99Ab 1871.4±8.87Ba Arg3 2084.9±76.77Aa 1940.7±20.28Aa 2113.8±25.95Aa 1952.8±112.68Aa 弹性(mm) CON 0.723±0.02Aa 0.665±0.046Aa 0.709±0.006Aa 0.68±0.05Aa Arg1 0.711±0.02Aa 0.719±0.01Aa 0.728±0.01Aa 0.728±0.02Aa Arg2 0.675±0.01Aa 0.736±0.01Aa 0.722±0.04Aa 0.74±0.03Aa Arg3 0.686±0.04Aa 0.675±0.02Aa 0.718±0.01Aa 0.739±0.02Aa 黏性(N.sec) CON 0.629±0.002Ab 0.632±0.029Ab 0.663±0.053Aa 0.655±0.097Aa Arg1 0.679±0.03Aab 0.66±0.01Aab 0.694±0.03Aa 0.728±0.02Aa Arg2 0.678±0.02Ab 0.697±0.01Aab 0.691±0.05Aa 0.695±0.05Aa Arg3 0.733±0.01Aa 0.734±0.05Aa 0.705±0.08Aa 0.718±0.02Aa 胶着性(N) CON 708.84±5.26Ad 763.71±45.78Ac 861.89±66.72Ac 965.34±180.45Ab Arg1 925.3±65.92BCc 883.1±86.66Cbc 1078.3±39.84ABbc 1149.5±16.61Aab Arg2 1149.5±18.92BCb 1026.3±21.44Cb 1334.4±68.38Aab 1301.4±99.91ABa Arg3 1527.8±66.98Aa 1423.3±76.6Aa 1491.3±184.33Aa 1400±35.74Aa 咀嚼性(mJ) CON 512.39±10.15Ac 509.18±65.75Ac 611.03±41.75Ac 661.27±170.77Ab Arg1 658.8±63.42BCbc 635.2±70.86Cbc 785±19.83ABbc 836.7±7.36Aab Arg2 776.1±24.29Ab 755.2±7.43Ab 965±104.49Aab 964.9±111.09Aa Arg3 1050±108.75Aa 961.4±79.85Aa 1072.1±147.31Aa 1034.3±1.52Aa 表 4 不同CH处理对牦牛肉成熟过程中TPA的影响Table 4. Effects of different chitosan treatment groups on texture of yak meat during maturation质构特性 组别 成熟时间(d) 1 3 5 7 硬度(g) CON 1126.8±4.59Cd 1207.5±16.68Cd 1300.2±3.37Bc 1469.6±57.98Ac CH1 1492.6±20.44Bc 1466.2±2.98Bc 1774.2±58.94Ab 1767.7±155.21Ab CH2 1817.8±8.65Bb 1568±39.41Db 1734.1±27.79Cb 2414.8±7.57Aa CH3 2084.9±76.77Aa 1940.7±20.28Aa 2113.8±25.95Aa 1952.8±112.68Ab 弹性(mm) CON 0.723±0.02Aa 0.665±0.046Aa 0.709±0.006Ab 0.68±0.05Aa CH1 0.696±0.01Aa 0.742±0.02Aa 0.711±0.017Ab 0.722±0.03Aa CH2 0.741±0.05Aa 0.645±0.05Aa 0.775±0.02Aa 0.683±0.06Aa CH3 0.686±0.04Aa 0.675±0.02Aa 0.718±0.01Ab 0.739±0.02Aa 黏性(N.sec) CON 0.629±0.002Ab 0.632±0.029Ab 0.663±0.053Aa 0.655±0.097Aa CH1 0.65±0.05Aab 0.675±0.02Aa 0.692±0.044Aa 0.593±0.02Aa CH2 0.676±0.03Aab 0.611±0.02Bb 0.68±0.02Aa 0.65±0.01ABa CH3 0.733±0.01Aa 0.734±0.05Aa 0.705±0.08Aa 0.718±0.02Aa 胶着性(N) CON 708.84±5.26Ad 763.71±45.78Ac 861.89±66.72Ab 965.34±180.45Ab CH1 971.2±89.4Ac 989.5±26.87Ab 1228.6±118.26Aa 1050±124.84Ab CH2 1228.8±50.39Bb 957.1±6.37Cb 1178.7±47.87Bab 1570.8±26.96Aa CH3 1527.8±66.98Aa 1423.3±76.6Aa 1491.3±184.33Aa 1400±35.74Aa 咀嚼性(mJ) CON 512.39±10.15Ab 509.18±65.75Ac 611.03±41.75Ab 661.27±170.77Ab CH1 675.7±62.6Ab 734.2±39.88Ab 874±105.34Aab 756.8±59.27Ab CH2 909.1±28.45Ba 617.5±39.76Cab 913.7±55.4Ba 1071.6±71.2Aa CH3 1050±108.75Aa 961.4±79.85Aa 1072.1±147.31Aa 1034.3±1.52Aa 2.6 Arg与CH复配对宰后牦牛肉成熟过程中脂质氧化的影响
2.6.1 Arg与CH复配对宰后牦牛肉成熟过程中POV的影响
POV用于衡量脂肪氧化过程中初级氧化产物积累的情况。表5所示,Arg处理组中,成熟5 d之前,所有复配处理组POV整体上高于CON组。1 d时,POV均较高,说明脂肪氧化产物主要以过氧化物形式存在;3 d时,各组POV含量均下降;到成熟后期,CON组POV含量不断增加,而复配处理组则在7 d呈现下降趋势,且低于CON组(P<0.05),且表现出随着Arg浓度的增加,POV逐渐降低。脂肪氧化初期,初级过氧化物的积累,导致较高的POV,而初级过氧化物不稳定,易降解为次级氧化产物,其生成速率低于降解速率,使得POV含量下降;同时,Arg和CH协同处理组在成熟后期POV下降,说明两者的添加可能促进了初级氧化产物分解为醛、酮、酸等物质,从而降低了POV。而两者的协同添加对成熟前期脂肪氧化作用没有显著变化可能是因为,Arg和CH的复配添加促进了前期MP结构的快速展开,暴露更多的基团与酶、金属离子等促氧化剂接触[20]。
表 5 不同复配处理对牦牛肉成熟过程中POV值的影响Table 5. Effects of different compound treatments on peroxidation value of yak meat during maturation样品组 成熟时间(d) 1 3 5 7 CON 0.942±0.130Ab 0.363±0.019Ca 0.622±0.016Bb 1.115±0.001Aa Arg1 0.913±0.019Ab 0.737±0.570Aa 1.050±0.080Aa 0.632±0.092Ab Arg2 1.312±0.139Aa 0.408±0.163Ca 0.802±0.059Bab 0.340±0.007Cc Arg3 0.860±0.099Ab 0.490±0.189ABa 0.530±0.170ABb 0.312±0.151Bc CON 0.942±0.130Aa 0.363±0.019Cb 0.622±0.016Bb 1.115±0.001Aa CH1 0.812±0.125Aa 0.787±0.179Aa 0.552±0.016Ab 0.485±0.130Ab CH2 0.878±0.016BCa 0.705±0.111Cab 1.032±0.068Aa 1.028±0.000Aa CH3 0.860±0.099Aa 0.490±0.189ABab 0.530±0.170ABb 0.312±0.151Bb 同样,CH处理组中,1 d时,各处理组POV相差不大,3 d时,所有复配处理组(除CH1外)POV高于CON组但差异不显著(P>0.05)。随成熟时间的延长,CON组和CH2组表现出相同的增加趋势,且差异不显著(P>0.05)。相反的是,CH1和CH3组则呈现下降趋势,且只有在第7 d时显著低于CON组(P<0.05)。原因可能是,随着CH2组多糖的添加,其MP内部形成了更密的水分子通道,导致MP侧链基团与促氧化剂接触更多,但当其添加量增加(CH3)时,黏弹性的多糖胶体则形成较大的水分子通道[36],反而减少MP侧链基团与促氧化剂接触。以上结果表明,在整个成熟期间,低浓度的复配处理对脂肪氧化没有明显的抑制作用,且Kanatt等[37]的研究中也表明,当CH和薄荷复配使用时,并没有增加CH的抗氧化作用,而当CH作为涂层用于肉制品中,则延缓了脂肪氧化,且可能形成了氧气屏障[16];综上,0.8% Arg和1.0% CH的协同处理则在成熟后期对延缓脂肪氧化影响较为明显。
2.6.2 Arg与CH复配对宰后牦牛肉成熟过程中TBARS值的影响
表6中,在整个成熟期,TBARS值整体上呈上升趋势,所有复配处理组基本高于CON组。其中,Arg2、Arg3和CH3复配处理组在整个成熟期间与CON组差异显著(P<0.05),而成熟早期,Arg1、CH1和CH2则与CON组差异不显著(P>0.05),且CH1组在成熟后期TBARS值略低于CON组,但差异不显著(P>0.05),这说明单独添加Arg可能对延缓脂肪氧化有一定改善作用,这与Xu等[9]的报道相一致,且其延缓作用可能与Arg浓度有关。成熟7 d时,复配处理组TBARS值显著增加,原因在于初级氧化产物的进一步降解[38],其增加与POV含量没有表现出明显的对应关系,这可能是因为,POV中氢过氧化物本身不稳定易受外界环境的干扰而降解,且肌肉组织本身也比较复杂,在成熟过程中会发生诸多物理化学变化,虽然两者的协同作用保留了牦牛肉的水分,但高浓度多糖也可能造成了较大的空腔,破坏了结构,导致更多的侧链氨基与氧接触而促进氧化。Chattopadhyay等[35]的研究中也提出,当CH处于较高浓度时,则会导致较高的TBARS值。
表 6 不同复配处理对牦牛肉成熟过程中TBARS值的影响Table 6. Effect of different compound treatments on TBARS value of yak meat during maturation样品组 成熟时间(d) 1 3 5 7 CON 2.87±0.03Bc 3.13±0.26Bc 3.42±0.64Bc 4.56±0.33Ac Arg1 2.70±0.14Cd 3.22±0.26Bc 3.49±0.05Bc 3.97±0.21Ac Arg2 6.12±0.10Da 8.28±0.12Ba 7.05±0.15Ca 8.62±0.19Aa Arg3 3.39±0.05Cb 3.94±0.12Cb 4.66±0.36Bb 7.14±0.47Ab CON 2.87±0.03Bbc 3.13±0.26Bb 3.42±0.64Bb 4.56±0.33Ab CH1 3.13±0.26Bab 2.88±0.05Bb 2.87±0.47Bb 4.04±0.50Abc CH2 2.77±0.05Cc 3.24±0.07Bb 3.55±0.18Ab 3.35±0.09ABc CH3 3.39±0.05Ca 3.94±0.12Ca 4.66±0.36Ba 7.14±0.47Aa 2.7 Arg与CH复配对宰后牦牛肉成熟过程中蛋白氧化的影响
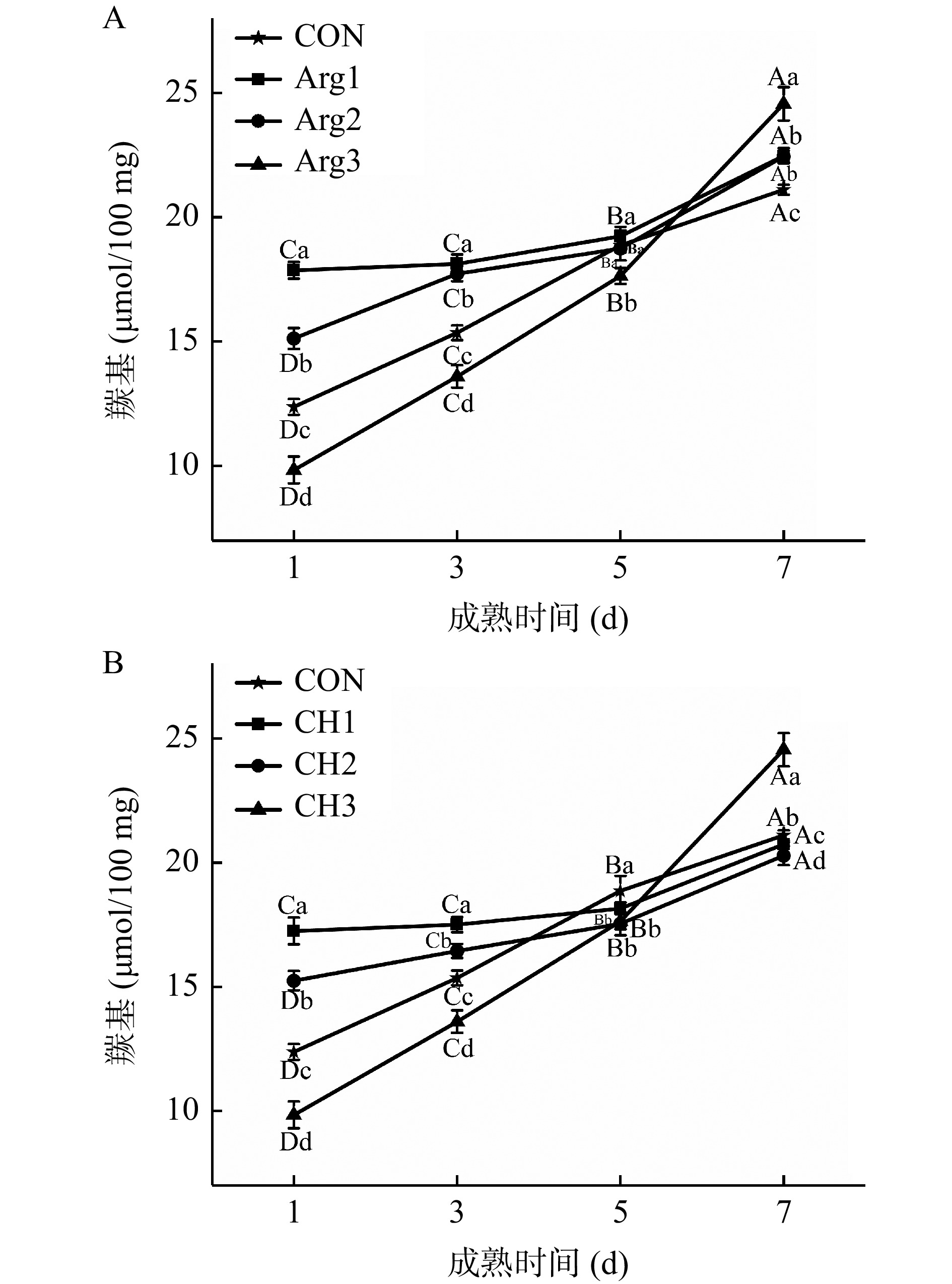
2.7.1 Arg与CH复配对宰后牦牛肉成熟过程中羰基含量的影响
蛋白质羰基化主要来源于氨基酸侧链的直接氧化。由图5(A、B)可知,羰基含量随着成熟时间的延长不断增加。在成熟前期,不同处理组间,随着Arg或CH浓度的增加(图A、B),羰基含量逐渐下降,且表现出浓度依赖性。其中,除了Arg3和CH3组羰基含量显著低于CON组外(P<0.05),其余复配处理组均显著高于CON组(P<0.05)。到第7 d时,Arg3和CH3组羰基化程度显著增加(P<0.05),且达到最大值。成熟后期,Arg1、Arg2和CH1、CH2组则与CON组基本一致。
成熟前期Arg复配处理组羰基含量普遍高于CON组可能是因为,与高浓度的CH多糖(1.0%)复配,导致组织结构造成一定程度的破坏,使其内部基团舒展并暴露在含有促氧化剂的水相[20],而此时低浓度的Arg添加不足以对体系起到保护作用从而促进了侧链基团的氧化。随着复配浓度增加,水分被截留在两者构成的复合体系中,减少了侧链氨基与氧化环境的接触,从而延缓了氧化程度。7 d时,Arg3和CH3组羰基含量显著增加,可能是因为添加了高浓度的Arg,而羰基氧化的侧链氨基酸主要是L-Thr、L-Arg、L-lys等氨基酸[38]。同样,CH复配处理组中,可能由于复配浓度中Arg含量(0.8%)较高,从而促进了氧化,且Chen等[5]研究表明,在成熟猪排中单独注射0.4% Arg时,则延缓了蛋白羰基化。
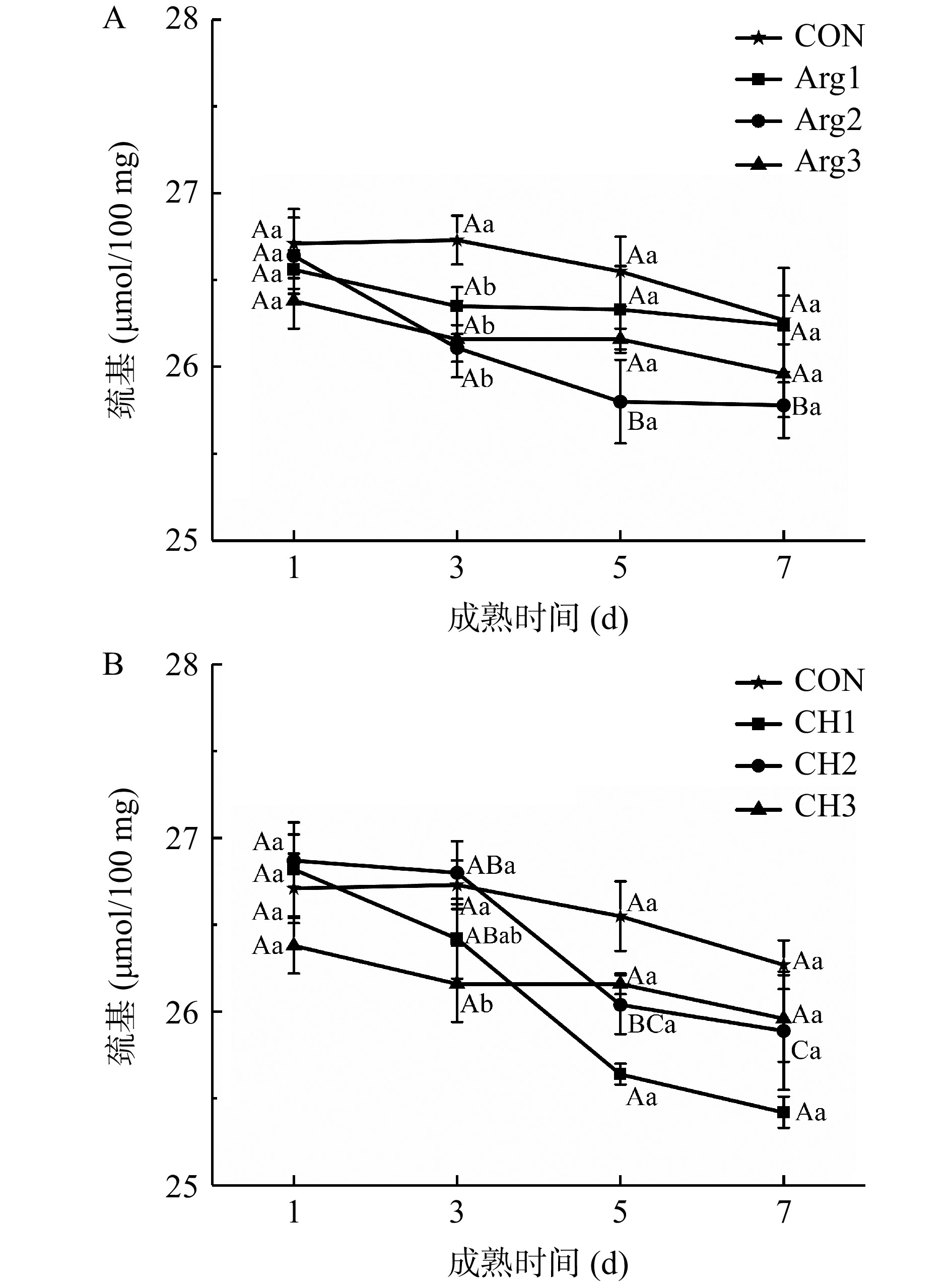
2.7.2 Arg与CH复配对宰后牦牛肉成熟过程中巯基含量的影响
如图6所示,在整个成熟期间,巯基含量下降,表明蛋白质氧化的发生。图6(A)中,与CON组相比,复配处理组降低了巯基含量,但差异不显著(P>0.05),其中,Arg2组在成熟后期巯基含量最低。图6(B)中,CH2组在1、3 d时略高于CON组,可能是因为Arg诱导了蛋白质结构的展开引起巯基暴露[39]。随着成熟时间的延长,各处理组巯基含量依旧下降,且低于CON组。这些结果表明,Arg和CH的复配略微加速了巯基的损失,同样,许鹏[20]也表明,虽然Arg降低了乳化香肠的羰基含量,但也促进了巯基损失,且作者表示,这可能是因为带正电的精氨酸增加了蛋白质中巯基与α,β−不饱和系列化合物的Michael加成反应,导致巯基含量下降,而Arg和CH均为带正电荷的物质。综上所述,低浓度Arg和CH复配对延缓蛋白氧化效果不明显,高浓度复配则显著降低了成熟前期蛋白羰基化,延缓了蛋白氧化程度,但其添加对巯基含量则没有显著影响。
2.8 Arg与CH复配对宰后牦牛肉成熟过程中MP结构的影响
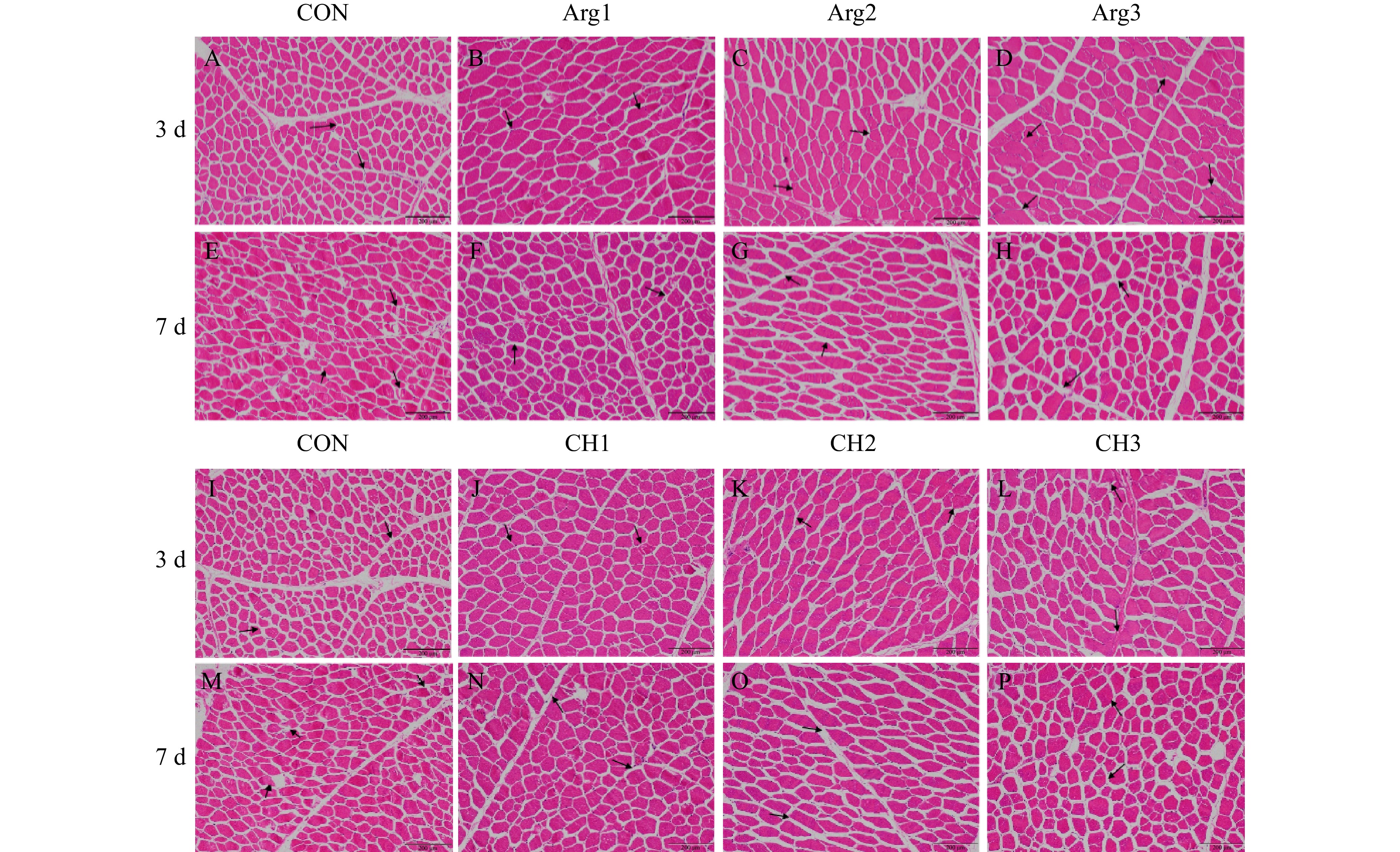
由图7可知,成熟3 d时,所有处理组MP肌束间空隙较小,细胞核多集中于肌纤维周围且数量较多;成熟7 d后,肌束间空隙增大,细胞核发生边缘化并降解。其中,成熟3 d时,CON组肌细胞横截面积较小,被水分通道截断成小而密的细胞单元,而Arg复配处理组和CH复配处理组细胞则更加完整饱满,细胞外空间更小,形成的水分通道明显减少,最终使得复配处理组CL显著下降(图3)。随着Arg浓度的增加,细胞间的接触更紧凑(Arg3组),从而减少MP侧链基团与水中促氧化剂的接触,降低蛋白氧化程度。7 d时,CON组细胞破坏较为严重,出现了明显的断裂和降解;所有复配处理组细胞损伤则较少,且中、高浓度组出现的细胞收缩较为明显,但其完整度和饱满度依旧高于CON组。以上结果说明,不同浓度的Arg或CH复配添加,使肌细胞在成熟期间更加完整饱满,水分流失减少,在成熟前期,高浓度处理组中水分通道的减少,也延缓了蛋白氧化。
3. 结论
Arg和CH复配处理降低了牦牛肉成熟期间的L*、b*值,提高了a*值、OMb含量,改善了牦牛肉的肉色稳定性,降低了牦牛肉的CL,并表现出浓度依赖性,同时,Arg和CH复配显著增加了牦牛肉的硬度,提高了MFI,促进了牦牛肉的嫩化。脂肪氧化和蛋白氧化结果表明,低浓度复配不能有效延缓脂肪和蛋白氧化,而成熟后期,随着复配浓度增加,牦牛肉脂肪氧化程度整体上降低;高浓度复配处理组蛋白羰基化程度则在成熟前、中期显著低于CON组,但巯基含量在整个成熟期间无显著差异。组织学观察中也发现,复配处理使肌细胞在成熟期间更加完整饱满,水分通道较少。研究表明,不同浓度Arg和不同浓度CH复配对宰后牦牛肉成熟过程中品质改善具有重要意义,因此,在肉制品加工中,本研究可为进一步探究Arg和CH的合适复配浓度以获得更优的牦牛肉制品提供理论支持。
-
表 1 不同Arg处理组对牦牛肉成熟过程中色度的影响
Table 1 Effect of different arginine treatments on color of yak meat during maturation
肉色指标 组别 成熟时间(d) 1 3 5 7 L*值 CON 38.20±1.64Aa 38.31±2.01Aa 39.63±0.29Aa 41.04±2.03Aa Arg1 37.87±2.32Aa 33.01±0.46Bb 33.61±1.74Bb 37.08±0.41Ab Arg2 39.31±0.75Aa 38.80±0.64ABa 35.42±0.56Cb 37.20±1.11Bb Arg3 37.52±0.73Aa 32.45±0.37BCb 33.58±1.46Bb 30.81±0.47Cc a*值 CON 11.45±0.24Ac 11.20±0.44Ab 10.26±0.23Ba 8.84±0.25Ca Arg1 11.37±0.38Ac 11.61±0.21Aab 10.65±0.18Ba 9.21±0.51Ca Arg2 13.32±1.02Ab 11.99±0.51Aa 10.71±0.46Ba 8.45±0.55Ca Arg3 15.12±1.13Aa 12.16±0.33Ba 10.54±0.27Ca 8.60±0.45Da b*值 CON 12.12±0.73Aa 10.85±0.64ABa 10.57±1.09Ba 9.86±0.59Ba Arg1 11.37±0.76Aa 8.17±0.09Bb 7.93±0.82Bb 7.81±0.30Bb Arg2 11.58±0.82Aa 10.74±0.49Aa 9.27±0.42Bab 7.47±0.30Cb Arg3 13.28±0.96Aa 8.60±0.54Bb 8.48±0.98Bb 7.13±0.25Cb 注:不同小写字母表示同一成熟时间不同处理组间差异显著(P<0.05);不同大写字母表示同一处理组内不同成熟时间差异显著(P<0.05);表2~表6同。 表 2 不同CH处理对牦牛肉成熟过程中色度的影响
Table 2 Effects of different CH treatments on color of yak meat during maturation
肉色指标 组别 成熟时间(d) 1 3 5 7 L*值 CON 38.20±1.64Aa 38.31±2.01Aa 39.63±0.29Aa 41.04±2.03Aa CH1 34.27±0.89Ab 32.59±0.28Bc 32.36±0.48Bb 29.56±0.16Cc CH2 36.64±0.91Aa 34.94±1.31ABb 33.18±0.36Bb 34.42±1.11Bb CH3 37.52±0.73Aa 32.45±0.37BCc 33.58±1.46Bb 30.81±0.47Cc a*值 CON 11.45±0.24Ac 11.20±0.44Ab 10.26±0.23Bb 8.84±0.25Cb CH1 13.88±0.32Aa 12.57±0.72Ba 11.64±0.50Ca 10.12±0.19Da CH2 12.74±0.64Ab 11.71±0.27Bab 10.65±0.19Cb 9.59±0.31Da CH3 15.12±1.13Aa 12.16±0.33Ba 10.54±0.27Cb 8.60±0.45Db b*值 CON 12.12±0.73Aab 10.85±0.64ABa 10.57±1.09Ba 9.86±0.59Ba CH1 9.85±0.25Ac 9.73±0.39Ab 9.63±0.37Aab 6.96±0.37Bc CH2 11.20±0.14Ab 10.29±0.27Bab 8.82±0.12Cb 8.22±0.42Db CH3 13.28±0.96Aa 8.60±0.54Bc 8.48±0.98Bb 7.13±0.25Cc 表 3 不同Arg处理组对牦牛肉成熟过程中TPA的影响
Table 3 Effects of different arginine treatment groups on texture of yak meat during maturation
质构特性 组别 成熟时间(d) 1 3 5 7 硬度(g) CON 1126.8±4.59Cd 1207.5±16.68Cc 1300.2±3.37Bd 1469.6±57.98Ab Arg1 1362.4±30.23BCc 1338.2±139.58Cbc 1553.2±8.96Ac 1579±22.03Ab Arg2 1715.7±21.51Cb 1472.8±11.79Db 1931.9±33.99Ab 1871.4±8.87Ba Arg3 2084.9±76.77Aa 1940.7±20.28Aa 2113.8±25.95Aa 1952.8±112.68Aa 弹性(mm) CON 0.723±0.02Aa 0.665±0.046Aa 0.709±0.006Aa 0.68±0.05Aa Arg1 0.711±0.02Aa 0.719±0.01Aa 0.728±0.01Aa 0.728±0.02Aa Arg2 0.675±0.01Aa 0.736±0.01Aa 0.722±0.04Aa 0.74±0.03Aa Arg3 0.686±0.04Aa 0.675±0.02Aa 0.718±0.01Aa 0.739±0.02Aa 黏性(N.sec) CON 0.629±0.002Ab 0.632±0.029Ab 0.663±0.053Aa 0.655±0.097Aa Arg1 0.679±0.03Aab 0.66±0.01Aab 0.694±0.03Aa 0.728±0.02Aa Arg2 0.678±0.02Ab 0.697±0.01Aab 0.691±0.05Aa 0.695±0.05Aa Arg3 0.733±0.01Aa 0.734±0.05Aa 0.705±0.08Aa 0.718±0.02Aa 胶着性(N) CON 708.84±5.26Ad 763.71±45.78Ac 861.89±66.72Ac 965.34±180.45Ab Arg1 925.3±65.92BCc 883.1±86.66Cbc 1078.3±39.84ABbc 1149.5±16.61Aab Arg2 1149.5±18.92BCb 1026.3±21.44Cb 1334.4±68.38Aab 1301.4±99.91ABa Arg3 1527.8±66.98Aa 1423.3±76.6Aa 1491.3±184.33Aa 1400±35.74Aa 咀嚼性(mJ) CON 512.39±10.15Ac 509.18±65.75Ac 611.03±41.75Ac 661.27±170.77Ab Arg1 658.8±63.42BCbc 635.2±70.86Cbc 785±19.83ABbc 836.7±7.36Aab Arg2 776.1±24.29Ab 755.2±7.43Ab 965±104.49Aab 964.9±111.09Aa Arg3 1050±108.75Aa 961.4±79.85Aa 1072.1±147.31Aa 1034.3±1.52Aa 表 4 不同CH处理对牦牛肉成熟过程中TPA的影响
Table 4 Effects of different chitosan treatment groups on texture of yak meat during maturation
质构特性 组别 成熟时间(d) 1 3 5 7 硬度(g) CON 1126.8±4.59Cd 1207.5±16.68Cd 1300.2±3.37Bc 1469.6±57.98Ac CH1 1492.6±20.44Bc 1466.2±2.98Bc 1774.2±58.94Ab 1767.7±155.21Ab CH2 1817.8±8.65Bb 1568±39.41Db 1734.1±27.79Cb 2414.8±7.57Aa CH3 2084.9±76.77Aa 1940.7±20.28Aa 2113.8±25.95Aa 1952.8±112.68Ab 弹性(mm) CON 0.723±0.02Aa 0.665±0.046Aa 0.709±0.006Ab 0.68±0.05Aa CH1 0.696±0.01Aa 0.742±0.02Aa 0.711±0.017Ab 0.722±0.03Aa CH2 0.741±0.05Aa 0.645±0.05Aa 0.775±0.02Aa 0.683±0.06Aa CH3 0.686±0.04Aa 0.675±0.02Aa 0.718±0.01Ab 0.739±0.02Aa 黏性(N.sec) CON 0.629±0.002Ab 0.632±0.029Ab 0.663±0.053Aa 0.655±0.097Aa CH1 0.65±0.05Aab 0.675±0.02Aa 0.692±0.044Aa 0.593±0.02Aa CH2 0.676±0.03Aab 0.611±0.02Bb 0.68±0.02Aa 0.65±0.01ABa CH3 0.733±0.01Aa 0.734±0.05Aa 0.705±0.08Aa 0.718±0.02Aa 胶着性(N) CON 708.84±5.26Ad 763.71±45.78Ac 861.89±66.72Ab 965.34±180.45Ab CH1 971.2±89.4Ac 989.5±26.87Ab 1228.6±118.26Aa 1050±124.84Ab CH2 1228.8±50.39Bb 957.1±6.37Cb 1178.7±47.87Bab 1570.8±26.96Aa CH3 1527.8±66.98Aa 1423.3±76.6Aa 1491.3±184.33Aa 1400±35.74Aa 咀嚼性(mJ) CON 512.39±10.15Ab 509.18±65.75Ac 611.03±41.75Ab 661.27±170.77Ab CH1 675.7±62.6Ab 734.2±39.88Ab 874±105.34Aab 756.8±59.27Ab CH2 909.1±28.45Ba 617.5±39.76Cab 913.7±55.4Ba 1071.6±71.2Aa CH3 1050±108.75Aa 961.4±79.85Aa 1072.1±147.31Aa 1034.3±1.52Aa 表 5 不同复配处理对牦牛肉成熟过程中POV值的影响
Table 5 Effects of different compound treatments on peroxidation value of yak meat during maturation
样品组 成熟时间(d) 1 3 5 7 CON 0.942±0.130Ab 0.363±0.019Ca 0.622±0.016Bb 1.115±0.001Aa Arg1 0.913±0.019Ab 0.737±0.570Aa 1.050±0.080Aa 0.632±0.092Ab Arg2 1.312±0.139Aa 0.408±0.163Ca 0.802±0.059Bab 0.340±0.007Cc Arg3 0.860±0.099Ab 0.490±0.189ABa 0.530±0.170ABb 0.312±0.151Bc CON 0.942±0.130Aa 0.363±0.019Cb 0.622±0.016Bb 1.115±0.001Aa CH1 0.812±0.125Aa 0.787±0.179Aa 0.552±0.016Ab 0.485±0.130Ab CH2 0.878±0.016BCa 0.705±0.111Cab 1.032±0.068Aa 1.028±0.000Aa CH3 0.860±0.099Aa 0.490±0.189ABab 0.530±0.170ABb 0.312±0.151Bb 表 6 不同复配处理对牦牛肉成熟过程中TBARS值的影响
Table 6 Effect of different compound treatments on TBARS value of yak meat during maturation
样品组 成熟时间(d) 1 3 5 7 CON 2.87±0.03Bc 3.13±0.26Bc 3.42±0.64Bc 4.56±0.33Ac Arg1 2.70±0.14Cd 3.22±0.26Bc 3.49±0.05Bc 3.97±0.21Ac Arg2 6.12±0.10Da 8.28±0.12Ba 7.05±0.15Ca 8.62±0.19Aa Arg3 3.39±0.05Cb 3.94±0.12Cb 4.66±0.36Bb 7.14±0.47Ab CON 2.87±0.03Bbc 3.13±0.26Bb 3.42±0.64Bb 4.56±0.33Ab CH1 3.13±0.26Bab 2.88±0.05Bb 2.87±0.47Bb 4.04±0.50Abc CH2 2.77±0.05Cc 3.24±0.07Bb 3.55±0.18Ab 3.35±0.09ABc CH3 3.39±0.05Ca 3.94±0.12Ca 4.66±0.36Ba 7.14±0.47Aa -
[1] 郭兆斌, 余群力, 陈骋, 等. 宰后牦牛肉水分分布变化与持水性能关系研究[J]. 农业机械学报,2019,50(10):343−351. [GUO Zaobin, YU Qunli, CHEN Cheng, et al. Relationship between water distribution change and water retention properties of yak meat during postmortem aging[J]. Transactions of the Chinese Society for Agricultural Machinery,2019,50(10):343−351. doi: 10.6041/j.issn.1000-1298.2019.10.040 [2] 杨巧能, 梁琪, 文鹏程, 等. 不同年龄牦牛宰后钙激活酶活性及嫩度指标变化[J]. 食品科学,2016,37(1):45−49. [YANG Qiaoneng, LIANG Qi, WEN Pengcheng, et al. Changes of calpain activity and tenderness indexes during postmortem of yak meat from different aged yaks[J]. Food Science,2016,37(1):45−49. doi: 10.7506/spkx1002-6630-201601009 [3] 崔文斌, 宋艳艳, 李明华, 等. 高铁肌红蛋白氧化对牦牛肉肌原纤维蛋白生化特性的影响[J]. 食品科学,2020,41(12):77−83. [CUI Wenbin, SONG Yanyan, LI Minghua, et al. Effect of metmyoglobin oxidation on biochemical characteristics of myofibrillar protein in yak meat[J]. Food Science,2020,41(12):77−83. doi: 10.7506/spkx1002-6630-20190320-268 [4] NING Cheng, LI Linxian, FANG Hongmei, et al. L-Lysine/L- arginine/L-cysteine synergistically improves the color of cured sausage with NaNO2 by hindering myoglobin oxidation and promoting nitrosyl myoglobin formation[J]. Food Chemistry,2019,284:219−226. doi: 10.1016/j.foodchem.2019.01.116
[5] CHEN Li, BAO Pengqi, WANG Yan, et al. Improving quality attributes of refrigerated prepared pork chops by injecting L-arginine and L-lysine solution[J]. Food Science and Technology,2022,153:112423.
[6] ZHU Xiaoxu, LI Linxian, LI Shiyi, et al. L-Arginine/L-lysine improves emulsion stability of chicken sausage by increasing electrostatic repulsion of emulsion droplet and decreasing the interfacial tension of soybean oil-water[J]. Food Hydrocolloids,2019,89:492−502. doi: 10.1016/j.foodhyd.2018.11.021
[7] ZHU Xiaoxu, NING Cheng, LI Shiyi, et al. Effects of L-lysine/L-arginine on the emulsion stability, textural, rheological and microstructural characteristics of chicken sausages[J]. International Journal of Food Science and Technology,2018,53(1):88−96. doi: 10.1111/ijfs.13561
[8] ZHENG Yadong. Effects of L-lysine/L-arginine on the physicochemical properties and quality of sodium reduced and phosphate-free pork sausage[J]. International Journal of Nutrition and Food Sciences,2017,6(1):12−18. doi: 10.11648/j.ijnfs.20170601.13
[9] XU Peng, ZHENG Yadong, ZHU Xiaoxu, et al. L-lysine and L-arginine inhibit the oxidation of lipids and proteins of emulsion sausage by chelating iron ion and scavenging radical[J]. Asian-Australasian Journal of Animal Sciences,2018,31(6):905−913. doi: 10.5713/ajas.17.0617
[10] 李星科. 壳聚糖的增稠、乳化性质及机制研究[D]. 无锡: 江南大学, 2011 LI Xingke. Study on thickening, emulsifying properties and mechanism of chitosan[D]. Wuxi: Jiangnan University, 2011.
[11] KACHANECHAI T, JANTAWAT P, PICHYANGKURA R. The influence of chitosan on physico-chemical properties of chicken salt-soluble protein gel[J]. Food Hydrocolloids,2008,22(1):74−83. doi: 10.1016/j.foodhyd.2007.04.010
[12] LI Xingke, XIA WenShui. Effects of chitosan on the gel properties of salt-soluble meat proteins from silver carp[J]. Carbohydrate Polymers,2010,82(3):958−964. doi: 10.1016/j.carbpol.2010.06.026
[13] 李楠, 吴婧, 单林鲜, 等. 壳聚糖-三七叶黄酮复合保鲜剂对冷鲜黄牛肉的保鲜效果[J]. 肉类研究,2020,34(4):71−76. [LI Nan, WU Jing, SHAN Linxian, et al. A chitosan-based coating with flavonoids extracted from Panax notoginseng leaves extends the shelf life of refrigerated beef[J]. Meat Research,2020,34(4):71−76. doi: 10.7506/rlyj1001-8123-20200220-050 [14] CHENG Yuanxia, HU Jingfei, WU Shengjun. Chitosan based coatings extend the shelf-life of beef slices during refrigerated storage[J]. Food Science and Technology,2021,138:110694.
[15] SUMAN S P, MANCINI R A, JOSEPH P, et al. Packaging-specific influence of chitosan on color stability and lipid oxidation in refrigerated ground beef[J]. Meat Science,2010,86(4):994−998. doi: 10.1016/j.meatsci.2010.08.006
[16] KANATT S R, RAO M S, CHAWLA S P, et al. Effects of chitosan coating on shelf-life of ready-to-cook meat products during chilled storage[J]. Food Science and Technology,2013,53(1):321−326.
[17] WANG Wenjie, XUE Changhu, MAO Xiangzhao. Chitosan: Structural modification, biological activity and application[J]. International Journal of Biological Macromolecules,2020,64:4532−4564.
[18] 马国源. 低剂量亚硝酸钠抑制牦牛肉肌红蛋白氧化的作用机制[D]. 兰州: 甘肃农业大学, 2021 MA Guoyuan. The mechanism of low dose sodium nitrite inhibiting the oxidation of yak meat myoglobin[D]. Lanzhou: Gansu Agricultural University, 2021.
[19] 张坤, 王道营, 张淼, 等. 高强度超声对鹅胸肉嫩度及品质的影响[J]. 食品科学,2018,39(15):122−127. [ZHANG Kun, WANG Daoying, ZHANG Miao, et al. Effect of high-intensity ultrasonic treatment on goose tenderness and meat quality[J]. Food Science,2018,39(15):122−127. doi: 10.7506/spkx1002-6630-201815018 [20] 许鹏. 赖氨酸/精氨酸对乳化香肠脂肪和蛋白质氧化及品质影响的研究[D]. 合肥: 合肥工业大学, 2017 XU Peng. The study of the effects of Lysine/Arginine on lipid and protein oxidation and quality properties of emulsion sausages[D]. Hefei: Hefei University of Technology, 2017.
[21] 王琳琳, 陈炼红, 李璐倩, 等. 解冻方式对牦牛肉蛋白氧化、功能特性及新鲜度的影响[J]. 农业机械学报,2021,52(5):342−349. [WANG Linlin, CHEN Lianhong, LI Luqian, et al. Effects of thawing methods on protein oxidation, protein functional properties and freshness of yak meat[J]. Transactions of the Chinese Society for Agricultural Machinery,2021,52(5):342−349. doi: 10.6041/j.issn.1000-1298.2021.05.038 [22] NYCHAS G J E, SKANDAMIS P N, TASSOU C C, et al. Meat spoilage during distribution[J]. Meat Science,2008,78(1−2):77−89. doi: 10.1016/j.meatsci.2007.06.020
[23] SANTOS M H S. Biogenic amines: Their importance in foods[J]. International Journal of Food Microbiology,1996,29(2−3):213−231. doi: 10.1016/0168-1605(95)00032-1
[24] DARMADJI P, IZUMIMOTO M. Effect of chitosan in meat preservation[J]. Meat Science,1994,38(2):243−254. doi: 10.1016/0309-1740(94)90114-7
[25] ZHOU Cunliu, LI Jun, TAN Shengjiang, et al. Effects of l-arginine on physicochemical and sensory characteristics of pork sausage[J]. Advance Journal of Food Science and Technology,2014,6(5):660−667. doi: 10.19026/ajfst.6.91
[26] GEORGANTELIS D, BLEKAS G, KATIKOU P, et al. Effect of rosemary extract, chitosan and a-tocopherol on lipid oxidation and colour stability during frozen storage of beef burgers[J]. Meat Science,2007,75:256−264. doi: 10.1016/j.meatsci.2006.07.018
[27] MANCINI R, HUNT M. Current research in meat color[J]. Meat Science,2005,71(1):100−121. doi: 10.1016/j.meatsci.2005.03.003
[28] ZHANG Yawei, GUO Xiuyun, PENG Zengqi, et al. A review of recent progress in reducing NaCl content in meat and fish products using basic amino acids[J]. Trends in Food Science & Technology,2022,119:215−226.
[29] GUO X Y, PENG Z Q, ZHANG Y W, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chemistry,2018,170:212−217.
[30] LEI Zhen, FU Yuan, XU Peng, et al. Effects of l-arginine on the physicochemical and gel properties of chicken actomyosin[J]. International Journal of Biological Macromolecules,2016,92:1258−1265. doi: 10.1016/j.ijbiomac.2016.08.040
[31] 黄明, 周光宏, 徐幸莲, 等. 不同注射处理对牛肉剪切力和肌原纤维小片化指数的影响[J]. 食品科学,2005(2):68−70. [HUANG Ming, ZHOU Guanghong, XU Xinglian, et al. Effects of injection treatments on beef warner-bratzler shear force and myofibrillar fragmentation index[J]. Food Science,2005(2):68−70. doi: 10.3321/j.issn:1002-6630.2005.02.011 [32] CLAUSEN I, JAKOBSEN M, ERTBJERG P, et al. Modified atmosphere packaging affects lipid oxidation, myofibrillar fragmentation index and eating quality of beef[J]. Packaging Technology and Science,2009,22(2):85−96. doi: 10.1002/pts.828
[33] HUANG Ming, HUANG Feng, MA Hanjun, et al. Preliminary study on the effect of caspase-6 and calpain inhibitors on postmortem proteolysis of myofibrillar proteins in chicken breast muscle[J]. Meat Science,2012,90(3):536−542. doi: 10.1016/j.meatsci.2011.09.004
[34] 王惠惠. 不同氧化强度下内源酶对牦牛肉宰后嫩度形成的影响[D]. 兰州: 甘肃农业大学, 2020 WANG Huihui. Effect of endogenous enzymes on the formation of tenderness of yak meat under different oxidation intensity during postmortem aging[D]. Lanzhou: Gansu Agricultural University, 2020.
[35] CHATTOPADHYAY K, XAVIER K A M, BALANGE A, et al. Chitosan gel addition in pre-emulsified fish mince-Effect on quality parameters of sausages under refrigerated storage[J]. Food Science and Technology,2019,110:283−291.
[36] ZHUANG Xinbo, WANG Lijian, JIANG Xiping, et al. Insight into the mechanism of myofibrillar protein gel influenced by konjac glucomannan: Moisture stability and phase separation behavior[J]. Food Chemistry, 2020, 127941.
[37] KANATT S R, CHANDER R, SHARMA A. Chitosan and mint mixture: A new preservative for meat and meat products[J]. Food Chemistry,2008,107(2):845−852. doi: 10.1016/j.foodchem.2007.08.088
[38] 李立敏, 成立新, 高爱武. 肉糜体系的氧化稳定性机理及影响因素[J]. 食品工业,2019,40(11):282−286. [LI Limin, CHENG Lixin, GUO Aiwu. Mechanism and influencing factors of oxidative stability of meat batters system[J]. The Food Industry,2019,40(11):282−286. [39] LI Shiyi, ZHENG Yadong, XU Peng, et al. L-Lysine and L-arginine inhibit myosin aggregation and interact with acidic amino acid residues of myosin: The role in increasing myosin solubility[J]. Food Chemistry,2018,242:22−28. doi: 10.1016/j.foodchem.2017.09.033
-
期刊类型引用(0)
其他类型引用(2)









 下载:
下载:

 下载:
下载:



