Effects of High Salt-intake on Renal Injury and Fibrosis in C57BL/6J Mice
-
摘要: 为进一步探究高盐摄入对普通小鼠肾脏的影响,本研究以C57BL/6J小鼠为研究对象,分为正常对照组(NC)、4%高盐组以及8%高盐组,分别喂养NaCl含量为0.5%、4%及8%的饲料,对比小鼠的肾功能指标、炎症因子分泌量以及病理损伤和纤维化程度。结果表明,高盐摄入导致C57BL/6J小鼠的肾功能损伤,显著性提高血清肌酐、血清尿素氮和尿液钠含量,显著降低尿液肌酐含量,同时,8%高盐摄入比4%高盐摄入能进一步加重肾脏损伤,包括进一步降低尿液肌酐以及升高血清尿素氮含量。相比于NC组,4%和8%高盐摄入也会提高肾脏炎症因子TNF-α、IL-6和IL-1β的分泌,而且8%高盐组比4%高盐组进一步提高了IL-6和IL-1β的分泌。HE和Masson染色结果显示,高盐摄入使C57BL/6J小鼠肾脏出现纤维化以及皮质和髓质病理损伤,且8%高盐组比4%高盐组进一步加重。高盐摄入会造成C57BL/6J小鼠肾脏损伤以及纤维化病变,提高盐浓度的摄入会进一步加重肾脏损伤与纤维化程度。Abstract: In order to further explore the effects of high salt intake on kidney of ordinary mice, C57BL/6J mice were randomly allocated into normal control group (NC), 4% high salt intake group (4% group) and 8% high salt intake group (8% group), which were fed with 0.5%NaCl normal diet, 4% or 8% high salt diet respectively. The renal function index, inflammatory factor secretion, pathological damage and fibrosis degree of mice from different groups were compared. The results indicated that high salt intake led to renal function injury in C57BL/6J mice. The contents of serum creatinine, serum urea nitrogen and urine Na were significantly increased, whereas the content of urine creatinine was significantly decreased. The 8% high salt diet showed further renal damage when compared to the 4% high salt diet, which include further decrease in urine creatinine and an increase in serum urea nitrogen. Compared with NC, 4% and 8% high salt intake also increased the secretion of inflammatory cytokines TNF-α、IL-6 and IL-1β in kidney, and the secretion of IL-6 and IL-1β was further increased in the 8% group compared with the 4% group. As the HE and Masson staining results shown, high salt intake caused renal fibrosis and pathological damage of cortex and medulla in C57BL/6J mice, and the 8% group was more severe than the 4% group. High salt diet induces kidney injury and fibrosis in C57BL/6J mice, and increasing salt intake can further aggravate the severity of injury and fibrosis.
-
Keywords:
- high salt-intake /
- kidney injury /
- renal fibrosis /
- renal function /
- inflammatory cytokines
-
最新数据显示,全球慢性肾病患者已经超过6.9亿,其中,我国患病人数达1.3亿,但该病的知晓率却低于10%[1]。该病的全球发病率和死亡率持续增长,已经成为威胁人类健康的全球性公共卫生问题。慢性肾病是一种由多种因素引起的慢性肾脏结构和功能障碍的疾病[2]。肾脏损伤是慢性肾病中常见的病理损害,而肾脏纤维化则是其典型症状[3-4]。慢性肾病的具体病理机制并没有被完全阐明,但已有证据证明其与炎症过程以及促炎症因子的产生密切相关[5]。
食盐(NaCl)是食品中的重要成分,可充当食品中的防腐剂、调味剂以及软化剂等。据调查,全球人均每日盐摄入量要高于世界卫生组织所推荐的5 g/d,而中国城乡居民平均每人盐摄入量为12 g/d,高盐饮食已经成为不可忽略的健康问题[6]。近年来,研究表明高盐摄入会引起肾脏功能损伤[7-8],甚至有可能发展成慢性肾病[9-11]。研究发现,8%高盐喂养Dahl盐敏感大鼠4周,其肾小球产生了严重损伤,肾功能也受到影响[12]。此外,炎症反应在高盐摄入引起的肾脏损伤以及肾脏纤维化的进程中起着重要作用[13]。Olorunnisola等[6]发现,4%高盐喂养雄性Wistar大鼠8周,大鼠肾脏炎症因子TNF-α、IL-2、6、8显著性增加。也有研究指出,8%高盐喂养比4%高盐喂养更进一步地加重了Dahl盐敏感大鼠的肾脏纤维化以及巨噬细胞浸润程度[14],而高盐摄入也可促进该模型的肾脏巨噬细胞转化为促炎表型[15]。上述研究说明高盐摄入可能会引起肾脏的炎症反应、功能受损以及纤维化病变,甚至发展成慢性肾病。
盐诱导肾脏损伤和纤维化病变的生理机制仍需要进一步研究[16],然而,大量相关研究多基于Dahl盐敏感性大鼠进行,而Dahl盐敏感性大鼠肾脏中的ROS水平以及NO水平之间平衡已经被破坏[17-19],只能模拟具有原发性高血压条件下持续高盐摄入情况。此外,以正常小鼠为研究模型,探究高盐摄入影响的报道较少,且中长期不同高盐浓度摄入对正常小鼠肾脏损伤和纤维化病变的影响尚未被报道。本研究选择C57BL/6J小鼠为研究对象,分为正常对照组(NC)、4%高盐组以及8%高盐组,分别连续喂养8周含0.5%NaCl正常饲料、含4%或8%NaCl的饲料,探究高盐摄入对肾功能指标、肾脏炎症因子分泌以及病理和纤维化程度的影响。本文旨在完善高盐摄入对普通小鼠肾脏损伤和纤维化的影响,以期为研究高盐摄入引起慢性肾病的具体机制提供理论支持和依据。
1. 材料与方法
1.1 材料与仪器
4周18~22 g的SPF级雄性C57BL/6J小鼠 广东省医学实验动物中心,许可证号:SCXK(粤)2018-0002;含0.5%、4%或8%的NaCl颗粒饲料 广东省医学实验动物中心,许可证号:粵饲证(2019)05073;肌酐试剂盒、尿素氮试剂盒 南京建成生物工程研究所;TNF-α试剂盒、IL-6试剂盒、IL-1β试剂盒 欣博盛生物科技有限公司;苏木素、伊红、Masson染色试剂盒、PBS(pH7.2~7.6) Wellbio公司;石蜡、中性树胶 Sigma公司。
Labserv K3酶标仪 赛默飞世尔科技(中国)有限公司;BA210T显微镜 Motic;BMJ-A包埋机 常州中威电子仪器公司;YD-315切片机 浙江金华益迪试验器材公司;DYY-6C恒温箱 北京六一公司;M199切片刀 莱卡公司;E-201-C精密pH计 雷磁公司。
1.2 实验方法
1.2.1 动物分组
实验经过华南农业大学动物房实验伦理会审查(编号:SYXK(粤)2019-0136)。小鼠适应性饲养1周后随机分为3组,分别是正常对照组(NC),喂养含0.5%NaCl颗粒饲料(每100 g饲料中含有0.5 g NaCl);4%高盐组(4%组),喂养含4%NaCl颗粒饲料(每100 g饲料中含有4 g NaCl);8%高盐组(8%组),喂养含8%NaCl颗粒饲料(每100 g饲料中含有8 g NaCl)。每组12只,连续喂养8周。动物室温度22~25 ℃,湿度45%左右。昼夜交替12 h,期间小鼠自由饮水摄食,记录小鼠摄食、摄水以及每周体重变化。
1.2.2 尿液、血液以及肾脏组织采集
实验进行的第4、6周取小鼠早上8:00~9:00的尿液,对小鼠进行眼眶取血。第8周,收集小鼠早上8:00~9:00的尿液,称重后进行眼球取血,收集的尿液以4000 r/min,4 ℃离心5 min后取上清液。取得的血液置于4 ℃冰箱放置1 h后37 ℃孵育30 min,4 ℃下4000 r/min离心10 min,取上清作为血清样品,样品均置于−80 ℃保存。解剖采血后的小鼠,取肾脏称重后,沿左肾冠状轴切开,置于10%中性多聚甲醛溶液中用于肾脏病理切片。
1.2.3 肾功能、炎症因子指标测定
取样小鼠第4、6、8周的尿液以及血清,肾功能指标:按照试剂盒的说明方法测定血清中的肌酐、尿素氮以及尿液中的肌酐、尿液钠。取小鼠右肾,制备成10%的组织匀浆液,离心取上清,按照试剂盒的操作步骤测定肾脏组织中TNF-α、IL-6和IL-1β含量。
1.2.4 肾脏病理切片观察
1.2.4.1 HE染色观察肾脏病理学变化
参考王琨等[20]的方法制作病理切片,采用苏木素-伊红染色法对切片进行染色,中性树胶封片,置于100和400倍显微镜下观察肾脏病理学变化。
1.2.4.2 Masson染色观察肾脏纤维化程度
参考Liu等[21]的方法制作病理切片,采用胶原纤维染色法对切片进行染色,置于100和400倍显微镜下观察肾脏纤维化程度。
1.3 数据处理
采用Excel 2019、GrapPad Primsm 8.3和SPSS 26等统计分析软件进行数据分析并作图。数据以平均值±标准误差表示,小鼠体重、摄食、摄水变化采用重复测量数据方差分析,而其他数据则进行方差齐性检验之后采用单因素方差分析,P<0.05为差异有统计学意义。
2. 结果与分析
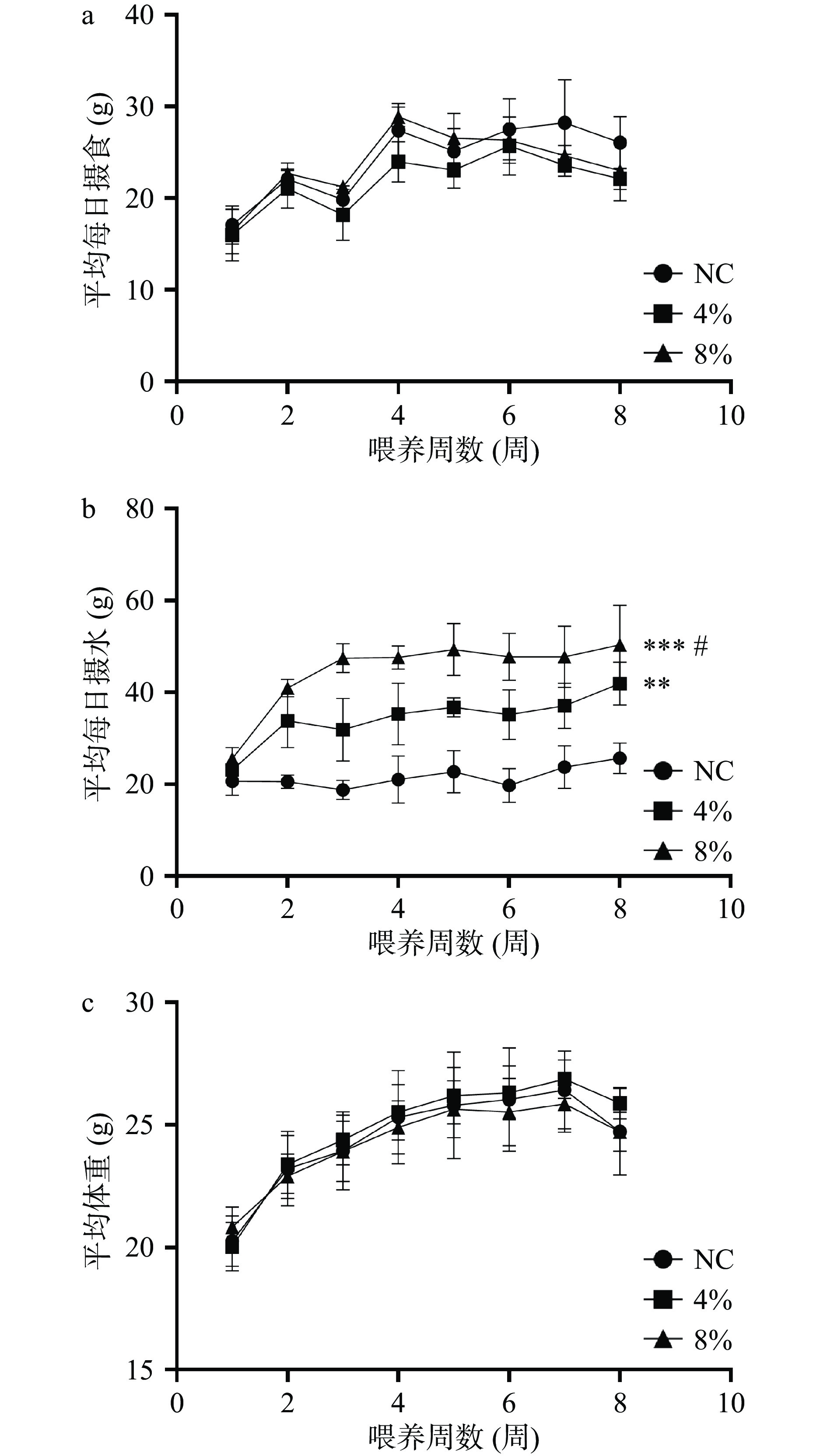
2.1 不同浓度盐摄入对小鼠摄食、摄水和体重的影响
随着实验的进行,小鼠的体重在不断增长,与NC组对比,4%或8%高盐组小鼠的摄食和体重并没有显著性差异(P>0.05)(图1),说明4%或8%的高盐摄入8周并不会显著性增加或者是降低小鼠的体重,也不会增加或者降低食欲。此外,高盐摄入让小鼠的摄水量显著性提高(P<0.05),并且随着盐浓度的提高而进一步提升(P<0.05)。该结果的可能原因是高盐摄入让小鼠的口渴感更强,会喝更多的水。
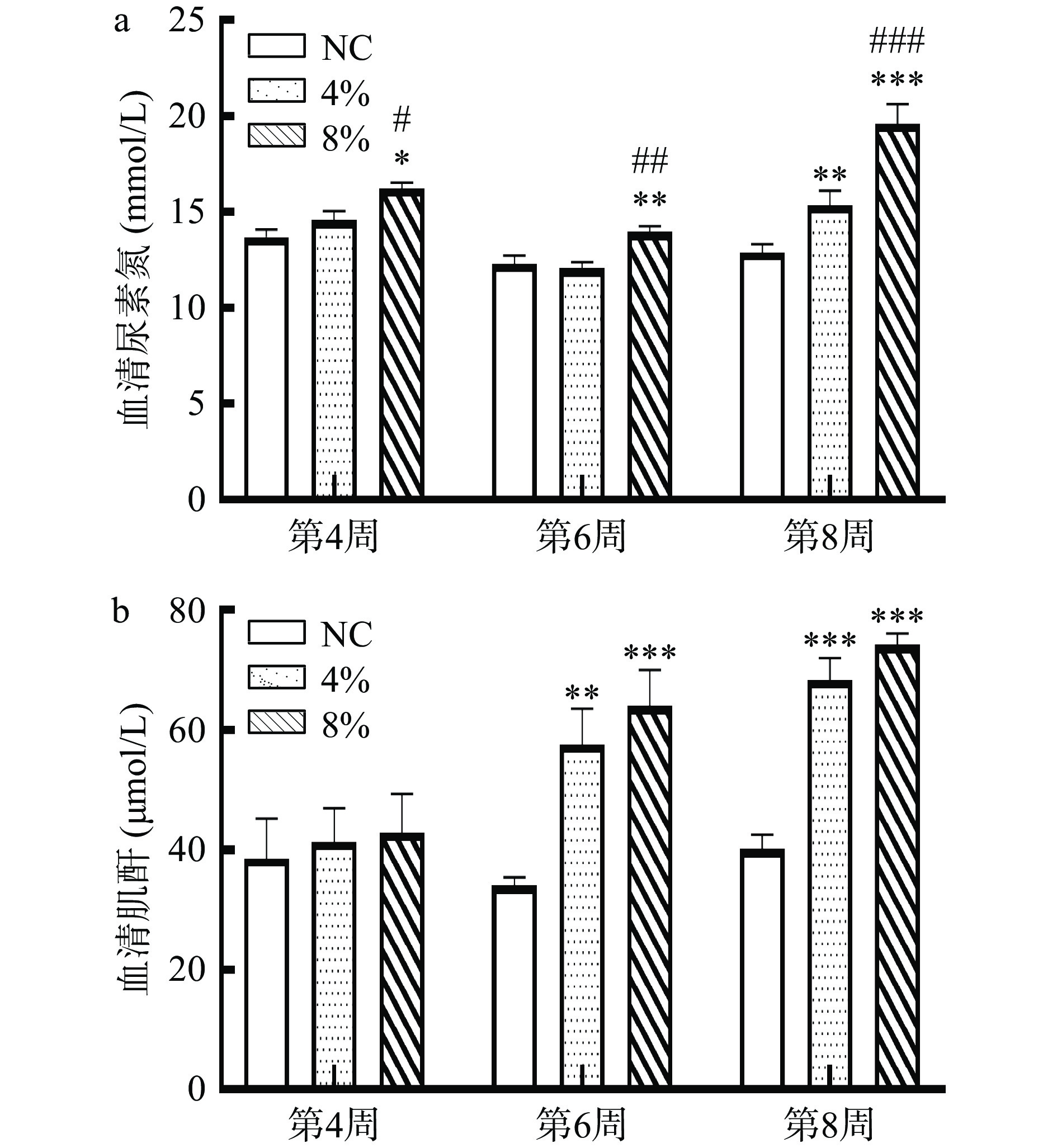
2.2 不同浓度盐摄入对小鼠肾功能指标的影响
如图2所示,从第4周开始,8%高盐组(16.2 mmol/L)对比NC组(13.7 mmol/L)的血清尿素氮出现显著性升高(P<0.05)。从第6周开始,4%高盐组(60.2 μmol/L)和8%高盐组(66.7 μmol/L)对比NC组(34.8 μmol/L)的血清肌酐均显著性升高(P<0.05)。类似地,一项研究中利用8%的高盐喂养Dahl盐敏感大鼠5周,血清的尿素氮以及肌酐含量相对正常对照组显著性升高[11]。
血尿素氮和血清肌酐是反映肾小管或肾小球上皮损伤的主要指标[22-23],若其相对正常对照组升高,表明蛋白质分解代谢强烈,肾小球滤过率降低。此外,8%高盐摄入6周就可从血清指标较为明显的看见肾脏损伤效果,包括提高血清尿素氮以及血清肌酐含量,而且8%高盐组比4%高盐组进一步升高了血清尿素氮的含量(P<0.05)。这可能是由于血清肌酐的含量主要取决于肾小球的滤过能力,而血清尿素氮含量除了肾内因素外,也受饮食的影响,高盐摄入对其影响更大。
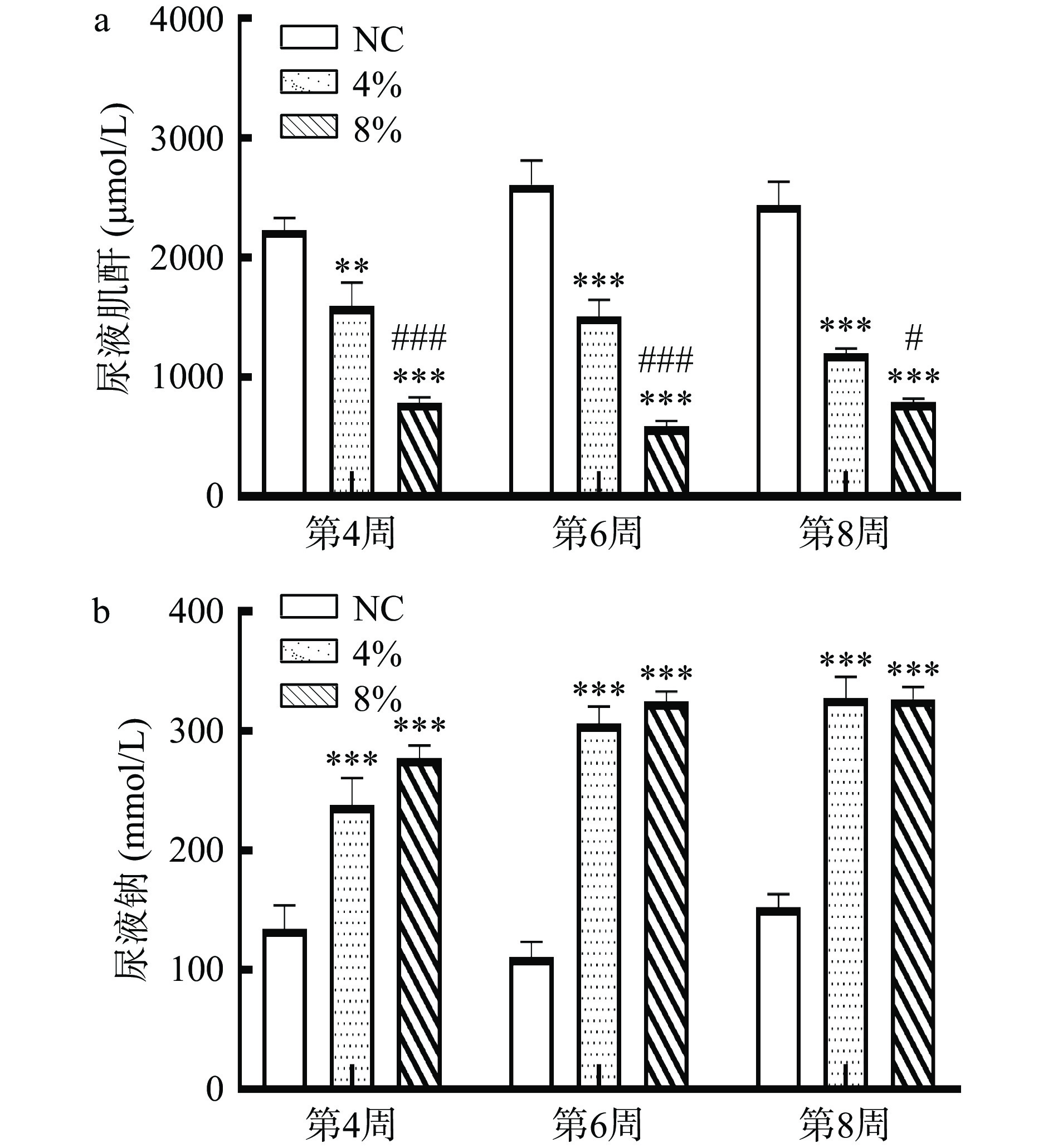
如图3所示,从第4周开始,相比于NC组(2229.1 μmol/L),4%高盐组(1593.3 μmol/L)和8%高盐组(785.2 μmol/L)的尿液肌酐含量均显著性下降(P<0.05)。同时,4%高盐组(237.9 mmol/L)和8%高盐组(277.4 mmol/L)的尿液钠含量均比NC组(134.4 mmol/L)显著性升高(P<0.05)。Liu等[9]通过切除大鼠5/6肾脏并在术后8周给予4%高盐3周,发现4%高盐组的24 h尿液钠含量显著性增加。Minegishi等[24]研究也发现,在8%高盐喂养2周后,小鼠的尿肌酐显著性降低。肾脏是机体排出Na+的主要器官,高盐摄入会让机体摄入过量Na+,导致肾脏的血流量增加和肾小球的滤过率下降,加重肾脏的负担,发生相应病理性改变[6]。此外,4%高盐摄入4周就可从尿液指标上较为明显地看出肾脏损伤效果,而且8%高盐组比4%高盐组进一步降低了尿液肌酐含量(P<0.05)。受高盐摄入的影响,肾脏组织出现病变,功能受损,其排泄废物的能力下降,毒素无法排出体外,可能导致尿液肌酐的下降以及进一步出现血清尿素氮和血清肌酐的升高。
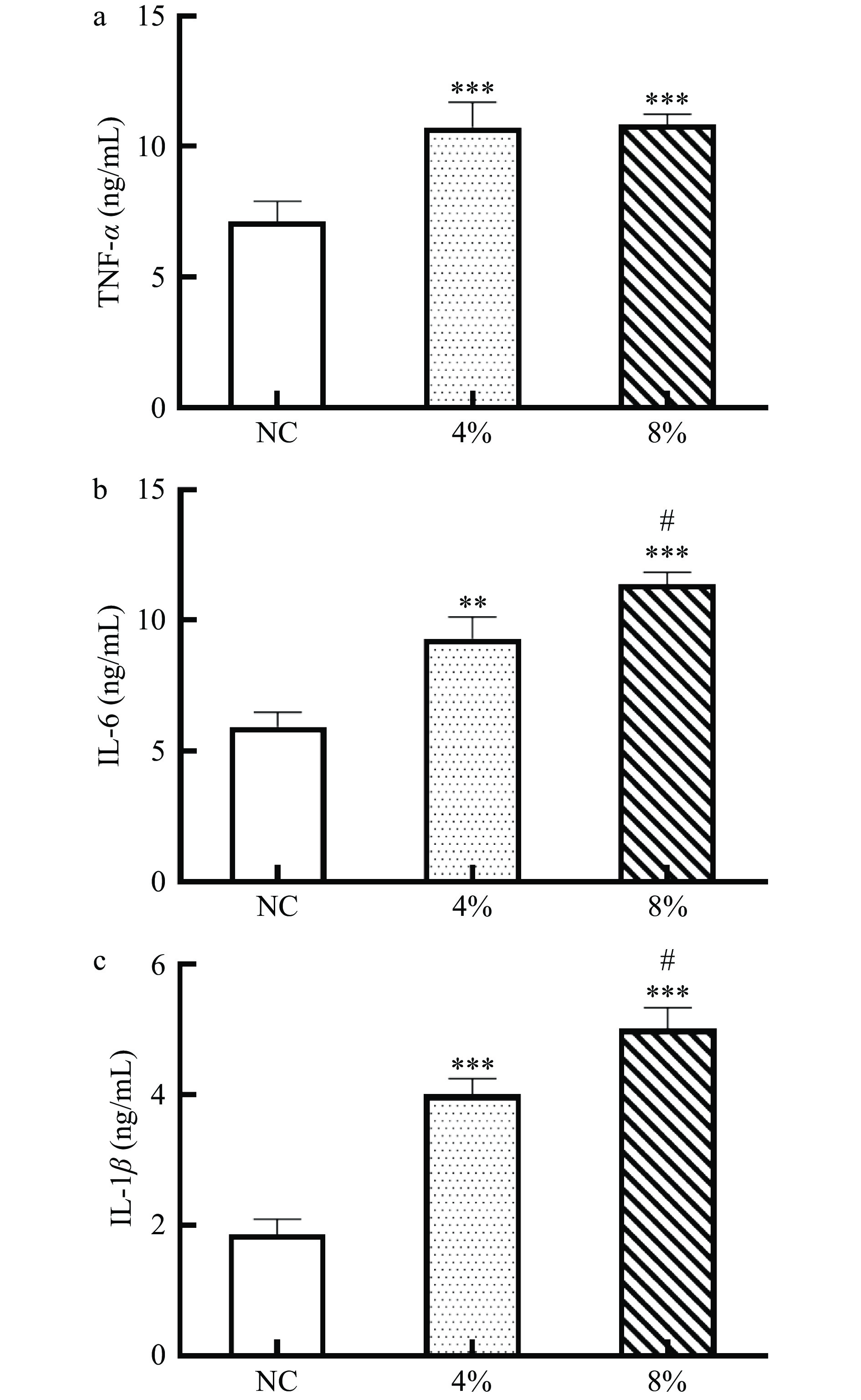
2.3 不同浓度盐摄入对小鼠肾脏炎症因子分泌影响
喂养至8周,相比于NC组,8%高盐组与4%高盐组均能显著性提高肾脏TNF-α(10.8、10.7比7.1 ng/mL)、IL-6(11.4、9.3比5.9 ng/mL)与IL-1β(5.0、4.0比1.9 ng/mL)的分泌(P<0.05)(图4)。8%高盐浓度较4%高盐浓度进一步促进IL-6与IL-1β的分泌(P<0.05),而TNF-α的分泌并没有显著性差异(P>0.05)。临床数据表明,慢性肾病患者血清中的IL-6水平会显著性升高,患者常常伴随着慢性炎症的状态,肾功能下降[9]。而在Dahl盐敏感大鼠模型中,4%高盐会导致免疫激活以及肾脏炎性浸润的进展[25]。Shibata等[3]通过切除ddy系小鼠右肾造出急性肾损伤模型,发现肾脏的TNF-α、IL-6以及IL-1β含量对比对照组显著性提高。大量的炎症因子的产生,会导致慢性炎症的发生[26],诱导肾脏组织发生病变,进而引起肾脏损伤和纤维化,而TNF-α并没有进一步提高,可能是由于4%的高盐摄入已经让TNF-α的分泌接近饱和,继续提高盐浓度摄入,其分泌水平增加不太明显。
2.4 不同浓度盐摄入对小鼠肾脏组织病理学影响
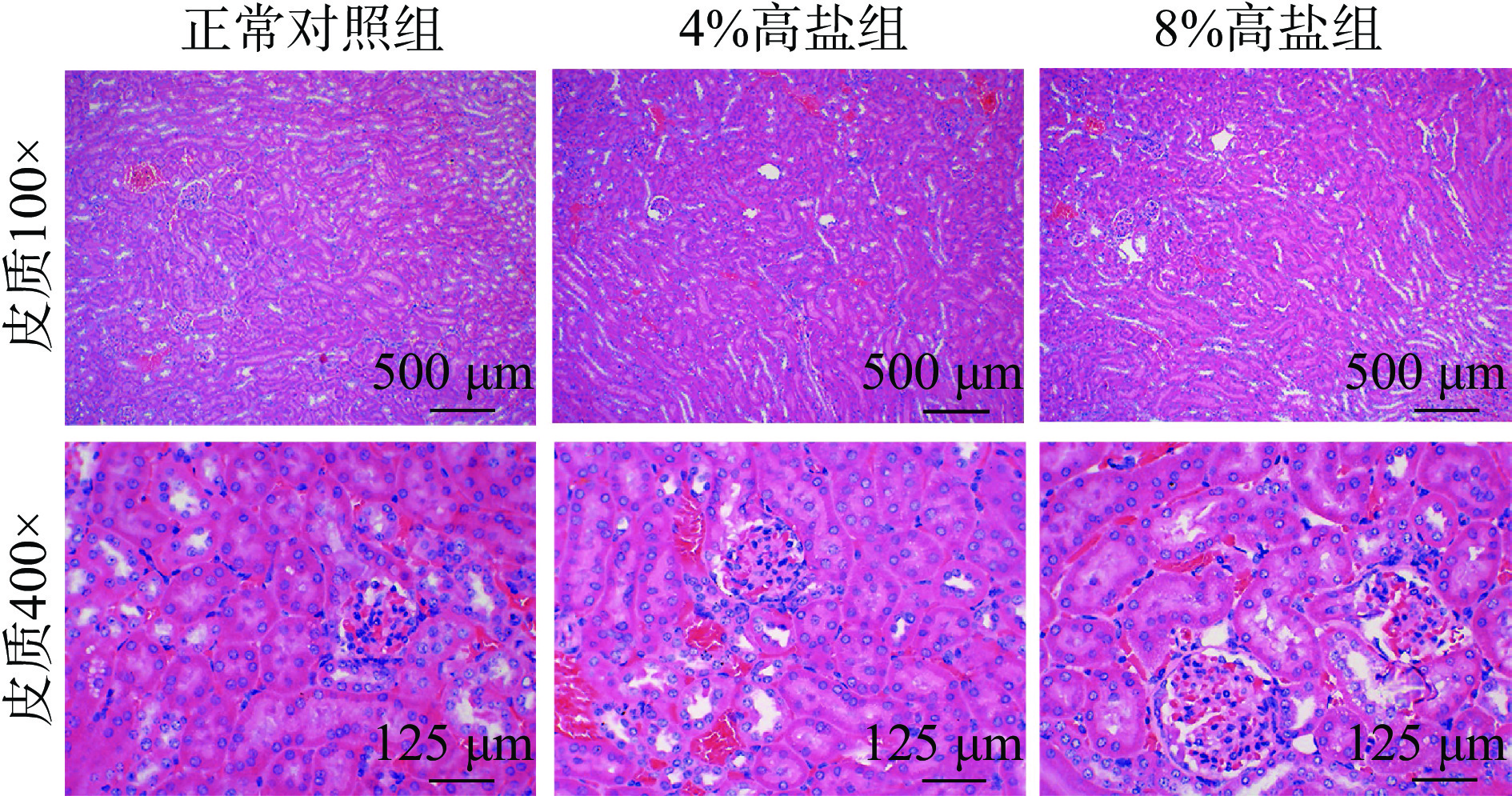
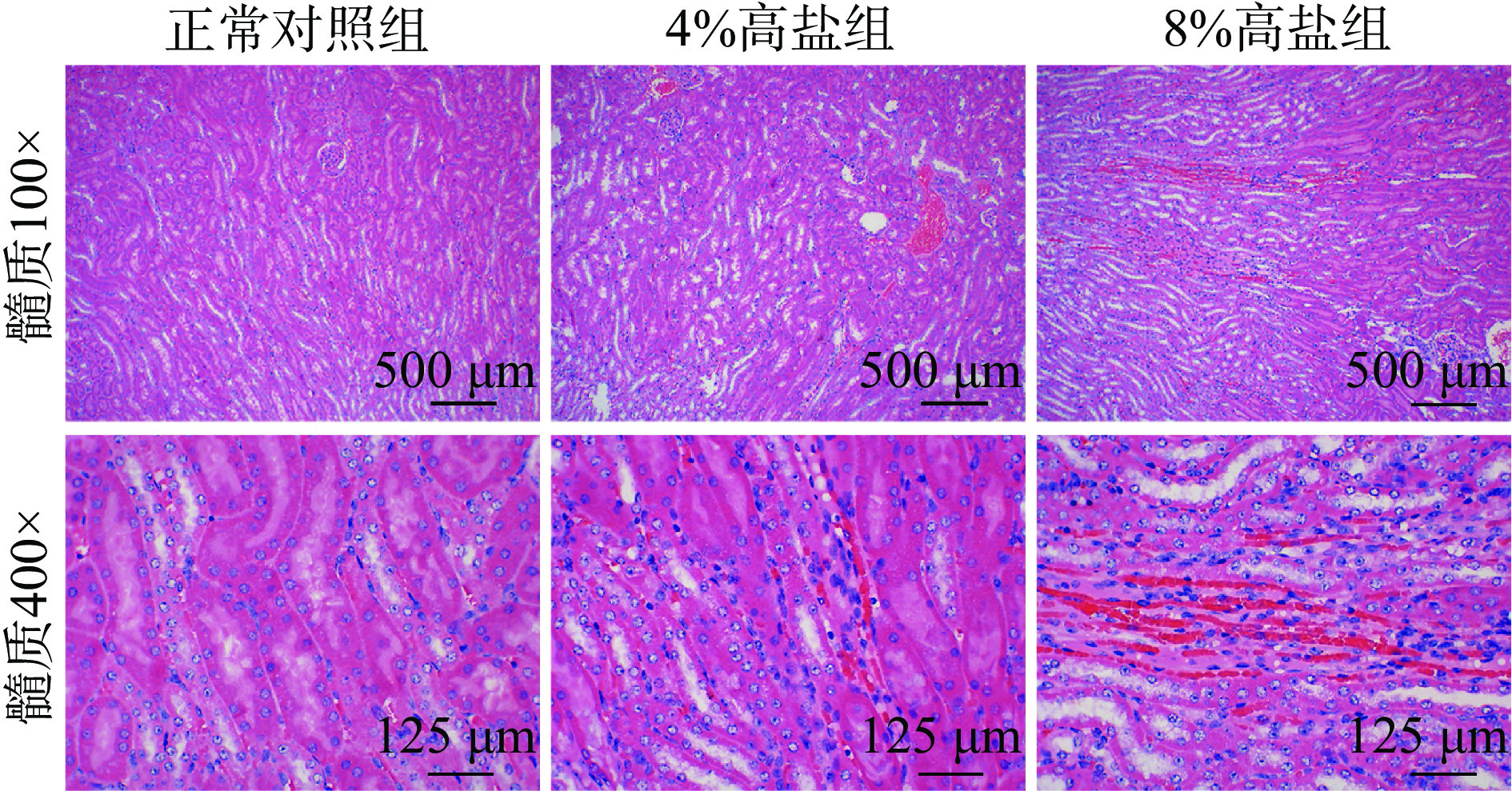
HE染色可观察各组肾组织病理变化,如图5和图6所示,小鼠肾脏皮质和髓质在4%高盐浓度喂养8周时出现了间质炎细胞浸润、肾小管管腔扩张、肾小管上皮细胞坏死脱落,形成细胞或颗粒管型以及部分管周毛细血管扩张充血,皮质区400倍下可以观察到萎缩的肾小球,而8%高盐组进一步加重了损伤。说明高盐摄入会导致肾脏皮质和髓质组织受损,而且8%高盐组比4%高盐组损伤更为严重。此外,HE染色结果也可以从病理形态上直观地看出随着盐浓度摄入的提高,肾脏的炎症浸润状态越严重,大量的炎症细胞聚集会释放促炎性因子[27],与观察到高盐摄入使小鼠肾脏的炎症分泌水平增加的结果一致。这样的组织病变可能会导致肾脏功能受损[28-29],甚至诱导慢性肾病的发生[30-32]。
2.5 不同浓度盐摄入对小鼠肾脏纤维化程度影响
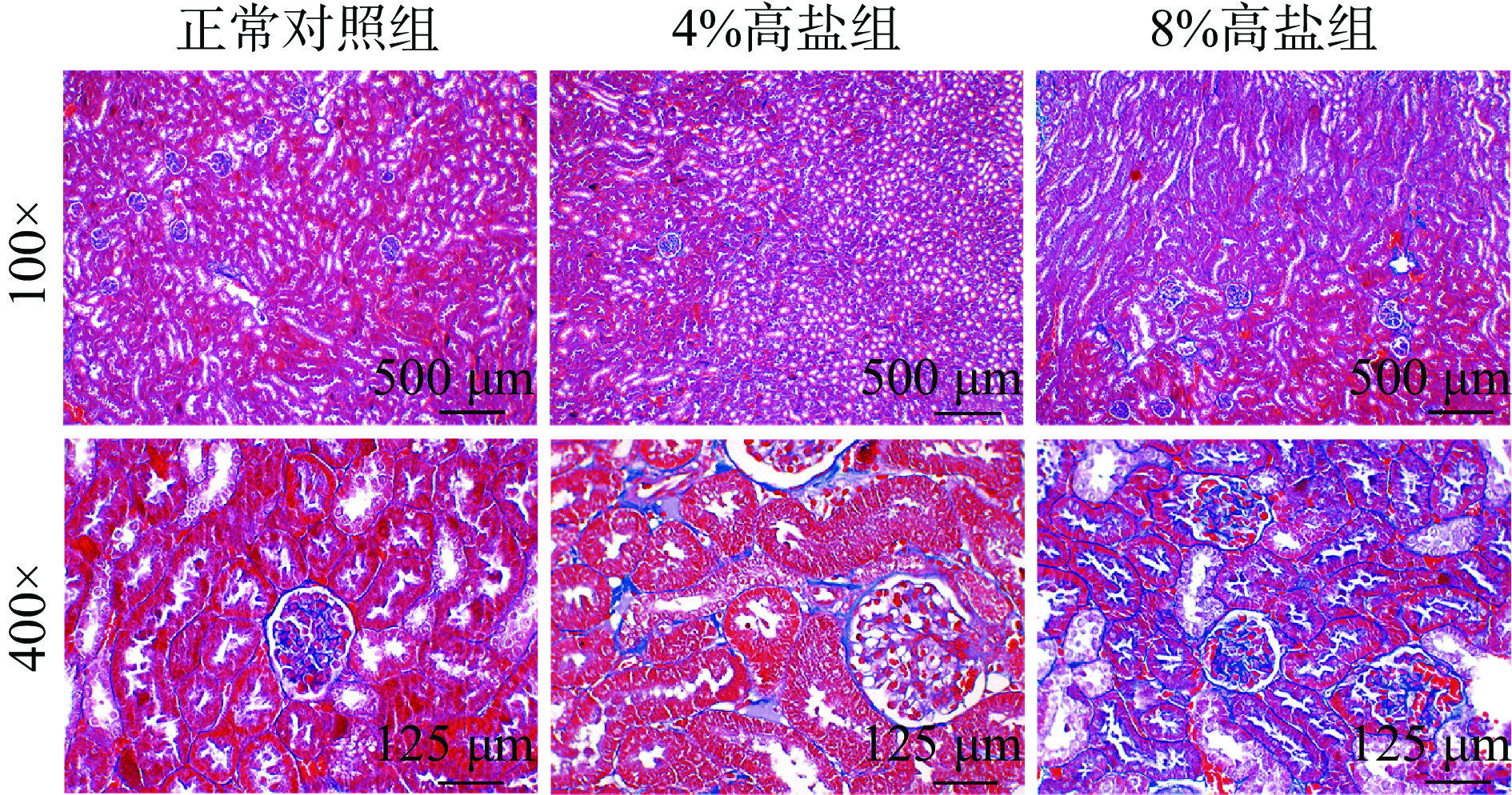
肾脏纤维化是慢性肾病的关键病理过程[33],肾脏间质中出现胶原蛋白沉积是慢性肾病的早期征兆[34],而Masson染色是检测肾组织中胶原蛋白沉积的重要方法。经染色后,肌纤维呈红色,而胶原纤维呈蓝色,颜色覆盖范围越广,颜色越深,代表纤维化病变越重。图7结果显示,100倍下,4%组小鼠的肾脏间质界限模糊,蓝色颜色较NC组深,已经有纤维化病变的症状,而8%高盐组小鼠纤维化程度进一步加重。而在400倍下,间质的蓝色随着摄入浓度提高而加深的更明显。提示着8%高盐浓度摄入比4%盐浓度摄入进一步加重C57BL/6J小鼠肾脏纤维化。受到高盐的影响,肾脏产生炎症反应,固有细胞受损,可能会导致肾脏间质出现大量胶原沉积和集聚,肾脏逐步硬化形成瘢痕,最终导致肾脏丧失脏器功能。
3. 结论
本文以C57BL/6J小鼠作为研究模型,采用含0.5%、4%和8%盐浓度的饲料饲喂8周,评价中长期不同盐浓度摄入对小鼠肾脏损伤和纤维化的影响。结果表明,4%高盐摄入4周即可从尿液指标上较为明显地呈现肾脏损伤效果,8%高盐摄入6周可从血清指标较为明显呈现。8%高盐摄入比4%高盐摄入能进一步加重肾脏损伤,包括进一步降低尿液肌酐以及升高血清尿素氮含量。此外,高盐摄入使C57BL/6J小鼠肾脏的组织出现病理损伤以及纤维化病变,并且8%高盐组比4%高盐组进一步加重病变。本研究为利用高盐摄入建造C57BL/6J小鼠慢性肾病模型提供了实验剂量与时间的参考依据,但剂量与时间对其具体的调控机制影响仍有待进一步的研究。
-
-
[1] BIKBOV B, PURCELL C, LEVEY A S, et al. Global, regional, and national burden of chronic kidney disease, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet,2020,395(10225):709−733. doi: 10.1016/S0140-6736(20)30045-3
[2] 苑佳奇, 沈晓丹, 虞飞, 等. lncRNA与慢性肾病关系的研究进展[J]. 生理科学进展,2022,53(3):219−223. [YUAN J Q, SHEN X D, YU F, et al. Research progress in the relationship between lncRNA and chronic kidney disease[J]. Advances in Physiological Science,2022,53(3):219−223. doi: 10.3969/j.issn.0559-7765.2022.03.011 [3] SHIBATA K, HASHIMOTO T, HASUMI K, et al. Potent efficacy of Stachybotrys microspora triprenyl phenol-7, a small molecule having anti-inflammatory and antioxidant activities, in a mouse model of acute[J]. European Journal of Pharmacology,2021,910:174496. doi: 10.1016/j.ejphar.2021.174496
[4] ZHANG D, JI P, SUN R, et al. Ginsenoside Rg1 attenuates LPS-induced chronic renal injury by inhibiting NOX4-NLRP3 signaling in mice[J]. Biomedicine & Pharmacotherapy,2022,150:112936.
[5] SANTANA A C, DEGASPARI S, CATANOZI S, et al. Thalidomide suppresses inflammation in adenine-induced CKD with uraemia in mice[J]. Nephrology, Dialysis, Transplantation: Official Publication of the European Dialysis and Transplant Association-European Renal Association,2013,28(5):1140−1149. doi: 10.1093/ndt/gfs569
[6] OLORUNNISOLA O S, FADAHUNSI O S, ADEGBOLA P I, et al. Phyllanthus amarus attenuated derangement in renal-cardiac function, redox status, lipid profile and reduced TNF-α, interleukins-2, 6 and 8 in high salt diet fed rats[J]. Heliyon,2021,7(10):e08106. doi: 10.1016/j.heliyon.2021.e08106
[7] WANG Y, LIU X, ZHANG C, et al. High salt diet induces metabolic alterations in multiple biological processes of Dahl salt-sensitive rats[J]. The Journal of Nutritional Biochemistry,2018,56:133−141. doi: 10.1016/j.jnutbio.2018.01.007
[8] KANG M, KANG E, RYU H, et al. Measured sodium excretion is associated with CKD progression: Results from the KNOW-CKD study[J]. Nephrology Dialysis Transplantation,2020,36(3):512−519.
[9] LIU Y, DAI X, YANG S, et al. High salt aggravates renal inflammation via promoting pro-inflammatory macrophage in 5/6-nephrectomized rat[J]. Life Sciences,2021,274:119109. doi: 10.1016/j.lfs.2021.119109
[10] HOSOHATA K. Biomarkers for chronic kidney disease associated with high salt intake[J]. International Journal of Molecular Sciences,2017,18(10):2080. doi: 10.3390/ijms18102080
[11] DU H, XIAO G, XUE Z, et al. QiShenYiQi ameliorates salt-induced hypertensive nephropathy by balancing ADRA1D and SIK1 expression in Dahl salt-sensitive rats[J]. Biomedicine & Pharmacotherapy,2021,141:111941.
[12] 任洁, 胡经文, 郭统帅, 等. 高盐饮食对盐敏感性高血压大鼠肾脏损伤的影响[J]. 安徽医学,2020,41(8):872−875. [REN J, HU J W, GUO T S, et al. Effect of high salt diet on kidney injury ofrats with salt-sensitive hypertension[J]. Anhui Medical Journal,2020,41(8):872−875. doi: 10.3969/j.issn.1000-0399.2020.08.002 [13] 赵宇, 李浩, 商黔惠, 等. 辣椒素通过抑制肾小管间质纤维化改善高盐诱导肾脏损害的作用[J]. 中华高血压杂志,2018,26(4):349−356. [ZHAO Y, LI H, SHANG Q H, et al. Capsaicin improve high-salt induced renal injury by inhibiting renal tubulointerstitial fibrosis[J]. Chinese Journal of Hypertension,2018,26(4):349−356. [14] 刘美丽, 刘丹, 刘艳霞, 等. 不同盐浓度对盐敏感性高血压肾脏纤维化及巨噬细胞浸润的影响[J]. 现代生物医学进展,2017,17(27):5214−5218. [LIU M L, LIU D, LIU Y X, et al. Influence of different dietary salt concerntration on the renal fibrosis and macrophages infiltration in salt sensitive hypertension[J]. Progress in Modern Biomedicine,2017,17(27):5214−5218. doi: 10.13241/j.cnki.pmb.2017.27.004 [15] FEHRENBACH D J, ABAIS-BATTAD J M, DASINGER J H, et al. Salt-sensitive increase in macrophages in the kidneys of Dahl SS rats[J]. American Journal of Physiology-Renal Physiology,2019,317(2):F361−F74. doi: 10.1152/ajprenal.00096.2019
[16] GAROFALO C, BORRELLI S, PROVENZANO M, et al. Dietary salt restriction in chronic kidney disease: A meta-analysis of randomized clinical trials[J]. Nutrients,2018,10(6):732. doi: 10.3390/nu10060732
[17] YANG P, ZHAO X, ZHOU L, et al. Protective effect of oral histidine on hypertension in Dahl salt-sensitive rats induced by high-salt diet[J]. Life Sciences,2021,270:119134. doi: 10.1016/j.lfs.2021.119134
[18] COWLEY A W. Renal medullary oxidative stress, pressure-natriuresis, and hypertension[J]. Hypertension,2008,52(5):777−786. doi: 10.1161/HYPERTENSIONAHA.107.092858
[19] MAJID D S A, KOPKAN L. Nitric oxide and superoxide interactions in the kidney and their implication in the development of salt-sensitive hypertension[J]. Clinical and Experimental Pharmacology and Physiology,2007,34(9):946−952. doi: 10.1111/j.1440-1681.2007.04642.x
[20] 王琨, 吴珊珊, 黎攀, 等. 茯苓对高尿酸血症大鼠肾损伤及肠道菌群的影响[J/OL]. 食品科学, https://kns.cnki.net/kcms/detail/11.2206.TS.20220309.2206.042.html. WANG K, WU S S, LI P, et al. Effects of Poria cocos on renal injury and gut microbiota in hyperuricemia rats[J]. Food Science, https://kns.cnki.net/kcms/detail/11.2206.TS.20220309.2206.042.html.
[21] LIU W, LI Y, XIONG X, et al. Traditional Chinese medicine protects against hypertensive kidney injury in Dahl salt-sensitive rats by targeting transforming growth factor-β signaling pathway[J]. Biomedicine & Pharmacotherapy,2020,131:110746.
[22] GAO L, YUAN P, ZHANG Q, et al. Taxifolin improves disorders of glucose metabolism and water-salt metabolism in kidney via PI3K/AKT signaling pathway in metabolic syndrome rats[J]. Life Sciences,2020,263:118713. doi: 10.1016/j.lfs.2020.118713
[23] VAIDYA V S, OZER J S, DIETERLE F, et al. Kidney injury molecule-1 outperforms traditional biomarkers of kidney injury in preclinical biomarker qualification studies[J]. Nature Biotechnology,2010,28(5):478−485. doi: 10.1038/nbt.1623
[24] MINEGISHI S, ISHIGAMI T, KINO T, et al. An isoform of Nedd4-2 is critically involved in the renal adaptation to high salt intake in mice[J]. Sci Rep,2016,6:27137. doi: 10.1038/srep27137
[25] MATTSON D L, MEISTER C J, MARCELLE M L. Immune suppression attenuates hypertension and renal disease in the Dahl salt-sensitive rat[J]. Hypertension,2006,48(1):149−156. doi: 10.1161/01.HYP.0000228320.23697.29
[26] RIMESSI A, PREVIATI M, NIGRO F, et al. Mitochondrial reactive oxygen species and inflammation: Molecular mechanisms, diseases and promising therapies[J]. The International Journal of Biochemistry & Cell Biology, 2016, 81(Pt B): 281−293.
[27] AKDIS M, AAB A, ALTUNBULAKLI C, et al. Interleukins (from IL-1 to IL-38), interferons, transforming growth factor β, and TNF-α: Receptors, functions, and roles in diseases[J]. Journal of Allergy and Clinical Immunology,2016,138(4):984−1010. doi: 10.1016/j.jaci.2016.06.033
[28] TOBA H, IKEMOTO M J, KOBARA M, et al. Secreted protein acidic and rich in cysteine (SPARC) and a disintegrin and metalloproteinase with thrombospondin type 1 motif (ADAMTS1) increments by the renin-angiotensin system induce renal fibrosis in deoxycorticosterone acetate-salt hypertensive rats[J]. Eur J Pharmacol,2022,914:174681. doi: 10.1016/j.ejphar.2021.174681
[29] PONTICELLI C, CAMPISE M R. The inflammatory state is a risk factor for cardiovascular disease and graft fibrosis in kidney transplantation[J]. Kidney International,2021,100(3):536−545. doi: 10.1016/j.kint.2021.04.016
[30] WU M, WU X, ZHU J, et al. Selenium-enriched and ordinary green tea extracts prevent high blood pressure and alter gut microbiota composition of hypertensive rats caused by high-salt diet[J]. Food Science and Human Wellness,2022,11(3):738−751. doi: 10.1016/j.fshw.2021.12.031
[31] 夏南, 张焕鑫, 赵继先, 等. 高盐饮食对自发性高血压大鼠肾脏的影响及左旋氨氯地平的作用[J]. 中国循证心血管医学杂志,2019,11(5):611−613, 7. [XIA N, ZHANG H X, ZHAO J X, et al. Effect of high salt diet on kidney in spontaneously hypertensive rats and the effect of L-amlodipine[J]. Chinese Journal of Evidence-Based Cardiovascular Medicine,2019,11(5):611−613, 7. doi: 10.3969/j.issn.1674-4055.2019.05.26 [32] 赵宇, 刘燕, 商黔惠, 等. 替米沙坦对4%高盐饮食诱导肾脏纤维化的保护作用[J]. 中国老年学杂志,2018,38(6):1430−1433. [ZHAO Y, LIU Y, SHANG Q H, et al. Improvement of telmisartan on renal fibrosis induced by 4% high-salt diet in Wistar rats[J]. Chinese Journal of Gerontology,2018,38(6):1430−1433. doi: 10.3969/j.issn.1005-9202.2018.06.064 [33] BUKOSZA E N, KAUCSÁR T, GODÓ M, et al. Glomerular collagen deposition and lipocalin-2 expression are early signs of renal injury in prediabetic obese rats[J]. Int J Mol Sci,2019,20(17):4266. doi: 10.3390/ijms20174266
[34] BAI M, LEI J, WANG S, et al. BMP1 inhibitor UK383, 367 attenuates renal fibrosis and inflammation in CKD[J]. American Journal of Physiology Renal Physiology,2019,317(6):F1430−F1438. doi: 10.1152/ajprenal.00230.2019
-
期刊类型引用(16)
1. 孙细珍,熊亚青,倪兴婷,李强. 吡嗪类化合物对酱香型白酒香气特征的影响分析. 食品与发酵工业. 2025(01): 305-311 .  百度学术
百度学术
2. 王高伟,曹润洁,陈双,徐岩. 采用顶空固相微萃取结合全二维气相色谱飞行时间质谱解析不同等级中高温大曲的挥发性组分差异特征. 食品与发酵工业. 2025(02): 285-292 .  百度学术
百度学术
3. 王娜,沈毅,庄园,程伟,罗森,张亚东,刘子轩,刘冰,高红波. 气相色谱-串联质谱同时测定白酒中20种吡嗪类化合物. 食品科学. 2025(05): 30-37 .  百度学术
百度学术
4. 蒋倩儿,梁会朋,李琳琳,钟俊辉,刘军峰. 芽孢杆菌在白酒酿造过程中的应用研究进展. 食品工业科技. 2025(08): 391-401 .  本站查看
本站查看
5. 杨瑞政. 白酒及原料检验准确性的影响因素及控制策略探讨. 食品安全导刊. 2024(07): 149-151 .  百度学术
百度学术
6. 杨沙,罗玉航,张季,侯睿. 高效液相色谱法同时测定不同年份酱香型白酒中12种吡嗪化合物含量. 食品安全质量检测学报. 2024(12): 220-229 .  百度学术
百度学术
7. 缪坤辰,张梦梦,赵巧珍,吕志远,吕晓凤,任广花. 两种功能麸曲混合应用对芝麻香型白酒酿造的影响. 酿酒科技. 2024(07): 74-82 .  百度学术
百度学术
8. 王宏雨,翁梦婷,孔子浩,张迪. 发酵处理对广叶绣球菌挥发性成分及风味的影响. 菌物学报. 2024(08): 154-170 .  百度学术
百度学术
9. 陈艳,王孝彦,刘冲,杨沙,张季. GC-MS/MS法同时测定年份酱香型白酒中19种吡嗪类和呋喃类化合物. 中国酿造. 2024(09): 241-248 .  百度学术
百度学术
10. 何艳艳,刘俊男,李瑞杰,丁润月,杨阳,李姝,赵侨,钟小忠,王松涛,周嘉裕. 酱香型白酒风味及其关键物质分析技术研究进展. 中国酿造. 2024(11): 1-7 .  百度学术
百度学术
11. 薛锡佳,程伟,陈雪峰,兰伟,李娜,李瑞龙,潘天全,代森. 馥合香型白酒酿造过程中四甲基吡嗪的检测及其溯源分析. 中国酿造. 2024(12): 38-44 .  百度学术
百度学术
12. 吕晓凤,孟武,刘玉涛,张梦梦,卢春玲,李强,邱振清,石林,赵巧珍,缪坤辰. 功能菌添加对芝麻香原酒中吡嗪类化合物含量的影响研究. 食品安全质量检测学报. 2023(07): 155-163 .  百度学术
百度学术
13. 陈荻,杨康卓,刘志鹏,赵东,郑佳. 包包曲风味萃取方式的对比及GC×GC-TOFMS在其风味化合物鉴定中的应用. 酿酒科技. 2023(06): 71-76 .  百度学术
百度学术
14. 苏泽佳,卢斌,李志溥,熊若冰,白卫东,梁景龙,赵文红. 12种市售豉香型白酒挥发性风味物质的分析. 中国酿造. 2023(08): 234-241 .  百度学术
百度学术
15. 秦炳伟,吕志远,张梦梦,刘阳晴雪,刘玉涛,王文洁,胥鑫钰,李小杰,崔新莹,商海林,王瑞明,高红波,宋妍妍. 顶空固相微萃取-全二维气相色谱-飞行时间质谱解析泉香型白酒的风味物质. 食品与发酵工业. 2023(18): 289-296 .  百度学术
百度学术
16. 陈心雨,刘念,王超凯,张磊,李觅,常少健,蔡海燕,彭奎. 高温大曲中美拉德反应的研究进展. 食品与发酵科技. 2023(06): 109-112 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



