Optimization of Decolorization and Deproteinization of Balanophora japonica Makino Polysaccharide by Response Surface Methodology
-
摘要: 研究日本蛇菰多糖双氧水脱色、Sevag法脱蛋白的条件并对其进行工艺优化。在单因素的基础上,以多糖脱色率为指标,采用响应面法设计三因素三水平实验对蛇菰多糖的脱色条件进行优化;以蛋白质脱除率、多糖保留率为指标,选取Sevag试剂比例(氯仿:正丁醇)、样液:Sevag试剂、振荡时间为因素水平设计响应面试验,得到最佳工艺条件。结果表明,在pH为8的条件下双氧水脱色最佳工艺为:双氧水用量为20%、脱色时间为46 min、脱色温度为60 ℃,在此条件下蛇菰多糖的脱色率为84.21%。脱蛋白最佳工艺条件为:氯仿:正丁醇5:1、样液:Sevag试剂4:1、振荡时间15 min,在此条件下,多糖保留率为81.03%,蛋白质脱除率为40.44%。双氧水和Sevag法脱色脱蛋白工艺稳定,方法可行操作简单,适用于蛇菰多糖的脱色、脱蛋白。Abstract: To study the decolorization and deproteinization conditions of Balanophora japonica polysaccharide by hydrogen peroxide and Sevag method, and to optimize the process. Based on single factor experiments, the response surface methodology was used to design a three factor and three level experiments to optimize the decolorization conditions of Balanophora japonica polysaccharides using the decolorization rate of polysaccharides as an index. Using protein removal rate and polysaccharide retention rate as indicators, a response surface experiment was designed at the factor level of Sevag reagent ratio (chloroform:n-butanol), sample solution: Sevag reagent and oscillation time to obtain the optimal process conditions. Results showed that, under the condition of pH8, the optimal decolorization process was as follows: The dosage of hydrogen peroxide was 20%, the decolorization time was 46 min, and the decolorization temperature was 60 ℃. Under this condition, the decolorization rate of polysaccharides was 84.21%. The optimal deproteinization conditions were chloroform:n-butanol 5:1, sample solution:Sevag reagent 4:1, and shock time 15 min, under this condition, the polysaccharide retention rate was 81.03%, and the protein removal rate was 40.44%. The decolorization and deproteinization of Balanophora japonica polysaccharide by hydrogen peroxide and Sevag method was stable, feasible and simple, and would be suitable for decolorization and deproteinization of Balanophora japonica polysaccharide.
-
日本蛇菰(Balanophora japonica Makino)为蛇菰科(Balanophoraceae) 蛇菰属(Balanophora)植物为一年或多年生全寄生草本植物[1],其又名文王一枝笔、鸡心七、鹿仙草,系蛇菰科蛇菰属植物,为拉枯族药“密都那此”。拉枯族民间医生用其治疗肝炎、肝硬化腹水、消化道出血、神经官能症、阳萎、外伤出血、痔疮、痛经、醒酒等病症[2-3]。《中华本草》记载蛇菰属植物能凉血止血、清热解毒,具有补肝益肾,止血生肌,调经活血,清热醒酒之功效[4]。
多糖是由醛糖或酮糖通过苷链连接在一起的多聚物,是一类具有广泛生物活性的生物大分子物质,具有免疫调节[5]、抗肿瘤[6]、抗衰老[7]、降血糖[8]和抗凝血[9]等药理活性和药效功能。多糖来源广泛且无毒,具有较高的研究与开发价值[10-11]。蛇菰中含有大量的多糖,在近年来的研究中对蛇菰多糖的生物活性方面取得了较好的成果,但对蛇菰多糖分离纯化方面研究甚少。在分离纯化过程中,由于蛇菰粗多糖中混有色素和蛋白质等小分子物质,使得分离纯化变得困难,因此需要对粗多糖进行杂质的去除,得到纯品多糖为进一步研究其活性奠定基础。多糖除杂质方法很多,其中脱蛋白一般有Sevag法、酶法、三氯乙酸法、木瓜蛋白酶法等[12-15];常用脱色方法有活性炭、H2O2、大孔树脂、次氯酸钠、聚酰胺、Al2O3柱层析、静态混合器等[16-17]。本文主要研究日本蛇菰多糖(后简称蛇菰多糖)的脱色、脱蛋白工艺,因每种脱色、脱蛋白方法都有它的优缺点,因此要选择合适的方法对多糖进行脱色、脱蛋白。根据前人对多糖的研究中发现Sevag法脱蛋白最常用,且效果良好,前期进行预实验发现由于活性炭颗粒较小且在后期难以将活性炭全部去除、大孔树脂脱色效果差影响后续多糖纯化。
因此本文选择了双氧水脱色法和Sevag法对蛇菰多糖进行除杂处理,以脱色率为考察指标,对双氧水脱色进行条件优选;以蛋白质脱除率和多糖保留率为指标,对其脱蛋白工艺进行优化,找到最佳工艺优化条件。
1. 材料与方法
1.1 材料与仪器
蛇菰块茎 购于云南普洱市药材市场;硫酸、30%过氧化氢、氯仿 重庆川东化工有限公司;磷酸、氢氧化钠 四川西陇科学有限公司;正丁醇 天津市恒兴化学试剂制造有限公司;蒽酮、牛血清蛋白 上海麦克林生化科技有限公司;考马斯亮蓝G250 北京索莱宝科技有限公司。
JA2003电子天平 上海舜宇恒平科学仪器有限公司;722S可见分光光度计 上海菁华科技仪器有限公司;数显恒温水浴锅 上海博讯实业有限公司医疗设备厂;CR-100S春霖超声波清洗机;HY-4A调速振荡器 常州澳华仪器有限公司。
1.2 实验方法
1.2.1 蛇菰粗多糖的提取
将蛇菰粉碎后过120目筛用水提醇沉法[18]进行提取多糖:称取10 g蛇菰粉末,加水100 mL在95 ℃下提取30 min,冷却至室温在4000 r/min转速下离心10 min,加入五倍体积的无水乙醇,4 ℃下静置12 h,离心所得沉淀用无水乙醇,丙酮,乙醚多次洗涤,得到蛇菰粗多糖放于4 ℃冰箱储存。
1.2.2 多糖中有色物质波长确定
称取1 g蛇菰粗多糖加纯水至100 mL超声辅助溶解,取溶液稀释得到3 mg/mL多糖溶液样品在4000 r/min下离心10 min备用。将多糖溶液在可见光区390~780 nm处进行波长扫描,显示多糖溶液无最大吸收波长曲线平缓,根据吸收曲线以及多糖溶液脱色前后均为橙黄色,根据互补光色可知选取450 nm为多糖的检测波长[19]。
1.2.3 多糖及蛋白质含量的测定
多糖采用蒽酮-硫酸法[20-21]测定,称取0.2012 g蒽酮于100 mL浓硫酸即可配制蒽酮-硫酸溶液;蛋白质含量采用考马斯亮蓝法[22]测定,称取考马斯亮蓝G250 0.1 g溶于50 mL 90%的乙醇中,加入85%的磷酸溶液100 mL,加入蒸馏水定容至1000 mL备用。
1.2.4 标准曲线的绘制
葡萄糖标准曲线:称取10 mg葡萄糖于100 mL容量瓶中定容至刻度线,配制成0.1 mg/mL的葡萄糖标准溶液。分别吸取标准溶液0.00、0.20、0.40、0.60、1.00 mL,依次加纯水2.00、1.80、1.60、1.40、1.20、1.0 mL补至2 mL,采用蒽酮-硫酸法[19-20]显色,在625 nm处测吸光度值并绘制曲线,得到回归方程y=8.1071x+0.0028,R2=0.9900。
牛血清蛋白标准曲线:称取10 mg牛血清蛋白于100 ml容量瓶中定容至刻度线,配制成0.1 mg/mL牛血清蛋白标准溶液。分别吸取0.00、0.20、0.40、0.60、0.80、1.00 mL,依次加入纯水1.00、0.80、0.60、0.40、0.20、0.00 mL补至1 mL,采用考马斯亮蓝法[21]在595 nm处测吸光度并绘制标准曲线y=8.33x+0.0043,R2=0.9915。
1.2.5 单因素实验
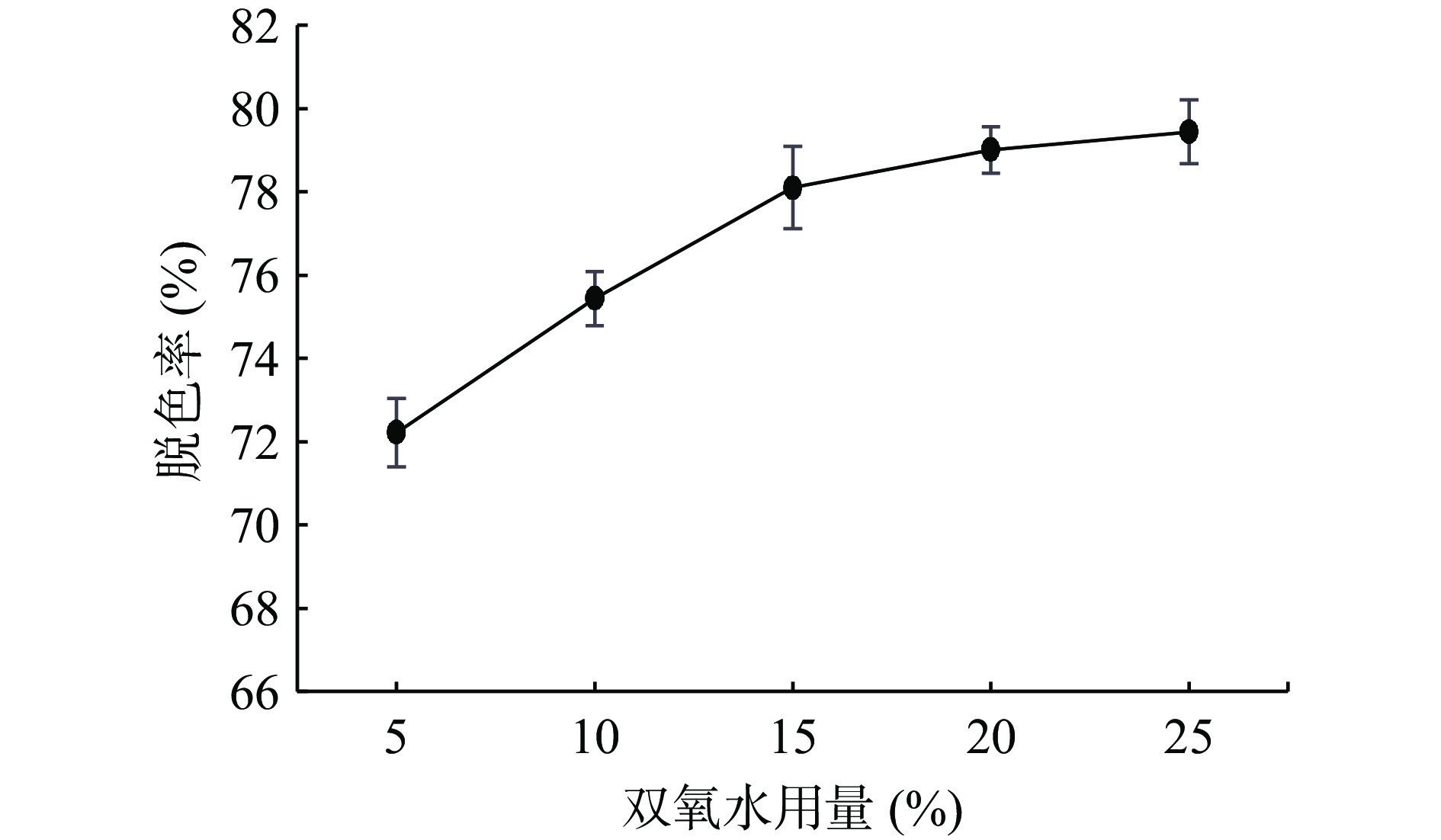
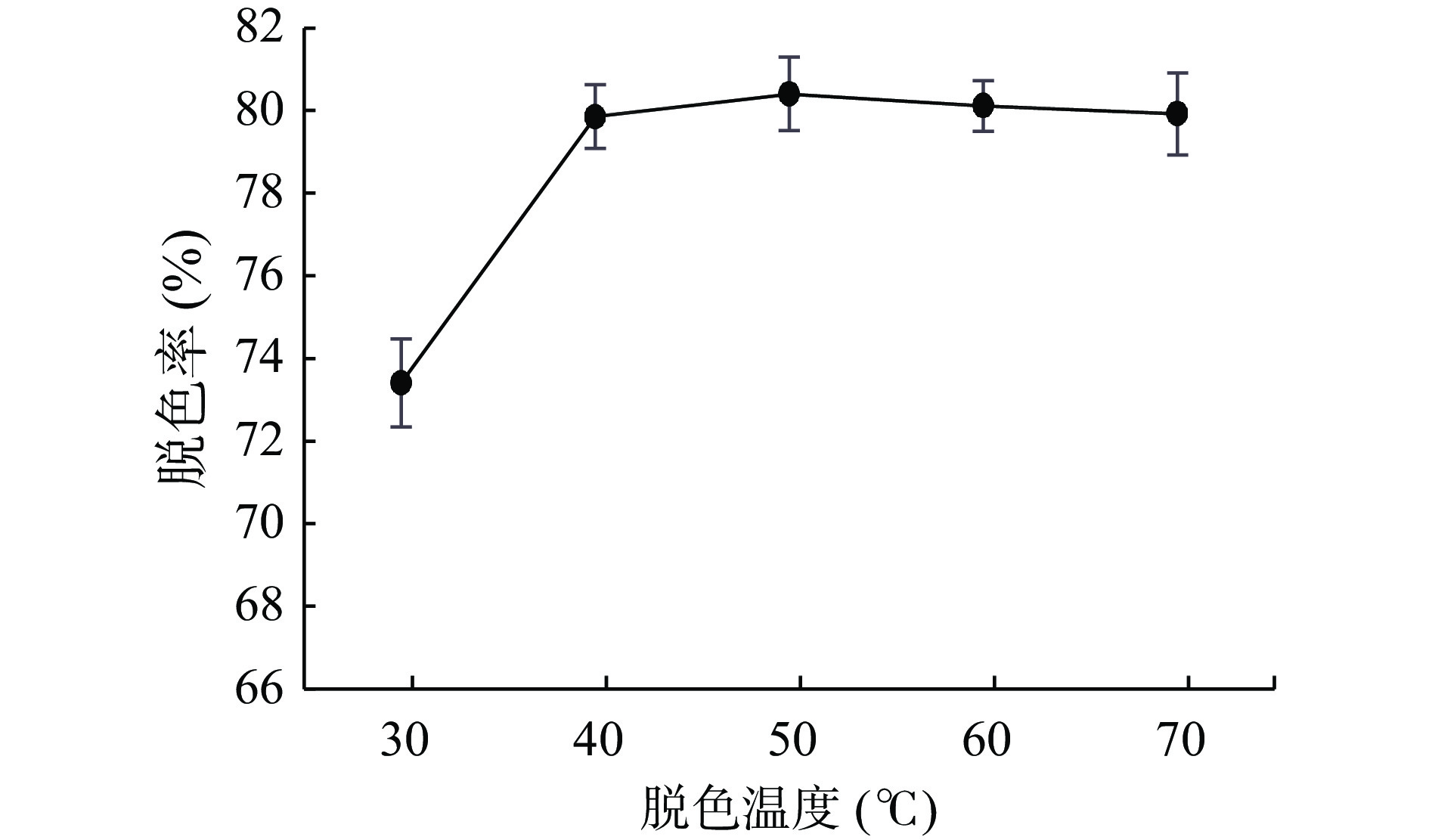
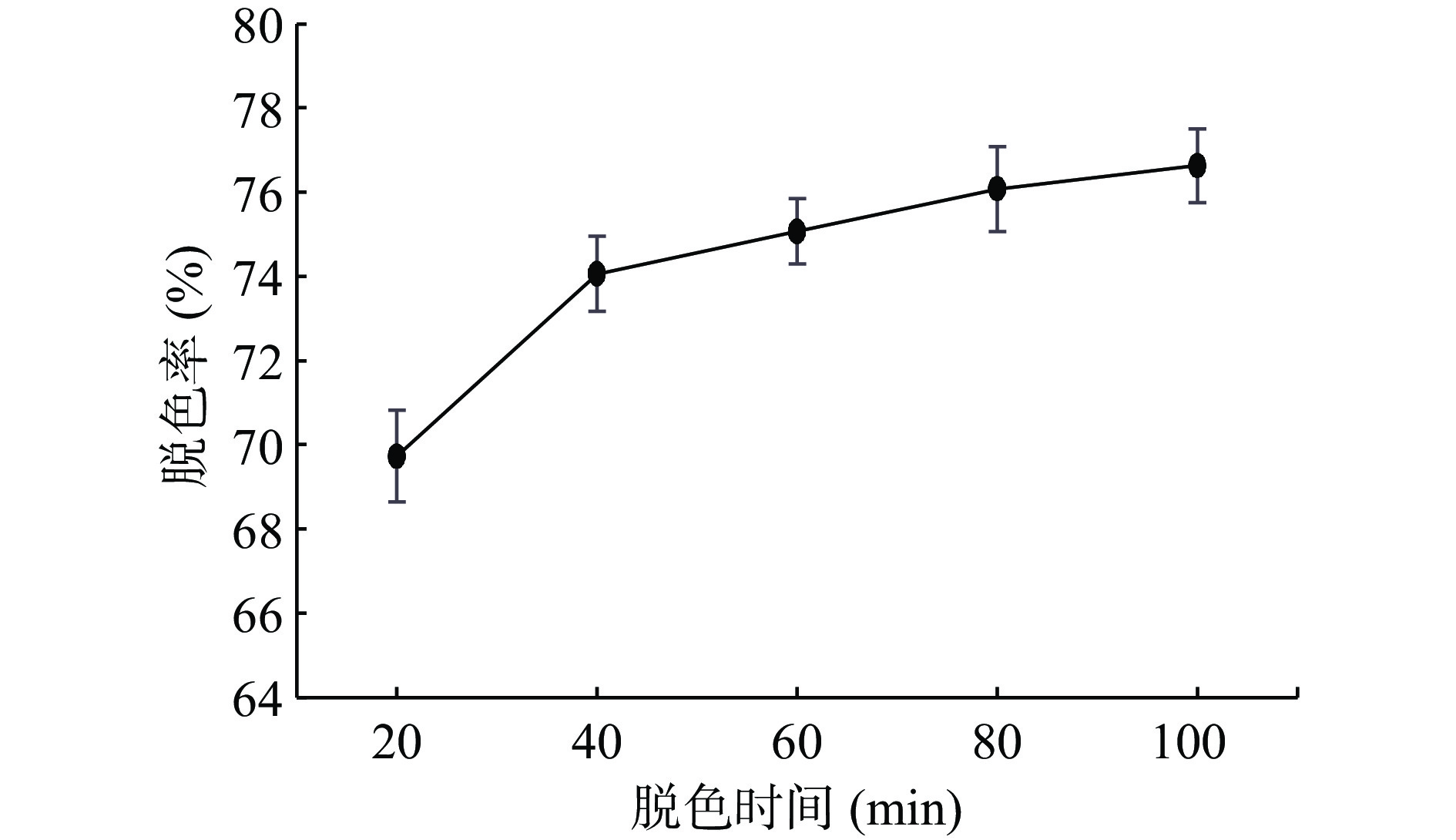
考虑到多糖在碱浓度较大的条件下会水解导致多糖保留率降低,因此本实验选择控制pH条件为8,取配制好的3 mg/mL多糖溶液10 mL为一份,固定条件双氧水用量15%、脱色时间60 min、脱色温度50 ℃,通过改变单一条件分别取五份考察双氧水用量(5%、10%、15%、20%、25%)、脱色温度(30、40、50、60、70 ℃)和脱色时间(20、40、60、80、100 min)对蛇菰多糖脱色效果的影响结果见图1~图3。
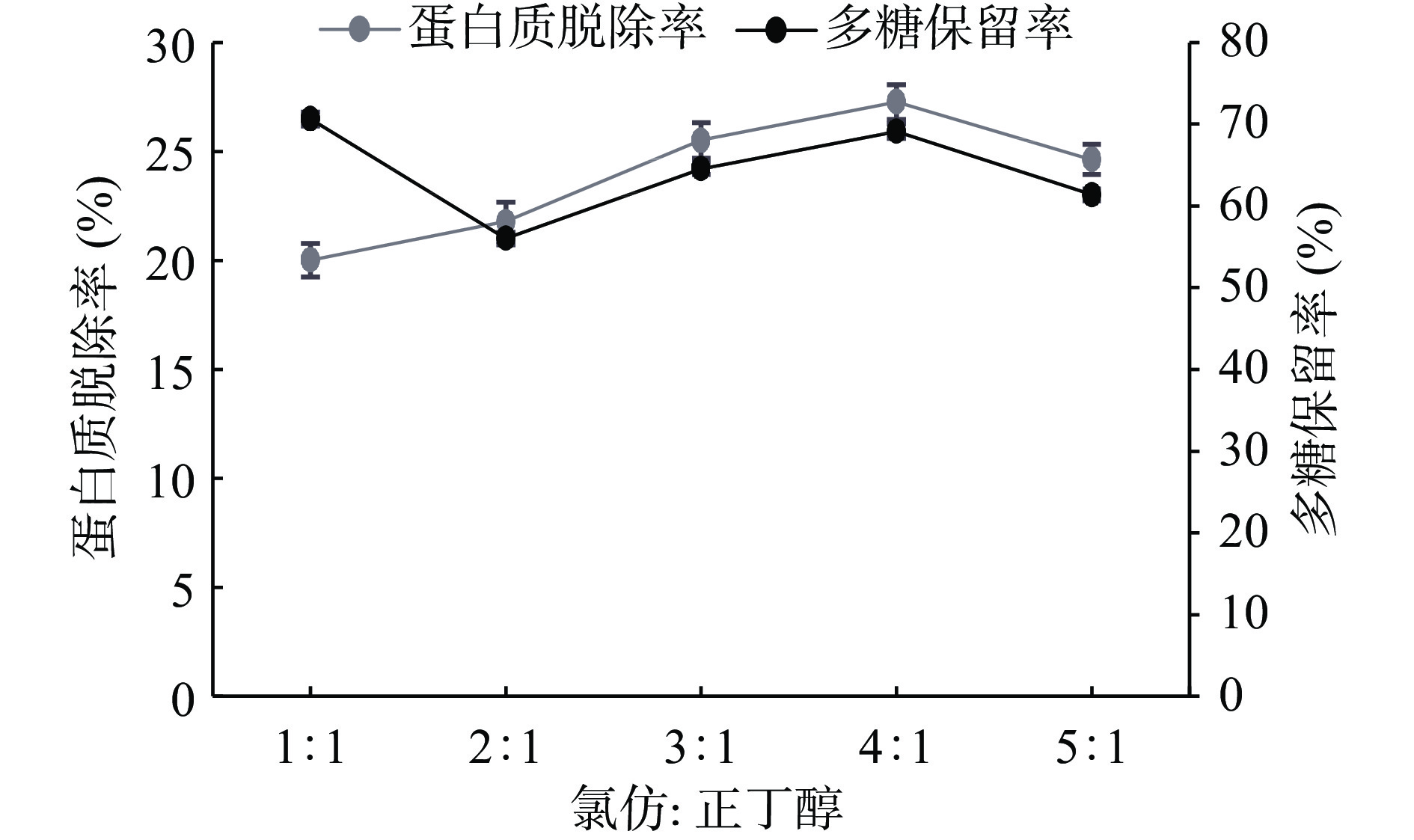
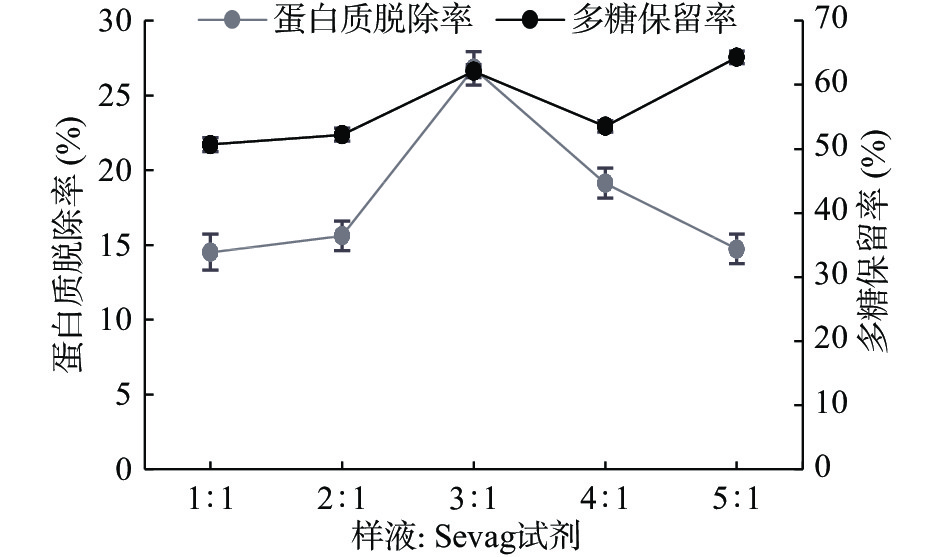
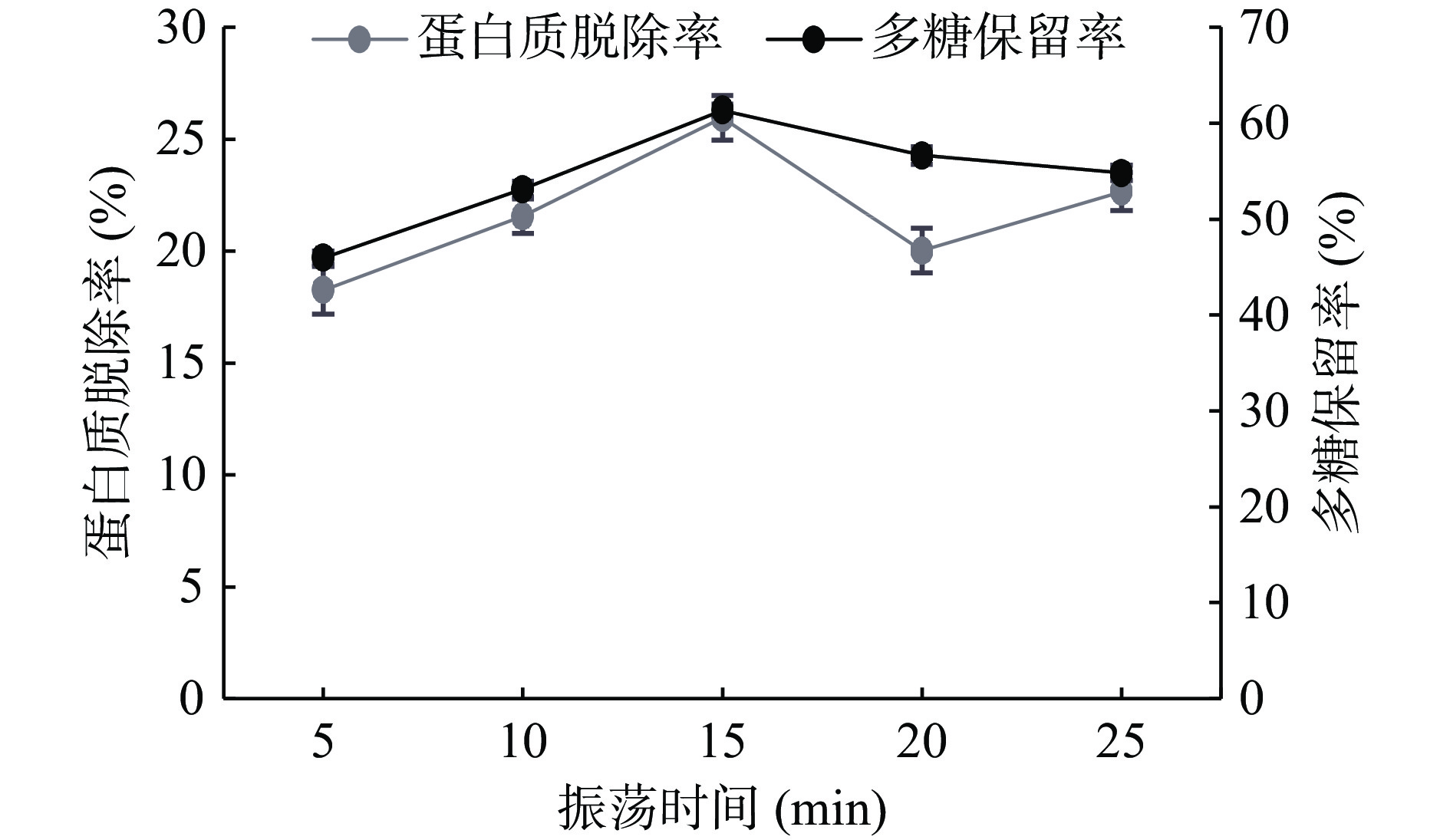
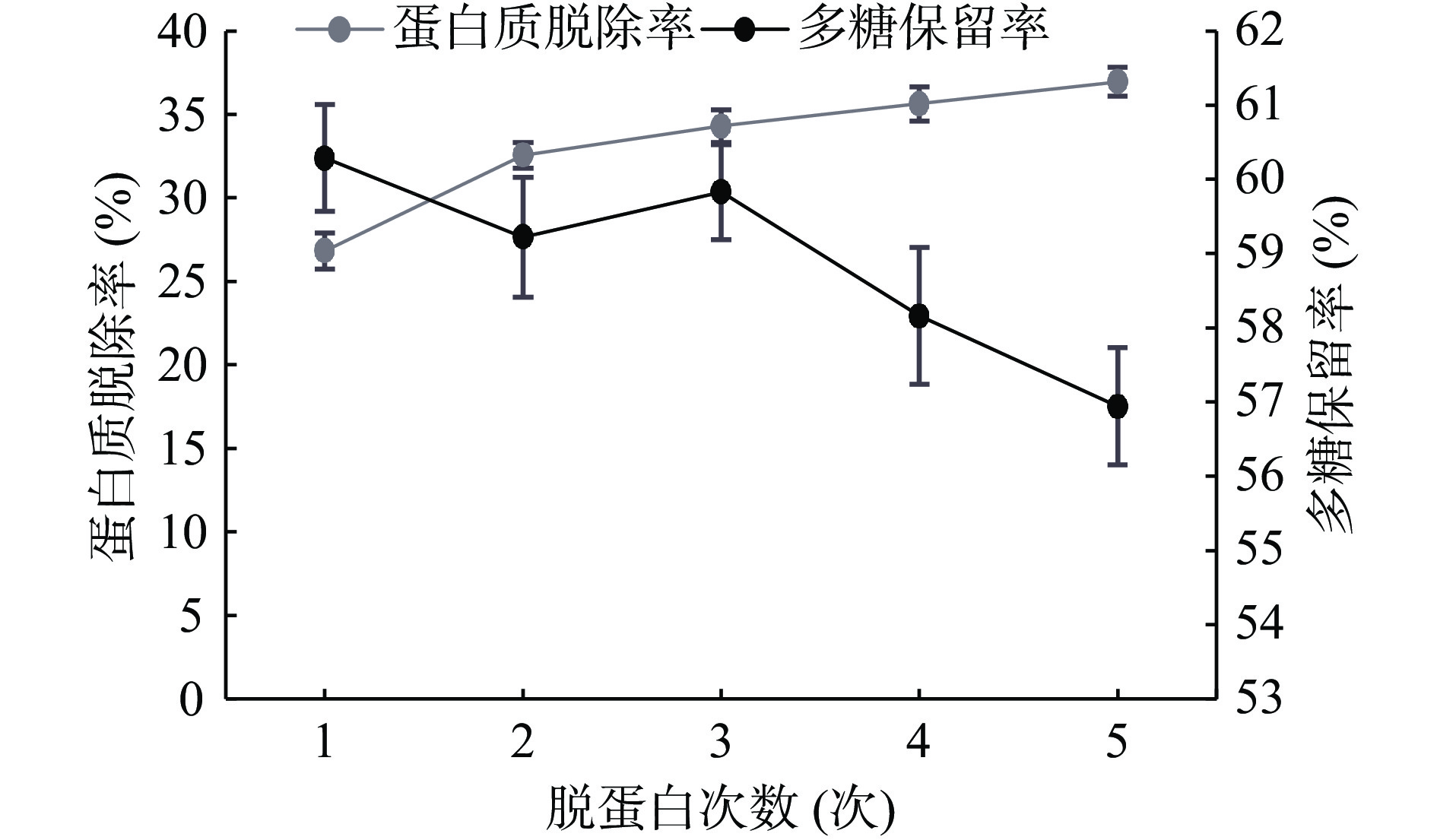
取配制好的3 mg/mL多糖溶液,固定条件氯仿:正丁醇3:1、样液:Sevag试剂3:1、振荡时间15 min、脱蛋白次数1次,通过改变单一条件分别取五份考察氯仿:正丁醇(1:1、2:1、3:1、4:1、5:1)、样液:Sevag试剂(1:1、2:1、3:1、4:1、5:1)、振荡时间(5、10、15、20、25 min)和脱蛋白次数(1、2、3、4、5次)四个因素对多糖保留率及蛋白质脱除率的影响结果见图5~图8。
1.2.6 脱色率、蛋白质脱除率、多糖保留率的测定与计算
在分光光度计预热30 min后,取3 mg/mL蛇菰多糖溶液,在450 nm处测其吸光度并做好记录,经过脱色处理后多糖溶液在同一台分光光度计同样条件下在450 nm处测其脱色后的吸光度做好记录。蛇菰多糖溶液脱色率的计算如下:
脱色率(%)=脱色前吸光度−脱色后吸光度脱色前吸光度×100 配制3 mg/mL的多糖溶液,测得脱蛋白前多糖含量记为A1,蛋白质含量记为B1;测得脱蛋白后多糖含量记为A2,蛋白质含量记为B2。蛇菰多糖溶液多糖保留率和蛋白质脱除率计算如下:
多糖保留率(%)=A2A1×100 蛋白质脱除率(%)=B1−B2B1×100 1.2.7 Box-Benhnken试验设计
以单因素实验结果为依据,利用Design-Expert设计软件对蛇菰多糖脱色脱蛋白进行工艺优化。以脱色率为响应值,双氧水用量、脱色温度、脱色时间为因素水平设计三因素三水平的Box-Behnken中心组合实验。因素水平表见表1。以多糖保留率和蛋白质脱除率为响应值,Sevag试剂比例、样液与Sevag试剂比例、振荡时间三因素设计响应面试验,因素水平表见表2。
表 1 双氧水脱色工艺响应面试验因素和水平设计Table 1. Response surface test factors and horizontal design of hydrogen peroxide decolorization process水平 因素 A双氧水用量(%) B脱色时间(min) C脱色温度(℃) −1 10 40 40 0 15 60 50 1 20 80 60 表 2 Sevag法脱蛋白工艺响应面试验因素与水平设计Table 2. Response surface test factors and horizontal design of Sevag deproteinization process水平 因素 A 氯仿:正丁醇 B 样液:Sevag试剂 C振荡时间(℃) −1 3:1 2:1 10 0 4:1 3:1 15 1 5:1 4:1 20 1.3 数据处理
根据单因素实验利用Excel对数据进行处理作图分析,设计响应面实验并按方案进行试验,每组平行测定三次,用Design-Expert设计软件对数据进行方差分析,分析得出其各因素对脱色率及蛋白质脱除率、多糖保留率的显著影响。
2. 结果与分析
2.1 双氧水脱色单因素实验结果
2.1.1 双氧水用量对脱色效果的影响
由图1可知,双氧水用量在15%时脱色率达到了最高78.1%,考虑到双氧水用量过多且在碱性环境下会氧化分解多糖导致得到的多糖含量减少,说明双氧水的用量是不宜超过20%[23],因此选择10%、15%、20%作为响应面试验三个水平。
2.1.2 脱色温度对脱色率的影响
由图2可知,随着温度的升高脱色率增大,在30~40 ℃时脱色率陡然上升,50 ℃后脱色率逐渐变小,原因是因为随着温度的升高双氧水活性增加但是温度过高且在碱性的条件下双氧水会分解[24],因此选择40、50、60 ℃作为响应面试验三水平。
2.1.3 脱色时间对脱色率的影响
由图3可知,脱色率随着时间增加而增大,40 min后变化逐渐减小。但是考虑到脱色时间越长双氧水同时也会氧化多糖导致多糖损失过多[25],因此选择40、60、80 min作为响应面试验三水平。
2.2 双氧水脱色工艺响应面试验结果与分析
2.2.1 响应面试验设计及结果
根据表1设计因素,采用Design-Expert设计软件对脱色工艺进行试验设计,试验得到最佳实验条件,响应面试验结果见表3,方差分析见表4。
表 3 双氧水响应面试验结果Table 3. Experimental results of hydrogen peroxide response surface实验号 A B C Y:脱色率% 1 0 1 1 82.52 2 0 0 0 78.2 3 −1 −1 0 75.99 4 0 1 −1 77.74 5 −1 0 −1 72.59 6 0 0 0 79.02 7 0 0 0 79.12 8 1 0 −1 74.61 9 −1 0 1 80.22 10 1 −1 0 79.67 11 −1 1 0 78.66 12 0 1 1 81.14 13 0 0 0 79.67 14 1 0 1 81.42 15 0 −1 −1 71.02 16 1 1 0 81.23 17 0 0 0 79.58 表 4 方差分析结果Table 4. Analysis of variance results方差来源 离差平方和 自由度 均方 F值 P值 显著性 模型 156.67 9 17.41 45.16 <0.0001 ** A双氧水用量 11.21 1 11.21 29.08 0.0010 ** B脱色时间 11.45 1 11.45 29.70 0.0010 ** C脱色温度 107.60 1 107.60 279.12 <0.0001 ** AB 0.31 1 0.31 0.80 0.4011 AC 0.17 1 0.17 0.44 0.5302 BC 16.40 1 16.40 42.55 0.0003 ** A2 1.33 1 1.33 3.46 0.1052 B2 0.46 1 0.46 1.21 0.3085 C2 7.62 1 7.62 19.77 0.0030 ** 残差 2.70 7 0.39 失拟项 1.33 3 0.44 1.29 0.3917 纯误差 1.37 4 0.34 总离差 159.37 16 注:R2=0.9831;“*”表示P<0.05显著;“**”表示P<0.01极显著。 2.2.2 模型建立及方差分析结果
根据软件对表3进行数据多元回归拟合,得到蛇菰多糖脱色率对双氧水用量(A)、脱色时间(B)、脱色温度(C)的而二次多项回归模型方程:Y=79.12+1.18A+1.20B+3.67C−0.28AB−0.20AC−2.02BC−0.56A2+0.33B2−1.35C2。该回归方程显著性及方差分析结果见表4。
根据表3知R2=0.9831,模型的P值小于0.0001极显著,失拟项P值为0.3917大于0.05为不显著,其中,一次项(双氧水用量、脱色时间、脱色温度)对响应值的影响全部极显著(P<0.01),交互项BC对响应值的影响极显著(P<0.01),二次项C2对响应值的影响极显著(P<0.01)。这些都说明该回归方程拟合度高,能够预测和分析蛇菰多糖的脱色最佳工艺条件。
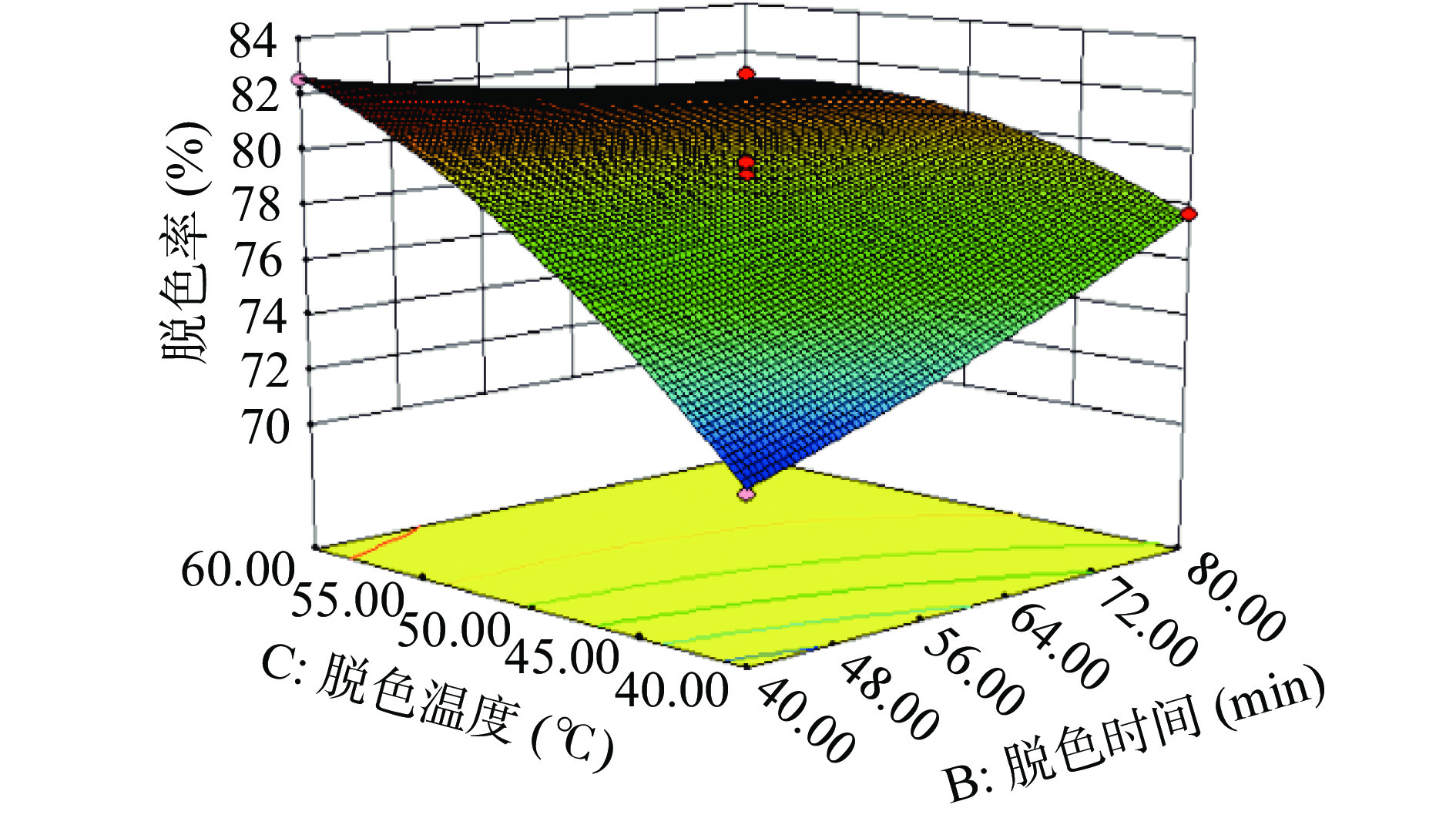
2.2.3 响应面图分析
根据图4分析可知当,随着脱色时间和脱色温度的增加,多糖脱色率是先增加后降低,且响应面图形较陡表示它们对多糖脱色率的影响较大,且脱色时间与脱色温度两者相互影响显著。
2.2.4 双氧水优化结果与验证实验
根据响应面实验得到双氧水脱色最佳工艺条件为:双氧水用量为19.51%、脱色时间为45.58 min、脱色温度为59.60 ℃,在此条件下蛇菰多糖的脱色率为82.72±3.06%。结合现实因素进行验证实验,即双氧水用量20%、脱色时间46 min、脱色温度为60 ℃,最终得到蛇菰多糖脱色率为84.21%,与响应面最优条件相差1.49%,说明利用响应面法优化蛇菰多糖双氧水脱色是可行的。
2.3 Sevag法脱蛋白单因素实验结果
2.3.1 Sevag试剂比例对多糖脱蛋白的影响
由图7可知,氯仿:正丁醇1:1时多糖保留率高、脱蛋白效率低,在氯仿:正丁醇2:1时蛋白质脱除率升高,但是多糖保留率却降低。由于氯仿对蛋白变性起主要作用,加入量越多,脱蛋白率越高;正丁醇对多糖溶解起一定的作用,加入量越少,糖损失率越低[26]。在氯仿:正丁醇4:1的时候多糖保留率与蛋白质脱除率均达到最高,因此选择氯仿:正丁醇3:1、4:1、5:1作为响应面试验三水平。
2.3.2 样液:Sevag试剂对多糖脱蛋白的影响
由图8可知,因为有机溶剂会对多糖结构有一定影响,随着Sevag用量的减少多糖的保留率逐渐提高,在样液:Sevag试剂3:1处多糖保留率和蛋白质脱除率均为高峰,在5:1时虽然多糖保留率上升但是由于Sevag试剂用量少蛋白质脱除率下降,因此选取2:1、3:1、4:1作为响应面试验三水平。
2.3.3 振荡时间对多糖脱蛋白的影响
由图9可知,随着振荡时间的延长,多糖的保留率是先增后减,蛋白质脱除率是振荡时间逐渐增加至15 min后有小幅度的变化,在振荡时间为15 min时多糖保留率和蛋白质脱除率达到最大值,综合考虑下选择10、15、20 min作为响应面试验三水平。
2.3.4 脱蛋白次数对多糖脱蛋白的影响
由图10可知,随着脱蛋白次数的增加蛋白质脱除率的影响并不大,脱蛋白次数在第二次后蛋白质脱除率比较平缓,但是多糖的保留率是有降低的趋势,为了能够得到较多的多糖,综合考虑下选择脱蛋白2次作为固定条件。
2.4 Sevag法脱蛋白响应面试验结果与分析
2.4.1 响应面试验设计结果
根据表2设计因素,采用响应面软件对脱蛋白工艺进行优化,得到最佳实验条件,响应面试验结果见表5,方差分析见表6~表7。
表 5 脱蛋白响应面剂验结果Table 5. Results of deproteinization response surface experiment实验号 A B C Y1:多糖保留率(%) Y2:蛋白质脱除率(%) 1 0 −1 0 55.35 27.82 2 0 −1 1 56.11 42.33 3 0 1 1 62.96 38.4 4 0 1 −1 55.86 33.26 5 1 0 1 60.43 36.89 6 0 0 0 73.11 33.07 7 0 0 0 74.38 32.92 8 0 0 0 78.18 32.86 9 −1 0 −1 49.01 26.61 10 1 1 0 84.53 39.92 11 0 0 0 70.57 33.47 12 1 −1 0 72.6 45.36 13 −1 0 1 59.16 42.64 14 0 0 0 70.32 33.61 15 1 0 −1 63.22 35.08 16 −1 1 0 66.01 44.75 17 −1 −1 0 59.41 39.61 表 6 多糖保留率方差分析结果Table 6. Analysis of variance of polysaccharide retention rate results方差来源 离差平方和 自由度 均方 F值 P值 显著性 模型 1339.77 9 148.86 11.59 0.0020 ** A 氯仿:正丁醇 278.36 1 278.36 21.67 0.0023 ** B样液:Sevag试剂 83.79 1 83.79 6.52 0.0379 * C振荡时间 28.96 1 28.96 2.25 0.1769 AB 7.10 1 7.10 0.55 0.4813 AC 41.86 1 41.86 3.26 0.1140 BC 10.05 1 10.05 0.78 0.4058 A2 5.52 1 5.52 0.43 0.5331 B2 9.85 1 9.85 0.77 0.4101 C2 850.48 1 850.48 66.22 <0.0001 ** 残差 89.90 7 12.84 失拟项 48.55 3 16.18 1.57 0.3293 纯误差 41.35 4 10.34 总离差 1429.67 16 注:R2=0.9371;“*”表示P<0.05显著;“**”表示P<0.01极显著。 表 7 蛋白质脱除率方差分析表Table 7. Analysis of variance of protein removal rate方差来源 离差平方和 自由度 均方 F值 P值 显著性 模型 482.53 9 53.61 224.07 <0.0001 ** A 氯仿:正丁醇 1.66 1 1.66 6.92 0.0339 * B样液:Sevag试剂 0.18 1 0.18 0.76 0.4108 C振荡时间 175.69 1 175.69 734.24 <0.0001 ** AB 27.98 1 27.98 116.95 <0.0001 ** AC 50.55 1 50.55 211.27 <0.0001 ** BC 21.95 1 21.95 91.73 <0.0001 ** A2 86.72 1 86.72 362.42 <0.0001 ** B2 92.45 1 92.45 386.36 <0.0001 ** C2 24.64 1 24.64 102.99 <0.0001 ** 残差 1.67 7 0.24 失拟项 1.22 3 0.41 3.62 0.1230 纯误差 0.45 4 0.11 总离差 484.20 16 注:R2=0.9965;“*”表示P<0.05显著;“**”表示P<0.01极显著。 2.4.2 模型建立与其显著性检验
根据软件对表进行数据多元回归拟合,得到蛇菰多糖多糖保留率和蛋白质脱除率对氯仿:正丁醇(A)、样液:Sevag试剂(B)、振荡时间(C)的二次多项回归模型方程分别为:
Y1(多糖保留率)=73.31+5.90A+3.24B+1.90C+1.33AB−3.24AC+1.59BC−1.14A2−1.53B2−14.21C2
Y2(蛋白质脱除率)=33.19+0.46A+0.15B+4.69C−2.65AB−3.56AC−2.34BC+4.54A2+4.69B2−2.42C2
根据表6知R2=0.9371,模型的P值小于0.01为极显著,失拟项P值为0.3293大于0.05为不显著,其中一次项前两项均显著,二次项C2极显著;表7可知R2=0.9965,模型的P值小于0.0001极显著,失拟项0.1230>0.05不显著,所有项中除了B样液:Sevag试剂不显著以外,其余都显著,说明回归方程拟合度高,能够预测蛇菰多糖的脱蛋白最佳工艺条件。
2.4.3 响应面图分析
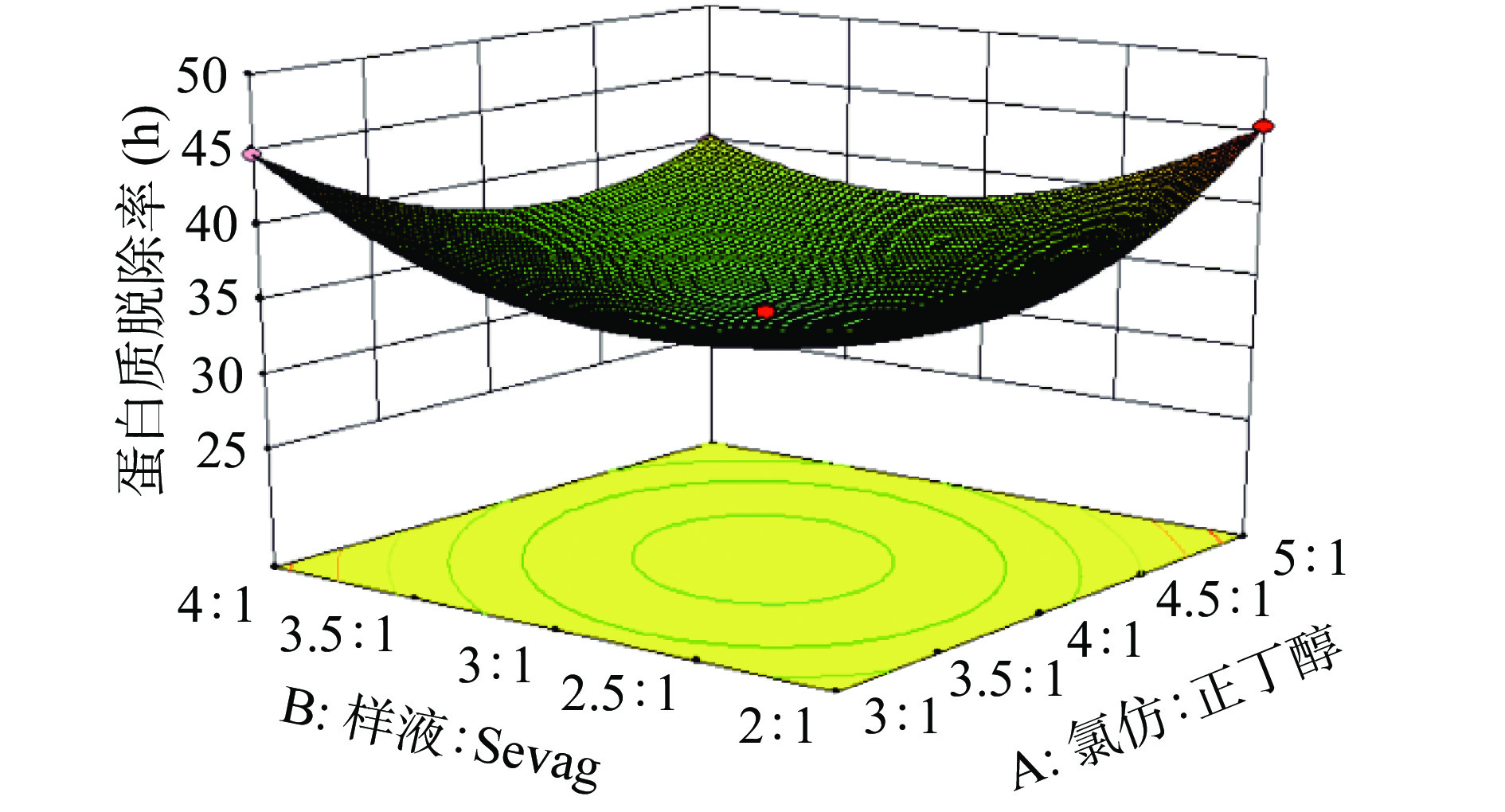
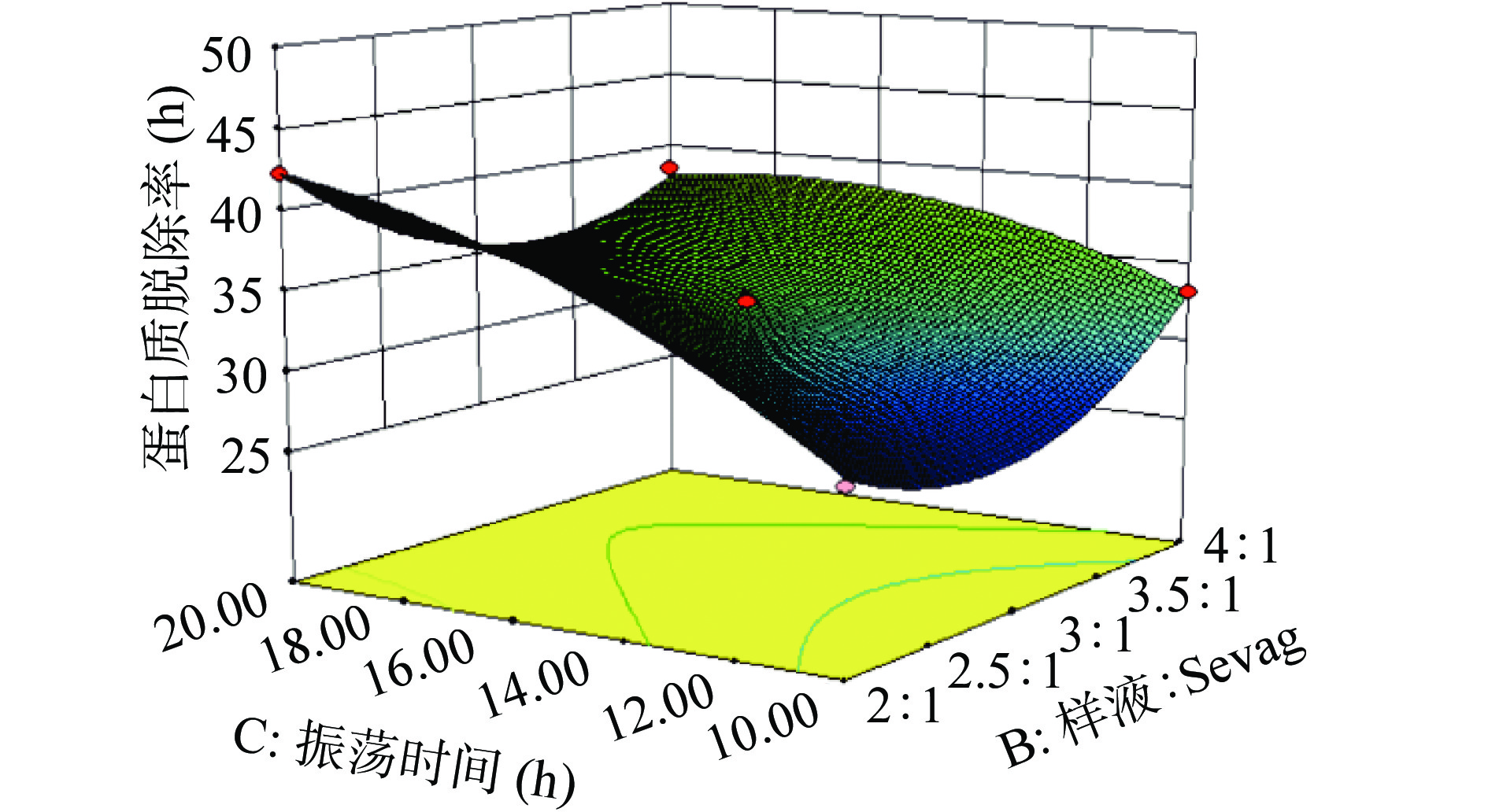
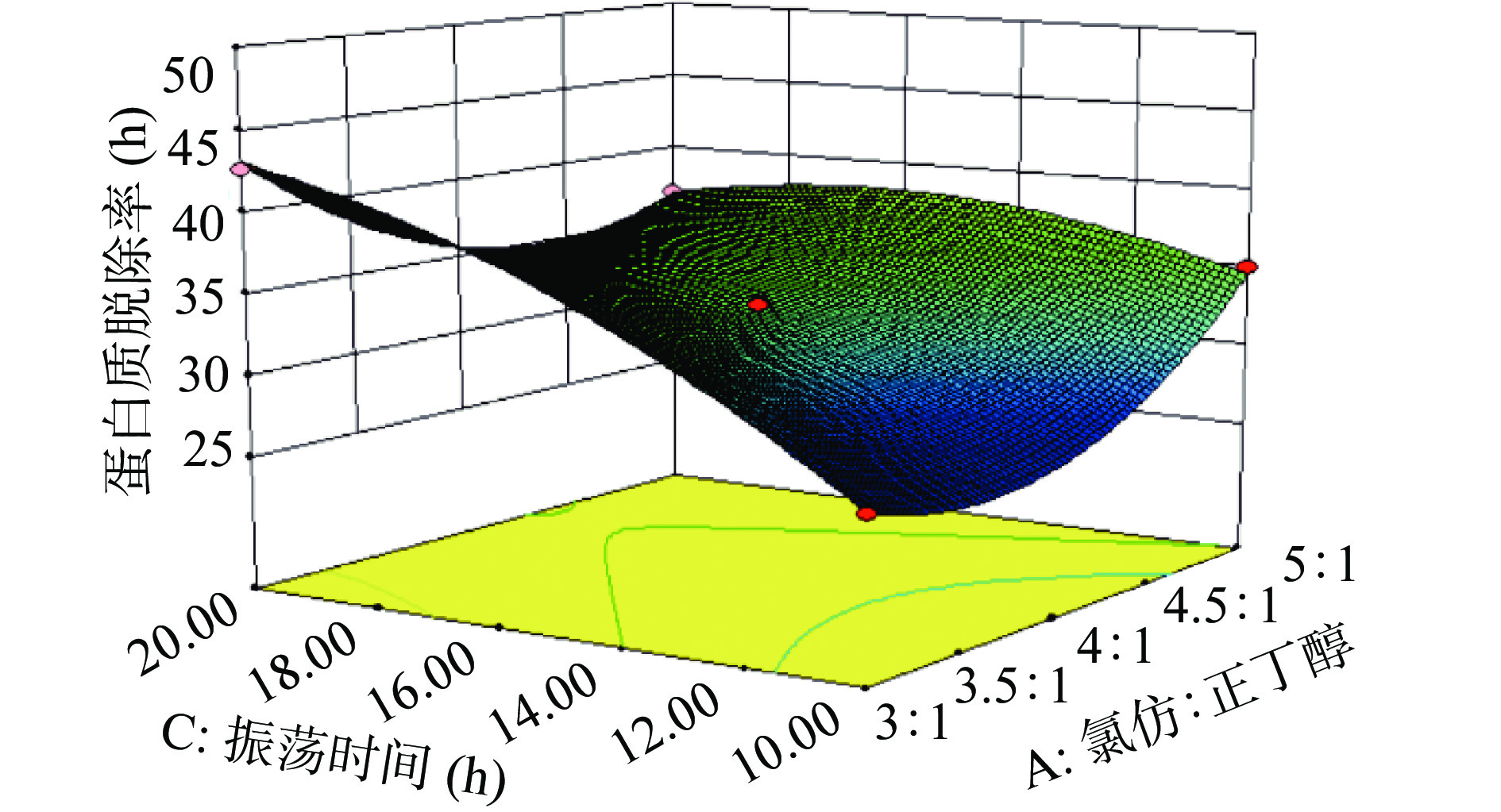
由图9~图11分析可知,随着交互因素的增加,蛋白质脱除率是先降低后增加,且响应面图是凹形的,图形越凹表示这几项因素对蛋白质脱除率的影响越大。图形显示,AB、AC和BC之间得交互影响对蛋白质脱除率是显著影响的。
2.4.4 Sevag法脱蛋白优化结果与验证实验
根据响应面试验得到Sevag法脱蛋白最佳工艺条件为:氯仿:正丁醇5:1、样液:Sevag试剂4:1、振荡时间14.68 min、脱蛋白次数2次,此时多糖保留率和蛋白质脱除率分别为81.03%和40.44%。由于现实实验条件有限,因此进行验证实验,氯仿:正丁醇5:1、样液:Sevag试剂4:1、振荡时间15 min、脱蛋白次数2次,最后多糖保留率和蛋白质脱除率分别为80.78%、40.89%,与响应面试验数据相比较蛋白质脱除率低了0.25%、多糖保留率提高0.45%。
3. 讨论
目前,多糖脱色脱蛋白方法有很多,曾杰等[27]运用D301型大孔吸附树脂对无花果多糖脱色,最优脱色工艺条件为pH4.2,脱色温度32 ℃,树脂用量4 g/50 mL,上样质量浓度5.5 mg/mL,脱色时间2 h,脱色率为86.18%。经嘉等[25]用双氧水法对猫爪草多糖进行了脱色工艺优化实验,结果表明在脱色时间60 min、pH9.0、脱色温度45 ℃、双氧水用量 20%,此条件下脱色率为79.7%,多糖保留率为74.3%。亓希武等[28]研究了以蛋白脱除率和多糖保留率为评价指标,研究了Sevag法、TCA法、木瓜蛋白酶法和盐酸法对桃胶多糖的脱蛋白效果,其中Sevag法为桃胶多糖脱蛋白的最佳方法,当脱蛋白4次时,蛋白脱除率为89.64%,多糖保留率为82.47%。文献[29-31]用了多种脱蛋白方法分别对不同的多糖进行了脱蛋白研究。本文选用了双氧水对蛇菰多糖进行脱色处理,脱色效果较活性炭脱色更佳,操作较大孔树脂脱色更简单,且成本低廉,结果与经嘉等[25]研究相接近;根据前人经验选取了Sevag法对蛇菰多糖进行脱蛋白处理,结果表明Sevag法脱蛋白操作简单,效果良好,是一种可行的方法。
4. 结论
本文采用双氧水和Sevag法对蛇菰多糖进行脱色、脱蛋白,并用响应面进行优化,最佳条件为双氧水用量为20%、脱色时间为46 min、脱色温度为60 ℃,在此条件下蛇菰多糖的脱色率为84.21%;氯仿:正丁醇5:1、样液:Sevag试剂4:1、振荡时间15 min,在此条件下,多糖保留率为81.03%,蛋白质脱除率为40.44%,为后续多糖的分离纯化以及活性研究奠下了一定的基础。
-
表 1 双氧水脱色工艺响应面试验因素和水平设计
Table 1 Response surface test factors and horizontal design of hydrogen peroxide decolorization process
水平 因素 A双氧水用量(%) B脱色时间(min) C脱色温度(℃) −1 10 40 40 0 15 60 50 1 20 80 60 表 2 Sevag法脱蛋白工艺响应面试验因素与水平设计
Table 2 Response surface test factors and horizontal design of Sevag deproteinization process
水平 因素 A 氯仿:正丁醇 B 样液:Sevag试剂 C振荡时间(℃) −1 3:1 2:1 10 0 4:1 3:1 15 1 5:1 4:1 20 表 3 双氧水响应面试验结果
Table 3 Experimental results of hydrogen peroxide response surface
实验号 A B C Y:脱色率% 1 0 1 1 82.52 2 0 0 0 78.2 3 −1 −1 0 75.99 4 0 1 −1 77.74 5 −1 0 −1 72.59 6 0 0 0 79.02 7 0 0 0 79.12 8 1 0 −1 74.61 9 −1 0 1 80.22 10 1 −1 0 79.67 11 −1 1 0 78.66 12 0 1 1 81.14 13 0 0 0 79.67 14 1 0 1 81.42 15 0 −1 −1 71.02 16 1 1 0 81.23 17 0 0 0 79.58 表 4 方差分析结果
Table 4 Analysis of variance results
方差来源 离差平方和 自由度 均方 F值 P值 显著性 模型 156.67 9 17.41 45.16 <0.0001 ** A双氧水用量 11.21 1 11.21 29.08 0.0010 ** B脱色时间 11.45 1 11.45 29.70 0.0010 ** C脱色温度 107.60 1 107.60 279.12 <0.0001 ** AB 0.31 1 0.31 0.80 0.4011 AC 0.17 1 0.17 0.44 0.5302 BC 16.40 1 16.40 42.55 0.0003 ** A2 1.33 1 1.33 3.46 0.1052 B2 0.46 1 0.46 1.21 0.3085 C2 7.62 1 7.62 19.77 0.0030 ** 残差 2.70 7 0.39 失拟项 1.33 3 0.44 1.29 0.3917 纯误差 1.37 4 0.34 总离差 159.37 16 注:R2=0.9831;“*”表示P<0.05显著;“**”表示P<0.01极显著。 表 5 脱蛋白响应面剂验结果
Table 5 Results of deproteinization response surface experiment
实验号 A B C Y1:多糖保留率(%) Y2:蛋白质脱除率(%) 1 0 −1 0 55.35 27.82 2 0 −1 1 56.11 42.33 3 0 1 1 62.96 38.4 4 0 1 −1 55.86 33.26 5 1 0 1 60.43 36.89 6 0 0 0 73.11 33.07 7 0 0 0 74.38 32.92 8 0 0 0 78.18 32.86 9 −1 0 −1 49.01 26.61 10 1 1 0 84.53 39.92 11 0 0 0 70.57 33.47 12 1 −1 0 72.6 45.36 13 −1 0 1 59.16 42.64 14 0 0 0 70.32 33.61 15 1 0 −1 63.22 35.08 16 −1 1 0 66.01 44.75 17 −1 −1 0 59.41 39.61 表 6 多糖保留率方差分析结果
Table 6 Analysis of variance of polysaccharide retention rate results
方差来源 离差平方和 自由度 均方 F值 P值 显著性 模型 1339.77 9 148.86 11.59 0.0020 ** A 氯仿:正丁醇 278.36 1 278.36 21.67 0.0023 ** B样液:Sevag试剂 83.79 1 83.79 6.52 0.0379 * C振荡时间 28.96 1 28.96 2.25 0.1769 AB 7.10 1 7.10 0.55 0.4813 AC 41.86 1 41.86 3.26 0.1140 BC 10.05 1 10.05 0.78 0.4058 A2 5.52 1 5.52 0.43 0.5331 B2 9.85 1 9.85 0.77 0.4101 C2 850.48 1 850.48 66.22 <0.0001 ** 残差 89.90 7 12.84 失拟项 48.55 3 16.18 1.57 0.3293 纯误差 41.35 4 10.34 总离差 1429.67 16 注:R2=0.9371;“*”表示P<0.05显著;“**”表示P<0.01极显著。 表 7 蛋白质脱除率方差分析表
Table 7 Analysis of variance of protein removal rate
方差来源 离差平方和 自由度 均方 F值 P值 显著性 模型 482.53 9 53.61 224.07 <0.0001 ** A 氯仿:正丁醇 1.66 1 1.66 6.92 0.0339 * B样液:Sevag试剂 0.18 1 0.18 0.76 0.4108 C振荡时间 175.69 1 175.69 734.24 <0.0001 ** AB 27.98 1 27.98 116.95 <0.0001 ** AC 50.55 1 50.55 211.27 <0.0001 ** BC 21.95 1 21.95 91.73 <0.0001 ** A2 86.72 1 86.72 362.42 <0.0001 ** B2 92.45 1 92.45 386.36 <0.0001 ** C2 24.64 1 24.64 102.99 <0.0001 ** 残差 1.67 7 0.24 失拟项 1.22 3 0.41 3.62 0.1230 纯误差 0.45 4 0.11 总离差 484.20 16 注:R2=0.9965;“*”表示P<0.05显著;“**”表示P<0.01极显著。 -
[1] 陶汝俊, 徐湘婷. 蛇菰属植物化学成分和药理活性研究进展[J]. 中国民族民间医药,2017,26(7):73−78. [TAO R J, XU X T. Research progress on chemical constituents and pharmacological activities of zizania SPP[J]. Chinese Ethnic Folk Medicine,2017,26(7):73−78. [2] 思茅地区民族传统医药研究所. 拉祜族常见药[M]. 昆明: 云南民族出版社, 1986. Simao Institute of Traditional Ethnic Medicine. Chinese Herbal medicine of lahu nationality [M]. Kunming: Yunnan Nationalities Publishing House, 1986.
[3] 庄远杯, 林大都, 李云霞, 等. 红冬蛇菰的研究概况[J]. 中国民族民间医药,2017,26(8):60−62. [ZHUANG Y B, LIN D D, LI Y X, et al. Research status of wild mushroom[J]. Chinese Folk Medicine,2017,26(8):60−62. [4] Editorial Board of China Herbal, State Administration of Traditional Chinese Medicine, China. China Herbal[M]. Shanghai: Shanghai Scientific and Technical Publishers, 1999.
[5] LIN T L, SHU C C, CHEN Y M, et al. Like cures like: Pharmacological activity of anti-inflammatory lipopolysaccharides from gut microbiome[J]. Frontiers in Pharmacology,2020,11:554. doi: 10.3389/fphar.2020.00554
[6] 彭梅, 张振东, 杨娟. 14种多糖对小鼠S_(180)肉瘤抑制活性筛选[J]. 山地农业生物学报,2011,30(1):56−59. [PENG M, ZHANG Z D, YANG J. Screening of 14 polysaccharides against S_(180) sarcoma in mice[J]. Journal of Mountain Agricultural Biology,2011,30(1):56−59. doi: 10.3969/j.issn.1008-0457.2011.01.012 [7] WANG X, HUO X Z, LIU Z, et al. Investigations on the anti-aging activity of polysaccharides from Chinese yam and their regulation on klotho gene expression in mice[J]. Journal of Molecular Structure,2020,1208:127895. doi: 10.1016/j.molstruc.2020.127895
[8] LI Q Q, HU J L, NIE Q X, et al. Hypoglycemic mechanism of polysaccharide from Cyclocarya paliurus leaves in type 2 diabetic rats by gut microbiota and host metabolism alteration[J]. Science China Life Sciences,2020,64:117−132.
[9] 杨庆伟, 王芃, 全迎萍. 灰树花子实体多糖硫酸酯化及抗凝血活性研究[J]. 北京联合大学学报,2022,36(2):52−56. [YANG Q W, WANG P, QUAN Y P. Study on sulfation and anticoagulant activity of polysaccharides from fruiting body of grifola frondosa[J]. Journal of Beijing union university,2022,36(2):52−56. [10] 陶遵威, 郑夺, 邸明磊, 等. 植物多糖的研究进展[C]//中药及天然产物与健康滨海论坛论文集, 2010: 148-152. TAO Z W, ZHENG D, DI M L, et al. Research progress of plant polysaccharides [C]// Journal of Traditional Chinese Medicine, Natural Products and Healthy Coastal Forum, 2010: 148-152.
[11] 石雪萍. 植物多糖研究进展[J]. 粮食与油脂,2005,18(8):8. [SHI X P. Research progress of the plant polysaccharides[J]. Grain and Oils,2005,18(8):8. doi: 10.3969/j.issn.1008-9578.2005.08.002 [12] 李倩倩, 陈贵元. 刺梨果多糖提取过程中脱蛋白和脱色方法研究[J]. 安徽农业科学,2022,50(11):162−166, 183. [LI Q Q, CHEN G Y. Study on the methods of deproteinization and decolorization of polysaccharide from Rosa roxerus[J]. Journal of Anhui Agricultural Sciences,2022,50(11):162−166, 183. [13] 李洁, 陈琳, 刘海棠, 等. 银条菜粗多糖脱蛋白的方法研究[J]. 天津科技大学学报,2022,37(1):18−22, 27. [LI J, CHEN L, LIU H T, et al. Study on the method of deproteinization of crude polysaccharide from Agaricus japonicus[J]. Journal of Tianjin University of Science and Technology,2022,37(1):18−22, 27. [14] 郭慧静, 张伟达, 陈国刚. 蒲公英多糖脱色脱蛋白方法及其降血糖活性研究[J]. 食品研究与开发,2020,41(3):24−28. [GUO H J, ZHANG W D, CHEN G G. Study on decolorization and deproteinization of dandelion polysaccharide and its hypoglycemic activity[J]. Food Research and Development,2020,41(3):24−28. [15] 何美佳, 刘晓, 唐翠翠, 等. 多糖脱蛋白方法的研究进展[J]. 中国海洋药物,2019,38(3):82−86. [HE M J, LIU X, TANG C C. Research progress of polysaccharide deproteinization methods[J]. China Marine Medicine,2019,38(3):82−86. [16] 付学鹏, 杨晓杰. 植物多糖脱色技术的研究[J]. 食品研究与开发,2007,28(11):166−169. [FU X P, YANG X J. Study on decolorization technology of plant polysaccharides[J]. Food Research and Development,2007,28(11):166−169. doi: 10.3969/j.issn.1005-6521.2007.11.051 [17] 车向前, 常明泉. 中药植物色素脱色工艺的应用[J]. 实用药物与临床,2017,20(8):979−982. [CHE X Q, CHANG M Q. Application of plant pigment decolorization technology for traditional Chinese medicine[J]. Practical Drugs and Clinic,2017,20(8):979−982. [18] 孙莹, 纪跃芝, 马爱民, 等. 水提-醇沉法提取大黄多糖工艺优化研究[J]. 中国实用医药,2010,5(18):6−8. [SUN Y, JI Y Z, MA A M, et al. Optimization of rhubarb polysaccharide extraction by water extraction and alcohol precipitation[J]. China Practical Medicine,2010,5(18):6−8. [19] 赵艳, 王白娟, 杨青松等. 红雪茶多糖过氧化氢脱色工艺优化[J]. 南方农业学报,2016,47(5):710−714. [ZHAO Y, WANG B J, YANG Q S, et al. Optimization of hydrogen peroxide decolorization technology of red snow tea polysaccharide[J]. Journal of Southern Agriculture,2016,47(5):710−714. doi: 10.3969/j:issn.2095-1191.2016.05.710 [20] 杨勤, 谷文超, 周浓, 等. 苯酚-硫酸法与蒽酮-硫酸法测定地参多糖的比较研究[J]. 食品科技,2020,45(1):343−350. [YANG Q, GU W C, ZHOU N, et al. Comparative study of phenol-sulfuric acid method and anthrone-sulfuric acid method for the determination of polysaccharides from radix ginseng[J]. Food Science and Technology,2020,45(1):343−350. [21] 谢心文, 门磊, 孙怡, 等. 蒽酮-硫酸法测定复方木鸡颗粒中粗多糖[J]. 中成药,2019,41(7):1685−1687. [XIE X W, MEN L, SUN Y, et al. Determination of crude polysaccharide in compound muji granules by anthrone-sulfuric acid method[J]. Chinese Patent Medicine,2019,41(7):1685−1687. doi: 10.3969/j.issn.1001-1528.2019.07.039 [22] 杨静, 白冰, 王宁, 张改红. 考马斯亮蓝法对烟草薄片涂布液中蛋白质含量的测定[J]. 湖北农业科学,2017,56(5):946−947,950. [YANG J, BAI B, WANG N, ZHANG G H. Determination of protein content in tobacco coating liquid by coomassie brilliant blue method[J]. Hubei Agricultural Sciences,2017,56(5):946−947,950. [23] 汪荣斌, 秦亚东, 周娟娟. 青钱柳叶多糖双氧水脱色工艺研究[J]. 辽宁中医药大学学报,2016,18(9):60−62. [WANG R B, QIN Y D, ZHOU J J. Study on decolorization technology of polysaccharides from leaves of Cyrrhizoma chinensis[J]. Journal of Liaoning University of Traditional Chinese Medicine,2016,18(9):60−62. [24] 刘冲英, 蒲定涛, 任佳妮, 等. 陕产地黄多糖的纯化及抗氧化活性研究[J]. 化学与生物工程,2020,37(10):15−21. [LIU C Y, PU D T, REN J N, et al. Purification and antioxidant activity of yellow polysaccharide from Shaanxi[J]. Chemical and Biological Engineering,2020,37(10):15−21. doi: 10.3969/j.issn.1672-5425.2020.10.004 [25] 经嘉, 廖启元. 猫爪草多糖双氧水脱色工艺研究[J]. 济宁医学院学报,2018,41(6):384−387. [JING J, LIAO Q Y. Study on the decolorization process of polysaccharide from catenopus rubra with hydrogen peroxide[J]. Journal of Jining Medical College,2018,41(6):384−387. doi: 10.3969/j.issn.1000-9760.2018.06.002 [26] 张萍, 贺茂萍, 殷力, 葛秋萍. 石榴皮多糖的Sevage法除蛋白工艺研究[J]. 食品科技,2013,38(12):219−222, 231. [ZHANG P, HE M P, YIN L, GE Q P. Study on removal of polysaccharides from pomegranate peel by Sevage method[J]. Food Science and Technology,2013,38(12):219−222, 231. doi: 10.13684/j.cnki.spkj.2013.12.049 [27] 曾杰, 房海灵, 梁呈元, 等. 无花果粗多糖脱色工艺优化及其吸附性能研究[J]. 中成药,2022,44(2):537−542. [ZENG J, FANG H L, LIANG C Y, et al. Study on decolorization process optimization and adsorption performance of crude polysaccharide from FIG[J]. Chinese Patent Medicine,2022,44(2):537−542. [28] 亓希武, 房海灵, 陈泽群, 梁呈元, 吕寒. 桃胶多糖脱蛋白工艺研究[J]. 现代食品,2021(8):104−107. [QI X W, FANG H J, CHENG Z Q, et al. Study on deproteinization technology of peach gum polysaccharide[J]. Modern Food,2021(8):104−107. [29] 王乐, 靳学远, 霍智文. 桑枝多糖酶法脱蛋白工艺优化及理化特性研究[J]. 中国食品添加剂,2022,33(7):136−143. [WANG L, JIN X Y, HUO Z W. Study on optimization of enzymatic deproteinization process and physicochemical properties of polysaccharides from mulberry branch[J]. China Food Additives,2022,33(7):136−143. [30] 王莹, 李锋涛, 黄美子, 等. 黄精多糖脱蛋白工艺及其抗氧化活性[J]. 食品工业,2021,42(12):57−62. [WANG Y, LI F T, HHUANG M Z, et al. Deproteinization process and antioxidant activity of polysaccharides from Rhizoma polygonatum[J]. Food Industry,2021,42(12):57−62. [31] 刘冲英, 陈子龙, 王睿, 等. 地黄多糖脱蛋白工艺研究[J]. 化学与生物工程,2020,37(11):46−50. [LIU C Y, CHEN Z L, WANG R, et al. Study on deproteinization of polysaccharides from rehmannia glutinosa[J]. Chemical and Biological Engineering,2020,37(11):46−50. -
期刊类型引用(5)
1. 张月,杨新玥,黄莉,马帅宇,胥畅,杨腊梅,裴慧洁,何维,杨勇. 乳酸菌复配发酵对川味香肠品质及酪胺含量的影响. 食品与发酵工业. 2025(06): 83-90 .  百度学术
百度学术
2. 牟燕,赖茂佳,易宇文,范文教. 微生物发酵剂对川味牦牛肉香肠品质的影响. 中国酿造. 2024(02): 188-193 .  百度学术
百度学术
3. 李晓,王成,郭楠楠,潘道东. 嗜酸乳杆菌发酵鸭肉脯工艺优化及品质分析. 肉类研究. 2024(01): 36-43 .  百度学术
百度学术
4. 赵志磊,李昊轩,牛晓颖,陈萌,庞艳苹. γ射线辐照结合VC、烟酰胺对卤驴肉中亚硝酸盐的降解效果. 食品科学. 2024(16): 197-203 .  百度学术
百度学术
5. 文静,许恒毅,甘蓓,周渊坤,张锦峰. 混合菌株发酵板鸭的研究进展. 江西科学. 2024(04): 710-715 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:



 下载:
下载:



