Ultrasound-Assisted Extraction of Anthocyanins from Aronia melanocarpa with Acidic Natural Deep Eutectic Solvents and Its Stability and Antioxidant Activity
-
摘要: 建立一种绿色、高效的超声波辅助酸性天然低共熔溶剂提取黑果腺肋花楸花青素的新方法,利用人工神经网络和遗传算法优化提取条件,并研究花青素提取物的稳定性和抗氧化活性。以甜菜碱和有机酸为氢键受体和氢键供体,制备了一系列酸性天然低共熔溶剂,并对其密度、粘度、pH理化性质进行了测定,通过红外光谱研究了天然低共熔溶剂的结构和形成机理,利用人工神经网络结合遗传算法优化了最佳提取条件,并评价了花青素提取物的光稳定性、热稳定性和抗氧化活性。结果表明,甜菜碱和乳酸通过氢键相互作用形成的天然低共熔溶剂具有密度低(1.19)、粘度小(24.75 mPa·s)、pH低(2.89)的特点,其最佳提取条件为:以甜菜碱和乳酸制备天然低共熔溶剂,摩尔比1:3,含水量为32%,超声功率124 W,超声时间24 min,初始超声温度32 ℃。在此最佳条件下,花青素的提取率达到23.62 mg/g。与传统溶剂和其它方法相比,本方法绿色高效,操作简单。稳定性和抗氧化实验结果显示,光照会加速提取物中花青素的降解,当温度大于50 ℃时,花青素热降解加速,一级动力学降解常数k>0.0234。当质量浓度为200 μg/mL时,花青素提取物的DPPH自由基清除率和总抗氧化能力分别为62.30%和6.39 mmol/L FeSO4·7H2O当量,且在质量浓度为30 μg/mL时,花青素提取物的ABTS+自由基清除率为85.14%,显著(P<0.05)高于VC,且与浓度呈正比。因此,超声波辅助酸性天然低共熔溶剂法可有效提取黑果腺肋花楸花青素,该法绿色环保,操作简单,为黑果腺肋花楸资源的开发利用提供科学依据。Abstract: A green and efficient ultrasonic-assisted acidic natural deep eutectic solvents for the extraction of anthocyanins from Aronia Melanocarpa was developed. The extraction conditions were optimized by the artificial neural networks and genetic algorithms, and the stability and antioxidant activity of anthocyanins extracts were investigated. A series of acidic natural deep eutectic solvents were prepared using betaine and organic acids as hydrogen bond acceptor and hydrogen bond donor respectively. Their physical and chemical properties such as density, viscosity, pH value were measured. The structure and formation mechanism of natural deep eutectic solvents were studied by infrared spectroscopy. The optimal extraction conditions were optimized by artificial neural network combined with genetic algorithm. The photostability, thermal stability and antioxidant activity of anthocyanins extract were evaluated. The experimental results showed that the natural deep eutectic solvents formed by the hydrogen bond interaction between betaine and lactic acid had the characteristics of density as low as 1.19, viscosity as low as 24.75 mPa·s and pH as 2.89. The optimal extraction conditions were as follows: betaine and lactic acid were used to prepare natural deep eutectic solvents, molar ratio was 1:3, water content was 32%, ultrasonic power was 124 W, ultrasonic time was 24 min and initial ultrasonic temperature was 32 ℃. Under this condition, the anthocyanins extraction yield reached 23.62 mg/g. Compared with traditional solvents and other methods, the method is green, efficient and simple to operate. The results of stability and antioxidant experiments showed that light can accelerate the degradation of anthocyanins in the extract. When the temperature was higher than 50 ℃, the thermal degradation of anthocyanins accelerated with the first-order kinetic degradation constant k>0.0234. When the mass concentration was 200 μg/mL, the DPPH free radical scavenging rate and total antioxidant capacity of anthocyanins extracts were 62.30% and 6.39 mmol/L FeSO4·7H2O equivalent, and at a mass concentration of 30 μg/mL, the ABTS+ free radical scavenging rate of anthocyanins extracts was 85.14%. The antioxidant activity of anthocyanins extracts was significantly (P<0.05) higher than that of VC, and was proportional to the concentration. Therefore, the ultrasonic-assisted acidic natural deep eutectic solvents method can effectively improve the extraction yield of anthocyanins from Aronia Melanocarpa, and provide a scientific basis for the development and utilization of Aronia Melanocarpa resources.
-
黑果腺肋花楸(Aronia melanocarpa)又称野樱莓、不老莓,属于蔷薇科植物,是一种具有药用价值且可食用的小型浆果[1],其果实中含有多酚类化合物、矿物质和维生素等营养成分[2]。其中,多酚类化合物的含量达到2.5%~3.5%,而花青素的含量占多酚类化合物的25%,主要成分为矢车菊素-3-半乳糖苷[3]。目前,花青素已被证实具有抗氧化性[4]、抗菌[5]、抗炎[6]和降血糖[7]等作用,已有学者将黑果腺肋花楸花青素应用于保健品、化妆品和药品中[8]。
目前,花青素提取方法主要有溶剂提取法[9]、微波辅助提取法[10]、超高压辅助提取法[11]以及超声波辅助提取法[12]等。其中,超声波辅助提取法因具有快速、简便、提取时间短等优点而被广泛使用。然而,甲醇、乙醇等有机溶剂常被用作萃取剂,它们具有易燃易爆、可挥发、污染环境及危害人体健康等缺点。此外,由于花青素在pH小于3的条件下最稳定,在其提取和储存过程中常需要加入盐酸或乙酸调节体系pH[13],这不仅使提取过程复杂化,还有可能造成样品污染。因此,建立一种绿色、高效的黑果腺肋花楸花青素的提取方法至关重要。所以,人们提出使用天然低共熔溶剂(Natural deep eutectic solvents,NADES)代替传统有机溶剂作为萃取剂。NADES是由氢键受体(Hydrogen bond acceptor,HBA)和氢键供体(Hydrogen bond donor,HBD)按照一定的摩尔比制备而成的混合物,具有挥发性低、热稳定性高、溶解性好、无毒且价格低廉[14]等优点。此外,还可通过调节HBA和HBD的种类及摩尔比,设计出具有特定理化性质的NADES。据报道,Koca等[15]用氯化胆碱和甘油合成的NADES可有效提取琉璃苣花中的花青素,实验结果表明,所制备的NADES不仅绿色环保,还能提高花青素的生物利用度。Alrugaibah等[16]用基于苹果酸合成的酸性NADES提取蔓越莓中的花青素,其提取效果不仅显著高于有机溶剂,还避免了酸的加入。但到目前为止,还未见到采用酸性NADES提取黑果腺肋花楸花青素的相关报道。
为了获得最高的花青素提取率,统计分析技术被广泛应用于提取条件的预测和优化研究。人工神经网络(Artificial neural network,ANN)是一种模拟人脑的信息处理系统,可以在输入变量和输出变量之间建立有效的非线性映射关系,由于其计算复杂决策过程的能力,在生物学和工程学领域的参数优化方面有较多应用,其中反向传播人工神经网络应用最为广泛[17]。遗传算法(Genetic algorithm,GA)是一种基于自然选择学说和遗传进化原理的全局寻优算法,多与ANN联用[18-19]。ANN-GA在优化提取条件方面,具有预测精度高,优化效果好等特点。相较于传统的正交试验法和响应面分析法等,ANN-GA能全面考察不同因素之间的相互影响,且所需实验次数少,能减少提取溶剂的使用,符合绿色化学理念。
鉴于此,本研究以甜菜碱为HBA,以有机酸为HAD,设计一系列酸性NADES,采用超声波辅助酸性NADES提取法提取黑果腺肋花楸花青素,对NADES的理化性质、结构和形成机理进行研究,在单因素实验的基础上,利用人工神经网络结合遗传算法优化最佳提取条件,并考察花青素提取物的光稳定性、热稳定性和抗氧化活性,旨在扩展黑果腺肋花楸资源的开发利用,为花青素提取物的应用研究提供数据和理论支持。
1. 材料与方法
1.1 材料与仪器
黑果腺肋花楸冻果 吉林省润泰农林科技开发有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、2,3,5-氯化三苯基四氮唑(TPTZ) 上海市阿拉丁试剂有限公司;DL-苹果酸、乳酸 天津市光复精细化工研究所;无水甜菜碱、甘油 上海市麦克林生化科技有限公司;其它试剂均为分析纯 北京化工厂。
H2050R型高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;XW-80型旋涡混合器 上海青浦泸西仪器厂;KQ5200DE型数控超声波清洗器 昆山市超声仪器有限公司;FW177型中草药粉碎机 天津市泰斯特仪器有限公司;DF-101S型磁力搅拌器 金坛市科仪仪器有限公司;UV-5500PC型紫外可见光分光度计 上海元析仪器有限公司;Nicolet IS50型傅立叶变换红外色谱仪 美国赛默飞世尔科技有限公司;PHS-3E型pH计 上海仪电科学仪器股份有限公司;DV-III型粘度计 美国博勒飞有限公司;YT-120G型密度测试仪 中国厦门亿恩达科技有限公司;LGJ-10型真空冷冻干燥机 北京松源华兴科技发展有限公司。
1.2 实验方法
1.2.1 NADES的制备及理化性质
由于甜菜碱成本低、无毒且可生物降解,因此选择中性分子甜菜碱作为HBA,与不同种类的有机酸基、醇基和糖基HBD按照一定摩尔比准确称量于锥形瓶中,在80 ℃水浴下进行磁力搅拌,直至形成均匀透明的无色液体,密封后至于室温下保存备用。HBA和HBD的种类及摩尔比如表1所示,其中NADES-1~NADES-3为基于有机酸的酸性NADES,以甘油和葡萄糖为代表的醇基和糖基作为HBD合成的NADES-4~NADES-6为对照组NADES。
表 1 NADES的理化性质Table 1. Physicochemical properties of NADES样品 组成 摩尔比 密度 pH
(30%含水量)粘度(30%
含水量)
(mPa·s)NADES-1 甜菜碱:乳酸 1:3 1.19 2.89 24.75 NADES-2 甜菜碱:柠檬酸:水 1:1:2 1.47 2.57 46.00 NADES-3 甜菜碱:苹果酸:水 1:1:1 1.38 2.88 47.25 NADES-4 乳酸:甘油 1:2 1.33 1.67 27.00 NADES-5 甜菜碱:甘油 1:2 1.27 6.86 36.25 NADES-6 甜菜碱:葡萄糖:水 1:1:1 1.27 6.23 65.25 为了深入了解NADES的理化性质,测定了含水量为30%(质量分数)时6种NADES的pH、粘度和密度。使用PHS-3E pH计在室温25 ℃下测定NADES的pH。使用DV-III粘度计,选择SC4-18转子,转速设为15 r/min,在25 ℃下测定NADES的粘度。密度是通过密度测试仪在25 ℃下测定。
1.2.2 样品前处理
选取无腐烂、颗粒饱满的黑果腺肋花楸冻果,去掉桔梗后,在室温下解冻、打浆,所得的果浆进行真空冷冻干燥,随后粉碎成颗粒小于0.45 mm的细粉,再用铝箔纸包裹后放干燥器中4 ℃避光保存备用。
1.2.3 超声波辅助酸性天然低共熔溶剂提取花青素
精确称取0.1 g黑果腺肋花楸粉末于10 mL离心管中,加入5 mL含水量为32%的NADES溶液。将混合物涡旋8 s后,在32 ℃、124 W的条件下超声提取32 min,然后在10000 r/min下离心10 min,取上清液,得到花青素提取物。
1.2.4 NADES的选择
NADES作为提取溶剂,按照1.2.3方法提取黑果腺肋花楸花青素,以提取率为指标,选择最佳的NADES。
1.2.5 NADES的傅里叶红外变换光谱分析
采用傅里叶红外光谱仪对HBA、HBD以及合成的NADES进行红外光谱分析,其扫描范围为500~4000 cm−1,每个样本扫描32次。
1.2.6 单因素实验
以最佳NADES为提取溶剂,分别考察NADES的摩尔比(1:1、1:2、1:3、1:4、1:5)、NADES的含水量(20%、25%、30%、35%、40%)、超声功率(100、120、140、160、180 W)、超声时间(10、20、30、40、50 min)和初始超声温度(25、30、40、50、60 ℃)对花青素提取率的影响。
1.2.7 ANN-GA优化提取条件
1.2.7.1 建立人工神经网络模型
使用Matlab软件构建一个3层前馈误差反向传播人工神经网络。其中输入层为4个神经元,分别代表NADES的含水量、超声功率、超声时间和初始超声温度。输出层为1个神经元,代表花青素提取率。隐藏层的神经元数量采用试错法确定,即从3~25由少至多逐个尝试的方法寻找最佳隐藏层神经元数量。建模数据来自于单因素实验,将实验样本随机分为3个数据集,70%用于训练,15%用于验证,15%用于测试。ANN的隐藏层采用Sigmoid非线性传递函数作为核函数,输出层采用Pureline线性传递函数作为核函数,并使用Levenberg-Marquardt训练算法。最终以所建模型得到的最小均方误差(MSE)和最大回归相关系数(R)作为指标确定隐藏层中神经元的数量。
1.2.7.2 遗传算法优化提取条件
用Matlab中的遗传算法工具箱求取模型最优解,种群数量设置为80,传代次数为20,交叉率和变异率分别为0.3和0.1。将训练好的神经网络模型作为遗传算法的适应度函数,以提取率最大化作为优化目标进行全局寻优。
1.2.8 提取方法比较
1.2.8.1 不同提取溶剂的比较
将纯水、70%甲醇、70%乙醇和80%溴化-1-丁基-3-甲基咪唑([BMIM]Br)的乙醇溶液作为提取溶剂,按照1.2.3节操作提取花青素。
1.2.8.2 超声辅助乙醇提取法
参考黄泰曾[12]的提取方法。精确称取0.1 g黑果腺肋花楸粉末于10 mL离心管中,按照1:50 g/mL的固液比加入5 mL含有0.9%盐酸的80%乙醇溶液。将混合物涡旋8 s后,在45 ℃,80 W的条件下超声提取30 min,然后在10000 r/min下离心10 min,取上清液,得到花青素提取液。
1.2.8.3 酸性乙醇浸提法
参考国石磊[9]的提取方法。精确称取0.1 g黑果腺肋花楸粉末于10 mL离心管中,按照1:45 g/mL的固液比加入4.5 mL含有0.5%乙酸的40%乙醇溶液。将混合物涡旋8 s后,在46 ℃的水浴条件下提取112 min,然后在10000 r/min下离心10 min,取上清液,得到花青素提取液。
1.2.9 花青素含量的测定
采用修改后的pH示差法[20]测定花青素含量。取2份1 mL花青素提取液,一份用pH为1.0的KCl-HCl缓冲溶液稀释至10 mL,另一份用2 mol/L NaOH溶液和pH为4.5的HAC-NaAC缓冲溶液调节提取液pH为4.5并稀释至10 mL,混匀后,室温下避光平衡30 min,然后在8000 r/min下离心5 min,所得上清液在510和700 nm处测定吸光度。按公式(1)、(2)计算花青素提取率,花青素提取率以黑果腺肋花楸粉末中含有的矢车菊素-3-葡萄糖苷当量(mg Cy-3-glu/g DW)来表示。
花青素提取率(mg/g)=ΔA×Mω×n×Vε×m (1) ΔA=(A510−A700)pH1.0−(A510−A700)pH4.5 (2) 式中,Mω为矢车菊素-3-葡萄糖苷的相对分子质量,449.2 g/mol;n为稀释倍数;V为提取液总体积,mL;ε为矢车菊素-3-葡萄糖苷的消光系数,26900;m为黑果腺肋花楸粉末质量,g。
1.2.10 花青素提取物的稳定性
1.2.10.1 光照对花青素稳定性的影响
在25 ℃下,将花青素提取液分别于避光和室内日光灯(约5000 Lux)条件下放置一段时间,每隔12 h取样测定花青素含量,按公式(3)计算花青素保留率[11]:
花青素保留率(%)=A0A1×100 (3) 式中,A0为处理后花青素提取率;A1为处理前花青素提取率。
1.2.10.2 温度对花青素稳定性的影响
将15 mL花青素提取液分别在4、30、50、70、90 ℃的水浴条件下避光放置一段时间,每隔1 h取样,冷却后测定花青素含量。花青素的降解遵循一级动力学模型,通过计算一级反应速率常数(k)和半衰期(t1/2)来确定花青素在NADES体系中的降解动力学[14]。计算公式如下
ln(CtC0)=−kt (4) t1/2=ln2k (5) 式中,k为反应速率常数;C0为初始浓度,mg/g;Ct为在给定温度下加热时间(t)后的浓度,mg/g;t1/2为反应的半衰期,h。
1.2.11 花青素提取物的抗氧化性
1.2.11.1 DPPH对自由基的清除能力
参考Pan等[21]方法并稍作修改。首先,在0.1 mL不同浓度(20、40、80、120、160、200 μg/mL)的花青素提取液中分别加入3.9 mL 0.1 mmol/L的DPPH溶液,混匀后,避光静置30 min,测定反应溶液在517 nm处的吸光值,并以抗坏血酸(VC)为阳性对照。
DPPH 自由基清除率(%)=(A0−A1)A0×100 (6) 式中,A0为对照组吸光值,A1为样品组吸光值。
1.2.11.2 ABTS+对自由基清除能力
参考Lm等[22]方法并稍作修改。首先,将ABTS溶液(7.4 mmol/L)与过硫酸钾溶液(2.6 mmol/L)按照1:1的体积比混合后,避光反应12 h制得ABTS储备液。再用磷酸盐缓冲溶液(200 mmol/L,pH7.4)调节ABTS储备液的浓度,使其在734 nm处的吸光值为0.700±0.02。然后,取0.05 mL不同浓度的花青素提取液分别加入4 mL ABTS工作液,混匀后,室温避光反应6 min,在734 nm处测定吸光值,并以VC为阳性对照。
ABTS+自由基清除率(%)=(A0−A1)A0×100 (7) 式中,A0为对照组吸光值,A1为样品组吸光值。
1.2.11.3 总抗氧化能力
参考国石磊[9]和Pan等[21]方法并稍作修改。首先,由醋酸缓冲液(300 mmol/L)、氯化三铁溶液(20 mmol/L)和TPTZ溶液(10 mmol/L TPTZ 溶解于40 mmol/L HCl)按照10:1:1的体积比混合制备FRAP工作液。再取0.1 mL不同浓度的硫酸亚铁溶液(0.3~2.1 mmol/L),分别加入5 mL FRAP工作液,混匀后,置于37 ℃下避光反应8 min,在593 nm处测定各吸光值,绘制标准曲线。花青素提取液按照相同方法测定吸光值,其抗氧化能力基于线性标准曲线换算的FeSO4·7H2O当量表示样品的抗氧化能力,即1FRAP单位=1 mmol/L FeSO4·7H2O,并以VC作为阳性对照。
1.3 数据处理
所有实验均重复三次,采用Microsoft office excel 2019和Origin 2021软件进行数据处理分析,采用IBM SPSS Statistics 23软件对数据进行显著性差异分析,通过Matlab Math Works R2021a软件预测和优化提取条件。
2. 结果与分析
2.1 NADES的理化性质
NADES的结构决定了其理化性质,在萃取过程中对生物活性物质的提取效率和稳定性有重要影响。从表1可以看出,NADES的密度均大于水,且不同类型NADES的密度有所差异,这归因于形成不同的NADES的原料有不同的分子组织和堆积方式[23]。理论上,NADES粘度越小,密度越低,越有利于固液分离。此外,从表1中可发现采用有机酸制备的NADES比甘油和糖制备的NADES具有更低的pH,其pH小于3。而且,以葡萄糖制备的NADES粘度最大,采用乳酸和甘油制备的NADES粘度较小,分别为24.75和27.00 mPa·s。这可能与制备NADES所用的HAB和HBD的理化性质、分子量、浓度和碳链长度有关[24],HAB和HBD结构越简单,碳链越短,NADES粘度越小。然而,NADES-3粘度却略高于NADES-2,这可能与溶剂制备过程中向NADES-2中添加了更高比例的水有关,从而降低了物质的浓度以及NADES的粘度。
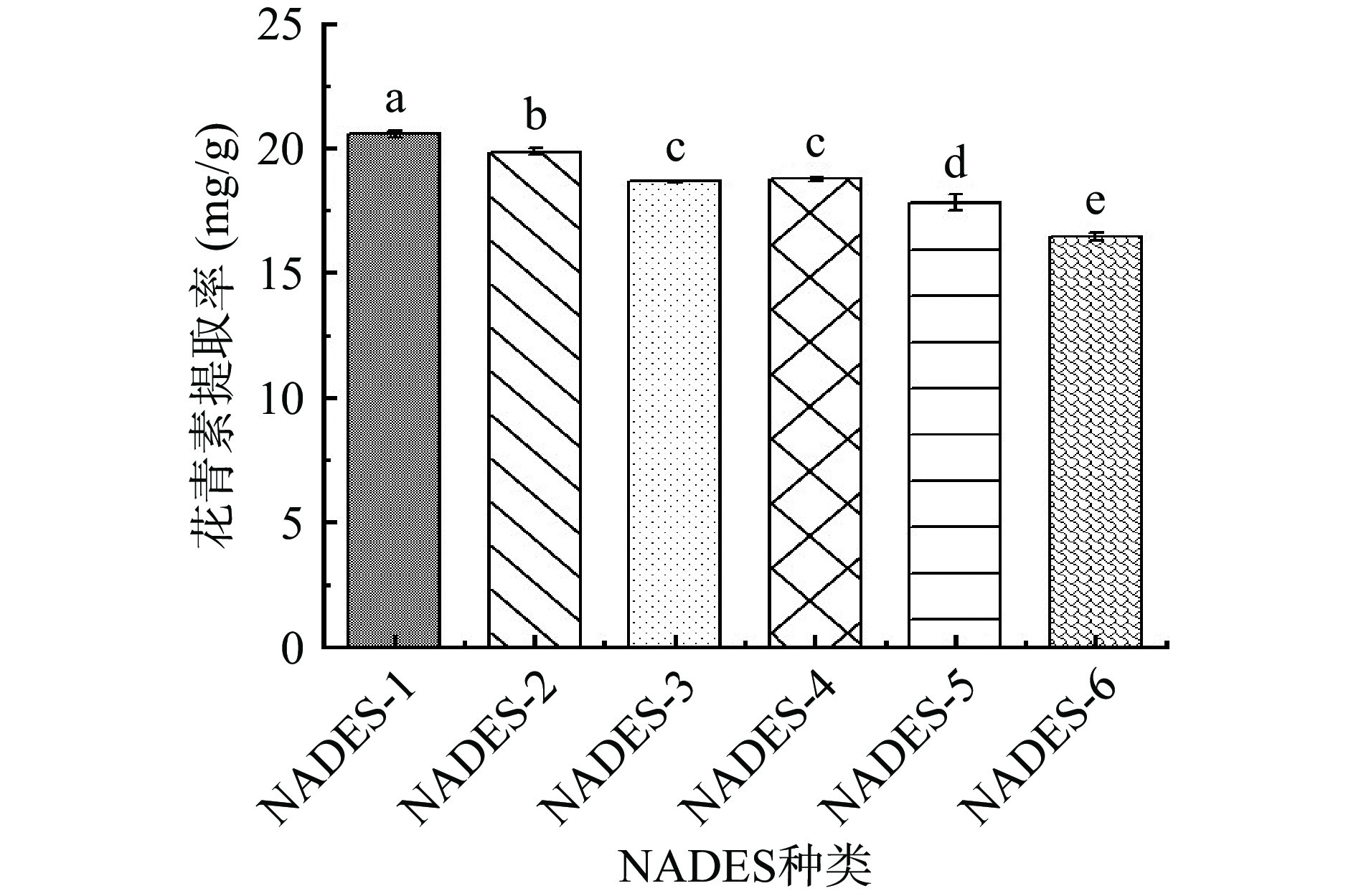
2.2 NADES的选择
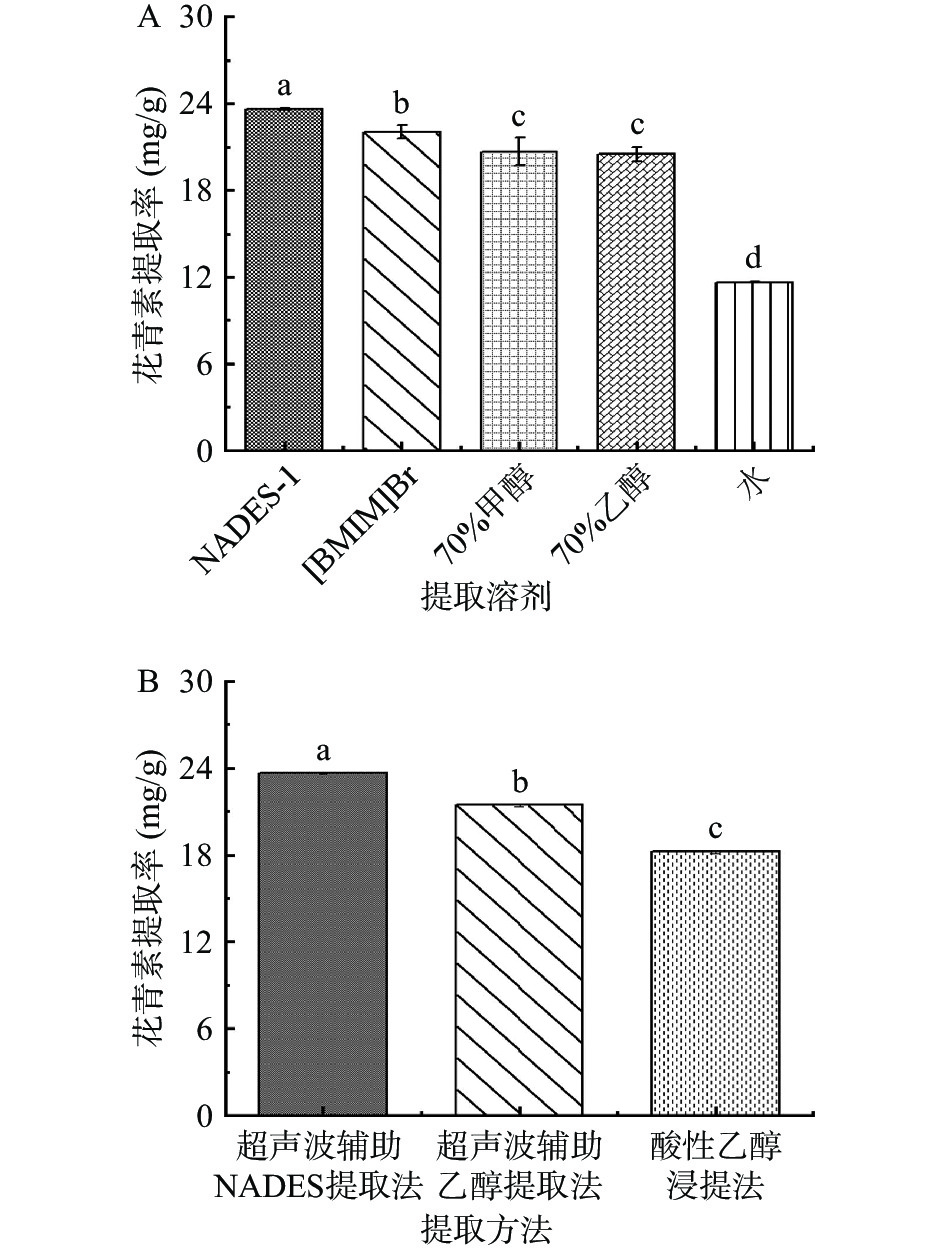
本研究考察了不同种类NADES对花青素提取率的影响。由图1可知,采用有机酸制备的NADES对花青素的提取率高于糖和醇制备的NADES。一方面,因为基于有机酸的NADES酸性强(pH<3),能提供给花青素更稳定的环境,另一方面,由于多羧酸可以增强NADES组分之间的氢键相互作用,从而提高提取率[13]。然而,NADES-2和NADES-3的粘度分别为46.00和47.25 mPa·s,高于其它有机酸基NADES,这不利于目标分析物的传质和转移。NADES-1和NADES-4的pH分别为2.89和1.67,当溶液pH小于3时,有利于花青素的稳定和提取,且两者粘度接近,但NADES-4的提取率略低于NADES-1,主要是因为在提取过程中,花青素被视为HBD,NADES-1中的甜菜碱和乳酸都含有羧基可作为HBA与花青素相互作用。而NADES-4中的甘油会和花青素竞争性地与乳酸的阴离子O−相互作用,且甘油的羟基分支可能会导致相当大的空间位阻,阻止花青素与乳酸之间的相互作用[25-26]。当NADES-1被用作提取溶剂时,可有效避免添加额外酸来调节体系pH,简化了实验操作,而且有利于花青素的提取和稳定,其花青素提取率高达20.56 mg/g,显著高于其他NADES。因此,本研究选择甜菜碱和乳酸制备的NADES作为提取溶剂进行后续实验。
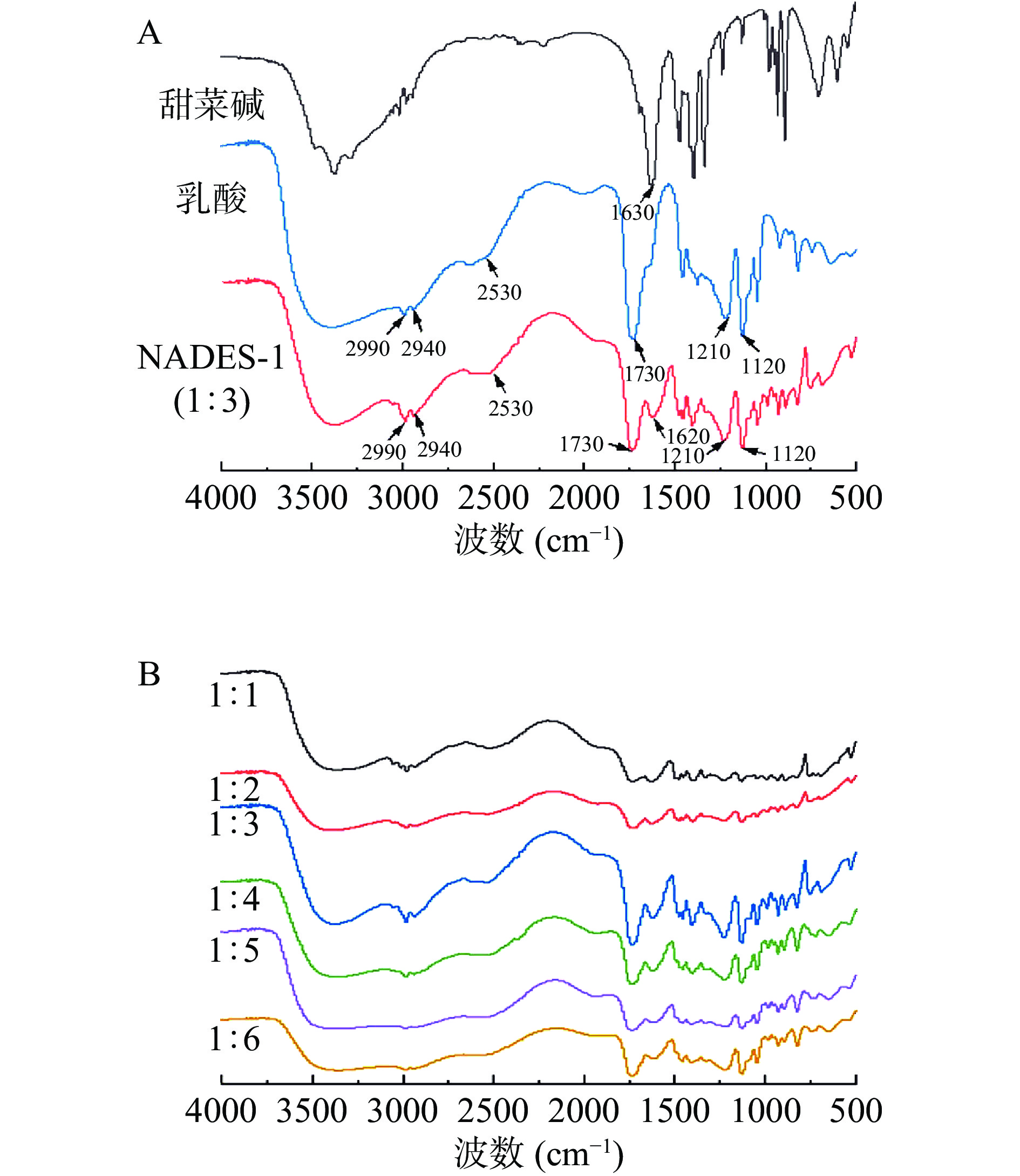
2.3 NADES的傅里叶红外变换光谱分析
为了探讨NADES的结构和形成机理,研究分析了不同摩尔比合成的NADES的红外光谱图。从图2A中可以看出,3500~3300 cm−1区域的红外谱带与OH基团的拉伸振动有关[27]。乳酸和NADES-1在2990和2940 cm−1处都有一个典型的双峰,代表C-H拉伸振动,且1300~1000 cm−1区域与C-O-C拉伸有关,特别是1210和1120 cm−1处的两个峰是由与不对称-CH3摇摆振动有关的C-O-C不对称振动引起的[28]。同时,乳酸和NADES-1在2530(O-H)、1730(C=O)、1210(C-O)cm−1处有相同的特征吸收峰,且在甜菜碱与乳酸相互作用合成NADES-1的过程中,由于氢键相互作用,甜菜碱中-COO的拉伸振动从1630 cm−1移动到1620 cm−1。此外,从图2B中可以看出,甜菜碱和乳酸以不同摩尔比合成的NADES-1的红外光谱均具有以上特征。因此,这证明甜菜碱和乳酸通过氢键相互作用制备了NADES-1。
2.4 单因素实验
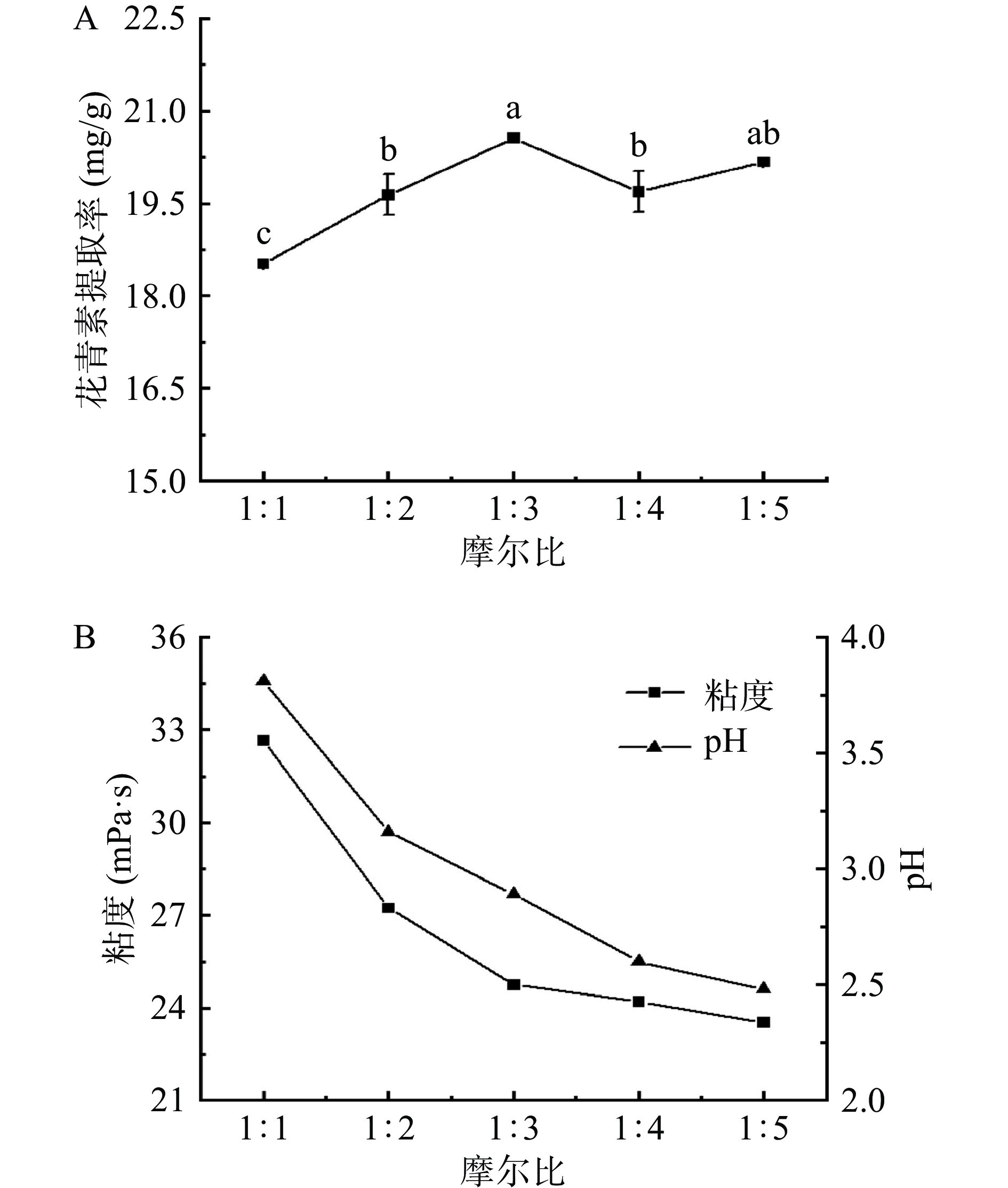
2.4.1 NADES的摩尔比
本研究考察了摩尔比为1:1、1:2、1:3、1:4和1:5时对花青素提取率的影响。如图3所示,当甜菜碱和乳酸的摩尔比从1:1增加到1:3时,花青素的提取率逐渐增高。这是因为随着乳酸含量的增加,NADES-1的粘度以及酸度降低,增强了花青素的传质效率及稳定性[29]。当摩尔比达到1:4时,花青素提取率开始下降。这可能是因为随着甜菜碱的浓度不断降低,使甜菜碱与花青素之间的氢键数量不断减少,从而导致提取率降低[29]。因此,甜菜碱和乳酸的最佳摩尔比为1:3。
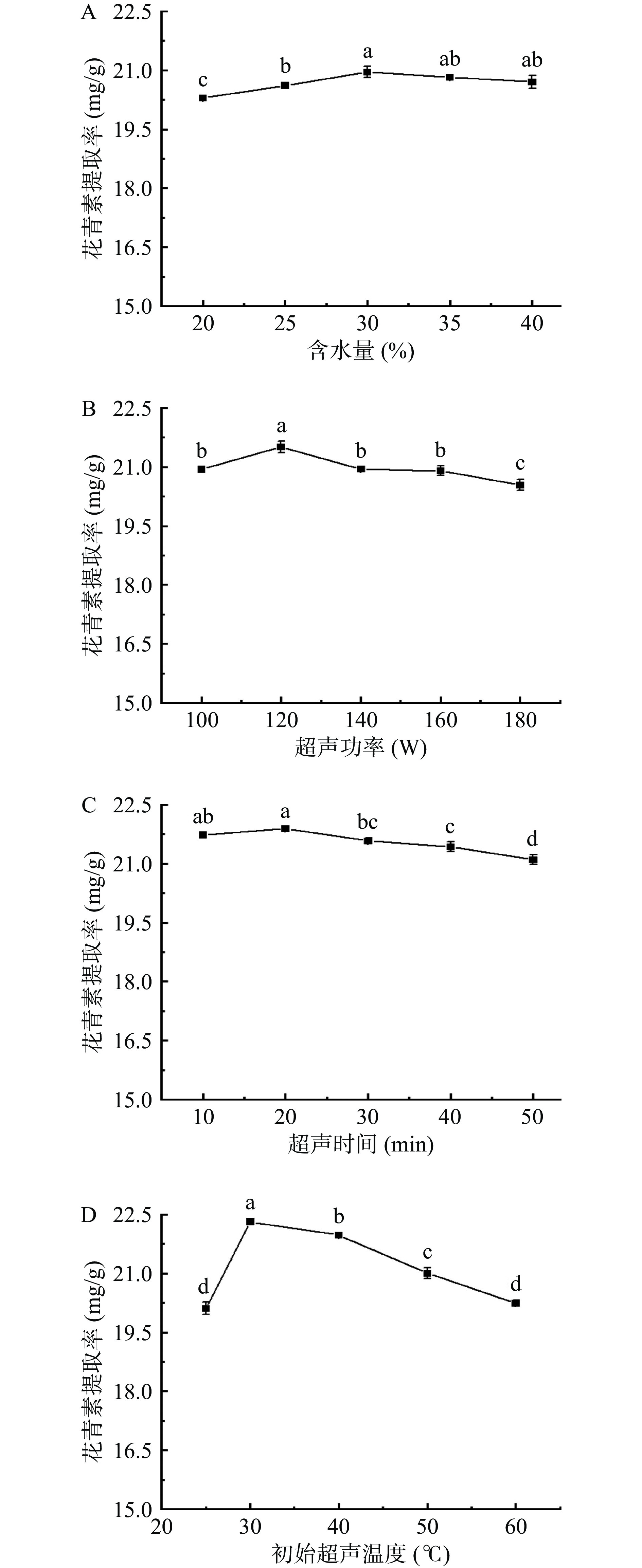
2.4.2 NADES的含水量
由于NADES粘度普遍较大,在实验过程中,需添加适量的水来降低粘度,以提高传质速率。本研究考察了不同含水量(20%、25%、30%、35%和40%)的NADES-1对花青素提取率的影响。如图4A所示,当含水量为30%时,花青素提取率最高。这是由于加入一定比例水的NADES其结构变化较小,同时其粘度降低、极性增强[30]。而当含水量过高时,水会削弱HBA和HBD之间的氢键相互作用,进而破坏NADES的超分子结构,使NADES与花青素之间的氢键相互作用减弱,导致提取率下降[31]。因此,NADES-1的最佳含水量为30%。
2.4.3 超声功率
本研究考察了超声功率为100、120、140、160及180 W时对花青素提取率的影响。由图4B可知,超声功率从100 W增加到120 W时,花青素提取率不断提高,而当超声功率继续增加后,提取率反而不断下降。这是由于高功率的超声会产生过多的热量,导致花青素发生热降解[32]。因此,选择120 W超声功率进行后续试验。
2.4.4 超声时间
本研究考察了不同超声时间(10、20、30、40和50 min)对提取率的影响。由图4C可知,超声时间为20 min时,花青素提取率最高,但随着超声时间的不断延长,提取率下降。这可能是由于短时间的超声即可实现细胞壁的完全破坏,使花青素溶出,提取率升高[33]。然而,随着超声时间的不断增加,由于超声空穴效应和机械效应,会使超声水池温度略有升高,在长时间光照、氧气和温度的综合作用下,花青素会发生氧化降解[34]。因此,选择超声时间为20 min进行后续试验。
2.4.5 初始超声温度
温度对花青素的提取具有重要影响,本研究考察了不同初始超声温度(25、30、40、50、60 ℃)下花青素提取率的变化。如图4D所示,当温度升高至30 ℃时,花青素提取率达到最高。这是因为高温可以减弱酚类化合物与样品基质之间的物理吸附和化学相互作用强度,使得酚类化合物易于从样品基质中解吸下来,从而提高酚类化合物在提取溶剂中的溶解能力[29]。同时,升高温度可以降低NADES的粘度,增加花青素传质效率。然而,随着温度进一步升高,花青素提取率逐渐降低,这是因为花青素在高温下发生了热降解反应[10]。因此,选择初始超声温度为30 ℃进行后续试验。
2.5 ANN-GA优化提取条件
2.5.1 人工神经网络的构建
20组单因素实验数据按70%(14)、15%(3)和15%(3)的比例分别对ANN进行训练、验证和测试。经过训练发现,当隐藏层神经元个数为14时,ANN获得最小的MSE和最大的R值,因此,最终ANN的拓扑结构为4-14-1。训练后ANN的权重和偏置矩阵公式(8)~(11)如下所示,w1代表输入层与隐藏层之间的连接权重,b1代表隐落层神经元的偏置值,w2代表隐藏层与输出层之间的连接权重,b2代表输出层神经元的偏置值,权重和偏置矩阵作为模型参数用于对输入数据预测其输出。
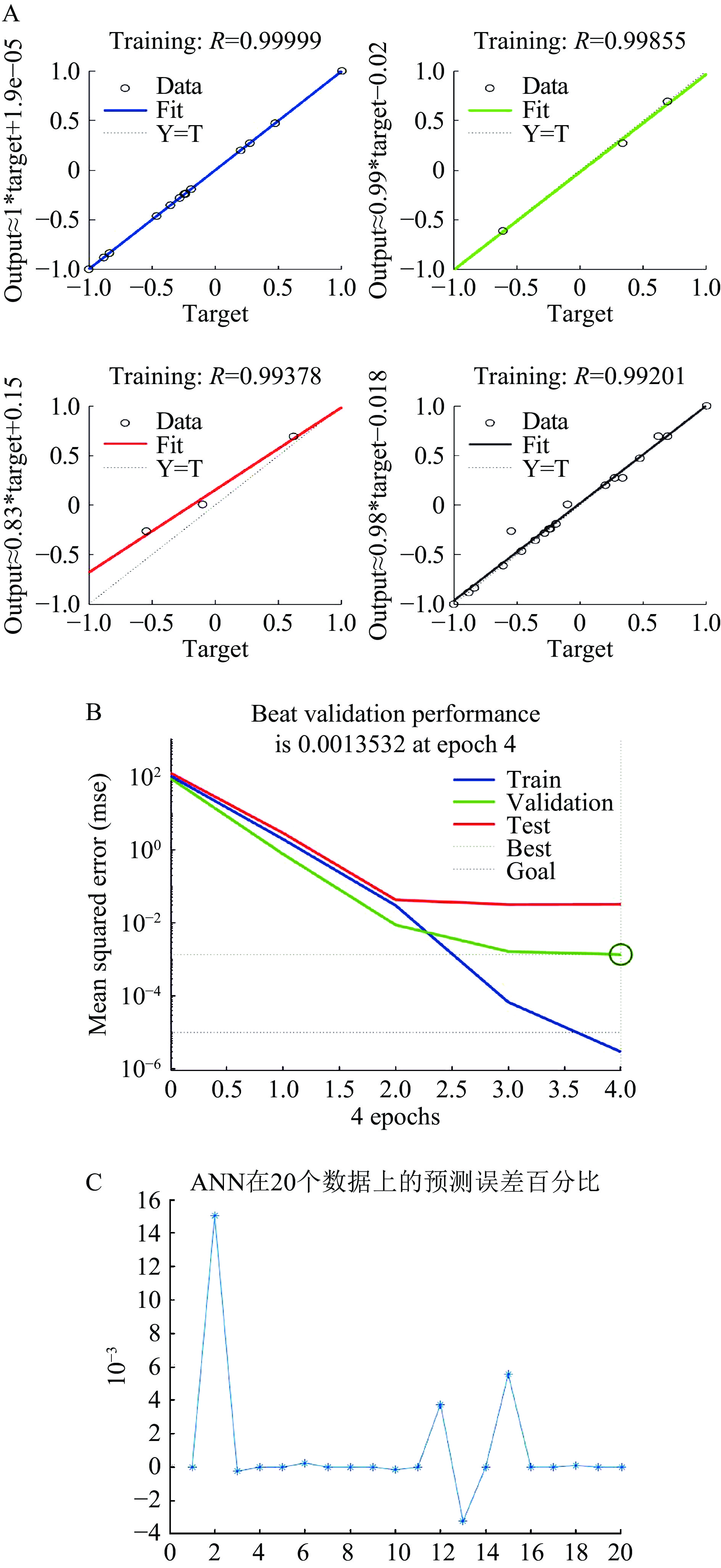
ANN在训练集、验证集和测试集的相关系数r分别为0.99999、0.99855和0.99378,在总数据集的相关系数r为0.99201,如图5A所示,所有r值均趋近于1,表明本研究开发的ANN模型在预测不同输入的响应值方面具有良好的可靠性。由图5B可知,ANN在epoch为4时获得最小的MSE,其在验证集和总数据集的均方差MSE分别为0.0013532和0.0060738,表明ANN模型达到了最佳的预测性能。图5C是ANN在20个数据上的预测值与实际值之间的误差百分比图,可以直观反应ANN的预测误差,由图可知本研究构建的ANN模型误差小,准确度高,可以如实反应不同因素间相互作用对结果的影响。
w1=[0.5806−0.29841.5898−1.0323−2.0993−2.7093−2.5147−1.7181−0.17430.19442.22412.3564−2.4829−1.36900.8864−1.3304−2.1669−0.85052.2246−2.20741.45340.46901.28992.0781−1.75252.9558−2.9435−2.64950.8868−1.25371.1511−0.7920−1.56502.2058−2.42732.34260.4182−1.49672.8641−2.6453−0.84420.4070−1.21560.18912.51201.59192.7965−2.71921.08522.0985−1.3772−0.60572.46330.52111.7280−2.0516] (8) b1=[ 2.3490−0.2852−2.7654−0.0746 0.0158 2.3001−1.5544 1.6191 1.7028−1.6504 2.9887 2.1508−2.4229−1.4906] (9) w2=[ 0.4571 1.2907−1.0343 1.5142−2.1635 2.8276 1.0566−0.4108 0.8849−1.5782 2.1085 1.0469−1.7158 0.4861] (10) b2=[1.0019] (11) 2.5.2 遗传算法优化提取条件
GA算法是一种遗传进化算法,其初始种群数量代表解决方案的数量,每个解决方案都是独立的,被表示为一条染色体,每个染色体上包含一组定义个体特征的基因。在本研究中,4个参数条件就是一条染色体上的4个基因,它们通过选择、交叉和变异产生新的染色体,直到找到最好的解决方案。ANN-GA运行结果显示,花青素最大提取率为23.75 mg/g,对应的最佳提取条件是NADES的含水量为32%,超声功率为124 W,超声时间为24 min,初始超声温度为32 ℃。以该实验条件进行验证实验,得到花青素实际提取率为23.62 mg/g,相对误差为0.55%。由此证明了ANN-GA在拟合实验参数和优化实验条件方面具有可靠性。
2.6 提取方法比较
为了评价NADES-1的提取性能,在相同提取条件下,研究了70%甲醇、70%乙醇、水、离子液体作为提取溶剂时的花青素提取率。结果如图6A所示,NADES-1作为提取溶剂所获得的花青素提取率最高。且NADES-1安全性高、挥发性低,不会危害环境和人体健康。同时,为了更好的评价本研究所建立的超声波辅助天然低共熔溶剂提取法,将本方法与文献报道的其他常用黑果腺肋花楸花青素提取法,如超声波辅助乙醇提取法和酸性乙醇浸提法进行比较。结果由图6B可知,本方法提取率高,提取时间短,仅为24 min,而其他两种方法提取时间分别长达30和112 min。其中超声波辅助乙醇提取法的提取率低于本方法,一方面与提取溶剂的性质有关,NADES中的HBA和HBD可以在NADES分子和花青素之间形成氢键,从而增强花青素的溶解能力。另一方面是超声波辅助NADES提取法的超声功率更高,因为从理论上讲,更高的超声功率会导致更剧烈的空化气泡破裂,产生更大的气泡,从而引发更高的剪切力,进而促进花青素提取[35]。此外,当以酸性NADES-1作为提取溶剂,使得后续实验无需调节溶液的pH,可避免盐酸、乙酸的加入,简化了实验操作。
2.7 花青素提取物的光稳定性和热稳定性
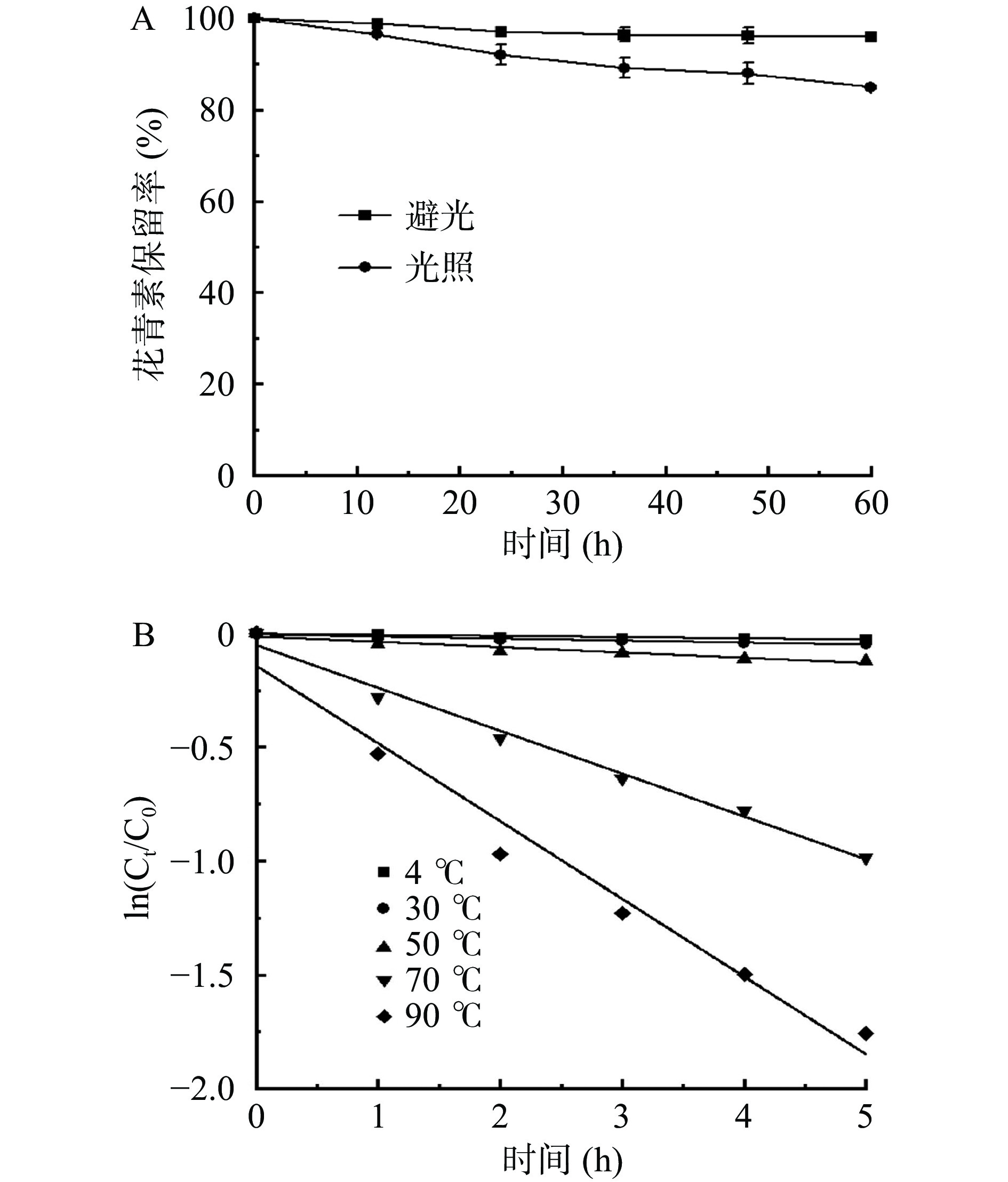
从图7A可以看出,在不同光照条件下,花青素的含量随着光照时间的增加逐渐减少,但总体而言,避光条件下花青素的降解速度比光照下花青素的降解速度慢。在避光和光照处理60 h后,花青素的保留率分别为95.90%和84.89%。这是由于光照会引发单重态或三重态花青素发生一系列自由基反应,导致花青素降解[36]。因此花青素在保存过程中需要避免光照。
黑果腺肋花楸花青素的温度降解过程符合一级反应。由图7B和表2可知,随着温度的升高,花青素的降解速率常数k增大,半衰期减小,说明花青素的降解是吸热反应,高温则加速降解,特别是当温度超过50 ℃时,降解速率开始加快。这是由于花青素的母体结构受热生成无色查尔酮式,造成花青素降解[37]。Condurache等[38]做了相关研究,发现茄子皮花青素在80和90 ℃热处理后的t1/2分别为1.56和1.46 h,低于黑果腺肋花楸花青素,且BI等[39]发现在70 ℃下桑葚花青素在酸性乙醇和NADES中的t1/2分别为1.96和3.12 h,也低于本研究报道的数值。但栾琳琳[40]考察了桑葚花青素的储存稳定性,发现其在4 ℃下的t1/2约为60 d,而黑果腺肋花楸花青素在此条件下的t1/2仅为130.78 h。由此说明花青素对高温敏感,在保存过程中温度应低于50 ℃,且在后续花青素的应用研究中,如何提高花青素的稳定性是也研究的一部分内容。
表 2 不同温度条件下黑果腺肋花楸花青素降解的一级动力学参数Table 2. First order kinetic parameters of anthocyanins degradation of Aronia melanocarpa under different temperatures温度(℃) 回归方程 速率常数k R2 t1/2(h) 4 ln(Ct/C0)=−0.0053t−0.0024 0.0053 0.9083 130.78 30 ln(Ct/C0)=−0.0089t−0.0066 0.0089 0.9322 77.88 50 ln(Ct/C0)=−0.0234t−0.0156 0.0234 0.9369 29.62 70 ln(Ct/C0)=−0.1881t−0.0529 0.1881 0.9895 3.68 90 ln(Ct/C0)=−0.3412t−0.1431 0.3412 0.9734 2.03 2.8 花青素提取物的抗氧化活性
以VC为阳性对照,评估了花青素提取物DPPH自由基清除能力、ABTS+自由基清除能力和总抗氧化能力。从图8中看出,花青素和VC的抗氧化能力与浓度呈正比关系,且花青素的抗氧化能力比VC强。当质量浓度为200 μg/mL时,花青素和VC的DPPH自由基清除能力分别为62.30%和54.00%。在30 μg/mL时,花青素的ABTS+自由基清除能力为85.14%,是VC的3.3倍。同时,在质量浓度为200 μg/mL时,花青素和VC的总抗氧化能力分别为6.39和2.86 mmol/L FeSO4·7H2O当量,即花青素的总氧化能力是VC的2.23倍,而位璐璐等[41]研究发现以乙醇作为萃取剂提取的黑果腺肋花楸花青素提取物的ABTS+自由基清除率和总抗氧化能力分别是VC的2倍和4倍,这与前人的研究结果一致。导致花青素提取物抗氧化能力不同原因,一方面可能是由于不同溶剂提取的花青素组分不同,而且各个花青素单体的抗氧化能力不同,另一方面可能是因为有机溶剂同时提取黑果腺肋花楸中的多酚类等其他抗氧化成分[9,42]。总而言之,NADES-1作为提取溶剂提取的花青素具有强抗氧化活性。
3. 结论
本研究建立了一种绿色、简便、高效的超声波辅助酸性NADES提取法用于提取黑果腺肋花楸中的花青素。该方法以甜菜碱和乳酸为原料,根据氢键相互作用合成的酸性NADES作为提取溶剂,这不仅绿色安全,还避免了盐酸、乙酸的加入,简化了实验操作。此外,利用单因素实验和ANN-GA优化提取条件,在最优条件下,该方法的花青素提取率达到23.62 mg/g。与传统提取方法相比,本方法的提取时间短,提取率高,这极大的扩展了黑果腺肋花楸资源的开发利用。同时,研究发现花青素在温度超过50 ℃环境下,降解速率加快,且具有比VC更强抗氧化能力,这为后续黑果腺肋花楸花青素提取物的应用提供了数据支撑和理论基础,但在未来花青素应用中如何提高花青素的稳定性也是我们需要解决的问题。
-
表 1 NADES的理化性质
Table 1 Physicochemical properties of NADES
样品 组成 摩尔比 密度 pH
(30%含水量)粘度(30%
含水量)
(mPa·s)NADES-1 甜菜碱:乳酸 1:3 1.19 2.89 24.75 NADES-2 甜菜碱:柠檬酸:水 1:1:2 1.47 2.57 46.00 NADES-3 甜菜碱:苹果酸:水 1:1:1 1.38 2.88 47.25 NADES-4 乳酸:甘油 1:2 1.33 1.67 27.00 NADES-5 甜菜碱:甘油 1:2 1.27 6.86 36.25 NADES-6 甜菜碱:葡萄糖:水 1:1:1 1.27 6.23 65.25 表 2 不同温度条件下黑果腺肋花楸花青素降解的一级动力学参数
Table 2 First order kinetic parameters of anthocyanins degradation of Aronia melanocarpa under different temperatures
温度(℃) 回归方程 速率常数k R2 t1/2(h) 4 ln(Ct/C0)=−0.0053t−0.0024 0.0053 0.9083 130.78 30 ln(Ct/C0)=−0.0089t−0.0066 0.0089 0.9322 77.88 50 ln(Ct/C0)=−0.0234t−0.0156 0.0234 0.9369 29.62 70 ln(Ct/C0)=−0.1881t−0.0529 0.1881 0.9895 3.68 90 ln(Ct/C0)=−0.3412t−0.1431 0.3412 0.9734 2.03 -
[1] 孙智谋, 张佳霖, 周旭. 黑果腺肋花楸多酚类物质抗氧化功效的研究进展[J]. 食品工业科技,2017,38(9):396−400. [SUN Z M, ZHANG J L, ZHOU X. Progress of antioxidant activity for polyphenols in Aronia melanocarpa[J]. Science and Technology of Food Industry,2017,38(9):396−400. doi: 10.13386/j.issn1002-0306.2017.09.068 [2] 王申萌, 管清杰, 张廷秀, 等. 黑果腺肋花楸果实的功能活性物质及产品开发进展[J]. 食品科技,2021,46(5):64−69. [WANG S M, GUAN Q J, ZHANG T X, et al. Progress in the development of functional active substances and products of Aronia Melanocarpa[J]. Food Science and Technology,2021,46(5):64−69. doi: 10.13684/j.cnki.spkj.2021.05.011 [3] 仇洋. 黑果腺肋花楸多酚的提取纯化及活性研究[D]. 长春: 吉林大学, 2017. CHOU Y. Research on extraction purification and activity of polyphenol from Aronia melanocarpa[D]. Changchun: Jilin University, 2017.
[4] YOUSUF B, GUL K, WANI A A, et al. Health benefits of anthocyanins and their encapsulation for potential use in food systems: A review[J]. Critical Reviews in Food Science and Nutrition , 2016, 56(13): 2223-2230.
[5] DENEV P, CIZ M, KRATCHANOVA M, et al. Black chokeberry (Aronia melanocarpa) polyphenols reveal different antioxidant, antimicrobial and neutrophil-modulating activities[J]. Food Chemistry,2019,284:108−117. doi: 10.1016/j.foodchem.2019.01.108
[6] BADESCU M, BADULESCU O, BADESCU L, et al. Effects of Sambucus nigra and Aronia melanocarpa extracts on immune system disorders within diabetes mellitus[J]. Pharmaceutical Biology,2015,53(4):533−539. doi: 10.3109/13880209.2014.931441
[7] 穆晶晶. 黑果腺肋花楸花色苷提取物改善T2DM大鼠肝脏胰岛素抵抗及其机制研究[D]. 沈阳: 沈阳农业大学, 2020. MU J J. Study on the effect and mechanism of Aronia melanocarpa anthocyanin extracts on alleviating hepatic insulin resistance in type 2 diabetes mellitus rats[D]. Shenyang: Shenyang Agricultural University, 2020.
[8] 赵明优. 黑果腺肋花楸的应用价值[J]. 果树实用技术与信息,2020(3):44−46. [ZHAO M Y. The application value of Aronia melanocarpa[J]. Applied Technology and Information for Fruit Tree,2020(3):44−46. [9] 国石磊. 黑果腺肋花楸花色苷分离纯化、结构鉴定及其抗氧化活性研究[D]. 秦皇岛: 河北科技师范学院, 2015. GUO S L. Purification, structure identification of anthocyanins and its antioxidant activity from Aronia melanocarpa[D]. Qinhuangdao: Hebei Normal University of Science & Technology, 2015.
[10] AHIN E K, BILGIN M, AHIN S J P B, et al. Recovery of anthocyanins from sour cherry (Prunus cerasus L.) peels via microwave assisted extraction: Monitoring the storage stability[J]. Preparative Biochemistry & Biotechnology,2021,51(7):686−696.
[11] 李腾. 超高压辅助提取黑果腺肋花楸花色苷及其稳定性研究[D]. 北京: 北京林业大学, 2018. LI T. Study on ultra high pressure assistant extraction of anthocyanins from Aronia melanocarpa and its stability[D]. Beijing: Beijing Forestry University, 2018.
[12] 黄泰曾. 黑果腺肋花楸花色苷的提取、纯化及种类鉴定[D]. 沈阳: 沈阳农业大学, 2017. HUANG T Z. Extraction, purification and structure identification of Aroniamelanocarpa anthocyanins[D]. Shenyang: Shenyang Agricultural University, 2017.
[13] BOSILJKOV T, DUJMIC, BUBALO M C, et al. Natural deep eutectic solvents and ultrasound-assisted extraction: Green approaches for extraction of wine lees anthocyanins[J]. Food and Bioproducts Processing,2017,102:195−203. doi: 10.1016/j.fbp.2016.12.005
[14] ZANNOU O, KOCA I, ALDAWOUD T M S, et al. Recovery and stabilization of anthocyanins and phenolic antioxidants of roselle (Hibiscus sabdariffa L.) with hydrophilic deep eutectic solvents[J]. Molecules,2020,25(16):3715. doi: 10.3390/molecules25163715
[15] KOCA I J M. Extraction of anthocyanins from borage (Echium amoenum) flowers using choline chloride and a glycerol-based, deep eutectic solvent: Optimization, antioxidant activity, andin vitro bioavailability[J]. Molecule,2021,27(1):134.
[16] ALRUGAIBAH M, YAGIZ Y, GU L J S, et al. Use natural deep eutectic solvents as efficient green reagents to extract procyanidins and anthocyanins from cranberry pomace and predictive modeling by RSM and artificial neural networking[J]. Separation and Purification Technology,2020,255:117720.
[17] BU X, XU Y, ZHAO M, et al. Simultaneous extraction of polysaccharides and polyphenols from blackcurrant fruits: Comparison between response surface methodology and artificial neural networks[J]. Industrial Crops & Products,2021,170:113682.
[18] ABDULLAH S, PRADHAN R C, PRADHAN D, et al. Modeling and optimization of pectinase-assisted low-temperature extraction of cashew apple juice using artificial neural network coupled with genetic algorithm[J]. Food Chemistry,2020,339:127862.
[19] XIA N, XIONG L, BI S, et al. Development of biocompatible DES/NADES as co-solvents for efficient biosynthesis of chiral alcohols[J]. Bioprocess and Biosystems Engineering,2020,43(11):1987−1997. doi: 10.1007/s00449-020-02387-5
[20] 郑悦. 黑果腺肋花楸花色苷分离、体外抗氧化及体外消化模拟研究[D]. 哈尔滨: 东北林业大学, 2017. ZHENG Y. Isolation of anthocyanins from Aronia melanocarpa fruits and their antioxidant activity and digestion in vitro[D]. Harbin: Northeast Forestry University, 2017.
[21] PAN C, ZHAO L, ZHAO D, et al. Microwave-assisted green extraction of antioxidant components from Osmanthus fragrans (Lour) flower using natural deep eutectic solvents[J]. Journal of Applied Research on Medicinal and Aromatic Plants,2020,20:100285.
[22] LM A, JZA B, YAN M C, et al. Composition and antioxidant activity of anthocyanins from Aronia melanocarpa cultivated in Haicheng, Liaoning, China[J]. Food Bioscience,2019,30:100413. doi: 10.1016/j.fbio.2019.100413
[23] 张亦可. 低共熔溶剂辅助羊毛角蛋白提取及其应用[D]. 上海: 东华大学, 2021. ZHANG Y K. Deep eutectic solvent assisted extraction of wool keratin and its application[D]. Shanghai: Donghua University, 2021.
[24] PAN Z, BO Y, LIANG Y, et al. Intermolecular interactions in natural deep eutectic solvents and their effects on the ultrasound-assisted extraction of artemisinin from Artemisia annua[J]. Journal of Molecular Liquids,2021,326:115283. doi: 10.1016/j.molliq.2021.115283
[25] JANCHEVA M, GRIGORAKIS S, LOUPASSAKI S, et al. Optimised extraction of antioxidant polyphenols from Satureja thymbra using newly designed glycerol-based natural low-transition temperature mixtures (LTTMs)[J]. Journal of Applied Research on Medicinal and Aromatic Plants,2017,6:31−40. doi: 10.1016/j.jarmap.2017.01.002
[26] BI W, TIAN M, ROW K H J J O C A. Evaluation of alcohol-based deep eutectic solvent in extraction and determination of flavonoids with response surface methodology optimization[J]. Journal of Chromatography A,2013,1285:22−30. doi: 10.1016/j.chroma.2013.02.041
[27] LI G, XIE Q, LIU Q, et al. Separation of phenolic compounds from oil mixtures by betaine-based deep eutectic solvents[J]. Asia-Pacific Journal of Chemical Engineering,2020,15(6).
[28] HUANG H, GRüN I, ELLERSIECK M, et al. Use of HPLC and FTIR as a tool for analysis of lactic acid in restructured fish products[J]. Journal of Nutrition, Food Research and Technology,2018,1(2):42−48. doi: 10.30881/jnfrt.00010
[29] REDHA A A J J O A, CHEMISTRY F. Review on extraction of phenolic compounds from natural sources using green deep eutectic solvents[J]. Journal of Agricultural and Food Chemistry,2021,69(3):878−912. doi: 10.1021/acs.jafc.0c06641
[30] JABLONSKY M, SKULCOVá A, MALVIS A, et al. Extraction of value-added components from food industry based and agro-forest biowastes by deep eutectic solvents[J]. Journal of Biotechnology,2018,282:46−66. doi: 10.1016/j.jbiotec.2018.06.349
[31] GAO M, CUI Q A, WANG L, et al. A green and integrated strategy for enhanced phenolic compounds extraction from mulberry (Morus alba L.) leaves by deep eutectic solvent[J]. Microchemical Journal,2020,154:104598. doi: 10.1016/j.microc.2020.104598
[32] GAJIC I S, SAVIC I, BOSKOV I, et al. Optimization of ultrasound-assisted extraction of phenolic compounds from black locust (Robiniae pseudoacaciae) flowers and comparison with conventional methods[J]. Antioxidants,2019,8(8):248. doi: 10.3390/antiox8080248
[33] XU C J M. Ultrasound-assisted deep eutectic solvent extraction of anthocyanins from blueberry wine residues: Optimization, identification, and HepG2 antitumor activity[J]. Molecules,2020,25(22):5456. doi: 10.3390/molecules25225456
[34] XUE H, TAN J, LI Q, et al. Optimization ultrasound-assisted deep eutectic solvent extraction of anthocyanins from raspberry using response surface methodology coupled with genetic algorithm[J]. Food,2020,9(10):1409. doi: 10.3390/foods9101409
[35] FU X, WANG D, BELWAL T, et al. onication-synergistic natural deep eutectic solvent as a green and efficient approach for extraction of phenolic compounds from peels of Carya cathayensis Sarg[J]. Food Chemistry,2021,355(45):129577.
[36] XF A, DI W A, TB A, et al. Natural deep eutectic solvent enhanced pulse-ultrasonication assisted extraction as a multi-stability protective and efficient green strategy to extract anthocyanin from blueberry pomace[J]. LWT,2021,144:111220. doi: 10.1016/j.lwt.2021.111220
[37] NG A, HN B, ZG A J F C. Red cabbage anthocyanins: Stability, extraction, biological activities and applications in food systems[J]. Food Chemistry,2021,365:130482. doi: 10.1016/j.foodchem.2021.130482
[38] CONDURACHE LAZĂR NN, CROITORU C, ENACHI E, et al. Eggplant peels as a valuable source of anthocyanins: Extraction, thermal stability and biological activities[J]. Plants,2021,10(3):577. doi: 10.3390/plants10030577
[39] BI Y, CHI X, ZHANG R, et al. Highly efficient extraction of mulberry anthocyanins in deep eutectic solvents: Insights of degradation kinetics and stability evaluation[J]. Innovative Food Science & Emerging Technologies,2020,66:102512.
[40] 栾琳琳. 桑葚果渣花青素的提取及稳定性研究[D]. 贵阳: 贵州大学, 2020. LUAN L L. Study on the extraction and stability of anthocyanins from mulberry pomace[D]. Guiyang: Guizhou University, 2020.
[41] 位路路. 黑果腺肋花楸花色苷提取物对脂多糖诱导巨噬细胞炎症的抑制作用[D]. 沈阳: 沈阳农业大学, 2018. WEI L L. The inhibition of Aronia melanocarpa anthocyanin extracts on macrophages inflammation induced by lipopolysaccharide[D]. Shenyang: Shenyang Agricultural University, 2018.
[42] JUN C, LUYAO C, MOHAN L, et al. Efficient extraction of proanthocyanidin from Ginkgo biloba leaves employing rationally designed deep eutectic solvent-water mixture and evaluation of the antioxidant activity[J]. Journal of Pharmaceutical & Biomedical Analysis,2018,158:317−326.
-
期刊类型引用(1)
1. 陈冠怡,许陈彩,李佳玲,李鑫,张伟坚,陈春蓓,王泽富,刘书成. 亚油酸介导氧化的金鲳鱼肌原纤维蛋白结构和凝胶特性变化. 现代食品科技. 2024(09): 248-256 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:












 下载:
下载:
